PEMISAHAN DAN PEROLEHAN KEMBALI ION LOGAM Zn(II) MENGGUNAKAN ASAM LEMAK HIDROKSAMIK YANG DIIMMOBILISASI KE DALAM ZEOLIT
FIRMAN OZAKI
Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Mataram
Jl. Majapahit No. 62 Mataram 83125 Tlp. 0370 634708 Email : firman.ozaki@yahoo.com
Abstrak. Penambangan liar di Indonesia banyak menimbulkan masalah kesehatan dan lingkungan akibat limbah logam berat berbahaya yang dihasilkan. Ion logam Zn(II) merupakan satu dari banyak limbah logam berat berbahaya yang dapat memberikan efek toksik bagi kesehatan manusia. Untuk mengata si permasalahan tersebut dilakukan penghilangan (removal) ion logam Zn(II) dari limbah dengan metode immobilisasi agen pengkela t asam lemak hidroksamik ke dalam zeolit. Metode ekstraksi padat-cair digunakan untuk memisahkan dan memperoleh kembali ion logam Zn(II). Hasilnya diperoleh kondisi optimum immobilisasi FHA dalam zeolit dengan daya jerap sebesar 11,3504 mg/g. Kondisi optimum untuk pemisahan dan perolehan kembali ion logam Zn2+, adalah waktu kontak 5 jam, pH ion logam Zn2+ = 5 dan daya jerap ion logam Zn2+ sebesar 5,29 mg/g. Berdasarkan hasil ekstraksi padat-cair yang telah dilakukan diperoleh serapan F HA-zeolit terhadap ion logam Zn2+ sebesar 90,18% dengan nilai recovery sebesar 99,63% dan pemisahan ion logam Zn2+ dengan logam lainnya sebesar 11,88%.
Kata kunci: Ion logam Zn2+, immobilisasi chelating agent, asam lemak hidroksamik, zeolit, ekstraksi padat-cair
PENDAHULUAN
Penambangan liar tanpa izin (PETI)
banyak dilakukan pada daerah dengan kadar
emas yang rendah oleh masyarakat. Proses
penambangan dilakukan secara tradisional,
seperti metode amalgamasi dan sianidasi
dimana hanya mineral emas yang diambil,
sedangkan limbah berupa mineral logam
lainnya dibuang ke saluran perairan sekitar
sehingga sangat berbahaya bagi kehidupan
dan lingkungan. Salah satu mineral logam
tersebut adalah ion logam Zn(II). Ion logam
tetapi dalam dosis tinggi Zn dapat berbahaya
dan bersifat toksik, seperti sakit lambung
akut, diare dan muntah. Zn memiliki sifat
toksik terutama dalam bentuk ion. Hampir
70% keberadaan Zn di dunia dihasilkan dari
penambangan dan 30% dari daur ulang Zn
(Widowati et al, 2008).
Oleh karena itu, dibutuhkan solusi
untuk mangatasi permasalahan yang
ditimbulkan limbah tersebut, khususnya ion
logam Zn(II) tanpa menimbulkan adanya
permasalahan yang baru dengan mengubah
limbah tersebut menjadi sesuatu yang
bermanfaat atau memiliki nilai pakai.
Langkah pertama yang perlu dilakukan
adalah memisahkan ion logam Zn(II) dari
pengotornya atau logam lain yang
berasosiasi dengannya. Telah banyak
dilakukan teknik pemisahan dan pemurnian
ion logam dengan agen pengkhelat, seperti
ekstraksi pelarut (Irwansyah, 2012) dan
metode immobilisasi chelating agent dalam resin untuk memisahkan ion-ion logam dari
air limbah (Nasrudin, 2015). Namun,
perolehan kembali logam-logam
menggunakan metode ekstraksi pelarut
menimbulkan masalah baru, seperti sebagian
besar pelarut organik yang digunakan untuk
mengekstraksi ion logam tersebut masih
bersifat toksik (racun) jika dibuang
langsung ke lingkungan, sehingga dalam
penelitian ini digunakan metode
immobilisasi chelating agent dalam resin. Metode immobilisasi ini memudahkan
pemisahan dan perolehan kembali
logam-logam dari limbahnya, karena chelating agent yang terikat pada fase padat resin akan mengikat logam-logam yang terkandung
dalam limbah secara spesifik. Sedangkan
jika tanpa agen pengkelat, maka resin akan
menyerap logam dengan menyeluruh, karena
yang memiliki selektivitas terhadap daya
jerap logam adalah agen penkelat yang
terikat pada fase padat resin. Metode ini
disebut juga dengan ektraksi padat-cair,
dengan resin yang mengikat chelating agent sebagai fase padat dan air limbah sebagai
fase cairnya (Muhsinun, 2011).
Pada peneltitian sebelumnya telah
digunakan resin Amberlite XAD-4 untuk
logam Cd2+(Wahyuni, 2013), namun resin
tersebut merupakan resin yang komersial
dan mahal. Oleh karena itu, pada penelitian
ini akan digunakan resin zeolit seperti yang
telah dilakukan oleh Nasrudin (2015) dalam
penelitiannya sebagai adsorben dari FHA
untuk logam Pb (timbal). Penggunaan zeolit
didasarkan atas kemampuannya melakukan
sebagai adsorben (Sutarti dan Rachmawati,
1994).
Pada penelitian sebelumnya
digunakan reagen-reagen sebagai agen
pengkelat seperti Amberlite
Xad-16-1,5-Difenil Karbazida (Wulandari, 2010) dan
EDTA (C10H16N2O8) (Saputri, 2014).
Namun, reagen-reagen tersebut masih
merupakan reagen komersial yang mahal
dan sulit diperoleh. Oleh karena itu,
dibutuhkan suatu reagen yang murah dan
mudah diperoleh dalam penanggulangannya
terhadap pencemaran lingkungan sehingga
dalam penelitian ini digunakan reagen yang
mempunyai gugus asam hidroksamik
(Hydroxamic Acid) dengan bahan dasar asam lemak. Reagen dengan gugus asam
hidroksamik merupakan reagen yang
mempunyai sifat pengkhelat logam yang
tinggi dan superior untuk ekstraksi dan
pemisahan spektrometer dari ion logam
(Agrawal et al., 1980). Menurut Suhendra
dan Gunawan (2012), asam-asam
hidroksamik merupakan agen pengkhelat
(chelating agent) turunan hidroksilamina dan asam karboksilat, oleh karena itu asam
hidroksamik juga disebut N-hidroksi amida karboksilat dengan rumus R-CO-NHOH.
Pembuatan poli (asam lemak hidroksamik)
dengan bahan dasar pati sagu ternyata dapat
digunakan untuk mengekstraksi logam
golongan unsur Lantanida baik dari
lingkungan maupun dari sumber lainnya
(Zaki et al., 2001), sehingga dapat
disimpulkan bahwa reagen asam lemak
hidroksamik ini mempunyai kemampuan
tinggi dalam mengekstraksi logam.
Asam lemak hidroksamik (FHA)
dapat disentesis dengan dua cara yakni
secara kimiawi dan secara enzimatis. Pada
penelitian ini FHA yang digunakan adalah
yang disintesis secara enzimatis dari minyak
inti buah ketapang. Sintesis secara enzimatis
dilakukan dengan mereaksikan asam lemak
pada minyak nabati (trigliserida) dengan
hidroksilamin dan dikatalis dengan enzim
lipase. Beberapa penelitian tentang sintesis
asam hidroksamik secara enzimatis yaitu,
sintesis tiohidroksamik dari minyak kelapa
sawit dengan katalis lipase (Mulla dkk. 2010) dan sintesis asam lemak hidroksamik dari
minyak kelapa secara enzimatis (Arsiwan,
2010). Dari beberapa penelitian sebagian
besar menggunakan bahan baku minyak
makanan (edible oil) untuk sintesis asam hidroksamik. Oleh karena itu, dibutuhkan
bahan lain sebagai pengganti dalam sintesis
asam hidroksamik berbahan non edible oil, seperti minyak inti buah ketapang.
Penggunaan minyak inti buah
ketapang sebagai bahan dasar sintesis FHA
mempunyai rantai karbon C 14 – C 20, yang
memungkinkan terbentuknya gugus
hidrofobik dan hidrofilik sekaligus
(Suhendra et al., 2014). Selain itu,
penggunaan minyak inti buah ketapang
disebabkan karena metode yang digunakan
adalah immobilisasi chelating agent ke dalam polimer pendukung yang tidak polar,
maka diperlukan chelating agent yang mempunyai sifat hidrofobik dan hidrofilik
sekaligus. Jika dilihat dari gugus fungsinya,
asam hidroksamik bersifat polar (hidrofilik).
Oleh karena itu, diperlukan gugus alkil rantai
menengah sampai panjang agar dapat juga
bersifat hidrofobik (Suhendra dan Gunawan,
2012). Minyak inti biji ketapang (Terminalia catappa Linn) memiliki kandungan trigliserida yang cukup tinggi yaitu sekitar
54% (Andriyani, 2010). Selain itu, biji
ketapang juga merupakan non edible oil dan tak banyak dimanfaatkan oleh masyarakat
sehingga menjadi salah satu pertimbangan
untuk menggunakan biji ketapang sebagai
bahan baku chelating agent dalam penelitian ini.
METODE PENELITIAN ALAT
Alat laboratorium yang digunakan pada
penelitian ini adalah semua peralatan dasar
dari gelas di laboratorium kimia, magnetic
stirrer, pemanas (hot plate), waterbathshaker, pompa vakum, neraca Analitik (Denver), statif, pH meter digital
(Orion 3 Star), kromatografi kolom, FTIR,
UV- Vis (Shimadzu UV-1800) dan AAS
(Shimadzu AA-7000).
BAHAN
Adapun bahan yang digunakan semuanya
berderajat P.A (Pro Analyze) kecuali yang
disebut khusus. Bahan tersebut adalah
sebagai berikut: Zeolit alam, methanol,
n-heksana, inti biji ketapang (kawasan
Universitas Mataram), hidroksilamin, enzim
Lipase TL, NaOH, HCl, H2SO4, ion logam
(Cu, Zn dan Pb), HNO3, Aquades (Lab.
Kimia dasar), pH universal (Merck) dan
kertas saring Whatman (Merck).
PROSEDUR PENELITIAN
Tahap Ekstrasi Minyak Inti Biji Ketapang
Ekstraksi inti biji ketapang dilakukan
dengan menggunakan metode sokhletasi.
Inti biji ketapang kering yang sudah
diblender ditimbang sebanyak 60 gram,
kemudian dibungkus dengan kertas saring
dan dimasukkan ke dalam alat sokhlet
selama 6 jam dengan 250 mL pelarut
n-heksan. Untuk memisahkan minyak dari
pelarutnya, hasil ekstraksi kemudian
n-heksan dengan rotary evaporator pada suhu
40 oC dengan kecepatan 110 rpm. Minyak
yang diperoleh kemudian ditimbang untuk
ditentukan kadarnya dan selanjutnya
ditambahkan natrium sulfat anhidrat untuk
menghilangkan kadar airnya. Kadar minyak
dapat dihitung dengan rumus:
� � � = � � �ℎ � � × %
Minyak ketapang yang dihasilkan
kemudian di uji KLT untuk melihat apakah
minyak yang dihasilkan sama dengan
standar trigliserida. Eluen yang digunakan
yaitu dietileter : n-heksana (13:87 v/v) yang
didiamkan selama kurang lebih 15 menit
supaya jenuh.
Tahap Sintesis FHA
Dilakukan sintesis FHA dengan
menggunakan kondisi waktu reaksi (25 jam)
dan perbandingan hidroksilamin : minyak
(2,86 mmol : 1 gram) pada hasil optimasi
yang telah diperoleh Nazili (2012). Untuk
perbandingan enzim lipase dengan minyak
yang digunakan, dilakukan optimasi dengan
variasi massa enzim 0,02; 0,03; 0,04; 0,05;
dan 0,06 dalam satuan gram.
FHA disintesis dengan menggunakan
perbandingan komposisi pada kondisi
optimum yang telah diperoleh yaitu
mereaksikan minyak ketapang,
hidroksilamin dan katalis enzim lipase.
Sebelum mereaksikan reaktan tersebut
terlebih dahulu hidroksilamin hidroklorida
dilarutkan dengan air (aquades) sedangkan
minyak dilarutkan dengan n-heksan.
Hidroksilamin hidroklorida yang telah
dilarutkan kemudian dinetralkan sampai pH
= 7 dengan menambahkan NaOH 0,1M.
FHA yang terbentuk kemudian
dipisahkan dari lapisan air. Lapisan air
dipisahkan dengan menggunakan corong
pisah. Untuk mendapatkan FHA padat,
fraksi n-heksan didinginkan dalam freezer (<-5 oC) selama 4 jam dan difiltrasi. FHA
yang didapat pada kertas saring dicuci
dengan n-heksan sebanyak 3 kali dan
dikeringkan dalam desikator yang telah diisi
dengan fosfor pentaoksida selama 24 jam.
FHA padat yang diperoleh kemudian
diidentifikasi dengan menggunakan reaksi
pembentukan kompleks antara FHA dengan
ion besi(III) dan ion tembaga(II) dalam
larutan metanol. Adanya gugus HA akan
merubah warna besi(III) menjadi merah dan
tembaga(II) menjadi hijau (Suhendra et al., 2014).
Analisis Kuantitatif
Analisis kuantitatif dilakukan dengan
menentukan jumlah gugus asam
hidroksamik yang terbentuk berdasarkan
jumlah nitrogen yang terkandung dalam
Semi Makro Kjeldhal. Adapun prosedur
kerja yang telah dikerjakan adalah sebagai
berikut (Sudarmadji et al., 2003): Ditimbang 0,5 gram asam lemak hidroksamik dan
dimasukkan ke dalam labu Kjeldahl. FHA
tersebut kemudian ditambahkan 2 gram
Na2SO4/CuSO4 (20:1) dan 5 mL H2SO4 pekat
dan dipanaskan pada pemanas listrik sampai
terbentuk larutan berwarna biru jernih
(destruksi). Hasil destruksi yang sudah
dingin kemudian ditambahkan 150 mL
aquades, 25 mL NaOH 40% dan 3 biji batu
didih dan dilakukan destilasi. Destilat
ditampung sampai volume 150 mL pada
erlenmeyer yang berisi 10 mL asam borat 2%
yang sudah diberi indikator campuran.
Destilat kemudian dititrasi dengan H2SO4
0,1N sampai titik ekivalen yang ditandakan
dengan berubahnya warna indikator. Dibuat
juga blangko dengan perlakuan yang sama
seperti sampel. Persentase N total kemudian
ditentukan dengan rumus sebagai berikut:
%N= V H2SO4 sampel−V H2SO4 blangko×[H2SO4]× 4,
Massa sampel× × %
Tahap Aktivasi Zeolit
Zeolit yang sudah ada dipanaskan di
dalam tanur selama 2 jam dalam suhu 450
0C. Pemanasan ini bertujuan untuk
memperbesar permukaan dari zeolit atau
mengkatifkan zeolit tersebut.
Tahap Immobilisasi FHA ke dalam Zeolit
Nasrudin (2014) menyatakan bahwa
konsentrasi FHA dan massa zeolit yang
optimum yang digunakan pada immobilisasi
FHA ke dalam zeolit adalah dengan jumlah
konsentrasi FHA sebesar 200 ppm dan massa
zeolit sebesar 0,25 gram. Dimana tahap
immobilisasi FHA ke dalam zeolit dilakukan
dengan pembuatan larutan FHA dalam
metanol dengan konsentrasi 200 ppm
sebanyak 20 mL kemudian ditambahkan 0,25
gram zeolit dan dishake selama 12 jam
menggunakan waterbath shaker. FHA-Zeolit
yang didapatkan kemudian disaring dan
disimpan pada suhu ±5 0C.
Studi Daya Jerap FHA-zeolit terhadap Ion Logam Zn(II)
1. Pengaruh Waktu Kontak
Sebanyak 0.1 gram FHA-Zeolit
dimasukkan ke dalam larutan ion logam
Zn(II) 200 ppm sebanyak 20 mL dan dikocok
dalam shaker pada 100 rpm dengan variasi
waktu 2, 3, 5, dan 9 jam. Selain itu dibuat
pembanding (inisial) tanpa penambahan
FHA-zeolit untuk melihat perbedaan serapan
antara final dengan inisial. Serapan logam
Zn(II) pada masing-masing varian waktu
kemudian diukur dengan AAS.
2. Pengaruh pH
Pengaruh pH ini ditentukan oleh
mL ion logam standar Zn(II) 200 ppm
dikocok dengan 100 mg FHA-Zeolit selama
5 jam untuk memastikan kesetimbangan
tercapai pada semua kondisi. Untuk pH dari
larutan ion logam diatur antara 3-6 dengan
larutan HCl 0,1 M dan larutan NaOH (0,1 M
dan 2,05 M) sebelum dikocok. Untuk
melihat perbedaan serapan antara final
dengan inisial maka dibuat dua larutan yang
berbeda dengan volume yang sama, yaitu
inisial (tanpa penambahan FHA-zeolit) dan
final (dengan penambahan FHA-zeolit).
Setelah setimbang, konsentrasi ion dalam
larutan ditentukan menggunakan AAS untuk
kalkulasi besarnya kapasitas serapan.
3. Pengaruh Konsentrasi
Sebanyak 0,1 gram FHA-Zeolit
dimasukkan ke dalam 20 mL larutan logam
Zn(II) dengan variasi konsentrasi dari 75
ppm, 100 ppm, 125 ppm, dan 150 ppm dan
dikocok dalam waterbath shaker selama 5 jam dengan pH larutan = 5. Serapan ion
logam Zn(II) pada masing-masing varian
konsentrasi diukur dengan AAS. Untuk
melihat perbedaan serapan antara yang tidak
ditambahkan FHA-zeolit (inisial) dengan
yang ditambahkan FHA-zeolit (finish) maka
dibuat dua larutan yang berbeda dengan
volume yang sama. Setelah setimbang,
konsentrasi ion dalam larutan ditentukan
menggunakan AAS untuk kalkulasi besarnya
daya jerap FHA-zeolit terhadap ion logam
Zn(II).
Tahap Ekstraksi Padat-Cair Ion Logam Zn(II) dalam FHA-Zeolit
Sebanyak 4 gram FHA-Zeolit
dimasukkan ke dalam sebuah kolom.
Kemudian sebanyak 60 mL larutan
campuran yang mengandung ion logam
Zn(II), Pb(II), dan Cu(II) dengan konsentrasi
masing-masing 125 ppm, dikondisikan pada
pH 5 dan didiamkan selama 5 jam di dalam
kolom. Kemudian dilewatkan melewati
kolom dengan kecepatan alir 0,25 mL/menit.
Konsentrasi ion logam Zn(II) sebelum dan
setelah melewati kolom ditentukan
menggunakan AAS untuk kalkulasi
persentase serapan ion logam Zn(II).
Tahap Pemisahan dan Perolehan Kembali Ion Logam Zn(II) Menggunakan Kromatografi Kolom
Pemisahan dan perolehan kembali ion
logam Zn(II) pada kolom dilakukan dengan
menggunakan larutan HNO3 10 % sebagai
eluen. Sebanyak 150 mL asam nitrat
dilewatkan melalui kolom yang mengandung
FHA-Zeolit-ion logam (Zn, Pb, Cu) dengan
kecepatan alir 0,25 mL/menit. Setiap urutan
fraksi (10 mL) yang diperoleh, ditampung
secara otomatis menggunakan pengumpul
fraksi. Konsentrasi masing-masing ion
ditentukan menggunakan AAS dengan
lampu katoda dari masing-masing logam
(Pb, Cu, Zn) untuk kalkulasi persentase
pemisahan.
HASIL DAN PEMBAHASAN Ekstraksi Minyak Inti Biji Ketapang
Tabel 1. Perolehan kadar minyak inti biji
biji ketapang diperoleh hasil sebesar
58,43%. Kadar minyak yang diperoleh lebih
besar dari kadar minyak yang diperoleh
Rahayu dkk. (2012) yaitu sebesar 57,7%. Hal ini dipengaruhi oleh kondisi geografis
tempat tumbuhnya tanaman yang
mengakibatkan terjadinya perbedaan
rendemen minyak (Manzoor dkk., 2007). Dalam uji KLT sampel minyak yang
didapatkan memiliki nilai Rf yang sama
dengan standar trigliserida, dimana nilai Rf
sampel yang mendekati atau sama dengan
nilai Rf standar menunjukkan kemiripan atau
kesesuaian minyak yang didapatkan dengan
standar trigliserida. Untuk melihat nilai Rf
sampel minyak dengan standar trigliserida
dapat dilihat pada Tabel 2 di bawah ini.
Tabel 2. Nilai Rf sampel minyak dengan standar trigliserida
Minyak Jarak tempuh substansi (cm)
Dalam sintesis FHA didapatkan
jumlah FHA yang disintesis berdasarkan
optimasi enzim yang digunakan adalah dapat
dilihat pada Gambar 1 di bawah.
Gambar 1. Pengaruh massa enzim terhadap sintesis FHA
Gambar 1 menunjukkan sintesis FHA
tertinggi pada penggunaan katalis lipozym
TL sebanyak 0,03 gram, yaitu sebesar 0,92
gram.
Identifikasi FHA dilakukan dengan
reaksi komplekasi antara FHA dengan ion
besi(III) menghasilkan warna merah dan
dengan ion tembaga (II) menghasilkan
warna hijau (Suhendra et al., 2014), hal ini menujukkan bahwa FHA terbentuk dengan
spektrum FTIR dari FHA ditunjukkan oleh
Gambar 2.
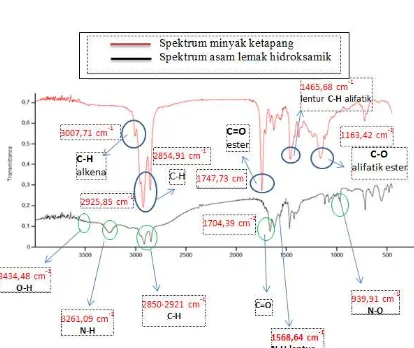
Gambar 2. Spektrum FTIR minyak ketapang dan FHA
Dari spektrum FTIR di atas
menunjukkan adanya serapan khas pada
bilangan gelombang 3434,48 cm-1 yang
merupakan regangan O-H dan pada bilangan
gelombang 3261,09 terdapat serapan
regangan N-H. Serapan tersebut didukung
dengan adanya serapan lentur N-H pada
bilangan gelombang 1568,64 cm-1. Selain
itu, pada bilangan gelombang 939,91 cm-1
terdapat serapan regang N-O. Serapan
regang C-H rantail alkil alifatik panjang
terlihat pada bilangan gelombang 2921-2850
cm-1, dan pada bilangan gelombang 1704,39
cm-1 terdapat serapan regangan C=O.
Jumlah N total yang terkandung
dalam sampel FHA kering sebesar 1,47%.
Artinya dalam 1 gram sampel FHA kering
yang disintesis dari minyak biji ketapang
terdapat gugus hidroksamik.
Immobilisasi FHA ke dalam Zeolit
Jumlah FHA yang terimmobilisasi ke
dalam zeolit dapat dilihat pada Tabel 3.
Tabel 3. Kondisi optimum immobilisasi FHA ke dalam zeolit
No. Parameter Kondisi Daya jerap (mg/g)
1 Konsentrasi
FHA 200 ppm
11,3504 mg/g
2 Masssa
zeolit 0,25 gram
Tabel 3 menunjukkan kondisi optimum
untuk immobilisasi FHA ke dalam zeolit.
Dimana interaksi antara FHA dengan zeolit
dapat dilihat dari model isoterm adsorbsi.
Isoterm adsorpsi merupakan parameter yang
sangat penting dalam adsorpsi karena ikut
berperan dalam menentukan kondisi
maksimum untuk menghasilkan adsorpsi
yang optimal. Isoterm adsorpsi dapat dikaji
dengan beberapa model yang ada untuk
mengetahui model adsorpsi isoterm yang
sesuai, dimana model adsorpsi isoterm FHA
ini akan dikaji menggunakan dua model
yaitu isoterm Langmuir dan Freundlich.
Penggunaan dua model adsorbsi ini karena
interaksi antara adsorbat dengan adsorben
Gambar 3. Model isoterm Langmuir Gambar 4. Model isoterm Freundlich
Dari Gambar 3 dan Gambar 4
menunjukkan bahwa nilai R2 dari model
isoterm adsorbsi Freundlich adalah 0,999
lebih besar dari model isoterm adsorbsi
Langmuir, yaitu 0,9425. Nilai R2 yang
mendekati 1 dan kapasitas adsorbsi yang
bernilai positif merupakan isoterm yang
sesuai untuk adsorbsi dengan menggunakan
zeolit alam teraktivasi (Emelda dkk, 2013), sehingga dapat dikatakan bahwa isoterm
adsorbsi dari proses penyerapan FHA oleh
zeolit pada penelitian ini lebih cenderung
mengikuti model Isoterm Freundlich.
Kesesuaian dengan persamaan Model
Isoterm Freundlich mengasumsikan bahwa
proses adsorpsi terjadi secara fisika (Estiaty,
2013). Hal ini didasarkan atas terbentuknya
lapisan monolayer dari molekul-molekul
adsorbat pada permukaan adsorben. Dimana
pengikatan adsorbat terjadi pada berbagai
macam tempat adsorbsi pada permukaan
padatan, karena pada adsorpsi Freundlich
situs-situs aktif pada permukaan adsorben
bersifat heterogen.
Studi Daya Jerap FHA-zeolit terhadap Adsorbsi Ion Logam Zn(II)
Ada tiga parameter yang digunakan
dalam menentukan jumlah ion logam
maksimum yang dapat diadsorbsi oleh
FHA-zeolit, yaitu waktu kontak, pH, dan
konsentrasi ionlogam Zn(II). Gambar 5
menujukkan waktu kontak optimum adsorbsi
ion logam Zn(II).
Gambar 5. Pengaruh waktu kontak logam
Zn2+ terhadap FHA-zeolit
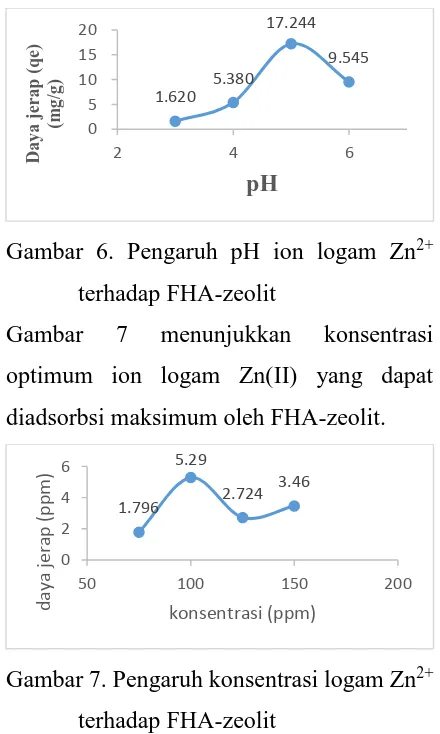
Gambar 6. Pengaruh pH ion logam Zn2+
terhadap FHA-zeolit
Gambar 7 menunjukkan konsentrasi
optimum ion logam Zn(II) yang dapat
diadsorbsi maksimum oleh FHA-zeolit.
Gambar 7. Pengaruh konsentrasi logam Zn2+
terhadap FHA-zeolit
Dari tiga parameter di atas didapatkan
kondisi optimum untuk ekstraksi ion logam
Zn(II) menggunakan FHA-zeolit, yaitu
waktu kontak 5 jam, pH 5, dan konsentrasi
100 ppm dengan daya jerapyang didapatkan
sebesar 5,29 mg/g.
Ekstraksi Padat-Cair Ion Logam Zn(II) dalam FHA-Zeolit
Tabel 4. Serapan ion logam dalam kolom FHA-zeolit
Ion logam Konsentrasi (ppm)
Berdasarkan Tabel 4 menujukkan bahwa ion
logam Zn(II) yan berhasil terekstrak dalam 4
gram FHA-zeolit sebesar 90,18%. Nilai ini
menunjukkan bahwa dalam setiap 1 gram
FHA-zeolit terdapat 22,095 ppm ion logam
Zn(II) yang terserap.
Recovery Ion Logam Zn(II)
Pemisahan ion logam dalam kolom
FHA-zeolit ini menggunakan larutan asam
nitrat 10% sebagai eluen disebabkan
penggunaan sampel awal yang berasal dari
ion-ion logam nitratnya dan digunakan asam
yang tidak terlalu pekat untuk menghindari
terjadinya kerusakan pada resin. Hal ini juga
untuk mengurangi kesalahan pembacaan
pada AAS.
Pada saat perolehan kembali ion-ion
logam, larutan asam nitrat 10% dilewatkan
ke dalam kolom sebagai fase geraknya
dimana setiap fraksi 10 ml ditampung dan
diukur dengan AAS konsentrasi ion logam
yang ter-recovery. Dari hasil AAS yang didapat, diperoleh kurva perolehan kembali
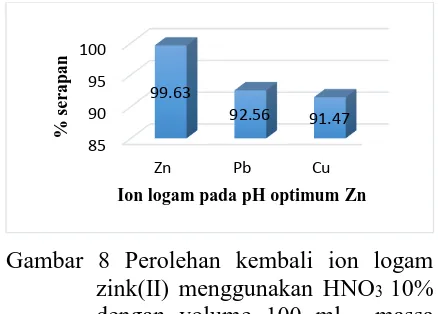
Gambar 8 Perolehan kembali ion logam
Zn(II) ter-recovery paling tinggi dibadingkan dengan logam-logam yang lain
yaitu sebesar 88,05 ppm atau sebesar 99,63%
dari jumlah yang terserap. Untuk pemisahan
ion logam Zn2+ dengan logam lainnya (Cu2+
dan Pb2+) dapat dilihat pada Gambar 9.
Gambar 9. Pemisahan ion logam Zn2+
dengan ion logam lainnya
Berdasarkan Gambar 9, pemisahan hanya
terjadi antara ion logam Zn(II) dengan ion
logam Pb(II), sedangkan dengan ion logam
tembaga(II) tidak terjadi pemisahan. Hal ini
disebabkan karena pH ion logam Zn(II) sama
dengan yang didapatkan oleh Adawiyah
(2016) pada recovery logam tembaga(II) dengan logam lainnya.
Pemisahan dan perolehan kembali
ion logam Zn(II) dengan metode
immobilasisi chelating agent dengan resin FHA-zeolit menghasilkan perolehan
kembali ion logam yang lebih besar, yairtu
99,63% jika dibandingakan dengan
pemisahan ion logam dengan menggunakan
metode ekstraksi cair-cair yang dilakukan
oleh Pahmi (2013), yaitu sebesar 95%. Dan
hasil dari pemisahan ion logam Zn(II) ini
hampir sama dengan yang didapatkan oleh
Haryunianti (2015) yaitu sebesar 99,806%,
namun dengan pemisahan yang lebih baik
antara ion logam Zn(II) dengan ion logam
lainnya menggunakan resin FHA-bentonit.
Proses desorpsi ion logam Zn2+ diperlihatkan
pada gambar 10.
Gambar 10. Proses recovery ion logam Zn2+
KESIMPULAN
Beberapa kesimpulan dapat diambil dari penelitian ini, diantaranya:
1. Jumlah FHA optimum yang
terimmobilisasi sebesar 11,3504 mg/g, yaitu dengan kondisi 0,25 gram zeolit dan FHA 200 ppm.
Ion logam pada pH optimum Zn
dan konsentrasi 100 dengan daya jerap
Perlu dilakukan studi lanjut tentang pengaplikasikan secara langsung pada pencemaran limbah di lingkungan dengan metode ekstraksi padat-cair dari ion logam Zn2+ akibat penambangan emas tradisional maupun penambangan zat mineral yang lain.
DAFTAR PUSTAKA
1. Agrawal, Y.K.; Patel, S.A. 1999. Hydroxamic acid; Reagents for the
solvent extraction and
spectrophotometric determination of metals, Rev. Anal. Chem.
2. Andriyani, R.S. 2010. Pembuatan Biodiesel dari Inti Buah Ketapang (Terminalia Catappa ) Dengan Proses Transesterifikasi Kimiawi. Skripsi. Program Studi Kimia Fakultas MIPA Universitas Mataram.
3. Arsiwan, R. 2010. Sintesis Asam Lemak Hidroksamik dari Minyak Kelapa secara Enzimatis. Universitas Mataram. Mataram.
4. Emelda, L., Suhardini M. P., dan Simparmin Br. G. 2013. Pemanfaatan Zeolit Alam untuk Adsorbsi Logam Crom (Cr3+). Jurnal Rekayasa Kimia dan Lingkungan vol. 9, No.4, hlm. 166-172.
5. Estiaty, L. M. 2013. Kesetimbangan dan Kinetika Adsorbsi Ion Cu2+ pada Zeolit-H. Ris.Geo.Tam Vol. 22, No.2, Juni 2013 (127-141)
6. Haryunianti, N. 2015. Pemisahan dan Perolehan Kembali Ion Logam Zn(II)
Menggunakan Asam Lemak
Hidroksamik dari Sintesisi Minyak Inti Biji Ketapang (Terminalia catappa) yang Diimmobilisasi dalam Bentonit. Skripsi. Universitas Mataram.
7. Irwansyah. 2012. Penarikan Kembali Ion Tembaga (cu2+) Menggunakan Asam Hidroksamik Dari Minyak Nyamplung Dengan Metode Ekstraksi Pelarut. Skripsi. Program Studi Kimia Fakultas MIPA Universitas Mataram.
8. Manzoor, M., Anwar, F., dan Iqbal, T., 2007, P hysico-chemical Characterization of Moringa concanensis Seeds and Seeds Oil. JAOCS, 84:413-419.
9. Muhsinun. 2011. Pemiahan dan Perolehan Kembali Ion Tembaga pada Limbah Pengolahan Emas Tradisional menggunakan Asam Hidroksamik dari Kelapa. Mataram: Universitas Mataram. 10.Mulla, Emad A. J. Al., Wan Md. Zin
Wan Y., dan Nor azowa Bt Ibrahim, dan Mohd Zaki Ab. Rahman, 2010, Enzimatic Synthesis of Palm Olein-based Fatty Thiohydroxamic Acids, Journal of Oleo Science, 59, (11) 569-573.
11.Nasrudin. 2014. Pemisahan dan Perolehan Kembali Ion Logam Timbal(II) menggunakan Asam Lemak Hidroksamik dari Sintesis Minyak inti Biji Ketapang (Terminalia cattapa L.) yang Diimmobilisasi dalam Zeolit. Mataram: Universitas Mataram.
12.Nazili, M. 2012. Sintesis Asam Lemak Hidroksamik Dari Minyak Inti Biji Ketapang (Terminalia catappa L.) Secara Enzimatis. Skripsi. Program Studi Kimia Fakultas MIPA Universitas Mataram.
14.Saputri, F., A. R. Razak dan Musafira. 2014. Kajian Penggunaan Pengkelat untuk Menurunkan Kandungan Besi dalam Minyak Daun Cengkeh. Jurusan Kimia FMIPA UNTAD Palu
15.Suhendra, D., Wan Yunus, W.M.Z., Haron, M.J., Basri M., and Silong S.. 2005. Enzimatic Synthesis of Fatty Hydroxamic Acid from P alm Oil. Journal Oleo Science, Vol. 54, No. 1, 33-38. 16.Suhendra, D., E. R. Gunawan, Murniati,
dan Amal. 2014. Immobilisasi Chelating Agent Fatty Hidroksamik Acids ke dalam Bentonite. Mataram: Universitas Mataram.
17.Suhendra, D., Copper Ion Extraction by a Mixture of fatty Hidroxamic Acids Synthesized from Commercial Palm Oil, Solvent Extraction and Ion Exchange, 2005, 23, 713-723.
18.Suhendra, D. dan E. R. Gunawan. 2012. Sintesis Asam-asam Lemak Hidroksamik dari Minyak Kelapa menggunakan Lipase sebagai Katalis. Mataram: Universitas Mataram.
19.Wahyuni, R. 2013. P emisahan dan Pemekatan Ion Logam Kadmium(II)
Mengguanakan Asam Lemak
Hidroksamik dari Minyak Inti Biji Ketapang yang Diimmobilisasi ke dalam Resin Amberlite XAD-4. Mataram: Universitas Mataram.
20.Widowati, W. 2008. Efek Toksik
Logam:Pencegahan dan
Penanggulangan Pencemaran. Yogyakarta:Abdi Press.
21.Wulandari, M. 2010. Resin Pengkhelat Amberlite Xad-16-1,5-Difenil Karbazida Untuk Prakonsentrasi Dan Analisis Selektif Kromium(VI). Tesis. Institut Teknologi Bandung.
22.Zaki, M.A.R., Rahman M.L., Haron M.J., Silong S., Wan Yunus, W.M.Z., and Ahmad M.B., Preliminary Study on Application of Sago Starch Based Poly(HydroxamicAcid) Resin for