UJI KONSENTRASI AIR REBUSAN DAUN SERAI WANGI Andoropogon nardus L. (Graminae) TERHADAP PERTUMBUHAN JAMUR Colletotrichum gloeosporioides Penz. PENYEBAB PENYAKIT
ANTRAKNOSA PADA PEPAYA SECARA IN VITRO
Martinius1), Yenny Liswarni1), Yanuar Miska2)
1)Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Andalas
Kampus Limau Manis Padang 25163
2)Alumni Fakultas Pertanian Universitas Andalas, Kampus Limau Manih, Padang
ABSTRACT
The research on concentration test of lemongrass (Andoropogon nardus L) leaves decoction water against the growth of Colletotrichum gloeosporioides caused anthracnose disease on papaya (Carica papaya L) in vitro was conducted in Phytopthology Laboratory Plant Pests and Diseases Departement, Agriculture Faculty, Andalas University, from December 2009 – February 2010. The aim of this research was to determine the effective concentration of lemongrass leaves decoction water in suppressing the growth of C. gloeosporioides The experiment was done on PDA (Potato Dextrose Agar) medium using Completely Randomized Design (CRD) with 6 treatments and 5 replications. The treatments were different concentration of lemongrass leaves decoction water namely: 0 % (control), 1%, 2%, 3%, 4%, and 5%. The observations were colony area, colony growth, wet and dry weight of the colony, the number of fungal conidia/ml suspension, and conidia viability. The results showed that lemongrass leave decoction water was able to suppress the growth of C. gloeosporioides. The effective concentration was 4%.
Keywords: Concentration, Andropogon nardus, Colletotrichum gloeosporioides, anthracnose
PENDAHULUAN
Pepaya (Carica papaya L.) merupakan salah satu buah yang berasal dari Amerika Tropik, yang telah lama dikenal dan berkembang luas di seluruh Indonesia. Selain diambil buahnya yang masak, buah yang masih mentah dan daunnya dimakan sebagai sayuran. Bahkan di desa-desa pepaya banyak digunakan sebagai obat tradisional (Semangun, 2000). Buah pepaya dapat diolah menjadi berbagai olahan seperti pasta pepaya, manisan kering, manisan basah, saus pepaya, dan jus pepaya (Rukmana, 1995). Buah, batang, dan daun pepaya mengandung banyak getah putih. Papain yang terdapat dalam getah putih digunakan sebagai bahan pengempuk daging, bahan baku pencampur dalam industri makanan dan minuman, obat-obatan, penyamak kulit, tekstil, kertas dan sebagainya (Sobir, 2009).
Produksi buah pepaya di Indonesia pada tahun 2007 mencapai 621.524 ton dan meningkat menjadi 643.451 ton pada tahun 2008. Pada tahun 2009 produksi buah pepaya meningkat menjadi 766.177 ton (Badan Pusat Statistik Republik Indonesia, 2010). Produksi buah pepaya di Sumatera Barat pada tahun 2007 sebesar 5.946,20 ton pada tahun 2008 meningkat menjadi 8.900 ton dan pada tahun 2009 meningkat menjadi 9.011 ton (Dinas Pertanian Tanaman Pangan dan Hortikultura Sumatera Barat, 2010).
Meningkatnya produksi pepaya di Indonesia dan Sumatera Barat seiring dengan meningkatnya permintaan konsumen akan kebutuhan buah segar. Budidaya yang dilakukan oleh sebagian besar petani selama ini hanya dengan memanfaatkan areal sekitar pekarangan, dan saat ini pepaya sudah dibudidayakan secara komersil. Sobir (2009)
menyatakan budidaya pepaya menghadapi masalah serangan hama dan penyakit yang dapat menurunkan produksi maupun kualitas buah pepaya yang dihasilkan. Belakangan ini, penyakit antraknosa dan kutu putih merupakan musuh utama di pertanaman pepaya. Keduanya bisa mengakibatkan kerugian besar.
Serangan penyakit antraknosa biasanya hanya terjadi pada fase pascapanen, akhir-akhir ini terlihat menyerang pertanaman di lapangan. Penyakit antraknosa menyebabkan kerusakan berat pada buah muda, daun tua, pelepah daun, bahkan batang yang dapat menyebabkan gagal panen dan pepaya jadi mati (Sobir, 2009). Serangan penyakit antraknosa pada buah pepaya pascapanen dapat menimbulkan kerugian mencapai 50% (Soesanto, 2006).
Patogen penyebab antraknosa pada buah pepaya di Indonesia adalah Colletotrichum gloeosporioides (Penz.) Penz. & Sacc (Semangun, 2000). Patogen dapat terbawa oleh benih, jika kondisi cuaca mendukung untuk perkembangannya bisa menunjukkan gejala rebah kecambah pada bibit. Patogen juga dapat dijumpai pada batang dan pelepah daun dari tanaman muda yang tidak bergejala (tampak sehat). Tanaman yang sudah mengandung patogen bisa timbul gejalanya pada saat kondisi fisiologi tumbuhan mendukung seperti meningkatnya umur maupun pada saat berbuah. Dengan demikian patogen ini bisa menginfeksi tanaman secara menyeluruh pada semua bagian tanaman (Wiyono dan Manuwoto, 2008).
2009). Penggunaan fungisida sintetis dalam pengendalian penyakit telah mendapat sorotan, dapat menimbulkan berbagai dampak negatif baik terhadap manusia maupun lingkungan (Sinaga, 1989). Untuk menghindari efek samping penggunaan fungisida, perlu dikembangkan alternatif lain yang tidak berbahaya bagi manusia dan lingkungan sekitarnya. Salah satu alternatif lain yang dapat digunakan dalam pengendalian penyakit tanaman yaitu penggunaan pestisida nabati (Utami, 1999).
Pestisida nabati adalah pestisida yang berasal dari tumbuh-tumbuhan yang kemudian diekstraksi, diproses, atau dibuat menjadi konsentrat yang tidak merubah struktur kimianya (Novizan, 2002). Pestisida nabati bersifat mudah terdekomposisi di alam sehingga tidak mencemari lingkungan serta relatif aman terhadap manusia dan hewan ternak, dan residunya mudah hilang (Kardinan, 2002). Penggunaan pestisida nabati dapat menggunakan pelarut air (air perasan, air rebusan), pelarut kimia tertentu (etanol, eter, dan lain sebagainya). Batas kelayakan penggunaan tanaman dengan pelarut air yang efektif dan ekonomis adalah 50 g/l air dengan efektifitas penekanan ≥ 90 % (Prijono, 1999).
Salah satu tumbuhan yang dapat digunakan sebagai fungisida nabati adalah daun serai wangi (Andoropogon nardus L.). Dari hasil penelitian yang telah dilakukan Chrisnawati (1994) kemampuan ekstrak daun serai wangi dalam menghambat pertumbuhan Rhizoctonia solani pada tanaman tomat lebih baik dibandingkan dengan pemberian ekstrak daun cengkeh, cinamon, dan nilam yang kesemuanya merupakan tanaman penghasil minyak atsiri yang mengandung eugenol. Eugenol yang dikandungnya dapat melarutkan lemak pada dinding sel sehingga dinding sel rusak dan akan mengganggu permeabilitas. Akibatnya sel jamur tersebut tidak selektif dan dapat menimbulkan kerusakan jaringan dan kematian. Menurut Pasya (1997), pemberian ekstrak daun serai wangi sebanyak 0,05 % dan 0,1 % dari berat kering tanah mempunyai kemampuan yang baik dalam menekan perkembangan penyakit rebah kecambah pada bibit cabai yang disebabkan oleh jamur Sclerotium rolfsii. Sejauh ini belum ada laporan tentang penggunaan air rebusan daun serai wangi untuk pengendalian penyakit antraknosa pada pepaya di Sumatera Barat.
Berdasarkan uraian di atas, penulis telah melakukan penelitian dengan judul”Uji Konsentrasi Air Rebusan Daun Serai Wangi Andoropogon nardus L. (Graminae) Terhadap Pertumbuhan Jamur Colletotrichum gloeosporioides Penz. Penyebab Penyakit Antraknosa Pada Pepaya secara In Vitro”. Tujuan penelitian ini adalah untuk mengetahui konsentrasi air rebusan daun serai wangi yang efektif dalam menekan pertumbuhan jamur Colletotrichum gloeosporioides penyebab penyakit antraknosa pada tanaman papaya secara In vitro.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini telah dilaksanakan di Laboratorium Fitopatologi Jurusan Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Andalas Padang dari bulan Desember 2009 sampai dengan Februari 2010.
Bahan dan Alat
Bahan yang digunakan adalah daun serai wangi (A. nardus L.), biakan murni jamur C. gloeosporioides, media Potato Dextrose Agar (PDA), akuades, spritus, aluminium foil, alkohol 70%, asam klorida (HCl) 2,5%, kapas, tissu, kertas Whatman No.40/ kertas saring, antibiotik (amoxicilin), dan kertas label.
Alat yang digunakan adalah gelas ukur, gelas piala, batang pengaduk, petri kaca, tabung reaksi, erlenmeyer, haemocytometer, cork borer, millimeter plotting, hand sprayer, tabung reaksi, mikro pipet, gelas objek, autoclave, ent case, jarum ose, mikroskop, lampu bunsen, pisau skapel, pisau, petri plastik, lumpang, pinset, timbangan, oven, dan alat-alat tulis.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 6 perlakuan dan 5 ulangan. Perlakuannya adalah perbedaan konsentrasi air rebusan daun serai wangi sebagai berikut :
A = Kontrol (akuades) B = 1%
C = 2% D = 3% E = 4% F = 5%
Data yang diperoleh dari hasil pengamatan dianalisis dengan menggunakan sidik ragam dan dilanjutkan dengan uji lanjut Duncan’s New Multiple Range Test (DNMRT) pada taraf 5 %.
Pelaksanaan Penelitian
Isolasi jamur C. gloeosporioides
Tabel 1. Hasil pengamatan morfologi jamur C. Gloeosporioides
No Pengamatan Hasil pengamatan
1. Penyebaran koloni Melingkar secara konsentris
2. Warna koloni Abu-abu dengan bagian bawah berwarna coklat 3. Bentuk dan warna aservulu Bulat, tidak beraturan; hialin; tidak ada setae
4. Bentuk dan warna konidia Berbentuk batang dengan ujung membulat terdiri dari 1 sel; hialin
5. Hifa Bersekat
penanaman jaringan yang sakit langsung pada media PDA. Selanjutnya diinkubasi pada suhu kamar, setelah patogen tumbuh diisolasi sampai didapatkan biakan murni. Setelah didapatkan biakan murni dilakukan identifikasi berpedoman pada buku Fungus Disease of Tropical Crop oleh Holliday (1980) dan Illustrated Genera of Imperfect Fungi oleh Barnet HL dan Hunter (1972), yaitu melalui pengamatan morfologi dengan mengamati bentuk dan warna koloni, bentuk dan warna aservulus, bentuk dan warna konidia, ada atau tidaknya setae, serta ada tidaknya sekat pada hifa. Hasil pengamatan morfologi pada Tabel 1
Berdasarkan hasil pengamatan terhadap morfologi jamur C. gloeosporioides sama dengan yang dinyatakan oleh Holiday (1980) dan Barnet HL dan Hunter (1972).
Pembuatan Air Rebusan Daun Serai Wangi Daun serai wangi diambil dari Kebun Percobaan Fakultas Pertanian Universitas Andalas. Air rebusan daun serai wangi diperoleh dari daun tumbuhan yang masih segar masing-masing ditimbang dengan berat 10 g, 20 g, 30 g, 40 g, dan 50 g lalu dicuci dengan akuades dan dikering anginkan. Kemudian daun tersebut dipotong kecil-kecil dan masing-masing takaran diblender sampai halus. Selanjutnya ditambahkan akuades sehingga volumenya menjadi 1 liter, kemudian dimasukkan kedalam Erlenmeyer steril dan ditutup dengan aluminium foil dan dipanaskan hingga mendidih, dan tetap dibiarkan sampai 15 menit (Sudarmo, Hamdani, dan Prijono., 1999). Kemudian diangkat dan disaring dengan menggunakan kertas saring dan ditambahkan akuades steril sampai volumenya 1 liter (Asfiadhi, 2007).
Pengujian Penghambatan Pada Media PDA Pengujian penghambatan pertumbuhan C. gloeosporioides dilakukan dengan cara mencampurkan 1 ml masing-masing perlakuan dengan 9 ml media PDA cair didalam tabung reaksi dan dihomogenkan, kemudian dituangkan kedalam cawan petri, dan didinginkan. Biakan murni jamur C. gloeosporioides dipotong dengan menggunakan cork borer berdiameter 7 mm, untuk selanjutnya diinokulasikan di tengah-tengah medium PDA yang telah diberi bahan perlakuan. Masing-masing perlakuan kemudian diinkubasi dalam suhu kamar untuk selanjutnya dilakukan pengamatan.
Perkecambahan Konidia
Untuk mengetahui kemampuan fungisida air rebusan daun serai wangi dalam menekan perkecambahan konidia secara in vitro dilakukan dengan menggunakan metode Slide germination (perkecambahan konidia). Gelas objek dicelupkan ke dalam air rebusan daun serai wangi sesuai perlakuan yang telah ditetapkan hingga basah merata, lalu dikering anginkan. Setelah kering ditetesi dengan suspensi konidia 0,05 ml dalam kerapatan 50.000 konidia/ml suspensi. Setiap tetes diupayakan agar menyebar pada diameter 10 mm dengan menggoyang-goyangkan. Setelah ditetesi suspensi konidia, gelas objek tersebut disimpan dalam cawan petri yang telah dialasi dengan kertas saring yang dilembabkan. Pengamatan daya kecambah dilakukan 1 x 24 jam setelah suspensi konidia diteteskan (Prijono, 2004).
Pengamatan
Luas Koloni C. gloeosporioides
Pengamatan dilakukan setiap hari dimulai dari hari ke-2 setelah inokulasi sampai cawan petri kontrol dipenuhi jamur (14 hari setelah inokulasi). Luas koloni diukur dengan menggunakan kertas millimeter ploting pada tiap-tiap cawan petri dengan menggambarkan luas tersebut pada plastik kaca. Untuk menghitung efektivitas masing-masing perlakuan terhadap luas koloni dapat digunakan rumus (Prijono, 2004) :
E = LK
LP LK
x 100% Keterangan : E = Efektivitas
LK = Luas koloni pada kontrol LP = Luas koloni pada perlakuan Pertumbuhan Koloni C. gloeosporioides
Pengamatan dilakukan pada hari setelah cawan petri tanpa perlakuan dipenuhi oleh jamur (hari ke-14) dengan melihat penyebaran koloni, warna koloni, arah pertumbuhan koloni, kerapatan miselium, struktur miselium/hifa untuk masing-masing perlakuan dan membandingkannya dengan kontrol. Data yang diperoleh disajikan dalam bentuk tabel.
Berat Basah dan Berat Kering Koloni C. gloeosporioides
perlakuan dipenuhi oleh jamur (hari ke-14). Untuk mengukur berat basah koloni jamur, setiap cawan petri ditambah dengan 10 ml HCl 2,5% untuk melarutkan agar, kemudian disaring dengan menggunakan kertas Whatman, lalu ditimbang dengan menggunakan timbangan analitik. Pengukuran berat kering jamur, miselium yang dibungkus dengan kertas Whatman No.40 dikeringkan dengan oven pada suhu 600C selama 2 hari. Selanjutnya ditimbang dengan timbangan analitik.
Efektivitas masing-masing perlakuan terhadap berat basah dihitung dengan rumus :
E =
BBK BBP BBK
x 100%
dan untuk berat kering dihitung dengan rumus :
E =
BKK BKP BKK
x 100%
Keterangan : E = Efektivitas BBK = Berat Basah Kontrol BKK = Berat Kering Kontrol BBP = Berat Basah Perlakuan BKP = Berat Kering Perlakuan Jumlah Konidia Jamur /ml suspensi
Penghitungan jumlah konidia jamur dilakukan setelah cawan petri kontrol dipenuhi jamur dengan menggunakan haemocytometer, dengan cara menambahkan 10 ml akuades ke dalam masing-masing cawan petri, lalu konidia dilepas dengan bantuan kuas kecil. Satu tetes suspensi konidia diletakkan di atas haemocytometer dengan volume kotak terkecil 0,00025 mm3. Penghitungan dilakukan dengan cara; memilih 5 kotak B secara acak (1 kotak B terdiri dari 16 kotak terkecil (C)). Jumlah konidia jamur/ml suspensi dapat dihitung dengan mencari jumlah rata-rata konidia pada kotak C yang diamati kemudian dikali dengan 4 x 106sel/ml.
Daya Perkecambahan Konidia C. gloeosporioides Pengamatan dilakukan 1 x 24 jam setelah suspensi konidia diteteskan pada objek glass, kemudian diamati di bawah mikroskop jumlah konidia yang berkecambah dan jumlah konidia seluruhnya. Setelah itu dilakukan penghitungan daya perkecambahan konidia dengan rumus :
Daya kecambah konidia =
% 100 diamati yang konidia Jumlah
h berkecamba yang
konidia Jumlah
x
Untuk menghitung efektivitas masing-masing perlakuan terhadap daya kecambah konidia dapat digunakan rumus :
E =
dk
dp
dk
x 100%Keterangan : E = Efektivitas
dk = Daya kecambah konidia pada kontrol dp = Daya kecambah konidia pada perlakuan
HASIL DAN PEMBAHASAN
Luas koloni C. gloeosporioides
Hasil analisis sidik ragam menunjukkan bahwa perlakuan berbagai konsentrasi air perasan daun serai wangi memberikan pengaruh yang berbeda nyata terhadap luas koloni C. gloeosporioides. Setelah dilakukan uji lanjutan DNMRT pada taraf nyata 5 %, hasilnya dapat dilihat pada Tabel 2. Tabel 2. Luas koloni C. gloeosporioides dengan
berbagai perlakuan di medium PDA (umur 14 hari)
Konsentrasi Luas koloni (cm2)
Efektivitas (%) 0 %
(Kontrol) 56,32 a
-1% 51,01 b 9,42
2% 48,70 b 13,52
3% 38,79 c 31,12
4% 26,32 d 53,26
5% 20,52 e 63,56
KK= 4,82%
Dari Tabel 2 dapat dilihat bahwa pemberian air rebusan daun serai wangi dapat menekan pertumbuhan luas koloni C. gloeosporioides. Semakin tinggi konsentrasi air rebusan daun serai wangi yang diperlakukan maka semakin kecil luas koloni C. gloeosporioides, dan efektivitasnya terhadap luas koloni juga makin tinggi. Pada konsentrasi 5% dapat menekan pertumbuhan luas koloni C. gloeosporioides sebesar 63,56%. Laju pertumbuhan luas koloni C. gloeosporioides dengan berbagai konsentrasi air rebusan daun serai wangi dimulai pada hari ke-2 sampai hari ke-14 dapat dilihat pada Gambar 1.
Gambar 1. Laju pertumbuan luas koloni C. gloeosporioides dengan berbagai konsentrasi air rebusan daun serai wangi pada medium PDA dimulai pada hari ke-2 sampai dengan hari ke-14.
Pertumbuhan Koloni C. gloeosporioides
Hasil pengamatan terhadap pertumbuhan koloni biakan C. gloeosporioides dapat dilihat pada Tabel 3.
Pada Tabel 3 dapat dilihat bahwa pemberian perlakuan air perasan daun serai wangi tidak mempengaruhi penyebaran koloni, arah pertumbuhan koloni dan kerapatan miselium, tetapi berpengaruh terhadap warna koloni. Warna koloni tanpa perlakuan yaitu abu-abu dengan bagian bawah berwarna coklat, sedangkan yang diberi perlakuan berwarna abu-abu muda dengan bagian bawah berwarna putih kekuningan.
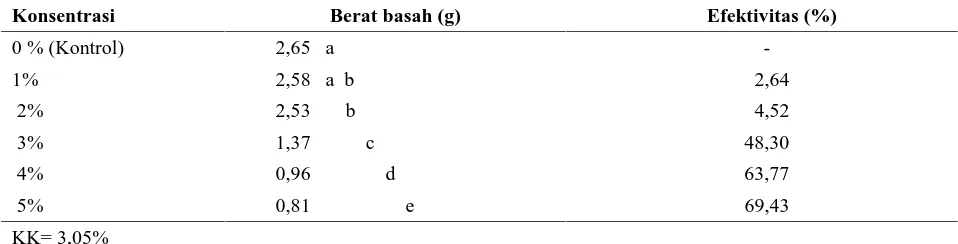
Berat Basah Koloni C. gloeosporioides
Hasil analisis sidik ragam berat basah koloni C. gloeosporioides menunjukkan bahwa perlakuan berbagai konsentrasi air perasan daun serai wangi memberikan pengaruh yang berbeda nyata. Setelah dilakukan uji lanjutan DNMRT pada taraf nyata 5 %, hasilnya dapat dilihat pada Tabel 4.
Dari Tabel 4 terlihat bahwa perlakuan dengan air rebusan daun serai wangi memberikan pengaruh terhadap berat basah koloni C. gloeosporioides. Semakin tinggi konsentrasi air rebusan daun serai wangi yang diperlakukan maka berat basah koloni C. gloeosporioides juga rendah dan efektivitasnya terhadap berat basah koloni semakin tinggi. Pada konsentrasi 5% dapat menekan berat basah koloni sebesar 69,43%.
Tabel 3. Pengamatan Makroskopis pertumbuhan koloni C. gloeosporioides (umur 14 hari)
No Pengamatan Tanpa perlakuan Dengan perlakuan
1. Penyebaran koloni Melingkar secara konsentris Melingkar secara konsentris 2. Warna koloni Abu-abu dengan bagian bawah berwarna coklat Abu-abu muda dengan bagian
bawah berwarna putih kekuningan
3. Arah pertumbuhan koloni Kesamping dan keatas Kesamping dan keatas 4. Kerapatan miselium Tebal dan rapat Tebal dan rapat
Tabel 4. Berat basah koloni C. gloeosporioides dengan berbagai konsentrasi (umur 14 hari)
Konsentrasi Berat basah (g) Efektivitas (%)
0 % (Kontrol) 2,65 a
-1% 2,58 a b 2,64
2% 2,53 b 4,52
3% 1,37 c 48,30
4% 0,96 d 63,77
5% 0,81 e 69,43
KK= 3,05%
0 10 20 30 40 50 60
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Lu
as
K
ol
on
i (
cm
2
)
Hari Pengamatan
Berat Kering Koloni C. gloeosporioides
Hasil analisis sidik ragam berat kering koloni C. gloeosporioides menunjukkan bahwa perlakuan berbagai konsentrasi air perasan daun serai wangi memberikan pengaruh yang berbeda nyata. Setelah dilakukan uji lanjutan DNMRT pada taraf nyata 5 %, hasilnya dapat dilihat pada Tabel 5. Tabel 5. Berat kering koloni C. gloeosporioides
dengan berbagai konsentrasi (umur 14 hari)
Konsentrasi Berat kering (g)
Efektivitas (%) 0 %
(Kontrol) 1,45 a
-1% 1,43 a 1,38
2% 1,30 b 10,34
3% 1,09 c 24,82
4% 0,67 d 53,79
5% 0,53 e 63,44
KK= 2,68 %
Pada Tabel 5 terlihat bahwa perlakuan dengan air rebusan daun serai wangi memberikan pengaruh terhadap berat kering koloni C. gloeosporioides. Semakin tinggi konsentrasi air rebusan daun serai wangi yang diperlakukan maka berat kering koloni C. gloeosporioides makin rendah dan efektivitasnya terhadap berat kering koloni semakin tinggi. Pada konsentrasi 5% dapat menekan berat kering koloni sebesar 63,44%.
Jumlah konidia C. gloeosporioides
Hasil analisis sidik ragam menunjukkan bahwa perlakuan berbagai konsentrasi air perasan daun serai wangi memberian pengaruh yang berbeda nyata terhadap jumlah konidia C. gloeosporioides. Setelah dilakukan uji lanjutan DNMRT pada taraf nyata 5 %, hasilnya dapat dilihat pada Tabel 6. Tabel 6. Jumlah konidia C. gloeosporioides/ml
suspensi dengan berbagai konsentrasi (umur 14 hari)
Konsentrasi Jumlah konidia/ml
suspensi Efektivitas (%) 0 %
(Kontrol) 5,41 . 10
6 a
-1% 5,01 . 106 b 7,39
2% 4,41 . 106 c 18,48
3% 3,06 . 106 d 43,43
4% 2,09 . 106 e 61,36
5% 1,08 . 106 f 80,03
KK= 2,40 %
Pada Tabel 6 dapat dilihat bahwa perlakuan dengan air rebusan daun serai wangi memberikan pengaruh terhadap jumlah konidia C. gloeosporioides. Semakin tinggi konsentrasi air rebusan daun serai wangi yang diperlakukan semakin rendah jumlah konidia C. gloeosporioides dan semakin tinggi efektivitasnya terhadap jumlah konidia. Pada konsentrasi 5% sudah dapat menekan pertumbuhan jumlah konidia jamur C. gloeosporioides sebesar 80,03%.
Daya Perkecambahan konidia C. gloeosporioides Hasil analisis sidik ragam menunjukkan bahwa perlakuan berbagai konsentrasi air perasan daun serai wangi memberikan pengaruh yang berbeda nyata terhadap jumlah konidia C. gloeosporiodes. Setelah dilakukan uji lanjutan DNMRT pada taraf nyata 5 %, hasilnya dapat dilihat pada Tabel 7.
Tabel 7. Daya Perkecambahan konidia C. gloeosporioides dari berbagai konsentrasi (umur 14 hari)
Konsentrasi Daya
kecambah (%) Efektivitas (%) 0 %
(Kontrol) 82,59 a
-1% 63,83 b 22,71
2% 46,51 c 43,68
3% 18,05 d 78,14
4% 0,00 e 100,00
5% 0,00 e 100,00
KK= 11,58 %
Pada Tabel 7 dapat dilihat bahwa perlakuan dengan air rebusan daun serai wangi memberikan pengaruh terhadap daya perkecambahan konidia jamur C. gloeosporiodes. Semakin tinggi konsentrasi air rebusan daun serai wangi yang diperlakukan semakin rendah jumlah konidia jamur C. gloeosporioides dan semakin tinggi efektivitasnya terhadap daya perkecambahan konidia, tetapi pada konsentrasi 4% dan 5% tidak terjadi perkecambahan
Pembahasan
jamur. Semakin tinggi konsentrasi air rebusan daun serai wangi maka semakin banyak senyawa yang larut didalamnya sehingga petumbuhan jamur semakin terhambat. Menurut Sastrohamidjojo (2004), senyawa yang terkandung dalam daun dan batang serai wangi adalah minyak atsiri yang terdiri dari sitronellal, geraniol, sitronellol, geranil asetat, sitronellil asetat, sitral, kavikol, eugenol, elemol, kadinol, kadinen, vanilin, limonen, kamfen. Menurut Nasrun, Jamailus, dan Nurmansyah (1993) sitronellal merupakan senyawa aldehid yang mempunyai sifat anti jamur yang kuat. Chrisnawati (1994), menambahkan ekstrak daun serai wangi mampu menghambat pertumbuhan jamur, karena senyawa eugenol yang dikandungnya dapat melarutkan lemak pada dinding sel sehingga dinding sel rusak dan akan mengganggu permeabilitas sehingga sel jamur tersebut tidak selektif dan dapat menimbulkan kerusakan jaringan jamur.
Hasil pengamatan pertumbuhan koloni jamur C. gloeosporioides secara makroskopis (Tabel 3) memperlihatkan bahwa jamur yang diperlakukan dengan air rebusan daun serai wangi maupun tanpa perlakuan menunjukkan penyebaran koloni miselia melingkar secara konsentris. Pada pengamatan warna koloni terdapat perbedaan warna antara tanpa perlakuan dan diberi perlakuan. Warna koloni jamur tanpa diberi perlakuan berwarna abu-abu dengan bagian bawah berwarna coklat sedangkan yang diberi perlakuan berwarna abu-abu muda dengan bagian bawah berwarna putih kekuningan. Perbedaan warna koloni berhubungan dengan jumlah konidia yang dihasilkan jamur. Dwidjoseputro (1978) dalam Lestari (2000), menyatakan pada umumnya jumlah konidia jamur ditentukan oleh warna koloni yang dimilikinya.
Pengamatan terhadap berat basah (Tabel 4) dan berat kering koloni jamur C. gloeosporioides (Tabel 5) menunjukkan bahwa pemberian air rebusan daun serai wangi memberikan pengaruh yang berbeda dalam menekan berat basah dan berat kering koloni jamur. Berat basah dan berat kering koloni jamur berkaitan dengan luas koloni jamur. Dimana luas koloni yang besar memperlihatkan berat basah dan berat kering koloni jamur yang tinggi dan sebaliknya dengan luas koloni yang kecil memperlihatkan berat basah dan berat kering yang rendah. Perbedaan tersebut terjadi karena adanya penekanan pertumbuhan dan perkembangan jamur. Hal ini menunjukkan bahwa senyawa yang terkandung dalam air rebusan daun serai wangi bersifat anti jamur dan menghambat pertumbuhan hifa sehingga berpengaruh terhadap luas koloni yang semakin kecil. Dahlan et al., (1998) menyatakan bahwa minyak serai wangi mampu menekan pertumbuhan koloni jamur dan mengendalikan biomassa koloni.
Pada pengamatan jumlah konidia/ml suspensi yang dihasilkan oleh jamur C. gloeosporioides (Tabel 6) memperlihatkan bahwa pemberian air rebusan daun serai wangi dengan
konsentrasi yang rendah maka efektivitasnya terhadap jumlah konidia juga rendah. Semakin tinggi konsentrasi yang diperlakukan maka efektivitasnya terhadap jumlah konidia juga tinggi dan jumlah konidia yang terbentuk semakin sedikit. Berkurangnya jumlah konidia yang terbentuk juga dipengaruhi oleh efektivitas senyawa kimia yang terkandung dalam air rebusan daun serai wangi terhadap luas koloni (Tabel 2). Semakin besar luas koloni, maka jumlah konidia yang dihasilkan juga akan semakin bertambah, demikian sebaliknya. Semangun (2000) menyatakan beberapa senyawa kimia seperti asam, minyak, ester, dapat menghambat proses pembentukan dinding sel yang diperlukan unutk memanjangnya ujung hifa, percabangan dan pembentukan konidia.
Hasil dari pengujian daya perkecambahan konidia C. gloeosporioides (Tabel 7) memperlihatkan bahwa pemberian air rebusan daun serai wangi pada masing-masing konsentrasi dapat menghambat perkecambahan konidia. Pada perlakuan 4% dan 5% tidak terjadi perkecambahan konidia. Pada konsentrasi 4% dan 5% mampu menekan perkecambahan konidia 100%. Hal ini menunjukkan bahwa semakin tinggi konsentrasi air rebusan daun serai wangi maka semakin tinggi efektivitasnya terhadap perkecambahan konidia. Penekanan daya perkecambahan ini terjadi karena adanya senyawa kimia yang bersifat sebagai anti jamur pada daun serai wangi. Senyawa kimia ini tidak hanya menghambat pertumbuhan sel tetapi juga dapat mematikan sel jamur. Menurut French (1985) senyawa-senyawa kimia yang terdapat dalam minyak atsiri dapat menimbulkan respon biologis pada jamur, diantaranya dapat menghambat dan menekan pertumbuhan serta perkecambahan konidia jamur. Kardinan (1999) menambahkan bahwa senyawa kimia yang terdapat dalam minyak atsiri dapat menghambat perkecambahan spora dan pertumbuhan hifa.
Dari hasil semua pengamatan dapat dilihat bahwa air rebusan daun serai wangi mampu menekan pertumbuhan luas koloni, berat basah koloni, berat kering koloni, jumlah konidia jamur/ml suspensi, dan daya perkecambahan konidia jamur C. gloeosporioides. Untuk semua konsentrasi yang digunakan adanya kecendrungan semakin tinggi konsentrasi yang digunakan maka semakin tinggi pula efektivitasnya dalam menekan pertumbuhan jamur C. gloeosporioides.
KESIMPULAN DAN SARAN
Kesimpulan
suspensi, dan daya perkecambahan konidia jamur C. gloeosporioides.
Saran
Disarankan untuk melakukan pengujian lebih lanjut mengenai pengaruh konsentrasi air rebusan daun serai wangi terhadap pertumbuhan jamur Colletotrichum gloeosporioides pada buah pepaya pascapanen.
DAFTAR PUSTAKA
Asfiadhi OS. 2007. Uji Konsentrasi Air Rebusan Daun Ruku-ruku (Ocimum sanctum Linn.) Dalam Mengendalikan Jamur Erysishype cichoacearum DC ex.Merat Penyebab Penyakit Tepung (Powdery Mildew) Pada Mentimun (Cucumis sativus Linn). [Skripsi]. Padang: Fakultas Pertanian Unand.
Barnet HL, Hunter BB. 1972. Illustrated Genera of Imperfect Fungi. Fourth Edition. New York: Macmillan Publishing Company.
Badan Pusat Statistik RI. 2010. Produksi Buah-buahan di Indonesia. Statistik Indonesia 2010. http;//www.bps.go.id/tab sub/view. php?tab=85. [14 Mei 2010].
Chrisnawati. 1994. Pengujian Beberapa Tanaman Penghasil Minyak Atsiri Terhadap Jamur Rhizoctonia solani Penyebab Rebah Kecambah Pada Tomat. Sukarami. Seminar sehari Perhimpunan Fitopatologi Indonesia Komisariat Sumbar, Riau, Jambi.
Dinas Pertanian Tanaman Pangan dan Hortikultura Sumbar. 2010. Statistik Tanaman Pangan dan Hortikultura Sumatera Barat tahun 2009. Sumatera Barat. Padang: Dinas Pertanian Tanaman Pangan dan Hortikultura Sumatera Barat
French CR. 1985. The Bioregulatory action Of Flavor Compound on Fungal Spores an Other Propagales. Ann, Rev. Phytophathologi 23: 99-173
Holliday P. 1980. Fungus diseases of Tropical Crops. Melbourne: Cambridge University Press. Kardinan, A. 1999. Pestisida Nabati Ramuan dan
Aplikasi. Jakarta: Penebar Swadaya.
Lestari, L. 2000. Uji daya kendali Kombinasi Rimpang Zingiberaceae Dengan Gambir dan EM4 Terhadap C. Capsici Penyebab Antraknosa Pada Cabai Secara In vitro. [Skripsi]. Padang: Fakultas Pertanian Unand. Novizan. 2002. Membuat dan Memanfaatkan
Pestisida Ramah Lingkungan. Jakarta: Agromedia Pustaka.
Pasya I. 1997. Pengaruh Pemberian Banyaknya Daun Serai Wangi (Andoropogon nardus L.) Terhadap Pengendalian Penyakit Rebah Kecambah yang disebabkan oleh Sclerotium rolfsii Sacc Pada Persemaian Cabai (Capsicum annuum). [Skripsi]. Padang: Fakultas Pertanian Unand.
Prijono D. 1999. Prinsip-prinsip Uji Hayati. Pusat Kajian Pengendalian Hama Terpadu. Bogor: Departemen Hama dan Penyakit Tumbuhan. Fakultas Pertanian IPB.
__________. 2004. Pengujian Pestisida Bahan Pelatihan Pengembangan dan Pemanfaatan Insektisida Alami. Bogor. Pusat Kajian Pengendalian Hama Terpadu. Bogor: Departemen Hama dan Penyakit Tumbuhan. Fakultas Pertanian IPB.
Rukmana R. 1995. Budidaya; Pepaya dan Pasca Panen. Yogyakarta: Kanisius Media.
Sastrohamidjojo H. 2004. Kimia minyak atsiri. Yogyakarta: Gadjah Mada University Press. Semangun H. 2000. Penyakit-penyakit Tanaman
Hortikultura di Indonesia. Yogyakarta: Gajah Mada University Press.
Sinaga MS. 1989. Potensi Gliocladium spp Sebagai Agen Hayati Beberapa Jamur Patogenik yang bersifat Soil Born. Bogor: Fakultas Pertanian Jurusan Hama dan Penyakit Tumbuhan. IPB. Sobir. 2009. Sukses Bertanam Pepaya Unggul
Kualitas Supermarket. Jakarta: Agromedia Pustaka.
Soesanto L. 2006. Penyakit Pasca Panen; Sebuah Pengantar. Yogyakarta. Kanisius Media. Sudarmo, Hamdani, Prijono, D. 1999. Keefektifan
Ekstrak Sederhana Algaea odorata Lour. (Meliaceae) Terhadap Ulat Krop Kubis Crocidolomia binotalis Zeller. Prosiding Forum Komunikasi Ilmiah Pemanfaatan Pestisida nabati. Pusat penelitian dan Pengembangan Tanaman Perkebunan. Prosiding. 9-10 Nopember 1999. Bogor: Pusat Penelitian dan Pengembangan Tanaman Perkebunan. Hal 122-132.
Utami, 1999. Pestisida Nabati Perangi Hama dan Penyakit. Dalam Trubus No 358. Edisi September. Th. XXX. Jakarta. hal 37.