146 Salah satu sumber daya alam yang tidak asing lagi adalah minyak bumi. Bahan alam ini amat mempengaruhi kehidupan. Ummat manusia masih menggantungkan sebagian besar aktivitas kehidupannya pada bahan alam tersebut yang kini semakin menipis keberadaannya. Manusia kini berpacu untuk menemukan bahan bakar pengganti minyak guna mengurangi ketergantungan pada “emas hitam” ini.
Minyak bumi merupakan campuran hidrokarbon yang terbentuk melalui proses fisis dan kimia yang sangat lama (jutaan tahun). Dari minyak bumilah, bahan bakar, sebagian bahan baku industri, dan berbagai produk kimia diperoleh. Hidrokarbon merupakan golongan paling sederhana di antara semua golongan senyawa organik.
Bukan saja pada minyak bumi dan hidrokabon, manusia juga sangat berketergantungan pada senyawa organik (senyawa karbon) baik alami maupun buatan. Mulai dari pangan (karbohidrat, protein, lemak, vitamin), sandang (serat alami dan buatan), papan (kayu, plastik), kesehatan dan kecantikan (obat-obatan, kosmetik, pengawet), pertanian (pupuk, pembasmi hama) sampai pada transportasi (bahan bakar, pelumas) dan industri (bahan bakar, bahan mentah, bahan baku), dan lain-lain.
A.
SENYAWA KARBON
Pada awalnya, senyawa-senyawa yang berasal dari makhluk hidup disebut senyawa organik; dan Ilmu Kimia yang mempelajari senyawa ini disebut Kimia Organik. Sebaliknya, senyawa-senyawa yang bukan berasal dari makhluk hidup disebut senyawa anorganik.
Pada perkembangannya, kemudian manusia mampu melakukan proses pembuatan sebagian senyawa organik. Frederick Wohler (Jerman) dapat membuat beberapa senyawa yang sifatnya persis sama dengan senyawa organik aslinya. Pada tahun 1824 Wohler berhasil membuat asam oksalat, suatu zat yang terdapat dalam getah tumbuhan (jenis oxalis), dan kemudian pada tahun 1828 ia berhasil membuat urea, suatu senyawa yang biasanya ditemukan dalam darah dan urin. Makhluk hidup tidak lagi merupakan sumber utama dari senyawa organik. Salah satu sifat utama senyawa organik baik alami maupun buatan adalah selalu mengandung unsur karbon.
Oleh karena itulah, istilah “senyawa organik” disempurnakan menjadi senyawa karbon; dan Ilmu Kimia yang mempelajarinya disebut sebagai Kimia Karbon. Namun demikian, istilah senyawa organik kadang-kadang masih digunakan terutama untuk membedakannya dari senyawa anorganik.
1.
Perbedaan Senyawa Organik Dan Senyawa Anorganik
Senyawa organik (senyawa karbon) dapat dibedakan dari senyawa anorganik dalam berbagai cara. Tabel 11.1 memperlihatkan perbedaan penting dari keduanya.
Beberapa perbedaan antara senyawa organik dan senyawa anorganik dapat diamati langsung (melalui percobaan) misalnya antara gula, alkohol, lilin, kamper, kayu, dst. dari kelompok senyawa organik dengan kelompok senyawa anorganik seperti garam dapur, logam-logam, oksida logam, dll.
No Senyawa Organik Senyawa Anorganik
1. Umumnya senyawa kovalen Senyawa Ion
2. Umumnya tak larut dalam air Dapat larut
3. Umumnya bertitik leleh rendah Bertitik leleh tinggi 4. Umumnya dapat terbakar Tidak dapat terbakar
5. Struktur ikatan rumit Lebih sederhana
6. Reaksi bersifat lambat Reaksinya lebih cepat
2.
Kekhasan Atom Karbon
Sebagai bahan perbandingan, pada abad 19 dikenal 30 ribu senyawa anorganik sementara senyawa karbon sebanyak 1 juta. Kini berjuta-juta senyawa karbon alami dan buatan dijumpai jauh melampaui jumlah senyawa anorganik yang ada. Mengapa senyawa organik demikian banyak jumlahnya?
Salah satu jawaban terhadap pertanyaan tersebut adalah disebabkan oleh sifat khas atom karbon (C). Kekhasan atom karbon di antaranya:
(a) Atom C berelektron valensi 4, dan cenderung membentuk berbagai tipe ikatan kovalen untuk mencapai konfigurasi stabilnya.
(b) Atom C dapat berikatan dengan atom C lain, bahkan dapat membentuk rantai atom C baik terbuka (lurus dan cabang) maupun lingkar.
Jadi yang menyebabkan senyawa karbon sangat beragam dan jumlahnya yang begitu banyak adalah sifat khas atom C adalah bahwa atom C menjadi unsur utama pembentuk senyawa karbon itu sendiri, dan atom C dapat berikatan melalui beragam cara.
3.
Penggolongan Senyawa Karbon
Dalam Kimia Karbon, struktur ikatan dari molekul sangat menentukan sifat kimia suatu senyawa karbon dan merupakan bagian penting yang menjadi salah satu lingkup bahasan Kimia Karbon.
Senyawa karbon terdiri dari unsur C dan H sebagai unsur utama, dan beberapa unsur lainnya seperti O, N, S, P, halogen, dan beberapa logam.
Gbr 11.2. Rantai Atom Karbon: (1) Lurus; (2) Cabang; (3) Lingkar; (4) Jaring. (1) CCCCCC (3) C C C C C C (2) CCCCCC CC C C (4) C C C C C C C C C C C C C C C C C C C Gbr 11.1. Beberapa Tipe Ikatan Kovalen dari Atom C.
4 ik. tunggal
C
C
2 ik. tunggal dan 1 ik. rangkap-2
C
2 ik. rangkap-2 1 ik. tunggal dan
C
1 ik. rangkap-3148 Sedemikian banyaknya jumlah senyawa organik dan penggunaannya yang meluas, mulai dari bidang pangan dan sandang, kedokteran, farmasi, pertanian, peternakan dan bahkan sampai untuk berbagai komponen peralatan dan industri menunjukkan bahwa lingkup bahan kajian Kimia Karbon begitu luas.
Usaha untuk mempelajari senyawa karbon telah mendorong usaha pembagian senyawa karbon atas dasar sifat umum senyawa tersebut. Tabel 11.2 memperlihatkan beberapa golongan senyawa karbon menurut jenis unsur pembentuknya.
Tabel 11.2. Jenis Unsur dan Golongan Senyawa Karbon
Jenis Unsur Golongan Senyawa Karbon
C; H Hhidrokarbon
C; H; O Alkohol, Eter, Karbohidrat, Asam Karboksilat, dll C; H, halogen Alkil-halida
C; H; N Amina, dll.
C; H; O; N Amida, Asam Amino, dll. C; H; O; N; P Asam Nukleat
C; H; O; N; P; S Protein
B.
HIDROKARBON
Sesuai dengan namanya, hidrokarbon merupakan golongan senyawa karbon yang hanya mengandung unsur C dan unsur H.
Berdasarkan pada struktur rantai C, hidrokarbon dapat dibedakan atas hidrokarbon alifatik (terbuka) dan hidrokarbon siklik (lingkar). Sedangkan berdasar pada jenis ikatan kovalen antar C, hidrokarbon dapat dibedakan atas hidrokarbon jenuh (hanya memiliki ikatan tunggal C–C), dan hidrokarbon tak-jenuh (memiliki ikatan rangkap-2: C=C, atau ikatan rangkap-3: CC).
Kelompok hidrokarbon yang akan dibahas pada paragraf ini hanya meliputi alkana (berikatan tunggal: C-C); alkena (hanya memiliki 1 ikatan rangkap-2: C=C), dan alkuna (hanya memiliki 1 ikatan rangkap-3: CC). Sedangkan kelompok hidrokarbon siklik akan dibahas pada bab lainnya.
HIDROKARBON
ALIFATIK SIKLIK
JENUH TAK-JENUH JENUH TAK-JENUH
ALKENA ALKUNA dll. AROMATIK SIKLOALKANA dll. ALKANA
1.
Alkana
Alkana merupakan hidrokarbon alifatik jenuh (berkerangka ikatan C tunggal terbuka). Kelompok senyawa ini sering disebut parafin karena sifatnya yang kurang reaktif.
(Parafin berasal dari kata parum affinis yang berarti berdaya gabung kecil; parum = sedikit, dan affinis = gabung.)
a.
Deret Homolog Dan Rumus Alkana
Struktur ikatan yang ditunjukkan pada gambar di atas akan selalu diterapkan untuk membahas molekul senyawa alkana lainnya. Struktur ikatan sepuluh senyawa alkana pertama yang mulai melibatlan ikatan antar 2 atom C, antar 3 atom C, dan seterusnya disusun seperti ditunjukkan pada Tabel 11.3.
Tabel 11.3. Sepuluh Senyawa Alkana Pertama.
n Struktur Ikatan dalam Molekul Molekul Rumus Senyawa Nama
1. CH4 metana
2. C2H6 etana
3. C3H8 propana
4. C4H10* butana
5. “lurus” dan “bercabang” C5H12 pentana
6. “lurus” dan “bercabang” C6H14 heksana
7. “lurus” dan “bercabang” C7H16 heptana
8. “lurus” dan “bercabang” C8H18 oktana
9. “lurus” dan “bercabang” C9H20 nonana
10. “lurus” dan “bercabang” C10H22 dekana Keterangan:
n = jumlah atom C alkana.
Mulai n=4 (*); struktur ikatan antar atom C pada alkana mulai membentuk rantai C cabang, selain membentuk rantai C lurus walaupun rumus molekulnya sama.
HCH H H HC H H CH H H HC H H C H H CH H H HC H H C H H CH H H C H H dan HC H H C H CH H H HCH H Gbr. 11.4 Molekul Metana
(a) Bentuk Ruang Molekul; (b) Struktur Lewis; (c) Struktur Ikatan; dan (c) Rumus Molekul. H H C H (a) H (b) H C H
.. ..
H.
.
H.
.
(c) H C H H H CH4 (d)Senyawa alkana terbentuk hanya dari atom-atom karbon (C) dan atom-atom hidrogen (H); dan molekul alkana yang paling sederhana adalah molekul CH4 (metana).
150 Dari Tabel 11.3, senyawa alkana tampak membentuk sebuah deret seperti berikut:
Jumlah atom C (n) 1 2 3 4 …
Rumus Molekul CH4 C2H6 C3H8 C4H10 CnH…
Beda: CH2 CH2 CH2
Deret inilah yang disebut deret homolog. Masing-masing senyawa pada deret di atas disebut homolog. (Homolog dari kata Yunani: homos berarti sama, dan logos berarti perkataan.) Sebuah homolog berbeda dari homolog berikutnya oleh sebuah gugus metilen, CH2. Jadi deret
di atas akan memenuhi homolog umum: CnH2n+2. Atau dengan kata lain, senyawa alkana
memiliki rumus umum,CnH2n+2.
b.
Sifat Alkana
Sifat Fisis
Beberapa sifat fisis alkana terutama wujudnya dapat dilihat pada Tabel 11.4. Tabel 11.4. Titik Leleh Dan Titik Didih Senyawa Alkana
Jumlah Atom C C1 C2 C3 C4 C5 C6 C7C17 C18 C19 C20
Titik Leleh (0C) -183 -172 -187 -135 -130 -94 -9122 28 32 36
Titik didih (0C) -162 -89 -42 -0,5 36 68,7 98–300 310 330 330 Alkana dengan jumlah atom C1-C4 berwujud gas; C5-C17 berwujud cair; dan > C17
berwujud padat. Sifat Kimia
Nama parafin yang diberikan kepada alkana seperti yang telah disebutkan di atas menunjukkan bahwa sifat kimia senyawa alkana umumnya kurang reaktif (sukar bereaksi) dengan zat lain.
c. Keberadaan Dan Kegunaan Alkana
Keberadaan
Senyawa-senyawa alkana terutama ditemukan antara lain sebagai gas alam dan minyak bumi. Senyawa alkana merupakan komponen terbesar penyusun minyak bumi. Alkana rendah (berwujud gas) ditemukan sebagai gas bumi atau gas alam.
Kegunaan
Alkana memiliki kegunaan yang luas. Alkana rendah (berwujud gas) sebagai bahan bakar gas, dan diperdagangkan dalam kemasan berwujud cair. Gas alam cair (LNG; liquefied natural gas) berasal dari gas bumi (gas alam) dengan kandungan utama alkana C1 50-99%. Sedangkan Elpiji (LPG, liquefied petroleum gas) merupakan campuran dari
C3 dan C4; sebagai hasil pemrosesan gas alam dan minyak bumi. Alkana cair seperti
avtur, bensin, solar, dan minyak tanah digunakan sebagai bahan bakar dan pelarut. Sementara alkana tinggi seperti minyak pelumas, vaselin dan parafin digunakan untuk pelumas, kosmetik, lilin, dll.
d.
Struktur Alkana
Senyawa alkana paling sederhana adalah alkana dengan atom C1, yakni metana, CH4. CH4
memiliki bentuk molekul dan struktur ikatan seperti ditunjukkan pada Gbr 11.4.
Untuk memperoleh pemahaman lebih jauh tentang alkana, maka pembahasan struktur ikatan pada alkana menjadi persyaratan penting karena struktur ikatan dapat mencirikan struktur molekulnya (yakni bagaimana kedudukan atau sebaran atomnya membentuk molekul senyawa yang bersangkutan).
Sifat khas atom C adalah dapat membentuk ikatan dengan atom C lain; atau antar atom C dapat membentuk rantai C. Dengan demikian atom C dari CH4 dapat berikatan dengan
gugus C lain (misalnya gugus metil, -CH3); caranya adalah melalui penggantian salah satu
gugus –H-nya pada molekul CH4 tersebut oleh sebuah gugus metil, CH3.
Senyawa alkana beratom C2 dapat dibentuk melalui penggantian salah satu gugus H pada CH4 oleh gugus metil, CH3, dengan membentuk H3C–CH3.
Selanjutnya terhadap salah satu gugus H pada C2H6 juga dapat digantikan oleh gugus CH3 yang lain membentuk H3C–CH2–CH3; dan seterusnya.
Tampak bahwa penggantian terhadap gugus –H manapun pada molekul H3C–CH3 akan
menghasilkan struktur ikatan yang sama. Namun bila penggantian gugus –H itu diteruskan terhadap molekul C3H8, maka akan menghasilkan 2 macam struktur ikatan berbeda
walaupun rumus molekulnya sama, yakni C4H10.
Dalam Kimia Karbon, struktur ikatan seperti tersebut di atas dapat disederhanakan penulisannya yang dikenal sebagai rumus struktur singkat seperti dicontohkan terhadap molekul-molekul di bawah ini.
e.
Isomeri
Uraian di atas memperlihatkan bahwa mulai dari alkana beratom C4 dengan rumus molekul
C4H10 (butana); molekulnya mempunyai 2 struktur ikatan yang berbeda. Walaupun rumus
molekul sama, tetapi bila struktur ikatannya berbeda, maka keduanya akan memiliki sifat yang berbeda, baik sifat fisis maupun sifat kimianya.
Rumus Molekul: C4H10 H3CCH2CH2CH3 H3CCHCH3 CH3 Rumus Molekul: C3H8 H3CCH2CH2H H3CCHCH3 H digantikan oleh:–CH3 digantikan oleh:–CH3 H3CCH2CH2CH3 H3CCHCH3
Rumus Molekul : C4H10 Rumus Molekul : C4H10
Titik didih : - 0,5 0C Titik didih : -12 0C CH3
HCH H H
CH4
metana gugus metil CH3 H gugus H HC H H H3CH
metana CHgugus metil 3 HC H H H CH H H H3CCH3 ; etana Hasil penggantian gugus –H pada CH4 oleh gugus metil
HC H H CH H H
152 “Peristiwa yang terjadi dimana dua senyawa atau lebih memiliki rumus molekul sama tetapi memiliki struktur ikatan beda” disebut isomeri.
(Untuk senyawa-senyawanya, dapat dikatakan bahwa senyawa yang satu merupakan isomer dari senyawa lainnya.)
Isomeri pada senyawa alkana beratom C5; dengan cara mengganti gugus –H
sedemikian sehingga diperoleh struktur ikatan yang satu sama lain berbeda namun masih beratom C5. Seberapa banyak struktur yang mungkin dapat diperoleh, cara berikut ini dapat
membantu untuk menetapkan dengan cepat isomeri pada senyawa alkana dengan C5, dan
juga pada isomeri lainnya.
Caranya:
(1) Susunlah rantai C lurus sesuai dengan jumlah atom C menurut rumus molekulnya. (2) Sebarkan atom C sambil mempertahankan jumlahnya sampai membentuk rantai atom C
yang berbeda (pola rantai C). Baru kemudian pola rantai disempurnakan dengan struktur ikatan senyawanya.
Perhatikan penerapan terhadap alkana rantai C5 (rumus molekul C5H12).
(a)Rumus molekul C5H12 dengan rantai C lurus: C–C–C–C–C
(b)Sebarkan atom C sehingga membentuk pola rantai C yang berbeda seperti berikut.
Rumus Molekul: C5H10
Rumus Struktur: CH3CH2CH2CH2CH3 CH3CH2CH(CH3)2 C(CH3)4
Titik Didih: 36 0C 27 0C 9,5 0C
Semakin bertambah jumlah atom C pada rumus molekul suatu alkana, semakin tinggi jumlah isomernya. Jumlah Atom C C4 C5 C6 C7 C8 C9 C10 Rumus Molekul C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 Jumlah Isomer 2 3 5 9 18 35 75 Struktur ikatan: H3C–CH2–CH2–CH2–CH3 H3C–CH–CH2–CH3 H3C–C–CH3 CH3 CH3 CH3 Pola rantai C: C–C–C–C–C C–C–C–C C–C–C C C C
Tampak bahwa alkana berantai atom C5 dengan rumus molekul C5H10 memiliki 3 macam struktur ikatan beda atau 3 isomer.
CATATAN:
Pada senyawa karbon, atom C yang membentuk rantai dapat dibedakan sebagai:
a. Atom C-primer, yakni atom C yang mengikat langsung hanya 1 atom C.
(Contoh: C1; C7; C8; C9; C10; C11; dan C13.)
b. Atom C-sekunder, yakni atom C yang mengikat langsung 2 atom C. (Contoh: C6; dan C12.) c. Atom C-tersier, yakni atom C yang mengikat langsung 3 atom C. (Contoh: C2; C4; C5.) d. Atom C-kuarterner, yakni atom C yang mengikat langsung 4 atom C. (Contoh: C3.)
C1 – C2 – C3 – C4 – C5 – C6 – C7 C11
C8 C9 C10
f.
Tata Nama Alkana
Terjadinya isomeri (rumus molekul sama, tetapi struktur ikatan beda) mendorong perlunya sistem penamaan atau tata nama terhadap senyawa karbon (termasuk senyawa alkana). Tata nama alkana akan menjadi dasar penting untuk penamaan senyawa karbon lainnya
.
1. Akhiran untuk senyawa alkana adalah -ana dengan awalan yang digunakan adalah awalan kimia. (Kecuali untuk alkana dengan jumlah atom C1; C2; C3; dan C4.)
Jumlah Atom Rumus Molekul Nama Jumlah Atom Rumus Molekul Nama
C1 CH4 metana C6 C6H14 heksana
C2 C2H6 etana C7 C7H16 heptana
C3 C3H8 propana C8 C8H18 oktana
C4 C4H10 butana C10 C10H22 dekana
C5 C5H12 pentana dst. dst. dst.
2. Jika rantai tak bercabang (lurus), nama senyawa alkana diberi awalan n-. (Kecuali senyawa alkana dengan jumlah atom C1; C2; dan C3.)
Contoh:
CH3CH2CH3 propana
CH3CH2CH2CH3 n-butana Baca: normal butana
CH3CH2CH2CH2CH3 n-pentana ; dst.
3. Jika bercabang, lakukan langkah penamaan berikut. a. Pilih rantai terpanjang sebagai rantai induk.
b. Beri nomor urut pada rantai induk (diawali dari at. C yang paling dekat dengan cabang).
c. Daftarkan semua cabang (gugus) terikat, dan kemudian sisipkan menurut alfabet pada nama rantai induk.
[Dalam contoh ini dimisalkan ada gugus-gugus terikat: –CH3 (metil); dan –CH2–CH3 (etil).]
TATA NAMA ALKANA (IUPAC)
nama rantai induk: heptana
C C C C C C C C C
C C
nama rantai induk: heptana
7C 6C 5C 4C 3C 2C 1
C C C
C C
nama rantai: etil–metil–heptana 7C 6C 5C 4C 3C 2C 1 C C C C C etil metil
154 d. Jika gugus terikat itu sama dan lebih dari 1, sisipkan awalan kimia yang sesuai di
depan nama gugus itu.
(Dalam contoh ini ada 2 gugusmetil, dan ada 1 gugusetil.)
e. Tempatkan nomor dari atom rantai induk di depan nama gugus terikat.
Jadi nama senyawa alkana dengan struktur ikatan seperti:
4. Bila 2 gugus atau lebih terikat pada atom rantai induk yang ekivalen (sama kedudukan/jaraknya), maka nomor terendah diberikan pada atom C rantai induk yang mengikat gugus dengan prioritas menurut urutan alfabet.
Contoh senyawa alkana dengan struktur ikatan:
Nama senyawa alkana ini adalah 3-etil-6-metiloktana
Selain sistem penamaan IUPAC, beberapa alkana juga memiliki nama tertentu. Beberapa contoh berikut dapat memperjelas hal ini.
Tabel 11.5. Beberapa Gugus Alkil
Jumlah At. C C1 C2 C3 C4 C5 C6 Cn
Rumus CH3 C2H5 C3H7 C4H9 C5H11 C6H13 CnH2n+1
Nama metil etil propil n-butil n-pentil (amil)
n-heksil ALKIL
Catatan: Beberapa nama lain dari gugus alkil (bergantung pada struktur isomernya):
nama rantai: etil–dimetil–heptana
nama rantai: 5–etil–2,5–dimetil–heptana
H3C H3C CH isopropil H3C H3C CHCH2 isobutil H3C H3C CHCH2CH2 isopentil adalah: 5–etil–2,5–dimetil–heptana. H3C–CH2–C–CH2–CH2–CH–CH3 CH2–CH3 CH3 CH3 CH3CH2CHCH2CH2CHCH2CH3 CH3 CH2–CH3 5 4 3 2 1 8 7 6 1
metil pada at. C no. 6
etil pada at. C no. 3
Rumus Molekul Struktur Ikatan dan namanya
C4H10
C5H12
CH3CH2CH2CH3
n-butana CH3 2-metilpropana; isobutanaCHCH3 CH3 CH3CH2CH2CH2CH3 n-pentana CH3CHCH2CH3 2-metilbutana; isopentana CH3 CH3CCH3 2,2-dimetilpropana; neopentana CH3 CH3
Selesaikan dulu latihan 11.1 berikut, baru kemudian melanjutkan ke subbab selanjutnya.
Latihan 11.1
1. Tulislah rumus molekul dan rumus struktur ikatan dari n-heksana.
2. Tuliskan sebuah rumus struktur ikatan yang merupakan isomer dari n-heksana.
3. Tuliskan struktur ikatan 2,2,3-trimetil-pentana, dan kemudian tuliskan rumus molekulnya.
4. Tunjukkan ada berapa buah atom C yang tergolong at. C primer, at. C sekunder, dan at. C tersier pada 2,2,3-trimetil-pentana.
5. Tulis kembali struktur ikatan trimetil-pentana, kemudian gantilah gugus 3-metil pada 2,2,3-trimetil-pentana oleh sebuah gugus –etil. Selanjutnya namailah senyawa yang diperoleh. 6. Namailah senyawa alkana dengan rumus struktur ikatan berikut.
7. Apakah kedua rumus struktur ikatan berikut merupakan isomer satu dengan lainnya.
2.
Alkena
Alkena tergolong hidrokarbon tak-jenuh karena memiliki sebuah ikatan rangkap-2 (ikatan C=C). Adanya ikatan rangkap ini, alkena juga disebut olefin; karena alkena melalui ikatan rangkapnya dapat bereaksi dengan air brom (Br2 dalam air) dengan membentuk suatu
zat yang berwujud seperti minyak. (Olefin berasal dari bahasa Latin: oleum berarti minyak, dan ficare berarti membuat.)
a.
Rumus Umum Dan Struktur Alkena
Senyawa ini juga membentuk deret homolog dengan rumus umum CnH2n.
Sama seperti pada alkana, maka alkena dengan rumus molekul C2H4 dan C3H6
masing-masing hanya memiliki sebuah struktur ikatan. Mulai dari alkena beratom C4 dengan rumus
molekul C4H8 yang memiliki lebih dari 1 struktur ikatan (dan terjadi isomeri).
H3C–CH–CH2–C–CH3 CH3 CH3 CH3 H3C–CH–CH2–C–CH3 CH3 CH3 CH3 CH–CH–CH2–CH2–CH3 CH3 H3C H3C R.M. Struktur Singkat: C2H4 H2C=CH2 C3H6 H2C=CH–CH3 C4H8 [1] [2] [3]
Keterangan: Alkena dengan rumus molekul C4H8 memiliki 3 struktur molekul berbeda (satu sama lain saling berisomer).
H2C=CH–CH2–CH3 H3C–CH=CH–CH3 H2C=C–CH3
CH3
Senyawa alkena yang paling sederhana (dan merupakan homolog pertama) mempunyai rumus molekul C2H4 dengan struktur ikatan seperti berikut: C
2H4 ; etena HC = CH
H H
156
b. Tata Nama Alkena
Sistem penamaan senyawa alkena tidak begitu berbeda dengan alkana hanya dalam
beberapa hal seperti:
(1) Akhiran –ana pada alkana diganti dengan dengan –ena untuk alkena
.
n Rumus Nama n Rumus Nama
2 C2H4 etena (etilena) 6 C6H12 heksena
3 C3H6 propena (propilena) 7 C7H14 heptena
4 C4H8 butena (butilena) 8 C8H16 oktena
5 C5H10 pentena n CnH2n ALKENA
Keterangan: nama dalam tanda kurung merupakan nama lainnya.
(2) Isomeri juga terjadi pada senyawa alkena, dan mulai ditemukan pada alkena dengan jumlah atom C4. Penomoran atom C pada rantai induk (rantai terpanjang) diawali dari
atom C yang paling dekat dengan ikatan rangkap
-2.
c. Sifat Alkena
Sifat Fisis
Tidak begitu berbeda jauh dengan alkana, beberapa sifat fisis senyawa alkena diikhti-sarkan menurut Tabel 11.6.
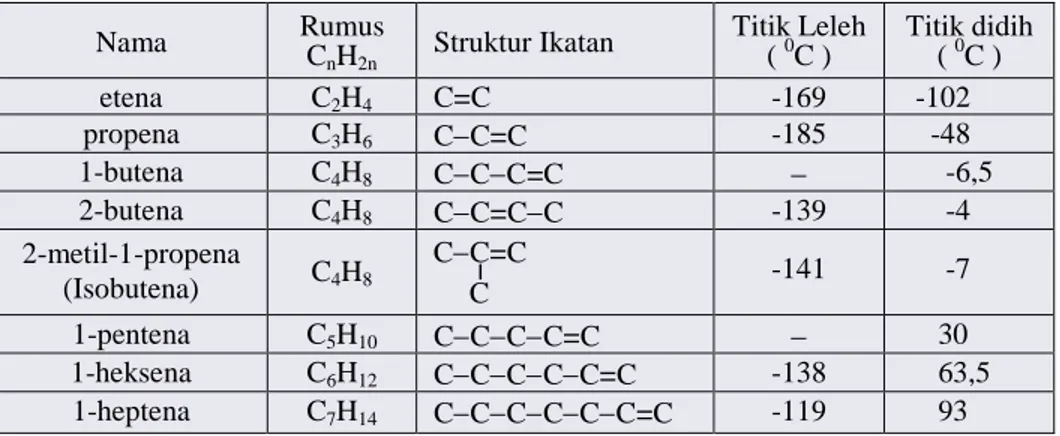
Tabel 11.6. Beberapa Sifat Fisis Senyawa Alkena. Nama Rumus C nH2n Struktur Ikatan Titik Leleh ( 0C ) Titik didih ( 0C ) etena C2H4 C=C -169 -102 propena C3H6 CC=C -185 -48 1-butena C4H8 CCC=C -6,5 2-butena C4H8 CC=CC -139 -4 2-metil-1-propena (Isobutena) C4H8 -141 -7 1-pentena C5H10 CCCC=C 30 1-heksena C6H12 CCCCC=C -138 63,5 1-heptena C7H14 CCCCCC=C -119 93 Sifat Kimia
Walaupun sifat fisis dari alkena dan alkana relatif tidak begitu berbeda, namun sifat kimianya berbeda dimana senyawa alkena lebih reaktif dari alkana. Adanya ikatan rangkap menyebabkan alkena dapat bereaksi dengan zat lain misalnya dengan air klor atau air brom.
CC=C C + Br2 H C C H H Br H Br C = C H H H H CH3CH2CH=CH2 1-butena CH3C=CH2
1-butena (atau isobutene)
3 2 1
CH3
CH3CH=CHCH3
2-butena
Atau: H2C=CH2 + Br2 H2(Br)C–C(Br)H2
Alkena (tergolong hidrokarbon tak-jenuh) dapat dibedakan dari alkana (hidrokarbon jenuh) berdasarkan reaksi di atas yakni dengan cara mereaksikannya dengan air brom. Adanya ikatan rangkap pada alkena menyebabkan hilangnya warna coklat dari air brom.
d. Pembuatan Dan Kegunaan Alkena
Pembuatan
Etena adalah gas yang tidak berwarna yang terjadi pada penyulingan kering batubara; dan dipeoleh secara besar-besaran melalui pengolahan gas alam dan dari penyulingan minyak bumi. Etena dan senyawa alkena lainnya juga dapat dibuat melalui beberapa reaksi kimia, di antaranya melalui reaksi dehidrasi alcohol (*).
*reaksi dehidrasi = reaksi penarikan molekul H2O dari sebuah molekul (de = penarikan; hidrat = air).
H2SO4 pekat berfungsi menarik molekul air.
Kegunaan
Beberapa senyawa alkena menjadi bahan untuk pembuatan beberapa polimer (misalnya plastik, paralon, karet, dll.).
Latihan 11.2.
a. Tuliskan nama dan rumus molekul dari senyawa alkena di samping ini.
b. Tuliskan rumus molekul dan struktur molekul (struktur ikatan) dari 3,4-dimetil-1-pentena. c. Tuliskan sebuah isomer dari 3,4-dimetil-pentena.
3.
Alkuna
Alkuna adalah kelompok hidrokarbon alifatik yang dicirikan oleh adanya sebuah ikatan rangkap-3 pada rantai atom C-nya.
a.
Rumus Umum Dan Struktur Alkena
Alkuna paling sederhana adalah HCCH dengan rumus molekul C2H2 (etuna; sering disebut
asetilen). Senyawa alkuna juga membentuk deret homolog dengan rumus umum CnH2n–2.
Deret homolog alkuna: C2H2, C3H4, C4H6, …, CnH2n–2.
Senyawa alkuna dengan beratom C4 dan yang lebih tinggi memiliki lebih dari 1 struktur
molekul (terjadi isomeri). n-C6H14 700-9000C (hasil penyulingan minyak bumi) CH4 + H2C=CH2 + H2C=CH–CH3 + lain-lain (15%)
metana (40%) etena propena (20%) (25%) H3C–CH2–OH H2C=CH2 + H2O etuna alkohol (etanol) H2SO4 1700C Rumus Molekul: C2H2 C3H4 C4H6 C4H6 Struktur Molekul: HCCH HCC– CH3 HCC–CH2–CH3 CH3–CC–CH3 CH3–CH=CH–CH–CH3 CH3
158
b.
Tata Nama Alkuna
Sistem penamaan pada dasarnya sama dengan penamaan pada senyawa alkena. Beberapa di antaranya seperti dicontohkan berikut ini.
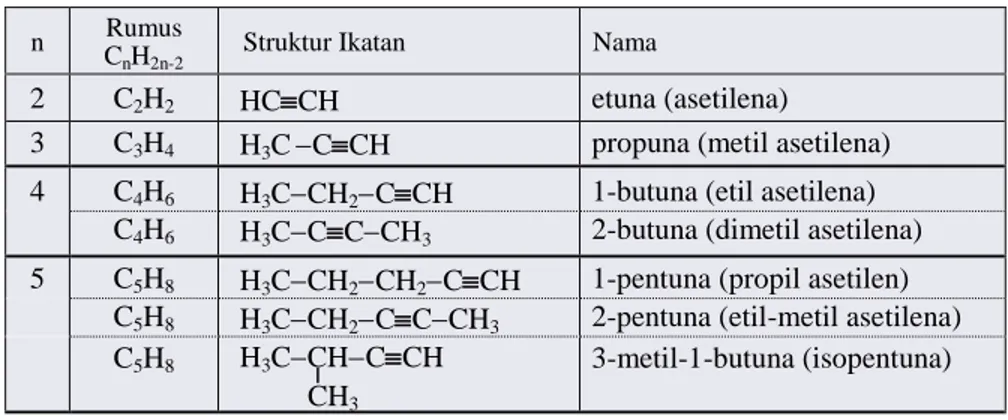
Tabel 11.7 Rumus Molekul, Nama, Dan Struktur Beberapa Senyawa Alkuna
n Rumus
CnH2n-2 Struktur Ikatan Nama
2 C2H2 HCCH etuna (asetilena)
3 C3H4 H3CCCH propuna (metil asetilena)
4 C4H6 H3CCH2CCH 1-butuna (etil asetilena)
C4H6 H3CCCCH3 2-butuna (dimetil asetilena)
5 C5H8 H3CCH2CH2CCH 1-pentuna (propil asetilen)
C5H8 H3CCH2CCCH3 2-pentuna (etil-metil asetilena)
C5H8 3-metil-1-butuna (isopentuna)
c.
Sifat Alkuna
Sifat fisis alkuna mirip dengan alkena yang sederajat. Alkuna beratom C rendah berwujud gas, dan titik didihnya hanya sedikit lebih tinggi dari alkena sederajat (Lihat Tabel 11.8).
Tabel 11.8. Sifat Fisis beberapa Alkuna. Senyawa Alkuna Titik Didih
(0C) Titik Leleh (0C) etuna (asetilen) –84,0 –81,5 propuna –23,2 –102,7 1-butuna 8,1 –122,5 1-pentuna 39,3 –90,0 1-heksuna 71 –132 2-butuna 27 –32,3 2-pentuna 55,5 –101 2-heksuna 84 –88 3-heksuna 81 –101
Alkuna dapat bereaksi dengan pereaksi tertentu. Seperti alkena, alkuna juga dapat menghilangkan warna air brom. Etuna adalah gas yang bila dibakar (dinyalakan) akan memberikan nyala api terang sekali (untuk penerang); dan bila dibakar sempurna bersama oksigen (berlebih) dapat memberikan kalor yang amat tinggi (mencapai 25000C). Karena itu etuna dipergunakan untuk mengelas (menyambung/memotong) berbagai logam dan baja.
d.
Pembuatan Dan Kegunaan Alkuna
Etuna (atau asetilen, C2H2) dapat dibuat dengan mereaksikan karbid (CaC2) dengan air; gas
etuna (asetilen) yang keluar sebenarnya tidak berbau dan tidak berwarna; bau yang keluar dari karbit disebabkan oleh pencemaran berupa gas H2S dan fosfin (PH3) karena karbit
mengandung C3P2 dan CaS.
CaC2(s) + 2 H2O(l) C2H2(g) + Ca(OH)2(s)
karbid etuna H3CCHCCH
Secara industrial, etuna dibuat berdasar reaksi berikut.
Etuna memiliki kegunaan yang luas seperti sebagai bahan baku untuk industri dan untuk mengelas (menyambung/memotong besi dan baja. Seperti etena, etuna (dan juga beberapa alkuna lainnya) digunakan untuk pembuatan beberapa polimer (seperti plastik, paralon, dsb.). Etuna merupakan bahan penting untuk pembuatan berbagai senyawa organik seperti asam asetat (cuka), aseton, dan bahan sintetis.
Latihan 11.3.
a. Tuliskan struktur molekul dari C5H8. Ada berapa isomer yang terbentuk, dan namailah
masing-masing isomernya.
b. Tuliskan pembakaran sempurna gas asetilen.
C.
MINYAK BUMI
Minyak bumi (petroleum; petra = batu, oleum = minyak) merupakan bahan tambang kental berwarna hitam sampai coklat kehijauan; merupakan campuran kompleks dari senyawa hidrokarbon dan senyawa organik lain dengan sejumlah kecil senyawa belerang dan senyawa nitrogen.
Indonesia termasuk negara produsen minyak dunia. Diduga daerah-daerah di Indonesia yang banyak mengandung cadangan minyak antara lain di sepanjang P. Sumatera membujur dari Utara ke Selatan melalui dataran rendah bagian Timur, bagian Utara P. Jawa dan P. Madura, di bagian Tenggara dan Timur P. Kalimantan, dan di kepala burung P. Irian.
Minyak merupakan sumber devisa penting bagi negara di samping menjadi sumber energi dan sumber bahan baku industri petrokimia dalam negeri.
1. Pembentukan Minyak Bumi
Minyak bumi (dan juga gas alam) terbentuk dari penguraian tumbuhan dan hewan laut melalui proses fisis dan proses kimia selama jutaan tahun. Lapisan dan permukaan bumi telah mengalami beberapa perubahan besar sebagai peristiwa alam. Pergeseran lapisan bumi mengubah letak tumbuhan dan hewan itu menuju celah atau pori-pori lapisan batu di perut bumi yang bersuhu dan bertekanan tinggi.
Proses kimia yang lama menyebabkan tumbuhan dan hewan itu terurai dengan membentuk gas (sebagai gas alam) dan cairan kental (sebagai minyak bumi).
Proses pembentukan minyak bumi tak mungkin dapat diulang; oleh karena itu minyak bumi (juga gas alam) digolongkan sebagai sumber daya alam yang tak dapat diperbaharui. Minyak bumi ini akan habis pada suatu saat; manusia yang menggantungkan aktivitas kehidupannya pada bahan alam ini harus melakukan penghematan dan mencari sumber penggantinya.
2. Komponen Minyak Bumi
Susunan atau komposisi minyak bumi di berbagai cadangan yang ditemukan agak berbeda menurut asalnya. Misalnya minyak dari Amerika terutama terdiri dari alkana, sementara minyak dari
Indonesia selain alkana juga mengandung hidrokarbon siklik (sebagai siklopentana dan sikloheksana).
2 CH4 1500 C2H2 + 2 H2 0C C C C H2 H2 H2 siklopentana C H2 C H2 sikloheksana C H2 C H2 C H2 C H2 C H2 C H2
160 Minyak bumi juga mengandung sedikit senyawa belerang ( 1%) dan senyawa nitrogen (kurang dari 0,1%). Kedua senyawa ini tidak dikehendaki dan harus disingkirkan karena akan menurunkan kualitas hasil dan menyebabkan polusi. Minyak Indonesia tergolong berkualitas tinggi karena kurang mengandung belerang.
3.
Pengolahan Minyak Bumi
Komponen penyusun minyak bumi dapat dipisahkan melalui distilasi bertingkat
(fraksinasi) berdasarkan perbedaan titik didihnya menjadi beberapa campuran yang lebih
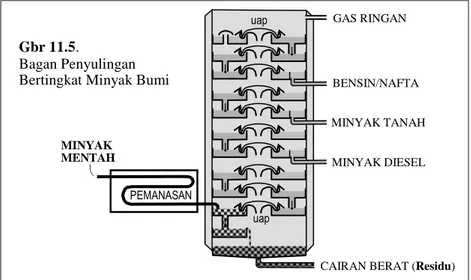
sederhana. Campuran-campuran sederhana inilah yang biasanya disebut fraksi minyak bumi. Secara garis besarnya, teknik penyulingan minyak bumi ditunjukkan pada Gbr 11.5.
Tabel 11.9 Fraksi-fraksi Minyak Bumi FRAKSI Jumlah Atom C Rentang t.d. ( 0 C ) Kegunaan
1. GAS RINGAN C1 – C4 20
a. METANA & ETANA C1 – C2 ( gas ) bahan bakar (LNG) b. OLEFIN (ALKENA) C2 – C4 20 alkohol ; karet ; plastik c. PROPANA & Butana C3 – C4 20 bahan bakar (ELPIJI)
2. GASOLIN C5 – C11 20–200
a. PETROLEUM ETER C5 – C6 30–60 bahan bakar ; pelarut
b. BENSIN C6 – C8 60–100 bahan bakar motor ; pelarut
c. NAFTA C8 – C11 100–200 pelarut
3. KEROSIN (minyak tanah) C12 – C16 200–300 bahan bakar ; pelarut 4. MINYAK DIESEL (SOLAR) C15 – C18 280–380 bahan bakar mesin berat 5. MINYAK PELUMAS C16 – C20 300–400 pelumas mesin
6. VASELIN C18 – C22 380 pelumas ; farmasi ; kedokteran
7. LILIN PARAFIN C20 – C30 t.l. 50–60 lilin penerang ; pelapis kedap air. 8. KRISTAL LILIN C30 – C50 t.l. 80–90 plastik ; dll.
9. ASPAL C50 – cat ; aspal jalan ; dll.
10. KOKAS C50 – metalurgi ; elektroda ; dll
BENSIN/NAFTA MINYAK DIESEL MINYAK TANAH MINYAK MENTAH Gbr 11.5. Bagan Penyulingan
Bertingkat Minyak Bumi
uap uap PEMANASAN GAS RINGAN
Dari Tabel 11.9, jelaslah mengapa minyak bumi merupakan bahan alam amat penting. Hasil pengolahannya memiliki kegunaan amat luas mulai dari bahan bakar, pelarut, pelumas, vaselin, lilin, aspal jalan, sampai pada bahan baku bagi berbagai industri petrokimia (pembuatan zat kimia, detergen, pupuk, plastik, karet, kosmetik, dll.).
4.
Bensin
Bensin merupakan bahan bakar yang digunakan secara meluas, namun bensin yang diperoleh dari penyulingan bertingkat tidak begitu banyak. Untuk memenuhi kebutuhan akan bensin, salah satu cara yang dilakukan adalah memproduksinya melalui proses pemecahan yang disebut cracking, yaitu proses pemecahan hidrokarbon tinggi pada suhu dan tekanan tinggi dengan bantuan katalis (pemercepat reaksi) menjadi alkana dan alkena rendah. Bensin yang diperoleh dengan cara ini kualitasnya lebih baik dari hasil penyulingan bertingkat.
Kualitas bensin ditentukan oleh mudah-tidaknya mengalami ketukan (“knocking”); bensin yang baik adalah bensin yang sukar mengalami knocking. Knocking berkurang dengan bertambahnya cabang dan bertambahnya rantai. Oleh karena itu nilai bensin ditetapkan berdasarkan pada suatu nilai yang disebut nilai oktan. Nilai ini mengacu senyawa isooktana (2,2,4-trimetil-pentana) dengan nilai oktan 100 sementara senyawa n-heptana diberi nilai 0. Suatu bensin yang mengandung campuran 85% isooktana dan 15% heptana; dikatakan bensin itu bernilai oktan 85. Makin tinggi nilai oktannya, makin baik bensin tersebut; artinya knocking sukar terjadi dan bensinnya bersifat hemat.
Knocking dapat dikurangi dengan menambahkan TEL {tetraethyl-lead; tetraetil-timbal, Pb(C2H5)4}. Bensin dengan nilai oktan 80 dan telah diberi TEL dikenal
sebagai bensin premium, sedangkan bensin super memiliki nilai oktan 95. Penggunaan TEL dapat menimbulkan masalah lingkungan. Debu Pb yang bertebaran di udara dari gas buang kendaraan sangat membahayakan kesehatan karena Pb merupakan racun berbahaya yang dapat menimbulkan anemia.
Kini TEL sudah mulai dikurangi penggunaannya dan sebagai pengganti adalah
MTBE (metil-tersierbutil-eter).
Penggunaan bensin sebagai bahan bakar kendaraan dapat memberikan dampak pada lingkungan kehidupan. Bensin yang mengandung senyawa belerang akan menghasilkan gas buang yang mengandung gas oksida belerang (sebagai SO2 dan SO3) ; gas ini selain mengotori
udara (beracun) juga dapat menyebabkan hujan asam yang merugikan karena gas tersebut melarut dalam air hujan membentuk asam yang bersifat korosif. Pembakaran tidak sempurna terhadap bensin (pada mesin kendaraan tua) akan menyebabkan terbentuknya gas CO di samping gas CO2. Kedua gas ini akan masuk ke udara dan mengubah komposisi udara; udara
sekitar tidak lagi bersih tetapi telah tercemar. Gas CO2 juga dapat menyebabkan hujan asam.
Oleh karena itu bensin masih dianggap sebagai sumber utama pencemaran udara.
Gas CO bersifat racun; dan udara yang tercemar oleh gas ini sangat membahayakan kesehatan. CO memiliki daya ikat terhadap hemoglobin darah hampir 200 lebih kuat dibandingkan dengan O2; darah yang seharusnya berfungsi untuk mengangkut O2 ke seluruh
tubuh menjadi hilang fungsinya karena teracuni oleh gas CO yang terhisap. Oleh karena itu menghisap udara yang tercemar berat gas CO dapat membuat manusia lesu, lemas, kurang bergairah, dan mudah mengantuk akibat tidak berfungsinya darah sebagai pengangkut oksigen. Berada dalam ruang dengan udara tercemar CO, seseorang akan cepat mengantuk kemudian
162 tertidur, dan Bahkan dalam waktu tertentu dapat menyebabkan kematian. Kadar gas CO di udara yang diperbolehkan hanya sampai 0,01% atau 100 ppm. Udara di kota-kota yang padat lalu lintas kendaraan, dan lokasi pemberhentian kendaraan (stasiun dan lampu lalu lintas) diperkirakan mengandung CO lebih dari 40 ppm.
Kekhasan atom karbon adalah dapat membentuk berbagai tipe ikatan kovalen, dan dapat membentuk ikatan antar atom-atomnya baik lurus, bercabang maupun melingkar.
Hidrokarbon merupakan kelompok senyawa organik yang tersusun hanya dari C dan H. Hidrokarbon dapat dibedakan berdasarkan sifat ikatan dan sifat rantai dari atom-atom C. Alkana merupakan hidrokarbon alifatik jenuh dengan rumus umum CnH2n+2.
Alkena merupakan hidrokarbon alifatik tak-jenuh yang memiliki sebuah ikatan CC (ikatan kovalen rangkap-2), dan mempunyai rumus umum, CnH2n.
Alkuna merupakan hidrokarbon alifatik tak-jenuh yang memiliki sebuah ikatan CC (ikatan kovalenrangkap-3), dan mempunyai rumus umum, CnH2n-2.
Isomeri adalah peristiwa yang dijumpai dalam senyawa organik yang mempunyai rumus molekul sama tetapi struktur ikatannya berbeda.
Minyak bumi adalah bahan tambang berupa cairan kental berwarna hitam sampai coklat-kehijauan dimana hidrokarbon sebagai komponen utamanya; digolongkan sebagai sumber daya alam yang tak dapat diperbaharui.
Bensin (gasolin) adalah campuran isomer alkana dengan C7C8 yang diperoleh dari distilasi
minyak bumi dan proses “cracking”; digunakan sebagai bahan bakar penting dan sebagai pelarut. Bahan bakar bensin merupakan sumber utama pencemaran udara.