i
SKRIPSI
IDENTIFIKASI FRAKSI AKTIF ANTIVIRUS
HEPATITIS C DARI EKSTRAK ETANOL 80%
HERBA
Scoparia dulcis
Linn.
LAILA NURHIDAYATUS SHOLIKIN
FAKULTAS FARMASI UNIVERSITAS AIRLANGGA
DEPARTEMEN FARMAKOGNOSI DAN FITOKIMIA
i
SKRIPSI
IDENTIFIKASI FRAKSI AKTIF ANTIVIRUS
HEPATITIS C DARI EKSTRAK ETANOL 80%
HERBA
Scoparia dulcis
Linn.
LAILA NURHIDAYATUS SHOLIKIN
051211131167
FAKULTAS FARMASI UNIVERSITAS AIRLANGGA
DEPARTEMEN FARMAKOGNOSI DAN FITOKIMIA
v
KATA PENGANTAR
Puji syukur kehadirat Tuhan atas segala berkat, rakhmat, karunia, serta hikmat-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “IDENTIFIKASI FRAKSI AKTIF ANTIVIRUS HEPATITIS C Dari EKSTRAK ETANOL 80% HERBA Scoparia dulcis Linn”.
Penelitian dilakukan di Laboratorium SATREPS, ITD kampus C Universitas Airlangga, untuk memenuhi syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Airlangga.
Penulis menyadari bahwa selama pengerjaan skripsi ini terdapat banyak hambatan dan kesulitan. Namun berkat bantuan Tuhan Yang Maha Esa serta bantuan dan dukungan moral dari berbagai pihak maka skripsi ini dapat terselesaikan dengan baik. Pada kesempatan ini perkenankanlah penulis menyampaikan penghargaan dan rasa terima kasih yang sebesar-besarnya kepada :
1. Dr. Umi Atiyah, M.S., Apt., selaku Dekan Fakultas Farmasi Universitas Airlangga yang telah memberikan kesempatan dan fasilitas dalam mengikuti program S1 pendidikan apoteker.
2. Dr. Achmad Fuad Hafid, MS. selaku dosen pembimbing utama yang selalu memberikan motivasi dan masukan dalam mendampingi saya dengan penuh kesabaran di Fakultas Farmasi.
vi
4. Dr.rer.nat.Mulja Hadi Santosa dan Neny Purwitasari, S.Farm., Msc. selaku dosen penguji skripsi yang telah memberikan saran dan masukan untuk perbaikan skripsi.
5. Dr. Tristiana Erawati Munandar, M.Si., Apt. Selaku dosen wali yang senantiasa memberi motivasi selama menempuh pendidikan di Fakultas Farmasi Universitas Airlangga.
6. Para dosen Fakultas Farmasi Universitas Airlangga yang telah mendidik dan membimbing selama menjalankan program pendidikan S-1 Farmasi.
7. Para staff yang berada di Departemen Farmakognosi dan Fitokimia serta Laboratorium SATREPS, Lydia Tumewu, Myrna Adianti, Adita Permanasari, Hikayatul Hilmi, Mas Burhan, dan Pak Parto selama proses pengerjaan skripsi telah banyak membantu, memberikan bimbingan dan dukungan.
8. Bapak Sholikin dan Ibu Susiah selaku kedua orang tua saya yang telah memberikan dukungan, doa, bimbingan dan kasih sayangnya sehingga skripsi ini dapat diselesaikan dengan baik.
9. Ardi Nugraha yang selalu ada memberikan waktu dan semangatnya di saat penulis merasa jenuh hingga skripsi ini dapat terselesaikan dengan baik.
10. Teman-teman proyek anti HCV dan Malaria, Dery, Eka, dan Yaya yang selalu memberikan semangat dan saling menguatkan sehingga skripsi ini dapat selesai tepat pada waktunya.
vii
12. Semua pihak dan teman-teman lain yang tidak dapat saya sebutkan satu persatu yang telah membantu baik selama proses perkuliahan, dalam proses penelitian maupun dalam penyusunan skripsi.
Penulis menyadari bahwa masih banyak kekurangan dalam tulisan ini. Karenanya penulis senantiasa mengharapkan masukan baik berupa kritik maupun saran dari semua pihak.Semoga karya tulis ilmiah ini dapat bermanfaat dan memberikan tambahan informasi ilmu pengetahuan maupun untuk penelitian lanjutan penemuan senyawa aktif dari tanaman yang dapat digunakan sebagai antivirus hepatitis C.
Surabaya, September 2016
viii RINGKASAN
IDENTIFIKASI FRAKSI AKTIF ANTIVIRUS HEPATITIS C DARI EKSTRAK ETANOL 80% HERBA
Scoparia dulcis Linn.
Laila Nurhidayatus Sholikin
Penyakit hepatitis merupakan masalah kesehatan di dunia yang dapat menyebabkan kematian jutaan orang di seluruh dunia namun belum ada vaksin yang tersedia untuk HCV. Saat ini terapi kombinasi pegylated interferon (PegIFN-α) dan ribavirin digunakan sebagai terapi standar untuk infeksi HCV kronis. Pengobatan dengan kombinasi interferon standard dan Ribavirin memiliki manfaat yang terbatas karena dapat menimbulkan resistensi selama pengobatan jangka panjang dan membutuhkan biaya yang cukup tinggi. Oleh karena itu perlu dilakukan penelitian-penelitian untuk memperoleh obat-obat hepatitis baru yang potensial. Tanaman merupakan sumber yang menjanjikan sebagai obat hepatitis baru.
Dalam penelitian ini digunakan tanaman Scoparia dulcis yang
berasal dari suku Scrophulariaceae. Tanaman ini secara tradisional digunakan untuk pengobatan masalah lambung. Bagian tanaman yang digunakan adalah akar atau seluruh bagian tanaman. Penelitian pendahuluan
yang pernah dilakukan terhadap ekstrak etanol 80% herba Scoparia dulcis
menunjukkan aktivitas sebagai antivirus hepatitis C yang potensial terhadap virus JFH1a dengan IC50 17,79 µg/ml. Oleh karena itu, dilakukan penelitian
lebih lanjut untuk mengetahui fraksi yang aktif dari ekstrak etanol 80% herba Scoparia dulcis
Tujuan dari penelitian ini adalah untuk mengetahui fraksi yang aktif sebagai antivirus hepatitis C dari ekstrak etanol 80% herba Scoparia dulcis. Pada penelitian ini, dilakukan fraksinasi ekstrak etanol 80% herba Scoparia dulcis dengan metode fraksinasi cair-cair dengan 3 pelarut yakni diklorometana, etil asetat, dan butanol. Dari hasil fraksinasi tersebut diperoleh 4 fraksi yakni fraksi diklorometana, fraksi etil asetat, dan fraksi air yang kemudian dilakukan uji aktivitas antivirus hepatitis C dan uji
toksisitas mengunakan metode MTT-assay Selain itu juga dilakukan
pengamatan profil kromatogram untuk mengetahui senyawa yang berperan terhadap aktivitasnya sebagai antivirus Hepatitis C.
ix
fraksi butanol, dan fraksi air dari ekstrak etanol 80% herba Scoparia dulcis secara berturut-turut adalah 5,32±0,50 µg/ml, >100 µg/ml, >100 µg/ml, dan >100 µg/ml. Hasil yang diperoleh menunjukkan bahwa fraksi diklorometana mempunyai aktivitas sebagai antivirus hepatitis C. Sedangkan fraksi etil asetat, fraksi butanol, dan fraksi air tidak memiliki aktivitas sebagai antivirus hepatitis C karena memiliki nilai IC50 lebih dari
>100 µg/ml.
Untuk uji toksisitas digunakan metode MTT assay dengan 8
konsentrasi uji yakni 800 µg/ml, 400 µg/ml, 200µg/ml, 100 µg/ml, 50 µg/ml, 25 µg/ml, 12,5 µg/ml, dan 6,25 µg/ml. Hasil uji toksisitas diperoleh
50% cytototoxic concentracion (CC50) dari keempat fraksi dari dari ekstrak
etanol 80% herba Scoparia dulcis secara berturut-turut adalah 23,313 µg/ml, >800 µg/ml, >800 µg/ml, dan >800 µg/ml. Hasil yang diperoleh menunjukkan bahwa fraksi diklorometana mempunyai toksisitas yang tinggi terhadap sel dengan nilai CC50 23,313 µg/ml jika dibandingkan
dengan ketiga fraksi lain yang memiliki nilai CC50 lebih dari >800 µg/ml.
Ekstrak etanol 80% dan fraksi diklorometana memiliki nilai SI secara berturu-turut sebesar 7,723 dan 4,382. Nilai ini lebih rendah jika dibandingkan dengan nilai SI dari fraksi etil asetat, fraksi butanol, dan fraksi air yang memiliki nilai SI lebih dari 8.
Pengamatan profil kromatogram menggunakan KLT fase normal dan fase terbalik. Untuk KLT fase normal digunakan fase diam : Kieselgel 60 GF, fase gerak : Kloroform : metanol (9:1) dan Penampak noda: H2SO4
10% dalam metanol. Sedangkan KLT fase terbalik menggunakan fase diam : Kieselgel 60 RP-18 F254, fase gerak : Asetonitril:metanol:air (1:2:2) dan
penampak noda : H2SO4 10% dalam metanol. Berdasarkan hasil
pengamatan profil kromatogram ekstrak etanol 80% dan fraksi diklorometana mempunyai kandungan senyawa golongan klorofil, flavonoid dan terpenoid. Sedangkan fraksi etil asetat dan fraksi butanol mempunyai kandungan senyawa flavonoid. Untuk fraksi air noda yang terlihat tidak begitu jelas.
x ABSTRACT
IDENTIFICATION OF ACTIVE FRACTIONS OF ANTIVIRAL HEPATITIS C FROM EXTRACT ETHANOL 80%
Scopari dulcis Linn HERBS.
Laila Nurhidayatus Sholikin
Scoparia dulcis is a plant that belongs to Scrophulariaceae family. It
used traditionally as remedies for stomach trouble. Previous study showed that ethanol extract 80% of Scoparia dulcis herbs has antiviral activity againts hepatitis C virus JFH1a infected hepatocyte cell Huh7it with IC50
value of 17.79 µg/ml. Further study is conducted on ethanol extract 80% of
Scoparia dulcis herbs by using fractination liquid-liquid method and
dichloromethane, ethyl acetate, and butanol as the solvent. The result showed that the dichloromethane fraction of ethanol extract 80% of
Scoparia dulcis herbs has IC50 value 5.32 ± 0.50 µg/ml. Ethyl acetate,
butanol and water fraction of ethanol extract 80% of Scoparia dulcis herbs has IC50 value more than 100µg/ml. Dichloromethane fraction of 80%
ethanol extract of Scoparia dulcis showed the highest activity (IC50 5.32 ±
0.50 µg/ml) compare to ethyl acetate, butanol, and water fractions (IC50
more than 100 µg/ml). Dichloromethane fraction of 80% ethanol extract of
Scoparia dulcis has the highest toxicity with CC50 value 23,31 µg/ml and SI
4,38. Ethyl acetate, butanol fraction, and water fraction of ethanol extract 80% of Scoparia dulcis herbs has CC50 value more than 800µg/ml and SI
more than 8. In conclusion, dichloromethane fraction of 80% ethanol extract
of Scoparia dulcis has the highest antiviral activity hepatitis C, but it also
toxic. It has chemical compound such as chlorophyll, terpenoid, and flavonoid.
xi DAFTAR ISI
SAMPUL ... i
HALAMAN JUDUL ... i
LEMBAR PERSETUJUAN PUBLIKASI ILMIAH ... ii
LEMBAR PERNYATAAN BUKAN HASIL PLAGIARISME ... iii
LEMBAR PENGESAHAN ... iv
KATA PENGANTAR ... v
RINGKASAN ... viii
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiv
DAFTAR TABEL ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
1.3 Tujuan Penelitian ... 5
1.3.1 Tujuan Umum ... 5
1.3.2 Tujuan Khusus ... 5
1.4 Hipotesis Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Tinjauan tentang S. dulcis ... 6
xii
2.1.2 Nama daerah Jawa ... 7
2.1.3 Deskripsi Tanaman ... 7
2.1.4 Penyebaran Tanaman ... 8
2.1.5 Kandungan Kimia dalam Tanaman ... 8
2.1.6 Bagian Tanaman yang digunakan ... 8
2.1.7 Kegunaan Tanaman ... 8
2.2 Tinjauan Tentang Hepatitis C ... 9
2.2.1 Pengertian Hepatitis C ... 9
2.2.2 Terapi Hepatitis C ... 13
2.3 Tinjauan tentang ekstrak ... 17
2.5 Tinjauan tentang Kromatografi ... 21
2.5.1 Pengertian Kromatografi ... 21
2.5.2 Kromatografi Lapis Tipis (KLT) ... 22
BAB III KERANGKA KONSEPTUAL ... 24
3.1 Uraian Kerangka Konseptual Penelitian ... 24
BAB IV METODE PENELITIAN ... 28
4.1 Jenis dan Rancangan Penelitian ... 28
4.1.1 Ekstraksi dan fraksinasi herba S. dulcis ... 28
4.1.2 Uji aktivitas antihepatitis C hasil fraksinasi dari ekstrak etanol 80% secara in-vitro ... 28
4.1.3 Uji toksisitas sel ... 29
4.1.4 Pengamatan profil kromatogram ekstrak etanol 80% dan hasil fraksinasi dari ekstrak etanol 80% herba Scoparia dulcis ... 29
4.2 Sampel Penelitian... 29
4.3 Variabel Penelitian dan Definisi Operasional ... 31
4.3.1 Variabel Penelitian ... 31
xiii
4.4 Bahan dan Alat Penelitian ... 32
4.4.1 Bahan Tanaman... 32
4.4.2 Bahan untuk ekstraksi, fraksinasi, dan skrinning fitokimia ... 32
4.4.3 Bahan virus dan sel ... 32
4.5 Instrumen Penelitian ... 33
4.6 Lokasi dan Waktu Penelitian ... 34
4.7 Prosedur Penelitian ... 34
4.7.1 Pembuatan Ekstrak Etanol 80% Herba S. dulcis ... 34
4.7.2 Fraksinasi Ekstrak Etanol 80% Herba S. dulcis ... 34
4.7.3 Pengamatan Profil Kromatogram Ekstrak dan Fraksi Etanol 80% Herba S. dulcis secara Kromatografi Lapis Tipis ... 35
4.7.4 Uji Aktivitas Anti Hepatitis C secara in-vitro ... 36
4.7.5 Uji Toksisitas Hasil Fraksinasi Ekstrak Etanol 80% Herba S.dulcis ... 48
BAB V HASIL PENELITIAN ... 51
5.1 Hasil Ekstraksi dan Fraksinasi Herba S. dulcis ... 51
5.2 Profil Kromatografi Lapis Tipis Ekstrak Etanol 80%, Fraksi Diklorometana, Fraksi Etil asetat, Fraksi Butanol, dan Fraksi Air dari Herba S. dulcis ... 52
5.3 Hasil Uji Aktivitas Antivirus Hepatitis C Ekstrak dan Fraksi dari Ekstrak Etanol 80% herba S. dulcis Secara In-Vitro ... 56
5.4 Hasil Uji Aktivitas Sitotoksisitas Ekstrak dan Fraksi dari Ekstrak Etanol 80% herba S. dulcis dengan metode MTT-assay ... 62
BAB VI PEMBAHASAN ... 69
BAB VII KESIMPULAN DAN SARAN ... 78
7.2 KESIMPULAN ... 78
7.3 SARAN ... 78
xiv
DAFTAR GAMBAR
Gambar BAB 2
Gambar 2. 1 S. dulcis L. ... 6 Gambar 2. 2 Siklus Hidup Hepatitis C... 12 Gambar 2. 3 Mekanisme Aksi dari Interferon ... 14 Gambar BAB 3
Gambar 3. 1 Skema Kerangka Konseptual ... 27 Gambar BAB 4
Gambar 4. 1 Skema Rancangan Penelitian ... 30 Gambar BAB 5
Gambar 5. 1 Kromatogram hasil Kromatografi Lapis Tipis dari ekstrak dan hasil fraksinasi dari ekstrak etanol 80% herba S.dulcis, dengan Fase diam : Kieselgel 60 F254 dan Fase gerak :
Kloroform : metanol (9:1) (A) setelah dieluasi dan dilihat pada lampu UV dengan λ 254 nm (B) dilihat pada lampu UV dengan λ 366 nm (C) setelah disemprot H2SO4 10% dalam
metanol (D) setelah disemprot H2SO4 10% dalam metanol
dilihat pada lampu UV dengan λ 366 nm ... 53 Gambar 5. 2 Kromatogram hasil Kromatografi Lapis Tipis dari ekstrak dan hasil fraksinasi dari ekstrak etanol 80% herba S.dulcis, dengan Fase diam : Kieselgel 60 RP-18 F254 dan Fase gerak :
Asetonotril : metanol:air (1:2:2) (A) setelah dieluasi dan dilihat pada lampu UV dengan λ 254 nm (B) dilihat pada lampu UV dengan λ 366 nm (C) setelah disemprot H2SO4
10% dalam metanol (D) setelah disemprot H2SO4 10% dalam
metanol dilihat pada lampu UV dengan λ 366 nm ... 55 Gambar 5. 3 Gambar Pengamatan Uji Aktivitas Antivirus Hepatitis C Pada Ekstrak Etanol 80% dan Fraksi dari Ekstrak Etanol 80% herba S. dulcis di bawah Mikroskop ... 61
xv
DAFTAR TABEL
Tabel BAB 2
Tabel 2. 1. Kombinasi Terapi untuk Hepatitis C Kronik ... 16 Tabel BAB 4
Tabel 4. 1 Definisi Operasional Penelitian ... 31 Tabel 4. 2 Pengenceran Virus dengan Ekstrak ... 40 Tabel BAB 5
Tabel 5. 1 Berat ekstrak dan masing-masing fraksi yang didapatkan dari hasil ekstraksi dan fraksinasi cair- cair ... 51 Tabel 5. 2 Tabel Hasil Uji Aktivitas Antivirus Hepatitis C Ekstrak Etanol 80% herba S. dulcis ... 56 Tabel 5. 3 Tabel Hasil Uji Aktivitas Antivirus Hepatitis C Ekstrak Etanol 80% herba S. dulcis ... 57 Tabel 5. 4 Hasil Uji Aktivitas Antivirus Hepatitis C Fraksi Etil Asetat dari Ekstrak Etanol 80% herba S. dulcis ... 58 Tabel 5. 5 Tabel Hasil Uji Aktivitas Antivirus Hepatitis C Fraksi Butanol dari Ekstrak Etanol 80% herba S. dulcis ... 59 Tabel 5. 6 Tabel Hasil Uji Aktivitas Antivirus Hepatitis C Fraksi Air dari Ekstrak Etanol 80% herba S. dulcis ... 60 Tabel 5. 7 Hasil Uji Sitotoksisitas Ekstrak etanol 80% dari Ekstrak Etanol 80% herba S. dulcis ... 63 Tabel 5. 8 Hasil Uji Sitotoksisitas Fraksi Diklorometana dari Ekstrak
Etanol 80% herba S.a dulcis ... 64 Tabel 5. 9 Hasil Uji Sitotoksisitas Fraksi Etil Asetat dari Ekstrak Etanol 80% herba S. dulcis ... 65 Tabel 5. 10 Hasil Uji Sitotoksisitas Fraksi Butanol dari Ekstrak Etanol 80% herba Sa dulcis ... 66 Tabel 5. 11 Hasil Uji Sitotoksisitas Fraksi Air dari Ekstrak Etanol 80%
herba S. dulcis ... 67 Tabel 5. 12 Hasil Perhitungan IC50, CC50, dan Selectivity Index (SI)
xvi Lampiran 3 Analisis IC50 Fraksi Diklorometana Herba S. dulcis Dengan
SPSS Replikasi 1 ... 90 Lampiran 4 Analisis IC50 Fraksi Diklorometana Herba S. dulcis Dengan
SPSS Replikasi 2 ... 93 Lampiran 12 Analisis CC50 Fraksi Diklorometana Herba S. dulcis Dengan
xvii
Lampiran 13 Analisis CC50 Fraksi Etil Asetat Herba S. dulcis Dengan
SPSS ... 109 Lampiran 14 Analisis CC50 Fraksi Butanol Herba S. dulcis Dengan SPSS
... 111 Lampiran 15 Analisis CC50 Fraksi Air Herba S. dulcis Dengan SPSS . 114
Lampiran 16 Perhitungan IC50 Ekstrak Etanol 80% dan Hasil Fraksinasi
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Penyakit hepatitis merupakan masalah kesehatan di dunia yang dapat menyebabkan kematian jutaan orang di seluruh dunia. Hepatitis dapat disebabkan oleh berbagai macam virus seperti virus hepatitis A,B,C,D, dan E (WHO, 2002). Hepatitis C merupakan salah satu penyebab utama dari penyakit sirosis hepatis dan HCC (hepatocellular carcinoma) (WHO, 2002). Lebih dari 185 juta orang diseluruh dunia terinfeksi oleh virus Hepatitis C, dan 350.000 diantaranya meninggal dalam setiap tahun (WHO, 2014). Di Asia Tenggara, lebih dari 11 juta orang telah terinfeksi oleh virus Hepatitis C (WHO, 2014). Di Indonesia, diperkirakan telah terdapat 24 juta penduduk Indonesia yang terinfeksi virus Hepatitis B dan C, 14 juta diantaranya berpotensi menjadi penyakit hati yang kronik. Penderita yang telah berkembang menjadi penyakit hati yang kronik, sekitar 1,4 juta diantaranya berpotensi untuk berkembang menjadi kanker hati (Depkes RI, 2014).
lewat transfusi darah, suntikan yang terkontaminasi selama proses medis terjadi, dan melalui penggunaan narkoba dengan jarum suntik. Hubungan seksual juga dapat menyebabkan penyakit ini namun kurang umum terjadi (WHO, 2012).
Hingga saat ini belum ditemukan vaksin untuk hepatitis C (Depkes RI, 2014). Saat ini terapi kombinasi pegylated interferon (PegIFN-α) dan ribavirin digunakan sebagai terapi standar untuk infeksi HCV kronis karena dapat menghambat replikasi virus (Depkes RI 2014). Namun, sebanyak 40-50% dari pasien gagal untuk menerima efek terapi dari pemberian terapi (PegIFN-α) atau Ribavirin. Timbulnya efek samping (sakit kepala, kelelahan, mialgia, depresi, neutropenia, trombositopenia) pada pasien yang menerima PEG interferon standar menyebabkan penghentian terapi (Javed et al., 2012). Selain itu, pengobatan yang berbasis IFN dapat berpotensi menyebabkan gangguan autoimun (Helen et al., 2012).
Terapi baru untuk infeksi HCV telah banyak dikembangkan, namun khasiat terapi yang dihasilkan masih perlu ditingkatkan. Tanaman obat merupakan sumber yang menjanjikan sebagai calon
obat untuk infeksi HCV (Wahyuni et al., 2012). Pada tanaman yang
memiliki kandungan senyawa kimia seperti flavonoid, terpenoid, lignan, sulfida, polifenol, kumarin, saponin, senyawa furil, alkaloid, polyines, thiophenes, protein dan peptida, cenderung dapat menghambat siklus replikasi berbagai jenis DNA virus RNA (Javed et al., 2012). Beberapa tanaman dilaporkan memiliki aktivitas sebagai anti virus hepatitis C. Eucalyptus globulus mempunyai aktivitas antihepatitis C yang potensial terhadap virus hepatitis C JFH1a (Versiati et al., 2014). Phyllantus amarus secara signifikan
(Ravikumar, 2011). Ekstrak dari Acacia nilotica, Boswellia carterii, Embelia schimperi, Piper cubeba, Quercus infectoria,
Trachyspermum ammi, dan Syzygium aromaticum secara signifikan
menghambat aktivitas protease HCV secara in vitro (Lee jihye et al., 2012).
Pemilihan tanaman Scoparia dulcis didasarkan pada
pendekatan kemotaksonomi dan penelitian pendahuluan yang pernah dilaksanakan sebelumnya. Melalui pendekatan kemotaksonomi,
tanaman Picrorhiza kurroa yang mempunyai familia sama dengan
S.dulcis yaitu Scrophulariaceae mempunyai aktivitas terhadap virus HCV (Mohanapriya et al., 2013). Pada penelitian pendahuluan yang pernah dilakukan sebelumnya, dilakukan dengan menguji tiga sampel tanaman yaitu S.dulcis, Spigellia anthelmia, dan Asystasia gangetica. Ketiga tanaman tersebut menunjukkan aktivitas sebagai antivirus Hepatitis C dengan IC50 masing-masing secara
berturut-turut sebesar 17,79 µg/ml, 83,93 µg/ml, dan lebih dari 100 µg/ml terhadap virus JFH1a (Adianti et al., 2015). Ekstrak tanaman dengan kadar IC50 < 30 µg/ml dinyatakan mempunyai aktivitas sebagai anti
HCV yang signifikan (Wahyuni et al., 2012). Hal ini menguatkan dugaan bahwa terdapat aktivitas sebagai antivirus hepatitis C pada tanaman S.dulcis.
Tanaman S.dulcis mempunyai familia Scrophulariaceae.
Tanaman ini di Indonesia lebih dikenal dengan nama Jaka Tuwa.
Kandungan senyawa kimia yang terdapat pada tanaman S.dulcis
adalah kumarin, fenol, saponin, tannin, asam amino, flavonoid, terpenoid, dan katekolamin (Murti et al.,2012). Secara tradisional
tanaman S.dulcis digunakan untuk mengobati masalah lambung,
antipiretik (Murti et al.,2012). Pada studi literatur lain, tanaman S.dulcis aktif sebagai antiviral pada pengujian untuk virus Herpes Simplex type 1 (Murti et al.,2012).
Pada penelitian ini akan dilakukan fraksinasi terhadap ekstrak
etanol 80% herba S.dulcis berturut-turut menggunakan pelarut
diklorometana, etil asetat, dan butanol. Pemilihan pelarut tersebut didasarkan pada perbedaan polaritas dari non polar, semi polar, hingga polar. Sehingga diharapkan senyawa yang bersifat polar,
semipolar, maupun non polar pada tanaman S.dulcis dapat
terekstraksi secara maksimal. Pada penelitian pendahuluan yang
pernah dilakukan terhadap ekstrak etanol 80% herba S.dulcis
menggunakan virus JFH1a pada sel hepatosit Huh7it menunjukkan aktivitas sebagai antivirus hepatitis C dengan IC50 sebesar 17,79
µg/ml, CC50 115,51 µg/ml, Selective Index 6,49 µg/ml (Adianti et
al., 2015) . Hal ini menguatkan dugaan bahwa terdapat fraksi yang aktif dari hasil fraksinasi menggunakan ekstrak etanol 80% herba
S.dulcis. Sehingga dapat digunakan sebagai produk obat anti
Hepatitis C. Selanjutnya, akan dilakukan pengamatan profil kromatogram hasil fraksinasi ekstrak etanol 80% herba S.dulcis secara Kromatografi Lapis Tipis dan pengujian aktivitas antivirus hepatitis C in-vitro untuk identifikasi fraksi yang aktif.
1.2 Rumusan Masalah
Adapun rumusan masalah pada penelitian ini adalah sebagai berikut :
1. Bagaimanakah aktivitas dari hasil fraksinasi ekstrak etanol 80%
2. Bagaimanakah toksisitas dari hasil fraksinasi ekstrak etanol 80% herba S.dulcis dengan menggunakan metode MTT assay ?
1.3 Tujuan Penelitian 1.3.1 Tujuan Umum
1. Untuk mengetahui aktivitas hasil fraksinasi ekstrak etanol 80%
herba S.dulcis sebagai antivirus Hepatitis C in-vitro.
2. Untuk mengetahui toksisitas hasil fraksinasi ekstrak etanol 80%
herba S.dulcis dengan menggunakan metode MTT assay.
1.3.2 Tujuan Khusus
1. Menentukan IC50 hasil fraksinasi ekstrak etanol 80% herba
S.dulcis sebagai antivirus Hepatitis C in-vitro.
2. Menentukan CC50 hasil fraksinasi ekstrak etanol 80% herba
S.dulcis dengan menggunakan metode MTT assay.
1.4 Hipotesis Penelitian
Terdapat fraksi yang aktif dari hasil fraksinasi ekstrak etanol 80% herba S. dulcis sebagai antivirus Hepatitis C in-vitro .
1.5 Manfaat Penelitian
Mendapatkan informasi mengenai aktivitas antivirus Hepatitis C dari hasil fraksinasi ekstrak etanol 80% herba S.dulcis sehingga
dapat dijadikan dasar pengembangan tanaman S.dulcis sebagai
6 BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan tentang Scoparia dulcis
2.1.1 Klasifikasi tanaman Kerajaan : Plantae Divisi : Magnoliophyta Kelas : Magnoliopsida Bangsa : Scrophulariales Suku : Scrophulariaceae Genus : Scoparia
Jenis : Scoparia dulcis Linn.
(Backer and Bakhuizen Van Den Brink, 1965)
2.1.2 Nama daerah Jawa
Jaka tuwa (Jawa) (Simda); Grinje menir, Grinje jepun (Jawa) 2.1.3 Deskripsi Tanaman
Habitus : Tanaman herba tahunan, tegak, tinggi hingga 2 m. Batang : Bulat, licin, sedikit berkayu, hijau.
Daun : Helaian daun bentuk oval, pangkal meruncing, ujung runcing, tepi bergerigi, panjang 1-2 cm,l ebar 0,5-1 cm, pertulangan menyirip, permukaan kasar, berwarna hijau, tangkai daun panjang 2-8 mm. Bunga : Tunggal di ketiak daun dan berkelompok dua,
hemaprodit, tangkai panjang 2-5 mm, bunga sempurna, mahkota bentuk bulat, berwarna kuning pucat hingga keputihan dengan bagian gelap di tengah, dengan diameter 6-7 mm, 4 helai, kelopak bunga berlepasan 4 helai, panjang 2-3 ram, hijau, gundul, benang sari 4, tangkai sari disisipkan di bagian atas mahkota bunga, kepala sari tegak dengan panjang 2 mm, putik terpotong menjadi 2 bagian, waktu berbunga hampir sepanjang tahun.
Buah : Bentuk bujur telur, keras, hijau.
2.1.4 Penyebaran Tanaman
Merupakan tumbuhan liar yang umumnya ditemukan di pinggiran sawah, pinggir jalan, tepi-tepi sungai atau di semak-semak, dari ketinggian 10 m sampai 800 m di atas permukaan laut. Pengumpulan bahan dapat dilakukan sepanjang tahun (Ristek, 2012). Di Negara–Negara lain tanaman S. dulcis lebih dikenal dengan nama “sweet broomweed”. Tanaman ini terdistribusi luas di daerah tropis dan subtropis seperti Asia dan Amerika selatan. Habitat asli dari tanaman ini adalah di Amerika (Murti et al., 2012).
2.1.5 Kandungan Kimia dalam Tanaman
Kandungan kimia yang terdapat pada tanaman ini adalah kumarin, fenol, saponin, tannin, asam amino, flavonoid, terpenoid, dan katekolamin. Senyawa aktif yang terdapat dalam tanaman
S.dulcis adalah scoparic acid A, scoparic acid B, scoparinol,
scopadulcic acid A dan B, scopadulciol, dan scopadulin yang merupakan golongan terpenoid (Murti et al.,2012).
2.1.6 Bagian Tanaman yang digunakan
Akar dan seluruh bagian tanaman dalam keadaan segar atau setelah dikeringkan (Ristek, 2012).
2.1.7 Kegunaan Tanaman 2.1.7.1 Secara Empiris
(Perry, 1980), bronkitis (Gonzalez -Torres, 1986 ) dan sebagai analgesik dan agen antipiretik (De Farias Freire dkk., 1993).
2.1.7.2 Berdasarkan uji preklinik
Ekstrak dari S.dulcis secara signifikan dapat meningkatkan produksi insulin pada uji yang dilakukan terhadap tikus wistar jantan. Senyawa diterpenoid yaitu scopadulcic acid A dari tanaman
S.dulcis mempunyai aktivitas sebagai anti malaria terhadap
Plasmodium falciparum secara in-vitro. Scopadulcic acid B yang merupakan senyawa diterpenoid dapat menghambat replikasi dari virus herpes simplex type 1 pada hamster. Ekstrak etanol dari
Scoparia dulcis mempunyai aktivitas sebagai analgesik dan
anti-inflamatory pada uji writhing-test terhadap mencit (Murti., et al 2012). Studi lain secara in-vitro, tanaman S.dulcis mempunyai aktivitas sebagai antioksidan (Patra., et al 2013).
2.1.7.3 Berdasarkan uji klinik
Pada studi secara in-vivo senyawa scopadulcic acid B dari tanaman Scoparia dulcis dapat menghambat tumor pada promoter 12-O-tetradecanoylphorbol-13-acetate (TPA) (Murti., et al 2012).
2.2 Tinjauan Tentang Hepatitis C 2.2.1 Pengertian Hepatitis C
penyakit kuning dan penyebabnya bukan hanya virus. Diagnosis yang tepat hanya dapat ditegakkan dengan pemeriksaan antibodi spesifik pada pasien (WHO, 2002).
Hepatitis C disebabkan oleh infeksi virus Hepatitis C (HCV) yang merupakan virus RNA rantai tunggal dan beramplop. Virus ini menginfeksi sel-sel hati dan mengakibatkan peradangan berat pada hati sehingga terjadi berbagai macam komplikasi dalam jangka panjang. Gejala yang ditimbulkan oleh penyakit ini tidak spesifik yang ditandai dengan anoreksia, perut terasa tidak nyaman,mual dan muntah, demam, dan terjadi jaundice pada sekitar 25% pasien dan lebih jarang terjadi dibandingkan dengan hepatitis B. Dari pasien yang terinfeksi HCV sekitar 40% dari mereka sembuh total namun 20% dari pasien berkembang menjadi sirosis hati dan lebih dari 20% lainnya berkembang menjadi kanker hati (WHO, 2002).
Virus Hepatitis C merupakan virus RNA yang beramplop dengan diameter 50 nm dan memiliki panjang 9.6 kb (WHO, 2014). Hepatitis C virus diklasifikasikan dalam genus Hepacivirus dan familia flaviviridae. Virus ini memilki genom yang bervariasi dan genotip-subgenotip yang bermacam-macam (WHO, 2014). Genom dari HCV memiliki kemampuan mutasi yang tinggi karena HCV merupakan virus RNA dan memiliki kemampuan proofreading yang kurang efisien. HCV mengalami mutasi yang cepat pada daerah
hypervariable dari genom yang mengkode untuk protein amplop dan
menyebabkan kehilangan kekebalan tubuh dari host. Sebagai akibatnya banyak orang yang terinfeksi HCV berkembang menjadi infeksi yang kronis (WHO, 2002).
melalui transfusi darah dan produk darah yang terkontaminasi oleh HCV, suntikan yang terkontaminasi selama prosedur medis, dan melalui penggunaan narkoba dengan menggunakan suntikan (WHO, 2012). HCV tidak disebarkan oleh ibu menyusui, bersin, batuk, dan memeluk (WHO 2002). HCV bisa ditularkan dari ibu yang positif HCV kepada bayi selama proses kelahiran.
Virus Hepatitis C dapat menyebabkan infeksi kronis dan akut. Infeksi HCV akut dapat didefinisikan sebagai keberadaan virus Hepatitis C dalam tubuh dengan jangka waktu enam bulan setelah terjadinya paparan dan infeksi. Hal ini biasanya tidak terdapat gejala yang terlihat, dan hanya terjadi pada penyakit yang dapat mengancam jiwa. Pembersihan secara spontan HCV akut terjadi dalam waktu enam bulan dari infeksi pada 15-45% individu yang terinfeksi dengan tidak adanya pengobatan. Antibodi anti-HCV merupakan bagian dari infeksi akut virus Hepatitis C. Seseorang dengan antibody anti-HCV dapat melakukan tes asam nukleat (NAT) untuk mendeteksi keberadaan RNA virus hepatitis C dan diperlukan sebagai diagnosis untuk infeksi HCV kronik (WHO, 2014).
tidak dapat dijadikan tolak ukur berkembangnya sirosis. Sekitar 20% pasien dengan infeksi kronis HCV akan mengidap sirosis hati (Dipiro et al., 2011).
Pada infeksi akut HCV, kebanyakan pasien tidak merasakan gejala apapun dan tidak terdiagnosis. RNA HCV dapat dideteksi pada minggu pertama hingga ke-2 sejak dari mulai tertular dan kadarnya meningkat tajam selama minggu-minggu awal. Kadar RNA HCV pada masa-masa tersebut berkisar antara 105 hingga 107 IU/ml.
Selain itu, kadar ALT akan meningkat yang mengindikasikan adanya kerusakan hati dan nekrosis sel. Biasanya, gejala mulai muncul pada minggu ke-7 setelah terinfeksi, denagan kisaran anatara 3 sampai 12 minggu (Dipiro et al., 2011).
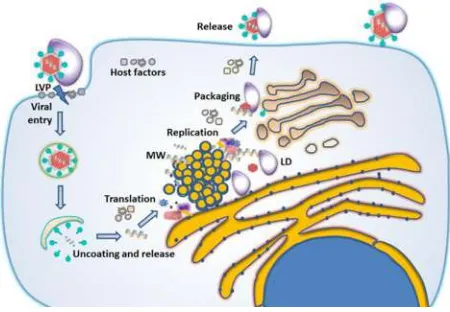
Gambar 2. 2 Siklus Hidup Hepatitis C (Carnero elena, 2015)
reseptor endositosis. Setibanya di awal endosome, terjadi fusi amplop virus dengan endosome dan melepaskan genom (meteri genetik) ke dalam sitosol. RNA virus ini kemudian diterjemahkan ke dalam poliprotein virus. Protein non-struktual NS3 sampai NS5B membentuk kompleks replikasi yang terkait dengan membran derivat ER yang disebut membran web dan mereplikasikan genom tersebut. Setelah akumulasi neosynthesized RNA genomik dan protein virus, partikel HCV dirakit dalam kompartemen ER-terkait yang dekat dengan jalur biogenesis VLDL. Kemudian, partikel HCV yang berikatan dengan lipoprotein, dikirim ke jalur sekresi (keluar dari sel) (Carnero Elena, 2015).
2.2.2 Terapi Hepatitis C
Pengobatan standar untuk hepatitis C virus (HCV) adalah terapi kombinasi Pegylated Interferon (PegIFN-α) dan Ribavirin (RBV) yang dipakai selama 48 minggu (Depkes RI 2014).
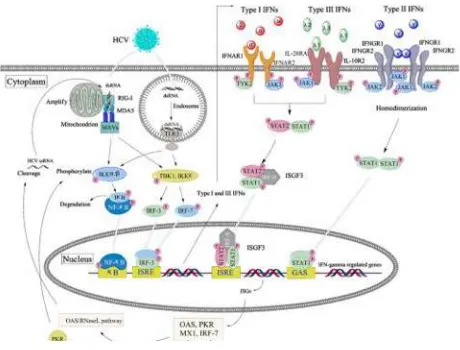
2.2.2.1 Interferon (IFN)
ada lagi jenis lain yang sedang dalam penelitian. Berbagai jenis interferon telah disetujui untuk mengobati penyakit yang berbeda. Penelitian terbaru telah tertuju pada penggunaan interferon untuk meningkatkan keberhasilan terapi lain, misalnya untuk mengobati kanker payudara
IFN-α mempunyai efek antivirus dengan mekanisme yaitu: (1) induksi antivirus non spesifik pada sel yang terinfeksi ; (2) efek immunodilator yang meningkatkan respon imun antivirus spesifik pada inang serta mempercepat kematian sel yang terinfeksi (Huang
et al., 2014).
2.2.2.2 Ribavirin (RBV)
RBV adalah obat antivirus yang ditemukan pada tahun 1970. Ribavirin merupakan analog guanosin yang terfosforilasi intraseluler pada enzim sel inang. Obat ini digunakan bersama interferon alfa. Pengobatan Ribavirin harus diberikan sesuai dengan berat badan
(Terdapat pada tabel 2.1). Pengobatan dengan kombinasi Ribavirin dan Interferon akan menghasilkan respon ketika melawan virus. Penderita dikatakan memiliki respon melawan virus jika jumlah virus Hepatitis C begitu rendah sehingga tidak terdeteksi pada tes standar RNA virus.
Tabel 2. 1. Kombinasi Terapi untuk Hepatitis C Kronik
Obat Dosis
Pegylated Interferon α -2 α 100 µg seminggu sekali
Ribavirin (Copegus ®) <75 kg: 1000 mg (Genotype 1,4) ≥75 kg: 1200 mg (Genotype 1,4) 800 mg (Genotype 2,3) Pegylated Interferon α -2β 1,5 µg/kg seminggu sekali
Ribavirin (Rebetol®)
≤65 : 800 mg 66-80 kg : 1000 mg 81-105 kg : 1200 mg
>105 kg : 1400 mg
*Non-pegylated Interferon termasuk interferon α -2α (Roferon®, dosis: 3-4,5 mill IU 3 waktu tiap minggu (TIW); Interferon α -2 β (Intron A®, dosis 3
mill IU TIW); dan Consensus Interferon (Infergen®: dosis 9 µg TIW) (Raymond T.Chung et al., 2008)
2.2.2.3 Peginterferon (PegIFN)
Maksud dari “pegilasi” adalah penambahan polimer inert polietilen glikol (PEG) pada protein terapetik seperti IFN. Semakin besar ukuran molekul senyawa, maka akan menghasilkan paruh waktu yang lebih lama akibat dari penurunan klirens sehingga aktivitas biologisnya dapat dipertahankan serta dosis yang lebih nyaman yaitu cukup diberiakan satu kali seminggu (Yu and Chuang, 2008).
2.2.2.4 Terapi Lain
dengan infeksi HCV genotip 1b dan genotip 1a tanpa adanya polimorfisme Q80K. Sofosbuvir diberikan kombinasi dengan Ribavirin tanpa PegIFN (tergantung genotip HCV). Terapi ini direkomendasikan untuk infeksi HCV genotip 1,2,3, dan 4. Terapi ini juga bisa diberikan kepada seseorang yang tidak dapat menggunakan terapi Interferon (WHO, 2014).
2.3 Tinjauan tentang ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Depkes RI, 1995 ).
Ekstrak cair adalah sediaan simplisia nabati yang mengandung etanol sebagai pelarut atau sebagai pengawet. Jika tidak dinyatakan lain pada masing-masing monografi tiap ml ekstrak mengandung senyawa aktif dari 1 g simplisia yang memenuhi syarat. Ekstrak cair yang cenderung membentuk endapan dapat didiamkan dan disaring atau bagian yang bening die nap tuangkan (dekantasi). Beningan yang diperoleh memenuhi persyaratan Farmakope. Ekstrak cair dapat dibuat dari ekstrak yang sesuai (Depkes RI, 1995).
2.4 Tinjauan tentang ekstraksi
seperti serat, karbohidrat, protein, dan lain-lain. Senyawa aktif yang terdapat dalam simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Struktur kimia yang berbeda-beda akan mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap pemanasan, udara, cahaya, logam berat, dan derajat keasaman. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat.
Proses pembuatan ekstrak diawali dari pembuatan serbuk simplisia kering (penyerbukan) yang memiliki derajat kehalusan tertentu. Semakin halus serbuk simplisia, maka proses ekstraksi yang terjadi semakin efektif, namun semakin halus serbuk simplisia yang diekstraksi menyebabkan semakin sulitnya proses penyarian yang diperlukan (Depkes RI, 2000).
Cairan pelarut dalam proses pembuatan ekstrak adalah pelarut yang baik (optimal) untuk senyawa kandungan yang berkhasiat atau yang aktif, dengan demikian senyawa tersebut dapat terpisahkan dari bahan dan dari senyawa kandungan lainnya serta ekstrak hanya mengandung sebagian besar senyawa kandungan yang diinginkan (Depkes RI, 2000).
Berbagai macam metode ekstraksi yang biasa dilakukan adalah : 1. Cara dingin
a. Maserasi
yang kontinyu (terus-menerus). Remaserasi yang berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya (Depkes RI, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan (Depkes RI, 2000).
2. Cara Panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Depkes RI, 2000).
b.Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Depkes RI, 2000).
c. Infus
d. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinyu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar) yaitu secara umum dilakukan pada temperatur 40-50oC
(Depkes RI, 2000). e. Dekok
Dekok adalah infuse pada waktu yang lebih lama (≥30oC) dan
temperature sampai titik didih air. 3. Destilasi Uap
Destilasi uap adalah ekstraksi senyawa kandungan menguap (minyak atsiri) dari bahan (segar atau simplisia) dengan uap air berdasarkan peristiwa tekanan parsial senyawa kandungan menguap dengan fase uap air dari ketel secara kontinyu sampai sempurna dan diakhiri dengan kondensasi fase uap campuran (senyawa kandungan menguap ikut terdestilasi) menjadi destilat air bersama senyawa kandungan yang memisah sempurna atau memisah sebagian (Depkes RI, 2000).
4. Cara ekstraksi lainnya
a. Ekstraksi Ultrasonik (Sonikasi)
b. Ekstraksi berkesinambungan
Proses ekstraksi yang dilakukan berulangkali dengan pelarut yang berbeda atau resirkulasi cairan pelarut dan prosesnya tersusun berturutan beberapa kali. Proses ini dilakukan untuk meningkatkan efisiensi (jumlah pelarut) dan dirancang untuk bahan dalam jumlah besar yang terbagi dalam beberapa bejana ekstraksi (Depkes RI, 2000).
c. Superkritikal Karbondioksida
Penggunaan prinsip superkritik untuk ekstraksi serbuk dengan simplisia, dan umumnya digunakan gas karbondioksida. Dengan variabel tekanan dan temperatur akan diperoleh spesifikasi kondisi polaritas tertentu yang sesuai untuk melarutkan golongan senyawa kandungan tertentu. Penghilangan cairan pelarut dengan mudah dilakukan karena karbondioksida menguap dengan mudah, sehingga hampir langsung diperoleh ekstrak (Depkes RI, 2000).
2.5 Tinjauan tentang Kromatografi 2.5.1 Pengertian Kromatografi
Teknik kromatografi umum membutuhkan zat terlarut terdistribusi diantara dua fase, satu diantaranya diam (fase diam), yang lainnya bergerak (fase gerak). Fase gerak membawa zat terlarut melalui media, hingga terpisah dari zat terlarut lainnya, yang tereluasi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen (Depkes RI, 2009).
Fase diam dapat bertindak sebagai zat penjerap, seperti halnya penjerap aluminia yang diaktifkan, silika gel, dan resin penukar ion, atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses terakhir ini suatu lapisan cairan pada suatu penyangga yang inert berfungsi sebagai fase diam (Depkes RI, 2009).
2.5.2 Kromatografi Lapis Tipis (KLT)
Pada Kromatografi Lapis TIpis (KLT), zat penjerap merupakan lapisan tipis serbuk halus yang dilapiskan pada lempeng kaca, plastik atau logam secara merata, umumnya digunakan lempeng kaca. Lempeng yang dilapisi dapat dianggap sebagai kolom kromatografi terbuka dan pemisahan yang tercapai dapat didasarkan pada adsorpsi, partisi, atau kombinasi kedua efek, yang tergantung dari jenis lempeng, cara pembuatan, dan jenis pelarut yang digunakan. Perkiraan identifikasi diperoleh dengan pengamatan bercak dengan harga Rf yang identik dan ukuran hampir sama, dengan menotolkan bahan uji dan pembanding pada lempeng yang sama (Depkes RI, 2009).
pada tahap permulaan pemisahan suatu cuplikan, sedangkan KLT pereparatif hanya dilakukan apabila diperlukan fraksi tertentu dari suatu campuran (Gritter et al.,1991).
KLT umumya lebih banyak digunakan untuk tujuan identifikasi, karena mudah dan sederhana serta memiliki fase diam yang beragam. Dalam KLT, perbandingan jarak rambat suatu senyawa tertentu terhadap jarak rambat fase gerak, diukur dari titik totolan sampai titik yang memberikan intensitas maksimum pada bercak noda, dinyatakan sebagai harga Rf dari suatu senyawa. Jika zat uji memiliki harga Rf yang sama dengan standar yang ada kemungkinan zat uji tersebut mempunyai kandungan senyawa yang sama dengan standar.
Penetapan letak bercak yang dihasilkan KLT dapat ditetapkan dengan : (1) pengamatan langsung jika senyawa tampak pada senyawa tampak, ultraviolet gelombang pendek (254 nm) atau gelombang panjang (366 nm) ; (2) pengamatan dengan cahaya tampak atau ultraviolet setelah disemprot dengan penampak bercak (Depkes RI, 2008).
24 BAB III
KERANGKA KONSEPTUAL
3.1 Uraian Kerangka Konseptual Penelitian
Penyakit hepatitis merupakan masalah kesehatan di dunia yang dapat menyebabkan kematian jutaan orang di seluruh dunia. Hepatitis dapat disebabkan oleh berbagai macam virus seperti virus hepatitis A,B,C,D, dan E (WHO, 2002). Hepatitis C merupakan salah satu penyebab utama dari penyakit sirosis hepatis dan HCC (hepatocellular carcinoma) (WHO, 2002). Lebih dari 185 juta orang diseluruh dunia terinfeksi oleh virus Hepatitis C, dan 350.000 diantaranya meninggal dalam setiap tahun (WHO, 2014). Di Asia Tenggara, lebih dari 11 juta orang telah terinfeksi oleh virus Hepatitis C (WHO, 2014). Di Indonesia, diperkirakan telah terdapat 24 juta penduduk Indonesia yang terinfeksi virus Hepatitis B dan C, 14 juta diantaranya berpotensi menjadi penyakit hati yang kronik. Penderita yang telah berkembang menjadi penyakit hati yang kronik, sekitar 1,4 juta diantaranya berpotensi untuk berkembang menjadi kanker hati (Depkes RI, 2014).
(Javed et al., 2012). Selain itu, pengobatan yang berbasis IFN dapat berpotensi menyebabkan gangguan autoimun (Helen et al., 2012).
Perlu dilakukannya penelitian terkait tanaman yang mempunyai aktivitas sebagai anti-Hepatitis C sebagai upaya pengembangan obat-obatan baru yang potensial untuk anti-Hepatitis C. Banyak tanaman dilaporkan memiliki aktivitas sebagai anti HCV. Eucalyptus globulus mempunyai aktivitas antihepatitis C yang potensial terhadap virus hepatitis C JFH1a (Versiati et al 2014).
Phyllantus amarus secara signifikan dapat menghambat HCV NS3
protease dengan IC50 sebesar 5µg/ml (Ravikumar, 2011). Untuk
menunjang hal tersebut, hal yang perlu dilakukan adalah pencarian komponen senyawa aktif yang berperan terhadap aktivitas sebagai antihepatitis C virus.
Pemilihan tanaman Scoparia dulcis didasarkan pada
pendekatan kemotaksonomi dan penelitian pendahuluan yang pernah dilaksanakan sebelumnya. Melalui pendekatan kemotaksonomi,
tanaman Picrorhiza kurroa yang mempunyai familia sama dengan
S.dulcis yaitu Scrophulariaceae mempunyai aktivitas sebagai antivirus Hepatitis C. (Mohanapriya et al., 2013).
Pada penelitian pendahuluan yang pernah dilakukan terhadap ekstrak etanol 80% herba S. dulcis menggunakan virus JFH1a pad sel Hepatosit Huh7it menunjukkan aktifitas sebagai antivirus Hepatitis C dengan IC50 sebesar 17,79 µg/ml, CC50 115,51 µg/ml,
Tanaman S.dulcis mempunyai familia Scrophulariaceae. Tanaman ini di Indonesia lebih dikenal dengan nama Jaka Tuwa.
Kandungan senyawa kimia yang terdapat pada tanaman S.dulcis
adalah kumarin, fenol, saponin, tannin, asam amino, flavonoid, terpenoid, dan katekolamin (Murti et al.,2012). Secara tradisional
tanaman S.dulcis digunakan untuk mengobati masalah lambung,
hipertensi, diabetes, bronkitis dan sebagai analgesik dan agen antipiretik (Murti., et al 2012). Pada studi literatur lain, tanaman S.dulcis aktif sebagai antiviral pada pengujian untuk virus Herpes Simplex type 1 (Murti., et al 2012).
Pada penelitian ini akan dilakukan fraksinasi terhadap ekstrak
etanol 80% herba S.dulcis berturut-turut menggunakan pelarut
diklorometana, etil asetat, dan butanol. Pemilihan pelarut tersebut didasarkan pada perbedaan polaritas dari non polar, semi polar, hingga polar. Sehingga diharapkan senyawa yang bersifat polar,
semipolar, maupun non polar pada tanaman S.dulcis dapat
terekstraksi secara maksimal.
Merujuk pada kandungan senyawa S.dulcis, penelitian
Skema Kerangka Konseptual
Gambar 3. 1Skema Kerangka Konseptua
Dasar Pemilihan :
Masalah kesehatan di dunia yang menyebabkan kematiaan jutaan orang di
seluruh dunia
Terapi Hepatis C
Obat modern Obat Alami
Obat –obatan meliputi :
Hasil fraksinasi dari ekstrak etanol 80% herba Scoparia dulcis memiliki
aktivitas sebagai anti-Hepatitis C Fraksinasi yang
28 BAB IV
METODE PENELITIAN
4.1 Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorik dan untuk mencapai tujuan penelitian ini, maka telah dilakukan tahapan penelitian sebagai berikut :
4.1.1 Ekstraksi dan fraksinasi herba Scoparia dulcis
Ekstraksi herba S.dulcis dilakukan dengan cara
ultrasonic-assisted extraction menggunakan pelarut etanol 80% dilanjutkan
dengan fraksinasi cair-cai
r menggunakan pelarut secara berturut-turut diklorometana, etil asetat, dan butanol.
4.1.2 Uji aktivitas antihepatitis C hasil fraksinasi dari ekstrak etanol 80% secara in-vitro
a. Persiapan sel dan virus
Sel huh7it dibudiyakan pada media Dulbecco’s modified Eagle’s
medium dilengkapi dengan fetal bovin serum, non essential
amino acids, dan kanamycin. Sel ditumbuhkan pada inkubator
5% CO2 37oC.
b. Persiapan bahan uji
serial pengenceran dengan medium sampai diperoleh 5 konsentrasi bahan uji : 100; 50; 25; 12,5; 6,25; 3,125 µg/ml. c. Uji aktivitas antihepatitis C
Uji aktivitas antihepatitis C in-vitro dilakukan pada 48-well plate dengan kepadatan sel (5x104 cells/well). Jumlah tetap virus JFH1a dengan nilai MOI (multiplication of infection) 0,1 (ffu)/cell (Wahyuni et al., 2012).
4.1.3 Uji toksisitas sel
Uji toksisitas terhadap sel dilakukan dengan metode
MTT-assay. Sel Huh7it pada 96-well plate dilakukan seri pengenceran
untuk ekstrak sampel atau kontrol (Wahyuni et al., 2012).
4.1.4 Pengamatan profil kromatogram ekstrak etanol 80% dan hasil fraksinasi dari ekstrak etanol 80% herba Scoparia dulcis
Pengamatan profil kromatogram menggunakan metode Kromatografi Lapis Tipis dengan menggunakan plat KLT fase normal dan terbalik.
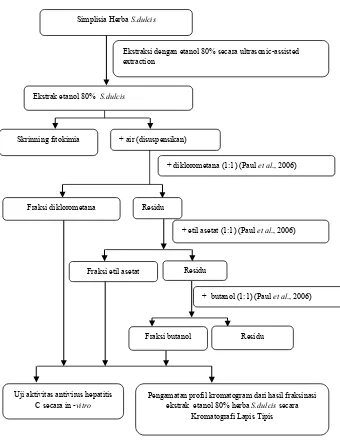
4.2 Sampel Penelitian
Sampel penelitian yaitu : ekstrak etanol 80% dan fraksi dari ekstrak etanol 80% herba S.dulcis. Secara umum skema rancangan penelitian sebagai berikut (Gambar 4.1):
Gambar 4. 1 Skema Rancangan Penelitian + air (disuspensikan)
Uji aktivitas antivirus hepatitis
C secara in -vitro Pengamatan profil kromatogram dari hasil fraksinasi ekstrak etanol 80% herba S.dulcis secara Kromatografi Lapis Tipis
Residu Fraksi butanol
Residu
+ etil asetat (1:1) (Paul et al., 2006)
Residu
+ butanol (1:1) (Paul et al., 2006) Simplisia Herba S.dulcis
Ekstrak etanol 80% S.dulcis
+ diklorometana (1:1) (Paul et al., 2006) Skrinning fitokimia
Fraksi etil asetat Fraksi diklorometana
4.3 Variabel Penelitian dan Definisi Operasional 4.3.1 Variabel Penelitian
1. Variabel bebas dalam penelitian ini adalah hasil fraksinasi dari
ekstrak etanol 80% herba S. dulcis2. Variabel Tergantung dalam penelitian ini aktivitas antivirus hepatitis C dengan berdasarkan nilai IC50 dan toksisitasnya
dengan berdasarkan nilai CC50
4.3.2 Definisi Operasional
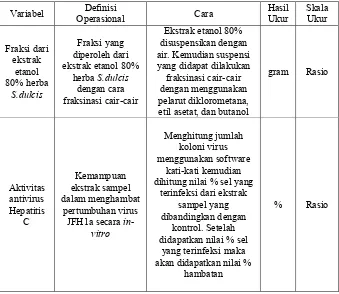
Tabel 4. 1 Definisi Operasional Penelitian
Variabel Operasional Definisi Cara Hasil Ukur Skala Ukur
Fraksi dari dihitung nilai % sel yang
Pada penelitian ini digunakan herba S.dulcis yang diperoleh dari daerah Hutan Lindung Sungai Wain Kota Balikpapan, Kalimantan Timur pada bulan September 2015 dan dideterminasi di LIPI Kebun Raya Purwodadi Pasuruan, Jawa Timur.
4.4.2 Bahan untuk ekstraksi, fraksinasi, dan skrinning fitokimia Bahan kimia yang digunakan pada penelitian ini adalah etanol 80% redistilasi, diklorometana p.a, etil asetat p.a, butanol p.a, kloroform p.a, asetonitril p.a, methanol p.a, aquadestilata, penampak noda H2SO4 10% dalam methanol.
4.4.3 Bahan virus dan sel
Sel Huh7it yang dikembangkan pada Dulbeco’s Modified
Eagle Medium (Wako, Osaka, Japan), virus JFH1a yang diperoleh
Medium (DMEM, GIBCO -Invitrogen) ditambah dengan 10% Fetal
Bovin Serum (FBS, GIBCO- Invitogen). Non-Essential Amino Acids
(NEAA, GIBCO –Invitrogen), 0,15 mg/ml larutan kanamycin (SIGMA), Dulbeco’s Phosphate Buffered Saline (DPBS, GIBCO-Invitrogen), Trypsin-EDTA (GIBCO-Invitrogen). Bovine Serum
Albumin (BSA, Roche), Formaldehyde (HCHO, Applicam),
TritonX-100 (Promega), 3,3’-diaminobenzidine (DAB) thermo
staining, HCV human patient anti-serum, HRP-Goat-anti-human Ig
(MBL), Phosphate Buffered Saline (PBS).
4.5 Instrumen Penelitian
4.5.1 Instrumen penelitian untuk ekstraksi, fraksinasi, dan skrinning fitokimia
Gunting, blender, ultrasonic SONICA. Rotavapor BUCHI, plat KLT Kieselgel 60 F254 (Merck), plat KLT Kieselgel 60 RP-18 F254
(Merck), chamber KLT CAMAG, pipa kapiler 2µl BLAUBRAND ,
TLC visualizer CAMAG , timbangan milligram dan gram, alat-alat
gelas.
4.5.2 Instrumen penelitian untuk uji aktivitas in-vitro dan uji toksisitas
Cell Titer 96 Aqueous Non-Radioactive Cell Proliferation
Assay (Promega), TC disk, tube ( 15 ml, dan 50 ml), pipet disposable
10 ml, 96-well plate, 48-well plate, U-type 96 well plate (Corning),
multichannel-pipette, pipette-man, micropipette (1000 µl, 3000 µl,
10 µl), vortex, sentrifuge, CO2 incubator, microscope inverted, 15 ml
4.6 Lokasi dan Waktu Penelitian
a. Ekstraksi dan fraksinasi tanaman dilakukan di Laboratorium NPMRD ITD Universitas Airlangga Surabaya
b. Uji aktivitas antihepatitis C dan uji toksisitas dilakukan di Laboratorium NPMRD ITD Universitas Airlangga Surabaya
4.7 Prosedur Penelitian
4.7.1 Pembuatan Ekstrak Etanol 80% Herba Scoparia dulcis
Herba S.dulcis dikeringkan pada suhu ruangan dengan cara diangin-anginkan hingga benar-benar kering (kadar air sedikit) terlebih dahulu. Setelah kering, kemudian dihaluskan dengan menggunakan mesin.
Ambil 1 bagian simplisia Herba S.dulcis (250 gram) kemudian dibagi lima bagian dengan masing-masing berat 50 gram dan diekstraksi dengan 200 ml pelarut etanol 80 %. Aduk sampai homogen lalu ultrasonifikasi selama 3x5 menit. Setelah itu diamkan selama 5 menit. Pisahkan maserat dengan cara filtrasi menggunakan corong dan kertas saring. Ulangi proses penyarian diatas sebanyak 3 kali dengan jumlah dan jenis pelarut yang sama. Kumpulkan maserat, uapkan pelarut dengan penguap tekanan rendah (rotavapor) hingga didapatkan ekstrak kental. Ekstrak kemudian dikeringkan dalam oven pada suhu 40o C. Selanjutnya ekstrak dapat digunakan
sebagai bahan uji.
4.7.2 Fraksinasi Ekstrak Etanol 80% Herba Scoparia dulcis
etil asetat, dan butanol. Sebelum dilakukan fraksinasi, ekstrak ditambah aquadestilata sebanyak 400 ml hingga terbentuk suspensi. Suspensi Herba S.dulcis dibagi menjadi 4 bagian yang sama dengan masing- masing volume 100 ml.
Masing-masing bagian kemudian difraksinasi cair-cair dengan diklorometana sebanyak 100 ml. Ulangi fraksinasi dengan jumlah pelarut yang sama sebanyak 4 kali hingga didapatkan fase diklorometana yang jernih. Kemudian pisahkan fase air dengan fase diklorometana. Fase air kemudian diuapkan hingga pelarut dikorometana yang tersisa di fase air hilang dan kemudian dilanjutkan fraksinasi berikutnya dengan etil asetat. Langkah yang sama dilakukan pada fraksinasi cair-cair dengan menggunakan etil asetat dan butanol. Fraksi diklorometana, fraksi etil asetat, fraksi butanol, dan fraksi air yang didapat kemudian dipekatkan dengan rotavapor hingga pelarut menguap. Setelah itu ekstrak dan masing-masing fraksi ditentukan aktivitas antivirus hepatitis C dan hitung IC50 serta dilakukan pengamatan profil kromatogram menggunakan
Kromatografi Lapis Tipis.
4.7.3 Pengamatan Profil Kromatogram Ekstrak dan Fraksi Etanol 80% Herba Scoparia dulcis secara Kromatografi Lapis Tipis
Pengamatan Profil Kromatogram secara Kromatografi Lapis Tipis (KLT) dilakukan dengan menngunakan lempeng kromatografi fase normal (Kieselgel GF254) dan lempeng kromatografi reversed
phase (Kieselgel 60 RP-18 F254). Pengamatan profil kromatogram
kloroform : metanol (9: 1) pada fase normal sedangkan asetonotril : metanol : air (1:2:2) pada reversed phase.
4.7.4 Uji Aktivitas Anti Hepatitis C secara in-vitro
4.7.4.1 Penyiapan sel (Menanam sel pada 48-well plate)
Semua langkah dilakukan di Biological Safety Cabinet (BSL2). Sel Huh 7it ditanam dalam complete medium DMEM yang terdiri dari : medium DMEM sebanyak 500 ml yang ditambah 10 % FBS 50 ml, 1xNEAA 5ml,0.15mg/ml kanamysin sebanyak 1,5 ml. Langkah kerja yang dilakukan untuk penanaman sel 48-well plate sebagai berikut :
a. Sel 90% confluent dalam (Petri disk) dikeluarkan dari inkubator CO2 37oC.
b. Medium lama dituang dari (Petri disk) pada tempat pembuangan.
c. DBPS steril dipipet 10 ml dan dimasukkan ke dalam cawan (Petri disk) dengan cara digoyang-goyangkan untuk mencuci sel dan secara hati-hati PBS dituang ke tempat pembuangan. d. Larutan Trypsin-EDTA ditambahkan 1 ml ke dalam disk dan
digoncangkan secara perlahan hingga seluruh bagian dasar terkena laruatan Trypsin-EDTA.
e. Disk ditempatkan pada inkubator 37oC selama 4 menit sampai
sel-sel hepatosit terlepas dari disk.
f. Segera ditambahkan 6 ml medium ke dalam disk (untuk mencuci EDTA dan mengambil sel).
h. Supernatan dibuang pada tempat pembuangan, pellet sel disuspensikan dalam 10 ml medium kultur DMEM (disuspensikan berulang-ulang hingga homogen).
i. Lakukan perhitungan kepadatan sel Huh7it, diambil kurang lebih 10µl dan letakkan pada block digital hemositometer. Amati dibawah mikroskop dengan perbesaran 100x.
Perhitungan sel Huh7it sebagai berikut : Jumlah sel = 393 sel/4
= 98,25 x 104 ml
Apabila ingin kepadatan sel 5,4 x 104 ml (pada 48-well plate)
maka tiap well akan diisi sebanyak 55 µl suspensi sel Huh7it. 5,4 x 104 ml / 98,25 x 104 ml = 0,0549 ml = 55 µl
Menghitung volume medium dan suspensi sel yang akan ditambahkan dalam 48-well plate :
Sel suspensi 55x60 = 3300 µl Volume total 200 X 60 = 12000 µl
Maka medium yang perlu ditambahkan adalah 8700 µl j. Dipipet complete DMEM dan Sel Huh7it sebanyak volume
sel yang dikehendaki ke dalam tube 50 ml sesuai perbandingan yang dikehendaki.
k. Sel di seeding di 48 well-plate menggunakan 8-multichannel
pipette, jumlah per well 200µl.
l. Diinkubasi selama 24 jam pada inkubator CO2 37oC.
4.7.4.2 Uji anti-HCV
4.7.4.2.1 Penyiapan Sampel Tanaman
Hasil fraksinasi ekstrak etanol 80% herba S.dulcis dimasukkan ke dalam tube 2 ml kemudian ditambahkan 10x DMSO (Dojindo, Japan) ke dalam tube untuk memperoleh 100.000 ppm. Ekstrak dilarutkan dengan vortex mixer dan sonikator. Ekstrak sampel di dalam tube disimpan pada -30oC sampai sampel digunakan
untuk uji toksisitas dan tes anti HCV.
4.7.4.2.2 Persiapan sampel ekstrak 2x konsentrasi
a. Sampel yang telah larut dalam DMSO (dipersiapkan pada langkah 2) diambil dari pendingin -30oC dan dicairkan pada
suhu ruang.
b. Setelah mencair, larutan persediaan (larutan stok) dihomogenkan dengan vortex.
c. Dibuat pengenceran pada 2x lebih tinggi dari konsentrasi yang digunakan di uji anti HCV (200;50;25;12,5;6,25;3,125 µg/ml) menggunakan tipe-U 96 well plate.
Catatan :Setiap sampel yang berbeda selalu menggunakan tip yang berbeda (tip harus diganti).
4.7.4.2.3 Persiapan 2x seri pengenceran
Final konsentrasi : (100 ; 50 ; 25 ; 12,5 ; 6,25 ; 3,125 µg/ml) Konsentrasi preparasi : (200 ; 50 ; 25 ; 12,5 ; 6,25; 3,125 µg/ml)
Stok sampel 100.000 ppm m1.v1 = m2.v2
a. Masing-masing stok ekstrak sampel diambil sebanyak 2,6 µl dan ditambah medium DMEM 1300 µl pada tube 2 ml. Kemudian sampel di vortex sehingga akan didapatkan konsentrasi yang baru 200 µg/ml.
b. Serial dilution preparation (2x konsentrasi) : Konsentrasi awal
µg/ml Pengenceran Konsentrasi (µg/ml) 200 150µl dari stok 200 µg/ml 200 200 75µl ekstrak + 75µl DMEM 100 100 75µl ekstrak + 75µl DMEM 50
50 75µl ekstrak + 75µl DMEM 25 25 60µl ekstrak + 60µl DMEM 12,5 12,5 40µl ekstrak + 40µl DMEM 6,25 6,25 40µl ekstrak + 40µl DMEM 3,125
4.7.4.2.4 Penyiapan Larutan Virus
Perhitungan larutan virus yang dibutuhkan : M.O.I = 0,1 , MOI = jumlah virus/jumlah sel = 0,1
Jumlah sel = 5,2 x 104 sel/well (jumlah sel pada 24 jam setelah
seeding sel)
FFU = 0,1 x 5,2 x 104
= 5,3 x 103 ffu
Konsentrasi stok virus = 1,5 x 107 ffu/ml
0,35 x 80 = 28 µl virus 54,65 x 80 = 4372 µl DMEM
28 µl stok virus diencerkan dengan 4372 µl DMEM
a. Tube stok (persediaan) virus dari -80oC diambil dan dicairkan
secara cepat dan diletakkan dalam kotak yang berisi es. b. Tube tersebut divortex .
c. Virus diencerkan dengan ekstrak sebagaimana berikut (Tabel 4.2).
d. Dari larutan konsentrasi akhir dimasukkan dalam 48-well
plate tipe-U sebagaimana berikut (Tabel 4.2).
Konsentrasi 4.7.4.2.5 Pencampuran Virus dan Sampel
Sebanyak 55 µl dari sampel ekstrak 2x (pada langkah 3) dicampurkan dengan 55 µl larutan virus (pada langkah 4) ke dalam
96-well plate tipe U dengan menggunakan 8-multichannel pipette
4.7.4.2.6 Penambahan Campuran Virus dan Sampel Ekstrak ke dalam Sel Huh7it
a. 48-well plate dikeluarkan dari inkubator CO2 37oC.
b. Medium kultur yang terdapat pada setiap well dibuang dan diganti dengan 110µl campuran dari virus dan sampel ekstrak. c. Pemindahan dilakukan dari dosis kecil ke besar.
d. 48-well plate diinkubasi selama 2 jam pada inkubator CO2
37oC.
4.7.4.2.7Pencucian wells
a. 48-well plate yang telah diinkubasi selama 2 jam, dikeluarkan
dari inkubator CO2.
b. Inokulum virus dibuang dan sel yang terinfeksi dicuci sebanyak 2 kali masing-masing dengan 200 µl DMEM. c. Setelah pencucian wells sebanyak 2 kali, DMEM yang
mengandung sampel ekstrak pada konsentrasi 100 µg/ml; 50 µg/ml; 25 µg/ml; 12,5 µg/ml; 6,25 µg/ml; 3,125 µg/ml sebanyak masing-masing 400 µl dimasukkan ke dalam well d. Inkubasi pada inkubator 37oC selama 48 jam.
Overlay laruatan ekstrak dari 200µg/ml stok ekstrak : Konsentrasi awal
25 230µl ekstrak + 690µl DMEM 6,25 12,5 230µl ekstrak + 690µl DMEM 3,125
4.7.4.3 Pemanenan Supernatan Kultur Pada 48 jam Setelah Infeksi: Untuk supernatan kultur :
a. Supernatan kultur dipanen sebanyak 400 µl pada setiap
well dan dimasukkan ke dalam tube 1,5 ml.
b. Tube disentrifuse pada 12.000 rpm selama 4 menit, 4oC
(untuk memisahkan supernatan virus dan debris virus). c. Supernatan diambil jangan sampai medium habis dan
dipindahkan ke tube yang baru (pemindahan dilakukan pada kotak berisi es untuk menjaga titernya).
d. Disimpan pada suhu -80oC sampai nanti dilakukan titrasi
virus.
4.7.4.4 Penyiapan Sel untuk Titrasi Virus dan Uji Toksisitas
Pada 20-24 jam sebelum inokulasi virus, sel Huh 7it di
seeding ke dalam 96-well plate (2,3x104sel/well) dan diinkubasi
dalam inkubator CO2 37oC.
Langkah-langkah penyiapan sel sebagai berikut :
a. Sel 90% confluent (Petri disk) dikeluarkan dari inkubator CO2 37oC.
c. DBPS steril dipipet 10 ml dan dimasukkan ke dalam (disk) untuk mencuci sel dan secara hati-hati PBS dituang ke tempat pembuangan.
d. Larutan Trypsin-EDTA ditambahkan 1-2 ml ke dalam disk dan digoncangkan secara perlahan hingga seluruh bagian dasar terkena larutan Trypsin-EDTA.
e. Disk ditempatkan pada inkubator CO2 37oC.selama 4 menit
sampai sel-sel hepatosit terlepas dari disk.
f. Segera ditambahkan 6 ml medium ke dalam disk (untuk mencuci EDTA dan mengambil sel).
g. Disuspensikan dengan menggunakan mikropipet kemudian sentrifuse 1200 rpm selama 4 menit.
h. Supernatan dipindahkan ke dalam tempat pembuangan, pellet sel disuspensikan dalam 10 ml medium kultur (DMEM) (disuspensikan berulang-ulang hingga homogen).
i. Diambil 10 µl dan diletakkan di hemositometer untuk menghitung sel Huh7it dengan melihatnya dibawah mikroskop. Sel akan terlihat jelas pada perbesaran 100x. Perhitungan sel Huh7it sebagai berikut :
Sel suspensi 19,8x300 = 5940µl
Kadar yang diinginkan 100 x 300 = 30.000 µl
Maka medium yang perlu ditambahkan adalah 24060 µl j. DMEM sebanyak yang telah dihitung melalui perhitungan
seperti di atas dimasukkan ke dalam tube 50 ml dan ditambahkan dengan suspensi sel sebanyak yang dibutuhkan . Kemudian Tube divortex.
k. Dimasukkan ke dalam 96-well plate sebanyak 100 µl/well dengan menggunakan 8-multichannel pipette .
l. 96-well plate diinkubasi dalam inkubator CO2 37oC selama 24
jam.
4.7.4.5 Check titer virus
a. Tube supernatan kultur dikeluarkan dari -80oC dan dicairkan
pada suhu ruang.
b. Setelah mencair, supernatan divortex sebentar (1-2 detik) dan diletakkan di kotak yang berisi es.
c. Supernatan kultur diencerkan dengan DMEM (15x pengenceran) yakni dipipet sebanyak 8 µl supernatan kultur dan ditambahkan dengan 112 µl DMEM masukkan pada setiap well.
d. Inkubasi selama 4 jam.
e. Setelah diinkubasi selama 4 jam, supernatant residu dibuang dan segera ditambahkan dengan complete DMEM sebanyak 400 µl/well.
4.7.4.6 Fiksasi dan Pewarnaan (Staining) Sel yang Terinfeksi Virus Pembuatan larutan yang dibutuhkan untuk fiksasi dan staining (pewarnaan) :
a. PBS 1x
- Dipipet 40 ml PBS 10x dan dimasukkan ke dalam botol. - Ditambahkan dengan 360 ml aquadest dan dikocok sampai
homogen. b. Formalin 3,7 %
- Dipipet 10 ml formaldehida 37 % dan dimasukkan ke dalam botol.
- Ditambahkan dengan PBS 1x sebanyak 90 ml dan dikocok. c. Triton 0,5 %
- Dipipet 50 µl TritonX-100 dan dimasukkan ke dalam botol. - Ditambahkan dengan 9950 µl PBS 1x dan dikocok sampai
homogen.
d. Larutan untuk Antiserum pasien HCV (Ab1) dan HRP-Goat anti
human Ig antibody (Ab2)
Volume total larutan untuk Anti serum pasien HCV (Ab1) dan
Goat anti human Ig antibody (Ab2) :
100 x 120 µl = 12.000 µl
BSA 1% dibuat dari BSA 10% yakni 1/10 x 12.000 = 1200 µl (BSA 10%)
Block ACE 2% dibuat dari Block ACE 4% yakni 2/4 x 12.000 µl = 6000 µl (Block ACE 4%)
Total volume = 1200 µl + 6000 µl = 7200 µl