LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. COMBIPHAR
JL. RAYA SIMPANG NO.383 PADALARANG, BANDUNG
PERIODE 16 JANUARI 2012-10 FEBRUARI 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
ISNA INAWATI ASIH, S.Farm.
1106047013
ANGKATAN LXXIV
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER-DEPARTEMEN FARMASI
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT.COMBIPHAR
JL. SIMPANG RAYA NO.383 PADALARANG, BANDUNG
PERIODE 16 JANUARI 2012-10 FEBRUARI 2012
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
ISNA INAWATI ASIH, S.Farm.
1106047013
ANGKATAN LXXIV
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
PROGRAM PROFESI APOTEKER-DEPARTEMEN FARMASI
DEPOK
JUNI 2012
Puji syukur kepada sumber segala kebenaran dan ilmu pengetahuan, Tuhan Yang Maha Esa, karena atas segala rahmat-Nya penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker di PT. Combiphar yang dilaksanakan mulai tanggal 16 Januari hingga 10 Februari 2012.
Laporan ini merupakan hasil Praktek Kerja Profesi Apoteker (PKPA) yang dilaksanakan di PT. Combiphar dan disusun sebagai salah satu syarat untuk menyelesaikan Program Profesi Apoteker di Departemen Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
Pada kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Drs. H. Husni Azhar, MBA, sebagai Plant Manager PT. Combiphar serta sebagai pembimbing yang telah mengarahkan dan memberi bimbingan selama praktek kerja berlangsung.
2. Bapak Maman Suhendar, Ssi., Apt., selaku koordinator PKPA yang telah memberikan kesempatan untuk melaksanakan kerja praktek di PT.Combiphar.
3. Ibu Prof. Dr. Yahdiana Harahap, M.S., Apt., selaku Ketua Departemen Farmasi FMIPA Universitas Indonesia.
4. Bapak Dr. Harmita, Apt., sebagai Ketua Program Profesi Apoteker Departemen Farmasi FMIPA Universitas Indonesia.
5. Ibu Dr. Silvia Surini, M.Pharm.Sc., Apt., sebagai pembimbing PKPA dari Program Pendidikan Profesi Apoteker Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia yang telah memberikan bimbingan, pengarahan dan bantuan selama melakukan PKPA ini.
6. Karyawan dan staf PT. Combiphar yang telah membantu dalam pelaksanaan dan penyusunan laporan Praktek Kerja Profesi Apoteker ini. 7. Bapak dan Ibu staf pengajar beserta segenap karyawan Departemen
Farmasi FMIPA UI.
8. Orang tua serta kakak yang selalu memberi dukungan, semangat dan doa kepada penulis.
10. Semua teman- teman Program Profesi Apoteker angkatan 74 serta semua pihak yang telah memberikan bantuan dan semangat kepada penulis selama pelaksanaan PKPA ini.
Penulis menyadari bahwa dalam penulisan laporan PKPA ini masih banyak terdapat kekurangan dan kesalahan. Kami berharap semoga pengetahuan dan pengalaman yang kami peroleh selama menjalani kerja praktek profesi apoteker ini dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang memerlukan.
Depok, Juni 2012
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv DAFTAR ISI ... vi 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian ... 2 2. TINJAUAN UMUM ... 3 2.1 Industri Farmasi ... 3
2.1.1 Persyaratan Usaha Industri Farmasi ... 3
2.1.2 Pencabutan Izin Usaha Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 4
2.2.1 Manajemen Mutu ... 5
2.2.2 Personalia ... 6
2.2.3 Bangunan dan Fasilitas ... 7
2.2.4 Peralatan ... 7
2.2.5 Sanitasi dan Higiene ... 8
2.2.6 Produksi ... 9
2.2.7 Pengawasan Mutu ... 14
2.2.8 Inspeksi Diri dan Audit Mutu ... 16
2.2.9 Penanganan Keluhan terhadap Produk, Penarikan Produk dan Produk Kembalian ... 17
2.2.10 Dokumentasi ... 18
2.2.11 Pembuatan dan Analisis berdasarkan Kontrak ... 19
2.2.12 Kualifikasi dan Validasi ... 20
3. TINJAUAN KHUSUS ... 23
3.1 Lokasi PT. Combiphar ... 23
3.2 Sejarah Perkembangan PT. Combiphar ... 23
3.3 Visi dan Misi ... 24
3.4 Sarana Fisik dan Sarana Penunjang ... 24
3.4.1 Sarana dan Prasarana Fisik... 24
3.4.2 Sarana Penunjang ... 25
3.5 Struktur Organisasi ... 26
3.5.1 Produksi ... 26
3.5.2 Quality Assurance ... 33
3.5.3 Administrasi dan Keuangan ... 40
3.5.4 Bagian HRD-GA (Human Resource Development-General Affair) .. 41
3.5.5 Product Development ... 42
3.5.6 Supply Chain Manager ... 45
4.3 Bangunan dan Fasilitas ... 55
4.4 Peralatan ... 56
4.5 Sanitasi dan Higiene ... 57
4.6 Produksi ... 58
4.7 Pengawasan Mutu ... 59
4.8 Inspeksi Diri dan Audit Mutu ... 60
4.9 Penanganan Keluhan terhadap Produk, Penarikan Produk dan Produk Kembalian ... 61
4.10 Dokumentasi ... 63
4.11 Pembuatan dan Analisis berdasarkan Kontrak ... 64
4.12 Kualifikasi dan Validasi ... 64
5. KESIMPULAN DAN SARAN ... 66
5.1 Kesimpulan ... 66
1.1 Latar belakang
Pembangunan kesehatan nasional pada hakikatnya bertujuan untuk meningkatkan kesadaran, kemauan dan kemampuan hidup sehat bagi setiap orang agar terwujud derajat kesehatan masyarakat yang setinggi-tingginya, sebagai investasi bagi pembangunan sumber daya manusia yang produktif secara sosial dan ekonomis. Salah satu fokus dari pembangunan di bidang kesehatan yaitu tercapainya pelayanan kesehatan yang baik (UU Kesehatan Nomor 32, 2009).
Dalam mendukung pelayanan kesehatan yang optimal, diperlukan perbekalan kesehatan, dalam hal ini obat menjadi salah satu elemen dasar. Peranan penting dipegang oleh industri farmasi untuk menjamin produk obat sesuai dengan tujuan penggunaan, memenuhi persyaratan yang berlaku dan tidak membahayakan konsumen karena keamanan (safety), mutu (quality), dan kemanjuran (efficacy) yang tidak memenuhi syarat. Mutu obat harus dibentuk sejak awal mulai dari penanganan starting material, proses produksi (pengolahan dan pengemasan), penyimpanan dan distribusi obat. Jaminan bahwa suatu obat yang diproduksi oleh industri farmasi bermutu tinggi adalah melalui penerapan Cara Pembuatan Obat yang Baik (Badan Pengawas Obat dan Makanan, 2006).
Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.1799/Menkes/Per/XII/2010 tentang Industri Farmasi, industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Untuk dapat menghasilkan obat yang memiliki spesifikasi sesuai dengan penggunaannya, maka industri farmasi harus mengikuti peraturan sesuai Keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988, semua pabrik farmasi harus mengacu pada pedoman Cara Pembuatan Obat yang Baik (CPOB).
Dalam penerapan CPOB dibutuhkan sarana dan prasarana yang menunjang pelaksanaan CPOB serta sumber daya manusia yang berkualitas, salah satunya apoteker yang memegang peran penting dalam industri farmasi. Untuk menghasilkan tenaga farmasis yang profesional dibutuhkan dukungan dan peran aktif dari berbagai pihak seperti perguruan tinggi farmasi, organisasi profesi, industri farmasi, rumah
sakit dan pemerintah dalam pembekalan yang menyeluruh secara teori dan praktek sebagai aplikasi ilmu dan teknologi kefarmasian. Pembekalan berupa praktek kerja secara langsung sangat diperlukan untuk mendapatkan gambaran mengenai fungsi dan tanggung jawab farmasis di suatu institusi seperti industri farmasi.
Oleh karena itu, Program Profesi Apoteker Departemen Farmasi Universitas Indonesia bekerjasama dengan PT. Combiphar menyelenggarakan Praktek Kerja Profesi Apoteker (PKPA) pada tanggal 16 Januari 2012 sampai tanggal 10 Februari 2012. Praktek kerja ini diharapkan dapat memberikan pengetahuan praktis dengan melihat dan terlibat langsung dalam pekerjaan kefarmasian di industri farmasi.
1.2 Tujuan
Praktek Kerja Profesi Apoteker (PKPA) yang dilaksanakan di PT. Combiphar ini bertujuan untuk:
1. Mengamati dan memahami penerapan Cara Pembuatan Obat yang Baik (CPOB) yang dilakukan PT. Combiphar.
2. Mengamati peranan apoteker dalam industri farmasi sehingga dapat dibandingkan dengan teori yang diperoleh selama masa perkuliahan dan menjadi bekal untuk menghadapi dunia kerja yang sesungguhnya.
2.1 Industri Farmasi
Berdasarkan Surat Keputusan Menteri Kesehatan Republik Indonesia No.1799/Menkes/Per/XII/2010 tentang Industri Farmasi, industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat.
2.1.1 Persyaratan Usaha Industri Farmasi
Usaha industri farmasi wajib memenuhi persyaratan sesuai dengan Surat Keputusan Menteri Kesehatan Republik Indonesia No.1799/Menkes/Per/XII/2010 yaitu sebagai berikut:
a. Berbadan usaha berupa perseroan terbatas.
b. Memiliki rencana investasi dan kegiatan pembuatan obat. c. Memiliki Nomor Pokok Wajib Pajak.
d. Memiliki secara tetap paling sedikit 3 (tiga) orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi, dan pengawasan mutu.
e. Komisaris dan direksi tidak pernah terlibat, baik langsung atau tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
2.1.2 Pencabutan Izin Usaha Industri Farmasi
Izin usaha industri farmasi dapat dicabut dalam hal (Daris, 2008):
a) Perusahaan industri farmasi yang telah mendapat izin usaha industri farmasi melakukan pemindahtanganan hak milik Izin Usaha Industri Farmasi dan perluasan tanpa memiliki izin sesuai dengan ketentuan dalam Surat Keputusan ini; dan atau
b) Perusahaan industri farmasi yang telah mendapat izin usaha industri farmasi tidak menyampaikan informasi industri farmasi secara berturut-turut 3 (tiga) kali atau dengan sengaja menyampaikan informasi yang tidak benar; dan atau
c) Perusahaan industri farmasi yang telah mendapat izin usaha industri farmasi melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis terlebih dahulu dari menteri; dan atau
d) Perusahaan industri farmasi yang telah mendapat izin usaha industri farmasi dengan sengaja memproduksi obat jadi atau bahan baku obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku, obat palsu; dan atau e) Tidak dipenuhinya ketentuan dalam izin usaha industri farmasi yang
ditetapkan dalam surat keputusan.
2.2 Cara Pembuatan Obat yang Baik (CPOB)
CPOB adalah bagian dari pemastian mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan dipersyaratkan dalam izin edar dan spesifikasi produk (BPOM, 2006).
CPOB mencakup produksi dan pengawasan mutu. Persyaratan dasar dari CPOB adalah (BPOM, 2006):
1. Semua proses pembuatan obat dijabarkan dengan jelas, dikaji secara sistematis berdasarkan pengalaman dan terbukti mampu secara konsisten menghasilkan obat yag memenuhi persyaratan mutu dan spesifikasi yang telah ditetapkan.
2. Tahap proses yang kritis dalam pembuatan, pengawasan proses dan sarana penunjang, serta perubahannya yang signifikan divalidasi.
3. Tersedia semua sarana yang diperlukan dalam CPOB, termasuk: Personil yang terkualifikasi dan terlatih.
Bangunan dan sarana dengan luas yang memadai. Peralatan dan sarana penunjang yang sesuai. Bahan, wadah dan label yang benar.
Prosedur dan instruksi yang disetujui
Tempat penyimpanan dan transportasi yang memadai
4. Prosedur dan instruksi ditulis dalam bentuk instruksi dengan bahasa yang jelas, tidak bermakna ganda, dapat diterapkan secara spesifik pada sarana yang tersedia.
6. Pencatatan dilakukan secara manual atau dengan alat pencatat selama pembuatan yang menunjukkan bahwa semua langkah yang dipersyaratkan dalam prosedur dan instruksi yang ditetapkan benar-benar dilaksanakan dan jumlah serta mutu produk yang dihasilkan sesuai dengan yang diharapkan. 7. Catatan pembuatan termasuk distribusi yang memungkinkan penelusuran
riwayat bets lengkap, disimpan secara komprehensif dan dalam bentuk yang mudah diakses.
8. Penyimpanan dan distribusi obat yang dapat memperkecil risiko terhadap mutu obat.
9. Tersedia sistem penarikan kembali bets obat manapun dari peredaran. Keluhan terhadap produk yang beredar dikaji, penyebab cacat mutu diinvestigasi serta dilakukan tindakan perbaikan yang tepat dan pencegahan pengulangan kembali keluhan.
2.2.1 Manajemen Mutu
Industri Farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen mutu bertanggung jawab untuk pencapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan manajemen mutu yang didesain secara menyeluruh dan diterapkan secara benar (BPOM, 2006).
Unsur dasar manajemen mutu adalah:
- Suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya; dan
- Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut Pemastian Mutu. Semua bagian sistem pemastian mutu hendaklah didukung dengan tersedianya personil
yang kompeten, bangunan dan sarana serta peralatan yang cukup dan memadai.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh karena itu, industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan (BPOM, 2006).
Industri farmasi hendaklah memiliki personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai. Tiap personil tidak dibebani tanggung jawab yang berlebihan untuk menghindari risiko terhadap mutu obat. Selain itu, diperlukan struktur organisasi serta tugas spesifik dan kewenangan dari personil pada posisi penanggungjawab hendaklah dicantumkan dalam uraian tugas tertulis. Tugas mereka boleh didelegasikan kepada wakil yang ditunjuk serta mempunyai tingkat kualifikasi yang memadai. Hendaklah aspek penerapan CPOB tidak ada yang terlewatkan ataupun tumpang tindih dalam tanggung jawab yang tercantum pada uraian tugas (BPOM, 2006).
Personil kunci mencakup Kepala Bagian Produksi, Kepala Bagian Pengawasan Mutu dan Kepala Bagian Manajemen Mutu (Pemastian Mutu). Posisi utama tersebut dijabat oleh personil purnawaktu. Kepala Bagian Produksi dan Kepala Bagian Manajemen Mutu (Pemastian Mutu) atau Kepala Bagian Pengawasan Mutu harus independen satu terhadap yang lain (BPOM, 2006).
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau laboratorium (termasuk personil teknik, perawatan dan petugas kebersihan), dan bagi personil lain yang kegiatannya berdampak pada mutu produk. Di samping pelatihan dasar dalam teori dan praktik CPOB, personil baru hendaklah mendapat pelatihan sesuai dengan tugas yang diberikan. Pelatihan
berkesinambungan hendaklah juga diberikan, dan efektivitas penerapannya hendaklah dinilai secara berkala. Hendaklah tersedia program pelatihan yang disetujui kepala bagian masing-masing. Catatan pelatihan hendaklah disimpan (BPOM, 2006).
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran dan dampak lain yang dapat menurunkan mutu obat (BPOM, 2006).
Sarana pendukung berupa ruang istirahat dan kantin hendaklah dipisahkan dari area produksi dan laboratorium pengawasan mutu. Sarana untuk mengganti pakaian kerja, membersihkan diri dan toilet hendaklah disediakan dalam jumlah yang cukup dan mudah diakses. Toilet tidak boleh berhubungan langsung dengan area produksi atau area penyimpanan. Ruang ganti pakaian hendaklah berhubungan langsung dengan area produksi namun letaknya terpisah (BPOM, 2006).
2.2.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan. Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat memengaruhi identitas, mutu atau kemurnian produk.
Kegiatan perbaikan dan perawatan hendaklah tidak menimbulkan risiko terhadap mutu produk. Pelaksanaan perawatan dan pemakaian suatu peralatan utama hendaklah dicatat dalam buku log alat yang menunjukkan tanggal, waktu,
produk, kekuatan dan nomor setiap bets atau lot yang diolah dengan alat tersebut. Catatan untuk peralatan yang digunakan khusus untuk satu produk saja dapat ditulis dalam catatan bets.
Peralatan hendaklah ditempatkan sedemikian rupa untuk memperkecil kemungkinan terjadinya pencemaran silang antar bahan di area yang sama. Peralatan hendaklah dipasang sedemikian rupa untuk menghindari risiko kekeliruan atau pencemaran. Peralatan satu sama lain hendaklah ditempatkan pada jarak yang cukup untuk menghindari kesesakan serta memastikan tidak terjadi kekeliruan dan campur-baur produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan segala sesuatu yang dapat menjadi sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu (BPOM, 2006).
2.2.5.1 Higiene Perorangan
Tiap personil yang masuk ke area pembuatan hendaklah mengenakan pakaian pelindung yang sesuai dengan kegiatan yang dilaksanakannya.
Prosedur higiene perorangan termasuk persyaratan untuk mengenakan pakaian pelindung hendaklah diberlakukan bagi semua personil yang memasuki area produksi, baik karyawan purna waktu, paruh waktu atau bukan karyawan yang berada di area pabrik, misalnya karyawan kontraktor, pengunjung, anggota manajemen senior dan inspektur (BPOM, 2006).
2.2.5.2 Sanitasi Bangunan dan Fasilitas
Bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik.
Hendaklah tersedia dalam jumlah yang cukup sarana toilet dengan ventilasi yang baik dan tempat cuci bagi personil yang letaknya mudah diakses dari area pembuatan (BPOM, 2006).
2.2.5.3 Pembersihan dan Sanitasi Peralatan
Setelah digunakan, peralatan hendaklah dibersihkan baik bagian luar maupun bagian dalam sesuai dengan prosedur yang telah ditetapkan, serta dijaga dan disimpan dalam kondisi yang bersih. Tiap kali sebelum dipakai, kebersihannya diperiksa untuk memastikan bahwa semua produk atau bahan dari bets sebelumnya telah dihilangkan (BPOM, 2006).
2.2.5.4 Validasi Prosedur Pembersihan dan Sanitasi
Prosedur pembersihan, sanitasi dan higiene hendaklah divalidasi dan dievaluasi secara berkala untuk memastikan efektivitas prosedur memenuhi persyaratan (BPOM, 2006).
2.2.6 Produksi
Produksi yang dilaksanakan harus sesuai dengan prosedur yang telah ditetapkan dan memenuhi ketentuan Cara Pembuatan Obat yang Baik (CPOB) sehingga menjamin produk yang dihasilkan memenuhi persyaratan mutu dan memenuhi ketentuan izin pembuatan dan izin edar (registrasi). Produksi dilakukan dan diawasi oleh personil yang kompeten. Segala proses yang terjadi dalam produksi harus dicatat. Terdapat beberapa hal penting yang harus diperhatikan dalam produksi, yaitu pengadaan bahan awal, validasi proses, pencegahan pencemaran silang, sistem penomoran bets atau lot, penimbangan dan penyerahan, pengembalian, pengolahan, kegiatan pengemasan, pengawasan selama proses, serta karantina dan penyerahan produk jadi (BPOM, 2006).
2.2.6.1 Pengadaan Bahan Awal
Pengadaan bahan awal hendaknya hanya berasal dari pemasok yang disetujui dan memenuhi spesifikasi yang relevan. Semua penerimaan, pengeluaran dan jumlah bahan tersisa hendaknya dicatat. Catatan berisi keterangan mengenai
pasokan, nomor bets atau lot, tanggal penerimaan atau penyerahan, tanggal pelulusan dan tanggal kadaluwarsa bila ada (BPOM, 2006).
Sebelum diluluskan untuk digunakan, tiap bahan awal hendaknya memenuhi spesifikasi dan diberi label dengan nama yang dinyatakan dalam spesifikasi. Bahan awal yang diterima hendaknya dikarantina sampai disetujui dan diluluskan untuk pemakaian oleh kepala bagian Pengawasan Mutu (BPOM, 2006).
Pada tiap penerimaan bahan awal hendaknya dilakukan pemeriksaan visual tentang kondisi umum, keutuhan wadah, segel, ceceran, kemungkinan adanya kerusakan bahan serta kesesuaian catatan pengiriman dengan label dari pemasok. Bahan awal yang terdapat di area penyimpanan diberi label yang memuat keterangan paling sedikit mengenai nama bahan dan bila perlu nomor kode bahan, nomor bets atau kontrol yang diberikan pada saat penerimaan bahan, status bahan, tanggal kadaluwarsa (BPOM, 2006).
Penyerahan bahan awal untuk produksi hendaknya dilakukan hanya oleh personil yang berwenang sesuai dengan prosedur yang telah disetujui. Semua bahan awal yang ditolak hendaklah diberi penandaan yang mencolok, ditempatkan terpisah dan dimusnahkan atau dikembalikan kepada pemasoknya (BPOM, 2006).
2.2.6.2 Validasi Proses
Sebelum suatu Prosedur Pengolahan Induk diterapkan, hendaklah diambil langkah untuk membuktikan prosedur tersebut cocok untuk pelaksanaan produksi rutin dan proses yang telah ditetapkan dengan menggunakan bahan dan peralatan yang telah ditentukan akan senantiasa menghasilkan produk yang memenuhi persyaratan mutu. Perubahan yang berarti dalam proses, peralatan atau bahan hendaklah disertai dengan tindakan validasi ulang untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang memenuhi persyaratan mutu (BPOM, 2006).
2.2.6.3 Pencegahan Pencemaran Silang
Pencemaran bahan awal atau produk oleh bahan atau produk lain harus dihindarkan. Tingkat resiko pencemaran silang tergantung dari jenis pencemar
dan produk tercemar. Pencemar yang paling berbahaya adalah bahan yang dapat menimbulkan sensitisasi kuat, preparat biologis yang mengandung mikroba hidup, hormon, bahan sitotoksik dan bahan lain yang berpotensi tinggi. Produk yang paling terpengaruh oleh pencemaran adalah sediaan parenteral, sediaan yang diberikan dalam dosis besar dan atau sediaan yang diberikan dalam jangka panjang (BPOM, 2006).
Pencemaran silang dapat dihindari dengan tindakan teknis atau pengaturan yang tepat, misalnya produksi di dalam gedung terpisah (untuk produk seperti penisillin, hormon seks, sitotoksik, vaksin hidup, sediaan yang mengandung bakteri hidup, produk biologi lain dan produk darah), tersedia ruang penyangga udara dan penghisap udara, memperkecil resiko pencemaran yang disebabkan udara yang disirkulasi ulang atau masuknya udara yang tidak diolah atau udara diolah secara tidak memadai, memakai pakaian pelindung yang sesuai di area dimana produk yang beresiko tinggi terhadap pencemaran silang diproses, melaksanakan prosedur pembersihan dan dekontaminasi yang efektif, menggunakan sistem self contained dan pengujian residu dan menggunakan label status kebersihan alat (BPOM, 2006).
2.2.6.4 Sistem Penomoran Bets atau Lot
Hal ini bertujuan untuk memastikan bahwa tiap bets atau lot produk antara, produk ruahan atau produk jadi dapat diidentifikasi. Sistem penomoran bets atau lot yang digunakan pada tahap pengolahan dan pengemasan hendaklah saling berkaitan dan menjamin bahwa nomor bets atau lot yang sama tidak dipakai secara berulang (BPOM, 2006).
2.2.6.5 Penimbangan dan Penyerahan
Penimbangan dan penyerahan bahan awal, bahan pengemas, produk antara dan produk ruahan dianggap sebagai bagian dari siklus produksi dan memerlukan dokumentasi yang lengkap. Hanya bahan awal, bahan pengemas, produk antara dan produk ruahan yang telah diluluskan oleh Pengawasan Mutu dan masih belum kadaluwarsalah yang boleh diserahkan (BPOM, 2006).
Bahan awal, produk antara dan produk ruahan yang terkait satu bets yang dapat ditempatkan dalam area penyerahan untuk menghindari terjadinya campur baur dan pencemaran silang. Sebelum penimbangan dan penyerahan, tiap wadah bahan awal hendaklah diperiksa kebenaran penandaan, termasuk label pelulusan dari bagian Pengawasan Mutu. Setelah penimbangan, penyerahan dan penandaan bahan awal, produk antara dan produk ruahan hendaklah diangkut dan disimpan dengan cara yang benar sehingga keutuhannya tetap terjaga sampai saat pengolahan berikutnya (BPOM, 2006).
2.2.6.6 Pengembalian
Semua bahan awal, bahan pengemas, produk antara dan produk ruahan yang dikembalikan ke gudang penyimpanan hendaklah memenuhi spesifikasi yang ditetapkan, didokumentasikan dengan benar dan direkonsiliasi (BPOM, 2006).
2.2.6.7 Pengolahan
Semua bahan yang akan dipakai dalam pengolahan hendaklah diperiksa terlebih dahulu. Kondisi lingkungan di area pengolahan dipantau dan dikendalikan agar selalu berada pada tingkat yang dipersyaratkan untuk kegiatan pengolahan. Selain itu, semua peralatan yang dipakai dalam pengolahan diperiksa sebelum digunakan. Peralatan dinyatakan bersih secara tertulis sebelum digunakan. Semua kegiatan pengolahan dilaksanakan mengikuti prosedur yang tertulis. Tiap penyimpangan dipertanggungjawabkan dan dilaporkan (BPOM, 2006).
2.2.6.8 Kegiatan Pengemasan
Kegiatan ini berfungsi untuk membagi dan mengemas produk ruahan menjadi produk jadi. Pengemasan hendaklah dilaksanakan di bawah pengendalian yang ketat untuk menjaga identitas, keutuhan dan kualitas produk akhir yang dikemas. Sebelum kegiatan pengemasan dimulai, hendaklah dilakukan pemeriksaan untuk memastikan bahwa area kerja dan peralatan telah bersih serta bebas dari produk lain, sisa produk lain atau dokumen lain yang tidak diperlukan untuk kegiatan pengemasan yang bersangkutan. Semua penerimaan produk
ruahan, bahan pengemas dan bahan cetak lain diperiksa dan diverifikasi kebenarannya terhadap Prosedur Pengemasan Induk atau perintah pengemasan khusus (BPOM, 2006).
Pada proses pengemasan, dilakukan berbagai kegiatan seperti prakodifikasi (pelabelan) bahan pengemas, kesiapan jalur pengemasan (memastikan bahwa semua bahan dan produk yang sudah dikemas dari kegiatan pengemasan sebelumnya telah disingkirkan dari jalur pengemasan dan area sekitarnya), pelaksanaan pengemasan dan penyelesaian proses pengemasan. Produk jadi yang sudah dikemas hendaklah dikarantina sambil menunggu pelulusan dari bagian Pengawasan Mutu (BPOM, 2006).
2.2.6.9 Pengawasan selama Proses
Bertujuan untuk memantau hasil dan memvalidasi kinerja dari proses produksi yang mungkin menjadi penyebab variasi karakteristik produk selama proses berjalan. Pengawasan selama proses hendaklah mencakup (BPOM, 2006):
a) Semua parameter produk, volume atau jumlah isi produk diperiksa pada saat awal dan selama proses pengolahan atau pengemasan
b) Kemasan akhir diperiksa selama proses pengemasan dengan selang waktu yang teratur untuk memastikan kesesuaiannya dengan spesifikasi dan memastikan semua komponen sesuai dengan yang ditetapkan dalam Prosedur Pengemasan Induk.
2.2.6.10 Karantina dan Penyerahan Produk Jadi
Karantina produk jadi merupakan tahap akhir pengendalian sebelum penyerahan ke gudang dan siap untuk didistribusikan. Sebelum diluluskan untuk diserahkan ke gudang, pengawasan yang ketat hendaklah dilaksanakan ntuk memastikan produk dan catatan pengemasan bets memenuhi semua spesifikasi yang ditentukan.
Selama menunggu pelulusan dari bagian Manajemen Mutu (Pemastian Mutu), seluruh bets atau lot yang sudah dikemas hendaklah ditahan dalam status karantina. Produk jadi yang memerlukan kondisi penyimpanan khusus hendaklah diberi penandaan jelas yang menyatakan kondisi penyimpanan yang diperlukan
dan disimpan dalam area karantina yang sesuai. Pelulusan akhir produk harus memperhatikan, yaitu:
a. Produk memenuhi persyaratan mutu dalam semua spesifikasi pengolahan dan pengemasan.
b. Sampel pertinggal dari kemasan yang dipasarkan dalam jumlah yang mencukupi untuk pengujian di masa mendatang.
c. Pengemasan dan penandaan memenuhi semua persyaratan sesuai hasil pemeriksaan oleh bagian Pengawasan Mutu.
d. Rekonsiliasi bahan pengemas cetak dan bahan cetak dapat diterima.
e. Produk jadi yang diterima di area karantina sesuai dengan jumlah yang tertera pada dokumen penyerahan barang.
Setelah pelulusan suatu bets atau lot oleh bagian Manajemen Mutu (pemastian Mutu), produk tersebut dipindahkan dari area karantina ke gudang produk jadi. Sewaktu menerima produk jadi, personil gudang hendaklah mencatat pemasukan bets tersebut ke dalam kartu stok yang bersangkutan.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari Cara Pembuatan Obat yang Baik yang berfungsi untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan penggunaannya. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk (BPOM, 2006).
Dalam pengawasan mutu terdapat ketentuan cara berlaboratorium pengawasan mutu yang baik, baik dari segi bangunan dan fasilitas, personil, peralatan laboratorium harus sesuai dengan jenis tugas yang ditentukan dan skala kegiatan pembuatan obat. Sumber daya yang memadai harus tersedia untuk memastikan bahwa segala kegiatan pengawasan mutu dapat dilaksanakan dengan efektif dan dapat diandalkan. Selain itu, pereaksi, media pembenihan, baku pembanding dan lainnya harus di siapkan dengan baik sesuai dengan prosedur tertulis (BPOM, 2006).
Dokumentasi dan prosedur pelulusan yang diterapkan dalam bagian pengawasan mutu bertujuan untuk menjamin bahwa pengujian yang diperlukan
telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan (BPOM, 2006).
2.2.7.1 Persyaratan Dasar Pengawasan Mutu
Menurut pedoman CPOB, persyaratan dasar dari pengawasan mutu yaitu (BPOM, 2006):
1. Sarana dan prasarana yang memadai, personil yang terlatih dan prosedur yang disetujui tersedia untuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi dan bila perlu untuk pemantauan lingkungan sesuai tujuan CPOB.
2. Pengambilan sampel bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi dilakukan oleh personil dengan metode yang disetujui oleh Pengawasan Mutu.
3. Metode pengujian disiapkan dan divalidasi (bila diperlukan).
4. Produk jadi berisi zat aktif dengan komposisi secara kualitatif dan kuantitatif sesuai dengan yang disetujui pada saat pendaftaran, dengan derajat kemurnian yang dipersyaratkan serta dikemas dalam wadah yang sesuai dan dikemas dalam wadah yang sesuai dan diberi label yang benar.
5. Dibuat catatan hasil pemeriksaan dan analisis bahan awal, bahan pengemas, produk antara, produk ruahan dan produk jadi secara formal dinilai dan dibandingkan terhadap spesifikasi.
Sampel pertinggal dari bahan awal dan produk jadi disimpan dalam jumlah yang cukup untuk dilakukan pengujian ulang bila perlu. Sampel produk jadi disimpan dalam kemasan akhir kecuali untuk kemasan yang besar.
2.2.7.2 Tugas Pokok Bagian Pengawasan Mutu
Bagian pengawasan mutu mempunyai tugas pokok sebagai berikut (BPOM, 2006):
1. Menyusun dan merevisi prosedur pengawasan dan spesifikasi.
2. Menyiapkan prosedur tertulis yang rinci untuk melakukan seluruh pemeriksaan, pengujian dan analisis.
4. Memastikan pemberian label yang benar pada wadah bahan dan produk. 5. Menyimpan sampel pertinggal untuk rujukan di masa mendatang.
6. Meluluskan atau menolak tiap bets bahan awal, produk antara, produk ruahan atau produk jadi.
7. Melakukan evaluasi stabilitas semua produk jadi secara berkelanjutan dari bahan awal bila diperlukan, serta menetapkan kondisi penyimpanan bahan dan produk berdasarkan data stabilitasnya.
8. Menetapkan masa simpan bahan awal dan produk jadi berdasarkan data stabilitas serta kondisi penyimpanannya.
9. Berperan atau membantu pelaksanaan program validasi.
10. Menyiapkan baku pembanding sekunder sesuai dengan prosedur pengujian yang berlaku dan menyimpan baku pembanding tersebut pada kondisi yang tepat.
11. Menyimpan catatan analitis dari hasil pengujian semua sampel yang diambil. 12. Melakukan evaluasi produk jadi kembalian dan menetapkan apakah produk
tersebut dapat diluluskan atau diolah ulang atau harus dimusnahkan.
13. Ikut serta dalam program inspeksi diri bersama dengan bagian lain dari perusahaan.
14. Memberikan rekomendasi kegiatan pembuatan obat berdasarkan kontrak setelah melakukan evaluasi kemmapuan penerima kontrak yang bersangkutan.
2.2.8 Inspeksi Diri dan Audit Mutu
Inspeksi diri bertujuan untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu indutri farmasi memenuhi ketentuan Cara Pembuatan Obat yang Baik (CPOB). Program inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan (BPOM, 2006).
Inspeksi diri harus dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan atau menggunakan auditor luar yang independen. Inspeksi diri dilakukan secara rutin dan pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua
saran untuk tindakan perbaikan agar dilaksanakan. Prosedur dan catatan inspeksi diri didokumentasikan dan dibuat program tindak lanjut yang efektif (BPOM, 2006).
Audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak (BPOM, 2006).
2.2.9 Penanganan Keluhan terhadap Produk, Penarikan Produk dan Produk Kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui cacat dari peredaran secara cepat dan efektif (BPOM, 2006).
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran. Hal ini dapat terjadi bila ditemukan produk yang cacat mutu atau bila ada laporan yang mengenai reaksi yang merugikan yang serius serta berisiko terhadap kesehatan. Konsekuensi yang diterima pabrik adalah terjadinya penundaan atau penghentian pembuatan obat tersebut (BPOM, 2006).
Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke pabrik karena adanya keluhan, kerusakan, kadaluwarsa, masalah keabsahan atau sebab lain mengenai kondisi obat, wadah atau kemasan sehingga menimbulkan keraguan akan keamanan, identitas, mutu dan jumlah obat yang bersangkutan (BPOM, 2006).
Berdasarkan hasil evaluasi, produk kembalian dapat dikategorikan antara lain produk kembalian yang masih memenuhi spesifikasi dan dapat dikembalikan ke dalam persediaan, produk kembalian yang dapat diproses ulang, serta produk kembalian yang tidak memenuhi spesifikasi dan tidak dapat diproses ulang.
Prosedur penanganan obat kembalian mencakup jumlah, karantina, penelitian, pengolahan kembali, pemeriksaan dan pengujian mutu yang seksama. Obat kembalian yang tidak dapat diolah ulang hendaklah dimusnahkan dan dibuat prosedurnya. Pencatatan dilakukan untuk penanganan obat kembalian dan dilaporkan serta setiap pemusnahan dibuatkan berita acara yang ditandatangani oleh pelaksana dan saksi (BPOM, 2006).
2.2.10 Dokumentasi
Dokumentasi merupakan bagian esensial dalam mengoperasikan suatu industri farmasi agar dapat memenuhi persyaratan CPOB. Dokumentasi bertujuan untuk memastikan bahwa setiap tugas mendapat instruksi secara rinci dan jelas mengenai tugas yang harus dilaksanakan sehingga memperkecil resiko terjadinya salah tafsir dan kekeliruan yang biasanya timbul karena mengandalkan komunikasi lisan saja (BPOM, 2006).
2.2.10.1 Ketentuan Dokumentasi
Menurut CPOB, ada beberapa ketentuan yang harus diperhatikan dalam dokumentasi, yaitu (BPOM, 2006):
1. Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu.
2. Dokumen hendaklah didesain, disiapkan, dikaji dan didistribusikan dengan cermat. Bagian dokumen pembuatan dan dokumen registrasi (dossier) yang relevan hendaklah sesuai.
3. Dokumen hendaklah disetujui, ditandatangani dan diberi tanggal oleh personil yang sesuai dan diberi wewenang.
4. Isi dokumen hendaklah tidak berarti ganda; judul, sifat dan tujuannya hendaklah dinyatakan dengan jelas. Penampilan dokumen hendaklah dibuat rapi dan mudah dicek. Dokumen hasil reproduksi hendaklah jelas dan terbaca. Reproduksi dokumen kerja dari dokumen induk tidak boleh menimbulkan kekeliruan yang disebabkan proses reproduksi.
5. Dokumen hendaklah dikaji ulang secara berkala dan dijaga agar selalu up-to-date. Bila perlu dokumen direvisi, hendaklah dijalankan suatu sistem untuk menghindarkan penggunaan dokumen yang sudah tidak berlaku secara tidak sengaja.
6. Dokumen hendaklah tidak ditulistangankan; namun, bila dokumen memerlukan pencatatan data, maka pencatatan ini hendaklah ditulistangankan dengan jelas, terbaca dan tidak dapat dihapus. Hendaklah disediakan ruang yang cukup untuk mencatat data.
7. Semua perubahan yang dilakukan terhadap pencatatan pada dokumen hendaklah ditandatangani dan diberi tanggal; perubahan hendaklah memungkinkan pembacaan informasi semula. Dimana perlu, alasan perubahan hendaklah dicatat. Pencatatan hendaklah dibuat atau dilengkapi pada tiap langkah yang dilakukan dan sedemikian rupa sehingga semua aktivitas yang signifikan mengenai pembuatan obat dapat ditelusuri. Catatan pembuatan hendaklah disimpan selama paling sedikit satu tahun setelah tanggal kadaluwarsa produk jadi.
8. Data dapat dicatat dengan menggunakan sistem pengolahan data elektronik, cara fotografis atau cara lain yang dapat diandalkan, namun prosedur rinci berkaitan dengan sistem yang digunakan hendaklah tersedia dan akurasi catatan hendaklah dicek. Apabila dokumentasi dikelola dengan menggunakan metode pengolahan data elektronis, hanya personil yang diberi wewenang boleh mengentri atau memodifikasi data dalam komputer dan hendaklah perubahan dan penghapusannya dicatat; akses hendaklah dibatasi dengan menggunakan kata sandi (password) atau dengan cara lain, dan hasil entri dari data kritis hendaklah dicek secara independen. Catatan bets yang disimpan secara elektronis hendaklah dilindungi dengan transfer pendukung (back-up transfer) menggunakan pita magnet, mikrofilm, kertas atau cara lain. Data selalu tersedia selama kurun waktu penyimpanan.
2.2.11 Pembuatan dan Analisis berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat
menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu (pemastian mutu) (BPOM, 2006).
Kontrak hendaklah mengizinkan Pemberi Kontrak untuk mengaudit sarana dari Penerima Kontrak. Pemberi kontrak bertanggung jawab untuk menilai kompetensi Penerima kontrak dalam melaksanakan pekerjaan atau pengujian yang diperlukan dan memastikan bahwa prinsip dan pedoman CPOB diikuti. Pembuatan obat berdasarkan kontrak hanya dapat dilakukan oleh industri farmasi yang memiliki sertifikat CPOB yang diterbitkan oleh Otoritas Pengawasan Obat (OPO) (BPOM, 2006).
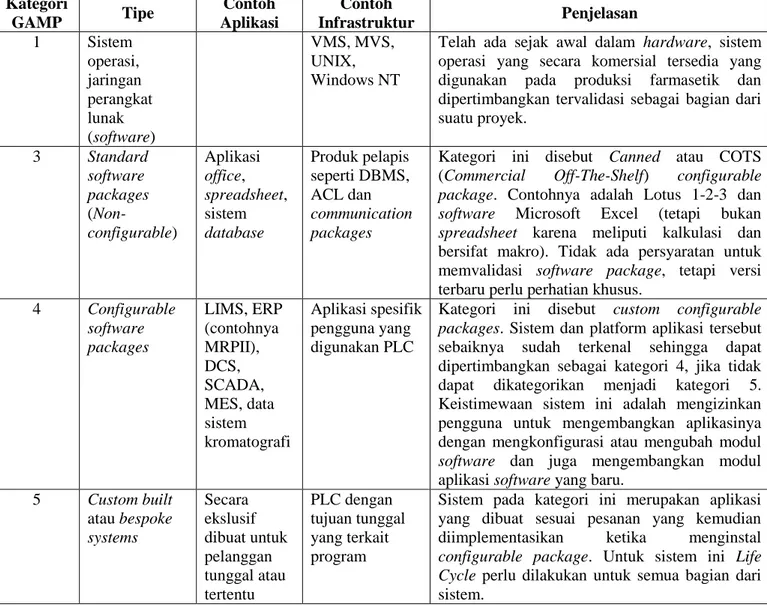
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Seluruh kegiatan validasi direncanakan dan unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan dalam Rencana Induk Validasi (RIV) atau dokumen setara (BPOM, 2006).
RIV hendaklah mencakup sekurang-kurangnya data, yaitu kebijakan validasi; struktur organisasi kegiatan validasi; ringkasan fasilitas, sistem, peralatan dan proses yang akan divalidasi; format dokumen yaitu format protokol dan laporan validasi, perencanaan dan jadwal pelaksanaan; pengendalian perubahan dan acuan dokumen yang digunakan (BPOM, 2006).
Laporan harus dibuat mengacu pada protokol kualifikasi dan atau protokol validasi dan memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan. Tiap perubahan terhadap rencana yang ditetapkan dalam protokol didokumentasikan dengan pertimbangan yang sesuai (BPOM, 2006).
Terdapat beberapa jenis kualifikasi antara lain : 1. Kualifikasi Desain (KD)
Kualifikasi desain bertujuan untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan atau bangunan yang akan dipasang atau dibangun (rancang bangun) sesuai dengan ketentuan atau spesifikasi yang diatur dalam CPOB yang berlaku. Kualifikasi desain dilakukan sebelum mesin, peralatan produksi atau sarana penunjang (termasuk bangunan untuk industri farmasi) tersebut dibeli atau dipasang atau dibangun (BPOM, 2006).
2. Kualifikasi instalasi (KI)
Kualifikasi instalasi bertujuan untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang diinstalasi sesuai dengan spesifikasi yang tertera pada dokumen pembelian. Manual alat yang bersangkutan dan pemasangannya dilakukan memenuhi spesifikasi yang telah ditetapkan. Kualifikasi instalasi dilakukan pada saat pemasangan atau instalasi mesin atau peralatan produksi atau sarana penunjang. Kegiatan kualifikasi instalasi meliputi pelaksanaan kalibrasi. Kalibrasi merupakan serangkaian kegiatan dalam kondisi yang telah ditentukan, yang menetapkan hubungan antara lain yang ditunjuk oleh alat ukur atau sistem pengukur, atau nilai yang ditampilkan oleh suatu ukuran bahan dengan nilai suatu rujukan standar (BPOM, 2006). 3. Kualifikasi Operasional (KO)
Kualifikasi operasional bertujuan untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai dengan spesifikasi yang diinginkan. Kualifikasi operasional dilakukan setelah pemasangan atau instalasi mesin atau peralatan produksi atau sarana penunjang dan digunakan sebagai tes mesin atau peralatan (BPOM, 2006).
4. Kualifikasi Kinerja (KK)
Kualifikasi kinerja bertujuan untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai
dengan spesifikasi yang diinginkan dengan cara menjalankan sistem sesuai dengan tujuan penggunaan (BPOM, 2006).
Untuk validasi proses produksi terdapat beberapa jenis, antara lain: a. Validasi Prospektif
Validasi prospektif merupakan validasi proses produksi yang dilakukan untuk produk-produk baru (belum pernah diproduksi atau dipasarkan sebelumnya oleh pabrik tersebut). Validasi ini dilakukan setelah proses scale up, optimalisasi prosedur dan finalisasi prosedur produksi oleh bagian R&D. Validasi dilakukan pada tiga bets pertama secara berurutan (BPOM, 2006). b. Validasi Konkuren
Validasi konkuren merupakan validasi yang dilakukan pada proses produksi yang sudah atau sedang berjalan dan diproduksi. Validasi dapat dilakukan karena adanya perubahan pada parameter kritis yang dapat mempengaruhi mutu dan spesifikasi produk, antara lain perubahan spesifikasi bahan baku, peralatan utama, prosedur pembuatan dan metode pengujian (BPOM, 2006).
c. Validasi Retrospektif
Validasi retrospektif merupakan validasi yang dilakukan terhadap produk-produk yang sudah lama diproduksi namun belum divalidasi. Validasi dilakukan dengan cara penelusuran data produksi yang sedang berjalan dengan menggunakan data dari catatan bets. Data yang dikumpulkan merupakan hasil pengujian terhadap parameter kritis pada setiap tahap proses produksi (BPOM, 2006).
3.1 Lokasi PT. Combiphar
Pabrik PT. Combiphar terletak di Jalan Raya Simpang No. 383 Padalarang, Bandung, sedangkan untuk kantor pusat (Head Office) dan bagian pemasaran PT. Combiphar terletak di Graha Atrium Senen lantai 14-16, Jakarta Pusat.
3.2 Sejarah Perkembangan PT. Combiphar
PT. Combiphar (Combined Imperial Pharmaceutical Incorporation) didirikan pada tahun 1971 di Jalan Sukabumi No. 61, Bandung. PT. Combiphar awalnya merupakan industri kecil yang memproduksi beberapa obat sederhana, diantaranya antibiotika, analgetika dan OBH combi. Pada tanggal 27 Juni 1981, divisi produksi PT. Combiphar berpindah lokasi ke Jalan Simpang Raya No. 383, Padalarang dan diresmikan oleh Direktur Jenderal POM, sedangkan kantor pusat tetap berada di Jalan Sukabumi No. 61, Bandung.
Pada tahun 1985, perusahaan ini menjadi milik GEMALA Group (PT. Kirana Guna Jaya) dan pada tahun 1987, kantor pusat PT. Combiphar dipindahkan ke Jalan Pulolentut Kav. 11/E-4, Jakarta Timur. Sejak 8 April 1998, kantor pusat PT. Combiphar menetap di Jalan Tanah Abang II/9 Jakarta Pusat dan selanjutnya dipindahkan ke Graha Atrium lantai 14-16 Jalan Senen Raya 135, Jakarta Pusat.
Suatu perubahan signifikan terjadi pada dekade kedua. Perubahan tersebut mencakup penataan ulang standard operating procedure (SOP) dan fasilitas produksi. Perubahan ini membawa PT. Combiphar tercatat sebagai salah satu perusahaan Farmasi Nasional yang mendapat penghargaan sertifikat CPOB pada tahun 1991. PT. Combiphar selalu melakukan penyesuaian dengan CPOB dan dengan kondisi yang terjadi saat ini. Oleh karena itu, pada tahun 1996, dilakukan renovasi terhadap gedung produksi dan didirikannya gedung produksi sefalosporin yang terpisah dari gedung produksi lainnya.
Pada tahun 1997, dibangun gedung induk produksi lensa mata dari Rohto yang merupakan perwujudan kerjasama PT. Combiphar dengan PT. Rohto dari
Jepang dan berakhir pada tahun 2002. Dengan berakhirnya kontrak kerjasama tersebut, gedung Rohto akhirnya digunakan oleh PT. Combiphar untuk departemen Product Development (Prodev) dan Quality Assurance (QA). Pada tahun yang sama, PT. Combiphar melakukan kerjasama dengan Sanofi-Syntelabo Perancis dan dibangunlah fasilitas PT. Sanofi-Syntelabo Combiphar (SSC) di lingkungan pabrik PT. Combiphar.
Pada tahun 2002, PT. Combiphar juga membangun fasilitas gedung khusus untuk produk OBH (Obat Batuk Hitam) yang dilatarbelakangi oleh adanya permintaan pasar yang sangat tinggi terhadap produk OBH Combi dan terbatasnya kapasitas untuk sarana produksi. Kemudian pada tahun 2003, PT. Combiphar telah meng-upgrade fasilitas Instalasi Pengolahan Air Limbah (IPAL).
Pada bulan Maret 2006, PT. Sanofi-Syntelabo Combiphar (SSC) beralih nama menjadi PT. Pharma Health Care (PHC). Kemudian, pada tanggal 5 Mei 2008, dilakukan peresmian laboratorium baru Product and Development PT. Combiphar untuk menggantikan laboratorium yang lama. PT. Combiphar memperoleh sertifikat CPOB untuk pertama kalinya pada tahun 1991. Pada tanggal 9 Oktober 2006, PT. Combiphar diperiksa oleh konsultan ISO, yaitu AIMS. Perusahaan ini kemudian di audit oleh SGS, yaitu badan yang berwenang memberikan sertifikat ISO. Berdasarkan hasil audit, PT. Combiphar dinyatakan berhak mendapatkan sertifikat ISO 9001 :2000.
3.3 Visi dan Misi
Visi yang dimiliki oleh PT. Combiphar yaitu menjadi salah satu Industri Farmasi terkemuka di Indonesia. Dalam menjalankan usahanya, PT. Combiphar memiliki misi, yaitu ikut berkontribusi terhadap peningkatan kualitas hidup.
3.4 Sarana Fisik dan Sarana Penunjang 3.4.1 Sarana dan Prasarana Fisik
Bangunan utama PT. Combiphar terdiri dari enam gedung, yaitu: a. Gedung Utama (Main Building)
1. Kantor
Meliputi ruang tamu, ruang administrasi, ruang Plant Director, ruang departemen administrasi dan keuangan, ruang departemen Supply Chain Management (SCM), ruang bagian Electronic Data Processing dan System Application Program (SAP), ruang departemen Plant HRD-GA serta ruang pertemuan.
2. Area Produksi
Terbagi menjadi dua daerah, yaitu daerah abu-abu (grey area) dan daerah hitam (black area). Daerah abu-abu terbagi menjadi beberapa ruangan, yaitu ruangan proses sediaan padat, semi padat, cairan, ruang pengujian IPC, ruang pengemasan primer, ruang airlock, dan ruang karantina. Daerah hitam meliputi ruang pengemasan sekunder, ruang ganti pakaian serta ruang penyimpanan bahan kemasan dan produk jadi.
3. Gudang
Gudang yang terdapat di PT. Combiphar adalah gudang bahan baku, gudang bahan kemas dan gudang obat jadi. Tiap gudang memiliki ruang administrasi, ruang penyimpanan kondisi khusus, area untuk menyimpan barang-barang karantina, diluluskan serta area untuk menyimpan barang-barang ditolak. b. Gedung Quality Assurance dan Product Development
c. Bangunan OBH
Bangunan OBH terdiri dari gudang (bahan baku, bahan pengemas dan produk jadi) dan ruang produksi.
d. Gedung Pharma Health Care
e. Gedung bagian teknik dan pemeliharaan, kantin, mushola, mess karyawan dan Instalasi Pengolahan Air Limbah (IPAL).
3.4.2 Sarana Penunjang
Terdapat beberapa sarana penunjang untuk mendukung dan memperlancar aktivitas produksi. Sarana penunjang tersebut antara lain bengkel teknik, generator diesel (genset), dua unit air compressor, pompa air, pengolahan air dengan sistem reverse osmosis, sistem high-ventillating air conditioning (HVAC) pada gedung utama dan gedung sediaan cair, waste water treatment plant
(WWTP), penangkal petir, sistem telekomunikasi dan system application program (SAP).
3.5 Struktur Organisasi
Manajemen puncak pada PT. Combiphar dipegang oleh President Director yang membawahi Vice President. Vice President membawahi Director yang juga membawahi Managing Director. Managing Director membawahi delapan kepala divisi, yaitu Head of Plant Division, Head of Ethical Division, Head of CCH Division, Head of Oncology Division, Head of Finance Division, Head of Bussiness Development Division¸ Head of Pharmaserve dan Head of Internal Audit.
Divisi pabrik PT. Combiphar memiliki struktur organisasi tersendiri dalam menjalankan fungsinya. Organisasi divisi pabrik dipimpin oleh seorang kepala pabrik (Plant Director), dan beberapa kepala bagian dari Bagian Produksi, Bagian Supply Chain, Bagian Product Development, Bagian Teknik, Bagian Cost Accounting, Bagian Human Resource Development, dan Bagian Administrasi. Bagian Quality Assurance Operation (QAO) masih berkaitan erat dengan Divisi Pabrik, tetapi bagian ini bertanggung jawab juga kepada Managing Director.
Dibawah manajer QAO terdapat dua bagian yaitu Quality Control dan Quality Assurance Service (QAS). QAS membawahi Quality Service (QC Pharmacist), Documentation and Change Control serta unit GMP Compliance. Unit GMP Compliance berada dibawah pimpinan QAS manajer dan mempunyai koordinasi langsung terhadap QAO manajer. Bagian QC membawahi QC Pharmacist dan Validation Officer. QC Pharmacist bergerak di bidang bahan baku dan obat jadi, sedangkan Validation Officer melakukan validasi proses dan Plant Director bertugas mengkoordinasikan segala sesuatu yang berkaitan dengan produksi tetapi disesuaikan dengan rencana penjualan dan rencana pesanan (plan order) dari distributor, serta ikut mengawasi pelaksanaan kegiatan produksi.
3.5.1 Produksi
Departemen produksi dipimpin oleh seorang manajer produksi yang merupakan seorang apoteker. Manajer produksi bertanggung jawab dalam
pelaksanaan semua proses produksi yang dilakukan oleh PT. Combiphar. Manajer produksi dibantu oleh dua orang asisten manajer, yaitu asisten manajer bagian solid dan semisolid, serta asisten manajer bagian liquid.
Tugas pokok bagian produksi divisi pabrik PT. Combiphar adalah:
a. Melaksanakan kegiatan pengolahan dan pengemasan produk sesuai dengan jadwal produksi yang telah ditetapkan.
b. Menyusun rencana produksi mingguan bersama dengan bagian supply chain. c. Membuat laporan kegiatan produksi sesuai dengan ketentuan perundang-
undangan yang berlaku.
d. Melaksanakan pembuatan produk baru skala produksi bersama dengan bagian product development.
e. Menyiapkan dan merencanakan sarana produksi beserta pengembangannya. f. Melaksanakan upaya-upaya peningkatan efisiensi proses produksi.
g. Menjamin penerapan CPOB di lingkungan bagian produksi.
PT. Combiphar memiliki unit-unit bagian produksi dengan penjelasan sebagai berikut:
a. Unit Solid dan Semisolid
Unit solid dan semisolid terdiri dari beberapa unit yang dibagi berdasarkan proses produksi, yaitu:
1. Subunit Dispensing Solid Mixing
Ruang dispensing terdiri dari ruang penyangga bahan baku, ruang penimbangan dan ruang penyimpanan bahan baku yang telah ditimbang. Ruang penimbangan memiliki alat timbangan berupa timbangan digital dan timbangan skala besar. Proses penimbangan dilakukan dibawah sistem Laminar Air Flow (LAF) untuk mencegah atau mengurangi terjadinya kontaminasi ke dalam bahan baku.
Proses penimbangan adalah bahan baku dari gudang masuk ke dalam ruang penyangga. Sebelum ditimbang, ruang penimbangan harus dipersiapkan terlebih dahulu. Persiapan tersebut antara lain pembersihan ruangan, alat dan wadah hasil penimbangan. Bahan baku ditimbang satu per satu, dimulai dari bahan yang inert kemudian bahan aktifnya. Urutan penimbangan, yaitu bahan yang jumlahnya banyak, tidak berbau dan tidak berwarna. Penimbangan dilakukan oleh petugas
penimbangan dan dibantu oleh seorang asisten apoteker yang berperan sebagai checker. Setelah selesai menimbang, ruang penimbangan dibersihkan secara menyeluruh untuk mencegah kontaminasi pada penimbangan berikutnya. Hasil penimbangan ditempatkan di staging area berdasarkan bahan baku masing-masing produk.
Ruang pencampuran padat (Solid Mixing) terdiri dari ruang pencampuran kering, ruang pencampuran basah, ruang pengeringan granul dan ruang produk antara. Proses produksi tablet dimulai dari dispensing (penimbangan) raw material. Raw material akan diayak dengan menggunakan oscillating granulator dengan ukuran mesh yang disesuaikan. Kemudian dilakukan pencampuran dan granulasi basah menggunakan alat super mixer. Granul yang terbentuk kemudian dikeringkan dengan Fluid Bed Dryer (FBD), diayak, ditambahkan bahan-bahan tambahan dan dicampur sampai rata di dalam drum roller. Terbentuk granul siap cetak yang akan disimpan dan dilakukan pengujian In Process Control (IPC) sebelum dilakukan pencetakan. Setelah diberikan label pelulusan dari QC, granul siap cetak akan dikirimkan ke sub unit tableting and coating atau sub unit capsule and solid filling.
2. Subunit Tableting dan Coating
Mesin tablet dan ruang pencetakan harus dalam keadaan bersih sebelum proses pencetakan dimulai. Selama proses pencetakan, dilakukan IPC setiap 15 menit yang meliputi pengukuran variasi bobot dan setiap 30 menit yang meliputi kekerasan dan ketebalan tablet. Pada waktu tertentu, dilakukan pemeriksaan fisik, keregasan dan waktu hancur (awal, tengah dan akhir proses) oleh bagian produksi. Bagian QC akan melakukan uji keseragaman bobot dan kesesuaian kadar zat aktif. Tablet yang telah selesai dicetak akan disimpan untuk menunggu pelulusan dari bagian QC.
Untuk proses penyalutan, PT. Combiphar memiliki dua jenis, yaitu salut tipis dan salut gula. Jenis salut tipis yang dibuat adalah salut transparan, salut berwarna dan salut enterik. Tablet salut tipis dibuat dengan menggunakan larutan penyalut yang disemprot menggunakan pompa sambil diputar dan dialiri udara panas. Suhu jangan terlalu panas karena dapat menyebabkan debu yang berlebihan, tetapi juga jangan terlalu dingin karena akan menyebabkan tablet
lengket. Tablet hasil salut akan disimpan di ruang produk ruahan. Untuk proses salut gula, penyalutan menggunakan panci penyalut yang dilengkapi dengan blower dan buffle. Blower berguna untuk mengalirkan udara panas, sedangkan buffle berguna untuk menggerakkan tablet yang sedang disalut. Proses salut yang terjadi meliputi subcoating, smoothing, colouring, dan polishing. Selama proses penyalutan, dilakukan IPC, yaitu keseragaman bobot dan waktu hancur.
3. Subunit Semisolid
Sediaan semisolid yang diproduksi berupa krim, salep, supositoria dan ovula. Setiap 30 menit, dilakukan pemeriksaan bobot tube, lipatan tube dan nomor bets. Pada pembuatan supositoria dan ovula, IPC yang dilakukan adalah homogenitas kadar zat aktif yang dilakukan pada tiga titik yang berbeda. Pada pembuatan krim, salep dan gel, IPC yang dilakukan adalah kerataan dan homogenitas sediaan. Setelah dikemas, IPC yang dilakukan adalah keseragaman bobot. Produk antara akan dikarantina kemudian QC akan melakukan pemeriksaan kadar zat aktif, viskositas dan berat jenis. Produk antara yang telah diluluskan akan dikirim ke bagian pengemasan primer.
4. Subunit Capsulating dan Solid Filling
Subunit yang bertugas untuk melakukan pengisian serbuk ke dalam cangkang kapsul, sachet atau botol. Pemeriksaan bobot kapsul dilakukan tiap 15 menit sebanyak 20 buah kapsul. Setelah ada persetujuan dari bagian QC, kapsul akan dikirim untuk proses stripping.
Bagian solid filling adalah pengisian serbuk ke dalam botol atau sachet. Beberapa sachet pertama akan diperiksa, jika memenuhi spesifikasi, maka pengisian serbuk ke dalam sachet akan dilanjutkan. Setiap 30 menit akan dilakukan IPC berupa uji kebocoran, nomor bets dan variasi bobot.
5. Sub Unit Primary Packaging
Pengemasan merupakan bagian dari produksi yang dilakukan terhadap produk ruahan sehingga menjadi produk jadi. Pengemasan primer merupakan pengemasan produk ruahan dimana kemasan langsung kontak dengan produk. Subunit pengemasan primer bertanggung jawab terhadap proses pengemasan primer seluruh produk ruahan solid dan semisolid yang telah dinyatakan lulus oleh bagian QC. Kemasan primer yang umum digunakan untuk sediaan solid
adalah strip dan blister. Pengemasan primer untuk sediaan semisolid terdiri dari pengemasan supositoria dan ovula ke dalam rotoplas, gel ke dalam roll on, salep dan krim ke dalam tube.
Stripping merupakan proses pengemasan primer untuk sediaan berupa tablet atau kapsul. Sebelum dilakukan stripping, aluminium foil yang digunakan diperiksa terlebih dahulu, nomor bets, tanggal kadaluarsa serta harga eceran tertinggi (HET). Pada saat proses stripping, dilakukan pengujian tes kebocoran dengan cara memasukkan strip atau blister ke dalam alat penguji kebocoran yang didalamnya terdapat air, lalu strip diberi penahan diatasnya dan dilakukan proses vakum dengan tekanan 40 cmHg selama satu menit. Jika terdapat kebocoran, maka tablet atau kapsul didalamnya akan basah.
Blister merupakan salah satu jenis kemasan untuk sediaan solid. Bahan yang digunakan ada dua jenis, yaitu aluminium foil untuk pengemas bagian depan dan rigid untuk bagian belakang. Umumnya bagian belakang menggunakan bahan dari PVC tetapi dapat juga menggunakan bahan aluminium untuk obat yang tidak stabil terhadap cahaya. Proses blistering dilakukan dengan forming PVC, yaitu pembentukan rongga pada PVC sebagai tempat tablet atau kapsul dengan menggunakan heater pada suhu 120°C dan dilakukan pemeriksaan kebocoran. Proses dilakukan dalam ruangan dengan suhu dibawah 25° C dan kelembaban 60-70%. IPC yang dilakukan berupa tes kebocoran, pengontrolan kelengkapan penandaan, daya lekat blister dan pemeriksaan blister yang tidak terisi oleh tablet atau kapsul pada waktu pengemasan sekunder dengan cara pengukuran bobot kemasan. Produk kemudian dikarantina sampai dinyatakan lulus oleh bagian QC. 6. Subunit Repack-Packing Service
Subunit yang terdiri dari seksi repack (pengemasan ulang) dan seksi packing service (penyiapan bahan kemas). Proses pengemasan ulang dilakukan pada produk impor atau produk kembalian yang mengharuskan dilakukan pengemasan ulang. Subunit packing service bertugas untuk memenuhi kebutuhan bahan pengemas di seluruh unit pengemasan produk solid dan semisolid.
Permintaan bahan pengemas primer dan sekunder dapat dilakukan melalui formulir Material Requirement Slip (MRS) kepada bagian supply chain. Bahan pengemas yang diperoleh dari gudang bahan kemas diambil sesuai dengan catatan
pengemasan bets. Petugas packing service memeriksa kesesuaian bahan kemas yang dating dengan kebutuhan yang tercantum dalam formulir MRS. Bahan kemas yang telah dihitung dan sesuai dengan pesanan, akan diberi penandaan berupa nomor bets, tanggal kadaluarsa dan HET. Leaflet tidak diberi penandaan tetapi dilakukan pelipatan.
Bahan kemas yang telah diberi penandaan dan pelipatan selanjutnya diperiksa oleh bagian QC. Untuk leaflet akan diperiksa identitas leaflet, kesesuaian arah lipatan leaflet dan kesesuaian jumlah lipatan. Untuk label akan diperiksa kesesuaian identitas label, HET, nomor bets, tanggal produksi dan tanggal kadaluarsa. Untuk inner boxakan diperiksa kesesuaian nomor bets, tanggal pembuatan, tanggal kadaluarsa,nomor registrasi, kesesuaian nama bahan kemas dan kode bahan kemas. Untuk produk jadi juga diambil retain sample. 7. Sub Unit Secondary Packaging
Sub unit pengemasan sekunder terdiri dari seksi packing lini solid dan seksi packing lini semisolid. Subunit ini bertugas untuk melakukan pengemasan sekunder terhadap hasil stripping, blistering dan sachet. Proses yang dilakukan meliputi memasukkan strip, leaflet dan etiket ke dalam inner box serta memasukkan inner box kedalam outer box.
Seksi packing line semisolid bertugas untuk melakukan pengemasan sekunder meliputi penempelan etiket pada tube, memasukkan tube ke dalam inner box, memasukkan leaflet ke dalam inner box dan memasukkan inner box ke dalam outer box. Hasil pengemasan akan disimpan di ruang karantina untuk diperiksa oleh bagian QC. Setelah produk dinyatakan lulus, maka akan dikirim ke gudang produk jadi.
b. Unit Liquid
Unit liquid terdiri dari enam subunit yang dibagi berdasarkan proses produksi, yaitu:
1. Subunit OBH Disepnsing-Process-Washing-Filling
Subunit yang akan melakukan proses penimbangan, pencampuran, pencucian botol hingga pengisian. Proses penimbangan dilakukan di ruang dispensing. Raw material dari gudang akan melewati air lock dan wadahnya akan
dibersihkan. Penimbangan dilakukan sehari sebelum produksi, sehingga bahan yang telah ditimbang akan ditempatkan di staging area.
Setelah penimbangan, proses produksi dilakukan dengan mencampurkan bahan baku. Proses pencampuran dilakukan dengan menggunakan dua buah double jacket tank yang berkapasitas 8000 liter. Setelah pencampuran, akan masuk ke dalam final mixing tank dan holding tank yang terhubung ke dalam ruang filling. Filling OBH dilakukan ke dalam sachet, botol kaca dan botol plastik. Untuk botol kaca, akan dicuci terlebih dahulu dengan air murni sedangkan botol plastik akan langsung digunakan untuk proses filling.
2. Subunit OBH Packaging I
Subunit yang bertanggung jawab dalam pengemasan OBH mulai dari pengemasan primer sampai produk diserahkan ke gudang produk jadi. Subunit dikepalai seorang supervisor yang bertanggung jawab saat shift 1 yang bekerja dari pukul 06.00 – 14.30 WIB. Penandaan dilakukan dengan menggunakan mesin sedangkan pengemasan dilakukan secara manual. Proses pengemasan meliputi tahap penempelan label atau etiket, memasukkan botol dan sendok ke dalam inner box, menutup inner box dan memasukkannya ke dalam outer box.
Pada proses pengemasan, QC akan mengambil sampel pada awal, tengah akhir proses. Sampel yang akan diambil disesuaikan dengan data pengambilan jumlah sampel untuk kimia, mikrobiologi dan retained sample. Pemeriksaan IPC yang dilakukan meliputi keseragaman volume dan uji kebocoran. Setelah dikemas, produk akan dikarantina di bagian packaging dan menunggu diluluskan oleh bagian QC, lalu akan disimpan di gudang produk jadi.
3. Subunit OBH Packaging II 4. Subunit OBH Packaging III 5. Subunit Liquid Packing Service
Subunit yang bertugas untuk memenuhi kebutuhan atau menyiapkan bahan pengemas di seluruh unit pengemasan produk liquid. Permintaan bahan kemas melalui formulir MRS kepada bagian supply chain sesuai dengan jumlah produk ruahan dan dapat berupa bahan kemas sekunder seperti inner box, outer box, etiket dan leaflet.