3
2
Tinjauan Pustaka
2.1
Pati Kentang
Secara umum pati tersusun dari dua tipe polimer D-glukosa, yaitu amilosa dan amilopektin. Pada amilosa ikatan glikosidik yang terbentuk berupa ikatan α-1,4-glikosidik, sedangkan terdapat dua ikatan glikosidik (α-1,4-glikosidik dan α-1,6-glikosidik). Amilopektin penyusun pati relatif bervariasi. Hal ini disebabkan oleh jumlah rantai cabang penyusunnya. Ada tiga jenis rantai cabang, yang sering dikenal dengan istilah rantai A, B dan C. Ketiga rantai tersebut dibedakan berdasarkan posisi percabangan. Rantai cabang paling luar dari struktur amilopektin disebut rantai A. Rantai B merupakan rantai cabang dari amilopektin yang masih terdapat percabangan, sedangkan rantai C merupakan rantai pokok dari semua percabangan. Pada rantai C terdapat gugus gula pereduksi. Perbandingan jumlah rantai A dan B menunjukkan derajat percabangan [Buleon et al., 1998].
Pada pati kentang Solanum tuberosum L mengandung gugus fosfat melalui ikatan kovalen dengan amilopektin. Interaksi kovalen dari gugus fosfat yang ada dalam pati kentang sangat bervariasi. Hampir 60-70% gugus fosfat membentuk ikatan kovalen dengan atom C6 dari
residu glukosa. Interaksi kovalen tersebut juga dapat terjadi pada atom C3 dari residu
glukosa sebanyak 30-40%. Selain itu, dimungkinkan pula terdapat interaksi kovalen gugus fosfat dengan atom C2sebanyak 1% [Wischmann et al., 1999]. Butir pati kentang terdiri dari
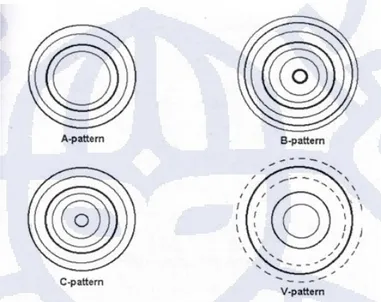
18-21% amilosa dengan bentuk oval. Komponen amilosa dan amilopektin pada pati kentang membentuk pola B-pattern [Buleon et al., 1998].
Gambar 2. 1 Pola difraksi sinar X butir pati kompleks amilosa
Berdasarkan Gambar 2. 1, dapat dilihat bahwa terdapat pola yang berbeda untuk masing-masing tipe. Garis-garis hitam yang melintang menujukkan komponen amilosa, sedangkan daerah putih di dalam lingkaran menunjukkan komponen amilopektin [Robyt, 1998].
2.2
Metabolisme Pati pada Tumbuhan
Pati merupakan salah satu cadangan makanan pada tumbuhan yang digunakan untuk respirasi di waktu gelap. Pati dihasilkan melalui proses fotosintesis, yaitu proses pengubahan energi sinar matahari menjadi energi kimia. Proses ini terjadi pada bagian tumbuhan yang mengandung klorofil. Bagian tumbuhan ini sering dikenal dengan istilah plastida. Pati yang sering ditemukan pada amiloplas berbentuk butir pati yang tidak larut dalam air. Amiloplas sering terdapat pada umbi, biji dan akar tanaman sebagai tempat penyimpanan cadangan makanan yang lain. Ukuran dan bentuk butir pati pada masing-masing tanaman memiliki sifat dan karakter yang khas.
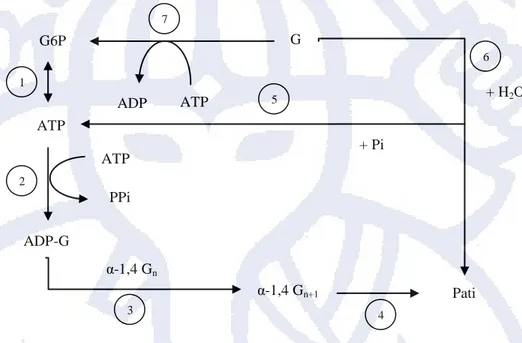
Dalam jalur metabolisme, biosintesis pati terjadi melalui serangkaian reaksi enzimatis. Pada Gambar 2.2, glukosa yang diperoleh dari respirasi mengalami fosforilasi menjadi Glukosa-6-fosfat, G6P dengan bantuan heksokinase. Fosforilasi tersebut melibatkan pengubahan molekul ATP menjadi ADP. Selanjutnya G6P diubah menjadi Glukosa-1-fosfat, G1P dengan bantuan fosfoglukomutase. G1P mengalami reaksi pirofosforilasi membentuk ADP-Glukosa, ADP-G dengan bantuan ADP-glukosa fosforilase. Pada reaksi pembentukan ADP-G melibatkan molekul ATP. Reaksi dilanjutkan dengan pembentukan ikatan α-1,4-glukan
dengan bantuan pati sintase. Biosintesis pati diakhiri dengan penggabungan glukan melalui pembentukan percabangan dengan bantuan enzim pencabangan [Buleon et al., 1998].
Gambar 2. 2 Skema biosintesis pati
G6P (Glukosa 6 fosfat), G1P (Glukosa 1 fosfat), ADP-G (Adenosin difosfat-glukosa), ATP (Adenosin trifosfat), ADP (Adenosin difosfat), Pi (fosfat anorganik).
(1) fosfoglukomutase; (2) ADP–glukosa pirofosforilase; (3) pati sintase; (4) enzim pencabangan; (5) pati fosforilase; (6) amilase; (7) heksokinase
Degradasi pati umumnya melibatkan molekul air, sehingga sering dikenal dengan hidrolisis pati. Pada proses hidrolisis pati, reaksi terbagi menjadi dua tahap, yaitu reaksi enzimatis dan non-enzimatis. Tahap awal yang dilakukan adalah gelatinisasi butir pati yang merupakan reaksi non-enzimatis. Proses ini dilakukan dengan cara pemanasan suspensi pati pada 105
o
C. Gelatinisasi bertujuan untuk membuka butir pati, sehingga diperoleh molekul amilosa dan amilopektin yang terpisah secara acak dalam larutan. Tahap berikutnya merupakan tahap reaksi enzimatis. Reaksi enzimatis ini terdiri dari dua proses, yaitu likuefaksi dan sakarifikasi.
Likuefaksi merupakan proses degradasi amilosa dan amilopektin menjadi molekul yang lebih sederhana dengan bantuan α-amilase. Likuefaksi diikuti dengan sakarifikasi, yaitu degradasi oligosakarida menjadi glukosa dengan bantuan glukoamilase. Sakarifikasi dapat dilakukan pada suhu 50-60 oC. Secara keseluruhan, degradasi pati memerlukan energi yang tinggi [Goyal et al., 2005].
5 G6P G ATP ADP ATP ATP PPi ADP-G α-1,4 Gn+1 α-1,4 Gn Pati + Pi + H2O 1 2 3 7 4 6
2.3
-Amilase
-Amilase termasuk dalam kategori enzim hidrolase. Enzim ini membantu dalam proses hidrolisis. -Amilase merupakan enzim yang dapat mendegradasi pati, yaitu dengan memutus ikatan α-1,4-glikosidik yang terdapat pada pati. Secara garis besar keluarga amilase terbagi menjadi dua kelas, yaitu: endoamilase dan eksoamilase. Endoamilase memutus ikatan α-1,4-glikosidik bagian dalam amilosa dan amilopektin dengan produk oligosakarida berbagai ukuran dengan konfigurasi α, sedangkan eksoamilase memutus ikatan α-1,4-glikosidik dari ujung pereduksi pati dengan produk hanya glukosa atau maltosa. α-Amilase sendiri termasuk dalam kelas endoamilase.
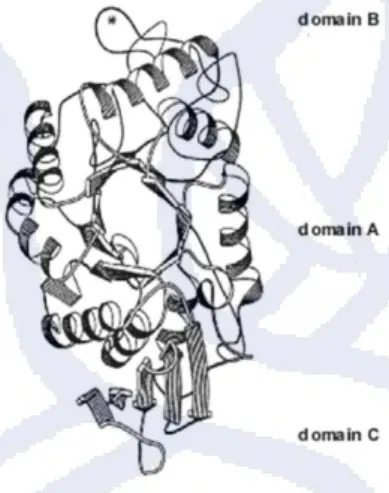
Gambar 2. 3 Stereokimia dari struktur α-amilase
Berdasarkan Gambar 2. 3, struktur α-amilase tersusun dari tiga domain, yaitu domain A, domain B dan domain C. Domain A merupakan domain katalitik yang mempunyai struktur (α /β)8-barel, domain B berperan dalam folding protein (terdapat tiga ion Ca
2+
), sedangkan domain C tersusun dari 5-strand antiparalel β-sheet yang fungsinya belum diketahui secara pasti.
Pada beberapa mikroorganisme ditemukan enzim amilase yang dapat memutus ikatan α-1,6-glikosidik pada amilopektin. Enzim tersebut antara lain pululanase dan isoamilase. Pululanase merupakan enzim amilase yang diteliti pada Aspergillus aerogenes. Enzim tersebut dapat memutus ikatan α-1,6-glikosidik pada pululan (poli-α-1,6-glikosidik). Selain pululanase, enzim lain yang dapat memutus ikatan α-1,6-glikosidik adalah isoamilase. Isoamilase diteliti pada Pseudomonas amyloderamosa dan sering disebut sebagai debranching enzyme, enzim yang dapat memutus α-1,6-glikosidik amilopektin dengan produk polisakarida rantai lurus.
2.4
Mekanisme Katalitik
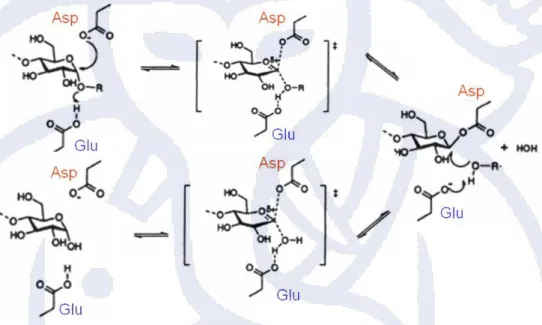
Reaksi katalitik α-amilase terjadi melalui mekanisme alpha retaining double displacement. Pada mekanisme ini melibatkan beberapa residu katalitik pada sisi aktif, yaitu residu asam glutamat (Glu) yang berperan sebagai katalis asam/basa serta residu asam aspartat (Asp) yang berperan sebagai nukleofil.
Gambar 2. 4 Mekanisme katalitik α-amilase
Substrat terikat pada daerah yang disebut subsite. Reaksi katalitik terjadi pada substrat yang berada pada subsite 1 dan -1. Mekanisme alpha retaining double displacement terjadi secara bertahap. Tahap pertama dimulai dengan pengikatan substrat pada sisi aktif. Pada tahap ini terjadi penyerahan proton dari residu asam glutamat (Glu) kepada atom oksigen dari substrat yang berikatan glikosidik pada subsite -1 dan 1. Residu asam aspartat (Asp) bertindak sebagai nukleofil yang menyerang atom C1dari substrat pada subsite -1 dan membentuk ion
oksokarbonium.
Reaksi tersebut diikuti dengan pembentukan intermediet kovalen. Glukosa yang terprotonasi terlepas dari sisi aktif dan menyerang ikatan kovalen yang terbentuk antara glukosa pada subsite -1. Residu asam glutamat yang bertindak sebagai katalis basa dapat menarik proton dari molekul air. Oksigen dari air akan menggantikan ikatan oksokarbonium antarmolekul glukosa pada subsite -1 dan residu aspartat membentuk ikatan glikosida baru antara subsite -1 dan -1.
Pada TAKA-amilase A, residu Glu230 tidak terionisasi membentuk ikatan hidrogen dengan proton residu Asp297 sebelum mengikat substrat. Residu Asp
206
memicu pembentukan intermediet ion karbonium. Ionisasi residu Glu230 menghasilkan gaya tolakan elektrostatik antara residu Glu230 dengan Asp297. Selanjutnya molekul air melakukan penyerangan nukelofilik. Hal ini mengakibatkan melemahnya gaya tolakan antara dua residu (terbentuk ikatan hidrogen antara dua sisi katalitik). Glu230 mengabstraksi ion hidroksi yang teraktivasi. Ion hidroksi ini menyerang ion intermediet untuk mengakhiri reaksi.
2.5
Bakteri Laut Penghasil α-Amilase
Laut merupakan suatu ekosistem yang terdiri dari makroorganisme dan mikroorganisme. Baik makroorganisme maupun mikroorganisme laut mampu menghasilkan enzim-enzim tertentu yang digunakan untuk proses metabolisme. Bakteri laut yang bersifat aerob mampu menghasilkan amilase, deoksiribonuklease, lipase, dan protease. Ada juga bakteri laut yang diketahui mampu menghasilkan enzim alginat liase, glukanase, kitinase, glutaminase dan DNA polimerase [Chandrasekaran, 1997].
Banyak penemuan bakteri laut yang menunjukkan adanya kemampuan mendegradasi pati. Ada tujuh isolat yang diperoleh dari usus abalon, Haliotis discus hannai. Dari ketujuh isolat tersebut, terdapat tiga isolat yang menunjukkan adanya aktivitas α-amilase. Ketiga isolat tersebut diidentifikasi sebagai Vibrio alginolyticus V447, Vibrio harveyi NCIMB 1280T, dan Vibrio splendidus biovar I HUPF 91 17T [Sawabe et al., 1998]. Selain itu, isolat bakteri laut yang mampu mendegradasi pati adalah Shewanella sp. Dari dua belas isolat dari genus Shewanella diperoleh tiga isolat bakteri yang mempunyai aktivitas -amilase, yaitu Shewanella collweliana, Shewanella woodyi, dan Shewanella japonica. Shewanella japonica juga diduga mempunyai kemampuan untuk melakukan proses fermentasi terhadap D-glukosa [Satomi et al., 2003].
2.6
α-Amilase Pendegradasi Pati Kentang
Belum banyak penemuan α-amilase yang mempunyai aktivitas pendegradasi pati kentang. Pada umumnya, α-amilase pendegradasi pati kentang diperoleh dari pati kentang itu sendiri. Namun, akhir-akhir ini ditemukan bakteri yang mampu mendegradasi butir pati kentang. Salah satu bakteri yang mempunyai kemampuan tersebut adalah Bacillus subtilis 65.
α-Amilase dari B. subtilis 65 mempunyai aktivitas pendegradasi butir pati kentang. Degradasi α-amilase dari B. subtilis 65 mempunyai pola tertentu. α-Amilase dari B.subtilis 65 mendegradasi G4, G5, G6 menjadi G1, G2 dan G3. G3 yang terbentuk dapat terdegradasi menjadi G1. Namun pada inkubasi 48 jam, G3 yang terbentuk tidak bisa terdegradasi lagi [Hayashida et al., 1988].
2.7
Danau Kakaban
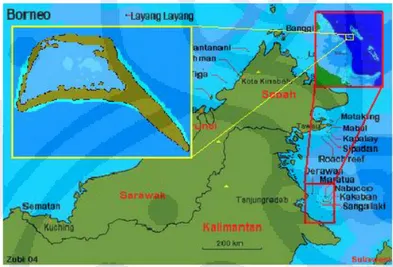
Danau Kakaban merupakan laguna dari sebuah atol yang terbentuk dari pengangkatan terumbu karang sekelilingnya ke atas permukaan air laut sebagai akibat adanya aktivitas tektonik, sehingga sebagian air laut terperangkap di dalamnya. Lima kilometer persegi air laut terperangkap di dalam pematang dengan ketinggian 50 m. Dengan demikian, Danau Kakaban merupakan danau air laut. Danau ini terletak di Pulau Kakaban, yang termasuk dalam Kepulauan Derawan, Kabupaten Berau, Kalimantan Timur [http://www.terangi.or.id].
Gambar 2. 5 Peta lokasi Danau Kakaban
Di kawasan Danau Kakaban ini terdapat beberapa spesies ubur-ubur, antara lain Aurelia aurita, berbadan bening mirip piring kaca; Tripedalia cystophora, ubur-ubur seukuran ujung jari telunjuk; serta Martigias papua, ubur-ubur yang menyerupai bola lampu pijar berwarna biru kecoklatan. Selain itu, terdapat juga spesies ubur-ubur Cassiopeia ornate. Ubur-ubur jenis ini berenang terbalik dengan tentakel menghadap ke atas. Perilaku itu merupakan bentuk adaptasi akibat keterbatasan makanan di danau, sehingga membuat ubur-ubur itu melakukan simbiosis mutualisme dengan alga hijau, zooxanthellae. Alga tersebut memerlukan bantuan sinar matahari untuk menghasilkan makanan [http://www.terangi.or.id].
2.8
Penapisan Aktivitas α-Amilase
Penapisan aktivitas α-amilase merupakan proses pemilahan/ penyaringan beberapa bakteri yang mempunyai aktivitas amilolitik. Dalam proses ini, beberapa bakteri tersebut ditumbuhkan pada media yang mengandung pati (amilosa dan amilopektin). Untuk penapisan aktivitas amilolitik dapat digunakan beberapa teknik, seperti teknik pembentukan kompleks pati-iodin, teknik degradasi pati-remazol brilliant blue serta teknik degradasi red amylopectine.
2.8.1
Teknik pembentukan kompleks pati-iodin
Penapisan aktivitas α-amilase dengan teknik pembentukan kompleks pati-iodin didasarkan pada penentuan aktivitas α-amilase dengan metode Fuwa. Uji positif ditandai dengan terbentuknya daerah terang dengan latar biru/ungu di sekitar kultur (pada media pertumbuhan yang mengandung pati) setelah penambahan larutan KI/I2.
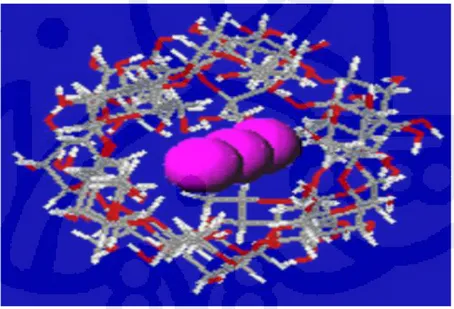
Gambar 2. 6 Struktur pati-iodin
Warna biru/ungu tersebut merupakan warna dari kompleks pati-iodin. Iodin dan pati akan saling berinteraksi, iodin tersebut terperangkap dalam struktur pati (Gambar 2.6). Pada akhirnya terjadi kompleks pati-iodin tersebut yang berwarna. Reaksi tersebut merupakan reaksi yang bersifat spesifik terhadap pati. Dengan demikian, uji tersebut dapat digunakan sebagai analisis pati dalam sampel baik kualitatif maupun kuantitatif.
Keberadaan α-amilase akan mendegradasi pati menjadi glukosa, sehingga warna biru/ungu yang terbentuk akan semakin hilang (muncul daerah terang). Aktivitas α-amilase dapat diperiksa dengan hilangnya warna biru/ungu (muncul daerah terang) pada medium pertumbuhan setelah penambahan iodin.
2.8.2
Teknik degradasi pati-
remazol brilliant blue
Teknik ini tidak jauh berbeda dengan teknik pembentukan kompleks pati-KI/I2. Dalam
penggunaannya, teknik ini sangat efektif untuk penapisan aktivitas α-amilase. Media pertumbuhan yang digunakan mengandung remazol brilliant blue yang membentuk kompleks dengan pati.
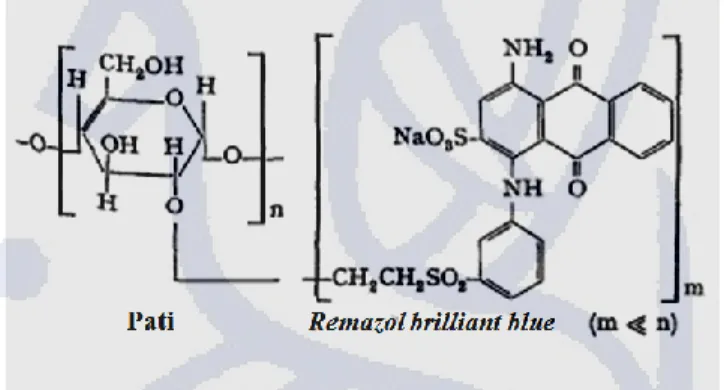
Gambar 2.7 Struktur pati-remazol brilliant blue
Berdasarkan Gambar 2.7, kompleks pati-remazol brilliant blue terjadi melalui interaksi antara gugus atom O pada posisi kedua dari glukosa (dalam pati) dengan atom C pada remazol brilliant blue. Kompleks yang terbentuk tersusun dari polimer glukosa dan remazol brilliant blue dengan perbandingan glukosa:remazol brilliant blue adalah m:n, dengan m lebih kecil dari n.
Indikasi adanya aktivitas α-amilase ditandai adanya warna terang dengan latar biru di sekitar kultur bakteri. Warna terang tersebut merupakan hasil degradasi kompleks pati-remazol brilliant blue. Adanya aktivitas α-amilase menyebabkan kompleks pati-remazol brilliant blue menjadi rusak. Hal ini terjadi karena kompleks pati-remazol brilliant blue hanya terjadi ketika terdapat pati dalam media. Jika konsentrasi pati berkurang (degradasi pati akibat adanya aktivitas amilase), kompleks tersebut akan berkurang juga. Hal ini menyebabkan terbentuknya warna terang di sekitar kultur bakteri. Teknik penapisan aktivitas enzim dengan cara pewarnaan substrat telah banyak dilakukan. Red amylose, blue xylan serta orange HE-cellulose merupakan contoh senyawa yang digunakan untuk penapisan aktivitas amilase,
xilanase dan selulase. Adanya aktivitas positif ditunjukkan dengan munculnya daerah terang di sekitar kultur bakteri [Ten et al., 2004].
2.8.3
Teknik degradasi
red amylopectine
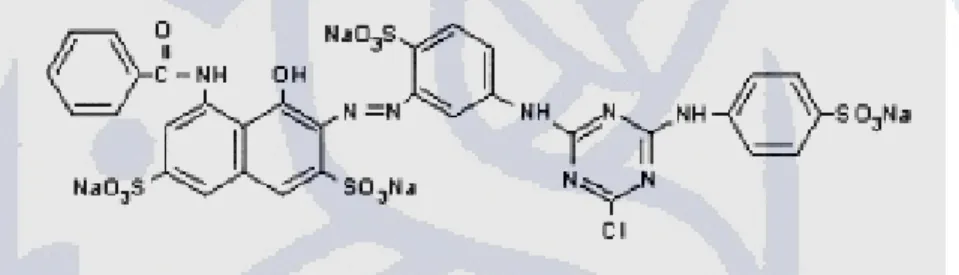
Teknik penapisan dengan red amylopectine pada dasarnya sama seperti teknik degradasi kompleks pati-remazol brilliant blue, amylose blue, red xylan serta orange HE-cellulose. Hal yang berbeda dari teknik ini adalah pemakaian amilopektin untuk pembentukan kompleks red amylopectine. Pada teknik ini substrat yang dipakai hanya amilopektin (dalam media pertumbuhan). Amilopektin sebagai substrat yang terikat dengan cibacron brilliant red 3b-a. Adanya aktivitas amilase ditunjukkan dengan adanya warna terang di sekitar kultur bakteri dengan latar warna merah. Struktur dari cibacron brilliant red 3b-a dapat dilihat pada Gambar 2. 8.
Gambar 2. 8 Struktur cibacron brilliant red 3b-a
Teknik degradasi red amylopectine dapat digunakan untuk uji aktivitas α-amilase secara kuantitatif dengan metode spektrofotometri. Panjang gelombang maksimal (λmax.) red
amylopectine adalah 517 nm. Dengan demikian, pengukuran aktivitas α-amilase dengan red amylopectine dapat dilakukan pada λ517 [O’Mahony, 2002].
2.9
Aktivitas α-Amilase
Aktivitas α-amilase dapat ditentukan dengan beberapa metode. Aktivitas α-amilase pada masing-masing metode dilihat dari sudut pandang yang berbeda. Adapun beberapa metode untuk menentukan aktivitas α-amilase antara lain, metode Fuwa dan metode DNS
2.9.1
Metode Fuwa
Metode ini didasarkan pada pembentukan kompleks antara sisa pati yang tak terdegradasi dengan iodin. Dalam suatu larutan, adanya pati dapat diperiksa dengan munculnya warna biru/ungu setelah penambahan iodin. Kompleks pati-iodin yang terbentuk masing-masing jenis pati berbeda satu sama lain. Hal ini dipengaruhi oleh jumlah residu glukosa (monomer) penyusun pati tersebut [Robyt, 1998].
2.9.2
Metode DNS
Uji aktivitas α-amilase dengan asam dinitro salisilat (DNS) didasarkan pada prinsip reaksi reduksi-oksidasi. Hidrolisis pati menghasilkan molekul oligosakarida dan monosakarida yang mempunyai ujung gugus pereduksi. Ujung gugus pereduksi tersebut mempu mereduksi asam dinitro salisilat yang berwarna kuning menjadi spesi tereduksinya yang berwarna jingga. Perubahan warna tersebut dapat ditentukan dengan analisis spektrometri.
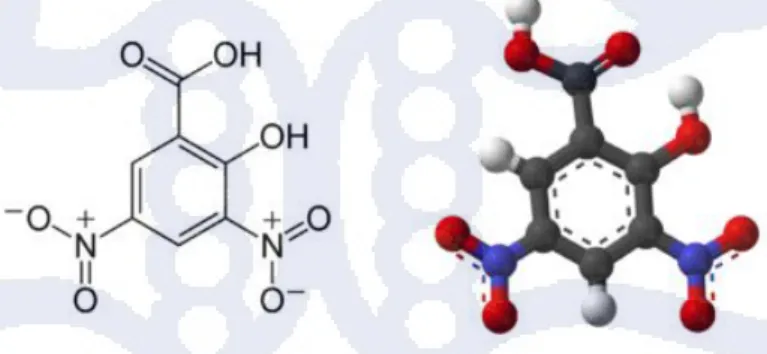
Adanya aktivitas α-amilase menghasilkan molekul oligosakarida dan monosakarida yang mempunyai gugus pereduksi. Dengan demikian, jumlah ujung gugus pereduksi dalam larutan bertambah. Adanya penambahan jumlah ujung pereduksi ini akan mempengaruhi perubahan warna pada uji DNS. Pada uji DNS ini, larutan pati diinkubasi dengan α-amilase pada suhu optimumnya. Sebagai kontrol, α-amilase diinaktivasi terlebih dulu dengan penambahan asam. Aktivitas α-amilase pada uji DNS ini ditentukan dengan membandingkan nilai absorbansi sampel dengan kontrol. Struktur dari asam dinitro salisilat dapat dilihat pada Gambar 2. 9.
Adanya aktivitas α-amilase ditunjukan dengan perubahan warna larutan dari kuning menjadi jingga. Hal ini disebabkan oleh reduksi gugus nitro (-NO2) menjadi amina (-NH2) oleh ujung
gula pereduksi hasil degradasi pati oleh α-amilase. Pada pengujian aktivitas α-amilase dengan metode DNS ditentukan dengan spektrometri pada panjang gelombang 500 nm.