i
SINTESIS SENYAWA 3-ETIL-2-PENTANON DARI ETIL ASETOASETAT DAN ETIL BROMIDA MENGGUNAKAN KATALIS ETOKSIDA MELALUI REAKSI ALKILASI DAN DEKARBOKSILASI
TUGAS AKHIR SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian
Persyaratan Guna Memperoleh Gelar Sarjana Sains
Oleh :
Devry Pramesti Putri NIM 13307141030
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
ii
SINTESIS SENYAWA 3-ETIL-2-PENTANON DARI ETIL ASETOASETAT DAN ETIL BROMIDA MENGGUNAKAN KATALIS ETOKSIDA MELALUI REAKSI ALKILASI DAN DEKARBOKSILASI
Oleh :
Devry Pramesti Putri NIM 13307141030
Pembimbing skripsi : Drs. Karim Theresih, SU
ABSTRAK
Tujuan dari penelitian ini adalah mensintesis senyawa 3-etil-2-pentanon dari etil asetoasetat dan etil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi; mengetahui rendemen senyawa hasil sintesis; dan mengidentifikasi senyawa hasil sintesis menggunakan FTIR dan GC-MS.
Penelitian ini menggunakan etil asetoasetat dan etil bromida sebagai bahan dasar sintesis 3-etil-2-pentanon. Sintesis diawali dengan reaksi alkilasi antara etil asetoasetat dan etil bromida dengan perbandingan mol 1:1. menggunakan katalis etoksida pada suhu 78oC selama 3 jam. Dilanjutkan reaksi hidrolisis dan dekarboksilasi pada suhu 103oC selama 2 jam. Senyawa hasil sintesis diidentifikasi menggunakan FTIR dan GC-MS.
Hasil penelitian menunjukkan bahwa sintesis senyawa 3-etil-2-pentanon dari etil asetoasetat dan etil bromida menggunakan katalis etoksida tidak berhasil, dan diduga menghasilkan senyawa yang lain yaitu 4-hidroksi-4-metil-2-pentanon.
Kata kunci: etil asetoasetat, etil bromida, etoksida, alkilasi, hidrolisis, dekarboksilasi
iii
SYNTHESIS OF COMPOUNDS 3-ETHYL-2-PENTANONE FROM ETHYL ACETOACETAT AND ETHYL BROMIDE USING ETHOXIDE
CATALYST THROUGH ALKYLATION AND DEKARBOXYLATION REACTIONS
By:
Devry Pramesti Putri NIM 13307141030
Supervisor : Drs. Karim Theresih, SU
ABSTRACT
The purpose of this research was to synthesis the compound 3-ethyl-2-pentanone from ethyl acetoacetate and ethyl bromide using ethoxide catalyst through alkylation and dekarboxylation reactions; to know the yield of the compound of the synthesis; and identifying compound synthesized using FTIR and GC-MS.
This research using ethyl acetoacetate and ethyl bromide as the basic ingredient of 3-ethyl-2-pentanone synthesis. The synthesis starting by alkylation between ethyl acetoacetate and ethyl bromide using ethoxide catalyst on temperature 78oC for 3 hours with mole ratio 1:1. Continued with hydrolysis and decarboxylation reactions on temperature 103oC for 2 hours. The compound of synthesis product were identified using FTIR and GC-MS.
The result showed that the synthesis of compound 3-ethyl-2-pentanone from ethyl acetoacetate and ethyl bromide using ethoxide catalyst had not succesfull, and it was suspected produce another compound that is 4-hydroxy-4-methyl-2-pentanone.
Keywords: ethyl acetoacetate, ethyl bromide, ethoxide, alkylation, hydrolysis, decarboxylation
iv
HALAMAN PERSETUJUAN
Tugas Akhir Skripsi dengan Judul
SINTESIS SENYAWA 3-ETIL-2-PENTANON DARI ETIL ASETOASETAT DAN ETIL BROMIDA MENGGUNAKAN KATALIS ETOKSIDA MELALUI REAKSI ALKILASI DAN DEKARBOKSILASI
v
HALAMAN PENGESAHAN
Tugas Akhir Skripsi
SINTESIS SENYAWA 3-ETIL-2-PENTANON DARI ETIL ASETOASETAT DAN ETIL BROMIDA MENGGUNAKAN KATALIS ETOKSIDA MELALUI REAKSI ALKILASI DAN DEKARBOKSILASI
Disusun oleh : Devry Pramesti Putri
NIM 13307141030
Telah dipertahankan di depan Tim Penguji Tugas Akhir Skripsi Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Negeri Yogyakarta Pada tanggal Agustus 2017
TIM PENGUJI
Nama/Jabatan Tanda Tangan Tanggal
Drs. Karim Theresih, SU. ……… ………
Ketua penguji/Pembimbing
Prof. Dr. Indyah Sulistyo Arty, M.S. ……… ……… Penguji I
Dr. Sri Handayani, M.Si. ……… ………
Penguji II
Yogyakarta, Agustus 2017
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta
Dekan,
Dr. Hartono
vi
HALAMAN PERNYATAAN
Saya yang bertanda tangan di bawah ini : Nama : Devry Pramesti Putri NIM : 13307141030
Program Studi : Kimia
Judul TAS : Sintesis Senyawa 3-Etil-2-Pentanon dari Etil Asetoasetat dan Etil Bromida Menggunakan Katalis Etoksida Melalui Reaksi Alkilasi dan Dekarboksilasi
menyatakan bahwa skripsi ini benar-benar karya saya sendiri. Sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang ditulis atau diterbitkan orang lain kecuali sebagai acuan atau kutipan dengan mengikuti tata penulisan karya ilmiah yang telah lazim.
Yogyakarta, Agustus 2017 Yang menyatakan,
Devry Pramesti Putri NIM 13307141030
vii
HALAMAN MOTTO
“Tidak ada daya dan upaya kecuali dengan bantuan dari Allah”
“Sesungguhnya sesudah kesulitan itu ada kemudahan” (QS. Asy-syarh: 6)
“Mencoba adalah berani menerima kegagalan. Dan terus mencoba dapat diartikan sebuah ketangguhan.”
~ Devry Pramesti Putri ~
“Your time is limited, so don’t waste it living someone else’s life. Don’t be trapped by dogma which is living with the result of other people’s thinking. Don’t
let the noise of other’s opinions drown out your own inner voice. And most important, have the courage to follow your heart and intuitions.”
~ Steve Jobs ~
“Belajarlah dari masa lalu, hiduplah untuk masa depan.” ~ Albert Einstein ~
viii
HALAMAN PERSEMBAHAN
Skripsi ini kupersembahkan teruntuk: Sukirna | Purwanti
Bapak & mamah tercinta, terkasihi dan tersayang yang senantiasa selalu memberikan kasih sayang, cinta, do’a, nasehat, semangat, motivasi, dan dukungan
baik secara material maupun non material. Terimakasih untuk semuanya, mah, pak. Semoga api bisa terus membanggakan mamah sama bapak.
Vyandra Areska Yulianto
Adikku tersayang, yang turut memberikan semangat dan menjadi alasan atas mengapa aku harus bersekolah setinggi mungkin serta memotivasiku untuk
menjadi panutan yang baik. Semangat sekolahnya, dek. Buat mamah sama bapak bangga.
Bayu Hendrawati | Erna Warisman | Nurul Dwi Syafitri
Sahabat tersayang yang telah membersamaiku selama 4 tahun ini, memberikan warna disetiap hari-hariku, menjadikan alasan dan penguat agar aku tetap bertahan
di kota istimewa ini. Terimakasih telah mengizinkanku menjadi bagian dalam sejarah kalian dan begitupun sebaliknya. Sukses buat kalian semua.
Maya Tri Hartanti
Partner kerjaku baik PKL maupun skripsi, yang selalu memberi semangat dan nasehat. Terimakasih telah menjadi teman untuk berkeluh kesah baik itu tentang
penelitian ataupun yang lainnya.Semangat may, innallaha ma’ashobirin. Teman-teman Kimia Organik | Kimia B 2013 | Sahabat di Karawang Terimakasih karena kalian telah memberikan warna dalam kehidupanku, tiada hentinya memberikanku perhatian dan dukungan, nasehat dan semangat, tempat
ix
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas berkat rahmat dan karunia-Nya, penulis dapat menyelesaikan Tugas Akhir Skripsi dengan judul “Sintesis Senyawa 3-etil-2-pentanon dari Etil Asetoasetat dan Etil Bromida Menggunakan Katalis Etoksida Melalui Reaksi Alkilasi dan Dekarboksilasi”, shalawat serta salam tak lupa tercurahkan kepada Nabi Muhammad SAW yang dinantikan syafa’atnya di yaumil akhir.
Tugas Akhir Skripsi ini dapat diselesaikan tidak lepas dari bantuan dan kerjasama dengan pihak lain. Berkenaan dengan hal tersebut, penulis menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Sutrisna Wibawa, M.Pd. selaku Rektor Universitas Negeri Yogyakarta.
2. Dr. Hartono selaku Dekan FMIPA Universitas Negeri Yogyakarta yang memberikan persetujuan pelaksanaan Tugas Akhir Skripsi ini.
3. Drs. Jaslin Ikhsan, M.App.Sc., Ph.D selaku Ketua Jurusan Pendidikan Kimia UNY dan Ketua Prodi Kimia UNY yang telah memberikan bantuan dan fasilitas selama proses penyusunan pra proposal sampai dengan selesainya Tugas Akhir Skripsi ini.
4. Drs. Karim Theresih, SU selaku Dosen Pembimbing Tugas Akhir Skripsi yang telah banyak memberikan semangat, dorongan, dan bimbingan selama penyusunan Tugas Akhir Skripsi ini.
x
5. Prof. Dr. Indyah Sulistyo Arty, M.S. dan Dr. Sri Handayani, M.Si selaku Penguji Utama dan Penguji Pendamping yang telah memberikan kritik dan saran terhadap Tugas Akhir Skripsi ini.
6. Dra. Cornelia Budimarwanti, M.Si selaku Pembimbing Akademik yang telah memberikan semangat, dorongan, nasehat dan bimbingan selama masa perkuliahan hingga penyusunan Tugas Akhir Skripsi ini.
7. Seluruh Dosen, Staff, dan Laboran Jurusan Pendidikan Kimia UNY yang telah membantu selama perkuliahan dan penelitian.
8. Keluarga, sahabat, dan teman-teman yang telah memberikan motivasi, semangat, nasehat, dan keceriaan selama masa perkulihahan.
9. Semua pihak secara langsung maupun tidak langsung yang tidak dapat disebutkan disini atas bantuan dan perhatiannya selama penyusunan Tugas Akhir Skripsi ini.
Akhirnya, semoga segala bantuan yang telah berikan semua pihak di atas menjadi amalan yang bermanfaat dan mendapatkan balasan dari Allah SWT dan semoga Tugas Akhir Skripsi ini bisa menjadi informasi bermanfaat bagi pembaca atau pihak lain yang membutuhkannya.
Yogyakarta, Agustus 2017 Penulis,
Devry Pramesti Putri NIM 13307141030
xi DAFTAR ISI Halaman HALAMAN JUDUL ... i ABSTRAK ... ii ABSTRACT ... iii HALAMAN PERSETUJUAN ... iv HALAMAN PENGESAHAN ... v HALAMAN PERNYATAAN ... vi
HALAMAN MOTTO ... vii
HALAMAN PERSEMBAHAN ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1 A. Latar Belakang... 1 B. Identifikasi Masalah ... 3 C. Pembatasan Masalah ... 3 D. Rumusan Masalah ... 4 E. Tujuan Penelitian ... 4 F. Manfaat Penelitian ... 4
BAB II KAJIAN TEORI ... 5
A. Kajian Teori ... 5
1. Etil Asetoasetat ... 5
2. Etil Bromida ... 7
3. Reaksi Alkilasi Etil Asetoasetat ... 8
xii
5. Spektroskopi FTIR ... 16
6. Spektroskopi GC-MS ... 18
B. Penelitian yang Relevan ... 19
C. Kerangka Berpikir ... 20
BAB III METODE PENELITIAN ... 21
A. Subjek dan Objek Penelitian ... 21
1. Subjek Penelitian ... 21
2. Objek Penelitian ... 21
B. Alat dan Bahan Penelitian ... 21
1. Alat-alat Penelitian ... 21
2. Bahan-bahan Penelitian ... 21
C. Prosedur Penelitian ... 22
1. Reaksi Alkilasi Etil Asetoasetat ... 22
2. Reaksi Hidrolisis dan Dekarboksilasi ... 22
D. Teknik Analisis Data ... 23
1. Data Kuantitatif ... 23
2. Data Kualitatif ... 23
BAB IV HASIL PENELITIAN DAN PEMBAHASAN ... 24
A. Hasil Penelitian ... 24
1. Hasil sintesis senyawa 3-etil-2-pentanon ... 24
2. Hasil Pengamatan Tahapan Reaksi Alkilasi ... 25
3. Hasil Pengamatan Tahapan Reaksi Alkilasi ... 25
4. Hasil Identifikasi FTIR Senyawa 3-etil-2-pentanon ... 27
5. Hasil Identifikasi GC-MS Senyawa 3-etil-2-pentanon ... 30
B. Pembahasan ... 32
1. Reaksi Alkilasi Etil Asetoasetat ... 32
2. Reaksi Hidrolisis dan Dekarboksilasi ... 36
3. Hasil Identifikasi Hasil Sintesis Menggunakan FTIR ... 39
xiii
BAB V KESIMPULAN DAN SARAN ... 45
A. Kesimpulan... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
xiii
DAFTAR TABEL
Halaman
Tabel 1. Sifat Kimia dan Fisika Etil Asetoasetat ... 6
Tabel 2. Sifat Fisika dan Kimia Etil Bromida ... 7
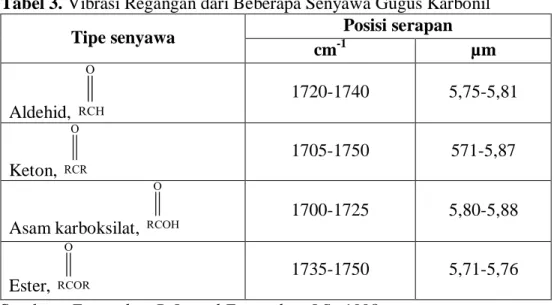
Tabel 3. Vibrasi Regangan dari Beberapa Senyawa Gugus Karbonil ... 17
Tabel 4. Data Pengamatan Hasil Sintesis Senyawa 3-etil-2-pentanon ... 24
Tabel 5. Pengamatan Tahapan Reaksi Alkilasi Etil Asetoasetat dengan Etil Bromida ... 25
Tabel 6. Pengamatan Tahapan Reaksi Hidrolisis dan Dekarboksilasi ... 26
Tabel 7. Daerah Serapan Gugus Fungsi Pada Spektrum IR Hasil Sintesis Percobaan Pertama ... 28
Tabel 8. Daerah Serapan Gugus Fungsi Pada Spektrum IR Hasil Sintesis Percobaan Kedua ... 29
Tabel 9. Daerah Serapan Gugus Fungsi Pada Spektrum IR Hasil Sintesis Percobaan Ketiga ... 30
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Etil Asetoasetat ... 5
Gambar 2. Reaksi Sintesis Etil Asetoasetat ... 5
Gambar 3. Reaksi Sintesis Etil Bromida dari Etanol dan Asam Bromida ... 8
Gambar 4. Reaksi Sintesis Etil Bromida dari Etena dan Asam Bromida ... 8
Gambar 5. Reaksi Alkilasi Enolat Melalui Reaksi SN2 (Fessenden, R.H & Fessenden, J.S., 1999) ... 9
Gambar 6. Reaksi Alkilasi antara Etil Asetoasetat dan Metil Iodida Menggunakan Katalis Natrium Etoksida (Fox & Whitesell, 1947) ... 11
Gambar 7. Mekanisme Reaksi Hidrolisis dan Pembentukan Ester Terkatalis Asam (Miller & Solomon, 1999). ... 13
Gambar 8. Mekanisme Reaksi Hidrolisis Ester Terkatalis Basa (Carey, 2000) ... 14
Gambar 9. Reaksi Dekarboksilasi dari Derivat Asetoasetat ... 15
Gambar 10. Senyawa Hasil Sintesis 3-etil-2-pentanon ... 24
Gambar 11. Spektrum IR Hasil Sintesis Percobaan Pertama ... 27
Gambar 12. Spektrum IR Hasil Sintesis Percobaan Kedua ... 28
Gambar 13. Spektrum IR Hasil Sintesis Percobaan Ketiga ... 29
Gambar 14. Kromatogram Hasil Sintesis Percobaan Kedua ... 30
Gambar 15. Spektrum Massa Hasil Sintesis Percobaan Kedua ... 31
Gambar 16. Kromatogram Hasil Sintesis Percobaan Ketiga ... 32
Gambar 17. Spektrum Massa Hasil Sintesis Ketiga ... 32
Gambar 18. Reaksi Pembentukan Ion Enolat dari Etil Asetoasetat oleh Natrium Etoksida ... 34
Gambar 19. Reaksi Alkilasi Etil Asetoasetat dan Etil Bromida Menggunakan Katalis Natrium Etoksida ... 35
Gambar 20. Pembentukan Ion Enolat Kedua dari Etil Asetoasetat oleh Natrium Etoksida ... 35
xv
Gambar 21. Reaksi Dialkilasi Etil Asetoasetat dan Etil Bromida
Menggunakan Katalis Natrium Etoksida ... 35
Gambar 22. Reaksi Hidrolisis 2-asetil-2-etilpropanoat menjadi Anion 2-asetil-2-etilpropanoat ... 37
Gambar 23. Reaksi Protonasi Anion 2-asetil-2-etilpropanoat menjadi Asam 2-asetil-2-etilpropanoat ... 37
Gambar 24. Reaksi Dekarboksilasi Asam 2-asetil-2-etilpropanoat menjadi Enol ... 38
Gambar 25. Enol Mengalami Tautomerisasi Menjadi Keton ... 38
Gambar 26. Struktur 4-hidroksi-4-metil-2-pentanon ... 41
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Jumlah Bahan Dasar ... 49
Lampiran 2. Bagan Kerja Reaksi Alkilasi Etil Asetoasetat ... 50
Lampiran 3. Bagan Kerja Reaksi Hidrolisis dan Dekarboksilasi ... 51
Lampiran 4. Data FTIR Hasil Sintesis Percobaan Pertama ... 52
Lampiran 5. Data FTIR Hasil Sintesis Percobaan Kedua ... 53
Lampiran 6. Data FTIR Hasil Sintesis Percobaan Ketiga ... 54
Lampiran 7. Data GC-MS Hasil Sintesis Percobaan Kedua ... 55
Lampiran 8. Data GC-MS Hasil Sintesis Percobaan Ketiga ... 56
1 BAB I PENDAHULUAN
A. Latar Belakang
Perkembangan ilmu pengetahuan pada jaman modern ini terus mengalami kemajuan, khususnya dalam bidang sintesis kimia. Sintesis kimia merupakan kegiatan mereaksikan satu senyawa dengan senyawa lain dalam kondisi tertentu untuk memperoleh suatu produk kimia.
Etil asetoasetat merupakan suatu produk kimia hasil reaksi antara dua molekul etil asetat dengan natrium etoksida yang melalui kondensasi Claisen dalam suasana asam. Etil asetoasetat bersifat asam karena memiliki hidrogen α terhadap dua gugus karbonil sehingga nilai pKa etil asetoasetat sama dengan 11. Ester ini lebih asam daripada etanol (pKa = 16) atau air (pKa = 15,7) (Fessenden, R.J & Fessenden, J.S, 1999).
Etil asetoasetat dapat digunakan sebagai zat perantara dalam sintesis kimia maupun produksi di bidang farmasi dan produk kimia seperti asam amino, analgesik, antibiotik, agen antimalaria, antipirin dan aminopirin, serta vitamin B. Selain itu, dapat digunakan dalam pembuatan pewarna, tinta, parfum, plastik, dan pigmen cat.
Menurut Carey, sebagaimana dikutip oleh Firdausiah (2012) Etil asetoasetat berguna sebagai material awal untuk pembuatan keton sebab senyawa ini memiliki keasaman yang tinggi pada hidrogen α serta asamnya yang mudah mengalami dekarboksilasi termal menghasilkan senyawa keton. Keton merupakan
2
senyawa berbau harum yang memiliki dua gugus alkil (aril) yang terikat pada C karbonil. Biasanya senyawa keton digunakan sebagai pelarut.
Penggunaan senyawa etil asetoasetat sebagai zat perantara dalam sintesis kimia telah dilakukan oleh Firdausiah (2012), yang mensintesis senyawa 6-hidroksi-2-heksanon dari reaksi alkilasi antara etil asetoasetat dan 3-bromo-1-propanol dengan basa natrium etoksida pada suhu 78oC selama tiga jam sehingga menghasilkan rendemen sebesar 36,09% berupa cairan bening kekuningan. Pada penelitian ini dikerjakan dengan memvariasikan perbandingan mol pereaksi etil asetoasetat dan 3-bromo-1-propanol.
Sintesis menggunakan etil asetoasetat sebagai material awal dalam pembuatan senyawa keton belum banyak digunakan, khususnya di Indonesia. Oleh karena itu, peneliti bermaksud akan melakukan penelitian yang menggunakan etil asetoasetat sebagai material awal dalam sintesis pembuatan senyawa keton, yaitu sintesis senyawa 3-etil-2-pentanon dari etil asetoasetat dan etil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi. Penelitian tentang sintesis 3-etil-2-pentanon dari etil asetoasetat dan etil bromida menggunakan katalis etoksida ini belum pernah dilakukan sebelumnya, sehingga diharapkan dapat bermanfaat sebagai media pengembangan ilmu sintesis senyawa organik.
Sintesis senyawa 3-etil-2-pentanon ini melibatkan reaksi alkilasi antara etil asetoasetat dan etil bromida menggunakan katalis basa natrium etoksida. Produk hasil reaksi alkilasi selanjutnya dihidrolisis dan dekarboksilasi untuk memperoleh senyawa 3-etil-2-pentanon.
3
Pada penelitian ini, untuk menghasilkan senyawa 3-etil-2-pentanon dilakukan 2 tahapan reaksi yaitu, tahap pertama reaksi alkilasi sedangkan tahap kedua reaksi hidrolisis dan dekarboksilasi. Setelah itu, senyawa hasil sintesis diidentifikasi menggunakan spektroskopi FTIR dan GC-MS.
B. Identifikasi Masalah
Berdasarkan latar belakang yang diuraikan, maka dapat diidentifikasi beberapa masalah sebagai berikut:
1. Bahan dasar yang digunakan dalam sintesis senyawa 3-etil-2-pentanon. 2. Katalis yang digunakan dalam sintesis senyawa 3-etil-2-pentanon. 3. Identifikasi yang digunakan dalam sintesis senyawa 3-etil-2-pentanon.
C. Pembatasan Masalah
Permasalahan pada penelitian ini dibatasi untuk menghindari perluasan masalah, maka dilakukan pembatasan masalah sebagai berikut:
1. Bahan dasar yang digunakan dalam sintesis senyawa 3-etil-2-pentanon adalah etil asetoasetat dan etil bromida.
2. Katalis yang digunakan dalam sintesis senyawa 3-etil-2-pentanon adalah natrium etoksida.
3. Identifikasi yang digunakan dalam sintesis senyawa 3-etil-2-pentanon menggunakan FTIR dan GC-MS.
4 D. Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas, dapat dirumuskan beberapa masalah sebagai berikut:
1. Apakah senyawa 3-etil-2-pentanon dapat disintesis dari etil asetoasetat dan etil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi?
2. Bagaimana cara mengidentifikasi senyawa hasil sintesis? 3. Berapa rendemen senyawa hasil sintesis?
E. Tujuan Penelitian
Sesuai dengan perumusan masalah, penelitian ini bertujuan untuk:
1. Mensintesis senyawa 3-etil-2-pentanon dari etil asetoasetat dan etil bromida meggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi.
2. Mengidentifikasi senyawa hasil sintesis menggunakan FTIR dan GC-MS. 3. Mengetahui rendemen yang diperoleh dari senyawa hasil sintesis.
F. Manfaat Penelitian
Adapun manfaat yang diperoleh dari penelitian ini adalah:
1. Memberikan informasi tentang sintesis senyawa 3-etil-2-pentanon dari etil asetoasetat dan etil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi.
2. Menambah khasanah ilmu pengetahuan sintesis senyawa organik. 3. Sebagai media pengembangan ilmu sintesis senyawa organik.
5 BAB II KAJIAN TEORI
A. Kajian Teori 1. Etil Asetoasetat
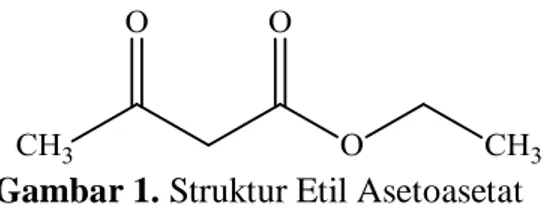
Etil asetoasetat, atau yang dikenal pula dengan nama etil 3-oksobutanoat merupakan turunan dari senyawa organik asam asetat yang memiliki rumus molekul C6H10O3. Senyawa etil asetoasetat memiliki rumus struktur seperti ditunjukkan sebagai berikut:
Gambar 1. Struktur Etil Asetoasetat
Etil asetoasetat mempunyai karakteristik seperti ester yakni memiliki aroma khas seperti buah. Etil asetoasetat banyak digunakan dalam sintesis kimia, salah satunya sebagai zat perantara dalam sintesis senyawa dihidropirimidinon sebagai senyawa antibakteri (Fauziyah, 2015). Etil asetoasetat dapat disintesis dari etil asetat dan natrium etoksida melalui Kondensasi Claisen. Reaksinya sebagai berikut (Hart, 2003):
O O
|| α || 1. NaOCH2CH3
CH3C—OCH2CH3 + H—CH2—C—OCH2CH3
etil asetat etil asetat dalam etanol 2. H3O+
O O || ||
CH3C—CH2—C—OCH2CH3 + CH3CH2OH etil asetoasetat etanol Gambar 2. Reaksi Sintesis Etil Asetoasetat
6
Tabel 1. Sifat Kimia dan Fisika Etil Asetoasetat Massa molekul 130,14 g/mol
Bentuk Cairan tidak berwarna
Titik leleh - 45oC Titik didih 180-184oC
Densitas 1,0358 g/cm3 (17oC)
Kelarutan Sedikit larut dalam air, sangat larut dalam pelarut organik
Sumber : Encyclopedia of Food and Color Additive Volume 1
Menurut Clayden sebagaimana dikutip oleh Firdausiah (2012), berdasarkan struktur kimia dari etil asetoasetat dapat diketahui bahwa senyawa ini memiliki dua posisi hidrogen α, yaitu hidrogen α yang bertetangga dengan gugus karbonil keto dan hidrogen α yang diapit oleh dua gugus karbonil. Keasaman kedua posisi hidrogen α ini berbeda, dimana hidrogen α yang diapit oleh dua gugus karbonil bersifat lebih asam (pKa=11) dibandingkan hidrogen α yang bertetangga dengan gugus karbonil keto (pKa>20).
Akibat memiliki keasaman yang tinggi pada hidrogen α serta asamnya mudah mengalami dekarboksilasi termal untuk menghasilkan senyawa keton, senyawa etil asetoasetat dapat digunakan sebagai material awal untuk pembuatan keton seperti yang telah dilakukan Firdausiah (2012), dalam sintesis senyawa 6-hidroksi-2-heksanon dari reaksi alkilasi antara etil asetoasetat dan 3-bromo-1-propanol dengan basa natrium etoksida.
7 2. Etil Bromida
Etil bromida atau yang memiliki nama lain bromoetana merupakan senyawa kimia dengan rumus molekul CH3CH2Br. Adapun sifat kimia dan fisika etil bromida dapat ditunjukkan pada Tabel 2.
Tabel 2. Sifat Fisika dan Kimia Etil Bromida Massa molekul 108,97 g/mol
Bentuk Cairan tidak berwarna
Titik leleh - 118,09oC (- 180,6oF) Titik didih 38,04 oC (100,5oF)
Densitas 1,46 g/mL
Kelarutan Larut sebagian dalam metanol, dietil eter. Sedikit larut dalam air dingin, air panas. Sumber : Sciencelab.com
Senyawa ini merupakan turunan dari etana dimana salah satu atom hidrogen digantikan oleh atom Bromin. Etil bromida dapat diperoleh dari sintesis etanol dengan asam bromida melalui reaksi substitisi nukleofilik. Reaksi ini terjadi apabila gugus pengganti merupakan pereaksi nukleofil. Asam bromida terionisasi melalui reaksi HBr H+ + Br-. Reaksinya sebagai berikut:
Tahap 1. Penyerangan nukleofil etanol terhadap atom hidrogen asam bromida menghasilkan ion etiloksonium yang bermuatan positif dan gugus lepas Br-.
8
Tahap 2. Ion bromida sebagai pereaksi nukleofil menyerang atom C yang mengikat atom oksigen dan mendorong air keluar.
Gambar 3. Reaksi Sintesis Etil Bromida dari Etanol dan Asam Bromida Etil bromida juga dapat diperoleh dari sintesis antara etena dengan asam bromida melalui reaksi adisi elektrofilik (Sumardjo, 2008). Reaksinya sebagai berikut:
Tahap 1. Penyerangan ikatan rangkap etena pada atom H asam bromida menghasilkan karbonium dan gugus lepas Br-.
Tahap 2. Penyerangan nukleofil pada karbonium
Gambar 4. Reaksi Sintesis Etil Bromida dari Etena dan Asam Bromida
3. Reaksi Alkilasi Etil Asetoasetat
Reaksi alkilasi erat hubungannya dengan pembentukan enolat yang dihasilkan karena adanya perlakuan dengan alkil halida. Reaksi alkilasi berguna untuk tujuan sintesis karena memungkinkan pembentukan ikatan karbon-karbon baru. Ikatan karbon-karbon yang baru terbentuk melalui reaksi
9
tipe SN2. Enolat akan bereaksi melalui tahap reaksi SN2 dengan alkil halida menghasilkan produk teralkilasi. Reaksinya dapat ditunjukkan sebagai berikut:
Gambar 5. Reaksi Alkilasi Enolat Melalui Reaksi SN2 (Fessenden, R.H & Fessenden, J.S., 1999)
Ion enolat jauh lebih berguna dibanding enol dengan dua alasan. Pertama, enol murni secara normal tidak dapat terurai; mereka hanya terbentuk sebagai intermediet yang singkat dalam konsentrasi yang kecil. Sebaliknya, larutan yang mengandung ion enolat murni lebih mudah dibuat dari kebanyakan senyawa karbonil yang apabila diberi perlakuan dengan basa kuat. Ion enolat jauh lebih reaktif dibandingkan dengan enol. Karena ion enolat membawa penuh muatan negatif, yang membuatnya lebih nukleofilik.
Enolat yang lazim digunakan adalah enolat yang diperoleh dari etil asetoasetat. Etil asetoasetat mempunyai hidrogen α yang bersifat protik dan memiliki pKa=11, sehingga akan mudah membentuk enolat dengan adanya ion etoksida (Firdausiah, 2012).
Menurut Clayden yang dikutip oleh Firdausiah (2012), pada reaksi terhadap etil asetoasetat, pemilihan basa menjadi hal yang penting. Pilihan terbaik biasanya suatu alkoksida yang identik dengan komponen alkoksida dari senyawa esternya.
10
Etil asetoasetat dapat mengalami reaksi alkilasi dengan metil iodida menggunakan katalis basa natrium etoksida. Reaksi etil asetoasetat dengan natrium etoksida dalam etanol akan menghasilkan ion enolat. Ion enolat berperan sebagai nukleofil yang menyerang hidrogen α yang diapit oleh dua gugus karbonil. Mekanisme reaksinya dapat ditunjukkan sebagai berikut:
a. Pembentukan ion enolat dari penyerangan nukleofil etoksida terhadap atom Hα etil asetoasetat.
b. Penyerangan ion enolat terhadap atom karbon pusat senyawa metil iodida dan melepaskan gugus lepas I-.
c. Pembentukan ion enolat kedua dari penyerangan nukleofil etoksida terhadap atom Hα etil asetoasetat lain.
d. Penyerangan ion enolat terhadap atom karbon pusat senyawa metil iodida dan melepaskan gugus lepas I- (reaksi alkilasi kedua).
11
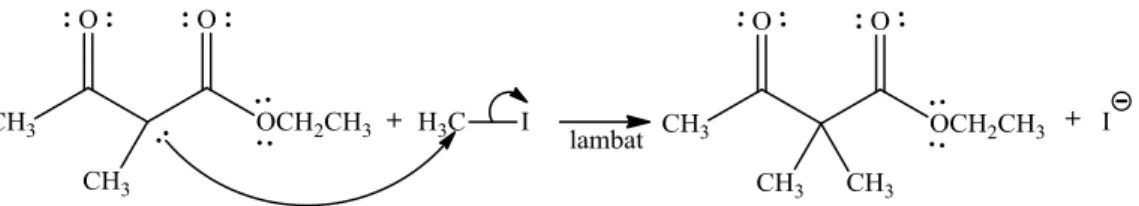
Gambar 6. Reaksi Alkilasi antara Etil Asetoasetat dan Metil Iodida Menggunakan Katalis Natrium Etoksida (Fox & Whitesell, 1947)
Produk yang dihasilkan dari reaksi alkilasi masih mempunyai hidrogen α yang dapat bereaksi kembali dengan ion etoksida. Reaksi alkilasi kedua dapat terjadi dari hidrogen α lain yang terletak pada ikatan karbon-karbon diantara gugus karbonil. Hidrogen α lain kembali diserang oleh nukleofil etoksida dan menghasilkan ion enolat. Selanjutnya ion enolat menyerang atom karbon pusat senyawa metil iodida. Namun, reaksi ini berjalan lambat dibandingkan dengan reaksi alkilasi pertama. Pada alkilasi kedua juga dapat direaksikan dengan alkil halida yang berbeda, menghasilkan produk yang tersubstitusi grup alkil berbeda (Fox & Whitesell, 1947).
Alkil halida yang digunakan adalah alkil halida yang harus tidak memiliki efek sterik (Carey, 2000). Alkil halidanya dapat berupa alkil halida metil, primer, sekunder, dan tersier. Alkil halida metil dan primer memberikan rendemen yang baik; alkil halida sekunder memberikan rendemen yang lebih rendah karena adanya reaksi eliminasi yang menyaingi, sedangkan alkil halida tersier bereaksi hanya melalui eliminasi (Fessenden, R.J., & Fessenden, J.S., 1999).
Ada beberapa reaksi samping yang ditemukan di dalam reaksi alkilasi. Pertama, alkil halida dapat mengalami penataan ulang, sebagai contoh n-propil
12
klorida menghasilkan turunan isopropil; dan yang kedua adalah halida produk dapat bereaksi lebih lanjut (Firdaus, 2012).
4. Reaksi Hidrolisis dan Dekarboksilasi Ester Asetoasetat
Hidrolisis merupakan reaksi pemecahan senyawa kimia menggunakan air. Secara umum, reaksi hidrolisis dapat terjadi ketika suatu asam bertemu dengan basa yang akan menghasilkan garam dan air (Abi, 2017). Reaksi hidrolisis selalu melibatkan air, namun dalam reaksi hidrolisis ester dibantu dengan katalis. Ester dapat mengalami hidrolisis menjadi asam karboksilat dan alkohol.
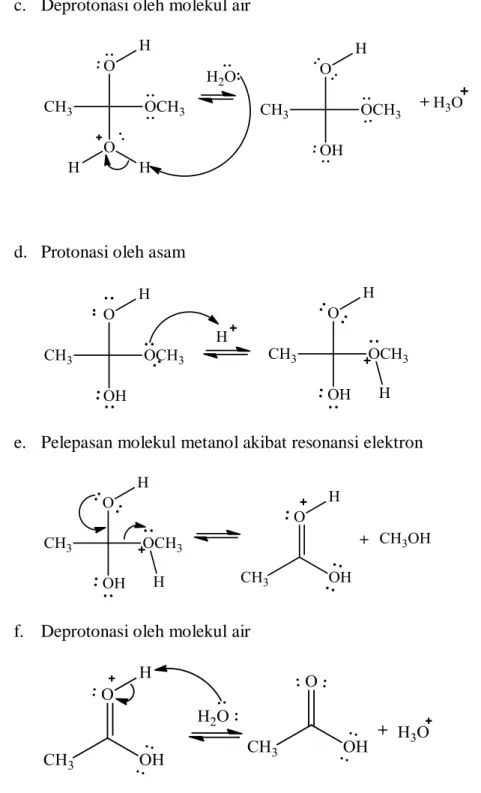
Hidrolisis ester menjadi asam karboksilat dapat terjadi baik menggunakan katalis asam maupun katalis basa. Pada hidrolisis ester terkatalisis asam, semua tahapannya bersifat reversible, dan mekanisme pembentukan ester merupakan kebalikan dari hidrolisis ester. Mekanismenya ditunjukkan pada Gambar 7.
a. Protonasi oleh asam
13 c. Deprotonasi oleh molekul air
d. Protonasi oleh asam
e. Pelepasan molekul metanol akibat resonansi elektron
f. Deprotonasi oleh molekul air
Gambar 7. Mekanisme Reaksi Hidrolisis dan Pembentukan Ester Terkatalis Asam (Miller & Solomon, 1999).
Hidrolisis ester terkatalisis basa, dapat disebut juga dengan reaksi penyabunan (saponifikasi), yaitu reaksi hidrolisis yang bersifat irreversible.
14
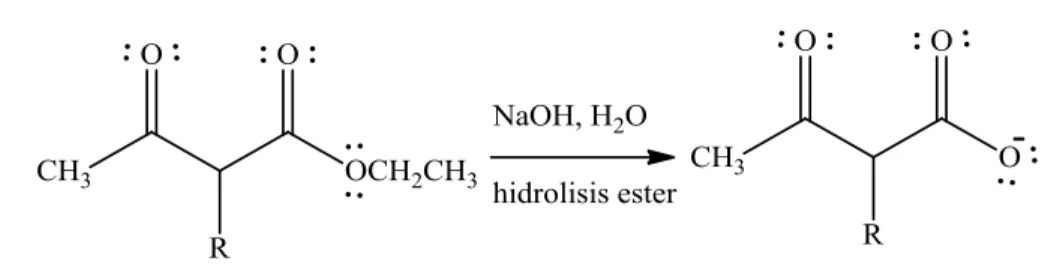
Hal ini karena pada kondisi ini, asam karboksilat terkonversi menjadi anion karboksilat dan anion ini tidak dapat mentransfer asil ke alkohol. Mekanismenya ditunjukkan pada Gambar 8.
a. Penyerangan nukleofil hidroksida terhadap atom C karbonil
b. Pelepasan gugus metoksi akibat reonansi elektron
c. Penyerangan gugus metoksi terhadap proton dari asam karboksilat
Gambar 8. Mekanisme Reaksi Hidrolisis Ester Terkatalis Basa (Carey, 2000) Dekarboksilasi merupakan reaksi penghilangan CO2 dari gugus karboksil (Bettelheim, 2013). Dekarboksilasi dapat terjadi hanya dengan gugus karbonil kedua tepat pada posisi β asam, karena produk dekarboksilasi harus diubah sebagai enol. Enol yang dihasilkan akan mengalami tautomerisasi menjadi keton. Kondisi dekarboksilasi harus pada suhu yang tinggi untuk melepaskan CO2 (Clayden, Greeves, and Warren, 2012). Suhu yang digunakan dalam reaksi
15
dekarboksilasi berkisar 140-160 oC (Allinger, 1980). Mekanisme reaksi dekarboksilasi dari derivat asetoasetat dapat ditunjukkan pada Gambar 9.
a. Reaksi hidrolisis terkatalis basa menggunakan NaOH yang telah dilarutkan dengan aquades
b. Reaksi protonasi anion karboksilat menjadi asam karboksilat
c. Reaksi dekarboksilasi menggunakan suhu tinggi menghasilkan enol
d. Enol mengalami tautomerisasi menjadi keton
16
Saponifikasi dan dekarboksilasi dari derivat teralkilasi etil asetoasetat dapat menghasilkan keton. Reaksi ini disebut sintesis ester asetoasetat. Reaksi ini merupakan prosedur standar pembentukan keton dari etil asetoasetat dan alkil halida menggunakan katalis etoksida (Carey, 2000).
5. Spektroskopi FTIR
Spektroskopi infrared atau inframerah merupakan suatu metode yang mengamati interaksi molekul dengan gelombang elektromagnetik yang berada pada panjang gelombang 0,75-1000 µm atau pada bilangan gelombang 13.000-10 cm-1 (Atun, 2016). Fungsi utama dari spektroskopi inframerah ini adalah memberikan informasi mengenai jenis gugus fungsional yang terdapat dalam senyawa yang tidak diketahui.
Spektroskopi FTIR (Fourier Transform Infra Red) merupakan metode instrumen inframerah modern yang digunakan untuk mendapatkan spektrum inframerah dari absorbansi, emisi, fotokonduktivitas atau Raman Scattering dari sampel padat, cair, dan gas (Fauzi, 2016). Prinsip kerja spektrofotometer inframerah adalah cahaya dari sumber dilewatkan melalui cuplikan kemudian dipecah menjadi frekuensi-frekuensi tunggal dalam monokromator dan intensitas relatif dari frekuensi masing-masing diukur oleh detektor (Atun, 2016).
Salah satu serapan paling khas dalam spektrum inframerah adalah kelompok gugus karbonil, menghasilkan puncak dengan intensitas kuat yang berada pada bilangan gelombang 1640-1820 cm-1. Senyawa aldehid, keton,
17
asam karboksilat, dan ester termasuk ke dalam kelompok gugus karbonil. Vibrasi regangan dari beberapa senyawa gugus karbonil dapat ditunjukkan pada Tabel 3.
Tabel 3. Vibrasi Regangan dari Beberapa Senyawa Gugus Karbonil
Tipe senyawa Posisi serapan
cm-1 µm Aldehid, 1720-1740 5,75-5,81 Keton, 1705-1750 571-5,87 Asam karboksilat, 1700-1725 5,80-5,88 Ester, 1735-1750 5,71-5,76
Sumber : Fessenden, R.J., and Fessenden, J.S., 1998
Keton memberikan spektra sederhana dari senyawa karbonil. Jika senyawa keton alifatik, akan memiliki regangan absorpsi yang kuat dan mengandung gugus C=O, C-H dan C-C.
Analisis menggunakan spektrofotometer FTIR memiliki beberapa kelebihan utama dibandingkan dengan spektrofotometer IR yaitu:
1. Dapat digunakan pada semua frekuensi dari sumber cahaya secara simultan, sehingga analisis dapat dilakukan lebih cepat.
2. Sensitivitas FTIR adalah 80-200 kali lebih tinggi dari instrumentasi dispersi standar karena resolusinya lebih tinggi .
3. Pada FTIR, mekanik optik lebih sederhana dengan sedikit komponen yang bergerak dibanding spektroskopi IR, sehingga dapat mengidentifikasi
18
material yang belum diketahui, serta dapat menentukan kualitas dan jumlah komponen sebuah sampel.
6. Spektroskopi GC-MS
Spektroskopi Massa merupakan suatu metode identifikasi yang tidak menggunakan interaksi antara gelombang elektromagnetik dengan materi, tetapi dengan menembakkan elektron berenergi tinggi (70 eV) pada sampel dalam keadaan gas, sehingga membentuk ion molekul dan ion fragmen (pecahan), selanjutnya ion akan dipisahkan berdasarkan massa/rasio muatan yang terekam sebagai data spektrum massa. Di dalam medan magnet, partikel-partikel bermuatan positif akan dibelokkan, sedangkan partikel-partikel-partikel-partikel yang tidak bermuatan (netral) tidak dibelokkan, sehingga partikel bermuatan positif yang akan terdeteksi dalam spektrofotometer massa (Atun, 2016).
Kromatografi Gas-Spektroskopi Massa merupakan kombinasi sinergis dari dua teknik mikroanalisis yang sangat baik. Kromatografi gas memisahkan komponen dari campuran dalam waktu tertentu dan spektrometer massa menghasilkan informasi yang membantu dalam indentifikasi dari masing-masing komponen (Kitson, Larsen, and Mc Ewen, 2011).
Secara umum spektrometer massa berfungsi untuk menghasilkan berkas sinar kation dari zat, menghasilkan berkas kation menjadi bentuk spektrum (m/z), serta mendeteksi dan mencatat nilai massa relatif (m/z) dan kelimpahan isotopnya (%) atau intensitasnya (Atun, 2016). Spekrometer massa juga dapat digunakan untuk menetapkan massa molekul (Hart, 2003).
19
Keunggulan dari metode ini adalah sebagai berikut :
1. Efisien dan resolusi tinggi sehingga dapat digunakan untuk menganalisa partikel berukuran sangat kecil seperti polutan dalam udara
2. Aliran fasa bergerak (gas) sangat terkontrol dan kecepatannya tetap
3. Sensitivitas tinggi sehingga dapat memisahkan berbagai senyawa yang saling bercampur dan mampu menganalisa berbagai senyawa meskipun dalam kadar/konsentrasi rendah. Seperti dalam udara, terdapat berbagai macam senyawa yang saling bercampur dan dengan ukuran partikel/molekul yang sangat kecil.
B. Penelitian yang Relevan
Reaksi alkilasi etil asetoasetat telah dilakukan oleh Firdausiah (2012) yaitu dengan mensintesis senyawa 6-hidroksi-2-heksanon sebagai tahapan awal sintesis molekul feromon seks Conopomorpha Cramerella. Senyawa tersebut diperoleh dari alkilasi senyawa etil asetoasetat dan 3-bromo-1-propanol dengan katalis basa natrium etoksida pada suhu 78oC selama 3 jam. Kemudian dilanjutkan dengan reaksi hidrolisis dan dekarboksilasi pada suhu 97oC selama 2 jam. Dalam penelitian ini dihasilkan senyawa 6-hidroksi-2-heksanon dengan rendemen 36,09%.
Sintesis berbahan dasar etil asetoasetat juga telah dilakukan oleh Fauziyah (2015) yaitu dengan mensintesis senyawa dihidropirimidinon dari etil asetoasetat dan aplikasinya sebagai antibakteri. Senyawa etil asetoasetat hasil sintesis digunakan sebagai zat perantara dalam sintesis dihidropirimidinon sebagai
20
senyawa antibakteri. Dalam penelitian ini, belum terbentuk senyawa etil asetoasetat melainkan senyawa etil asetat dan berdasarkan uji aktivitas antibakteri senyawa dihidropirimidinon tidak menunjukkan adanya daya hambat.
C. Kerangka Berpikir
Senyawa etil asetoasetat merupakan senyawa yang berguna sebagai material awal dalam pembuatan keton. Namun, penelitian akan hal ini masih belum banyak dilakukan. Untuk meningkatkan pengetahuan tersebut, maka perlu dilakukan pengembangan ilmu sintesis senyawa organik dengan melakukan sintesis senyawa 3-etil-2-pentanon dari etil asetoasetat dan etil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi. Reaksi ini merupakan reaksi substitusi elektrofilik dimana ion etil dari etil bromida berperan sebagai elektrofil akan menggantikan satu atom H pada posisi C3 dari senyawa etil asetoasetat yang berperan sebagai nukleofil. Berdasarkan mekanisme reaksi, maka memungkinkan senyawa 3-etil-2-pentanon akan terbentuk melalui dua kali reaksi alkilasi. Senyawa hasil sintesis kemudian diidentifikasi menggunakan FTIR dan GC-MS.
21 BAB III
METODE PENELITIAN
A. Subjek dan Objek Penelitian 1. Subjek Penelitian
Subjek dari penelitian ini adalah senyawa 3-etil-2-pentanon.
2. Objek Penelitian
Objek penelitian ini adalah rendemen dan identifikasi dari senyawa 3-etil-2-pentanon hasil sintesis.
B. Alat dan Bahan Penelitian 1. Alat-alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah rangkaian alat refluks, termometer 100oC dan 200oC, magnetic stirrer, hot plate, spektrofotometer FTIR (Shimadzu FTIR), spektrometer GC-MS (GCMS-QP2010 SE), dan peralatan gelas yang umum digunakan dalam laboratorium (gelas kimia, gelas ukur, Erlenmeyer, pengaduk gelas, pipet ukur, gelas arloji, corong gelas, dan corong pisah).
2. Bahan-bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian adalah, logam Na, etil asetoasetat, etil bromida, NaOH 7%, H2SO4 50%, Na2SO4 anhidrat, NaHCO3 10%, etanol p.a, dietil eter p.a aquades, dan kertas saring biasa.
22 C. Prosedur Penelitian
1. Reaksi Alkilasi Etil Asetoasetat
Sebanyak 1,4375 gram (0,0625 mol) logam Na dan 16 mL etanol kering dicampurkan dalam labu alas bulat leher tiga yang dilengkapi dengan kondensor. Campuran diaduk pada suhu kamar hingga logam Na benar-benar larut. Setelah logam Na larut, ditambahkan 7,97 mL (8,13 g, 0,0625 mol) etil asetoasetat, kemudian diaduk selama 10 menit pada suhu kamar. Ditambahkan 4,66 mL (6,81 g, 0,0625 mol) etil bromida secara perlahan sambil diaduk. Kemudian larutan direfluks selama 3 jam pada suhu 78oC. Setelah proses refluks selesai, hasil refluks didiamkan dan didekantasi untuk dipisahkan cairan berwarna kuning dari endapannya. Kemudian endapan dicuci dengan 2 x 3 mL etanol kering. Selanjutnya larutan dievaporasi untuk menguapkan pelarutnya dan didapatkan cairan kental berwarna kuning. Cairan kental berwarna kuning inilah yang digunakan pada tahap selanjutnya.
2. Reaksi Hidrolisis dan Dekarboksilasi
Hasil dari tahap pertama, dimasukkan ke dalam labu alas bulat leher tiga. Ditambahkan 15 mL NaOH 7% secara perlahan dan direfluks selama 2 jam pada suhu 103oC. Campuran didiamkan hingga mencapai suhu kamar dengan cara labu leher tiga direndam menggunakan air, kemudian dimasukkan kembali ke dalam labu alas bulat dan ditambahkan 3 mL H2SO4 50% secara perlahan sambil diaduk selama 1 jam. Setelah diaduk, larutan direfluks selama 2 jam pada suhu 103oC. Larutan didinginkan pada suhu kamar dan dimasukkan ke dalam corong pisah untuk diambil lapisan minyaknya.
23
Lapisan minyak diekstraksi dengan 25 mL dietil eter. Lapisan dietil eter dicuci dengan 20 mL NaHCO3 10%, kemudian dikeringkan dengan Na2SO4 anhidrat selama semalam. Lapisan dietil eter didekantasi dan dievaporasi hingga pelarut dietil eter menguap sehingga yang tersisa hanyalah senyawa yang diduga mengandung senyawa keton. Hasil sintesis yang diperoleh selanjutnya dianalisis menggunakan FTIR dan GC-MS. Analisis GC-MS dikerjakan dengan kolom J&W 122-5731 (30 m x 250 µm x 1,0 µm). Suhu oven 70oC yang dipertahankan selama 5 menit dan diprogram pada laju 10oC/menit sampai mencapai 300oC. Dan dipertahankan selama 33 menit.
D. Teknik Analisis Data 1. Data Kuantitatif
Data kuantitatif diperoleh dengan cara menghitung rendemen senyawa hasil sintesis yaitu:
( ) ( )
2. Data Kualitatif
Data kualitatif diperoleh dari bentuk dan warna senyawa hasil sintesis serta hasil identifikasi senyawa 3-etil-2-pentanon yang dihasilkan menggunakan FTIR dan GC-MS.
% kemurnian senyawa hasil sintesis berdasarkan kromatogram GC
24 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Hasil Penelitian
Berdasarkan penelitian yang telah dilakukan, diperoleh hasil sebagai berikut:
1. Hasil sintesis senyawa 3-etil-2-pentanon
Sintesis senyawa 3-etil-2-pentanon diperoleh dari reaksi alkilasi etil asetoasetat dan etil bromida menggunakan katalis etoksida. Produk hasil reaksi alkilasi selanjutnya dihidrolisis dan dekarboksilasi. Pada penelitian ini dilakukan tiga kali percobaan. Hasil sintesis yang diperoleh, dapat ditunjukkan pada tabel 4.
Tabel 4. Data Pengamatan Hasil Sintesis Senyawa 3-etil-2-pentanon
Parameter Hasil sintesis
Percobaan 1 Percobaan 2 Percobaan 3 Massa hasil sintesis (gram) 0,050 0,055 0,049
Bentuk Cair Cair Cair
Warna Cokelat Cokelat Kuning
(1) (2) (3) Gambar 10. Senyawa Hasil Sintesis 3-etil-2-pentanon
25
2. Hasil Pengamatan Tahapan Reaksi Alkilasi
Tahapan reaksi alkilasi diawali dengan pembuatan katalis etoksida dari reaksi eksoterm logam Na dengan etanol kering. Setelah itu, reaksi alkilasi antara etil asetoasetat dan etil bromida. Pengamatan tahapan reaksi alkilasi dapat dirangkum pada Tabel 5.
Tabel 5. Pengamatan Tahapan Reaksi Alkilasi Etil Asetoasetat dengan Etil Bromida
No Perlakuan Hasil pengamatan
1 Logam Na + etanol kering Cairan kental kuning pucat 2 Penambahan etil asetoasetat,
diaduk 10 menit pada suhu kamar
Cairan kuning jernih
3 Penambahan etil bromida, direfluks 3 jam 78oC
Cairan keruh berwarna kuning kemerahan
4 Didekantasi I Cairan kuning kemerahan +
endapan putih
5 Cairan dievaporasi Cairan sedikit keruh berwarna kuning kemerahan
6 Didekantasi II Cairan kuning kemerahan + endapan putih
3. Hasil Pengamatan Tahapan Reaksi Alkilasi
Produk hasil reaksi alkilasi berupa cairan kuning kemerahan kemudian dihidrolisis dan dekarboksilasi. Pengamatan dari tahapan reaksi hidrolisis dan dekarboksilasi dapat dirangkum pada Tabel 6.
26
Tabel 6. Pengamatan Tahapan Reaksi Hidrolisis dan Dekarboksilasi
No Perlakuan Pengamatan
1 Penambahan NaOH 7%, direfluks 2 jam 103 oC
Cairan coklat kekuningan + endapan coklat
2 Penambahan H2SO4 50%, diaduk 1 jam pada suhu kamar dengan cara merendam labu leher tiga dengan air
Pembentukan gelembung gas, larutan berwarna kuning pucat
3 Direfluks 2 jam 103oC Larutan berwarna kuning pucat 4 Dimasukkan ke corong pisah
dan didiamkan semalam
Terbentuk 2 lapisan,
1) Lapisan minyak (mengambang) berwarna kuning kecoklatan 2) Lapisan air kuning keruh 5 Lapisan minyak diekstraksi
dengan dietil eter
Larutan berwarna kuning
6 Lapisan dietil eter dicuci dengan NaHCO3 5%
Terbentuk 2 lapisan,
1)* Lapisan dietil eter (atas) berwarna putih bening kekuningan
2) Lapisan NaHCO3 (bawah), berwarna kuning bening 7 Penambahan Na2SO4 anhidrat
ke dalam lapisan dietil eter 1)* dan didiamkan semalam
Larutan berwarna putih bening kekuningan
27
4. Hasil Identifikasi FTIR Senyawa 3-etil-2-pentanon
Identifikasi FTIR dilakukan pada ketiga percobaan hasil sintesis. Pada senyawa hasil sintesis percobaan pertama diperoleh hasil FTIR sebagai berikut:
Gambar 11. Spektrum IR Hasil Sintesis Percobaan Pertama
Berdasarkan spektrum IR diatas, senyawa hasil sintesis 3-etil-2-pentanon percobaan pertama memiliki beberapa gugus fungsi. Hasil pengamatan spektrum IR dapat ditunjukkan pada Tabel 7.
OH
C-H
28
Tabel 7. Daerah Serapan Gugus Fungsi Pada Spektrum IR Hasil Sintesis Percobaan Pertama
Bilangan gelombang (cm-1) Kemungkinan gugus fungsi
3295,48 Gugus hidroksi (OH)
2967,39 Gugus alifatik (C-H)
1695,48 Gugus karbonil (C=O)
Selanjutnya dilakukan identifikasi FTIR hasil sintesis percobaan kedua. Pada senyawa hasil sintesis percobaan kedua diperoleh hasil FTIR sebagai berikut:
Gambar 12. Spektrum IR Hasil Sintesis Percobaan Kedua
OH C-H
29
Berdasarkan spektrum IR diatas, senyawa hasil sintesis 3-etil-2-pentanon percobaan kedua memiliki beberapa gugus fungsi. Hasil pengamatan spektrum IR dapat ditunjukkan pada Tabel 8.
Tabel 8. Daerah Serapan Gugus Fungsi Pada Spektrum IR Hasil Sintesis Percobaan Kedua
Bilangan gelombang (cm-1) Kemungkinan gugus fungsi
3294,72 Gugus hidroksi (OH)
2972,19 Gugus alifatik (C-H)
1691,45 Gugus karbonil (C=O)
Selanjutnya dilakukan identifikasi FTIR hasil sintesis percobaan ketiga. Pada senyawa hasil sintesis percobaan ketiga diperoleh hasil FTIR sebagai berikut:
Gambar 13. Spektrum IR Hasil Sintesis Percobaan Ketiga C=O
CH2
CH3
30
Berdasarkan spektrum IR diatas, senyawa hasil sintesis 3-etil-2-pentanon percobaan ketiga memiliki beberapa gugus fungsi. Hasil pengamatan spektrum IR dapat ditunjukkan pada Tabel 9.
Tabel 9. Daerah Serapan Gugus Fungsi Pada Spektrum IR Hasil Sintesis Percobaan Ketiga
Bilangan gelombang (cm-1) Kemungkinan gugus fungsi
3425,58 Gugus hidroksi (OH)
2924,09 Gugus alifatik (C-H)
1728,22 Gugus karbonil (C=O)
5. Hasil Identifikasi GC-MS Senyawa 3-etil-2-pentanon
Identifikasi GC-MS dilakukan pada hasil sintesis percobaan kedua dan percobaan ketiga. Pada senyawa hasil sintesis percobaan kedua diperoleh hasil GC-MS sebagai berikut:
31
Berdasarkan analisis GC-MS hasil sintesis percobaan kedua yang dihasilkan, menunjukkan bahwa terdapat dua puncak pada waktu retensi 4,402 dengan senyawa 4,6-dimetil-2H-pira-2-on dan pada waktu retensi 9,225 dengan senyawa 3,5-dihidroksitoluena. Hasil spektrum massa hasil sintesis kedua ini ditunjukkan pada gambar sebagai berikut:
Gambar 15. Spektrum Massa Hasil Sintesis Percobaan Kedua
Selanjutnya dilakukan identifikasi GC-MS hasil sintesis percobaan ketiga. Pada senyawa hasil sintesis percobaan ketiga diperoleh hasil GC-MS sebagai berikut:
32
Gambar 16. Kromatogram Hasil Sintesis Percobaan Ketiga
Berdasarkan analisis GC-MS hasil sintesis percobaan ketiga diperoleh 50 kemungkinan senyawa 3-etil-2-pentanon. Dari 50 kemungkinan itu, hanya ada satu kemungkinan senyawa alifatik sedangkan yang lainnya termasuk senyawa aromatik. Hasil spektrum massa hasil sintesis percobaan ketiga ini ditunjukkan pada gambar sebagai berikut:
Gambar 17. Spektrum Massa Hasil Sintesis Ketiga
B. Pembahasan
1. Reaksi Alkilasi Etil Asetoasetat
Tahap pertama sintesis 3-etil-2-pentanon adalah pembentukan senyawa etil 2-asetilpropanoat melalui reaksi alkilasi antara etil asetoasetat dan etil bromida menggunakan katalis etoksida. Reaksi berlangsung melalui
33
mekanisme substitusi nukleofilik bimolekuler atau SN2 karena alkil halida yang digunakan adalah etil bromida yang termasuk alkil halida primer.
Berdasarkan struktur kimia etil asetoasetat, dapat diketahui bahwa senyawa etil asetoasetat memiliki dua posisi hidrogen α, yaitu hidrogen α yang bertetangga dengan gugus karbonil keto dan hidrogen α yang diapit oleh dua gugus karbonil. Menurut Clayden (2001), keasaman kedua posisi hidrogen α ini berbeda, dimana hidrogen α yang diapit oleh dua gugus karbonil bersifat lebih asam (pKa=11) dibandingkan hidrogen α yang bertetangga dengan gugus karbonil keto (pKa>20). Oleh karena itu, pembentukan ion enolat terjadi melalui pelepasan hidrogen α yang diapit oleh dua gugus karbonil tersebut. Namun, apabila memungkinkan reaksi alkilasi kedua dalam pembentukan ion enolat juga dapat terjadi melalui pelepasan hidrogen α yang lain.
Sintesis etil 2-asetil propanoat diawali dengan pembentukan ion enolat yang diperoleh dari reaksi antara etil asetoasetat menggunakan natrium etoksida. Natrium etoksida yang digunakan dalam penelitian dibuat secara langsung. Pembuatan katalis natrium etoksida melalui reaksi eksoterm antara logam Na dengan etanol kering. Pelarut etanol yang digunakan haruslah bebas dari air agar tidak bereaksi dengan logam Na membentuk natrium hidroksida. Oleh karena itu, sebelum digunakan, etanol p.a. dikeringkan terlebih dahulu dengan Na2SO4 anhidrat dan didiamkan selama semalam. Setelah logam Na bereaksi dalam etanol, ke dalamnya ditambahkan etil asetoasetat secara perlahan dan diaduk pada suhu kamar selama 10 menit agar larutan homogen.
34
Selanjutnya ke dalam larutan kuning jernih tersebut ditambahkan etil bromida secara perlahan dan direfluks pada suhu 78 oC selama 3 jam. Selama proses refluks pengaturan suhu adalah hal yang penting karena suhu yang tidak stabil dapat mempengaruhi hasil sintesis. Pada 10 menit pertama refluks, telah terjadi pembentukan endapan putih dan terus bertambah selama proses refluks. Endapan putih ini berasal dari natrium bromida yang merupakan salah satu produk dari reaksi alkilasi ini. Kelarutan natrium bromida dalam etanol sangat kecil, yaitu 6 g/ 100 g etanol (Clayden, 2001).
Dalam reaksi pembentukan ion enolat, nukleofil etoksida akan menyerang hidrogen α etil asetoasetat sehingga atom H akan lepas dan lebih tertarik ke nukleofil etoksida untuk membentuk etanol. Produk yang dihasilkan berupa ion enolat etil asetoasetat, etanol, dan ion Na. Reaksinya sebagai berikut:
Gambar 18. Reaksi Pembentukan Ion Enolat dari Etil Asetoasetat oleh Natrium Etoksida
Ion enolat etil asetoasetat yang dihasilkan kemudian menyerang atom C pusat senyawa etil bromida dan melepaskan gugus lepas Br-. Produk yang dihasilkan adalah etil 2-asetilpropanoat dan garam natrium bromida. Reaksinya sebagai berikut:
35
Gambar 19. Reaksi Alkilasi Etil Asetoasetat dan Etil Bromida Menggunakan Katalis Natrium Etoksida
Alkilasi kedua dapat terjadi karena etil asetoasetat masih mempunyai hidrogen α lain yang dapat diserang oleh natrium etoksida sehingga menghasilkan ion enolat (Gambar 19). Ion enolat akan menyerang atom karbon pusat senyawa etil bromida kembali untuk menghasilkan etil 2-asetil-2-etilpropanoat (Gambar 20).
Gambar 20. Pembentukan Ion Enolat Kedua dari Etil Asetoasetat oleh Natrium Etoksida
Gambar 21. Reaksi Dialkilasi Etil Asetoasetat dan Etil Bromida Menggunakan Katalis Natrium Etoksida
Setelah proses refluks selesai, campuran berwarna kuning kemerahan tersebut didiamkan pada suhu kamar, kemudian didekantasi untuk memisahkan antara larutan dengan endapan natrium bromida. Larutan hasil sintesis langsung dimasukkan ke dalam labu evaporasi sedangkan endapan natrium bromida dicuci dengan etanol kering agar tidak ada senyawa etil
2-asetil-2-36
etilpropanoat yang menempel dalam endapan. Larutan hasil dekantasi kemudian dievaporasi untuk menguapkan pelarutnya. Setelah dievaporasi, masih terbentuk endapan putih yang diduga berasal dari natrium bromida yang sedikit larut dalam etanol. Kemudian campuran didekantasi kembali untuk diambil cairannya. Cairan berwarna kuning kemerahan ini yang digunakan untuk tahapan selanjutnya.
2. Reaksi Hidrolisis dan Dekarboksilasi
Tahap selanjutnya adalah reaksi hidrolisis etil 2-asetil-2-etilpropanoat yang dilakukan dengan mereaksikan cairan berwarna kuning kemerahan hasil tahap pertama dengan larutan NaOH 7%. Penambahan NaOH 7% dilakukan secara perlahan dan direfluks pada suhu 103oC selama 2 jam.
Hidrolisis yang digunakan dalam sintesis 3-etil-2-pentanon adalah hidrolisis terkatalis basa karena bersifat irreversible yang menghasilkan garam karboksilat. Garam karboksilat diubah menjadi asam karboksilat dengan bantuan asam. Asam yang digunakan adalah asam kuat seperti H2SO4.
37
Gambar 22. Reaksi Hidrolisis 2-etilpropanoat menjadi Anion 2-asetil-2-etilpropanoat
Senyawa 2-asetil-2-etilpropanoat diharapkan akan terhidrolisis menjadi anion 2-asetil-2-etilpropanoat. Nukleofil hidroksida akan menyerang atom C karbonil dan memutuskan ikatan π sehingga atom O akan bermuatan negatif. Kemudian atom O bermuatan negatif akan membentuk ikatan π kembali yang menyebabkan lepasnya gugus etoksida dan menghasilkan asam 2-asetil-2-etilpropanoat dan natrium etoksida. Atom H pada asam 2-asetil-2-2-asetil-2-etilpropanoat akan diserang oleh nukleofil etoksida sehingga menghasilkan garam 2-asetil-2-etil propanoat dan etanol.
Setelah direfluks selama 2 jam, larutan didiamkan beberapa saat hingga dingin dan dimasukkan kembali ke dalam labu alas bulat leher tiga untuk diproses ke tahap berikutnya, yaitu penambahan larutan H2SO4 50% dan diaduk selama 1 jam. Penambahan asam bertujuan untuk memprotonasi anion 2-asetil-2-etilpropanoat menjadi asam 2-asetil-2-etilpropanoat menurut reaksi pada gambar sebagai berikut:
Gambar 23. Reaksi Protonasi Anion asetil-etilpropanoat menjadi Asam 2-asetil-2-etilpropanoat
38
Pada saat penambahan larutan H2SO4 50%, terbentuk gelembung gas dalam larutan yang disebabkan adanya pelepasan CO2. Setelah pelepasan gas CO2 mulai berkurang, larutan direfluks pada suhu 103oC selama 2 jam untuk mendekarboksilasi asam 2-asetil-2-etilpropanoat menjadi enol (Gambar 25). Kemudian enol mengalami tautomerisasi menjadi keton (Gambar 26).
Gambar 24. Reaksi Dekarboksilasi Asam 2-asetil-2-etilpropanoat menjadi Enol
Gambar 25. Enol Mengalami Tautomerisasi Menjadi Keton
Hasil sintesis yang berwarna kuning pucat tersebut kemudian dimasukkan ke dalam corong pisah dan didiamkan selama semalam agar lapisan minyak terpisah secara sempurna dari lapisan airnya. Setelah itu, lapisan minyaknya diekstraksi dengan pelarut dietil eter. Kemudian lapisan dietil eter dicuci dengan larutan NaHCO3 10% untuk menetralkan asam yang mungkin terikut dalam lapisan dietil eter. Ekstrak dietil eter ini selanjutnya dikeringkan dengan Na2SO4 anhidrat dan didiamkan selama semalam. Penambahan Na2SO4 anhidrat bertujuan untuk mengikat H2O yang masih
39
terkandung dalam ekstrak dietil eter. Kemudian ekstrak dietil eter dievaporasi untuk menghilangkan pelarutnya.
Hasil sintesis senyawa berupa cairan berwarna kuning, dengan bau keton. Secara fisik dapat dikatakan bahwa senyawa tersebut diduga mengandung senyawa keton. Identifikasi senyawa hasil sintesis dilakukan dengan menggunakan spektroskopi FTIR dan GC-MS.
3. Hasil Identifikasi Hasil Sintesis Menggunakan FTIR
Identifikasi FTIR dilakukan pada ketiga percobaan hasil sintesis. Percobaan pertama dan kedua memberikan hasil spektrum IR yang tidak jauh berbeda. Berdasarkan spektra IR terdapat daerah serapan gugus hidroksi (OH) melebar dengan intensitas yang cukup kuat pada bilangan gelombang 3295,48 cm-1 untuk percobaan pertama dan bilangan gelombang 3294,72 cm-1 untuk percobaan kedua. Adanya ikatan hidrogen menyebabkan munculnya serapan gugus hidroksi (OH) yang melebar. Kemudian serapan gugus karbonil (C=O) sudah dapat ditunjukkan pada bilangan gelombang 1695,48 cm-1 untuk percobaan pertama dan bilangan gelombang 1691,45 cm-1 untuk percobaan kedua. Serapan dengan intensitas cukup lemah pada bilangan gelombang 2967,39 cm-1 untuk percobaan pertama dan bilangan gelombang 2972, 19 cm-1 untuk percobaan kedua, menunjukkan adanya serapan gugus alifatik (C-H).
Permasalahan tersebut dapat disebabkan penggunaan suhu refluks saat dekarboksilasi kurang tinggi sedangkan reaksi dekarboksilasi diperlukan suhu yang tinggi mencapai 140-150oC. Oleh karena itu, dilakukan percobaan sintesis
40
ketiga dengan mengunakan suhu tinggi saat reaksi dekarboksilasi menggunakan penangas minyak. Penangas minyak digunakan agar dapat mencapai suhu yang tinggi, karena titik didih minyak dapat mencapai dua kali lipat lebih tinggi dibandingkan titik didih air yaitu 200oC (100oC). Namun, suhu yang dapat dicapai dalam reaksi hidrolisis dan dekarboksilasi hanya sebesar 103 oC.
Dari spektrum IR hasil sintesis percobaan ketiga memperlihatkan masih terdapat serapan gugus hidroksil pada bilangan gelombang 3425,58 cm-1 walaupun dengan intensitas lemah. Serapan sangat kuat dan tajam terdapat pada bilangan gelombang 2924,09 cm-1 menunjukkan adanya regangan C-H alifatik dari metil. Serapan kuat dan tajam pada bilangan gelombang 1728,22 cm-1 menunjukkan adanya regangan C=O yang berasal dari gugus karbonil. Berdasarkan analisis FTIR, dalam senyawa hasil sintesis ini memiliki beberapa gugus fungsi. Kemungkinan gugus fungsi yang dimiliki adalah gugus hidroksi (OH), gugus alifatik (C-H), dan gugus karbonil (C=O).
4. Hasil Identifikasi Hasil Sintesis Menggunakan GC-MS
Identifikasi GC-MS dilakukan pada hasil sintesis percobaan kedua dan percobaan ketiga. Berdasarkan analisis GC-MS hasil sintesis percobaan kedua yang dihasilkan, menunjukkan bahwa terdapat dua puncak pada waktu retensi 4,402 dengan senyawa 4,6-dimetil-2H-pira-2-on dan pada waktu retensi 9,225 dengan senyawa 3,5-dihidroksitoluena. Selain itu, spektrum massa yang dihasilkan tidak ada pecahan fragmen-fragmen yang sesuai dengan
3-etil-2-41
pentanon. Karena pada hasil GC-MS tersebut kedua puncaknya diperoleh senyawa aromatik, sedangkan 3-etil-2-pentanon merupakan senyawa alifatik dan tidak mungkin mengalami penataan ulang menjadi senyawa aromatik.
Selanjutnya dilakukan identifikasi GC-MS pada senyawa hasil sintesis percobaan ketiga. Berdasarkan analisis GC-MS hasil sintesis percobaan ketiga diperoleh 50 kemungkinan senyawa 3-etil-2-pentanon. Dari 50 kemungkinan itu, hanya ada satu kemungkinan senyawa alifatik sedangkan yang lainnya termasuk senyawa aromatik. Kemungkinan senyawa alifatik tersebut diduga senyawa 4-hidroksi-4-metil-2-pentanon pada waktu retensi 13,080 menit dengan persentase kemurnian yang sangat kecil yaitu 0,20%.
Gambar 26. Struktur 4-hidroksi-4-metil-2-pentanon
Berdasarkan analisis GC-MS, Kemungkinan fragmentasi yang dihasilkan dari spektrum massa dapat dituliskan sebagai berikut:
42 b. Pelepasan gugus metil (CH3)
c. Pelepasan molekul air (H2O)
d. Pelepasan gugus metilen (CH2)
e. Pelepasan etuna (HC≡CH)
43
Spektrum massa ini kurang sesuai dengan struktur 4-hidroksi-4-metil-2-pentanon, dimana tidak nampak ion molekuler m/z 116 melainkan terdapat pada m/z 110. Puncak m/z 83 diperoleh dari pelepasan gugus metil yang dilanjutkan dengan pelepasan molekul H2O. Setelah pelepasan H2O, terjadi pelepasan etuna yakni HC≡CH yang ditunjukkan pada puncak m/z 69. Puncak dasar (baseline) berada pada m/z 43, yang merupakan ciri dari senyawa karbonil dengan ujung metil, yakni dari kation CH3CO+. Dalam sintesis senyawa keton, terkadang ion molekuler tidak terdeteksi. Hal tersebut dapat disebabkan kemungkinan senyawa hasil sintesis tidak stabil sehingga ketika proses penembakan, yang terdeteksi hanyalah fragmen-fragmennya. Berdasarkan analisis GC-MS, dalam senyawa hasil sintesis ini memiliki beberapa gugus fungsi. Kemungkinan gugus fungsi yang dimiliki adalah gugus metil (CH3), gugus metilen (CH2), dan senyawa karbonil dengan ujung metil, yakni dari kation CH3CO+.
Berdasarkan analisis FTIR senyawa hasil sintesis memiliki gugus hidroksil (OH), gugus alifatik(C-H) dan gugus karbonil (C=O), sedangkan analisis GC-MS memiliki gugus metil (CH3), gugus metilen (CH2), dan senyawa karbonil dengan ujung metil, yakni dari kation CH3CO sehinggadapat disimpulkan kemungkinan senyawa hasil sintesis adalah senyawa 4-hidroksi-4-metil-2-pentanon. Rendahnya rendemen dan ketidaksesuaian hasil sintesis dengan yang diharapkan, dapat disebabkan oleh beberapa hal sebagai berikut:
44
1. Penggunaan katalis yang dibuat secara langsung kinerjanya kurang maksimal dalam pembentukan ion enolat. Pereaksian logam Na dengan etanol kering dalam pembuatan natrium etoksida serta pada proses refluks pertama yang masih menyerap uap air dari atmosfer, sehingga terjadi reaksi antara logam Na dengan air membentuk natrium hidroksida sehingga bukannya natrium etoksida yang mendeprotonasi hidrogen-α etil asetoasetat melainkan natrium hidroksida yang menghidrolisisnya menjadi asam asetoasetat.
2. Penggunaan suhu hidrolisis dan dekarboksilasi yang kurang optimum sehingga menyebabkan rendahnya kuantitas hasil sintesis yang diharapkan.
45 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan analisis yang telah dilakukan maka dapat ditarik beberapa kesimpulan sebagai berikut:
1. Senyawa 3-etil-2-pentanon tidak dapat dihasilkan dari etil asetoasetat dan etil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi.
2. Identifikasi dari senyawa hasil sintesis berupa cairan berwarna kuning yang mengandung gugus fungsi metil (CH3), metilen (CH2) , hidroksil (OH), asetil (CH3CO)dan karbonil (C=O), yang diduga merupakan senyawa 4-hidroksi-4metil-2-pentanon.
3. Rendemen senyawa hasil sintesis sebesar 0,001375 %.
B. Saran
Saran yang dapat penulis berikan untuk penelitian selanjutnya adalah: 1. Penggunaan silika gel pada bagian atas kondensor untuk menjamin agar
sistem refluks saat reaksi alkilasi bebas dari uap air.
2. Diperlukan penelitian lanjutan untuk menelusuri reaksi terbentuknya senyawa 4-hidroksi-4-metil-2-pentanon.
46
DAFTAR PUSTAKA
Allinger, N, L., et al. (1980). Organic Chemistry. New York: Worth Publisher Inc. Abi. (2017). Hidrolisis adalah [pengertian, contoh, klasifikasi, obat]. Diakses dari http://www.alamipedia.com/hidrolisis-adalah-pengertian-contoh-klasifikasi-obat/amp pada 16 Juli 2017 pukul 21.53 WIB.
Anonim. (2005). Material Safety Data Sheet Etil Bromida MSDS. Diunduh dari
http://www.sciencelab.com/msds.php?msdsId=9923962 pada 10 Mei 2017 pukul 10.45 WIB.
Atun, S. (2016). Elusidasi Struktur Molekul Senyawa Organik. Yogyakarta: UNY Press.
Bettelheim, F. A., et al. (2013). Introduction Organic And Biochemistry Eight Edition. USA: Brooks/Cole, Cengage Learning.
Burdock, George A. (1997). Encyclopedia of Food and Color Additive Volume 1. New York:CRC Press, Inc.
Carey, F.A. (2000). Organic Chemistry Fourth Edition. New York: The McGraw-Hill Companies, Inc.
Clayden, J., Warren, S., Greeves, N., and Wothers, P. (2001). Organic Chemistry. New York: Oxford University Press, Inc.
Clayden, J., Greeves, N., and Warren, S. (2012). Organic Chemistry Second Edition. New York: Oxford University Press, Inc.
Fauzi. (2016). Spektroskopi FTIR (Fourier Transform Infra Red). Diunduh dari
http://www.kimiafum/ftir/ pada 13 Juni 2017 pukul 10.45 WIB.
Fauziyah, S. (2015). Sintesis Senyawa Dihidropirimidion dari Etil Asetoasetat dan Aplikasinya sebagai Antibakteri. Skripsi. Semarang: Universitas Negeri Semarang.
Fauziyah, S., Supartono, And Mursiti, S. (2016). Sintesis Senyawa Dihidropirimidion dari Etil Asetoasetat dan Aplikasinya sebagai Antibakteri. Indonesian journal of chemistry science.
Fessenden, R.J., Fessenden, J.S., and Logue, M. (1998). Organic Chemistry.—6th ed. USA: Library of congress cataloging-in-publication data.