SINTESIS SENYAWA 4-ALIL-6-(METOKSIMETIL)-2- METOKSI FENOL DARI EUGENOL MELALUI
REAKSI MANNICH DIIKUTI METILASI DAN SUBSTITUSI MENGGUNAKAN NaOMe
SKRIPSI
STEVEN WINARDI 150802049
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
SINTESIS SENYAWA 4-ALIL-6-(METOKSIMETIL)-2- METOKSI FENOL DARI EUGENOL MELALUI
REAKSI MANNICH DIIKUTI METILASI DAN SUBSTITUSI MENGGUNAKAN NaOMe
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
STEVEN WINARDI 150802049
PROGRAM STUDI S1KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
PENGESAHAN SKRIPSI
Judul :Sintesis Senyawa 4-Alil-6-(MetoksiMetil)-2-Metoksi Fenol dari Eugenol Melalui Reaksi Mannich Diikuti Metilasi dan Substitusi Menggunakan NaOMe
Kategori : Skripsi
Nama : Steven Winardi
Nomor Induk Mahasiswa : 150802049 Program Studi : Sarjana Kimia
Fakultas : MIPA – Universitas Sumatera Utara
Disetujui di
Medan, November 2019
Ketua Program Studi Pembimbing
Dr. Cut Fatimah Zuhra, M.Si Sabarmin Peranginangin, S.Si, M.Si NIP. 197404051999032001 NIP. 196912131997022001
PERNYATAAN ORISINALITAS
SINTESIS SENYAWA 4-ALIL-6-(METOKSIMETIL)-2-METOKSI FENOL DARI EUGENOL MELALUI REAKSI MANNICH
DIIKUTI METILASI DAN SUBSTITUSI MENGGUNAKAN NaOMe
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan dan masing masing disebutkan sumbernya.
Medan, November 2019
Steven Winardi 150802049
PENGHARGAAN
Segala puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus, karena atas berkat kasih karunia dan pertolongan-Nya penulis dapat menyelesaikan penyusunan skripsi ini sebagai salah satu syarat untuk menyelesaikan pendidikan sarjana sains di FMIPA USU. Dalam pelaksanaan penelitian hingga menyelesaikan skripsi ini penulis menyadari banyak mendapat bantuan, motivasi dan dukungan dari berbagai pihak.
Terimakasih penulis sampaikan kepada Ibu Sabarmin Peranginangin, SSi, MSi selaku dosen pembimbing yang telah meluangkan waktunya selama penyusunan skripsi ini. Terimakasih kepada Bapak Prof. Dr.Kerista Sebayang, MS selaku Dekan FMIPA USU, Ibu Dr. Cut Fatimah Zuhra, MSi dan Ibu Dr. Sovia Lenny, SSi, MSi selaku ketua dan sekretaris program studi Kimia FMIPA USU, Bapak Prof. Dr.
Jamaran Kaban, MSc selaku Ketua Bidang Kimia Organik, Bapak Dr. Mimpin Ginting, MS selaku Kepala Laboratorium Kimia Organik beserta Dosen dan seluruh staff Pegawai FMIPA USU.
Penulis juga mengucapkan banyak terimakasih kepada rekan-rekan asisten laboratorium Kimia Organik (angkatan 2013-2017), dan teman-teman IMK angkatan 2014-2019 yang telah banyak memberikan bantuan dan masukan kepada penulis.
Secara khusus penulis mengucapkan terimakasih kepada Bapak tercinta (Subianto Wijaya) dan Ibu tersayang (Susilawaty) yang telah banyak memberikan dukungan doa, moril, materil, dan kasih sayang yang tak terhingga hingga akhirnya penulis dapat menyelesaikan studi. Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan karena keterbatasan penulis. Untuk itu dengan segala kerendahan hati, penulis mengharapkan saran yang bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan.
Medan , November 2019
Steven Winardi
SINTESIS SENYAWA 4-ALIL-6-(METOKSIMETIL)-2-METOKSI FENOL DARI EUGENOL MELALUI REAKSI MANNICH
DIIKUTI METILASI DAN SUBSTITUSI MENGGUNAKAN NaOMe
ABSTRAK
Senyawa turunan eugenol 4-alil-6-(metoksimetil)-2-metoksi fenol telah disintesis melalui reaksi Mannich, metilasi, dan substitusi nukleofilik. Reaksi Mannich dilakukan dengan mereaksikan eugenol, formaldehid 37%, dan dimetilamin 40%
dalam kondisi refluks dengan pelarut etanol pada suhu 78°C selama 90 menit menghasilkan senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol sebesar 85,65%.
Terbentuknya gugus dimetilaminometil didukung dengan munculnya vibrasi ulur C- N pada bilangan gelombang 1234,44 cm-1 dan puncak ion molekul 221 pada analisa GC-MS. Metilasi senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol dilakukan menggunakan metil iodida dalam pelarut etanol menghasilkan senyawa 6-[(N-iodo- N-metil-N-metil-N-metilamino)metil]-4-alil-2-metoksi fenol, dimana senyawa ini merupakan garam ammonium kuartener yang didukung munculnya puncak serapan pada bilangan gelombang 1481,33 cm-1menunjukkan karakteristik dari +N-(CH3) dan pergeseran kimia pada δ = 3.1 ppm menunjukkan proton-proton pada +N-(CH3) dengan puncak singlet. Senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol diperoleh melalui rekasi substitusi nukleofilik 6-[(N-iodo-N-metil-N-metil-N-metilamino) metil]-4-alil-2-metoksi fenol dengan natrium metoksida pada kondisi refluks dengan pelarut akuades pada suhu 100°C selama 5 jam menghasilkan senyawa dengan hasil sebesar 41,35%, didukung dengan munculnya puncak serapan pada bilangan gelombang 848,68 cm-1 menunjukkan vibrasi ulur asimetrik dari C-O-C eter dan pergeseran kimia pada δ = 3.3 menunjukkan proton-proton pada H3C-O-CH2 dengan puncak singlet.
Kata Kunci :Eugenol, Metilasi, Reaksi Mannich, Substitusi nukleofilik, dan 4-alil-6- (metoksimetil)-2-metoksi fenol.
SYNTHESIS OF 4-ALLYL-6-(METHOXYMETHYL)-2-METHOXY PHENOL FROM EUGENOL THROUGH MANNICH
REACTION FOLLOWED BY METHYLATION AND SUBSTITUTION WITH NaOMe
ABSTRACT
Eugenol derivative compound 4-allyl-6-(methoxymethyl)-2-methoxy phenol was synthesized through Mannich reaction, methylation, and nucleophilic substitution.
Mannich reaction was carried out by reacting eugenol, formaldehyde 37%, and dimethylamine 40% in reflux condition with ethanol solvent at temperature 78°C for 90 minute produced 4-allyl-6-(dimethylamino)methyl-2-methoxy phenol with yield of 85,65%. The formation of dimethylaminomethyl group supported by C-N stretching vibration at 1234,44cm-1 and ion molecule peak at 221 in GC-MS. Methylation of 4- allyl-6-(dimethylamino)methyl-2-methoxy phenol was carried out with methyl iodide in ethanol solvent produced 6-[(N-iodo-N-methyl-N-methyl-N-methylamino)methyl]- 4-allyl-2-methoxy phenol which this compound is a quartenary ammonium salt supported by the appearance of vibration 1481,33 cm-1 show the characteristic of
+N-(CH3) and chemical shift at δ = 3.1 ppm indicate protons at +N-(CH3) with singlet peaks. 4-allyl-6-(methoxymethyl)-2-methoxy phenol was synthesized by nucleophilic substitution reaction of 6-[(N-iodo-N-methyl-N-methyl-N-methylamino) methyl]-4-allyl-2-methoxy phenol with sodium methoxide in reflux condition with aquadest solvent at temperature 100°C for 5 hours produced with yield 41,35%, supported by the appearance of vibration 848,68 cm-1 show the characteristic of asymmetric C-O-C ether and chemical shift at δ = 3.3 ppm indicate protons at H3C- O-CH2 with singlet peak.
Keywords: Eugenol, Mannich Reaction, Methylation, Nucleophilic Substitution, 4- allyl-6-(methoxymethyl)-2-methoxy phenol.
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ORISINALITAS PENGHARGAAN
ii iii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
DAFTAR SINGKATAN xi
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 3
1.4 Pembatasan Masalah 3
1.5 Manfaat Penelitian 3
1.6 Metodologi Penelitian 3
BAB 2 TINJAUAN PUSTAKA
2.1 Eugenol 5
2.2 Formaldehid 6
2.3 Dimetilamin 6
2.4 Metil Iodida
2.5 Natrium Metoksida
6 7
2.6 Reaksi Substitusi Elektrofilik Aromatik 8
2.7 Reaksi Mannich
2.8 Kondisi Reaksi Mannich
9 11 2.9 Garam Amonium Kuartener dari Basa Mannich 12 2.10 Reaksi Basa Mannich Metil Iodida dengan Nukleofil 13 BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 15
3.2 Alat dan Bahan 15
3.2.1 Alat 15
3.2.2 Bahan 16
3.3 Prosedur Penelitian 17
3.3.1 Pembuatan Larutan Na2S2O3 17
3.3.2 Pembuatan Larutan HCl 10%
3.3.3 Sintesis Senyawa 4-alil-6-(dimetilamino)metil-2- Metoksi fenol
3.3.4 Pembuatan Metil Iodida
17 17 17
3.3.5 Sintesis Senyawa (6-((N-iodo-N-metil-N-metil-N- metilamino)metil)-4-alil-2-metoksi fenol
18 3.3.6 Sintesis Senyawa 4-alil-6-(metoksimetil)-2-metoksi
fenol
18
3.4 Bagan Penelitian 19
3.4.1 Sintesis Senyawa 4-alil-6-(dimetilamino)metil-2- metoksi fenol
19
3.4.2 Pembuatan Metil Iodida 20
3.4.3 Sintesis Senyawa (6-((N-iodo-N-metil-N-metil- N-metilamino)metil)-4-alil-2-metoksi fenol
21 3.4.4 Sintesis Senyawa 4-alil-6-(metoksimetil)-
2-metoksi fenol
22
BAB 4 HASIL DAN PEMBAHASAN
4.1 Sintesis Senyawa 4-alil-6-(dimetilamino)metil-2-metoksi Fenol
23 4.2 Sintesis Senyawa (6-((N-iodo-N-metil-N-metil-
N-metilamino)metil)-4-alil-2-metoksi fenol
29 4.3 Sintesis Senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol 34 BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 41
5.2 Saran 41
DAFTAR PUSTAKA 42
LAMPIRAN 44
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Data Spektrum 1H-NMR Senyawa 33
6-((N-iodo-N-metil-N-metil-N-metilamino)metil) -4-alil-2-metoksi fenol
4.2 Data spektrum 1H-NMR senyawa 39
4-alil-6-(metoksimetil)-2-metoksi fenol
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2.1 Struktur eugenol 5
2.2 Reaksi umum substitusi elektrofilik aromatik 9
2.3 Reaksi antara keton dengan kation iminium 11
2.4 Contoh reaksi Mannich 11
4.1 Spektrum FT-IR senyawa eugenol komersil 23
4.2 Spektrum FT-IR senyawa 4-alil-6-(dimetilamino)metal-2- 24 metoksi fenol
4.3 Reaksi sintesis senyawa 4-alil-6-(dimetilamino)metil-2- 26 Metoksi fenol
4.4 Kromatogram senyawa 4-alil-6-(dimetilamino)metil-2- 27 metoksi fenol
4.5 Spektrum Massa senyawa 4-alil-6-(dimetilamino)metil-2- 27 Metoksi fenol
4.6 Pola fragmentasi dari senyawa 4-alil-6-(dimetilamino) 28 Metil-2-metoksi fenol
4.7 Spektrum FT-IR senyawa 6-((N-iodo-N-metil-N-metil- 30 N-metilamino)metil)-4-alil-2-metoksi fenol
4.8 Reaksi sintesis senyawa 6-[(N-iodo-N-metil-N-metil-N- 31 metilamino]metil-4-alil-2-metoksi fenol
4.9 Spektrum1H-NMR senyawa 6-((N-iodo-N-metil-N-metil- 32 N-metilamino)metil)-4-alil-2-metoksi fenol
4.10 Senyawa 6-((N-iodo-N-metil-N-metil-N-metilamino)metil) 32 -4-alil-2-metoksi fenol
4.11 Spektrum FT-IR senyawa 4-alil-6-(metoksimetil)-2- 35 metoksi fenol
4.12 Reaksi pembentukan 4-alil-6-(metoksimetil)-2-metoksi 36 fenol
4.13 Perbandingan spektrum FT-IR dari tiga senyawa hasil 37 sintesis
4.14 Spektrum1H-NMR senyawa 4-alil-6-(metoksimetil)-2- 38 metoksi fenol
4.15 Senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol 38
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1 Foto rangkaian alat refluks 44
2 Foto rangkaian alat destilasi 44
3 Foto proses ekstraksi 44
4 Foto metil iodida 44
5 Foto zat hasil sintesis 45
6 Perhitungan massa 46
7 Data GC-MS 4-alil-6-(dimetilamino)metil-2-metoksi fenol 49
8 1H-NMR Eugenol (data pembanding) 53
9 Spektrum dan perbesaran 1H-NMR senyawa 6-((N-iodo 54
-N-metil-N-metil-Nmetilamino)metil-4-alil-2-metoksi fenol
10 Spektrum dan perbesaran 1H-NMR senyawa 4-alil- 58
6-(metoksimetil)-2-metoksi fenol
DAFTAR SINGKATAN
NaOMe = Natrium Metoksida
FT-IR = Fourier Transform-Infra Red
GC-MS = Gas Chromatography-Mass Spectrometry
1H-NMR = Proton Nuclear Magnetic Resonance
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Eugenol merupakan komponen utama yang terkandung dalam minyak cengkeh (Syzygium aromaticum) dengan kandungan 70-96% yang merupakan cairan bening hingga kuning pucat dengan aroma menyegarkan dan pedas seperti bunga cengkeh kering, memberikan aroma yang khas pada minyak cengkeh (Kardinan , 2005).
Eugenol merupakan senyawa fenolik yang memiliki beberapa gugus fungsi seperti alil, hidroksida dan metoksi. Dengan adanya gugus fungsi tersebut membuat senyawa eugenol dapat ditransformasikan menjadi beberapa senyawa turunan yang bermanfaat langsung atau menjadi bahan dasar untuk pembuatan senyawa lain.
Beberapa turunan eugenol yang telah dilakukan adalah alkilasi, adisi, isomerisasi, asetilasi, esterifikasi, polimerisasi, siklisasi monoeter dan sebagainya (Suryanto dan Anwar, 2008).
Penelitian dengan material eugenol telah banyak dilakukan , khususnya untuk senyawa turunan eugenol misalnya transformasi gugus alil pada eugenol menjadi gugus aldehida pada vanillin yang digunakan sebagai bahan aditif pada makanan, demikian juga transformasi gugus hidroksil menjadi alkil, asil ataupun asetil dari turunan eugenol seperti metil eugenol, eugenil benzoat, dan asetil eugenol yang dapat digunakan sebagai zat bioaditif pada bahan bakar solar (Sastrohamidjojo, 2004).
Aidira (2015) mensintesis metil eugenol melalui eterifikasi metil nitrat dengan eugenol hasil isolasi dari minyak cengkeh. Metil eugenol sendiri bersifat atraktan atau sebagai penarik lalat buah.
Triana (2017) melakukan sintesis senyawa 2-(4-alil-2-metoksi fenoksi)-N,N- bis (2-hidroksietil) asetamida dari eugenol melalui eterifikasi, esterifikasi dan amidasi.
Reaksi Mannich merupakan reaksi yang digunakan untuk memasukkan gugus dialkilaminometilen pada tipe-tipe senyawa enolat yang mempunyai atom hidrogen aktif. Reaksi ini terjadi melalui reaksi kondensasi pada gugus-gugus yang dapat mengalami enolisasi dengan ion imminium (basa Mannich) yang dihasilkan dari
reaksi formaldehid dengan amina sekunder. Pada senyawa eugenol atom hidrogen aktif terdapat pada atom hidrogen posisi orto dari gugus hidroksi fenol. Hasil reaksi Mannich berupa masuknya gugus dialkilaminometilen pada posisi orto. Gugus dialkilaminometilen ini dapat dirubah lebih lanjut menjadi gugus pergi yang baik sehingga atom karbon benziliknya dapat memungkinkan mengalami penyerangan dengan suatu nukleofil. Gugus pergi yang baik diperoleh dengan jalan merubah gugus dialkilamino menjadi suatu garam amina. Perubahan tersebut diperoleh dengan reaksi penggaraman amina oleh suatu sumber elektrofil seperti metil iodida.
Penggunaan garam ammonium kuartener pada reaksi substitusi nukleofilik telah dikenal. Atom karbon yang terikat pada garam ammonium kuartener akan bersifat elektrofil sehingga mudah diserang oleh suatu nukleofil. Prinsip ini telah digunakan untuk fungsionalisasi senyawa-senyawa heterosiklik melalui reaksi Mannich.
Dengan penyerangan nukleofil pada atom karbon benzilik memungkinkan memasukkan gugus-gugus penyerang nukleofil seperti ion metoksida, ion sianida, ion hidrid, dll (Purwono dan Daruningsih, 2006).
Barus (2019) melakukan sintesis senyawa (6-((N-iodo-N-metil-N-metil-N- metilamino)Metil)-4-alil-2-metoksi fenol) dari eugenol melalui reaksi mannich diikuti metilasi dengan metil iodida serta uji aktivitas antibakteri.
Siahaan (2017) melakukan sintesis senyawa 4-alil-6-(hidroksimetil)-2- metoksi fenol dari eugenol melalui reaksi mannich diikuti metilasi dengan metil iodida dan substitusi menggunakan NaOH.
Berdasarkan uraian diatas peneliti tertarik untuk mensintesis senyawa 4-alil- 6-(metoksimetil)-2-metoksi fenol dari eugenol melalui reaksi Mannich diikuti metilasi dan substitusi menggunakan NaOMe. Kemudian senyawa yang diperoleh dianalisa dengan menggunakan spektofotometer FT-IR dan 1H-NMR.
1.2 Permasalahan
Bagaimana mensintesis senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol dari eugenol melalui reaksi Mannich diikuti metilasi dan substitusi menggunakan Natrium Metoksida (NaOMe)?
1.3 Tujuan Penelitian
Untuk mensintesis senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol dari eugenol melalui reaksi Mannich diikuti metilasi dan substitusi menggunakan Natrium Metoksida (NaOMe) ?
1.4 Pembatasan Masalah
1. Eugenol yang digunakan adalah eugenol p.a Merck yang memiliki kemurnian sebesar 97%.
2. Senyawa metil iodida diperoleh dari hasil destilasi campuran yang diperoleh dari reaksi antara metanol, kalium iodida, dan asam fosfat.
1.5 Manfaat Penelitian
Sebagai sumber informasi dalam reaksi sintesis dan pengembangan dari reaksi-reaksi organik dalam reaksi mannich , metilasi dengan metil iodida dan substitusi untuk menghasilkan senyawa turunan eugenol .
1.6 Metodologi Penelitian
Penelitian ini bersifat eksperimen laboratorium yang terdiri dari 3 tahap.
Tahap pertama yaitu sintesis senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol melalui reaksi Mannich dengan menggunakan eugenol, formaldehid dan dimetilamin. Hasil yang diperoleh kemudian dianalisa dengan menggunakan alat
spektrofotometer FT-IR dan GC-MS. Dan tahap kedua, senyawa 4-alil-6- (dimetilamino)metil-2-metoksi fenol direaksikan dengan metil iodida dalam pelarut etanol sehingga menghasilkan senyawa garam amonium kuartener yaitu 6-[(N-iodo- N-metil-N-metil-N-metilamino)metil]-4-alil-2-metoksi fenol yang mana dimurnikan melalui rekristalisasi dengan pelarut etanol. Hasil yang diperoleh dianalisa menggunakan spektrofotometer FT-IR dan 1H-NMR. Tahap ketiga adalah pembuatan senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol dengan natrium metoksida pada kondisi refluks selama 5 jam pada suhu 100°C. Hasil yang diperoleh dianalisa menggunakan sprektrofotometer FT-IR dan 1H-NMR.
BAB 2
TINJAUAN PUSTAKA
2.1 Eugenol
Eugenol merupakan cairan tidak berwarna atau berwarna kuning-pucat, dapat larut dalam alkohol, eter dan kloroform. Mempunyai rumus molekul C10H12O2 bobot molekulnya adalah 164,20 dan titik didih 250-255°C. Senyawa eugenol merupakan komponen utama yang terkandung dalam minyak cengkeh (Syzygium aromaticum), dengan kandungan dapat mencapai 70-96%, dan walaupun minyak cengkeh mengandung beberapa komponen lain seperti eugenol asetat dan β caryophyllene (Alma et al., 2007).
Eugenol secara luas digunakan dalam kedokteran gigi, anastesi, analgesik, agen anti pembengkakan, dan agen perasa. Farmakodinamik dari eugenol telah dikembangkan untuk fungsi imunilogikal, regulasi sistem saraf pusat, efek reproduksi, sistem kardiovaskular, sistem pencernaan, biokimia darah dan saluran urinal (Kong et al., 2014).
Eugenol merupakan senyawa fenolik yang memiliki beberapa gugus fungsi seperti alil, hidroksida dan metoksi. Dengan adanya gugus fungsi tersebut membuat senyawa eugenol dapat ditransformasikan menjadi beberapa senyawa turunan yang bermanfaat langsung atau menjadi bahan dasar untuk pembuatan senyawa lain.
Beberapa turunan eugenol yang telah dilakukan adalah alkilasi, adisi, isomerisasi, asetilasi, esterifikasi, polimerisasi, siklisasi monoeter dan sebagainya (Suryanto dan Anwar, 2008).
OH
H2C
OCH3
CH CH2
Cambar 2.1. Struktur eugenol (Sastrohamidjojo, 2004).
2.2 Formaldehid
Formaldehid adalah bahan yang sangat penting dalam industri dimana menunjukkan sifat yang sama dengan aldehida lainnya namun lebih reaktif sebagai contoh lebih mudah dioksidasi oleh oksigen atmosfer menjadi asam formiat.
Formaldehid adalah elektrofil yang baik pada reaksi substitusi elektrofilik senyawa aromatis dan mengalami adisi elektrofilik pada alkena dan aromatik (Morrison, 2002).
Larutan formaldehid disebut juga dengan formalin. Dapat larut sebanyak 37% (w/w) gas formaldehid dalam air . Tidak memiliki warna dan berbau tajam pedas. Dapat larut dalam air, aseton dan alkohol. Uapnya dapat menyebabkan iritasi sampai membran lendir dan kulit, gangguan pencernaan seperti sakit perut, hematuria, protenuria, manuria, asidosis, vertigo, koma, dan kematian (Anonim, 1976).
2.3 Dimetilamin
Dimetilamin merupakan senyawa organik dengan rumus kimia (CH3)2NH.
Amina sekunder ini berupa gas mudah terbakar tidak berwarna dan berbau seperti amonia. Dimetilamin memiliki titik leleh –96°C dan titik didih 7,5°C, sangat larut dalam air dan harga kb 5,4 × 10-4 (Morrison, 2002).
Dimetilamin secara komersial sebagai larutan dalam air hingga 40%.
Dimetilamin adalah basa yang lemah dan pka dari garam amoniumnya (10,73) lebih besar daripada Metilamin (10,64) dan Trimetilamin (9,79). Dimetilamina bereaksi dengan asam membentuk garam seperti dimetilamin hidroklorida, suatu padatan putih tidak berbau dengan titik lebur 171,5°C. Dimetilamin diproduksi melalui reaksi katalitik methanol dan ammonia pada suhu dan tekanan tinggi.
2 CH3OH+NH3→ (CH3)2NH + 2H2O (Gysel dan Musin, 2000).
2.4 Metil Iodida
Alkil iodida adalah alkil halida yang paling mudah terbentuk. Destilasi dengan pemanasan konstan dari alkohol dengan asam hidriodat adalah sebuah metode umum untuk pembentukan alkil iodida. Seperti yang terjadi pada klorida dan bromida, hasil dari alkil iodida dalam reaksi ini mungkin mengalami penyusutan dalam kasus alkohol sekunder dan tersier sebagai hasil penyusutan kerangka. Sebuah alternatif yang paling efektif secara partikular untuk perubahan dari di-ol menjadi di- iodo adalah sebuah campuran dari KI dan H3PO4 85%. Reagen tersebut memecah tetrahidrofuran dan tetrahidrofiran untuk hasil dari senyawa iodo (Vogel, 1989).
Iodo metana atau metil iodida adalah suatu senyawa kimia dengan rumus molekul CH3I. Senyawa ini merupakan cairan dengan densitas dan tekanan uap yang tinggi. Senyawa ini meupakan turunan dari metana dengan salah satu atom hidrogen digantikan oleh atom iodin. Senyawa ini dapat bercampur sempurna dengan pelarut- pelarut organik. Sifat- sifat dari metil iodida adalah sebagai berikut:
Formula :CH3I
Massa molar : 141,94 gram/mol
Warna : Bening
Aroma : Seperti eter
Densitas : 2,28gram/ml Titik lebur : -66,5OC Titik didih : 42,4OC
Kelarutan dalam air : 14gr/liter (Sulikowski, 2005).
2.5 Natrium Metoksida
Natrium metoksida adalah senyawa kimia dengan rumus CH3ONa. Padatan tak berwarna ini, yang dibentuk oleh deprotonasi metanol, adalah pereaksi yang banyak digunakan di industri dan laboratorium. Ini juga merupakan basa kaustik (El-Kattan dan McAtee, 2006).
Natrium metoksida dibuat dengan memperlakukan hati-hati metanol dengan logam Na:
2Na+2 CH3OH →2 CH3ONa + H
Reaksinya sangat eksotermik sehingga pengapian bisa terjadi. Larutan yang dihasilkan, tidak berwarna, sering digunakan sebagai sumber natrium metoksida, tetapi bahan murni dapat diisolasi dengan penguapan diikuti dengan pemanasan untuk menghilangkan sisa metanol. Padatan dihidrolisis dalam air untuk menghasilkan metanol dan natrium hidroksida; produk komersial dapat terkontaminasi dengan hidroksida. Padatan dan larutan menyerap karbon dioksida (dan uap air) dari udara, sehingga mengurangi alkalinitas basa
2CH3ONa + CO2 + H2O → 2CH3OH + Na2CO3
Dalam bentuk padat, natrium metoksida adalah polimer, dengan susunan atom pusat Na +, masing-masing terikat pada empat oksigen.Struktur, dan karena kebasaannya, natrium metoksida dalam larutan tergantung pada pelarut. Ini adalah basa yang jauh lebih kuat di DMSO di mana ia lebih terionisasi dan bebas dari ikatan hidrogen (Chandran et al., 2006).
Kristal putih, bubuk mengalir bebas. Peka terhadap udara dan kelembapan.
Larut dalam metanol, etanol. Juga ada dalam bentuk larutan, CH3ONa.2CH3OH, bubuk putih. Dipakai pada reaksi Sintesis Organik (Anonim, 1976).
2.6. Reaksi Substitusi Elektrofilik Aromatik
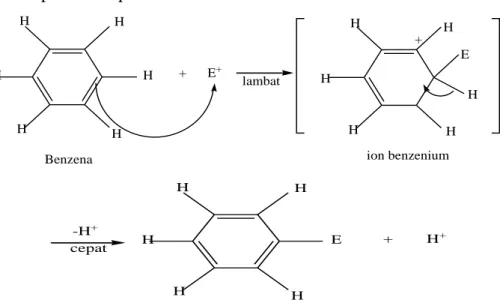
Reaksi yang paling umum terjadi pada senyawa aromatik adalah substitusi atom atau gugus lain terhadap hidrogen pada cincin aromatik. Benzena dan sistem aromatic lainnya adalah pusat kerapatan electron tinggi dan mudah diserang oleh spesies yang elektrofil dan umumnya bukan oleh nukleofil (Hart, 1990).
Tahap pertama elektrofil beradisi pada cincin aromatik dengan menggunakan dua electron dari awan aromatik dan membentuk sebuah ikatan sigma dengan salah satu atom atom karbon cincin, dan menghasilkan suatu macam karbokation yang
terstabilkan oleh resonansi yang disebut suatu ion benzenonium.Ion yang terbentuk pada tahap ini merupakan tahap antara.
H
H
H H H
H
+ E+
lambat
H H
H
H H
H E +
Benzena ion benzenium
-H+ cepat
H
E
H H H
H
+ H+
produk
Gambar 2.2. Reaksi umum substitusi elektrofilik aromatik (Fessenden dan Fessenden, 1986).
Tahap kedua, ion benzenonium bereaksi lebih lanjut, dalam hal ini sebuah hidrogen dibuang dari dalam zat antara (misalnya ditarik oleh ion yang sebelumnya berikatan dengan E+) untuk menghasilkan produk substitusi (Fessenden dan Fessenden, 1986).
2.7 Reaksi Mannich
Reaksi Mannich telah banyak digunakan untuk mengubah senyawa aminometi lentersubstitusi menjadi berbagai senyawa organik lain yang lebih bermanfaat. Reaksi Mannich terdiri atas pembentukan basa Mannich yang terjadi dari kondensasi formaldehida, suatu amina dengan suatu senyawa yang memiliki atom hydrogen aktif. Reaksi Mannich telah mengalami perkembangan yang sangat pesat dan telah banyak digunakan untuk memperoleh bahan-bahan yang bermanfaat dalam kehidupan sehari-hari, misalnya antibiotik, obat penahan rasa sakit, pembuatan polimer, dan sintesis antioksidan yang dewasa ini sedang menjadi pusat perhatian. Senyawa fenol merupakan senyawa yang memiliki atom hidrogen aktif sehingga dimungkinkan berkondensasi dengan formaldehida dan suatu amina untuk membentuk basa Mannich.
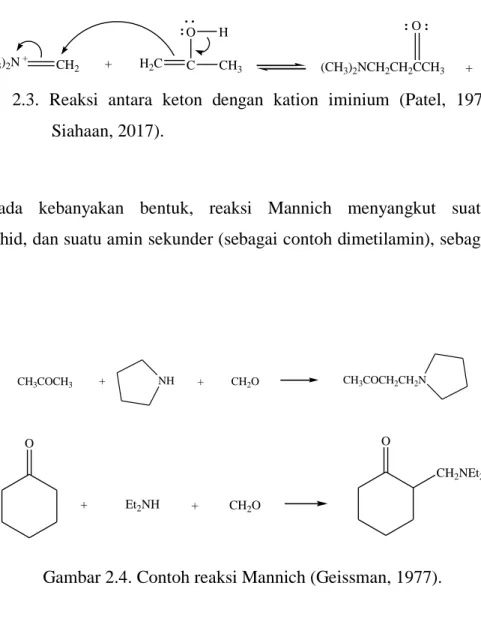
Tahap awal pada reaksi Mannich diyakini sebagai tahap pembentukan suatu kation iminium dari amina dan formaldehida. Kation iminium menyerupai suatu imina, tetapi memiliki muatan positif. Kation iminium merupakan elektrofil yang sangat reaktif. Bentuk enol dari keton, meskipun biasanya ada dalam konsentrasi rendah merupakan elektrofil karbon potensial. Reaksi antara dua komponen menghasilkan produk basa Mannich. Reaksi Mannich sangat potensial dipakai untuk mensintesis suatu senyawa. Pemilihan secara luas dari amina primer dan amina sekunder, macam aldehida, dan nukleofil akan menghasilkan senyawa yang beragam (Budimarwanti, 2009).
Reaksi Mannich adalah reaksi yang berdasarkan kondensasi dari amonia, atau suatu amina primer dans ekunder dengan aldehid, biasanya formaldehid, dan suatu senyawa yang mengandung paling sedikit satu atom hidrogen yang reaktif. Ciri utama dari reaksi ini adalah pergantian suatu atom hidrogen aktif dengan suatu gugus amino metal atau gugus amino metal tersubtitusi. Reaksi dapat diilustrasikan sebagai persamaan berikut:
R2NH + HCHO+R'H R2N — CH2 — R′ + H2O
Senyawa dengan hidrogen aktif R’H kebanyakan adalah suatu keton, suatu aldehid, suatu asam, suatu asetilen, suatu ester, suatu fenol, dan juga dengan nitroalkana.
Tahap awal dari reaksi Mannich adalah pembentukan dari suatu kation iminium dari amina dan formaldehid. Suatu kation iminium berdasarkan imine tetapi memiliki muatan positif.
(CH3)2NH + HCHO H
+ (CH3)2N + CH2
+ H2O
kation iminium
Kation iminium adalah elektrofilik yang sangat reaktif.Enol yang terbentuk dari keton secara normal ada pada konsentrasi rendah adalah suatu karbon elektrofil yang potensial. Reaksi dari kedua komponen mengarah pada produk.
H2C C CH3 H
:O :
Keton
H2C C O
CH3 H
Enol
H+
(CH3)2N + CH2 C O + H2C CH3
: H . .
(CH3)2NCH2CH2CCH3 : O :
+ H +
Gambar 2.3. Reaksi antara keton dengan kation iminium (Patel, 1979, dalam Siahaan, 2017).
Pada kebanyakan bentuk, reaksi Mannich menyangkut suatu keton, formaldehid, dan suatu amin sekunder (sebagai contoh dimetilamin), sebagai berikut ini :
CH3COCH3 + NH + CH2O CH3COCH2CH2N
+ Et2NH + CH2O
O O
CH2NEt2
Gambar 2.4. Contoh reaksi Mannich (Geissman, 1977).
2.8 Kondisi Reaksi Mannich
Reaksi biasanya dilakukan pada larutan alkohol dengan amina sekunder dalam bentuk klorida. Karena amin (sebagai contoh, dimetilamin ) adalah suatu basa dengan kekuatan sedang, didalam garamnya berdisosiasi kedalam bentuk terprotonasi (Me2NH2+
) dan spesi tidak terprotonasi (Me2NH). Hal ini menyediakan suatu medium dimana, kesetimbangan transfer proton dibutuhkan untuk reaksi dapat terjadi. Jika amina bebas digunakan sebagai reagen, sejumlah kecil asam ditambahkan pada larutan (Geissman,1977).
2.9 Garam Ammonium Kuartener
Garam ammonium kuarterner adalah garam amin yang memiliki atom nitrogen terikat pada empat atom karbon (Latin quaterni, ―tiap empat)‖. Oleh karena pasangan elektron sunyi pada atom nitrogen digunakan dalam pembentukan ikatan nitrogen mempunyai muatan ion positif. Ikatan sekitar nitrogen dari garam ammonium kuarterner sama dengan yang ada disekitar karbon hibrida sp3 dalam suatu alkana atau alkena yang tersubtitusi. Jika atom nitrogen terikat pada empat gugus yang berbeda, kationnya kiral dan garam ammonium kuarterner berada sebagai sepasang enantiomer yang dapat dipisahkan.
N CH3
H3C
CH3 CH3
+
Cl-
Tetrametilamonium klorida garam amonium kuartener
N R1
R2
R3 R4
+
Cl-
Garam amonium kuartener kiral
(Fessenden dan Fessenden, 2010).
Sangat berkaitan dengan garam ammonium dimana senyawanya memiliki empat atom hidrogen NH4+
diganti dengan gugus akil atau aril.Senyawa seperti ini disebut garam ammonium kuartener.Berikut contoh beberapa senyawanya:
(CH3)4N+Cl-
tetra metil amonium klorida PhN+Et3Br-
N,N,N-trietilanillum bromida PhCH2N+(CH3)3OH-
Benziltrimetilamonium hidroksida
CH3(CH2)15 N+ CH3
CH3 H2
C Ph Cl-
Benzalkonium Klorida
Surfaktan Kationik
Amina dapat dikonversi menjadi garam amonium kuartener dengan alkil halida berlebih dalam kondisi tertentu.Dalam proses ini disebut kuartenerisasi adalah satu dari aplikasi penting dalam sintesis alkilasi amina.Reaksi sangat berguna ketika terutama alkil halida yang reaktif seperti metil iodida atau benzil halida digunakan.
PhCH2N(CH3)2
. .
+ CH3I EtOH PhCH2N+(CH3)3 I-
Benzildimetilamine Benziltrimetilamonium iodida
Yield 94-99%
CH3(CH2)15N(CH3)2 + PhCH2Cl Acetone CH3(CH2)15N+(CH3)3 Cl- N,N-dimetil-1-hexadekanamin Benzil Klorida
Benzilheksadekildimetilamonium klorida CH2Ph
CH3CHNHCH3 C2H5
Sek-butilmetilamine
+ CH3I (berlebih) Eter Panas
CH3CHN+(CH3)3 + HI
sek-butiltrimetil-amonium klorida
(Loudon, 1995).
2.10 Reaksi basa Mannich metil iodida dengan nukleofil
Substitusi nukelofilik terjadi dengan dua jalur utama, yaitu SN1 dan SN2. Tanpa memperhatikan mekanisme reaksi, keseluruhan perubahan semua reaksi substitusi nukleofilik adalah sama. Suatu nukelofil (Nu : atau Nu: -)bereaksi dengan suatu substrat R-X dan substitusi untuk X: -(gugus pergi) untuk menghasilkan produk R-Nu. Jika nukelofil adalah netral (Nu:) , kemudian produk adalah bermuatan positif
untuk menjaga muatan ; jika muatan negatif ( Nu: -) produk adalah netral (McMurry, 1994 )
Pergantian dari atom nitrogen tersier dan kuartener oleh reagen nukleofilik adalah reaksi yang cukup dikenal. Banyak turunan benzilamin, sebagai contoh telah mengalami reaksi sebagai amina atau garam ammonium kuartener dengan nukelofilik seperti ion sianida, alkoksida dan fenoksi, ion asetat dan ion malonat.
Meskipun reaksi ini sangat umum dan berguna dalam sintesis, hal ini berjalan mudah pada sistem yang relatif sedikit. Contoh berikut kemampuan alkilasi menjaga untuk tetap bermuatan positif mengindikasikan bahwa reaksi difasilitasi dengan pelepasanelektron pada atom karbon ketika pergantian terjadi. Hal ini diilustrasikan dengan reaksi turunan azulen dimana intermediet memiliki keberadaan terbatas yang mungkin terbentuk namun juga dapat terbentuk keadaan transisi adalah bimolekular.
Reaksi dengan turunan fenol sebagai jalur intermediet sangat berguna dalam sintesis quinone methida dan turunannya
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat
Proses penelitian dilaksanakan dari bulan November 2018 hingga September 2019. Proses penelitian dilakukan di Laboratorium Kimia Organik FMIPA USU Medan. Analisis spektrofotometer (FT-IR), Analisis (GC-MS) dilakukan di Laboratorium Kimia Organik Universitas Gajah Mada (UGM) dan analisa 1H-NMR dilakukan di Laboratorium Kimia Institut Teknologi Bandung (ITB).
3.2. Alat dan Bahan 3.2.1. Alat
Spektrofotometer FT-IR Shimadzu
GC-MS Shimadzu
Spektrofotometer 1H-NMR JOEL JNMECA 500
Rotary evaporator Heidolph
Labu rotary 100 mL Heidolph
Labu Takar 100 mL Pyrex
Labu Takar 1000 mL Pyrex
Gelas Ukur 50 mL Pyrex
Labu Leher Tiga 250 ml Pyrex
Hotplate Stirrer Fishons
Magnetic Bar
Neraca Analitis RADWAG AS 220/6/2
Termometer 110 Pyrex
Gelas Erlenmeyer 50 mL Pyrex
Beaker Glass 100 ml Pyrex
Kondensor Pyrex
Panci Jawa
Oven Memmert
Plastik dan Karet
Corong Penetes
Kertas saring Whatman No.42
Spatula
Botol Aquadest
Cawan Petri
Pipet Tetes
Sample Cup
Botol Vial
Desikator
Indikator pH Universal Sartorius
3.2.2. Bahan
Eugenol p.a E’Merck
Dimetilamin 40% p.a E’Merck
Ethanol 96% p.a E’Merck
Formaldehid 37% p.a E’Merck
KI p.a E’Merck
Asam fosfat 85% p.a E’Merck
Na2S2O3 p.a E’Merck
HCl 37% p.a E’Merck
NaOMe p.a E’Merck
Aquadest
Na2SO4 anhidrat p.a E’Merck
Dietileter p.a E’Merck
Kloroform p.a E’Merck
AgNO3 0,1N
3.3. Prosedur Penelitian
3.3.1. PembuatanLarutan Na2S2O3 5%
Sebanyak 5 g serbuk Na2S2O3 dilarutkan dengan aquadest didalam labu takar 100 mL sampai garis tanda dan dihomogenkan.
3.3.2. Pembuatan larutan HCl 10%
Sebanyak 270,27 ml HCL 37% dilarutkan dengan aquadest didalam labu takar 1000 mL sampai garis tanda dan dihomogenkan.
3.3.3. Sintesis Senyawa 4-Alil-6-(Dimetilamino)Metil-2-Metoksi Fenol (Karanov et al., 1995)
Ke dalam labu leher tiga berkapasitas 100 mL yang telah dilengkapi pengaduk magnet dimasukkan sebanyak 28 mL etanol dan 4,8 g (0,03 mol) eugenol.
Setelah larut ditambahkan campuran formaldehid 37% sebanyak 3,8 g (3,48 mL ; 0,04 mol) dan 5,6 g (6,3 mL ; 0,05 mol) dimetilamin 40% dilanjutkan refluks pada suhu 780C selama 90 menit. Campuran didinginkan dan diaduk dengan pengaduk magnet selama 24 jam. Selanjutnya kelebihan etanol diuapkan dengan rotary evaporator. Hasil yang diperoleh dianalisis dengan spektofotometer FT-IR dan GC- MS.
3.3.4. Pembuatan Metil Iodida (Suarez et al., 2001)
Sebanyak 66,4 g (0,4 mol) kalium iodida dilarutkan dengan 175 mL (3 mol) asam fosfat 85% di dalam labu leher tiga kemudian ditambahkan 120 mL (3 mol) metanol. Kemudian dirangkai alat destilasi, dan diaduk menggunakan pengaduk magnet sambil dipanaskan secara perlahan-lahan. Dikumpulkan destilat pada labu yang telah didinginkan dan dihentikan setelah suhu destilat mencapai 650C.
Dimasukkan kedalam corong pisah dan diekstraksi dengan larutan Na2S2O3 5% yang akan membentuk dua lapisan. Lapisan bawah diambil dan dicuci kembali dengan aquades yang akan membentuk dua lapisan juga. Lapisan bawah dikeringkan dengan menggunakan Na2SO4 anhidrat. Hasil metil iodida yang diperoleh diuji secara
kualitatif menggunakan pereaksi AgNO3 dalam tabung reaksi menghasilkan padatan AgI berwarna kuning.
3.3.5. Sintesis Senyawa 6-[(N-Iodo-N-Metil-N-Metil-N-Metilamino)Metil]4- Alil-2-Metoksi Fenol
(Popovici et al., 1999)
Sebanyak 4,404 g (0,2 mol) Senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol dimasukkan kedalam wadah Erlenmeyer. Ditambahkan sebanyak 35 ml etanol dan ditambahkan metil iodida sebanyak 2,84 g (0,2 mol) dan wadah ditutup rapat.
Campuran reaksi diaduk pada suhu kamar dengan magnetik stirrer selama 2 jam dan didiamkan dalam lemari pendingin selama semalam. Endapan yang terbentuk disaring menggunakan kertas saring dan dicuci dengan dietil eter. Hasil yang diperoleh dimurnikan dengan rekristalisasi dengan menggunakan etanol dan hasil diperoleh dianalisa dengan alat spektrofotometer FT-IR dan analisa 1H-NMR.
3.3.6. Sintesis senyawa 4-alil-6-(metoksimetil)-2-metoksi fenol
Ke dalam labu leher tiga berkapasitas 250 mL yang telah dilengkapi pengaduk magnet dimasukkan sebanyak 50 mL akuades dan 3,621 g (0,01 mol) (6- ((N-iodo-N-metil-N-metil-N-metilamino)Metil)-4-allil-2-metoksi fenol) . Setelah larut ditambahkan NaOMe 2,16 g (0,04 mol) yang telah dilarutkan dengan 50 mL akuades dilanjutkan refluks pada suhu 1000C selama 5 jam. Campuran didinginkan dan diasamkan hingga pH 3 dengan HCl 10% .Selanjutnya diekstraksi dengan 60 mL kloroform , kelebihan metanol diuapkan dengan rotary evaporator. Hasil yang diperoleh dianalisis dengan spektofotometer FT-IR dan 1H-NMR
3.4. Bagan Penelitian
3.4.1. Sintesis Senyawa 4-Alil-6-(Dimetilamino)Metil-2-Metoksi Fenol
3.4.2. Pembuatan Metil Iodida
3.4.3 Sintesis Senyawa 6-[(N-Iodo-N-Metil-N-Metil-N-Metilamino)Metil]-4- Alil-2-Metoksi Fenol
3.4.4. Sintesis Senyawa 4-Alil-6-(MetoksiMetil)-2-Metoksi Fenol
BAB 4
HASIL DAN PEMBAHASAN
4.1 Sintesis Senyawa 4-Alil-6-(Dimetilamino)Metil-2-Metoksi Fenol
Sintesis senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol diperoleh melaui reaksi Mannich dari eugenol dengan formaldehid dan dimetilamin. Senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol yang diperoleh berupa cairan berwarna coklat kehitaman sebanyak 5,35 gram (88,3%).
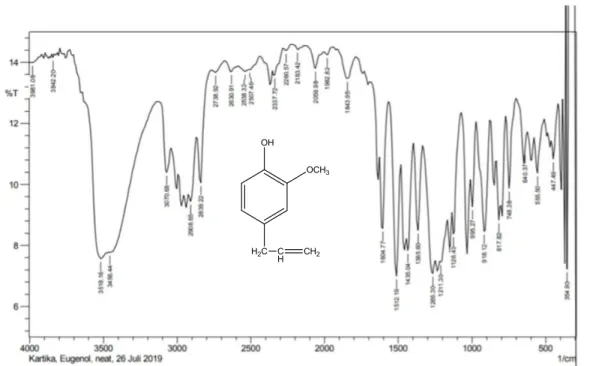
Eugenol yang digunakan dalam penelitian ini adalah eugenol p.a E’Merck dengan tingkat kemurnian 97%. Hasil analisis spektroskopi FT-IR dari senyawa eugenol komersilmemberikan spektrum dengan puncak-puncak vibrasi pada daerah bilangan gelombang 3518,16 cm-1 ; 2908,65 cm-1 ; 2839,22 cm-1 ; 1604,77 cm-1 ; 1512,19 cm-1 ; 1435,04 cm-1 ; 1365,60 cm-1 ; 1265,30 cm-1 ; 918,12 cm-1. Hasil analisis spektroskopi FT-IR dari senyawa eugenol komersil (Gambar 4.1.) adalah sebagai berikut :
Gambar 4.1. Spektrum FT-IR senyawa eugenol komersil
Spektrum yang ditunjukkan dari data FT-IR eugenol menunjukkan adanya serapan pada bilangan gelombang 3518,16 cm-1menunjukkan vibrasi O-H. Pita serapan pada daerah bilangan gelombang 2908,65 cm-1 dan 2839,22 cm-
1menunjukkan rentangan C-H dari alkil yang diperkuat adanya pita pada 1435,04 cm-
1untuk gugus metilen (―CH2―) dan pada 1365,60 cm-1 untuk gugus metil (―CH3) serta C=C aromatis ditunjukkan pada bilangan gelombang 1604,77 cm-1 dan 1512,19 cm-1. Gugus vinil ditunjukkan pada 918,12 cm-1. Pita pada 1265,30 cm-1 menunjukkan rentangan C-O-C dari eter.
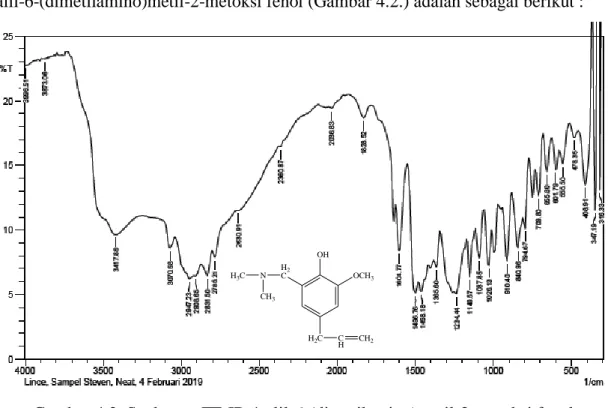
Data spektroskopi FT-IR senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol memberikan spektrum dengan puncak-puncak vibrasi pada daerah bilangan gelombang 3417,86 cm-1 ; 3070,68 cm-1 ; 2947,23 cm-1 ; 1604,77 cm-1 ; 1458,18 cm-1
; 1234,44 cm-1 ; 1026,13 cm-1. Hasil analisis spektroskopi FT-IR dari senyawa 4- alil-6-(dimetilamino)metil-2-metoksi fenol (Gambar 4.2.) adalah sebagai berikut :
Gambar 4.2. Spektrum FT-IR 4-alil-6-(dimetilamino)metil-2-metoksi fenol Spektrum yang ditunjukkan dari data FT-IR memberi dukungan bahwa senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol yang terbentuk memiliki ikatan C-N yang berasal dari gugus dimetilaminometil dengan munculnya vibrasi ulur C-N pada bilangan gelombang 1234,44 cm-1.Puncak serapan pada bilangan gelombang 3417,86 cm-1 menunjukkan vibrasi O-H. Pita serapan pada daerah panjang gelombang 2947,23 cm-1 dan 2908,65 cm-1 menunjukkan rentangan C-H dari alkil yang diperkuat adanya pita pada 1458,18 cm-1 untuk gugus metilen (―CH2―) dan pada 2785,21 cm-1 untuk gugus metil (―CH3) serta C=C aromatis ditunjukkan pada bilangan gelombang 1604,77 cm-1. Gugus vinil ditunjukkan pada 1026,13 cm-1. Pita pada 1149,57 cm-1 menunjukkan rentangan C-O-C dari eter.
OH
H2C OCH3 H2
C
CH CH2 N
CH3 H3C
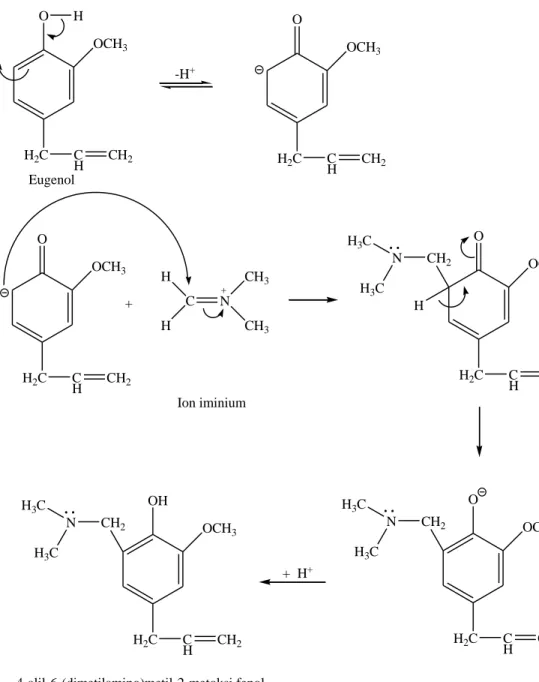
Senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol diperoleh dari eugenol melalui reaksi Mannich, dimana eugenol direaksikan dengan ion iminium yang sebelumnya dibentuk melalui reaksi antara formaldehid dengan dimetilamin. Pada reaksi Mannich dari eugenol, hidrogen aktif dari eugenol digantikan oleh gugus dimetilaminometil. Reaksi Mannich ini dilakukan pada kondisi refluks pada suhu 78°C selama 90 menit menggunakan pelarut etanol. Hasil dari reaksi eugenol, formaldehid, dan dimetlamin menghasilkan senyawa turunan eugenol 4-alil-6- (dimetilamino)metil-2-metoksi fenol. Mekanisme reaksi Mannich eugenol digambarkan sebagai berikut :
N CH3 H
+ H3C
H C
O -
H N H+
CH3 CH3
C N
Dimetilamin
. .
H CH3
CH3 H
+
Transfer proton
Ion iminium
H C
OH
H N CH3
CH3
-OH- C
O
H
Formaldehid . .:
. .
C N
H CH3
CH3 H
+
Ion karbokation N,N-dimetilmetanamin . .
C N
H CH3
CH3 H
+
+
O
H2C C H CH2
OCH3
H CH2 N H3C
H3C
OH
H2C C H CH2
OCH3 CH2
N H3C
H3C
4-alil-6-(dimetilamino)metil-2-metoksi fenol O
H2C C H CH2
OCH3
H O
H2C C H CH2
OCH3
O
H2C C H CH2
OCH3
O
H2C C H CH2
OCH3
CH2 N H3C
H3C + H+
-H+
. .
. . . . Eugenol
Ion iminium
Gambar 4.3. Reaksi sintesis senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol Hasil analisa dengan GC-MS terhadap senyawa 4-alil-6- (dimetilamnino)metil-2-metoksi fenol yang diperoleh dari hasil sintesis menunjukkan puncak waktu retensi 29,650 menit dengan kemurnian sebesar 85,65%.
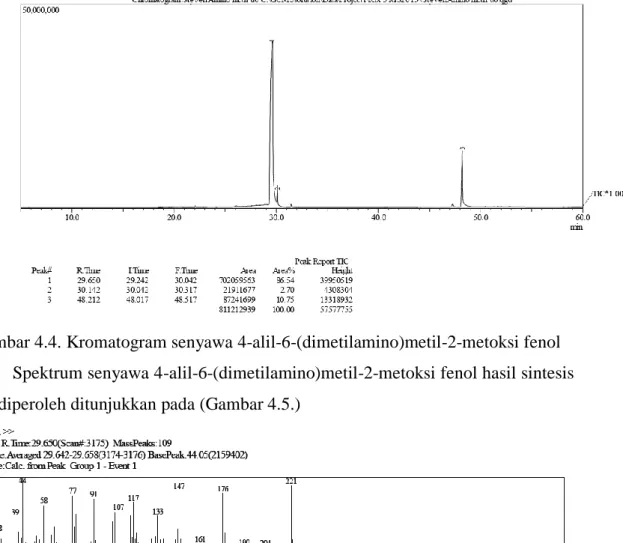
Kromatogram massa senyawa hasil sintesis dengan GC-MS (Gambar 4.4.) ditunjukkan sebagai berikut :
Gambar 4.4. Kromatogram senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol Spektrum senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol hasil sintesis yang diperoleh ditunjukkan pada (Gambar 4.5.)
Gambar 4.5. Spektrum Massa 4-alil-6-(dimetilamino)metil-2-metoksi fenol
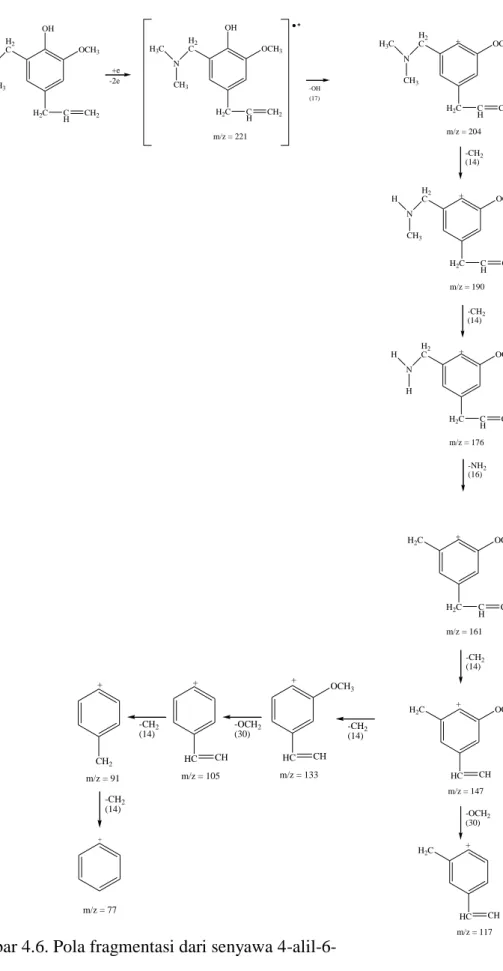
Puncak dengan waktu retensi 39,650 menit merupakan senyawa dengan rumus molekul C13H19NO2 dengan massa molekul relatif sebesar 221 g/mol. Data spektrum menunjukkan puncak ion molekul pada m/e 221 diikuti puncak-puncak fragmentasi pada m/e 204, 190, 176, 161, 147, 133, 117, 107, 91, 77, 58, 44, 39, dan 28, dimana nilai ini sesuai dengan berat molekul relatif (Mr) dari senyawa 4-alil-6- (dimetilamino)metil-2-metoksi fenol yang disintesis.
Pola fragmentasi dapat dilihat pada (Gambar 4.6.)
Gambar 4.6. Pola fragmentasi dari senyawa 4-alil-6- (dimetilamino)metil-2-metoksi fenol
OCH3
H2C H2C
CH CH2
m/z = 161
-CH2 (14) +
OCH3
HC H2C
CH m/z = 147
-OCH2 (30)
HC H2C
CH m/z = 117 +
+ OCH3
H2C H2 C
CH CH2 N
CH3 H3C
m/z = 204
-CH2 (14)
OCH3
H2C H2 C
CH CH2 N
CH3 H
m/z = 190
-CH2 (14)
OCH3
H2C H2 C
CH CH2 N
H H
m/z = 176
-NH2 (16) +
+
+ OH
OCH3
H2C H2 C
CH CH2 N
CH3 H3C
+e
OH
OCH3
H2C H2 C
CH CH2 N
CH3 H3C
m/z = 221
-OH (17) -2e
-CH2 (14) OCH3
HC CH
m/z = 133
+
-OCH2 (30)
HC CH
m/z = 105 -CH2
(14)
CH2 m/z = 91
-CH2 (14)
m/z = 77
+ + +
Berdasarkan hasil analisa GC-MS, disamping produk hasil sintesis terdapat senyawa lain yang merupakan pengotor dan senyawa hasil reaksi samping.
Senyawa dengan waktu retensi 30,142 menit adalah senyawa p-alilanisol sebesar 2,70%. Senyawa dengan waktu retensi 48,212 menit adalah senyawa 2- etil-2-(p-tolil)malonamida sebesar 10,75%. Munculnya senyawa p-alilanisol dan 2-etil-2-(p-tolil)malonamida diduga berasal dari bahan baku eugenol yang digunakan, dimana eugenol tidak bereaksi secara sempurna.
4.2 Sintesis Senyawa 6-[(N-Iodo-N-Metil-N-Metil-N-Metilamino)Metil]-4- Alil-2-Metoksi Fenol
Sintesis senyawa 6-((N-iodo-N-metil-N-metil-N-metilamino)metil)-4-alil-2- metoksi fenol diperoleh melalui reaksi antara senyawa 4-alil-6-(dimetilamino)metil- 2-metoksi fenol dengan metil iodida dalam pelarut etanol. Senyawa 6-((N-iodo-N- metil-N-metil-N-metilamino)metil)-4-alil-2-metoksi fenol yang diperoleh berupa padatan berwarna kuning sebanyak 5,83 gram (80,5%).
Data spektroskopi FT-IR senyawa 6-[(N-iodo-N-metil-N-metil-N- metilamino)metil]-4-alil-2-metoksi fenol memberikan spektrum dengan puncak- puncak vibrasi pada daerah bilangan gelombang 3433,29 cm-1 ; 3008,95 cm-1 ; 2924,09 cm-1 ; 1635,64 cm-1 ; 1481,33 cm-1 ; 1396,46 cm-1 ; 1288,45 cm-1; 1087,85 cm-1 ; 948,98 cm-1 ; 455,20 cm-1. Hasil analisis spektroskopi FT-IR dari senyawa 6- [(N-iodo-N-metil-N-metil-N-metilamino)metil]-4-alil-2-metoksi fenol (Gambar 4.7.) adalah sebagai berikut :
Gambar 4.7. Spektrum FT-IR senyawa 6-[(N-iodo-N-metil-N-metil-N metilamino)metil]-4-alil-2-metoksi fenol
Spektrum yang ditunjukkan dari data FT-IR memberikan dukungan bahwa senyawa 6-[(N-iodo-N-metil-N-metil-N-metilamino)metil)]-4-alil-2-metoksi fenol yang terbentuk memiliki ikatan +N(CH3)3 ditunjukkan pada bilangan gelombang 1481,33 cm-1dan telah hilangnya serapan C-N, dimana bilangan gelombang 1481,33 cm-1 ini merupakan ciri khas dari garam ammonium kuartener (Zhang, 2018).
Puncak serapan pada bilangan gelombang 3433,29 cm-1 menunjukkan vibrasi O-H, kemudian puncak serapan pada bilangan gelombang 2924,09 cm-1 menunjukkan rentangan C-H dari alkil yang diperkuat adanya pita pada 1396,46 cm-1 untuk gugus metilen (―CH2―) dan pada 1288,45 cm-1 untuk gugus metil (―CH3) serta C=C aromatis ditunjukkan pada bilangan gelombang 1635,64 cm-1. Pita pada 1087,85 cm-1 menunjukkan rentangan C-O-C dari eter. Gugus vinil ditunjukkan pada 948,98 cm-1. Pita pada bilangan gelombang 455,20 cm-1 menunjukkan vibrasi dari I-.
Pembuatan senyawa 6-[(N-iodo-N-metil-N-metil-N-metilamino)metil]-4-alil- 2-metoksi fenol dilakukan melalui reaksi metilasi menggunakan metil iodida dalam pelarut etanol. Reaksi antara senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol dengan metil iodida dapat digolongkan dalam reaksi pembentukan garam amonium kuartener, dimana senyawa 4-alil-6-(dimetilamino)metil-2-metoksi fenol merupakan
OH
OCH3
H2C H2 C
CH CH2 N
CH3 H3C
H3C I-
+
senyawa amina tersier yang dapat bereaksi lanjut untuk membentuk garam amonium kuartener.
Dalam penelitian ini reaksi antara senyawa 4-alil-6-(dimetilamino)metil-2- metoksi fenol dengan metil iodida dilakukan dalam wadah tertutup karena sifat dari metil iodida yang mudah menguap. Hasil reaksi berupa padatan dimana saat reaksi berlangsung akan mengendap secara perlahan dalam wadah reaksi, campuran reaksi yang didiamkan selama semalam dan didinginkan bertujuan untuk memaksimalkamn hasil reaksi yang diperoleh. Hasil reaksi yang diperoleh berupa padatan sehingga memungkinkan untuk dilakukan pemurnian melalui proses rekristalisasi. Adapun reaksi pembuatan senyawa 6-[(N-iodo-N-metil-N-metil-N-metilamino)metil]-4-alil- 2-metoksi fenol (Gambar 4.8.) dapat ditulis sebagai berikut :
OH
OCH3
H2C H2 C
CH CH2 N
CH3 H3C
Pelarut : Etanol
4-alil-6-(dimetilamino)metil-2-metoksi fenol H3C I . .
OH
OCH3
H2C H2 C
CH CH2 N
CH3 H3C H3C
6-[(N-iodo-N-metil-N-metil-N-metilamino)metil]-4-alil-2-metoksi fenol I- +
Gambar 4.8. Reaksi sintesis senyawa 6-[(N-iodo-N-metil-N-metil-N- metilamino]metil-4-alil-2-metoksi fenol
Untuk menganalisa struktur dari senyawa 6-((N-iodo-N-metil-N-metil-N- metilamino)metil)-4-alil-2-metoksi fenol (Gambar 4.9.) maka spektrum tersebut didukung oleh hasil analisa spektroskopi 1H-NMR yang ditunjukkan dalam gambar berikut (Gambar 4.9.) :
Gambar 4.9. Spektrum 1H-NMR senyawa 6-((N-iodo-N-metil-N-metil-N- metilamino)metil)-4-alil-2-metoksi fenol
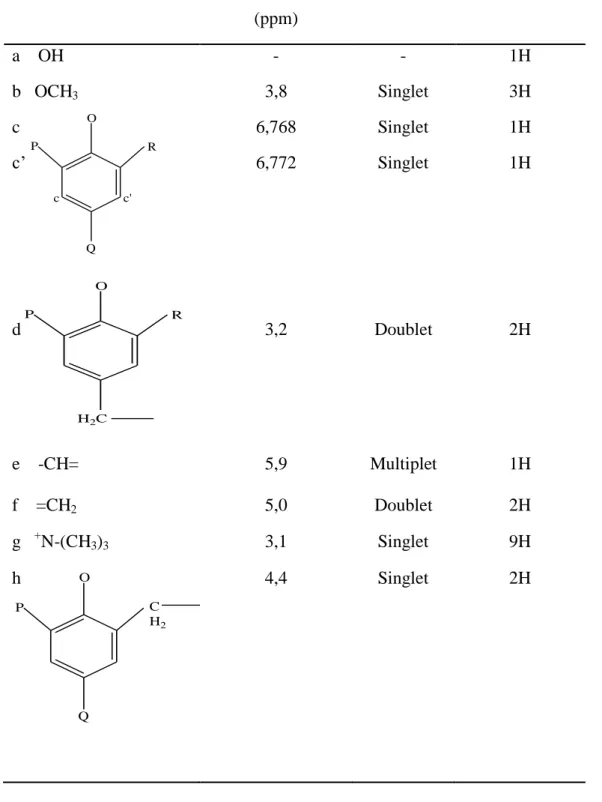
Hasil analisa spektroskopi 1H-NMR senyawa 6-((N-iodo-N-metil-N-metil-N- metilamino)metil)-4-alil-2-metoksi fenol diperoleh sebanyak 9 lingkungan proton yang ditunjukkan dalam tabel sebagai berikut (Tabel 4.1.) :
OH
OCH3
H2C H2
C
CH CH2 N
CH3 H3C H3C
+
a
b c'
d e f
h
g g g
c
I-
Gambar 4.10. Senyawa 6-((N-iodo-N-metil-N-metil-N-metilamino)metil)-4- alil-2-metoksi fenol
Tabel 4.1. Data spektrum 1H-NMR senyawa 6-((N-iodo-N-metil-N-metil-N- metilamino)metil)-4-alil-2-metoksi fenol
Gugus Pergeseran Kimia (ppm)
Signal Jumlah proton
a OH - - 1H
b OCH3 3,8 Singlet 3H
c c’
6,768 6,772
Singlet Singlet
1H 1H
d 3,2 Doublet 2H
e -CH= 5,9 Multiplet 1H
f =CH2 5,0 Doublet 2H
g +N-(CH3)3 3,1 Singlet 9H
h 4,4 Singlet 2H
Dari hasil interpretasi spektrum resonansi magnetik inti proton (1H-NMR) senyawa hasil sintesis dengan menggunakan pelarut D2O dapat dilihat bahwa telah terbentuknya amina kuartener pada pergeseran kimia δ = 3,1 ppm yang menunjukkan
O
P R
H2C O P
Q
R
c c'
O P
Q
C H2
![Gambar 4.7. Spektrum FT-IR senyawa 6-[(N-iodo-N-metil-N-metil-N metilamino)metil]-4-alil-2-metoksi fenol](https://thumb-ap.123doks.com/thumbv2/123dok/3800883.3942433/43.893.180.768.141.488/gambar-spektrum-senyawa-metil-metil-metilamino-metil-metoksi.webp)