SINTESIS 4-METIL-2-PENTANON DARI ETIL ASETOASETAT DAN s-PROPIL BROMIDA MENGGUNAKAN KATALIS ETOKSIDA
MELALUI REAKSI ALKILASI DAN DEKARBOKSILASI
TUGAS AKHIR SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian Persyaratan Guna
Memperoleh Gelar Sarjana Sains
Oleh : Maya Tri Hartanti NIM 13307144013
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
SINTESIS 4-METIL-2-PENTANON DARI ETIL ASETOASETAT DAN s-PROPIL BROMIDA MENGGUNAKAN KATALIS ETOKSIDA
MELALUI REAKSI ALKILASI DAN DEKARBOKSILASI Oleh :
Maya Tri Hartanti NIM 13307144013
Pembimbing Utama : Karim Theresih ABSTRAK
Penelitian ini bertujuan untuk mensintesis senyawa 4-metil-2-pentanon dari senyawa etil asetoasetat dan s-propil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi, serta mengidentifikasi senyawa menggunakan spektroskopi FTIR, dan spektroskopi GC-MS.
Sintesis senyawa 4-metil-2-pentanon diawali dengan pembuatan natrium etoksida dengan cara mereaksikan natrium dan etanol. Katalis ini kemudian direaksikan dengan etil asetoasetat dan s-propil bromida melalui reaksi alkilasi pada suhu 69-76oC selama 3 jam, dilanjutkan dengan reaksi hidrolisis pada suhu 90-100oC selama 2 jam dan reaksi dekarboksilasi pada suhu 98-105 oC selama 3 jam. Hasil sintesis diidentifikasi menggunakan spektroskopi FTIR dan spektroskopi GC-MS.
Senyawa 4-metil-2-pentanon dapat disintesis dari senyawa etil asetoasetat dan s-propil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi. Senyawa hasil sintesis berupa cairan kental berwarna merah bata. Hasil spektra FTIR menunjukkan adanya serapan O – H, C-H alifatik, C=O dan C-O, sedangkan hasil spektra GC-MS menunjukkan kelimpahan senyawa 4-metil-2-pentanon sebesar 0,09% sehingga menghasilkan rendemen sebesar 0,0078%.
Kata kunci : etil asetoasetat, s-propil bromida, natrium etoksida,
SYNTHESIS OF 4-METHYL-2-PENTANONE FROM ETHYL ACETOACETATE AND s-PROPYL BROMIDE USING ETHOXIDE
CATALYST THROUGH ALKYKATION AND DECARBOXYLATION REACTIONS.
By :
Maya Tri Hartanti NIM 13307144013 Supervisor : Karim Theresih
ABSTRACT
The research aims to synthesize 4-methyl-2-pentanone compound from ethyl acetoacetate and s-propyl bromide using ethoxide catalyst throught alkylation and decarboxylation reactions and identify compounds using FTIR spectroscopy and GC-MS spectroscopy.
The compound synthesis 4-methyl-2-pentanone was started from prosessing the sodium ethoxide by reacting sodium and ethanol. Then,this catalyst was reacted with ethyl acetoacetate and s-propyl bromide using alkylation at 69oC for 3 hours, continued by hydrolysis reaction at 90-100oC for 2 hours and decarboxylation reaction at 98-103oC for 2 hours. The results of the synthesis were identified using FTIR spectroscopy and GC-MS spectroscopy.
The 4-methyl-2-pentanone compound could be synthesized from ethyl acetoacetate and s-propyl bromide using ethoxide catalyst through alkylation and decarboxylation reactions. The results of the synthesis were a thick red-brick liquid. The results of FTIR spectra showed the absorbtion of O-H, C-H aliphatic, C=O and C-O , while the result of GC-MS spectra showed the abundance 4-methyl-2-pentanone compound in the amount of 0,09% that was produced a yield in the amount of 0,0078%.
Keywords: ethyl acetoacetate, s-propyl bromide, sodium ehoxide,
pernyataan
MOTTO
sesungguhnya Allah beserta orang-orang yang sabar
Katakanlah: "Hai hamba-hamba-Ku yang beriman. bertakwalah kepada Tuhanmu". Orang-orang yang berbuat baik di dunia ini memperoleh kebaikan.
Dan bumi Allah itu adalah luas. Sesungguhnya hanya orang-orang yang bersabarlah yang dicukupkan pahala mereka tanpa batas.
PERSEMBAHAN
Alhamdulillahirobbil’alamin, atas izin Allah SWT tugas akhir skripsi ini dapat diselesaikan. Tugas akhir skripsi ini saya persembahkan kepada :
1. Bapak Suharto, Ibu Suwarsiyem, Andri Wahyudi dan Yuliana Puspita Dewi selaku keluarga saya. Terimakasih sudah menjadi penyemangat dan selalu mendoakan saya.
2. Yudi Guntoro terimakasih atas segala dukungan dan doanya.
3. Devry Pramesti Putri (teman bimbingan skripsi), terimakasih atas diskusi, dukungan, motivasi, serta sarannya.
4. Hitz (Asida, Kirana, Igi, Puspa), terimakasih atas segala dukungannya. 5. Teman-teman Kimia E 2013, terimakasih atas semangat dan persaudaraan
selama perkuliahan.
6. Teman-teman satu lab. (Eka, Novia, Linda, Sinta, Elga, Asiah, Fitri, Hajar, Amel)
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas berkat rahmat dan karunia-Nya , Tugas Akhir Skripsi dalam rangka untung memenuhi sebagian persyaratan untuk mendapatkan gelar Sarjana Sains dengan judul “ Sintesis 4-Metil-2-Pentanon dari Etil Asetoasetat dan s-Propil Bromida menggunakan Katalis Etoksida Melalui Reaksi Alkilasi dan Dekarboksilasi”, dapat disusun sesuai dengan harapan. Tugas Akhir Skripsi ini dapat diselesaikan tidak lepas dari bantuan dan kerjasama dengan pihak lain. Berkenaan dengan hal tersebut, penulis menyampaikan ucapan terima kasih kepada yang terhormat:
1. Bapak Karim Theresih, S.U selaku Pembimbing Tugas Akhir Skripsi atas ilmu, bimbingan dan nasihat yang telah diberikan.
2. Ibu Prof. Dr. Nurfina Aznam, Apt.,S.U selaku Penguji Utama yang sudah memberikan koreksi perbaikan secara komprehensif terhadap TAS ini. 3. Ibu Prof. Dr. Sri Atun, M.Si selaku Penguji Pendamping yang sudah
memberikan koreksi perbaikan secara komprehensif terhadap TAS ini 4. Bapak Jaslin Ikhsan, Ph. D. selaku Ketua Jurusan Pendidikan Kimia dan
Koordinator Progam Studi Kimia serta Koordinator Tugas Akhir Skripsi Kimia FMIPA Universitas Negeri Yogyakarta yang telah memberikan ijin penelitian, nasihat, dan saran-saran.
5. Bapak Dr. Hartono, M.Si selaku Dekan FMIPA Universitas Negeri Yogyakarta yang telah memberikan ijin penelitian.
6. Bapak Dr. Crys Fajar Pratana, M.Si selaku Dosen Penasehat Akademik yang telah membimbing akademik selama 2 tahun ini.
7. Seluruh dosen, laboran, dan staf Jurusan Pendidikan Kimia FMIPA Universitas Negeri Yogyakarta atas bantuannya selama perkuliahan dan penelitian.
8. Semua pihak yang telah membantu dalam penyelesaian skripsi ini.
Dalam penyusunan Tugas Akhir Skripsi ini, penulis menyadari adanya keterbatasan kemampuan, pengetahuan, dan pengalaman sehingga masih terdapat kekurangan. Oleh karena itu, saran dan kritik yang bersifat membangun sangat penulis harapkan. Akhir kata, semoga skripsi ini dapat bermanfaat bagi pembaca sekalian.
Yogyakarta, ………. 2017 Yang menyatakan,
DAFTAR ISI Halaman HALAMAN JUDUL ... i ABSTRAK ... ii ABSTRACT ... iii HALAMAN PERSETUJUAN ... iv HALAMAN PENGESAHAN ... v HALAMAN PERNYATAAN ... vi MOTTO ... vii
HALAMANPERSEMBAHAN ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
BAB I ... 1
A. Latar Belakang Masalah ... 1
B. Identifikasi Masalah ... 3 C. Batasan Masalah... 4 D. Rumusan Masalah ... 4 E. Tujuan Penelitian ... 4 F. Kegunaan Penelitian... 5 BAB II ... 6 A. Deskripsi Teori ... 6
1. s-Propil Bromida ... 6
2. Natrium Etoksida ... 6
3. Etil Asetoasetat ... 7
4. Reaksi Alkilasi ... 9
5. Reaksi Hidrolisis dan Dekarboksilasi ... 11
6. Spektroskopi Inframerah (FTIR) ... 17
7. Kromatografi Gas-Spektroskopi Massa (KG-SM) ... 19
B. Penelitian yang Relevan ... 20
C. Kerangka Berfikir... 21
BAB III ... 22
A. Subjek Penelitian dan Objek Penelitian ... 22
1. Subjek Penelitian ... 22
2. Objek Penelian ... 22
B. Alat dan Bahan Penelitian ... 22
1. Bahan-bahan Penelitian ... 22
2. Alat-alat Penelitian ... 23
C. Prosedur Penelitian... 24
1. Reaksi Alkilasi Etil Asetoasetat ... 24
2. Reaksi Hidrolisis dan Dekarboksilasi ... 24
D. Teknik Analisis Data ... 25
1. Data Kuantitatif ... 25
2. Data Kualitatif... 25
BAB IV ... 26
A. HASIL PENELITIAN ... 26
2. Spektrum IR senyawa hasil sintesis 4-metil-2-pentanon ... 27
3. Kromatogram dan spektrum massa senyawa hasil sintesis 4-metil-2-pentanon ... 30
B. PEMBAHASAN ... 33
1. Hasil sintesis 4-metil-2-pentanon ... 33
2. Spektrum FTIR senyawa hasil sintesis 4-metil-2-pentanon ... 40
3. Spektrum GC-MS senyawa hasil sintesis 4-metil-2-pentanon ... 41
BAB V ... 45
A. Kesimpulan ... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Halaman Tabel 1. Data pengamatan hasil sintesis senyawa 4-metil-2-pentanon. ... 26 Tabel 2. Daerah serapan Hasil 1 dan Hasil 2 sintesis senyawa 4-metil-
2-pentanon... 29 Tabel 3. Daerah serapan Hasil 3 dan Hasil 4 sintesis senyawa 4-metil-
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur s-propil bromida ... 6
Gambar 2. Reaksi pembentukan natrium etoksida ... 7
Gambar 3. Struktur Etil Asetoasetat... 9
Gambar 4. Reaksi satu tahap SN2 ... 10
Gambar 5. Reaksi pembentukan ion enolat etil asetoasetat. ... 10
Gambar 6. Reaksi alkilasi. ... 11
Gambar 7. Produk alkilasi bersifat asam... 11
Gambar 8. Mekanisme hidrolisis asam (Carey, 2000). ... 13
Gambar 9. Mekanisme hidrolisis basa. ... 14
Gambar 10. Mekanisme hidrolisis basa dari etil asetoasetat ... 14
Gambar 11. Reaksi dekarboksilasi senyawa yang memiliki karbonil posisi β. .... 15
Gambar 12. Reaksi dekarboksilasi asam 3-oksobutanoat. ... 15
Gambar 13. Reaksi sintesis 4-metil-2-pentanon dari etil asetoasetat dan s-propil bromida melalui reaksi alkilasi, hidrolisis dan dekarboksilasi. ... 16
Gambar 14. Senyawa hasil sintesis. ... 26
Gambar 15. Spektrum FTIR Hasil 1 ... 27
Gambar 16. Spektrum FTIR Hasil 2 ... 27
Gambar 17. Spektrum FTIR Hasil 3 ... 28
Gambar 18. Spektrum FTIR Hasil 4 ... 28
Gambar 19. Spektrum GC-MS Hasil 2 ... 30
Gambar 20. Spektrum GC-MS Hasil 3 ... 31
Gambar 21. Spektrum GC-MS Hasil 4 dengan temperatur injeksi 70oC ... 32
Gambar 22. Spektrum GC-MS hasil 4 dengan temperatur injeksi 200oC... 32
Gambar 23. Spektrum GC-MS senyawa hasil sintesis... 33
Gambar 24. Reaksi pembentukan natrium etoksida. ... 34
Gambar 26. Mekanisme reaksi alkilasi ion enolat etil asetoasetat dan s-propil bromida ... 36 Gambar 27. Mekanisme reaksi hidrolisis dari senyawa etil
2-isopropil-3-oksobutanoat. ... 37 Gambar 28. Reaksi pembentukan Na2CO3... 38 Gambar 29. Mekanisme reaksi protonasi dari ion etil 2-isopropil-
3-oksobutanoat ... 38 Gambar 30. Mekanisme dekarboksilasi dari senyawa 2-isopropil-
3-oksobutanoat. ... 39 Gambar 31. Fragmentasi senyawa 4-metil-2-pentanon ... 43
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Jumlah Bahan dan Rendemen ... 49
Lampiran 2. Prosedur Kerja ... 51
Lampiran 3. Dokumentasi Penelitian ... 53
BAB I PENDAHULUAN A. Latar Belakang Masalah
Kimia organik merupakan cabang ilmu kimia yang berkaitan dengan makhluk hidup. Kimia organik sering didefinisikan sebagai senyawa kimia yang mengandung karbon. Akan tetapi kimia organik tidak terbatas hanya pada senyawa yang mengandung atom karbon saja melainkan dapat mengandung atom lain seperti hidrogen, nitrogen, oksigen, sedikit pospor dan sedikit belerang.
Sintesis memiliki peranan penting di dalam ilmu kimia. Sintesis merupakan suatu kegiatan mereaksikan bahan-bahan kimia untuk memperoleh suatu produk kimia baru yang reaksinya hanya dapat terjadi apabila kondisi reaksi dapat terpenuhi seperti suhu, pH, kelembaban yang optimum. Sintesis organik merupakan pembangunan senyawa organik kompleks dengan bahan awal senyawa sederhana oleh serangkaian reaksi kimia. Sintesis dapat dilakukan secara sederhana, langsung atau dapat dengan cara yang sangat rumit.
Dalam ilmu kimia sebagian besar reaksi dilakukan dalam bentuk larutan. Larutan sendiri terdiri dari pelarut (solvent) dan zat terlarut (solute). Pelarut (solvent) adalah zat yang berada pada larutan dalam jumlah yang besar, sedangkan zat lainnya dianggap sebagai zat terlarut (solute). Pelarut memiliki beberapa fungsi yaitu, dapat melarutkan reaktan dan reagen agar keduanya bercampur sehingga akan menghasilkan suatu produk, selain itu pelarut bertindak sebagai kontrol suhu, yang
berguna untuk meningkatkan energi dari tumbukan partikel sehingga partikel-partikel tersebut dapat bereaksi lebih cepat.
Pemanfaatan pelarut dalam bidang penelitian dan industri sangat dibutuhkan, oleh karena itu dituntut ketersediaan pelarut-pelarut tersebut dalam jumlah besar. Perkembangan riset-riset ilmiah yang banyak berkembang di dunia tentang pembuatan pelarut baik secara sintesis menggunakan bahan alami maupun bahan kimia menjadi produk yang memiliki daya pakai yang lebih, menjadikan konsumsi dunia terhadap pelarut-pelarut selain air semakin meningkat.
Senyawa alkanon biasanya digunakan sebagai pelarut, salah satunya adalah senyawa 4-metil-2-pentanon atau yang lebih dikenal dengan nama methyl isobutyl
ketone (MIBK). Senyawa 4-metil-2-pentanon adalah suatu senyawa keton. Dimana
keton merupakan senyawa karbonil dengan atom karbon berada pada gugus karbonil dihubungkan dengan dua gugus alkil atau aril (Matsjeh dkk,1993:364).
Senyawa 4-metil-2-pentanon merupakan pelarut yang berupa cairan tidak berwarna, sedikit larut dalam air, dan pada umumnya larut di dalam pelarut organik. Di dalam industri, senyawa 4-metil-2-pentanon biasanya diproduksi dari aseton melalui tiga proses. Pertama aseton mengalami kondensasi aldol untuk membentuk diaseton alkohol, yang mudah mengalami dehidrasi. Kedua, senyawa didehidrasi dan menghasilkan mesitil oksida. Ketiga, mesitil oksida kemudian di hidrogenasi sehingga menjadi MIBK.
Senyawa 4-metil-2-pentanon pada mulanya digunakan sebagai pelarut untuk keperluan tertentu, karena ketika itu orang lebih mengenalnya sebagai aseton. Baru
setelah diketahui 4-metil-2-pentanon atau MIBK adalah suatu pelarut yang bagus, orang mulai menggunakan MIBK sebagai pelarut.
MIBK memiliki banyak sekali manfaat yaitu: dapat digunakan sebagai pelarut
vynil, epoxy, acrilik (yang biasa digunakan pada industri cat dan thinner), pelarut
untuk pelapis tekstil, pelarut untuk nitroselulosa, pelarut untuk antibiotik dan obat-obatan lainnya, pelarut untuk pemisahan logam, pelarut untuk pelapis pemeliharaan industri, dll (Trademark of The Dow Chemical Company, 2002).
Banyaknya manfaat yang dimiliki oleh senyawa 4-metil-2-pentanon, maka perlu dilakukan penelitian lebih lanjut mengenai sintesis senyawa 4-metil-2-pentanon. Dalam penelitian ini dilakukan sintesis senyawa 4-metil-2-pentanon bukan dari aseton melalui reaksi kondensasi aldol melainkan, dari etil asetoasetat dan s-propil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi. Senyawa hasil sintesis selanjutnya diidentifikasi menggunakan spektroskopi FTIR dan GC-MS.
B. Identifikasi Masalah
Berdasarkan uraian dalam latar belakang masalah diatas, maka didapat beberapa masalah yang muncul sehingga di dapat identifikasi masalah sebagai berikut:
1. Bahan dasar yang digunakan untuk mensintesis 4-metil-2-pentanon. 2. Ada berapa cara untuk mengidentifikasi senyawa hasil sintesis. 3. Reaksi yang digunakan dalam sintesis senyawa 4-metil-2-pentanon.
C. Batasan Masalah
Agar tidak menimbulkan pengertian yang salah mengenai penelitian ini, maka masalah yang diteliti dibatasi pada :
1. Bahan dasar yang digunakan untuk mensintesis 4-metil-2-pentanon adalah etil asetoasetat dan s-propil bromida.
2. Reaksi yang digunakan dalam sintesis senyawa 4-metil-2-pentanon adalah reaksi alkilasi dan dekarboksilasi.
3. Identifikasi senyawa menggunakan spektroskopi inframerah (FTIR) dan GC-MS.
D. Rumusan Masalah
Dari uraian latar belakang dapat dirumuskan permasalahan sebagai berikut: 1. Apakah senyawa 4-metil-2-pentanon dapat disintesis dari etil asetoasetat dan
s-propil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi?
2. Bagaimana identifikasi struktur senyawa hasil sintesis? 3. Berapa rendemen senyawa 4-metil-2-pentanon hasil sintesis?
E. Tujuan Penelitian
Berdasarkan latar belakang, identifikasi masalah dan rumusan masalah di atas maka tujuan yang ingin dicapai dalam penelitian ini adalah:
1. Mensintesis senyawa 4-metil-2-pentanon dari senyawa etil asetoasetat dan s-propil bromida menggunakan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi.
2. Mengidentifikasi struktur senyawa hasil sintesis.
3. Menentukan rendemen senyawa 4-metil-2-pentanon hasil sintesis.
F. Kegunaan Penelitian
Adapun manfaat penelitian yang dapat diperoleh dari adanya penelitian ini adalah sebagi berikut :
1. Menambah khasanah pengetahuan ilmiah di bidang ilmu kimia yang dapat digunakan di laboratorium.
2. Mengerti reaksi untuk mensintesis senyawa 4-metil-2-pentanon dari etil asetoasetat dan s-propil bromida.
3. Memenuhi kebutuhan pelarut yang digunakan bagi peneliti lain atau keperluan praktikum kimia lainnya.
CH3 CH CH3 Br BAB II KAJIAN PUSTAKA A. Deskripsi Teori 1. s-Propil Bromida
Senyawa alkil halida telah banyak digunakan dalam penelitian di bidang industri sebagai senyawa antara untuk menghasilkan senyawa-senyawa lain yang bermanfaat, misalnya senyawa s-propil bromida. Senyawa s-propil bromida merupakan golongan senyawa halida sekunder dimana atom karbon ujung mengikat dua gugus alkil. Struktur senyawa s-propil bromida dapat dilihat pada Gambar 1 sebagai berikut:
Gambar 1. Struktur s-propil bromida
Senyawa s-propil bromida atau yang lebih dikenal dengan nama 2-bromopropana atau isopropyl bromida merupakan senyawa haloalkanadengan rumus CH3CH(CH3)Br. Senyawa tersebut merupakan cairan tak bewarna memiliki massa molar 123 g/mol, titik didih 59,38oC, titik lebur -89oC dan densitas 1,31 g/ml.
2. Natrium Etoksida
Natrium etoksida (C2H5ONa) atau lebih sering disebut alkoksida merupakan suatu katalis basa kuat yang memiliki massa molar sebesar 68,05 g/mol, densitas 0,868 g/ml, titik leleh 260oC.
Natrium etoksida dapat dibuat dari reaksi antara logam natrium dengan etanol kering. Etanol kering yang yang digunakan untuk melarutkan logam natrium adalah etanol tak berair (bukan etanol 95% biasa). Etanol kering berperan sebagai pelarut (Fessenden & Fessenden, 1999: 167). Oleh sebab itu pelarut etanol yang digunakan haruslah bebas dari air . Hal tersebut dikarenakan natrium bersifat reaktif sehingga dengan mudah akan membentuk natrium oksida dan natrium hidroksida saat terpapar oksigen dan uap air (Chandran et al., 2006). Sebelum digunakan, etanol p.a. dikeringkan terlebih dahulu dengan Na2SO4 anhidrat dan didiamkan semalaman. Natrium bereaksi stabil dengan etanol menghasilkan gas hidrogen dan membentuk larutan natrium etoksida.
Jika larutan ini diuapkan sampai kering, maka natrium etoksida akan tertinggal sebagai padatan putih (bisa juga berwarna kuning). Reaksi pembentukan natrium etoksida dapat dilihat dari Gambar 2.
+
C
2H
5OH
C
2H
5ONa
(aq) 1/
2H
2 (g)natrium etoksida
logam Na
etanol
Na
(s) (aq)+
gas hidrogen Gambar 2. Reaksi pembentukan natrium etoksida
3. Etil Asetoasetat
Etil 3-oksobutanoat (etil asetoasetat) adalah senyawa kimia berupa cairan tak berwarna yang memiliki rumus molekul C6H10O3, massa molar 130,16 g/mol, densitas 1,03 g/ml, dan titik didih 180,8oC (Science Lab, 2005). Etil asetoasetat merupakan β
keto ester yang dibentuk melalui reaksi kondensasi claisen antara 2 ester etil asetat menggunakan basa berupa natrium alkoksida atau natrium hidrida.
Firdaus et al, (2013) menyatakan bahwa struktur kimia dari etil asetoasetat terdiri dari dua posisi hidrogen-α, yaitu hidrogen-α yang hanya bertetangga dengan gugus karbonil keto serta hidrogen-α yang diapit oleh dua gugus karbonil. Keasaman kedua posisi hidrogen-α ini berbeda, dimana hidrogen-α yang diapit oleh dua gugus karbonil bersifat lebih asam (pKa=11) dibandingkan yang hanya bertetangga dengan karbonil keto (pKa>20). Hal ini disebabkan terjadinya kestabilan anion melalui delokalisasi elektron pada kedua oksigen karbonil. Oleh karena itu, pembentukan ion enolat terjadi melalui pelepasan hidrogen-α yang diapit oleh dua gugus karbonil tersebut.
Apabila ester yang memiliki hidrogen-α direaksikan dengan basa kuat (biasanya alkoksida dari kelompok alkohol ester), maka akan terbentuklah β-keto ester. Proses itu disebut juga sebagai reaksi kondensasi karena molekul yang kecil (alkohol) dikeluarkan (Pine dkk, 1988 : 380).
Senyawa β-keto ester merupakan suatu senyawa yang penting dalam sintesis organik karena senyawa tersebut dapat bertindak sebagai elektrofilik dan nukleofilik yang memungkinkan turunannya menjadi produk alami yang lebih komplek (Kondaiah, 2007).
Senyawa etil asetoasetat biasanya digunakan untuk mensintesis senyawa kimia tepatnya sebagai material awal pembuatan keton, sebab senyawa ini memiliki keasaman yang tinggi pada proton α serta asam asetoasetatnya mudah mengalami dekarboksilasi termal (Carey, 2000:839).
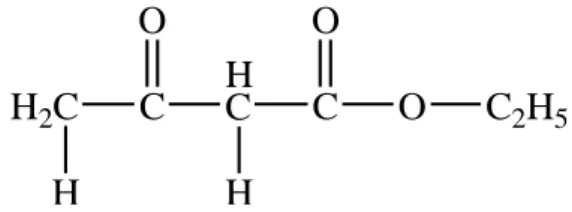
Struktur senyawa etil asetoasetat dapat dilihat pada Gambar 3. H2C H C O H C C O O C2H5 H
Gambar 3. Struktur Etil Asetoasetat
4. Reaksi Alkilasi
Metil halida merupakan alkil halida primer yang memberikan hasil rendemen terbaik. Sedangkan pada alkil halida sekunder memberikan rendemen yang lebih rendah. Menurut Hard et al (2003), pada halida sekunder dimungkinkan terjadi keempat mekanisme, yaitu SN2 dan E2, SN1 dan E1. Komposisi produk sangat ditentukan oleh nukleofil (kekuatannya sebagai basa) dan pada kondisi reaksi (pelarut, suhu). Pada umumnya, substitusi cenderung terjadi dengan nukleofil kuat yang bukan basa kuat (SN2) atau dengan nukleofil lemah seperti pelarut polar (SN1), tetapi eliminasi cenderung terjadi dengan basa kuat (E2).
Sedangkan pada alkil halida tersier akan memberikan produk eliminasi, dan aril halida tidak reaktif pada kondisi SN2 (Fessenden & Fessenden, 1999:169). Banyaknya rendemen yang dihasilkan dari reaksi alkilasi sangat bergantung pada urutan kereaktifan alkil halida tersebut (primer > sekunder > tersier). Hal ini disebabkan adanya gugus lain belakang atom karbon tempat terjadinya pergantian lebih sesak jika lebih banyak gugus alkil yang melekat, sehingga menyebabkan laju reaksinya lambat (Hard et al, 2003: 201).
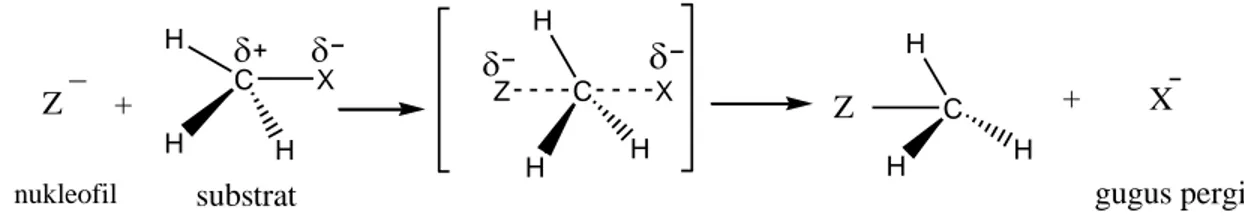
Reaksi alkilasi menjalani reaksi SN2 dimana reaksi SN2 menggunakan mekanisme satu tahap yang di gambarkan pada Gambar 4.
Gambar 4. Reaksi satu tahap SN2
Nukleofil menyerang dari sisi belakang ikatan C-X. Pada keadaan transisi, nukleofil dan gugus pergi keduanya terikat secara parsial pada karbon tempat berlangsungnya reaksi substitusi. Ketika gugus pergi meninggalkan karbon dengan sepasang elektron bebasnya nukleofil memasok sepasang elektron lain pada atom karbon (Hard et al, 2003:199).
Berikut merupakan tahap-tahap alkilasi dari etil asetoasetat dengan alkil halida menggunakan katalis etoksida :
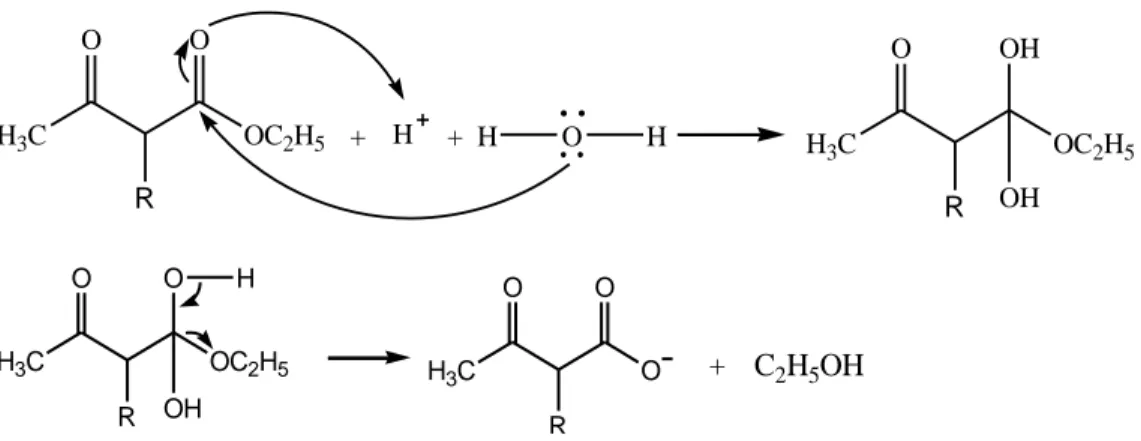
a. Tahap 1. Pembentukan ion enolat ester asetoasetat dari etil asetoasetat dengan natrium etoksida dalam etanol kering menurut Carey (2000) ditunjukkan pada Gambar 5.
Gambar 5. Reaksi pembentukan ion enolat etil asetoasetat. H3C C O C H C H O OCH2CH3+ NaOCH2CH3 H3C C OH C H C OH OCH2CH3 Na + CH3CH2OH Z + C X H H Z C + X
nukleofil substrat gugus pergi
H Z C H H H H H H X
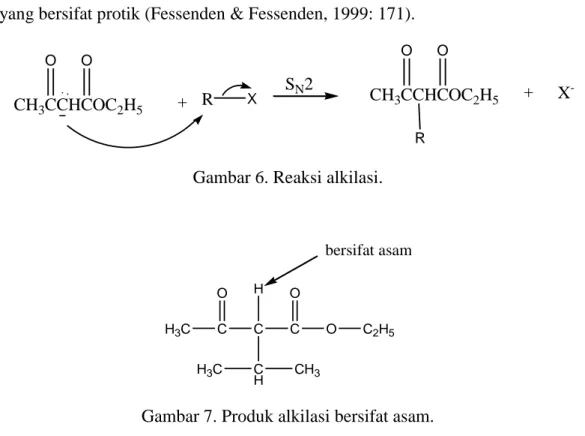
b. Tahap 2. Reaksi alkilasi (terjadi reaksi SN2). Dilihat dari Gambar 6 dan Gambar 7, menunjukkan bahwa reaksi ini akan menghasilkan suatu senyawa yang bersifat asam. Hal ini dikarenakan produk alkilasi masih mengandung satu hidrogen yang bersifat protik (Fessenden & Fessenden, 1999: 171).
Gambar 6. Reaksi alkilasi.
H3C C O C C O C2H5 O C H H bersifat asam H3C CH3
Gambar 7. Produk alkilasi bersifat asam.
5. Reaksi Hidrolisis dan Dekarboksilasi
Jika suatu ester dihidrolisis, maka ester tersebut akan menghasilkan suatu senyawa asam karboksilat dan alkohol (Fessenden & Fessenden, 1999:70). Hidrolisis ester dapat dilakukan menggunakan dua cara, yaitu hidrolisis menggunakan katalis asam dan hidrolisis menggunakan katalis basa. Reaksi hidrolisis asam bersifat reversibel. Gambar 8 berikut ini merupakan mekanisme hidrolisis menggunakan katalis asam: CH3CCHCOC2H5 + R X SN2 CH 3CCHCOC2H5 R + X -O O O O
Tahap 1. Protonasi oksigen pada karbonil ester,
Tahap 2. Adisi nukleofilik air menjadi ester yang terprotonasi.
Tahap 3. Deprotonasi ion oxonium.
Tahap 4. Protonasi oksigen,
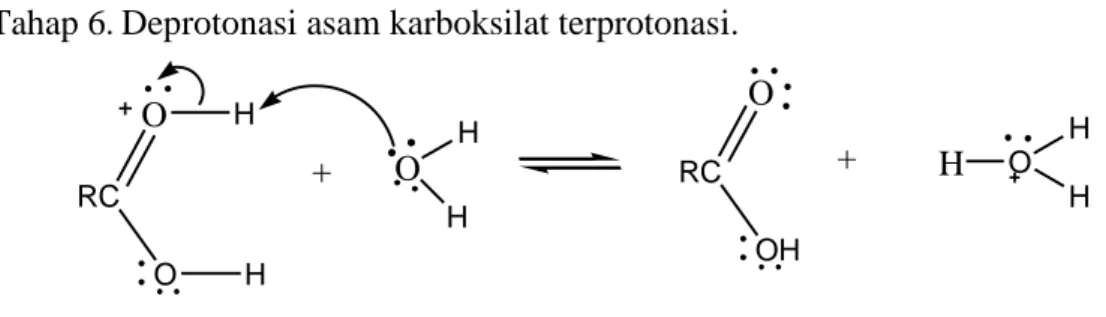
Tahap 5. Disosiasi menjadi alkohol dan asam karboksilat terprotonasi. RC OR' O H + O H H OH RC OR' O H H OH RC OR' O H H OH RC OR' OH + O H H H O H H + RC OR' O + H O H H RC OR' O H O H H + OH RC OR' OH H O H H + OH RC O OH R' H + O H H OH RC O OH R' H + O R' H OH RC OH + O H H
Tahap 6. Deprotonasi asam karboksilat terprotonasi.
Gambar 8. Mekanisme hidrolisis asam (Carey, 2000).
Hidrolisis basa disebut juga proses penyabunan atau saponifikasi. Hidrolisis basa ini bersifat irreversibel hal ini disebabkan karena asam karboksilat terkonversi menjadi anion karboksilat dan anion ini tidak dapat mentransfer asil ke alkohol (Carey, 2000:794). Hasil dari hidrolisis basa berupa garam karboksilat dan alkohol yang lebih mudah dipisahkan.
Berikut mekanisme hidrolisis katalis basa dapat dilihat dari Gambar 9: Tahap 1. Adisi nukleofilik ion hidroksida ke gugus karbonil ester,
Tahap 2. Transfer proton anion Tahap 3. Disosiasi + HO RC O OR' RC O OH OR' RC O OH OR' + H OH RC OH OH OR'
+
OH + RC O OH OR' H OH RC O OH OR' + + H O H O RC O H H + O H H O RC OH H O H H +Tahap 4. Transfer proton menghasilkan alkohol dan ion karboksilat
Gambar 9. Mekanisme hidrolisis basa.
Sintesis senyawa keton dari etil asetoasetat menggunakan reaksi hidrolisis basa, hal ini dikarenakan hidrolisis basa tidak bersifat reversible sehingga akan menghasilkan rendemen yang lebih baik dari pada hidrolisis asam. Berikut hidrolisis basa dari etil asetoasetat dapat dilihat dari Gambar 10.
H3C OC2H5 O O R H + H O H + H 3C OC2H5 O OH R OH H3C OC2H5 O O R OH H H3C O O O R + C2H5OH
Gambar 10. Mekanisme hidrolisis basa dari etil asetoasetat
Reaksi dekarboksilasi merupakan reaksi yang menyebabkan hilangnya gugus karboksil dan melepasnya karbon dioksida (CO2) dari suatu senyawa. Biasanya proses dekarboksilasi berkaitan dengan reaksi asam karboksilat yaitu ketika asam
H OH + RO H + OH RO RC O O H + RC O O + O H H OH
karboksilat kehilangan satu atom karbon dari rantai karbon dengan menggunakan pemanasan. Hampir semua asam karboksilat yang dipanasi pada suhu tinggi akan mengalami dekarboksilasi termal menghasilkan keton. Jika dilakukan pada suhu sedang, sebagian besar asam karboksilat tidak akan mengalami dekarboksilasi melainkan hanya akan mendidih atau melebur saja.
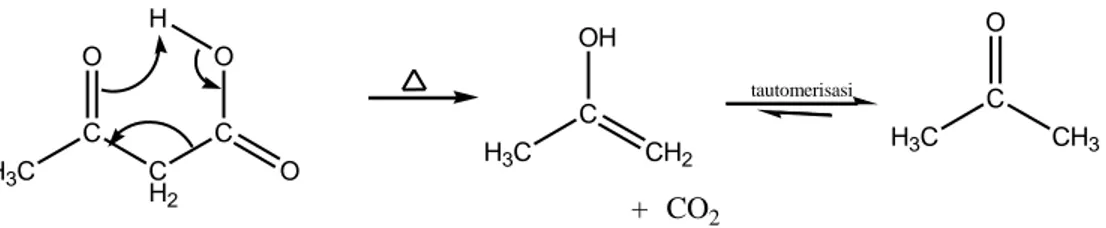
Apabila suatu senyawa memiliki suatu gugus karbonil yang berposisi beta terhadap suatu gugus karbonil lain maka senyawa tersebut akan mengalami dekarboksilasi (kehilangan CO2) bila dipanasi (Fessenden & Fessenden, 1999:168). Reaksi dekarboksilasi dapat dilihat pada Gambar 11.
Gambar 11. Reaksi dekarboksilasi senyawa yang memiliki karbonil posisi β.
Menurut Bruice yang dikutip oleh Syadza (2013), dekarboksilasi menjadi lebih mudah jika reaksinya berada pada kondisi asam. Hal ini disebabkan reaksi terkatalis oleh transfer intramolekuler proton dari gugus karbonil ke oksigen karbonil. Enol yang terbentuk mengalami tautomerisasi menjadi keton. Contoh reaksi dekarboksilasi dari senyawa asam 3-oksobutanoat dapat dilihat pada Gambar 12.
Gambar 12. Reaksi dekarboksilasi asam 3-oksobutanoat. CCH2CH2OH O O CCH3 O + CO2 kalor H3C C C H2 C O O O H H3C C OH CH2 H3C C O CH3 tautomerisasi + CO2
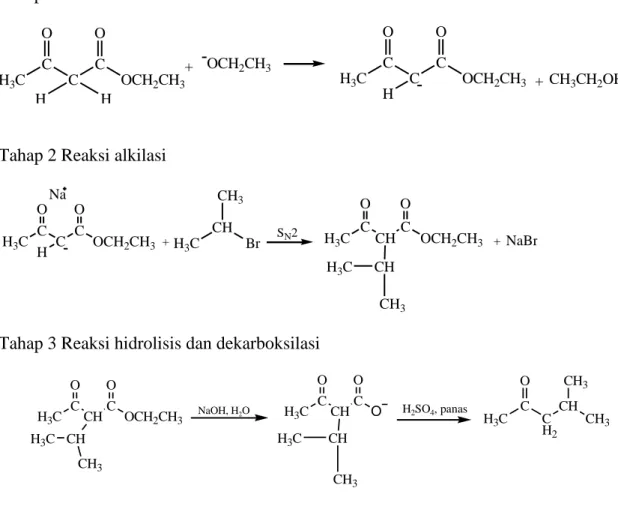
Sintesis 4-metil-2-pentanon dapat dilakukan dengan mereaksikan etil asetoasetat dan s-propil bromida menggunakan katalis natrium etoksida melalui reaksi alkilasi, hidrolisis dan dekarboksilasi. Berikut merupakan tahapan proses sintesis 4-metil-2-pentanon yang dapat dilihat pada Gambar 13.
Tahap 1 Pembentukan ion enolat
H3C C O C H C H O OCH2CH3 + OCH2CH3 H3C C O C H C O OCH2CH3 + CH3CH2OH
Tahap 2 Reaksi alkilasi
H3C C O C H C O OCH2CH3 H3C CH CH3 Br + SN2 H3C C O CHC O OCH2CH3 Na +NaBr CH H3C CH3
Tahap 3 Reaksi hidrolisis dan dekarboksilasi
H3C C O CHC O OCH2CH3 CH H3C CH3 NaOH, H2O H3C C O CHC O O CH H3C CH3 H2SO4, panas H3C C C H2 CH CH3 O CH3
Gambar 13. Reaksi sintesis 4-metil-2-pentanon dari etil asetoasetat dan s-propil bromida melalui reaksi alkilasi, hidrolisis dan dekarboksilasi.
6. Spektroskopi Inframerah (FTIR)
Spektroskopi adalah studi mengenai antaraksi antara energi cahaya dan materi. Spektroskopi inframerah adalah suatu metode yang mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada panjang gelombang inframerah. Panjang gelombang inframerah berkisar 400 nm hingga 800 nm.
Spektroskopi FTIR (Fourier Transform Infra Red) merupakan suatu metode spektroskopi inframerah modern yang dilengkapi dengan teknik transformasi Fourier untuk deteksi dan analisis hasil spektrumnya. FTIR berguna untuk mengidentifikasi zat organik dan anorganik. Selain itu, FTIR juga berguna untuk menduga jumlah beberapa komponen dari suatu campuran yang tidak diketahui.Metode ini sangat sesuai untuk analisis suatu senyawa berupa padatan, cairan dan gas (Tailor & Joshi, 2014).
Analisis FTIR dilakukan dengan melihat bentuk spektrumnya yaitu dengan melihat puncak-puncak spesifik yang menunjukkan jenis gugus fungsional yang dimiliki oleh senyawa tersebut (Kristianingrum,2009). Metode spektroskopi yang digunakan pada FTIR sama seperti metode spektroskopi IR yaitu metode spektroskopi absorbsi. Metode spektroskopi absorbsi adalah spektroskopi yang didasarkan atas perbedaan penyerapan radiasi inframerah oleh molekul suatu materi. Absorbsi inframerah oleh suatu materi dapat terjadi jika dipenuhi dua syarat, yakni kesesuaian antara frekuensi radiasi inframerah dengan frekuensi vibrasional molekul sampel dan perubahan momen dipol selama bervibrasi.
Hampir setiap senyawa memiliki ikatan kovalen, baik senyawa organik atau anorganik, akan menyerap berbagai frekuensi radiasi elektromagnetik dalam daerah spektrum inframerah (Atun, Sri. 2016: 32). Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation), dengan cara serupa dua bola yang terikat pada pegas.
Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan di dalam amplitudo getaran atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi tereksitasi (energi yang terserap akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar). Keadaan vibrasi dari ikatan terjadi dalam keadaan tetap, atau terkuantitas, tingkat-tingkat energi. Panjang gelombang dari keadaan terabsorpsi oleh suatu tipe ikatan tertentu, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu tipe ikatan yang berlainan (C-H, C-C, O-H, C=O, dll) menyerap radiasi inframerah pada gelombang karakteristik yang berlainan (Fessenden & Fessenden, 1997: 315).
Senyawa 4-metil-2 pentanon memberikan daerah serapan tertentu pada spektrum inframerah. Hal tersebut disebabkan karena adanya gugus-gugus yang terdapat pada 4-metil-2 pentanon itu sendiri . Gugus dasar yang terdapat pada 4-metil-2 pentanon diantaranya terdapat gugus C=O yang akan memberikan serapan pada daerah 1705-1725 cm-1 yang terlihat sangat tajam dan terdapat gugus C-H alkana (alifatik) yang akan memberikan serapan pada daerah 2850-3000 cm-1 yang terlihat tajam.
7. Kromatografi Gas-Spektroskopi Massa (KG-SM)
Kromatografi gas-spektroskopi Massa (Gas Chromatography Mass Spec
trometry) atau yang sering disebut dengan GC-MS merupakan penggabungan antara
alat kromatografi gas dan spektroskopi massa.
Alat kromatografi gas berfungsi untuk memisahkan komponen-komponen senyawa kimia yang dianalisis. Khopkar, S.M., (2010: 169) menyatakan bahwa dalam kromatografi gas, fasa gerak berupa gas dan zat terlarut terpisah menjadi uap. Pemisahan dapat tercapai dengan partisi sampel antara fasa gerak dan fasa diam berupa cairan dan titik didih tinggi (tidak mudah menguap) yang terikat pada zat penunjang. Kromatografi gas digunakan untuk mengetahui tingkat kemurnian dari suatu senyawa hasil sintesis (Gritter, 1991:34). Sedangkan alat spektroskopi massa merupakan teknik untuk mengukur massa dan berat molekul dari suatu molekul. Selain itu juga memberikan informasi yang menguntungkan mengenai struktur suatu molekul yang baru (McMurry, 2007:415).
Pada spektroskopi massa, molekul organik ditembak dengan berkas elektron bertenaga tinggi sehingga molekul organik tersebut berubah menjadi ion-ion bermuatan positif yang disebut sebagai ion induk. Ion induk dapat pecah menjadi ion-ion yang lebih kecil lagi menjadi ion-ion anak, proses ini sering disebut fragmentasi (Sastrohamidjojo, 2007;163). Seberkas elektron berenergi tinggi umumnya berkekuatan 70eV yang akan menghasilkan radikal kation (ion molekul atau ion induk), yang akan terurai menjadi sepasang pecahan (fragmen), menjadi ion yang lebih kecil (ion pecahan atau ion anakan) berupa radikal dan ion atau molekul yang
kecil dan radikal kation (Silverstein, et al, 2005:3). Lepasnya elektron dari molekul menghasilkan radikal kation dapat dikatakan sebagai berikut:
Setelah ion-ion terbentuk, ion tersebut akan mengalami fragmentasi dan penataan ulang. Proses ini berjalan sangat cepat (10-10 – 10-6 detik). Partikel yang berumur panjang dapat dideteksi oleh pengumpul ion, sedangkan yang berumur pendek mungkin tidak sempat mencapai pengumpul ion, sehingga tidak dapat terdeteksi dan hanya produk fragmentasinya yang menunjukkan peak (Fessenden & Fessenden, 1999:456).
B. Penelitian yang Relevan
Penelitian yang dilakukan oleh Firdaus,dkk (2013) yaitu sintesis 6-hidroksi-2-heksanon sebagai tahapan awal sintesis feremon seks hama penggerek buah kakao (Conopomorpha Cramerella) yang menggunakan bahan etil asetoasetat dan 3-bromopropanol sebagai bahan dasar melalui reaksi alkilasi, hidrolisis, dan dekarboksilasi. Dari peneltian ini, senyawa 6-hidroksi-2-pentanon diperoleh dari reaksi alkilasi antara etil asetoasetat dan 3-bromo-1-propanol dengan basa natrium etoksida pada suhu 78 oC selama 3 jam dengan perbandingan mol etil asetoasetat dan 3-bromo-1-propanol 1:1, dilanjutkan dengan reaksi hidrolisis dengan suhu dan
M M
dekarboksilasi masing-masing pada suhu 97oC selama 2 jam. Hasil sintesis diperoleh rendamen sebesar 36,09%.
Penelitian yang dilakukan oleh Syifa Fauziyah (2015) yaitu sintesis senyawa dihidropirimidinon dari etil asetoasetat dan aplikasinya sebagai antibakteri. Senyawa etil asetoasetat didapat melalui reaksi kondensasi Claisen. Hasil sintesis etilasetoasetat kemudian digunakan sebagai zat perantara dalam sintesis senyawa dihidropirimidinon (I) sebagai senyawa antibakteri yang dibandingkan dengan senyawa dihidropirimidinon (II) dari etil asetoasetat hasil industri. Dalam penelitian ini, pembentukan zat perantara etil asetoasetat belum terbentuk melainkan masih berupa senyawa awal yaitu etil asetat.
C. Kerangka Berfikir
Dalam penelitian sintesis senyawa 4-metil-2-pentanon ini menggunakan bahan dasar etil asetoasetat dan s-propil bromida dengan katalis etoksida melalui reaksi alkilasi, hidrolisis, dan dekarboksilasi. Pertama-tama pembuatan natrium etoksida, natrium etoksida dibuat dengan cara mereaksikan logam natrium dan etanol kering. Kemudian natrium etoksida ini akan bereaksi dengan senyawa etil asetoasetat membentuk ion enolat ester yang kemudian akan bereaksi dengan s-propil bromida melalui reaksi SN2 dan selanjutnya akan mengalami reaksi hidrolisis dalam suasana basa dan mengalami dekarboksilasi dengan pemanasan sehingga mengasilkan senyawa 4-metil-2-pentanon. Senyawa hasil sintesis kemudian diidentifikasi menggunakan FTIR dan GC-MS.
BAB III
METODE PENELITIAN
A. Subjek Penelitian dan Objek Penelitian 1. Subjek Penelitian
a. Subjek penelitian ini adalah sintesis senyawa 4-metil-2-pentanon dari etilasetoasetat s-propil bromida.
2. Objek Penelian
b. Objek penelitian ini adalah identifikasi senyawa 4-metil-2-pentanon yang dihasilkan dari sintesis etilasetoasetat dan s-propil bromida melalui reaksi alkilasi dan dekarboksilasi.
B. Alat dan Bahan Penelitian
1. Bahan-bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah : c. Larutan s-propil bromida
d. Larutan etil asetoasetat e. Akuades
f. Logam natrium g. Etanol kering h. H2SO4 50%
i. NaOH 7% j. Detil eter k. NaHCO3 10% l. Na2SO4 anhidrat
2. Alat-alat Penelitian
Alat yang digunakan dalam penelitian ini adalah : a. Spektrometer FTIR
b. Spektrometer GC-MS c. Timbangan analitik d. 1 set alat refluks e. Gelas ukur f. Pipet tetes
g. Pipet ukur 5 ml dan 10 ml h. Corong pisah i. Gelas beker j. Kertas saring k. Erlenmeyer l. Hot plate m. Thermometer 150oC dan 100 oC
C. Prosedur Penelitian
1. Reaksi Alkilasi Etil Asetoasetat
Sebanyak 1,4375 gram (0,0625 mol) logam Na dan 25 mL etanol kering dicampurkan dalam labu alas bulat leher tiga yang dilengkapi dengan kondensor. Campuran diaduk pada suhu kamar hingga logam Na benar-benar larut. Setelah logam Na larut, ditambahkan 8 mL (8,13 g, 0,0625 mol) etil asetoasetat, kemudian diaduk selama 10 menit pada suhu kamar. Ditambahkan 5,87 mL (7,69 g, 0,0625 mol) s-propil bromida secara perlahan sambil diaduk. Kemudian larutan direfluks selama 3 jam pada suhu 69-76oC. Setelah direfluks, hasil refluks didiamkan dan didekantasi untuk dipisahkan cairan berwarna kuning dari endapannya. Kemudian 2 x 3 mL etanol kering ditambahkan ke endapan. Selanjutnya larutan dievaporasi untuk menguapkan pelarutnya dan didapatkan cairan kental berwarna kuning. Cairan kental berwarna kuning inilah yang digunakan pada tahap selanjutnya.
2. Reaksi Hidrolisis dan Dekarboksilasi
Hasil dari tahap pertama, dimasukkan ke dalam labu alas bulat leher tiga. Ditambahkan 15 mL NaOH 7% secara perlahan dan direfluks selama 2 jam pada suhu 90-100oC. Campuran didiamkan pada suhu kamar kemudian dimasukkan kembali ke dalam labu alas bulat dan ditambahkan 3 mL H2SO4 50% secara perlahan sambil diaduk selama 1 jam. Setelah diaduk, larutan direfluks selama 2 jam pada suhu 98-105oC. Larutan didinginkan pada suhu kamar dan dimasukkan ke dalam corong pisah untuk diambil lapisan minyaknya. Lapisan minyak diekstraksi dengan 25 mL dietil
eter. Lapisan dietil eter dicuci dengan 20 mL NaHCO3 10%, kemudian dikeringkan dengan Na2SO4 anhidrat selama semalam. Lapisan dietil eter dievaporasi hingga pelarut dietil eter menguap sehingga yang tersisa hanyalah senyawa yang diduga mengandung senyawa keton. Hasil sintesis yang diperoleh selanjutnya dianalisis menggunakan FTIR dan GC-MS.
D. Teknik Analisis Data
1. Data Kuantitatif
Analisis data untuk menentukan rendemen senyawa hasil sintesis adalah :
Rendemen % =
x % kemurnian GC-MS
2. Data Kualitatif
Senyawa produk sintesis dianalisis menggunakan spektrometer inframerah (FTIR), spektrometer kromatografi massa gas (GC-MS) untuk ditentukan gugus fungsi dan struktur senyawa hasil sintesis.
a. Spektrometer inframerah digunakan untuk menentukan gugus-gugus fungsional. b. Spektrometer kromatografi massa gas digunakan untuk menganalisis komponen
senyawa yang terkandung serta mengetahui persen kelimpahan dari senyawa hasil sintesis.
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. HASIL PENELITIAN
Berdasarkan hasil penelitian yang sudah dilakukan diperoleh hasil sintesis sebagai berikut :
1. Hasil sintesis 4-metil-2-pentanon
Senyawa 4-metil-2-pentanon diperoleh melalui reaksi alkilasi, reaksi hidrolisis dan reaksi dekarboksilasi antara etil asetoasetat dengan s-propil bromida menggunakan katalis natrium etoksida. Hasil yang diperoleh tersaji dalam Tabel 1.
Tabel 1. Data pengamatan hasil sintesis senyawa 4-metil-2-pentanon.
Parameter Hasil 1 Hasil 2 Hasil 3 Hasil 4
Massa hasil sintesis 0,578 gram 0, 542 gram 0, 525 gram 0,593 gram Bentuk hasil sintesis Cairan cairan Cairan Cairan Warna hasil sintesis merah bata merah bata merah bata merah bata
Senyawa hasil sintesis tampak seperti Gambar 14:
Hasil 1 Hasil 2 Hasil 3 Gambar 14. Senyawa hasil sintesis.
2. Spektrum IR senyawa hasil sintesis 4-metil-2-pentanon
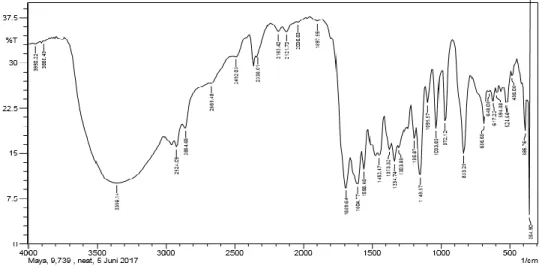
Senyawa hasil sintesis kemudian diidentifikasi menggunakan metode spektroskopi inframerah. Metode ini digunakan untuk mengetahui daerah serapan oleh gugus fungsi yang ada pada senyawa hasil sintesis. daerah serapan tersebut terlihat pada seperti berikut:
Dari 8 hasil sintesis, 4 diantaranya diidentifikasi menggunakan FTIR. Berikut hasil spektrum FTIR ke-empat hasil sintesis:
Gambar 15 menunjukkan spektrum FTIR pertama hasil sintesis:
Gambar 15. Spektrum FTIR Hasil 1
Gambar 16 menunjukkan spektrum FTIR kedua hasil sintesis:
Gambar 17 menunjukkan spektrum FTIR ketiga hasil sintesis:
Gambar 17. Spektrum FTIR Hasil 3 Gambar 18 menunjukkan spektrum FTIR ketiga hasil sintesis:
Gambar 18. Spektrum FTIR Hasil 4
Interpretasi spektrum IR di atas menunjukkan daerah serapan untuk masing-masing gugus fungsi pada senyawa hasil sintesis. Daerah serapan dapat dilihat pada Tabel 2 dan Tabel 3 berikut :
Tabel 2. Daerah serapan Hasil 1 dan Hasil 2 sintesis senyawa 4-metil-2-pentanon Hasil 1 Hasil 2 Daerah Serapan (cm-1) Gugus Fungsi Daerah Serapan (cm-1) Gugus Fungsi 3259,93 O – H alkohol 3306,85 O – H alkohol 2964,49 C-H alifatik 1602,95 C=O 1602,81 C=O 1153, 37 C-O 1153,96 C-O
Tabel 3. Daerah serapan Hasil 3 dan Hasil 4 sintesis senyawa 4-metil-2-pentanon Hasil 3 Hasil 4 Daerah Serapan (cm-1) Gugus Fungsi Daerah Serapan (cm-1) Gugus Fungsi 3356,14 O – H alkohol 3356,14 O – H alkohol 2978,09 C-H alifatik 2924,09 C-H alifatik 1604,77 C=O 1689,64 C=O 1157,29 C-O 1149,57 C-O
3. Kromatogram dan spektrum massa senyawa hasil sintesis 4-metil-2-pentanon
Berdasarkan spektrum GC-MS dapat diketahui massa serta persen kelimpahan dari suatu senyawa hasil sintesis. Dari keempat hasil sintesis yang telah diidentifikasi menggunakan FTIR, tiga diantaranya diidentifikasi menggunakan spektrometer GC-MS. Berikut Gambar kromatogram GC-MS hasil sintesis:
Gambar 19 menunjukkan spektrum GC-MS Hasil 2
Gambar 19. Spektrum GC-MS Hasil 2 Gambar 20 menunjukkan spektrum GC-MS Hasil 3
Gambar 20. Spektrum GC-MS Hasil 3
Gambar 21. Spektrum GC-MS Hasil 4 dengan temperatur injeksi 70oC Gambar 22 menunjukkan spektrum GC-MS Hasil 4 dengan temperatur injeksi 200oC.
Dari keempat hasil spektrum GC-MS, hasil 4 dengan temperatur injeksi 200oC mempunyai puncak fragmentasi yang mirip dengan fragmentasi senyawa metil-2-pentanon. Jadi diperkirakan fragmentasi tersebut merupakan fragmentasi senyawa 4-metil-2-pentanon hasil sintesis.
Gambar 23. Spektrum GC-MS senyawa hasil sintesis
B. PEMBAHASAN
1. Hasil sintesis 4-metil-2-pentanon
Senyawa 4-metil-2-pentanon atau yang sering disebut MIBK merupakan senyawa berupa cairan tidak berwarna dengan bau yang harum yang memiliki titik didih 117-118oC, densitas 0,8 g/ml pada suhu 20 oC, dan akan larut dalam air
(1.91g/100ml mL pada suhu 20 oC) serta mudah larut dalam senyawa organik (https://monographs.iarc.fr/ENG/Monographs/vol101/mono101-008.pdf).
Dalam penelitian ini, sintesis 4-metil-2-pentanon dilakukan dengan cara mereaksikan senyawa etil asetoasetat dengan s-propil bromida menggunakan katalis natrium etoksida melalui reaksi alkilasi, hidrolisis, dan dekarboksilasi. Hasil sintesis kemudian diidentifikasi menggunakan spektrometer FTIR dan GC-MS.
Penggunaan natrium etoksida berperan menarik Hα pada ester etil asetoasetat sehingga menjadi ion enolat etil asetoasetat. Katalis natrium etoksida diperoleh dari mereaksikan logam natrium dengan etanol kering. Etanol kering harus terbebas dari air karena natrium sangat reaktif terhadap air menghasilkan natrium hidroksida, oleh sebab itu kedalam etanol harus ditambahkan natrium sulfat dan didiamkan semalaman agar natrium sulfat mengikat air menghasilkan etanol kering.
Pada pembuatan katalis natrium etoksida, natrium dimasukkan kedalam labu leher tiga, dan ditambah etanol kering kemudian diaduk sampai natrium larut dan terbentuk cairan kental berwarna putih. Pengadukan ini bertujuan untuk mempercepat reaksi. Ketika natrium bereaksi dengan etanol terbentuk gas berwarna putih dan dinding labu menjadi panas. Hal tersebut dapat terjadi karena reaksi antara natrium dan etanol kering akan menghasilkan gas hidrogen dengan reaksi eksoterm seperti pada Gambar 24:
Gambar 24. Reaksi pembentukan natrium etoksida. Na + C2H5OH NaOC2H5 + H2
Setelah logam natrium benar-benar larut dan terbentuk natrium etoksida, etil asetoasetat dimasukkan dan diaduk selama 10 menit agar terbentuk ion enolat etil asetoasetat. Gambar 25 menunjukkan ion etoksida pada natrium etoksida akan menyerang salah satu Hα yang diapit oleh kedua gugus karbonil, sehingga menghasilkan ion enolat etil asetoasetat dan etanol.
Gambar 25. Reaksi pembentukan ion enolat etil asetoasetat
Pembentukan ion enolat ini ditandai dengan adanya perubahan warna larutan dari tidak berwarna menjadi kuning. Setelah warna larutan menjadi kuning, ke dalam larutan ditambahkan s-propil bromida secara perlahan lalu direfluks selama tiga jam dengan suhu sekitar 69-76oC. Hasil refluks ini berupa cairan berwarna kuning yang mengandung senyawa etil 2-isopropil-3-oksobutanoat dan endapan berwarna putih natrium bromida. Endapan dipisahkan dari cairan kuning. Kemudian ditambahkan etanol kering sebanyak 2x3 ml ke dalam endapan . Penambahan ini berguna untuk melarutkan senyawa etil 2-isopropil-3-oksobutanoat yang masih menempel pada endapan. Cairan kuning lalu dievaporasi untuk menghilangkan pelarutnya. Pada tahap ini ion enolat etil asetoasetat akan bereaksi dengan s-propil bromida melalui reaksi SN2. Dimana ion enolat etil asetoasetat akan menyerang atom karbon yang mengikat bromida sehingga ion bromida akan lepas menjadi gugus pergi dan akan bereaksi
H3C C O C H C H O OCH2CH3 + OCH2CH3 H3C CH OH C H CH OH OCH2CH3 + CH3CH2OH
dengan ion natrium membentuk natrium bromida yang berupa padatan putih dan senyawa etil 2-isopropil-3-oksobutanoat. Reaksi ini ditunjukkan pada gambar 26.
Gambar 26. Mekanisme reaksi alkilasi ion enolat etil asetoasetat dan s-propil bromida
Setelah evaporasi, cairan kuning akan berubah menjadi cairan kuning kental. Cairan kuning kental dimasukan ke dalam labu leher tiga kemudian ditambahkan NaOH 7% secara perlahan dan direfluks selama 2 jam pada suhu 90-100oC. Pada tahap ini terjadi hidrolisis basa dengan NaOH berair. Mekanisme hidrolisis basa senyawa etil 2-isopropil-3-oksobutanoat tampakpada Gambar 27:
Tahap 1. Adisi nukleofilik ion hidroksida. Dimana ion hidoksida akan menyerang gugus karbonil yang menyebabkan terbentuknya anion etil 1-hidroksi-2-isopropil-3-oksobutanoat. + OH H3C C O CHC O OCH2CH3 CH H3C CH3 H3C C O CHC O OCH2CH3 CH H3C CH3 OH H3C C O C H C O OCH2CH3 H3C CH CH3 Br + SN2 H3C C O CHC O OCH2CH3 Na + NaBr CH H3C CH3
Tahap 2. Transfer proton anion etil 1-hidroksi-2-isopropil-3-oksobutanoat. Anion etil 1-hidroksi-2-isopropil-3-oksobutanoat akan menyerang atom hidrogen dari molekul air menyebabkan lepasnya gugus hidroksi.
Tahap 3. Ion hidroksi menyerang hidrogen yang terikat pada oksigen yang menyebabkan terbentuknya senyawa asam 2-isopropil-3-oksobutanoat, ion etoksida dan air.
Tahap 4. Transfer proton. Ion etoksida akan menyerang hidrogen dari air yang akan menghasilkan etanol dan ion hidroksida. Ion hidroksida ini akan menyerang hidrogen asam pada asam 2-isopropil-3-oksobutanoat menghasilkan anion 2-isopropil-3-oksobutanoat (ion karboksilat) dan air.
Gambar 27. Mekanisme reaksi hidrolisis dari senyawa etil 2-isopropil-3-oksobutanoat. + H O H OH + H3C C O CH C O CH H3C CH3 OH OCH2CH3 H3C C O CH C O CH H3C CH3 OH H OCH2CH3 + H OH + H3C C O CHC O OCH2CH3 CH H3C CH3 OH + H3C C O CHC OH OCH2CH3 CH H3C CH3 OH OH OCH2CH3 + H3C C O CHC O CH H3C CH3 O H + H OH HOCH2CH3 + OH OH + H2O ion karboksilat H3C C CH C CH O O O H3C CH3
Pada tahap ini, anion 2-isopropil-3-oksobutanoat dapat langsung mengalami reaksi dekarboksilasi menjadi 4-metil-2-pentanon seperti pada Gambar 28:
H3C C CH C O CH H3C CH3 O O H3C C C H CH O CH3 CH3 H OH H3C C C H2 CH O CH3 CH3 -CO2 -NaOH
Gambar 28. Reaksi pembentukan Na2CO3
Hasil hidrolisis berupa cairan berwarna coklat kehitaman, hasil ini kemudian dimasukkan ke dalam labu leher tiga dan ditambahkan H2SO4 50% secara perlahan sambil diaduk selama 1 jam. Penambahan H2SO4 50% ini berfungsi untuk memprotonasi ion karboksilat yang tersisa sehingga menjadi asam karboksilat. Reaksi protonasi etil 2-isopropil-3-oksobutanoat dapat dilihat pada Gambar 29.
Gambar 29. Mekanisme reaksi protonasi dari ion etil 2-isopropil-3-oksobutanoat Pada penambahan asam terbentuk gelembung-gelembung gas. Gelembung gas ini merupakan pelepasan gas CO2 dari Na2CO3. Setelah gelembung gas sudah tidak ada lagi larutan direfluks pada suhu 140-150oC agar terjadi proses dekarboksilasi. Pada
CO2 + 2NaOH Na2CO3 + H2O H3C C O CHC O O CH H3C CH3 + H H3C C O CHC O OH CH H3C CH3
penelitian ini suhu dekarboksilasi dapat terjadi pada suhu 98-105oC. Proses dekarboksilasi ditunjukkan pada Gambar 30.
Gambar 30. Mekanisme dekarboksilasi dari senyawa 2-isopropil-3-oksobutanoat.
Hasil dari tahap dekarboksilasi membentuk 2 lapisan yaitu lapisan minyak dan air. Lapisan air berwarna kuning sedangkan lapisan minyak berwarna coklat. Hasil kemudian dimasukkan ke dalam corong pisah dan didiamkan selama 2. Pendiaman dilakukan agar lapisan air dan minyak benar-benar terpisah. Setelah hasil
H3C C O CH C O O CH H3C CH3 H H3C C C H CH CH3 OH CH3 + CO2 H3C C C H CH CH3 OH CH3 H3C C C H2 CH CH3 O CH3 tautomerisasi + H+ Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O H3C C O CHC O OH CH H3C CH3 kalor H3C C C H2 CH CH3 O CH3 + CO2 + H
dekarboksilasi didiamkan selama 2 hari, lapisan air berubah menjadi tak berwarna sedangkan lapisan minyak berwarna kuning dan coklat. Lapisan minyak diambil kemudian dilarutkan dengan dietil eter dan dihomogenkan. Larutan dicuci dengan 2x15 ml NaHCO3 untuk menetralkan asam yang terikut dalam dietil eter. Larutan selanjutnya dikeringkan menggunakan Na2SO4 anhidrat dan didiamkan selama semalam kemudian pelarut dietil eter dihilangkan sehingga menghasilkan cairan kental berwarna merah bata bening.
Pada penelitian ini dilakukan pengulangan sebanyak 8 kali, dari 8 hasil sintesis menunjukkan ciri fisik yang sama yaitu menghasilkan cairan kental berwarna merah bata. Hasil sintesis tidak sesuai dengan teori, menurut teori senyawa 4-metil-2-pentanon merupakan senyawa yang tak berwarna dan memiliki bau yang harum. Dari kedelapan hasil sintesis, empat diantaranya diidentifikasi menggunakan FTIR dan GC-MS. Dari keempat hasil identifikasi didapat senyawa hasil 4 diperkirakan mengandung senyawa 4-metil-2-pentanon.
2. Spektrum FTIR senyawa hasil sintesis 4-metil-2-pentanon
Spektroskopi FTIR (Fourier Transform Infra Red) merupakan suatu metode spektroskopi inframerah modern yang dilengkapi dengan teknik transformasi Fourier untuk deteksi dan analisis hasil spektrumnya. Spektrum ini berupa puncak-puncak hasil serapan yang menunjukkan gugus fungsi yang terdapat pada senyawa hasil sintesis.
Spektrum FTIR dari keempat hasil sintesis menunjukkan adanya persamaan. Hampir semua spektra menunjukkan adanya serapan melebar gugus O-H alkohol, C=O (serapan tajam dan kuat), C-O (serapan tajam pada daerah sidik jari), dan C-H alifatik.
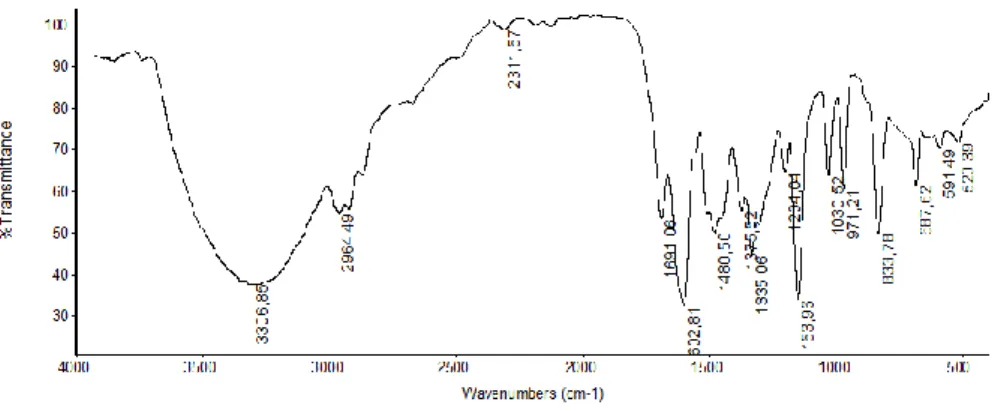
Dari spektrum FTIR Hasil 4 menunjukkan adanya serapan yang melebar pada daerah 3356, 14 cm-1 yang menunjukkan adanya gugus O-H alkohol. Serapan yang melebar ini disebabkan oleh adanya ikatan hidrogen intermolekular dari gugus alkohol (Atun, 2016: 46). Serapan pada daerah 2924,09 cm-1 menunjukkan adanya gugus C-H alifatik. Serapan tajam dan kuat pada daerah 1689,64 cm-1 menunjukkan adanya gugus karbonil (C=O). Serta adanya serapan tajam pada daerah sidik jari yaitu pada daerah 1149,57 cm-1 yang menunjukkan adanya ikatan tunggal C-O.
Spektrum FTIR ini tidak sesuai dengan teori, seharusnya 4-metil-2-pentanon mempunyai spektrum FTIR yang menunjukkan adanya gugus C-H alifatik pada daerah serapan 3000-2850 cm-1 dan serapan tajam kuat pada daerah 1705-1725 cm-1 (Atun, 2016:60).
3. Spektrum GC-MS senyawa hasil sintesis 4-metil-2-pentanon
Spektroskopi GC-MS (Gas Chromatpgraphy-Mass Spectrometri) merupakan metode penggabungan antara kromatografi gas dan spektroskopi massa. Teknik analisis spektroskopi GC-MS didasari oleh pemisahan berkas ion-ion yang sesuai dengan perbandingan massa dengan muatan dan pengukuran intensitas dari berkas
ion-ion tersebut. Spektroskopi GC-MS digunakan untuk menentukan molekul relatif dan persen kelimpahan dari senyawa hasil sintesis.
Berdasarkan kromatogram GC-MS dengan suhu injeksi 200oC, senyawa Hasil 4 menghasilkan beberapa puncak. Dari puncak tersebut diperkirakan terdapat puncak yang fragmentasinya menyerupai senyawa 4-metil-2-pentanon yaitu pada waktu retensi 24,220 menit dengan kelimpahan 0,09 %.
Fragmentasi spektrum GC-MS pada waktu retensi 24,220 menit diperkirakan sesuai dengan struktur pentanon. Ion molekuler senyawa 4-metil-2-pentanon menghasilkan puncak kecil pada m/z 100. m/z merupakan ion molekuler/radikal kation dari molekul organik yang ditembaki elektron berkekuatan tinggi umumnya e70, sehingga elektron terlepas dari molekul dan menghasilkan radikal kation (ion molekuler atau ion induk). Spektrum GC-MS menunjukkan puncak m/z 99 yang berarti telah hilangnya satu atom radikal hidrogen, diikuti dengan pelepasan gugus metilen (CH2) yang menghasilkan puncak m/z 85. Puncak paling tinggi terdapat pada m/z 57 menunjukkan telah terlepasnya gugus etena (2HC=CH2), puncak ini merupakan base peak. Terdapat puncak m/z 43 yang berasal dari pelepasan gugus metilen (CH2). Adanya pelepasan gugus metilen pada m/z 43 merupakan fragmentasi terakhir dari senyawa 4-metil-2-pentanon. Berikut fragmentasi senyawa 4-metil-2-pentanon dapat dilihat pada Gambar 31:
H3C C C H2 CH CH3 O CH3 e -70 eV H3C C C H2 CH CH O CH3 Mr = 100 m/z = 100
H3C C C H2 CH C O CH3 H3C C C H2 CH CH2 O CH3 + H H m/z = 100 m/z = 99 H3C C C H2 CH CH2 O CH3 m/z = 99 H3C C C H2 CH O CH3 m/z = 85 + CH2
Gambar 31. Fragmentasi senyawa 4-metil-2-pentanon
Berdasarkan hasil sintesis diketahui bahwa ciri fisik dan hasil spektra FTIR tidak sesuai dengan teori. Hal tersebut diperkirakan masih adanya pengotor dalam hasil sintesis sehingga senyawa hasil sintesis berupa senyawa campuran bukan senyawa murni yang mengakibatkan terjadinya perubahan warna dan pergeseran daerah serapan.
Spektrum FTIR terdapat gugus O-H alkohol yang diperkirakan dari etanol hasil reaksi hidrolisis. Selain gugus O-H, terdapat juga gugus C-O yang diperkirakan berasal dari ikatan antara karbon dengan oksigen dari alkohol (etanol). Berdasarkan
H2C CH2 H3C C CH2 O H3C C O + CH2 m/z= 57 m/z = 43 + m/z = 85 H3C C C H2 CH O CH3 H3C C CH2 O m/z= 57
hasil spektrum GC-MS, masih terdapat banyak puncak yang membuktikan bahwa senyawa hasil sintesis merupakan senyawa campuran bukan senyawa murni. Selain itu, terdapat puncak paling tinggi dengan % area yang besar, hal tersebut menunjukkan terdapat senyawa lain yang mendominasi hasil sintesis dimana senyawanya belum diketahui. Rendemen senyawa 4-metil-2-pentanon yang diperoleh dari hasil sintesis sebesar 0,0078%. Rendahnya rendemen senyawa yang diinginkan kemungkinan disebabkan oleh beberapa faktor yaitu :
1. Katalis natrium etoksida yang digunakan tidak terbentuk sempurna dan diperkiranan sebagian membentuk natrium hidroksida atau natrium oksida. Hal ini dikarenakan logam natrium sangat reaktif terhadap udara dan air sehingga dengan mudah membentuk natrium oksida atau natrium hidroksida. Selain itu natrium etoksida dalam kelembaban tinggi mudah bereaksi membentuk natrium hidroksida dan alkohol (Candran, 2007).
2. Tidak terdekarboksilasinya senyawa hasil sintesis secara sempurna. Hal ini disebabkan oleh kurang tingginya suhu yang digunakan pada proses dekarboksilasi. Menurut teori, suhu dekarboksilasi mencapai 140-150oC akan tetapi pada penelitian ini proses dekarboksilasi hanya dapat dilakukan pada suhu 98-105 oC.
BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
Berdasarkan analisis yang telah dilakukan maka dapat ditarik beberapa kesimpulan sebagai berikut :
1. Sintesis senyawa 4-metil-2-pentanon dari etil asetoasetat dan s-propil bromida dengan katalis etoksida melalui reaksi alkilasi dan dekarboksilasi dalam penelitian diperkirakan telah terbentuk.
2. Berdasarkan analisa menggunakan spektrometer FTIR dan GC-MS diperkirakan terdapat senyawa 4-metil-2-pentanon.
3. Rendemen senyawa 4-metil-2-pentanon hasil sintesis sebesar 0,0078%.
B. Saran
Saran yang dapat diberikan penulis untuk penelitian selanjutnya adalah:
1. Perlu diperhatikan tentang pemilihan dan pembuatan katalis secara langsung mengingat pentingnya katalis dalam reaksi ini.
2. Penggunaan siliki gel pada bagian atas kondensor pada proses alkilasi hal ini dimaksutnya agak natrium atau natrium etoksida tidak bereaksi dengan uap air. 3. Penggunaan pelarut lainnya yang berbeda untuk melarutkan senyawa hasil
dekarboksilasi.
4. Perlu dilakukan proses pemurnian senyawa hasil sintesis agar didapat senyawa yang murni.
DAFTAR PUSTAKA
Anonim. (2005). Material Safety Data Sheet Ethyl acetoacetate MSDS. https://www.sciencelab.com/msds.php?msdsId=9927531. Diunduh pada tanggal 15 Juli 2017 pukul 19.43.
Anonim.(__). Metil Isobutyl Ketone. https://monographs.iarc.fr /ENG/ Monographs /vol101/mono101-008.pdf. Diunduh pada tanggal 15 Juli 2017 pukul 20.11. Atun, Sri. (2016). Elusidasi Struktur Molekul Senyawa Organik. Yogyakarta: UNY
Press.
Candra, K., Nithya, R., Sankaran, K., Gopalan, A., Ganesan,V. (2006). Synthesis and characterization of sodium alkoxide. Bull Mater Sci, vol. 29 (173-179).
Carey, A. Francis. (2000). Fourth Edition Organic Chemistry. New York : The McGraw-Hill Companies, Inc.
Fauziyah, Syifa. (2015). Sintesis Senyawa Dihidropirimidinon dari Etil Asetoasetat dan Aplikasinya Sebagai Antibakteri . Skripsi. Semarang: FMIPA UNNES. Fessenden, Ralph J. & Fessenden, Joan S. (1999). Kimia Organik edisi ke 3 Jilid 2.
(Terjemahan A. H. Pudjaatmaka). Jakarta: Erlangga.
Firdaus, Raya, Indah., Karim, Abd., Firdausiah Syadza/ (2013). Sintesis 6-hidroksi-2-heksanon sebagai Tahapan Awal Sintesis Feromon Seks Hama Penggerek Buah Kakao(Conopomorpha Cramerella). Manasir, 1, (66-74).
Firdausiah, Syadza. (2013). Sintesis 6-hidroksi-2-heksanon sebagai Tahapan Awal Sintesis Feromon Seks Hama Penggerek Buah Kakao(Conopomorpha Cramerella). Skripsi. Makasar: FMIPA UNHAS.
Gritter, T. A., Bobbit, J. M., & Schwarting, A. E. (1991). Pengantar Kromatografi
Edisi kedua. (Terjemahan Kosasih Padmawinata). Bandung: Penerbit ITB.
Hart, Harold., Craine, L.E., & Hart, D.J., (2003). Kimia Organik Suatu Kuliah
Singkat. Edisi Kesebelas.(Alih Bahasa: Suminar Setriati Achmadi, Phd.).
Jakarta : Penerbit Erlangga.
Kondaiah, C.M., Reddy, L.A., Babu, K.S., et al. (2007). Boric acid: an efficient and environmentally benign catalyst for transesterification of ethyl acetoacetate.
Tetrahedron Letter, 49, (106-109).
Kristianingrum, Susila. (2009). Handout Spektroskopi Infra Merah.
http://staff.uny.ac.id/sites/default/files/pendidikan/Susila%20Kristianingrum,%20 Dra.,%20M.Si./Handout-INSTRUMEN-IR-Susi.pdf. Diakses pada tanggal 25 Juli 2017 pukul 13.18.
Matsjeh, Sabirin., Soelistyawati,Retno D., & Purwoto, Bambang. (1993). Kimia
Organik Dasar 1. Yogyakarta: Laboratorium Kimia Organik Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Gajah Mada.
McMurry, John. (2007). Organic Chemistry:A Biological Approach. USA: Thomson Brooks/Cole.
Pine, Stanley H., Hendrickson, James B., et al. (1988). Kimia Organik 1. Bandung: ITB Bandung.
Silverstein, R.M., Webster.F.X., & Kiemle.D. J. (2005). Spectrometric Identification
of Organic Compounds. Seventh edition. New York: John Wiley and Sons, Inc.
Sastrohamidjojo, Hardjono. (2007). Spektroskopi. Edisi Ketiga. Yogyakarta: Liberty/ Tailor, Mansi & Joshi, Vimal. (2014). Crystallization, FT-IR and powder XRD study
of gel grown iron-manganese-nickel ternary dextro-tartrate crystals in hydro silica gel. Advance in Applied Science Research, 5, (115-116).
Trademark of The Dow Chemical Company. 2002. http://www.dow.com/ assets/ attachments/business/pcm/solvents/methyl_isobutyl_ketone/tds/methyl_isobuty l_ketone.pdf: diakses pada tanggal 28 Oktober 2016).
Lampiran 1. Perhitungan Jumlah Bahan dan Rendemen
Mula2 : 0,0625 mmol 0,0625 mmol 0,0625 mmol - Reaksi : 0,0625 mmol 0,0625 mmol 0,0625 mmol 0,0625 mmol
Sisa : - - - 0,0625 mmol
1. Etil asetoasetat
Massa etil asetoasetat = Mr x mol = 130 g/mol x 0,0625 = 8,125 gram
Volume etil asetoasetat = massa : densitas = 8,125 g : 1,03 g mL-1 = 7,9 mL
2. s-propil bromida
Massa s-propil bromida = Mr x mol
= 123 g/mol x 0,0625 mol = 7.6875 gram
Volume s-propil bromida = massa : densitas = 7,6875 g : 1,31 g mL-1 = 5,868 mL 3. Na Massa Na = Mr x mol = 23 g/mol x 0,0625 mol = 1,4375 gram H3C C O C H C H O OCH2CH3 + H3C CH CH3 Br + OC2H5 H3C C C H2 CH CH3 O CH3
4. Massa hasil sintesis
Massa hasil sintesis = Mr x mol
= 100 g/mol x 0,0625 mol = 6,25 gram
5. Rendemen hasil sintesis
Rendemen % =
x % kemurnian GC-MS
Rendemen % =
Lampiran 2. Prosedur Kerja
A. Reaksi Alkilasi dari Sintesis Senyawa 4-metil-2-pentanon Na 1,4375g Etanol 25 mL Labu leher tiga Etil asetoasetat 7,97 mL Hasil Endapan diaduk s-propil bromide 5,87 mL direfluks Larutan Etanol 2x3 mL Larutan Endapan Hasil dievaporasi dicuci
B. Reaksi Hidrolisis dan Dekarboksilasi dari Sintesis Senyawa 4-metil-2-pentanon NaOH 7% 15 mL Hasil Tahap 1 Larutan Labu Leher Tiga Larutan direfluks H2SO4 50% 3 mL diaduk direfluks Lapisan minyak
Lapisan air Dietil
eter 25 mL Lapisan dietil eter NaHCO3 10% dicuci Lapisan dietil eter Na2SO4 anhidrat Hasil Data diidentifikasi FTIR dan GC-MS
Lampiran 3. Dokumentasi Penelitian No Gambar Keterangan 1 Hasil Alkilasi 2 Hasil Hidrolisis 3 Penambahan H2SO4
4
Hasil Dekarboksilasi
5
Lapisan minyak dan air
6
Hasil dekarboksilasi didiamkan 2 hari
7
Lapisan minyak hasil dekarboksilasi
minyak dilarutkan dalam dietil eter
Lapisan dietil eter ditambah NaHCO3
Penambahan Na2SO4 anhidrat