INTISARI
Senyawa analog kurkumin dengan gugus α,β-unsaturated keton diketahui memiliki aktivitas sebagai inhibitor protein NF-κB yang bertanggung jawab atas perkembangan sel kanker di dalam tubuh. Pada penelitian ini direaksikan 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin untuk mendapatkan senyawa analog kurkumin yang memiliki gugus α,β-unsaturated
keton.
Penelitian ini merupakan penelitian non eksperimental deskriptif. Sintesis dilakukan dengan mereaksikan 4,439 mmol 2-kloro-benzaldehida dan 4,439 mmol etil 3-oksobutanoat dengan katalis dimetilamin berdasarkan reaksi kondensasi Knoevenagel. Senyawa hasil sintesis dianalisis dengan uji kualitatif yaitu organoleptis dan kromatografi lapis tipis dengan fase diam silika gel F254 dan fase
gerak toluena, serta dilakukan elusidasi struktur menggunakan kromatografi gas -spektroskopi massa dan -spektroskopi inframerah. Uji kuantitatif dilakukan dengan perhitungan rendemen senyawa hasil sintesis.
Senyawa hasil sintesis berbentuk cair berwarna kuning, berbau khas dan nilai rata-rata crude product sebesar 52,79 %. Kromatogram lapis tipis menunjukkan bahwa senyawa baru yang terbentuk memiliki nilai Rf sebesar 0,61 dan 0,72. Kromatografi gas menunjukkan senyawa yang dihasilkan merupakan senyawa campuran dan terdapat senyawa dengan komposisi terbanyak pada waktu retensi 16,110 menit. Hasil elusidasi struktur menggunakan spektroskopi massa dan spektroskopi inframerah menunjukkan senyawa hasil sintesis pada waktu retensi 16,110 menit adalah etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat. Kata kunci: 4-(2-Klorofenil)but-3-en-2-on, Kondensasi Knoevenagel,
ABSTRACT
Analog compounds of curcumin with α,ß-unsaturated ketone group were known to have an activity as inhibitor of NF-κB protein that responsible for the growth of cancer cells in the body. In this research, 2-chloro-benzaldehyde and ethyl 3-oxobutanoic were reacted with dimethylamine catalyst to produce analog compound of curcumin that has α,ß-unsaturated ketone group.
This study was non-experimental descriptive. The synthesis was done by reacting 4.439 mmol of 2-chloro-benzaldehyde and 4.439 mmol of ethyl 3-oxobutanoic with dimethylamine as catalyst by Knoevenagel condensation reaction. The synthesized compound was analyzed by qualitative tests such as organoleptic and thin-layer chromatography using silica gel F254 as stationary
phase and toluene as the mobile phase, and the elucidation of the structure was performed using gas chromatography-mass spectroscopy and infrared spectroscopy. Quantitative test was performed by calculating the yield of the synthesized compound.
The synthesized compound had the form of yellow liquid, characteristic odor and an average crude product of 52.79 %. Thin-layer chromatogram showed there were new compounds formed with Rf values of 0.61 and 0.72. Gas
chromatography showed the synthesized compound was a mixture of compounds and there was a compound with the highest composition at a retention time of 16.110 minutes. The results of structure elucidation using mass spectroscopy and infrared spectroscopy showed the compound synthesized at the retention time of 16.110 minutes was ethyl-2 -[(2-chlorophenyl)metilidene]-3-oxobutanoat.
REAKSI ANTARA 2-KLORO-BENZALDEHIDA DAN ETIL 3-OKSOBUTANOAT DENGAN KATALIS DIMETILAMIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh : Angky Glori NIM : 118114005
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Proverbs 1:7
The fear of the LORD is the beginning of knowledge:
but fools despise wisdom and instruction.
Romans 11:36
For of him, and through him, and to him,
are
all things: to whom
be
glory for ever. Amen.
Note :
Karya ini saya persembahkan untuk Tuhan, orang tua & kakak
vii
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas segala berkat dan penyertaan-Nya sehingga penulis dapat menyelesaikan skripsi berjudul “Reaksi antara 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Keberhasilan penulis dari awal penelitian hingga pada penulisan naskah, tidak terlepas dari dukungan dan bantuan oleh berbagai pihak. Oleh sebab itu, penulis ingin mengucapkan terimakasih sebesar-sebesarnya kepada :
1. Tuhan Yang Maha Esa atas berkat dan penyertaannya sehingga penulis dapat menyelesaikan skripsi ini.
2. Ibu Aris Widayati, M.Si., Ph.D., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
3. Bapak Jeffry Julianus, M.Si., selaku dosen pembimbing yang selalu memberikan bimbingan, dukungan, koreksi dan saran dalam menyelesaikan penelitian ini.
4. Bapak Enade Perdana Istyastono, Ph.D., Apt., selaku dosen penguji yang telah memberikan masukan dan saran kepada penulis.
5. Bapak F. Dika Octa Riswanto, M.Sc., selaku dosen penguji yang telah memberikan masukan dan saran kepada penulis.
6. Papa dan mama yang tiada henti terus berdoa, atas dukungan dan semangat yang tiada henti.
viii
8. Kepada teman-teman seperjuangan di laboratorium kimia organik dan laboratorium kimia analisis.
9. Teman-teman kost yang selalu mendukung dalam semangat.
10. Pendeta dan Teman-teman Gereja Mimbar Reformed Injili Yogyakarta. 11. Kepada laboran-laboran yang berkenan membantu selama penelitian di
laboratorium.
12. Semua pihak yang telah membantu penulis dari awal hingga penyelesaian skripsi ini yang tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa penelitian ini masih jauh dari kata sempurna. Penulis mengharapkan kritik dan saran yang membangun. Akhir kata semoga penelitian yang penulis lakukan dapat berguna bagi semua pihak, terutama bagi perkembangan ilmu pengetahuan di bidang kefarmasian.
ix
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vi
x
F. Kondensasi Knoevenagel ... 14
G.Kromatografi ... 18
H.Elusidasi ... 19
1. Spektrofotometri inframerah (IR) ... 19
2. Spektrofotometri massa ... 21
I. Landasan Teori ... 23
J. Parameter Empiris ... 24
BAB III. METODE PENELITIAN... 25
A.Jenis dan Rancangan Penelitian ... 25
xi
3. Pembuatan Natrium Bikarbonat 10% ... 27
4. Sintesis Senyawa 4-(2-klorofenil)but-3-en-2-on ... 27
5. Analisis Hasil Sintesis ... 28
a. Pemeriksaan organoleptis ... 28
b. Uji kromatografi lapis tipis (KLT) ... 28
6. Elusidasi Struktur Senyawa Hasil Sintesis ... 29
a. Spektrofotometri inframerah ... 29
b. Gas kromatografi -spektrometri massa ... 29
G.Analisis Hasil ... 30
1. Perhitungan rendemen ... 30
2. Analisis hasil organoleptis ... 30
3. Analisis uji kemurnian ... 30
4. Elusidasi struktur ... 30
BAB IV. PEMBAHASAN ... 31
A.Sintesis 4-(2-klorofenil)but-3-en-2-on ... 31
B.Analisis Pendahuluan ... 39
1. Pemeriksaan organoleptis ... 39
2. Pemeriksaan kemurnian dengan kromatografi lapis tipis ... 40
C.Elusidasi Struktur Senyawa Hasil Sintesis ... 42
1. Pengujian dengan spektrofotometri inframerah (IR) ... 43
2. Pengujian dengan spektrofotometri massa ... 49
BAB V. KESIMPULAN DAN SARAN ... 57
xii
B.Saran ... 57
DAFTAR PUSTAKA ... 58
LAMPIRAN ... 62
xiii
DAFTAR TABEL
Tabel I. Karakteristik senyawa antara dan senyawa target dalam reaksi sintesis 4-(2-klorofenil)but-3-en-2-on ... 18 Tabel II. Pengaruh waktu terhadap jumlah % area hasil sintesis ... 37 Tabel III. Perbandingan sifat fisik senyawa hasil sintesis dan starting
material... 39 Tabel IV. Nilai Rf senyawa hasil sintesis dan starting material ... 42 Tabel V. Interpretasi spektra inframerah senyawa hasil sintesis ... 45 Tabel VI. Interpretasi spektra inframerah senyawa starting material
xiv
DAFTAR GAMBAR
Gambar 1. Gugus metilen aktif pada kurkumin ... 3
Gambar 2. Gugus-gugus aktif pada kurkumin ... 4
Gambar 3. Mekanisme reaksi suatu α,β-unsaturated keton dari kurkumin yang merupakan sebuah akseptor reaksi Michael berikatan kovalen dengan residu sistein dalam aktivitas sebagai anti kanker………... 5
Gambar 4. Resonansi suatu α,β-unsaturated keton dari senyawa 3-buten-2-on………... 10
Gambar 5. Struktur senyawa 2-kloro-benzaldehida ... 11
Gambar 6. Struktur senyawa etil 3-oksobutanoat ... 13
Gambar 7. Struktur senyawa dimetilamin ... 14
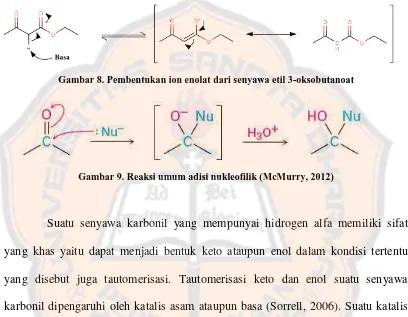
Gambar 8. Pembentukan ion enolat dari senyawa etil 3-oksobutanoat ... 15
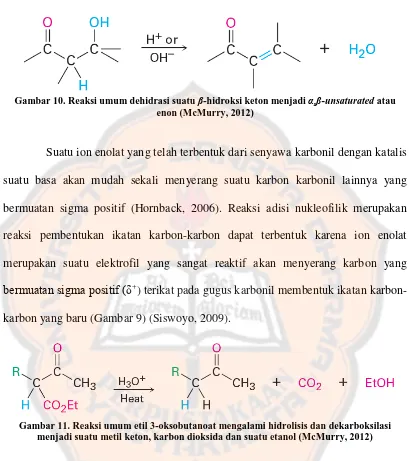
Gambar 9. Reaksi umum adisi nukleofilik ... 15
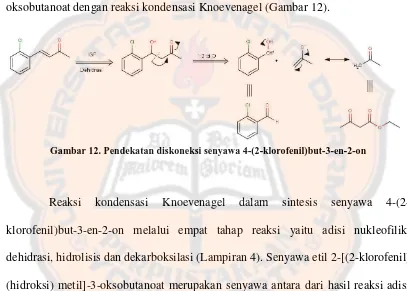
Gambar 10. Reaksi umum dehidrasi suatu β-hidroksi keton menjadi α,β -unsaturated atau enon………... 16
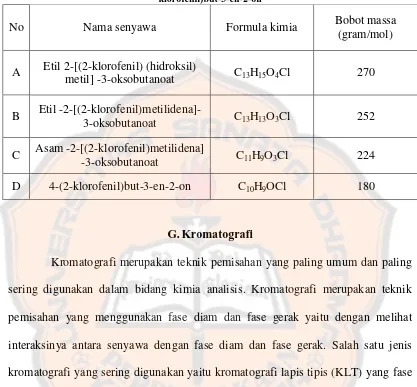
Gambar 11. Reaksi umum etil 3-oksobutanoat mengalami hidrolisis dan dekarboksilasi menjadi suatu metil keton, karbon dioksida dan suatu etanol……… 16
xv
Gambar 14. Reaksi umum sintesis senyawa 4-(2-klorofenil)but-3-en-2-on 23 Gambar 15. Etil 3-oksobutanoat memiliki lima hidrogen alfa dan dua
gugus karbonil ... 31
Gambar 16. Macam-macam bentuk molekul etil 3-oksobutanoat pada pH 0 – 5,6 (1) dan pH 5,8 – 14 (2) ... 33
Gambar 17. Macam-macam bentuk molekul asam 3-oksobutanoat pada pH 0-8,2 (1) , pH 0-14 (2), dan pH 11-14 (3) ... 33
Gambar 18. Gugus hidroksil pada asam 3-oksobutanoat mudah diserang oleh suatu basa ... 34
Gambar 19. Hasil analisis kromatografi lapis tipis dibawah sinar UV 254 nm menggunakan fase diam silika gel F254 dan fase gerak toluena dengan jarak elusi 9 cm ... 41
Gambar 20. Spektra inframerah senyawa hasil sintesis (Plat NaCl) ... 43
Gambar 21. Spektra inframerah senyawa 2-kloro-benzaldehida ... 46
Gambar 22. Spektra inframerah senyawa etil 3-oksobutanoat ... 47
Gambar 23. Kromatogram spektrometri massa senyawa hasil sintesis 12 jam ... 49
Gambar 24. Spektra massa EI senyawa hasil sintesis pada waktu retensi 16,110 menit ... 50
Gambar 25. Usulan mekanisme fragmentasi ion molekul senyawa hasil sintesis jalur pertama ... 51
xvi
Gambar 27. Usulan mekanisme fragmentasi ion molekul senyawa hasil
sintesis jalur ketiga ... 52
Gambar 28. Mekanisme reaksi sintesis etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat ... 55
Gambar 29. Pengadukan starting material dengan katalis selama 12 jam .. 79
Gambar 30. Penambahan aquadest dan pH 1-2 ... 79
Gambar 31. Hasil reaksi dekarboksilasi dan pH netral ... 79
Gambar 32. Hasil pemisahan cairan kuning dengan aquadest ... 79
xvii
DAFTAR LAMPIRAN
Lampiran 1. Data perhitungan massa senyawa hasil sintesis secara teoretis 62
Lampiran 2. Data perhitungan rendemen dari hasil replikasi ... 63
Lampiran 3. Perhitungan dalam sintesis senyawa 4-(2-klorofenil)but-3-en-2-on ... 64
Lampiran 4. Mekanisme reaksi sintesis senyawa 4-2-(klorofenil)but-3-en-2-on ... 66
Lampiran 5. Spektra inframerah senyawa hasil sintesis ... 68
Lampiran 6. Spektra inframerah senyawa 2-kloro-benzaldehida ... 69
Lampiran 7. Spektra inframerah senyawa etil 3-oksobutanoat ... 70
Lampiran 8. Kromatogram GC senyawa hasil sintesis pada pengadukan 0,5 jam ... 71
Lampiran 9. Kromatogram GC senyawa hasil sintesis pada pengadukan 12 jam ... 72
Lampiran 10. Kromatogram GC senyawa hasil sintesis pada pengadukan 24 jam ... 73
Lampiran 11. Spektra massa senyawa hasil sintesis pada waktu retensi 10,807 menit pengadukan 0,5 jam ... 74
Lampiran 12. Spektra massa senyawa hasil sintesis pada waktu retensi 17,145 menit pengadukan 0,5 jam ... 74
xviii
Lampiran 14. Spektra massa senyawa hasil sintesis pada waktu retensi 7,229 menit pengadukan 12 jam ... 75 Lampiran 15. Spektra massa senyawa hasil sintesis pada waktu retensi
16,110 menit pengadukan 12 jam ... 75 Lampiran 16. Spektra massa senyawa hasil sintesis pada waktu retensi
16,357 menit pengadukan 12 jam ... 75 Lampiran 17. Spektra massa senyawa hasil sintesis pada waktu retensi
16,445 menit pengadukan 12 jam ... 76 Lampiran 18. Spektra massa senyawa hasil sintesis pada waktu retensi
18,273 menit pengadukan 12 jam ... 76 Lampiran 19. Spektra massa senyawa hasil sintesis pada waktu retensi
18,599 menit pengadukan 12 jam ... 76 Lampiran 20. Spektra massa senyawa hasil sintesis pada waktu retensi
20,010 menit pengadukan 12 jam ... 77 Lampiran 21. Spektra massa senyawa hasil sintesis pada waktu retensi
20,200 menit pengadukan 12 jam ... 77 Lampiran 22. Spektra massa senyawa hasil sintesis pada waktu retensi
20,405 menit pengadukan 12 jam ... 77 Lampiran 23. Spektra massa senyawa hasil sintesis pada waktu retensi
20,592 menit pengadukan 12 jam ... 78 Lampiran 24. Spektra massa senyawa hasil sintesis pada waktu retensi
xix
Lampiran 25. Spektra massa senyawa hasil sintesis pada waktu retensi 16,065 menit pengadukan 24 jam ... 78 Lampiran 26. Dokumentasi proses sintesis senyawa
xx
INTISARI
Senyawa analog kurkumin dengan gugus α,β-unsaturated keton diketahui memiliki aktivitas sebagai inhibitor protein NF-κB yang bertanggung jawab atas perkembangan sel kanker di dalam tubuh. Pada penelitian ini direaksikan 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin untuk mendapatkan senyawa analog kurkumin yang memiliki gugus α,β-unsaturated
keton.
Penelitian ini merupakan penelitian non eksperimental deskriptif. Sintesis dilakukan dengan mereaksikan 4,439 mmol 2-kloro-benzaldehida dan 4,439 mmol etil 3-oksobutanoat dengan katalis dimetilamin berdasarkan reaksi kondensasi Knoevenagel. Senyawa hasil sintesis dianalisis dengan uji kualitatif yaitu organoleptis dan kromatografi lapis tipis dengan fase diam silika gel F254 dan fase
gerak toluena, serta dilakukan elusidasi struktur menggunakan kromatografi gas -spektroskopi massa dan -spektroskopi inframerah. Uji kuantitatif dilakukan dengan perhitungan rendemen senyawa hasil sintesis.
Senyawa hasil sintesis berbentuk cair berwarna kuning, berbau khas dan nilai rata-rata crude product sebesar 52,79 %. Kromatogram lapis tipis menunjukkan bahwa senyawa baru yang terbentuk memiliki nilai Rf sebesar 0,61 dan 0,72. Kromatografi gas menunjukkan senyawa yang dihasilkan merupakan senyawa campuran dan terdapat senyawa dengan komposisi terbanyak pada waktu retensi 16,110 menit. Hasil elusidasi struktur menggunakan spektroskopi massa dan spektroskopi inframerah menunjukkan senyawa hasil sintesis pada waktu retensi 16,110 menit adalah etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat. Kata kunci: 4-(2-klorofenil)but-3-en-2-on, kondensasi Knoevenagel,
xxi
ABSTRACT
Analog compounds of curcumin with α,ß-unsaturated ketone group were known to have an activity as inhibitor of NF-κB protein that responsible for the growth of cancer cells in the body. In this research, 2-chloro-benzaldehyde and ethyl 3-oxobutanoic were reacted with dimethylamine catalyst to produce analog
compound of curcumin that has α,ß-unsaturated ketone group.
This study was non-experimental descriptive. The synthesis was done by reacting 4.439 mmol of 2-chloro-benzaldehyde and 4.439 mmol of ethyl 3-oxobutanoic with dimethylamine as catalyst by Knoevenagel condensation reaction. The synthesized compound was analyzed by qualitative tests such as organoleptic and thin-layer chromatography using silica gel F254 as stationary
phase and toluene as the mobile phase, and the elucidation of the structure was performed using gas chromatography-mass spectroscopy and infrared spectroscopy. Quantitative test was performed by calculating the yield of the synthesized compound.
The synthesized compound had the form of yellow liquid, characteristic odor and an average crude product of 52.79 %. Thin-layer chromatogram showed there were new compounds formed with Rf values of 0.61 and 0.72. Gas
chromatography showed the synthesized compound was a mixture of compounds and there was a compound with the highest composition at a retention time of 16.110 minutes. The results of structure elucidation using mass spectroscopy and infrared spectroscopy showed the compound synthesized at the retention time of 16.110 minutes was ethyl-2 -[(2-chlorophenyl)metilidene]-3-oxobutanoat.
1
BAB I PENGANTAR
A.Latar Belakang
Kanker merupakan suatu penyakit, terjadi pertumbuhan sel yang tidak terkontrol dan menyebar dalam tubuh. Kanker disebut juga dengan malignant neoplasm atau malignant tumours (Nugroho, 2012). Senyawa-senyawa karsinogenik dalam rokok, makanan dan disekitar lingkungan dapat menyebabkan kanker dengan cara meningkatkan mutasi gen (inducing gene mutations) atau mengganggu diferensiasi sel-sel (Patrick, 2005). Kanker masih merupakan penyakit paling berbahaya di dunia modern saat ini dan merupakan penyebab kematian tertinggi setelah serangan jantung. World Health Organization
menyatakan bahwa satu dari tiga orang yang terkena kanker meninggal pada tahun 2000 (Patrick, 2013). Jumlah kematian akibat kanker menunjukkan peningkatan dari tahun 2008 hingga 2012, pada tahun 2008 tercatat terdapat 7,6 juta manusia yang meninggal akibat kanker dan 8,2 juta pada tahun 2012. Diperkirakan terdapat sekitar 14,1 juta kasus baru penderita penyakit kanker pada saat ini.
World Health Organization memprediksikan akan ada 19,3 juta kasus kanker yang baru pada tahun 2025 (WHO, 2013).
digunakan oleh penduduk Asia, terutama di India dan Indonesia. Penelitian tentang kurkumin sebagai bahan aktif untuk beberapa penyakit telah banyak dilakukan selama dua dekade belakangan ini, karena berkhasiat serta tidak menimbulkan efek toksik yang merugikan. Kurkumin (diferuloylmethane) merupakan bagian terbesar pigmen kuning yang terdapat dalam rimpang kunyit (Curcuma longa L.) yang telah diketahui memiliki berbagai aktivitas biologis seperti anti oksidan, anti inflamasi, anti mikroba dan anti kanker (Nurrochmad, 2004).
Senyawa-senyawa kimia yang dapat menutup jalannya proliferasi sel-sel kanker memiliki potensi yang besar sebagai obat anti kanker. Penelitian-penelitian terhadap penggunaan senyawa kurkumin sebagai obat anti kanker telah banyak dilakukan dan telah terbukti memiliki potensi yang sangat besar sebagai anti kanker. Senyawa kurkumin diketahui dapat menghambat protein nuclear transcription factor kappa-B (NF-κB) yang banyak diekspresikan pada sel-sel kanker kolon. (Hsu, Singh, and Schuster, 2004).
meningkat. Jumlah kurkumin dilaporkan sebanyak 96,47% pada pH 1,2, kemudian mengalami penurunan hingga 71 % pada pH 6,8, 47,87 % pada pH 7 dan 3,83 % pada pH 7,4 pada kondisi suhu 37 ± 0,5 ⁰C dan selama 60 menit. Kurkumin mengalami dekomposisi lebih dari 90% pada pH fisiologis menjadi senyawa vanillin dan ferulic acid (Kumavat et al., 2013).
Gambar 1. Gugus metilen aktif pada kurkumin
Gambar 2. Gugus-gugus aktif pada kurkumin (Gupta et al., 2011)
Gambar 3. Mekanisme reaksi suatu α,β-unsaturated keton dari kurkumin yang merupakan
sebuah akseptor reaksi Michael berikatan kovalen dengan residu sistein dalam aktivitas sebagai anti kanker (Gupta et al., 2011)
Senyawa 4-(2-klorofenil)but-3-en-2-on dapat disintesis melalui reaksi kondensasi Knoevenagel antara satu senyawa yang memiliki suatu hidrogen alfa yang bersifat asam lemah dan senyawa yang memiliki gugus karbonil dengan menggunakan katalis suatu amin. Senyawa target dapat disintesis dengan mereaksikan 2-kloro-benzaldehida yang merupakan suatu senyawa aldehida yang memiliki gugus karbonil dan etil 3-oksobutanoat yang merupakan suatu senyawa ester yang memiliki hidrogen alfa dengan bantuan katalis suatu basa dimetilamin melalui reaksi kondensasi Knoevenagel.
1. Permasalahan
Apakah senyawa 4-(klorofenil)but-3-en-on dapat disintesis dari 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin melalui reaksi kondensasi Knoevenagel?
2. Keaslian Penelitian
Penelitian-penelitian sejenis tentang sintesis senyawa 4-(2-klorofenil)but-3-en-2-on antara lain:
a. Rheosmin (“Raspberry Ketone”) and Zingerone, and Their Preparation by Crossed Aldol-Catalytic Hydrogenation Sequences (Smith, 1996).
b. Sintesis senyawa 4-(3-hidroksifenil)-3-buten-2-on dan uji potensinya sebagai tabir surya (Saputro, 2012).
3. Manfaat
a. Manfaat teoretis
Penelitian ini diharapkan dapat memberikan informasi mengenai reaksi kondensasi Knoevenagel pada 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin.
b. Manfaat metodologis
Penelitian ini diharapkan dapat memberikan informasi mengenai kondisi-kondisi yang diperlukan pada proses reaksi kondensasi Knoevenagel 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin.
c. Manfaat praktis
Penelitian ini diharapkan dapat memperoleh senyawa 4-(2-klorofenil)but-3-en-2-on.
B.Tujuan 1. Tujuan umum
Penelitian ini bertujuan untuk memahami reaksi kondensasi Knoevenagel dan penerapan dalam sintesis kimia organik.
2. Tujuan khusus
8 (WHO, 2013). Kanker merupakan penyakit yang ditandai dengan timbulnya kelainan siklus sel sehingga sel-sel tumbuh tanpa terkendali, menyerang jaringan biologis didekatnya dan dapat bermigrasi ke jaringan tubuh melalui sirkulasi darah. Dalam keadaan yang normal, terdapat gen-gen yang bertanggung jawab untuk mendeteksi setiap sel-sel yang dicurigai merupakan sel-sel kanker. Tumor suppression genes merupakan gen-gen yang bertanggung jawab untuk mengawasi setiap sel di dalam tubuh, memperbaiki sel yang rusak, dan menyebabkan suicide
atau apoptosis bagi sel-sel yang sudah tidak bisa diperbaiki lagi (Patrick, 2013). Apoptosis merupakan suatu kematian sel secara terprogram di dalam organisme multi sel. Apoptosis merupakan proses normal untuk menyingkirkan sel-sel rusak. Proses kematian sel-sel dengan ciri-ciri penggumpalan DNA, kondensasi dan fragmentasi nukleus yang mengakibatkan sel difagositosis tanpa induksi respon inflamasi (Baratawidjaja dan Rengganis, 2010). Melalui jalur intrinsik, mitokondria mempunyai protein-protein yang dapat memacu proses apoptosis saat terdapat sel-sel kanker. Mitokondria akan melepaskan sitrokrom c yang menyebabkan terputusnya kompleks protein oligomerik yang disebut apoptosome. Apoptosome
caspases teraktivasi maka akan memicu proses apoptosis pada sel-sel kanker.
Caspases merupakan suatu enzim protease yang mengandung residu sistein yang merupakan sisi aktif yang sangat penting dalam proses menghambat proliferasi sel-sel kanker dengan mekanisme apoptosis.
Dalam tubuh normal terdapat gen-gen yang berfungsi sebagai anti apoptosis atau dapat menghambat daya apoptosis dalam tubuh seperti 2 dan bcl-x (Karna and Yang, 2009). Over-ekspresi protein NF-κB membuat sel kanker dapat hidup dan berkembang menyerang sel-sel normal lain. Ekspresi protein NF-κB yang berlebihan akibat adanya sel-sel kanker meyebabkan sel-sel kanker menjadi resisten terhadap apoptosis karena protein NF-κB dapat mengekspresikan gen-gen anti apoptosis seperti bcl-2 sehingga proses apoptosis dapat dihindari. Protein
NF-κB merupakan salah satu jalur yang menyebabkan sel-sel kanker dapat hidup dan menyebar ke sel-sel terdekat (Shishodia, Amin, Lai, and Aggarwal, 2005).
B.Kurkumin
NF-κB pada sel-sel kanker (Anand et al., 2008), selain itu kurkumin juga dapat menginduksi apoptosis pada sel-sel kanker (Han et al., 2002). Kurkumin bekerja dengan cara menghambat ekspresi protein NF-κB yang berperan penting dalam mengatur ekspresi gen-gen anti apoptosis seperti bcl-2 dan bcl-x. Penghambatan pada protein NF-κB akan berdampak pada sel, sehingga sel mudah mengalami apoptosis dan menghambat proliferasi sel kanker (Shishodia et al., 2005).
Gambar 4. Resonansi suatu α,β-unsaturated keton dari senyawa 3-buten-2-on (Brown and
Poon, 2005)
Berdasarkan penelitian yang dilakukan oleh Han et al. (2002), protein
NF-κB merupakan salah satu kunci target untuk menghambat pertumbuhan sel-sel kanker sehingga bagi obat-obat yang memiliki aktivitas menghambat protein
suatu reaksi Michael. Muatan positif yang diemban pada posisi β suatu ikatan rangkap akan menentukan reaktivitas dari sebuah elektrofilik (Gambar 4). Semakin positif karbon pada posisi β maka semakin reaktif reaksi Michael atau perpanjangan karbon-karbon (Brown and Poon, 2005).
C.Aldehida
Aldehida memiliki suatu gugus karbonil yaitu suatu karbon yang berikatan rangkap pada suatu oksigen. Aldehida merupakan suatu senyawa yang polar karena adanya interaksi dipol-dipol antara molekul, memiliki titik didih yang tinggi dari pada hidrokarbon ataupun suatu eter (Denniston, Topping, and Caret, 2008). Reaktivitas suatu aldehida dilihat dari ikatan rangkap antara karbon dan oksigen. Ikatan rangkap antara karbon dan oksigen termasuk dalam hibridisasi sp2, berbentuk trigonal dan memiliki sudut ikatan ± 120⁰. Oksigen memiliki
keelektronegatifan yang tinggi yang dapat menarik elektron dari karbon sehingga
oksigen akan mengemban muatan parsial negatif (δ
-) dan karbon mengemban
muatan parsial positif (δ+
) (Jones, 2005).
Dua-kloro-benzaldehida (Gambar 5) merupakan senyawa golongan aldehida aromatis yang tersubtitusi gugus klor pada posisi orto. 2-kloro-benzaldehida memiliki formula kimia C7H5ClO, berbentuk cairan, berbau khas,
memiliki bobot molekul sebesar 140,57 gram/mol, tidak berwarna, memiliki titik didih 211⁰C, titik leleh 12,39⁰C, sukar larut dalam air pada suhu ruang tetapi mudah larut dalam air dingin (Anonim, 2013).
Karbon pada karbonil yang terikat dengan suatu oksigen mengemban suatu
muatan parsial positif (δ+
) dikarenakan oksigen memiliki keelektronegatifan yang tinggi sehingga elektron dari karbon tertarik ke oksigen. Muatan parsial positif pada karbon pada gugus karbonil akan mudah sekali diserang oleh suatu nukleofil sehingga semakin positif muatan pada karbon karbonil, maka semakin elektrofil suatu senyawa itu (McMurry, 2012).
D.Ester
Etil 3-oksobutanoat atau etil asetoasetat (Gambar 6) merupakan suatu ester dengan formula kimia C6H10O3, bobot molekul 130,16 gram/mol, tidak berwarna, berbau
khas, memiliki titik didih 180,8 ⁰C, dan memiliki kelarutan yang parsial pada air dingin (Anonim, 2013). Etil 3-oksobutanoat memiliki lima hidrogen alfa dan pada posisi yang diapit oleh dua karbonil bersifat paling asam.
Gambar 6. Struktur senyawa etil 3-oksobutanoat
E.Katalis
Katalis adalah zat yang meningkatkan laju reaksi kimia tanpa ikut terpakai. Katalis dapat bereaksi menjadi zat antara, tetapi akan diperoleh kembali dalam tahap reaksi berikutnya. Katalis mempercepat suatu reaksi dengan cara menurunkan nilai aktivasi (Ea) sehingga dari suatu reaktan menjadi produk membutuhkan energi
yang lebih kecil untuk menjadi produk karena adanya katalis (Chang, 2004).
Gambar 7. Struktur senyawa dimetilamin
Dimetilamin (Gambar 7) merupakan suatu amin sekunder, suatu basa lemah dengan pKa sebesar 10,68, memiliki formula kimia yaitu (CH3)2NH,
memiliki bobot molekul 45,08 gram/mol, berbentuk cairan, tidak berwarna dengan bau ammonia yang kuat, memiliki kelarutan dengan air yang baik dan mudah larut pada air dingin (Anonim, 2013). Suatu pembentukan ion enolat sangat bergantung terhadap kekuatan basa kuatu katalis. Karena suatu hidrogen alfa pada senyawa karbonil hanya merupakan sebuah asam yang lemah, maka diperlukan suatu basa kuat untuk mendapatkan rendemen ion enolat yang lebih baik.
F. Kondensasi Knoevenagel
ammonia atau amin. Reaksi kondensasi Knoevenagel merupakan suatu modifikasi dari reaksi aldol karena adanya sifat hidrogen yang memiliki sifat asam yang lebih tinggi pada posisi alfa dari sebuah karbonil (Menegatti, 2012).
Gambar 8. Pembentukan ion enolat dari senyawa etil 3-oksobutanoat
Gambar 9. Reaksi umum adisi nukleofilik (McMurry, 2012)
Gambar 10. Reaksi umum dehidrasi suatu β-hidroksi keton menjadi α,ß-unsaturated atau enon (McMurry, 2012)
Suatu ion enolat yang telah terbentuk dari senyawa karbonil dengan katalis suatu basa akan mudah sekali menyerang suatu karbon karbonil lainnya yang bermuatan sigma positif (Hornback, 2006). Reaksi adisi nukleofilik merupakan reaksi pembentukan ikatan karbon-karbon dapat terbentuk karena ion enolat merupakan suatu elektrofil yang sangat reaktif akan menyerang karbon yang
bermuatan sigma positif (δ+
) terikat pada gugus karbonil membentuk ikatan karbon-karbon yang baru (Gambar 9) (Siswoyo, 2009).
Gambar 11. Reaksi umum etil 3-oksobutanoat mengalami hidrolisis dan dekarboksilasi menjadi suatu metil keton, karbon dioksida dan suatu etanol (McMurry, 2012)
posisi β terhadap gugus karbonil. Melalui protonasi dan pemanasan, suatu ester β -keto akan mengalami hidrolisis dan dekarboksilasi yang ditandai dengan pelepasan gelembung atau menghasilkan CO2 (Gambar 11) (Bresnick, 2004). Berdasarkan
pendekatan diskoneksi, senyawa target yaitu 4-(2-klorofenil)but-3-en-2-on dapat disintesis menggunakan starting material 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan reaksi kondensasi Knoevenagel (Gambar 12).
Gambar 12. Pendekatan diskoneksi senyawa 4-(2-klorofenil)but-3-en-2-on
Tabel I. Karakteristik senyawa antara dan senyawa target dalam reaksi sintesis 4-(2-klorofenil)but-3-en-2-on
No Nama senyawa Formula kimia Bobot massa
(gram/mol)
Kromatografi merupakan teknik pemisahan yang paling umum dan paling sering digunakan dalam bidang kimia analisis. Kromatografi merupakan teknik pemisahan yang menggunakan fase diam dan fase gerak yaitu dengan melihat interaksinya antara senyawa dengan fase diam dan fase gerak. Salah satu jenis kromatografi yang sering digunakan yaitu kromatografi lapis tipis (KLT) yang fase diam berupa lapisan yang seragam pada permukaan bidang datar yang didukung oleh lempeng kaca, plat alumunium, atau plat plastik. Fase gerak adalah cairan atau pelarut atau gas pembawa yang tidak bereaksi dengan senyawa-senyawa yang dipisahkan (Sherma and Fried, 2003).
dipisahkan hanya untuk menentukan jumlah dan struktur senyawa. Kromatografi preparatif dilakukan untuk memisahkan senyawa dalam jumlah yang cukup untuk diambil kembali dan dianalisis selanjutnya (Rohman dan Gandjar, 2012).
Ada beberapa kelebihan metode kromatografi dibandingkan dengan metode pemisahan yang lain yaitu metode ini dapat dilakukan untuk jumlah sampel yang sangat kecil (dalam mikro atau semimikro). Selain itu metode ini bersifat selektif untuk senyawa organik multikomponen. Hal ini disebabkan interaksi fase diam dan fase gerak secara simultan terdapat senyawa-senyawa organik yang dipisahkan dapat memberikan perbedaan distribusi dan berakhir pada pemisahan senyawa-senyawa yang secara struktural sangat mirip sekalipun. Dengan demikian, biaya yang harus dikeluarkan juga minimal dan metode ini menjadi sangat efektif serta efisien (Wonorahardjo, 2013).
H.Elusidasi 1. Spektrofotometri inframerah (IR)
Sinar inframerah mempunyai panjang gelombang 600-4000 cm-1 yang lebih panjang dari pada sinar UV-Vis dan memberikan energi yang lebih kecil. Sinar inframerah hanya dapat menyebabkan vibrasi pada ikatan baik berupa
Inti-inti atom yang terikat oleh ikatan kovalen akan mengalami getaran atau osilasi sehingga energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat. Molekul ini berada dalam keadaan vibrasi tereksitasi, dan keadaan vibrasi dari ikatan sangat tergantung terhadap tipe ikatan. Tipe ikatan yang dihasilkan setiap senyawa berbeda-beda maka radiasi inframerah yang diserap akan berbeda dan menunjukkan pada panjang gelombang tertentu. Ikatan-ikatan yang menyerap energi inframerah akan menjalani berbagai macam osilasi yaitu bisa menyebabkan kenaikan vibrasi ulur ataupun kenaikan vibrasi tekuk (Fessenden and Fessenden, 1986).
Sumber sinar inframerah menghasilkan sinar inframerah yang dibagi menjadi 2 berkas yang intensitasnya sama (Io). Salah satu berkas sinar dilewatkan ke cuplikan sehingga intensitasnya berkurang menjadi I. Chopper berputar sehingga menerima berkas sinar baku (dari reflektor 1) dan berkas sinar yang melewati cuplikan (reflektor 2) secara bergantian. Sinar dengan intensitas yang berbeda (Io dan I) tersebut masing-masing diubah menjadi monokromatis oleh monokromator. Sinar ini selanjutnya diterima oleh detektor dan diubah menjadi spektrum (Sitorus, 2009).
2. Spektrofotometri massa
Prinsip dasar mengenai spektroskopi massa adalah pada saat senyawa dalam keadaan gas atau uap jika berada dalam arus listrik tegangan tinggi dapat melepaskan elektron (e-) menjadi kation. Kation ini dapat dipercepat dan dibiaskan oleh medan magnet, medan listrik, dan pembiasan ini akan tergantung pada massa, muatan dan kecepatan kation tersebut (Hoffmann and Stroobant, 2007).
Penyiapan dan memasukan sampel dapat menggunakan beberapa sistem seperti sistem reservoir, sistem pemanasan ataupun sistem kromatografi gas. Penyiapan dan memasukan sampel menggunakan sistem kromatografi gas merupakan salah satu metode yang paling sering digunakan dalam sintesis senyawa organik. Penggunaan metode kromatografi gas bertujuan untuk memisahkan beberapa sampel berdasarkan titik didih senyawa sehingga nantinya didapatkan beberapa komponen yang telah terpisah. Proses volatilisasi terjadi pada proses ini yaitu proses suatu zat diubah menjadi uap dalam keadaan vakum tinggi.
Sampel yang telah dipisahkan menggunakan kromatografi gas akan di ionisasi untuk membentuk suatu muatan positif. Metode ionisasi yang sering digunakan seperti electron impact (EI), chemical ionization, field ionization field desorption, dan fast atom bombardment. Penggunaan metode electron impact
fragmen. Pemisahan ion molekul dengan ion-ion fragmen menggunakan suatu medan magnet ataupun quadruplet. Setelah terpisah, maka kolektor akan mendeteksi dan mencatat ion yang dihasilkan dalam bentuk spektra (Sitorus, 2009).
Gambar 13. Pola peak M dan M+2 dari senyawa yang memiliki atom halogen seperti klor atau brom (Silverstein, Webster, and Kiemle, 2005)
Berdasarkan informasi yang didapat dari spektroskopi massa, dapat diketahui berat molekul senyawa hasil sintesis dan ion fragmen yang stabil yang penting dalam senyawa hasil sintesis. Ion fragmen akan memberi gambaran yang sangat penting dalam penentuan struktur senyawa (Silverstein, Webster, and Kiemle, 2005).
I. Landasan Teori
Reaksi kondensasi Knoevenagel merupakan suatu reaksi antara senyawa karbonil yang mempunyai hidrogen alfa yang diapit oleh dua gugus karbonil dengan senyawa aldehida atau keton dalam suasana basa. Etil 3-oksobutanoat merupakan suatu senyawa karbonil yang mempunyai hidrogen alfa yang diapit oleh dua gugus karbonil yang akan mudah teraktivasi oleh adanya katalis basa dimetilamin membentuk ion enolat. Ion enolat yang terbentuk akan menjadi karbanion etil 3-oksobutanoat yang bertindak sebagai sebuah nuklofil yang akan menyerang atom C karbonil yang bermuatan positif pada 2-kloro-benzaldehida yang merupakan senyawa aldehida. Produk akhir dari reaksi tersebut akan menghasilkan 4-(2-klorofenil)but-3-en-2-on. Persamaan reaksi umum yang terjadi ditunjukkan oleh gambar berikut:
Sintesis senyawa 4-(2-klorofenil)but-3-en-2-on dilakukan dengan menggunakan katalis suatu basa yaitu dimetilamin. Penggunaan katalis basa mengarahkan reaksi melalui jalur pembentukan ion enolat sehingga reaksi akan berjalan lebih cepat dikarenakan adanya suatu karbanion etil 3-oksobutanoat yang bermuatan negatif dan bersifat reaktif.
J. Parameter Empiris
25
BAB III
METODE PENELITIAN
A. Jenis Rancangan Penelitian
Penelitian yang berjudul “Reaksi antara 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin“ merupakan penelitian non eksperimental deskriptif. Dalam penelitian ini hanya dipaparkan fenomena yang terjadi tanpa melibatkan hubungan sebab-akibat.
B. Parameter
Senyawa 4-(2-klorofenil)but-3-en-2-on dapat terbentuk dari 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin dan memungkinkan terbentuknya senyawa lain seperti etil 2-[(2-klorofenil) (hidroksi) metil]-3-oksobutanoat, etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat, dan asam-2-[(2-klorofenil)metilidena]-3-oksobutanoat.
C. Definisi Operasional
1. Molekul target merupakan senyawa hasil sintesis yang diharapkan terbentuk. 2. Rendemen senyawa adalah persentase jumlah produk reaksi yang dihasilkan dari
hasil sintesis dibandingkan dengan jumlah produk reaksi secara teoretis.
D.Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah 2-kloro-benzaldehida (p.a, E.Merck), etil 3-oksobutanoat (p.a, E.Merck), dimetilamin (p.a, E.Merck), etanol (p.a, E.Merck), etanol 70% (teknis, Genera Labora), aquadest (Laboratorium Sanata Dharma), kloroform (p.a, E.Merck), silika gel GF254 (p.a, E.Merck), toluena
(p.a, E.Merck), natrium sulfat (teknis, Brataco Chemika), natrium bikarbonat (teknis, Brataco Chemika).
E.Alat Penelitian
Labu erlenmeyer, labu takar, labu alas bulat leher dua, gelas beker, gelas ukur, pipet tetes, corong, pengaduk kaca, pH indikator (E.Merck), cawan petri, mikropipet, flakon, oven (Memmert Oven Model 400), neraca analitik (Ohaus PA413), Magnetic stirrer, waterbath (Memmert W350), chamber, desikator, spektrometer inframerah (Nicolet Avatar 360 IR), spektrometer massa (GCMS
-QP2010 SE)
F. Tata Cara Penelitian 1. Pembuatan Etanol Super Dry
menguap yang ditandai dengan tidak ada tetesan lagi. Destilat dikumpulkan dalam labu takar.
2. Pembuatan HCl 1N
Asam sulfat 37% sebanyak 83 mL dimasukkan ke dalam labu takar 1 L kemudian ditambah aquadest hingga batas tanda.
3. Pembuatan natrium bikarbonat 10%
Natrium bikarbonat sebanyak 10 gram dimasukkan kedalam erlenmeyer. Aquadest 50 mL ditambahkan kedalam erlenmeyer dan diaduk hingga larut sempurna. Natrium bikarbonat yang sudah larut dengan aquadest dipindahkan kedalam labu takar 100 mL. Gelas beker dibilas dengan 20 mL dan tambahkan ke dalam labu takar 100 mL. Aquadest ditambahkan hingga batas tanda labu takar 100 mL.
4. Sintesis Senyawa 4-(2-klorofenil)but-3-en-2-on
ditambahkan hingga pH 1-2, dipanaskan pada suhu 90˚C selama 2 jam hingga tidak ada gelembung gas yang terbentuk. Natrium bikarbonat 10% ditambahkan hingga pH netral dan dinginkan selama 24 jam didalam kulkas. Warna kuning yang terbentuk dipisahkan dengan sisa aquadest dan dikeringkan dalam desikator hingga didapatkan hasil sintesis yang pekat. Timbang hasil sintesis yang terbentuk dan dihitung rendemen.
5. Analisis Hasil Sintesis : a. Pemeriksaan organoleptis
Senyawa hasil sintesis diamati bentuk, warna dan bau kemudian dibandingkan dengan starting material yang digunakan.
b. Uji kromatografi lapis tipis (KLT)
Senyawa hasil sintesis yang didapat diencerkan sebesar 100 kali, 2-kloro-benzaldehida sebesar 100 kali dan etil 3-oksobutanoat sebesar 9 kali. Fase gerak toluena sebanyak 20 mL ditambahkan kedalam chamber dan lakukan penjenuhan. Lempeng silika gel GF254 dipanaskan selama 30 menit pada suhu
100⁰C. Penotolan dilakukan 1,5 cm dari batas bawah plat dan jarak antar totolan sebesar 1,5 cm. Penotolan dilakukan dengan mengambil masing-masing 1 µL senyawa hasil sintesis, 2-kloro-benzaldehida dan etil 3-oksobutanoat ditotolkan pada lempeng silika gel GF254 yang telah dipanaskan. Lakukan elusi didalam
chamber yang telah jenuh sepanjang 9 cm. Lempeng silika gel GF254 yang sudah
6. Elusidasi Struktur Senyawa Hasil Sintesis a. Spektrofotometri inframerah
Sampel sebanyak 0,1-1 mL diambil dan dioleskan dengan NaCl
Windows. NaCl Windows ditekan sehingga tidak ada gelembung udara diantara keduanya. Chopper akan berputar sehingga menerima berkas sinar baku (dari reflektor 1) dan berkas sinar yang melewati cuplikan (reflektor 2) secara bergantian. Sinar dengan intensitas yang berbeda (Io dan I) tersebut masing-masing diubah menjadi monokromatis oleh monokromator. Sinar ini selanjutnya diterima oleh detektor dan diubah menjadi spektrum.
b. Gas kromatografi-spektrometri massa
G.Analisis Hasil 1. Perhitungan rendemen
Perhitungan rendemen senyawa hasil sintesis dilakukan dengan cara menghitung berat senyawa hasil sintesis yang telah dikeringkan dibandingkan dengan perhitungan berat senyawa secara teoretis
Rendemen Berat senyawa hasil sintesisBerat secara teoretis 00
2. Analisis hasil organoleptis
Analisis berdasarkan hasil organoleptis yaitu bentuk, warna dan bau. 3. Analisis uji kemurnian
Melihat kemurnian senyawa hasil sintesis berdasarkan dari uji kromatografi lapis tipis dan gas kromatografi.
4. Elusidasi struktur
31
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis 4-(2-klorofenil)but-3-en-2-on
Senyawa 4-(2-klorofenil)but-3-en-2-on merupakan suatu senyawa analog kurkumin yang dapat disintesis dari starting material 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin melalui reaksi kondensasi Knoevenagel. Senyawa 2-kloro-benzaldehida tidak memiliki hidrogen alfa dan bertindak sebagai suatu elektrofil sedangkan etil 3-oksobutanoat merupakan senyawa yang memiliki hidrogen alfa yang dapat bertindak sebagai suatu nukleofil dalam kondisi menggunakan katalis suatu asam atau basa. Reaksi berlangsung saat etil 3-oksobutanoat yang memiliki hidrogen alfa dengan diubah menjadi ion enolat dengan adanya katalis basa.
Gambar 15. Etil 3-oksobutanoat memiliki lima hidrogen alfa dan dua gugus karbonil
katalis basa. Penggunaan katalis basa akan menghasilkan suatu intermediet ion enolat sedangkan katalis asam akan menghasilkan suatu enol. Penggunaan katalis basa lebih dipilih dibandingkan dengan katalis asam, hal ini dilihat dari reaktivitas dari suatu intermediet ion enolat yang lebih besar dibandingkan dengan suatu enol. Reaktivitas enolat lebih tinggi dari pada enol karena suatu ion enolat memiliki karbon yang bermuatan negatif di posisi alfa dari karbonil sedangkan enol bersifat netral. Adanya muatan negatif pada karbon dari ion enolat akan meningkatkan reaktivitas sebagai suatu nukleofil. Katalis basa seperti dimetilamin digunakan dalam penelitian ini dengan tujuan membentuk ion enolat dari etil 3-oksobutanoat sehingga reaksi akan berjalan lebih cepat.
Berdasarkan program Marvin Sketch 5.11.4, etil 3-oksobutanoat memiliki dua bentuk molekul pada rentang pH 1-14. Kedua bentuk molekul etil 3-oksobutanoat tersebut ditunjukkan pada gambar berikut :
Gambar 16. Macam-macam bentuk molekul etil 3-oksobutanoat pada pH 0 -5,6 (1) dan pH 5,8
– 14 (2)
Bentuk molekul (1) merupakan bentuk utuh dari senyawa etil 3-oksobutanoat pada pH 0-5,6 sebanyak 100 %. Bentuk molekul (1) akan semakin menurun pada suasana pH basa dan bentuk molekul (2) akan semakin meningkat hingga mencapai 92,14 % pada pH 11. Hal ini membuktikan bahwa semakin basa suatu katalis, maka karbanion dari etil 3-oksobutanoat akan semakin meningkat dan pembentukan reaksi kondensasi Knoevenagel antara etil 3-oksobutanoat dengan 2-kloro-benzaldehida akan berlangsung dan menghasilkan rendemen yang lebih baik.
Gambar 17. Macam-macam bentuk molekul asam 3-oksobutanoat pada pH 0-8,2 (1) , pH 0-14 (2), dan pH 11-14 (3)
asam 3-oksobutanoat yang banyak terdapat pada pH 0-3 dan akan menurun hingga 9,58 % pada pH 5. Pada saat bentuk molekul (1) mulai menurun pada pH netral, bentuk molekul (2) meningkat dan mencapai 100 % dari pH 8,4 hingga 10,8. Bentuk molekul (3) mulai sedikit bertambah hingga mencapai angka tertinggi yaitu 5,64 % pada pH 14. Hal ini membuktikan bahwa pencegahan suatu etil 3-oksobutanoat mengalami hidrolisis menjadi sangat penting karena karbanion dari asam 3-oksobutanoat hanya terdapat 5,64 % pada pH 14, sedangkan karbanion yang terbentuk oleh etil 3-oksobutanoat mencapai 92,14 % pada pH 11.
Gambar 18. Gugus hidroksil pada asam 3-oksobutanoat mudah diserang oleh suatu basa
Tahap awal proses sintesis senyawa 4-(2-klorofenil)but-3-en-2-on dimulai pada pengadukan antara etil 3-oksobutanoat dengan 2-kloro-benzaldehida dengan katalis basa. Pengadukan dibantu dengan magnetic stirrer untuk meningkatkan pergerakan molekul sehingga tumbukan antar molekul menjadi lebih banyak dan meningkatkan hasil rendemen. Adapun perubahan warna terjadi dari tidak berwarna menjadi kuning ketika etil 3-oksobutanoat ditambahkan. Hal tersebut menandakan bahwa reaksi kimia telah berlangsung. Suatu nukleofil yaitu karbanion dari etil 3-oksobutanoat akan menyerang karbon karbonil dari 2-kloro-benzaldehida yang menyebabkan putusnya ikatan rangkap (sp2) C=O menjadi ikatan tunggal (sp3) membentuk ion alkoksida. Ion alkoksida akan mengambil hidrogen dari katalis atau pelarut membentuk gugus hidroksil. Suatu beta hidroksi keton yang terbentuk mudah sekali mengalami dehidrasi melepaskan air membentuk suatu α,β -unsaturated keton.
penambahan aquadest yang berlebih dalam proses pemanasan adalah untuk mencegah senyawa target yang berwarna kuning menjadi kering dan lengket pada dasar erlenmeyer. Hasil sintesis dikeluarkan dari waterbath dan ditambahkan natrium bikarbonat 10% hingga pH netral dan didinginkan dalam kulkas selama 24 jam. Setelah 24 jam, fase yang berwarna kuning dipisahkan dengan fase aquadest. Fase kuning yang didapatkan kemudian dipekatkan didalam desikator hingga didapatkan senyawa yang pekat.
Pengaruh waktu pengadukan terhadap hasil rendemen dapat dilihat dari data pengujian selama 0,5 jam (Lampiran 8), 12 jam (Lampiran 9) dan 24 jam (Lampiran 10). Pemilihan 0,5 jam, 12 jam dan 24 jam dilihat berdasarkan perubahan warna dari tidak berwarna menjadi kuning hingga kuning gelap. Perubahan warna menandakan terbentuknya senyawa lain dari starting material.
Pada pengadukan selama 0,5 jam, warna yang dihasilkan saat pengadukan adalah tidak berwarna dan hasil GC-MS didapatkan puncak nomor 1 dengan waktu retensi 10,807 menit, % area sebesar 0,83 % yaitu ion molekul dengan nilai m/z
sebesar 130 (Lampiran 11), puncak nomor 2 dengan waktu retensi 17,145 menit, % area sebesar 20,16 % yaitu ion molekul dengan nilai m/z sebesar 138 [M.+] atau 141 [M+2]+ (Lampiran 12), dan puncak nomor 3 dengan waktu retensi 35,195 menit, % area sebesar 54,97 % yaitu ion molekul dengan nilai m/z sebesar 217 (Lampiran 13). Pada pengadukan selama 12 jam, warna yang dihasilkan saat pengadukan adalah warna kuning muda dan hasil GC-MS didapatkan puncak nomor 1 dengan waktu retensi 7,229 menit, % area sebesar 1,9 % yaitu ion molekul dengan nilai m/z
menit, % area sebesar 65,96 % yaitu ion molekul dengan nilai m/z sebesar 217
Tabel II. Pengaruh waktu terhadap jumlah % area hasil sintesis
Waktu
Berdasarkan data yang telah dipaparkan, suatu reaksi berjalan optimal jika reaktan yang digunakan semakin berkurang dan jumlah produk target yang dihasilkan semakin bertambah. Pada pengadukan 0,5 jam, masih terdapat starting material etil 3-oksobutanoat dengan bobot molekul 130 gram/mol sebanyak 0,83%, juga terdapat starting material 2-kloro-benzaldehida dengan bobot molekul 140 gram/mol sebanyak 20,16 % dan jumlah produk target sebanyak 54,97 %. Pada waktu pengadukan 0,5 jam masih terdapat banyak starting material yang digunakan. Hal ini menyatakan bahwa reaksi belum berjalan dengan waktu yang optimal, sehingga perlu ditingkatkan waktu pengadukan. Pada pengadukan 12 jam dan 24 jam, starting material etil 3-oksobutanoat tidak ditemukan lagi, artinya bahwa etil 3-oksobutanoat sudah habis bereaksi membentuk senyawa lain. Pada pengadukan 12 jam dan 24 jam, 2-kloro-benzaldehida masih ditemukan dengan persentase 1,9 % pada waktu 12 jam, dan 2,96 % pada waktu 24 jam.
target produk semakin bertambah, dipilih waktu pengadukan 12 jam sebagai waktu optimum reaksi sintesis yaitu didapatkan 65,96 % senyawa target, 1,9 % senyawa 2-kloro-benzaldehida dan tidak ditemukan adanya etil 3-oksobutanoat. Berdasarkan hasil penelitian, berat produk target yang diperoleh berdasarkan hasil replikasi pertama, kedua dan ketiga pada waktu pengadukan 12 jam yaitu sebesar 0,612 gram; 0,759 gram; dan 0,55 gram. Hasil sintesis yang berbentuk cair perlu dianalisis lebih lanjut untuk memastikan apakah cairan yang didapat merupakan senyawa target yaitu 4-2-(klorofenil)but-3-en-2-on.
B. Analisis Pendahuluan 1. Pemeriksaan organoleptis
Analisis pendahuluan yang dilakukan adalah pemeriksaan organoleptis dengan tujuan untuk mengetahui bentuk, warna dan bau dari hasil senyawa yang didapatkan. Pemeriksaan organoleptis dilakukan dengan membandingkan senyawa hasil sintesis dengan starting material.
Tabel III. Perbandingan sifat fisik senyawa hasil sintesis dan starting material
Pengamatan 2-kloro-
Warna Tidak berwarna Tidak berwarna Kuning
Ditinjau dari ketiga aspek dalam pemeriksaan organoleptis, wujud fisik senyawa hasil sintesis berbeda dengan starting material. Berdasarkan hasil dari pemeriksaan organoleptis, dapat disimpulkan bahwa senyawa hasil sintesis merupakan senyawa yang berbeda dari starting material. Perbedaan dilihat berdasarkan warna dari hasil produk yaitu kuning dan starting material tidak berwarna. Perubahan warna dari tidak berwarna menjadi kuning menandakan bahwa senyawa hasil sintesis bereaksi dari starting material menjadi senyawa yang berbeda, dan terjadi perpanjangan kromofor yang menyebabkan perubahan warna menjadi kuning. Perbedaan juga dapat dilihat dari karakteristik bau antara
starting material dibandingkan dengan senyawa hasil sintesis. 2-kloro-benzaldehida memiliki bau menyengat, dan etil 3-oksobutanoat memiliki berbau khas yang berbeda dengan senyawa hasil sintesis.
2. Pemeriksaan kemurnian dengan kromatografi lapis tipis (KLT)
Pemeriksaan kemurnian senyawa hasil sintesis menggunakan kromatografi lapis tipis (KLT) dapat digunakan sebagai identifikasi awal secara kualitatif yang menunjukkan bahwa senyawa hasil sintesis berbeda dengan dengan starting material yang digunakan. Selain itu penggunaan kromatografi lapis tipis juga dapat digunakan untuk mengetahui kemurnian dari hasil sintesis senyawa dengan melihat bercak yang muncul pada setiap penotolan pada plat KLT. Kemurnian hasil sintesis senyawa dapat dilihat dari nilai Rf(Retardation
1
1,5 cm
Pada penelitian ini, pemeriksaan KLT dilakukan dengan menggunakan fase diam silika gel F254 dengan ketebalan 0,2-0,25 mm yang dapat
berfluoresensi hijau jika dilihat dibawah sinar UV 254 nm. Fase gerak yang digunakan dalam analisis KLT senyawa hasil sintesis adalah toluena. Pada awalnya, dilakukan pengenceran senyawa hasil sintesis dan starting material
menggunakan etanol dikarenakan senyawa hasil sintesis dan starting material
sangat pekat sehingga hasil penotolan memberikan hasil yang tailing. Hal ini menyatakan bahwa kapasitas suatu fase diam sangat terbatas, dan perlu dilakukan pengenceran untuk memberikan hasil yang lebih baik. Hasil pemeriksaan dengan KLT ditunjukkan pada gambar dibawah ini.
Gambar 19. Hasil analisis kromatografi lapis tipis dibawah sinar UV 254 nm menggunakan fase diam silika gel F254 dan fase gerak toluena dengan jarak elusi 9 cm. Senyawa hasil sintesis
dengan pengenceran 100x (A dan B), senyawa 2-kloro-benzaldehida dengan pengenceran sebesar 100x (C), dan senyawa etil 3-oksobutanoat dengan pengenceran sebesar 9x (D)
Suatu senyawa yang terdeteksi menggunakan kromatografi lapis tipis akan memadamkan fluoresensi dari silika dilihat dari warna hitam yang terbentuk. Hasil pemeriksaan menggunakan kromatografi lapis tipis menyatakan bahwa hasil sintesis yang didapat berbeda dengan starting material yang digunakan. Perbedaan antara hasil sintesis dengan starting material dapat dilihat dari perbedaan nilai Rf yang menyatakan bahwa senyawa hasil sintesis memiliki dua bercak dengan nilai 0,72 (B) dan 0,61 (A), sedangkan 2-kloro-benzaldehida memiliki nilai Rf 0,86 (C) dan etil 3-oksobutanoat memiliki nilai Rf 0,43 (D) (Tabel IV). Pengujian senyawa hasil sintesis menggunakan kromatografi lapis tipis juga memberikan informasi bahwa senyawa hasil sintesis tidak murni karena memiliki dua bercak yaitu A dan B pada pengenceran 100 kali.
Tabel IV. Nilai Rf senyawa hasil sintesis dan starting material
Senyawa Nilai Rf
2-kloro-benzaldehida 0,86 (C)
Etil 3-oksobutanoat 0,43 (D)
Senyawa hasil sintesis 0,72 (B) 0,61 (A)
C. Elusidasi Struktur Senyawa Hasil Sintesis
1. Pengujian dengan spektrofotometri inframerah (IR)
Pengujian menggunakan spektrofotometri inframerah merupakan satu pengujian yang bertujuan untuk melihat gugus-gugus fungsional dalam menentukan struktur suatu senyawa yang tidak diketahui. Spektra senyawa hasil sintesis yang diperoleh dari hasil pengujian ditampilkan pada gambar 20.
Gambar 20. Spektra inframerah senyawa hasil sintesis (Plat NaCl)
Senyawa hasil sintesis diketahui memiliki gugus karbonil (C=O) yang ditandai dengan munculnya pita serapan dengan intensitas kuat dan tajam pada bilangan gelombang 1714,59 cm-1. Adanya serapan kuat dari ikatan C-O
stretching yang berada pada daerah 1238,39 cm-1 menggambarkan bahwa senyawa hasil sintesis yang memiliki suatu gugus karbonil merupakan suatu ester. Suatu α,β unsaturated ester yang memiliki gugus karbonil (C=O) terdeteksi pada panjang gelombang 1730-1715 cm-1 dan ikatan C-O stretching
1160 cm-1 (Silverstein, Webster, and Kiemle, 2005). Pita serapan lain pada 1096,27 cm-1 dengan intensitas sedang menggambarkan bahwa senyawa hasil sintesis memiliki struktur klorobenzena yang pada umumnya terdapat pada panjang gelombang 1096-1089 cm-1 (Silverstein, Webster, and Kiemle, 2005). Pita serapan dengan intensitas kuat pada panjang gelombang 758,62 cm-1 memberikan informasi bahwa terdapat aromatis yang tersubtitusi dua gugus pada posisi orto. Pada umumnya serapan pada orto disubtituted aromatic terdapat pada panjang gelombang 770-735 cm-1 dengan intensitas yang kuat (Mohan, 2004). Pita serapan lain juga muncul pada daerah 1592,62 cm-1 yang memberikan intensitas sedang menggambarkan keberadaan sebuah alkena (C=C), akan tetapi pita serapan 1592,62 cm-1 mengalami tumpang tindih dengan adanya gugus karbonil yang begitu dominan. Pemastian adanya sebuah alkena dikonfirmasi dengan adanya C-H stretching pada bilangan gelombang 3066,76 cm-1. Suatu senyawa alkena (C=C) yang terkonjugasi terdeteksi pada panjang gelombang 1600 cm-1 dan C-H stretching alkena terdeteksi pada panjang gelombang diatas 3000 cm-1 (Lampiran 5) (Kalsi, 2004).
adalah suatu ester dengan adanya gugus C-O stretching. Hal ini menyatakan bahwa reaksi dehidrasi dalam proses sintesis senyawa 4-(2-klorofenil)but-3-en-2-on telah berlangsung. Adanya gugus klorobenzena dan gugus orto disubtituted aromatic menandakan bahwa terdapat gugus kloro dan adanya gugus aromatis yang tersubtitusi dua gugus pada posisi orto.
Tabel V. Interpretasi spektra inframerah senyawa hasil sintesis
Keterangan : s = strong ; m = medium, w = weak, sh = sharp
Sebagai pembandingnya, dilakukan interpretasi spektra inframerah antara senyawa hasil sintesis dibandingkan dengan starting material yaitu 2-kloro-benzaldehida ditunjukan pada gambar 21 dan etil 3-oksobutanoat pada gambar 22.
Bilangan gelombang (cm-1) Intensitas Gugus fungsi
1714,59 s,sh
Gugus C=O ester yang terkonjugasi α,β– tidak
jenuh
1238,39 s, sh
Gugus C-O stretching ester yang terkonjugasi α,β– tidak
jenuh
1592,62 m, sh C=C alkena
3066,76 W C-H stretching alkena
1096,27 M Klorobenzena
758,62 S Gugus orto disubtituted
Gambar 21. Spektra inframerah senyawa 2-kloro-benzaldehida (Sumber : http ://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_disp.cgi?sdbsno=1421)
Gambar 22. Spektra inframerah senyawa etil 3-oksobutanoat (Sumber : http: //sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_disp.cgi?sdbsno =573)
Daerah serapan yang terbaca pada spektra etil 3-oksobutanoat (Gambar 22) menunjukkan keberadaan gugus karbonil (C=O) pada bilangan gelombang 1719 cm-1 dengan intensitas kuat dan tajam. Suatu serapan yang terdapat pada bagian 1116 cm-1 memberikan informasi bahwa terdapat ikatan C-O stretching
Tabel VI. Interpretasi spektra inframerah senyawa starting material dengan senyawa hasil
Perbandingan interpretasi spektra inframerah antara senyawa hasil sintesis dengan starting material ditampilkan dalam tabel VI. Kesimpulan yang didapatkan berdasarkan spektra inframerah antara senyawa hasil sintesis dibandingkan dengan starting material yaitu terdapat suatu gugus alkena (C=C) yang membedakan antara senyawa hasil sintesis dibandingkan dengan starting material. Gugus alkena yang didapat menandakan bahwa senyawa hasil sintesis telah melalui proses reaksi dehidrasi. Pita yang seharusnya tidak muncul adalah pita pada daerah serapan 1096,27 cm-1 yang menandakan bahwa senyawa yang didapatkan merupakan senyawa ester. Jika suatu reaksi hidrolisis dan dekarboksilasi terjadi membentuk senyawa 4-(2-klorofenil)but-3-en-2-on, maka pita tersebut seharusnya tidak muncul pada spektra senyawa hasil sintesis.
merupakan senyawa yang mengalami proses dehidrasi tetapi tidak mengalami proses hidrolisis dan dekarboksilasi. Analisis dengan bantuan metode lainnya perlu dilakukan untuk memastikan kesimpulan yang telah dipaparkan.
2. Pengujian dengan spektrofotometri massa
Pengujian menggunakan spektrofotometri massa bertujuan untuk mengetahui bobot massa dan pola fragmentasi pada suatu hasil sintesis. Pada percobaan yang dilakukan, pengujian dilakukan menggunakan kromatografi gas-spektrometri massa (GC-MS) dengan metode ionisasi electron impact (EI). Senyawa hasil sintesis dipisahkan terlebih dahulu menggunakan kromatografi gas dengan prinsip pemisahan berdasarkan perbedaan titik didih.
Gambar 23. Kromatogram spektrometri massa senyawa hasil sintesis 12 jam
hasil sintesis dan hasil yang dominan pada senyawa hasil sintesis terdapat pada waktu retensi 16,110 menit dengan % area sebesar 65,96 %.
Gambar 24. Spektra massa EI senyawa hasil sintesis pada waktu retensi 16,110 menit
Berdasarkan dari reaksi-reaksi dalam proses sintesis senyawa target 4-(2-klorofenil)but-3-en-2-on (Lampiran 4), puncak nomor dua memiliki nilai m/z yang paling mendekati dengan senyawa antara dari suatu reaksi senyawa target. Puncak nomor dua memiliki nilai m/z sebesar 217 yang merupakan (M-Cl) yang memiliki kesamaan dengan senyawa etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat dengan bobot massa sebesar 252. Salah satu kelemahan penggunaan metode ionisasi electron impact adalah adanya beberapa kasus yang muncul akibat adanya ortho-effect yang menyebabkan tidak terdeteksinya atau hilangnya sebuah gugus klor dari suatu ion molekul. Penelitian dari Granoth (1972) mengatakan bahwa penggunaan metode ionisasi electron impact
dikarenakan penggunaan elektron dengan energi yang sangat tinggi yaitu sebesar 70 eV yang menyebabkan hilangannya atom klor akibat adanya ortho-effect. Fragmentasi senyawa hasil sintesis ditunjukkan pada gambar di bawah ini.
Gambar 25. Usulan mekanisme fragmentasi ion molekul senyawa hasil sintesis jalur pertama
Gambar 27. Usulan mekanisme fragmentasi ion molekul senyawa hasil sintesis jalur ketiga
dehidrasi yaitu dengan nilai m/z = 252. Peak C (M-35) memiliki nilai m/z = 217 yang kehilangan sebuah atom klor. Berdasarkan pola fragmentasi dari peak C, maka dapat disimpulkan bahwa sebuah atom klor terdapat pada senyawa target. Hal ini menandakan bahwa adanya pengaruh ortho-effect menyebabkan tidak munculnya peak khas klor di spektra massa, akan tetapi hal tersebut bukan menandakan bahwa senyawa hasil sintesis tidak mengandung atom klor, karena berdasarkan fragmentasi peak A ke peak C dapat membuktikan bahwa senyawa hasil sintesis mengandung atom klor. Peak F memiliki nilai m/z = 171 yang muncul karena ion molekul melepaskan sebuah etoksida.
Gambar 26 menjelaskan mengenai pola mekanisme fragmentasi ion molekul pada jalur kedua yang menghasilkan beberapa peak yaitu B dan I. Peak B (M-15) memiliki nilai m/z = 237 yang muncul karena ion molekul melepaskan sebuah metana. Peak I memiliki nilai m/z = 115 yang muncul dari perpecahan fragmen peak B yang melepaskan [C7H4Cl].. Pembentukan peak I juga
membuktikan bahwa pelepasan sebuah [C7H5Cl]. memiliki atom klor yang
berasal dari starting material 2-kloro-benzaldehida.
Gambar 27 menjelaskan mengenai pola mekanisme fragmentasi ion molekul pada jalur ketiga yang menghasilkan beberapa peak yaitu D, G, H, J, K, dan L. Peak D (M-45) memiliki nilai m/z = 207 yang muncul karena ion molekul melepaskan sebuah radikal etoksida. Peak G memiliki nilai m/z = 165 yang muncul dari adanya penataan ulang McLafferty yang melepaskan suatu [C2H2O].. Peak H memiliki nilai m/z = 137 yang muncul dari perpecahan
m/z = 101 yang muncul dari perpecahan fragmen dari peak H yang melepas sebuah atom klor. Perpecahan peak H ke peak J juga membuktikan bahwa senyawa hasil sintesis memiliki atom klor. Peak K memiliki nilai m/z = 89 yang muncul dari perpecahan fragmen J yang melepaskan sebuah karbon. Peak L memiliki nilai m/z = 75 yang muncul dari perpecahan fragmen K yang merupakan sebuah radikal benzena yang stabil.
Gambar 28. Mekanisme reaksi sintesis etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat
Senyawa target 4-(2-klorofenil)but-3-en-2-on tidak terbentuk diduga karena reaksi hidrolisis tidak terjadi dalam proses sintesis senyawa target. Senyawa hasil sintesis belum mengalami hidrolisis dikarenakan faktor waktu reaksi yang terlalu singkat yaitu hanya 2 jam, oleh karena itu perlu dilakukan optimasi waktu reaksi hidrolisis untuk mendapatkan senyawa target. Selain itu, perlu menggunakan metode hidrolisis lainnya seperti menggunakan hidrolisis dengan katalis basa.
57
BAB V
KESIMPULAN DAN SARAN
A.Kesimpulan
Reaksi antara 2-kloro-benzaldehida dan etil 3-oksobutanoat dengan katalis dimetilamin tidak menghasilkan senyawa 4-(2-klorofenil)but-3-en-2-on. Senyawa yang terbentuk adalah etil-2-[(2-klorofenil)metilidena]-3-oksobutanoat dengan rata-rata crude product sebesar 52,79 % dan kemurnian sebesar 65,96 %.
B. Saran
1. Perlu dilakukan pemisahan senyawa menggunakan kromatografi kolom untuk mendapatkan senyawa yang murni.