KARAKTERISASI ELEKTRODA REFERENSI
Suryanto PRPN BAT AN
Kawasan Puspiptek Serpong, Tangerang 15413, Tangerang
ABSTRAK
Satu dari berbagai cara untuk mempelajari proses yang terjadi pada permukaan suatu logam yang ada di dalam suatu larutan adalah dengan mengukur potensial logam tersebut terhadap larutan elektrolitnya. Pengukuran ini dapat dilakukan dengan menggunakan elektroda referensi. Elektroda ini dirancang khusus untuk digunakan didalam suatu larutan yang bersifat asam maupun basa serta pada temperatur rendah maupun temperatur tinggi. Elektroda ini disambungkan ke voltmeter yang mempunyai sensitifitas tinggi. Penggunaan, prinsip operasi dan jenis-jenis elektroda dibahas. Selain itu dilakukan perhitungan konversi potensial yang diukur berdasarkan suatu elektroda referensi ke elektroda referensi lainnya pad a temperatur 25°C maupun pad a temperatur tinggi. Hasil perhitungan yang didapat sesuai dengan hasil pengamatan langsung.
ABSTRACT
One of methods to study the process that take place at a surface of a metal which is immersed in an electrolyte solution is by measuring potential different between metal and its electrolyte solution. Potential measurement is carried out using reference electrode. The reference electrode is designed can be used in acid or base solution and in low or high temperature solution. In application, this electrode is connected to voltmeter with high sensitivity. Applications, requirements, operation principle and type of reference electrodes are discussed. In addition, calculation to convert potential different from one type of reference electrode to another type was performed at 25°C and above. The results show that calculated potential are same as that of direct measurements.
Prosiding Pertemuan IImiah Nasional Rekayasa Perangkat Nuklir Serpong, 20 Nopember 2007
PENDAHULUAN
ISSN 1693-3346
Pengukuran tingkat keasaman suatu larutan penting sekali dalam industri kimia untuk menjamin bahwa proses yang diharapkan benar-benar terjadi. Tingkat keasaman, pH, yang terlalu rendah atau terlalu tinggi akan mengganggu jalannya proses. Pengukuran tingkat keasaman dalam beberapa kasus dapat dilakukan seeara manual. Untuk mendapatkan pengukuran yang akurat dan terus-menerus, maka pengukuran yang dilakukan menggunakan metode potentiometrik. Pengukuran dengan metoda ini memerlukan elektroda referensi.
Selain untuk pengukuran tingkat keasaman larutan, elektrode referensi juga diperlukan untuk melakukan pengukuran-pengukuran dalam menentukan tingkat korosi suatu logam. Pengukuran yang dilakukan antara lain, Open circuit potential yaitu pengukuran beda potensial suatu logam di dalam suatu larutan elektrolit tanpa pemberian arus listrik ke logam terse but. Selain itu, pengukuran yang lainnya adalah polarisasi yaitu pengukuran besamya arus yang melewati elektroda terhadap beda potensial yang diberikan. Pengukuran yang terakhir dikenal dengan pengukuran korosi yang dipereepat.
Makalah ini akan membahas jenis-jenis elektroda referensi dan karakteristiknya serta perhitungan konversi potensial suatu elektroda referensi ke elektroda refemsi lainnya.
II. JENIS-JENIS ELEKTRODA POSITIF
Elektrode referensi yang baik mempunyai :
a. Potensial elektroda referensi yang stabil. Stabilitas yang tinggi akan tereapai jika material yang
digunakan untuk elektroda maupun pengisinya telah di ketahui karakteristiknya dengan baik.
Beberapajenis elektroda referensi yang umum di gunakan : a. Sistem logam mulia / gas hidrogen
Pada sistem ini akan terjadi reaksi reduksi ion hidrogen menjadi gas hidrogen dan sebaliknya pada permukaan logam mulia platina. Logam platina yang digunakan biasanya diperoleh dari elektrodeposisi sehingga butirannya halus. b. Sistem logam / garam tak lamt
Pad a sistem ini akan terjadi reaksi reduksi dari garam logam menjadi logam mulia dan sebaliknya. Garam yang terbentuk umumnya tidak lamt dalam air. Sistem ini dapat dioperasikan hingga temperature lebih dari 100°C tergantung pada logam mulia yang digunakan
c. Sistem logam / garam
Pada sistem ini terjadi reaksi reduksi dari ion logam membentuk logam dan sebaliknya. Banyak pendapat yang menyatakan bahwa sistem ini tidak sepenuhnya elektroda referensi tetapi elektroda referensi semu.
Pad a suatu elektroda referensi reaksi kimia yang terjadi umumnya dapat dinyatakan sebagai berikut:
Rd
(I)
Dimana: Ox adalah zat yang direduksi dan Rd adalah zat yang dioksidasi. Reaksi diatas hams terjadi dalam lingkungan yang sesuai dimana komposisi elektrolit sebagai bahan pengisi elektroda tetap. Jika ini terjadi maka potensial yang ada dapat ditentukan dan konstan. Besamya potensial tersebut mengikuti persamaan Nerst:
Ec=Eo
+
(RT/nF) In ([Ox]/[RdDDimana Eo = Potensial elektroda dasar R =Konstanta Gas Molar T
=
TemperaturF =Konstanta Faraday
Prosiding Pertemuan IImiah Nasional Rekayasa Perangkat Nuklir Serpong, 20 Nopember 2007
ISSN 1693-3346
Konsentrasi [OX] dan [Rd] tergantung pada komposisi larutan. Persamaan (2) mengindikasi-kan bahwa potensial suatu elektroda referensi tergantung pada temperatur dan komposisi zat pengisi elektroda.
ILL Elektroda Hidrogen Standar (SHE)
Ini merupakan elektroda referensi dengan sistem logam mulia / gas hidrogen. Reaksi yang terjadi dapat ditulis sebagai berikut:
(3)
Elektrolit yang digunakan dalam elektroda ini adalah as am klorida. Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Pt (s) IH2 (g) IH+ (aq)
Garis tegak menyatakan batas fasa. Potensial elektrodanya dapat dinyatakan sebagai berikut:
(4)
Dimana [H+] adalah konsentrasi ion hidrogen di dalam larutan, [H2] adalah tekanan parsial gas hidrogen. Untuk kondisi standar, bahan mumi pada temperatur 25°C, tekanan hidrogen parsial pada 1 atm, aktifitas ion hidrogen 1 unit (equivalent dengan 1,18 M asam klorida), maka suku ke dua dari persamaan (4) menjadi nol, sehingga:
Potensial elektroda sekarang menjadi potensial elektroda hidrogen standar (SHE) yang nilainya not pada semua temperatur. Berdasarkan konvensi SHE merupakan elektroda referensi standar utama.
Elektroda hidrogen standar dipelihatkan pada gambar 1. Elektroda ini sangat tidak praktis, karena elektroda ini memerIukan suplai gas hidrogen. Waktu yang diperIukan untuk menstabilkan elektroda hidrogen standar yang baru dibuat cukup lama. Hal ini disebabkan lambatnya elektroda hidrogen mencapai kesetimbangan. Karena kesulitan-kesulitan ini, maka elektroda ini jarang digunakan.
11.2. Elektroda Perak /Perak Klorida
Ini merupakan elektroda referensi dengan sistem logam / garam. Elektroda ini banyak digunakan karena mudah dan handal. Elektroda ini dapat dioperasikan pada temperatur lebih dari 100°C. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
AgCI
+
eO Ag +cr
(6)Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Ag (s) IAgCI (s) Icr (aq)
Potensial elektrodanya dapat dinyatakan sebagai berikut:
EAg/AgCI= EOAg/AgCI- (RT/F) In ([AgCI]/([Ag][Cr]) (7)
Dimana EOAg/AgCl= 0,2223 V vs SHE pada 2SoC dengan koefisien temperatur -0,23 mV fC. karena perak dan perak klorida berada dalam bentuk padat maka
Prosiding Pertemuan IImiah Nasional Rekayasa Perangkat Nuklir Serpong, 20 Nopember 2007
ISSN 1693-3346
Persamaan (7) memperlihatkan bahwa potensial elektroda ini tergantung pada aktifitas ion klorida didalam elektroda. Untuk itu penting sekali untuk mengetahui komposisi elektrolit yang menjadi larutan pengisi serta konsentrasinya. Untuk larutan pengisi yang mengandung 3,5 M kalium klorida, maka potensial elektrodanya mencapai 0.199 V vs SHE pada temperature 25 DC. Gambar 2 memperlihatkan elektroda referensi Ag/AgCI.
Kelemahan dari elektroda ini adalah sensitif terhadap cahaya. Cahaya menyebabkan AgCl berubah menjadi Ag. Selain itu elektroda ini tidak cocok untuk larutan yang mengandung ion komplek seperti ion ammonium dan ion sianida.
11.3. Elektroda Merkuri IMerkuro Klorida (Calomel) SCE
Ini merupakan elektroda referensi dengan sistem logam / garam tak lamt. Elektroda ini digemari karena kemudahan dan kehandalannya. Elektroda ini lebih dikenal dengan sebutan kalomel. Gambar 3 memperlihatkan elektroda kalomel. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
HgCl
+
eO Hg+
cr
(9)Fasa-fasa yang ada dapat dinyatakan sebagai berikut:
Hg (I) IHgCl (s) I
cr
(aq)Potensial elektrodanya dapat dinyatakan sebagai berikut:
Dimana EOHglHgCI= 0,268 V vs SHE pada 25°C dengan koefisien temperatur -0,29 mV fC. karena merkuri dalam bentuk cair dan merkuro klorida dalam bentuk padat maka [HgCI]=[Hg]=I. Dengan ini maka persamaan (9) berubah menjadi:
EHglHg2CI2= EOHglHg2CI2- (RTIF) In [Cr] (11 ) Persamaan ini menunjukkan bahwa potensial elektroda tergantung pada aktifitas ion klorida didalam larutan pengisi. Konsentrasi ion klorida dapat divariasi. Untuk 0.1 M, 1.0 M dan 3.8 M Genuh), potensial elektroda pada temperatur 25°C adalah 0.336 V, 0.283 V dan 0.245 V vs SHE. Umumnya elektroda ini mempunyai larutan pengisi yang mengandung garam kalium klorida jenuh. Konsentrasi kalium klorida yang jenuh dapat dilihat pada bagian bawah elektroda yang umumnya didapatkan kalium klorida padat (tidak larut). Elektroda ini mempunyai 2 kendala, pertama, temperatur maksimum dimana elektroda ini bekerja stabil adalah 70°C, kedua, pembuatan elektroda ini lebih sulit dibandingkan dengan elektroda Ag/AgCI. Selain elektroda kalomel, ada 2 elektroda referensi lain yang menggunakan merkuri.
11.4. Elektroda Merkuri / Merkuro Sulfat
Ini merupakan elektroda referensi dengan sistem logam / garam tak larut. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
YzHg2S04
+
e' = Hg+
Y2S0l'Fasa-fasa yang ada dapat dinyatakan sebagai berikut: Hg (I) IHg2S04 (s) Isol' (aq)
Potensial elektrodanya dapat dinyatakan sebagai berikut: EHglHg2s04= EOHglHg2S04- (RT/F) In [SOl']
(12)
(13)
Persamaan ini menunjukkan bahwa potensial elektroda tergantung pada aktifitas ion sulfat didalam larutan pengisi. Jika elektroda diisi dengan kalium
Prosiding Pertemuan IImiah Nasional Rekayasa Perangkat Nuklir Serpong, 20 Nopember 2007
11.5. Elektroda Merkuri / Merkuro Oksida
ISSN 1693-3346
Ini merupakan elektroda referensi dengan sistem logam / garam tak larut. Reaksi keseimbangan yang terjadi dapat ditulis sebagai berikut:
HgO
+
H20+
2e- = Hg+
20H-Fasa-fasa yang ada dapat dinyatakan sebagai berikut:Hg (I)IHgO (s) IOK (aq)
Potensial elektrodanya dapat dinyatakan sebagai berikut: EHglHgo= EOHglHgO- (RT/2F) In [OH-]
(14)
(15)
Jika elektroda ini diisi dengan natrium hidroksida 0.1 M, maka potensialnya menjadi 0,926 V vs SHE pada temperature 25°C.
III. KONVERSI
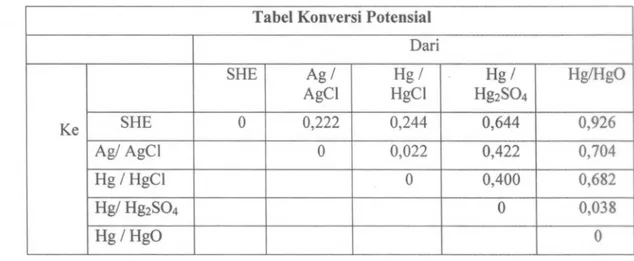
Dalam menuliskan hasil penelitian, potensial yang didapat harus rnengacu pada salah satu elektroda referensi dan mengkonversinya menjadi potensial yang sebenamya berdasarkan elektroda referensi gas hidrogen (SHE). Hal yang sarna dilakukan untuk data yang didapatdari literatur. Dengan konversi ini maka, potensial yang diperoleh dapat dibandingkan dengan hasil pengamatan lain atau literatur yang ada. Tabel dibawah ini dapat digunakan untuk mengkonversi potensial yang diperoleh rnenjadi potensial standar berbasis elektroda referensi gas hidrogen.
Tabel I: tabel konversi potensial elektroda referensi Tabel Konversi Potensial
Dari SHE Ag/Hg/HgOHg/Hg/ AgCI HgCI Hg2S04 Ke SHE 0 0,2220,2440,6440,926 Ag/ AgCl 0 0,0220,4220,704 Hg / HgCI 0 0,4000,682 Hg/ Hg2S04 0 0,038 Hg / HgO 0
Untuk pengukuran yang dilakukan menggunakan elektroda referensi SCE, maka konversinya mengikuti:
E(vsSHE) = E(vsSCE) + 0,244 Volt
KESIMPULAN
I. Pengukuran Potensial harus mengacu pada salah satu elektroda referensi dan mengkonversi menjadi potensial berdasarkan elektroda referensi gas hidrogen. 2. Potensial elektroda tergantung pada temperatur dan konsentrasi larutan elektrolit
yang digunakan untuk mengisi elektroda referensi.
3. HasH Perhitungan ini sesuai dengan pengamatan langsung.
IV. DAFT AR PUST AKA
1. Bockris, J.a and Reddy A.N., Modern Electrochemistry, Macdonald, London, 1987 2. West, J.M., Electrodeposition and Corrosion Processes, 2nd Edition, Van Nostrand
Reinhold, London, 1970 Gelas Gelas HCI, 1,18 M, 25°C Ke elektroda lain Keramik Porous H2, 1 Atm
Prosiding Pertemuan IImiah Nasional RekaY~JI>>:>erangkatNuklir Serpong, 20 Nopember 2007 Kawat Platina Gelas Gelas KCl Jenuh Hg Hg&HgCl Gelas Porous Keram ik Porous
Gambar 2: Elektroda Referensi Calomel (SCE)
Kawat Ag Gelas KCl,IM Porous AgCl
Porous Keramik
Gambar 3: Elektroda Referensi Ag/AgCl