Laporan Praktikum Fisiologi Hewan V
Pengukuran Laju Pertumbuhan dan Konsumsi Oksigen Ikan Mas
(Cyprinus carpio L.) pada Lingkungan yang Terdedah Detergen
Nama
: Cokhy Indira Fasha
NIM
: 10699044
Kelompok
: 4
Tanggal Praktikum
: 9-21 Oktober 2001
Tanggal Laporan
: 24 Oktober 2001
Asisten
: Indah
Departemen Biologi
Institut Teknologi Bandung
Laporan Praktikum Fisiologi Hewan
Pengukuran Laju Pertumbuhan dan Konsumsi Oksigen Ikan Mas
(Cyprinus carpio L.) pada Lingkungan yang Terdedah Detergen
I. Pendahuluan
Latar Belakang
Salah satu aktivitas hidup yang terpenting adalah respirasi. Hal ini merupakan mekanisme pengambilan O2
yang akan digunakan dalam pengubahan molekul yang memiliki potensial energi tinggi(karbohidrat) ke molekul yang mengandung siap pakai (ATP) pada organisme. Proses respirasi yang sangat sensitif baik secara fisik maupun kimiawi terhadap zat lain. Hal ini akan mempengaruhi seluruh metabolisme dalam tubuh secara langsung ataupun tidak langsung. Kejadian inilah yang merupakan hal yang akan diamati pada percobaan ini.
Tujuan
Tujuan dari praktikum ini adalah :
1. Mengukur laju konsumsi oksigen ikan mas (Cyprinus carpio L.) dengan metode Winkler.
2. Mengukur frekuensi membuka menutupnya operkulum ikan mas(Cyprinus carpio L.).
3. Mengetahui pengaruh detergen yang terlarut dalam air terhadap laju konsumsi oksigen ikan
mas (Cyprinus carpio L.).
B.
Teori DasarPerkembangan pada hewan dan tumbuhan tidak terbatas pada morfogenesis dan diferensiasi saja, melainkan mencakup juga suatu peningkatan besarnya organisme tersebut yang disebut pertumbuhan. Dalam pertumbuhan suatu organisme, biasanya dapat dibedakan menjadi beberapa periode. Periode pertama adalah periode lamban dengan adanya sedikit pertumbuhan. Selanjutnya periode lamban diikuti oleh periode logaritmik atau periode eksponen. Pada saat inilah, pertumbuhan yang mula-mula lambat mulai menjadi cepat.
Ikan mengkonsumsi oksigen memamui insang yang kemudian dialirkan melalui sistem sirkulasi ke seluruh tubuh seperti tubuh bagian belakang, ginjal, saluran pencernaan, hati, dan tubuh bagian depan. Insang merupakan lipatan keluar dari permukaan tubuh terutama berfungsi untuk pertukaran gas. Luas permukaan insang labih luas daripada luas permukaan tubuh lainnya.
Sebagai medium respiratori, air memiliki keuntungan dan kerugian. Salah satu keuntungannya ialah air ikut mempertahankan kelembaban membran respiratori dan salah satu kekurangannya ialah air mengandung kensentrasi oksigen yang rendah dibandingkan udara. Semakin asin dan panas air, semakin berkurang konsentrasi oksigennya. Sebagai bentuk adaptasinya, insang haruslah sangat efisien untuk mendapatkan oksigen dari dalam air. Salah satu proses yang membantunya adalah ventilasi, yang merupakan peningkatan arus medium respiratori (dalam hal ini air) pada permukaan respiratori (insang). Ventilasi ini akan membawa pasokan oksigen dan menghilangkan karbon dioksida yang dikeluarkan oleh insang. Karena air lebih padat dan mengandung oksigen lebih sedikit daripada udara, ikan harus mengeluarkan energi lebih banyak untuk memventilasikan insangnya.
Pengaturan kapilaritas dalam insang ikan juga meningkatkan pertukaran gas. Darah mengalir berlawanan arah dengan arah air melewati insang. Jal ini akan memingkinkan untuk oksigen ditransfer ke darah oleh proses yang dinamakan pertukaran arus balik. Ketika darah mengalir melalui kapiler, makin banyak oksigen yang ditransfer. Proses ini dapat menyebabkan oksigen dalam air bisa terserap sebesar 80%-nya. Proses pertukaran arus balik ini juga penting dalam termoregulasi.
Pada ikan, peredaran darahnya tunggal, artinya darah hanya sekali melewati jantung dan disirkulasikan ke seluruh tubuh termasuk insang. Pada jantung, seluruhnya diisi dengan darah yang mengandung banyak CO2 dimana setelah dari jantung tersebut, darah langsung mengalir ke insang untuk mendapatkan pasokan oksigen dan pembuangan CO2. Skema peredaran oksigen oleh darah pada ikan digambarkan sebagai berikut :
Kenaikan kerja otot dan laju metabolisme berhubungan dengan pergerakan ikan akan menaikkan pengambilan O2 oleh insang dan meningkatkan penghantaran O2 ke jaringan. Kedua proses ini bisa dikatakan sebagai faktor pembatas dalam penentuan kemampuan pegerakan. Pada pergerakan yang berkelanjutan, pengambilan O2 dari air 12-15 kali lebih besar dibandingkan pada saat istirahat. Hal ini disebabkan kenaikan transfer O2 sebagai hasil dari kenaikan keluaran cadiac output dan ventilasi insang. Faktor lain, termasuk perubahan konduktansi difusi O2 pada insang juga berkontribusi pada pengambilan O2 pada insang dan pengaturan tekanan oksigen arteri, terutama pada kegiatan berenang cepat ketika waktu transit darah pada insang sangat menurun.
Pergerakan O2 melalui epitel respiratori insang dapat dirumuskan sebagai berikut :
MO2 = (KO2 . A . PO2 )/ E
Dimana KO2 adalah koefisien permeasi O2 (berhubungan dengan kapasitansi dan permeabilitas permukaan respiratori, A adalah luas permukaan respiratori yang fungsional, E adalah ketebalan barrrier difusi dan PO2 adalah gradien rata-rata tekanan parsial O2 antara darah dan air pada lingkungan. Faktor-faktor yang diketahui mempengaruhi beberapa atau semua variabel diatas adalah : catecholamine, perfusi insang dan ventilasi insang.
Pada saat instirahat, Catecholamines memiliki konsentrasi 10-9M, dan jumlah ini dapat meningkat
menjadi 2-3 kalinya pada dan setelah pergerakan. Beberapa percobaan menunjukkan bahwa kenaikan jumlah adrenalin (AD) akan meningkatkan MO2 dengan meningkatkan konduktansi difusi.
Pada pergerakan, cardiac output meningkat 3-5 kali terutama disebabkan kenaikan dari stroke volume selain kenaikan frekuensi denyut jantung. Kenaikan perfusi insang pada pergerakan diikuti dengan kenaikan rata-rata tekanan aorta dorsal dan ventral serta tekanan denyut. Perfusi insang meliputi :
1. Area permukaan dan jarak difusi
Pada saat instirahat, 60% lamela diperfusi, tetapi pada saat pergerakan dapat mencapai 100%. Hal ini terjadi karena penggabungan lamela distal dan dilatasi aktif dari arteriol aferen lamela.
2. Permeabilitas epitel
Permeabilitas epitel juga mempengaruhi perfusi insang.
Volume ventilasi insang meningkat ketika terjadi pergerakan sebagai hasil dari kenaikan kecil dari laju pernafasan dan perubahan besar dalam stroke volume. Kenaikan ventilasi dapat meningkatkan konduktansi difusi dengan mengurangi lapisan batas di sebelah lamela. Persentasi penggunaan O2 dari air yang mengalir melalui insang tidak menurun saat Vg meningkat, walaupun lam tinggalnya air dalam insang menurun secara drastis dari 250 ms pada saat istirahat ke 30 ms pada pegerakan bertempo tinggi. Pada pergerakan, PO2 membesar secara cepat sebagai hasil dari penurunan PvO2.
Variabel yang mempengaruhi transpor O2 diatas akan mempengaruhi fluks CO2 secara berlawanan. CO2 ini harus dikeluarkan dari dalam tubuh karena akan menyebabkan keracunan.
Keracunan CO2 merupakan suatu proses pengasaman darah (asidosis) yang merupakan terjadinya
reaksi yang menghasilkan asam karbonat secara berlebihan, dapat digambarkan sbb:
CO2(g)+ H2O(l) H2CO3(aq)
II.
Alat dan Bahan
Alat Bahan Wadah plastik Timbangan digital Gelas Beker Botol Winkler Erlenmeyer 3 L Pipet, buret dan statif
Ikan mas (Cyprinus carpio L.)
Detergen Air
Larutan Na2S2O3 Larutan H2SO4 pekat
Larutan KOH-KI Larutan MnSO4
III.
Cara Kerja
A. Pengambilan Sampel Air dan Penghitungan Jumlah Gerakan Operkulum
Pada percobaan ini digunakan erlenmeyer 3 L yang diisi air. Pada erlenmeyer dimasukkan seekor ikan mas hidup lalu kemudian erlenmeyer ditutup dengan gabus karet yang memiliki tiga keran yaitu keran untuk masuknya air(SM), keluarnya air(SK), dan keluarnya udara. Pada erlenmeyer dihilangkan udara yang tersisa dan keran tempat keluarnya udara ditutup. Selanjutnya dari SM dialirkan air masuk ke dalam erlenmeyer dan air yang keluar dari SK ditampung di botol Winkler lewat mulut botol. Pada penampungan ini diusahakan tidak terjadi gelembung atau percikan air. Selanjutnya botol Winkler ditutup tanpa adanya gelembung udara.
Lalu ujung saluran SM dan SK ditutup selama 30 menit dengan klep penjepit dimana selama itu gerakan operkulum ikan dihitung pada selang waktu 5 menit sebanyak 6 kali. Setelah penghitungan, SK dan SM dibuka kembali dan tanpa mengalirkan air melalui SM, air yang terdapat dalam erlenmeyer dikeluarkan dari SK dan ditampung kembali ke botol Winkler lewat mulut botol. Pada penampugnan ini diusahakan tidak ada gelembung udara atau percikan air. Selanjutnya botol Winkler ditutup tanpa adanya gelembung udara.
Kedua sampel air pada botol Winkler ini selanjutnya diproses kembali untuk mengukur kadar oksigennya dengan metode Winkler dan ikan yang diamati ditaruh ke tempat pemeliharaannya.
Pada percobaan ini digunakan dua ikan dimana ikan yang pertama dipelihara pada air yang berkomposisi normal dan ikan yang kedua dipelihara pada air yang mengandung detergen 10 ppm.
B. Titrasi Winkler
Botol Winkler tertutup yang telah berisi air sampel dari waktu awal (t=0) dan akhir (t=30’) masing-masing ditambahkan di bagian bawah permukaan dengan MnSO4 dengan pipet ukur sebanyak 1 ml. Lalu ditambahkan pula 1 ml KOH-KI. Selanjutnya botol Winkler dibolak-balik selama 5 menit agar O2 terikat sempurna.
Selanjutnya botol dibiarkan selama 15’ yaitu sampai endapan seluruhnya berada di dasar botol. Lalu 2 ml larutan di permukaan atas botol dibuang dan 1 ml H2SO4 pekat ditambahkan dengan menggunakan pipet ukur. Botol ditutup kembali dan dibolak-balik.
Larutan yang terjadi sebanyak 100 ml dipindahkan ke erlenmeyer 250 ml. Larutan dititrasi dengan larutan Na2S2O3 hingga warnanya kuning muda. Lalu ditambahkan amilum sebanyak 5 tetes dan titrasi dilanjutkan hingga larutan menjadi bening. Volume larutan Na2S2O3 yang terpakai dicatat. Titrasi Winkler dilakukan sebanyak dua kali dan volume larutan Na2S2O3 dirata-ratakan.
C. Pemeliharaan
Pada pemeliharaan, ikan pertama dipelihara dalam air yang memiliki komposisi normal sebagai kontrol. Ikan kedua dipelihara dalam air yang mengandung detergen 10 ppm. Cara pembuatan detergen 10 ppm adalah dengan menambahkan 0,01 gram detergen ke tiap liter air. Ikan setiap hari diperiksa. Bila airnya kotor, maka air diganti sesuai dengan perlakuan terhadap ikan. Setiap dua hari sekali berat badan diukur dan diberi makan sebesar 0,1 kali dari berat badannya. Setiap 4 hari sekali dilakukan lagi titrasi Winkler.
IV.
Pengamatan
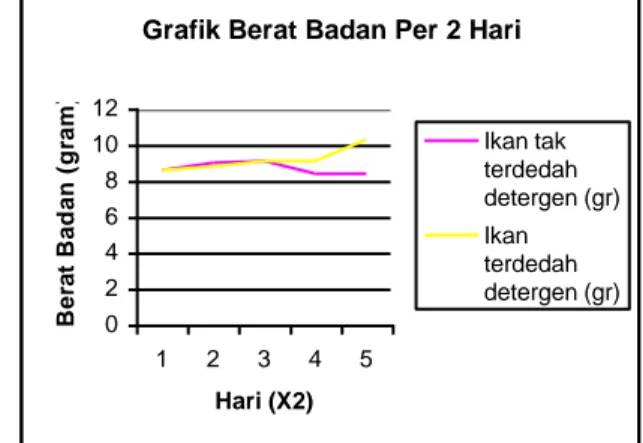
Pada awal percobaan dilakukan penimbangan berat ikan. Berat ikan yang ditimbang adalah sbb : Ikan tak terdedah
detergen (gr) Ikan terdedah detergen (gr) 8,6 8,6 9 8,8 9,1 9,1 8,4 9,1 8,4 10,3
Pada percobaan, ketika dimasukkan ikan ke dalam erlenmeyer, ikan tampak panik dan bergerak sangat lincah. Beberapa lama ikan sudah mulai tenang dan dapat dihitung jumlah gerakan
operkulumnya. Sebelum dihitung jumlah gerakan operkulum ikan, sampel air dalam tabung dikeluarkan melalui selang ke tabung Winkler dengan cara menambahkan air ke selang lain. Jumlah gerakan operkulum ikan beserta waktu pengamatan adalah sebagai berikut :
Ikan tidak terdedah detergen
Hari Jumlah gerakan operkulum
1 2 3 4 5 6
Hari I 148 146 154 148 140 145
Hari IV 143 145 145 121 141 132
Hari VIII 125 141 115 114 90 103
Ikan terdedah detergen
Hari Jumlah gerakan operkulum
1 2 3 4 5 6
Hari I 139 157 145 150 153 154
Hari IV 109 156 119 147 119 157
Hari VIII 150 151 121 103 163 127
Pada titrasi Winkler, ketika ditambahkan larutan MnSO4 dan KOH-KI tampak terjadi endapan berwarna coklat. Makin dikocok, jumlah endapan makin bertambah. Setelah didiamkan selama 15’ endapan sudah seluruhnya turun ke dasar botol. Setelah ditambahkan H2SO4 endapan langsung melarut kembali dan terbentuk larutan berwarna coklat. Setelah dititrasi dengan larutan Na2S2O3, warna larutan mulai pudar hingga menjadi warna kuning muda. Setelah ditambahkan amilum, warna larutan menjadi biru tua. Setelah dititrasi kembali dengan larutan Na2S2O3 warna kemudian menjadi pudar hingga menjadi bening. Dari sini didapatkan volume larutan Na2S2O3 yang digunakan. Data volume larutan Na2S2O3 beserta waktu pengamatan adalah sebagai berikut :
Hari Jumlah larutan Na2S2O3 yang digunakan dalam titrasi (ml)
Ikan yang tidak terdedah detergen Ikan yang terdedah detergen
T=0' T=30' T=0' T=30'
1 2 1 2 1 2 1 2
Hari I 2,75 3 3,1 2,9 4 3,75 2,5 2,45
Hari IV 2 2 2,1 2,1 2,2 2,2 2,1 2,1
Hari VIII 5 4,5 ; 3 4,7 2,7 ; 3 4 2,2 2,5 2,5
Pada pemeliharaan, didapatkan hasil yang kurang baik, dimana seekor ikan pada percobaan pertama hilang kemudian percobaan diulang dengan menggunakan dua ikan yang baru dan pada percobaan yang kedua ini, setelah selesai dilakukan penghitungan operkulum dan titrasi Winkler, ikan ditaruh dalam tempat pemeliharaan dan tak lama kemudian seekor ikan terlihat lemas dan mati. Selanjutnya pada waktu itu juga, digunakan seekor ikan baru sebagai pengganti ikan yang mati.
V. Perhitungan
1. Konsumsi O2 : Hari I :
QO2 ikan terdedah detergen = 2 (1,4) x 0,698 x (3-0,01) / (8,6x1/2) = 1,36 ml.O2/gr/jam
QO2 ikan tidak terdedah detergen = 2 (0,125) x 0,698 x (3-0,01) / (8,6x1/2) = 0,121 ml.O2/gr/jam
Hari II :
QO2 ikan terdedah detergen = 2 (0,1) x 0,698x (3-0,01) / (9,1x1/2) = 0,0917 ml.O2/gr/jam QO2 ikan tidak terdedah detergen = 2 (0,1) x 0,698x (3-0,01) / (9,1x1/2) = 0,0917 ml.O2/gr/jam
Hari III :
QO2 ikan terdedah detergen = 2 (0,6) x 0,698x (3-0,01) / (10,3x1/2) = 0,486 ml.O2/gr/jam QO2 ikan tidak terdedah detergen = 2 (0,9) x 0,698 x (3-0,01) / (8,4x1/2) = 0,894 ml.O2/gr/jam
2. Rata-rata gerakan operkulum : Hari I :
Rata-rata gerakan operkulum ikan tidak terdedah oksigen = (148+146+154+148+140+145)/6 = 146,33 Rata-rata gerakan operkulum ikan terdedah oksigen = (139+157+145+150+153+154)/6 = 149,67
Hari II :
Rata-rata gerakan operkulum ikan tidak terdedah oksigen = (143+145+145+121+141+132)/6 = 137,83 Rata-rata gerakan operkulum ikan terdedah oksigen = (109+156+119+147+119+157)/6 = 134,5
Hari III :
Rata-rata gerakan operkulum ikan tidak terdedah oksigen = (125+141+115+114+90+103)/6 = 114,67
Rata-rata gerakan operkulum ikan terdedah oksigen = (150+151+121+103+163+127)/6 = 135,83
VI. Pembahasan
Percobaan dengan metode Winkler bertujuan untuk menghitung konsumsi O2 pada hewan akuatik dengan cara mengisolasi hewan tersebut ke dalam tabung yang konsentrasi O2 awal dan konsentrasi O2 pada saat yang ditentukan diketahui. Cara mengetahui konsentrasi O2 tersebut ialah dengan mereaksikan O2 terlarut dalam air dengan MnSO4 dan KOH-KI untuk mengikatnya kemudian dilakukan titrasi dengan Na2S2O3 untuk mengetahui konsentrasinya I2 yang dihasilkan dari reaksi yang pertama. Reaksi kimia yang terjadi secara lengkap dapat digambarkan sebagai berikut :
MnSO4 + 2 KOH Mn(OH)2 + K2SO4 Mn(OH)2 + O2 MnO(OH)2 MnO(OH)2 + 2 KI MnSO4 + K2SO4 + I2
2 Na2S2O3 + I2 Na2S4O6 + 2 NaI
Variabel yang diukur pada percobaan adalah meliputi : Berat badan, laju konsumsi oksigen, gerakan operkulum. Pada percobaan ini dilakukan pertama kali adalah penimbangan berat badan. Pada penimbangan berat badan ini, terjadi fluktuasi yang terlihat sebagai berikut :
Grafik Berat Badan Per 2 Hari
0 2 4 6 8 10 12 1 2 3 4 5 Hari (X2) B e ra t B a d a n ( g ra m ) Ikan tak terdedah detergen (gr) Ikan terdedah detergen (gr)
Fluktuasi yang terjadi ini mungkin disebabkan terjadinya kesalahan pada saat penimbangan, dimana pada pemindahan ikan, air yang berasal dari tempat pemeliharaan juga ikut terambil dan tertimbang. Selain itu mungkin memang terjadi perubahan berat secara alami, dimana ikan yang terdedah detergen beratnya bertambah sedangkan ikan yang tidak terdedah detergen beratnya berkurang. Berat badan disini juga mempengaruhi laju konsumsi oksigen total ikan tersebut. Makin berat ikan, makin besar laju konsumsi oksigen totalnya.
Pada pekerjaan selanjutnya dilakukan pengambilan sampel air dan penghitungan jumlah gerakan operkulum. Pada persiapannya, air yang dimasukkan ke dalam erlenmeyer 3 L harus sudah tidak mengandung gelembung udara lagi, begitu juga saat penutupan erlenmeyer dengan sumbat, tidak boleh ada gelembung udara. Hal ini disebabkan gelembung udara ini masih mengandung oksigen yang mungkin akan berdifusi ke air sehingga akan mengganggu pengukuran. Pada pengambilan
sampel air ini, awalnya ikan terlihat panik dan gelisah yang terlihat dari gerakannya yang sangat lincah. Saat terjadi hal ini, sampel air tidak diambil terlebih dahulu karena pada ikan yang gelisah dan gerakannya berlebihan, maka laju konsumsi O2-nya akan meningkat dan kita hanya akan mengamati laju konsumsi O2 pada saat normal saja. Pada saat ikan tenang, mulailah sampel air diambil dengan cara penambahan air pada selang SM dan menampung air yang keluar dari selang SK ke tabung Winkler. Sama seperti persiapan alat, pada tabung Winkler ini juga tidak boleh ada gelembung udara didalamnya.
Selanjutnya dihitung gerakan operkulum ikan selama 6 X 5 menit. Dari hasil didapatkan grafik sebagai berikut :
Rata-Rata Gerakan Operkulum Per 5 Menit 0 50 100 150 200 1 2 3 Hari J u m la h G e ra k a n o p e rk u lu m Ikan tidak terdedah detergen Ikan terdedah detergen
Dari grafik didapatkan pada ikan terdedah detergen gerakan operkulumnya cenderung menurun lebih lambat dibandingkan pada ikan yang tidak terdedah detergen. Hal ini sesuai dengan yang seharusnya, dimana ikan yang terdedah detergen, operkulumnya akan bergerak lebih cepat dibandingkan dengan ikan yang tidak terdedah detergen. Hal ini disebabkan pada air yang mengandung detergen, kandungan oksigennya lebih sedikit, sehingga untuk mengambil oksigen dengan volume yang sama pemompaan air masuk ke insang harus lebih banyak. Penyimpangan yang mungkin terjadi ialah kesalahan pengamatan, dimana gerakan operkulum ikan sangat sulit diamati, terutama bila ikan sedang banyak bergerak.
Selanjutnya dilakukan pengambilan sampel air yang kedua, yaitu 30 menit sesudah pengambilan sampel air pertama. Pada pengambilan sampel air ini tidak ditambahkan air lagi ke dalam erlenmeyer. Hal ini disebabkan penambahan air yang segar (baru) akan menambahkan kandungan oksigen terlarut sehingga mengganggu pengukuran. Dari sini didapatkan dua sampel air yang akan dihitung kadar O2 terlarutnya dengan titrasi Winkler.
Pada titrasi Winkler, yang pertama ialah penambahan MnSO4 dan KOH-KI. Dari sini akan dihasilkan MnSO4, K2SO4, I2. I2 inilah yang akan dititrasi dengan Na2S2O3 yang akan menghasilkan NaI dan Na2S4O6. Penambahan amilum pada tepat sebelum akhir titrasi dimaksudkan untuk memudahkan pengamatan dimana warna kuning muda menjadi biru tua yang lebih kontras warnanya. Dari titrasi Winkler ini didapatkan jumlah volume Na2S2O3 yang dititrasi dan dua kali volume ini ekivalen dengan kadar oksigen terlarut dalam air(mg/L air) atau a mg/L X 0,698 = ml O2/ L air. Dari titrasi ini didapatkan selisih kandungan oksigen awal dengan kandungan oksigen akhir yang merupakan laju konsumsi oksigen total ikan. Setelah mendapatkan nilai laju konsumsi total, untuk menghitung laju konsumsi spesifiknya, nilai laju konsumsi total ini dibagi dengan berat badan ikan.
Dari data yang didapatkan, ada beberapa data yang tidak valid dimana jumlah oksigen terlarut pada awal lebih sedikit daripada jumlah oksigen terlarut pada akhir. Hal ini berarti jumlah oksigen dalam air malah bertambah. Data ini yaitu data ikan yang tidak terdedah oksigen hari I dan hari IV. Hal ini mungkin disebabkan penggunaan alat yang tidak selalu sama, terutama pada titrasi dimana tabung titrasi yang digunakan tidak berskala sama. Dengan masih memasukkan data yang tidak valid, didapatkan grafik sebagai berikut :
Laju Konsumsi Spesifik 0 0,5 1 1,5 I IV VIII Hari L a ju K o n s u ms i S p e s if ik ( ml O 2 /k g b b /j a m ) Ikan tidak terdedah detergen Ikan terdedah detergen
Dari grafik ini, dapat dilihat bahwa ikan yang terdedah detergen, walaupun grafiknya sempat turun, tetap laju konsumsi O2 spesifiknya meningkat kembali.
VII. Kesimpulan
1. Titrasi Winkler merupakan metode untuk mengukur laju konsumsi O2 hewan akuatik dengan cara menghitung kadar O2 terlarut pada air saat awal dan akhir percobaan.
2. Laju konsumsi O2 spesifik ikan pada air yang komposisinya normal adalah 0,894 ml O2/gram bb/jam.
3. Pada ikan terdedah detergen, laju gerakan operkulumnya meningkat dibandingkan dengan ikan pada air yang berkomposisi normal.
4. Detergen akan meningkatkan laju konsumsi O2 spesifik ikan.
VIII. Daftar Pustaka
1.
Campbell, N. A, 1996. Biology 4th ed. Addison Wesley Longman. Singapore.2.
Gilles, R. 1984. Circulation, Respiration, and Metabolism : Current Comparative Approaches.Springer Verlag. New York.