MODUL 05
SPEKTRUM ATOM dari DUA ELEKTRON : He, Hg
Indah Darapuspa, Rizky Budiman,Tisa I Ariani, Taffy Ukhtia P, Dimas M Nur10211008, 10211004, 1021354, 10213074, 10213089 Program Studi Fisika, Institut Teknologi Bandung, Indonesia
E-mail: darapuspa.indah@gmail.com Asisten: Retno Dwi Wulandari / 10212069
Tanggal Praktikum: 11-11-2015
Abstrak
Setiap atom memiliki spektrum tertentu. Hg dan He merupakan atom yang memiliki jumlah elektron terluarnya adalah dua. Transisi optik atom He dan Hg dapat ditentukan melalui spektrumnya. Untuk menentukan spektrum atom, maka dirancang percobaan dengan menggunakan metode grating. Tujuan dari eksperimen ini adalah memahami proses difraksi pada celah banyak menggunakan metode grating, memahami prinsip kerja lampu He dan Hg, memahami spetrum emisi lampu He dan Hg untuk kemudian hasilnya dapat digunakan untuk menentukan panjang gelombang dari spektrum Hg dan He serta jenis atom berdasarkan spektrumnya. Hasil percobaan diperoleh nilai panjang gelombang spektrum, energi transisi, berserta transisinya. Atom yang tidak diketahui dengan mencocokan spektrumnya maka atom tersebut adalah
Kata kunci: eksitasi, spektrum, transisi I. Pendahuluan
Pada percobaan ini kita akan mengamati difraksi pada celah banyak menggunakan metode grating, memahami prinsip kerja lampu He dan Hg, spektrum emisi lampu He dan Hg. Hasil percobaan diperoleh nilai panjang gelombang spektrum, energi transisi, dan transisinya yang kemudian digunakan untuk menentukan panjang gelombang spektrum He dan Hg serta jenis atom berdasar spektrumnya.
Spektrum elektromagnetik adalah susunan semua bentuk gelombang elektromagnetik berdasarkan panjang gelombang dan frekuensinya. Tetapi spektrum elektromagnetik ini tidak hanya cahaya tampak, ada juga gelombang radio, gelombang mikro, sinar inframerah, sinar UV (Ultra Violet), sinar-X, sinar Gamma [1].
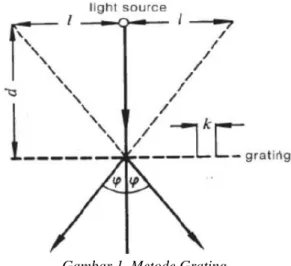
Difraksi grating meripakan salah satu alat yang digunakan untuk memisahkan spektrum cahaya[2]. Difraksi grating adalah metode yang sangat berguna untuk pemisahan garis spektrum yang terkait dengan transisi atom. Panjang gelombang spektrum dapat dihitung menggunakan persamaan berikut :
𝜆 = 𝑘𝐿
𝐿2+𝑑2... (1) Keterangan :
λ : Panjang gelombang (nm)
k : Konstanta grating (1/6000 garis/cm) L : Jarak dari pusat ke terang (kanan/kiri) d : Jarak antara pengamatan dan lampu (cm)
Gambar 1. Metode Grating
Sumber cahaya yang dihasilkan pada lampu merupakan bentuk konsekuensi dari proses eksitasi elektron dari keadaan eksitasinya E1 menuju keadaan dasarnya E0. Proses eksitasi disertai dengan emisi foton dengan panjang gelombang :
𝜆 = ∆𝐸 ℎ𝑐...(2) dengan ∆𝐸 = 𝐸𝑓 − 𝐸𝑖 ...(3) Keterangan : λ : Panjang gelombang (nm) ΔE : Selisih energi (eV) Ef : Energi awal (eV) Ei : Energi akhir (eV)
h : Konstanta Planck (6,63x10-34 J/s) c : Kecepatan cahaya (3x108 m/s)
Berbeda dengan model atom Hidrogen, untuk kasus transisi optik pada atom He dan Hg melibatkan jumlah elektron lebih dari satu. Probabilitas paling tinggi eksitasi dan absorbsi terjadi pada elektron terluar dari atom. Energi ikat elektron terluar memiliki nilai yang lebih kecil daripada energi elektron di dalamnya sehingga lebih mudah melakukan transisi optik pada elektron terluar.
Pada kasus percobaan kali ini, gas Helium pada lampu memiliki kontribusi dua elektron disetiap atomnya. Percobaan kali ini dilakukan untuk menentukan spektrum dari atom Hg dan He. Serta menentukan lampu atom tertentu dengan hanya mengetahui spektrumnya.
II. Metode Percobaan
Percobaan dilakukan dengan menggunakan metode Grating. Perlengkapan disusun sedemikian rupa sehingga sumber cahaya mengenai lensa grating dan kemudian dapat diamati pola difraksi dengan mata secara langsung pada bangku optik ditempatkan di dekat lensa. Serta jarak spektrum hasil pola difraksi dapat diukur menggunakan penggaris.
Gambar 2. Skema penyusunan alat pada percobaan
Pertama, lampu diberi tegangan hingga menyala dengan tegangan maksimal 5 kV. Pemberian tegangan dilakukan secara perlahan. Untuk setiap lampu, akan teramati pola difraksi (spektrum) dari lampu tersebut. Panjang gelombang spektum dihitung melalui persamaan 1, dengan L ditentukan melalui jarak dua spektrum dibagi dua (kiri dan kanan). Nilai d ditentukan dengan mengukur jarak lensa grating ke penggaris.
Percobaan ini dilakukan untuk 3 lampu yaitu lampu Hg(merkuri), lampu Helium dan lampu X (jenisnya tidak dikatehui) dengan masing-masing lampu diberi 3 variasi jarak d, yaitu pada 40 cm, 50 cm dan 60 cm. III. Data dan Pengolahan
a. Percobaan lampu Hg (merkuri), Lampu He dan Lampu X (jenisnya tidak diketahui)
- Lampu Hg
Pemberian tegangan = 0,6 kVolt
Tabel 1. Warna yang dihasilkan dari variasi jarak pengamatan untuk lampu Hg (merkuri) dengan
variasi d =40 cm, 50cm dan 60 cm d = 40 cm Warna L (cm) kanan kiri Merah 255 - Kuning 181 270 Hijau 167 252 Ungu 123 209 d = 50 cm Warna L (cm) kanan kiri Kuning 221 312 Hijau 205 297 Biru 153 242 Ungu 134 225 d = 60 cm Warna L (cm) kanan kiri Merah 340 428 Kuning 262 352 Hijau 243 330 Biru 180 265 Ungu 168 246 - Lampu Helium
Pemberian tegangan = 0,6 kVolt
Tabel 2. Warna yang dihasilkan dari variasi jarak pengamatan untuk lampu Helium dengan variasi
d =40 cm, 50cm dan 60 cm d = 40 cm Warna L (cm) kanan kiri Merah 233 305 Kuning 204 270 Hijau 164 240 Biru 157 235 Ungu 140 219
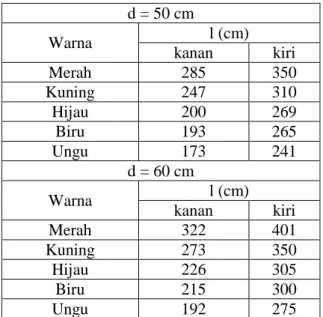
d = 50 cm Warna l (cm) kanan kiri Merah 285 350 Kuning 247 310 Hijau 200 269 Biru 193 265 Ungu 173 241 d = 60 cm Warna l (cm) kanan kiri Merah 322 401 Kuning 273 350 Hijau 226 305 Biru 215 300 Ungu 192 275
- Lampu X (jenisnya tidak diketahui) Pemberian tegangan : 240 Volt
Tabel 3. Spektrum warna yang dihasilkan dari variasi jarak pengamatan untuk lampu X yang
jenisnya tidak diketahui d = 40 cm Warna l (cm) kanan kiri Merah 217 220 Hijau 167 180 Biru 141 171 Ungu 135 155 d = 50 cm Warna l (cm) kanan kiri Merah 250 245 Hijau 192 198 Biru 176 190 Ungu 163 175 d = 60 cm Warna l (cm) kanan kiri Merah 296 286 Hijau 229 225,5 Biru 214 218 Ungu 194 200
b. Spektrum lampu Hg (merkuri), Lampu He dan Lampu X (jenisnya tidak diketahui)
- Lampu Hg(merkuri)
Tabel 4. Spektrum Lampu Hg (merkuri) untuk jarak d = 40cm
Warna λ(nm) ΔE (eV) Transisi Merah 895.9289 1.3858 5p – 2s
Kuning 818.4803 1.5169 5p – 2s
Hijau 773.276 1.6056 5p – 2s
Biru 0 0
0
Ungu 638.8389 1.9434 5p – 2s
Tabel 5. Spektrum Lampu Hg(merkuri) untuk jarak d = 50cm
Warna λ(nm) ΔE (eV) Transisi
Merah 0 0 0
Kuning 783.932 1.5837 5p – 2s
Hijau 747.7383 1.6604 5p – 2s
Biru 612.2971 2.0277 5p – 2s
Ungu 563.1436 2.2046 5p – 2s
Tabel 6. Spektrum Lampu Hg(merkuri) untuk jarak d = 60cm
Warna λ(nm) ΔE (eV) Transisi Merah 898.4228 1.3819 5p – 2s Kuning 759.1719 1.6354 5p – 2s Hijau 718.161 1.7288 5p – 2s Biru 579.4934 2.1424 5p – 2s Ungu 543.5606 2.2841 5p – 2s - Lampu Helium
Tabel 7. Spektrum Lampu He untuk jarak d = 40cm
Warna λ(nm) ΔE(eV) Transisi Merah 930.0781 1.3349 5p – 2s
Kuning 849.5724 1.4614 5p – 2s
Hijau 751.301 1.6525 5p – 2s
Biru 733.3587 1.6929 5p – 2s
Ungu 682.3601 1.8195 5p – 2s
Tabel 8. Spektrum Lampu He untuk jarak d = 50cm
Warna λ (nm) ΔE(eV) Transisi Merah 893.4265 1.3896 5p – 2s
Kuning 811.0115 1.5308 5p – 2s
Hijau 707.6991 1.7543 5p – 2s
Biru 694.0071 1.7889 5p – 2s
Tabel 9. Spektrum Lampu He untuk jarak d = 60cm
Warna λ (nm) ΔE(eV) Transisi Merah 860.1157 1.4434 5p – 2s Kuning 767.9508 1.6167 5p – 2s Hijau 674.4218 1.8409 5p – 2s Biru 657.3023 1.8888 5p – 2s Ungu 604.4518 2.054 5p – 2s - Lampu X
Tabel 10. Spektrum Lampu X untuk jarak d = 40cm
Warna λ(nm) ΔE(eV) Transisi Merah 798.9834 1.5539 5p – 2s
Hijau 663.2154 1.872 5p – 2s
Biru 605.5755 2.0502 5p – 2s
Ungu 567.9989 2.1858 5p – 2s
Tabel 11. Spektrum Lampu X untuk jarak d = 50cm
Warna λ(nm) ΔE(eV) Transisi Merah 739.3753 1,6792 5p – 2s
Hijau 605.5755 2.0502 5p – 2s
Biru 572.8379 2.1673 5p – 2s
Ungu 533.6731 2.3264 5p – 2s
Tabel 12. Spektrum Lampu X untuk jarak d = 60cm
Warna λ(nm) ΔE(eV) Transisi Merah 727.3065 1.707 5p – 2s
Hijau 590.3268 2.1031 5p – 2s
Biru 564.5324 2.1992 5p – 2s
Ungu 519.9152 2.388 5p – 2s
c. Tabel Referensi
Tabel 13. Referensi Lampu Hg (merkuri) Warna λref (nm) [4] ΔE (eV) Transisi Kuning 576.9 5p – 2s Hijau 546.074 5p – 2s Biru 435.835 5p – 2s Ungu 404.6 5p – 2s
Tabel 14. Referensi Lampu Helium Warna λref (nm) [4] ΔE (eV) Transisi Merah 667.8 5p – 2s Kuning 587.5 5p – 2s Hijau 504.7 5p – 2s Biru 492.1 5p – 2s Ungu 447.1 5p – 2s
Tabel 15. Referensi Lampu X Warna λref (nm) ΔE (eV) Transisi Merah 667.8 5p – 2s Hijau 504.7 5p – 2s Biru 492.1 5p – 2s Ungu 447.1 5p – 2s IV. Pembahasan
Difraksi grating menggunakan lensa khusus, lensa grating, yang merupakan lensa yang diberi geratan tak tembus cahaya. Sehingga bagian yang tembus cahaya berperan seperti sebagai celah pada kisi. Lensa grating yang digunakan memiliki 600 goresan/cm. Setiap bagian lensa yang tidak digores (yang mentransmisikan cahaya) berperan sebagai sumber cahaya baru yang koheren. Hal ini disebut prinsip Huygens. Sehingga akan membentuk pola difraksi yang dapat teramati. Pola difraksi diamati langsung dengan posisi mata dekat dengan grating. Bila diletakkan penggaris didepan lensa (dibelakang sumber cahaya) maka pengamat dapat mengamati proyeksi pola difraksi pada penggaris. Gambar 1 menunjukan konfigurasi gratting.[2]
Hasil percobaan dibandingkan dengan referensi berbeda. Hasil percobaan diperoleh panjang gelombang dengan nilai mendekati 1/3 panjang gelombang referensi. Perbedaan hasil ini dipengaruhi oleh kekonsistenan pengamat dalam mengamati pola grating. Saat percobaan sangat mungkin posisi mata pengamat tidak tetap. Selain itu, penempatan penggaris kurang horizontal (miring). Sehingga nilai L yang diperoleh akan lebih besar dari seharusnya. Namun, faktor tersebut tidaklah menyebabkan kesalahan yang besar, sedangkan hasil percobaan diperoleh nilai panjang gelombang hanya hampir 1/3 panjang gelombang referensi. Sehingga, kemungkinan spektrum yang teramati berada pada orde 3. Persamaan yang digunakan untuk menghitung panjang gelombang adalah pada orde 1 (n = 1). Apabila n=3 maka diperoleh panjang gelombang yang mendekati dengan panjang gelombang referensi.
Transisi elektron dari tingkat energi tinggi ke tingkat energi yang lebih rendah menyebabkan adanya energi yang diradiasikan (berupa cahaya). Untuk variasi perubahan tingkat energi memberikan
pemancaran gelombang elektromagnetik berbeda (panjang gelombang yang berbeda). Setiap panjang gelombang ini adalah spektrum dari sebuah atom. Setiap jenis atom memiliki jumlah elektron yang berbeda beda maka transisi elektronya berbeda-beda. Variasi perubahan tingkat energinya pun berbeda-beda. Pada akhirnya setiap atom memiliki spektrum yang berbeda-beda.
Berdasarkan teori kuantum, untuk fungsi keadaan elektron pada sebuah atom direpresentasikan oleh fungsi fungsi keadaan dengan label bilangan kuantum n , l ,m , dan s. Untuk menentukan energi dari setiap keadaan, maka dikerjakan operator Hamiltonian pada fungsi keadaan. Untuk kasus model atom hidrogen diperoleh nilai eigen energi dari operator hamiltoniannya adalah 𝐸𝑛 = − 𝑚 𝑒4 32𝑥2𝜖 𝑜2ℏ2 1 𝑛2 = 𝐸1 𝑛2 ...(4) Akibat energi terkuantisasi maka ketika terjadi transisi elektron, elektron akan menyerap/meradiasi energi sebesar perubahan energinya. Yaitu ΔE = Ef − Ei untuk kasus eksitasi elektron dari tingkat energi lebih tinggi ke tingkat energi lebih rendah akan memancarkan radiasi/cahaya dengan energi sebesar hf atau hc /λ maka panjang gelombang yang dipancarkan adalah pada persamaan 2. untuk atom secara umum, transisi keadaan elektron akan memberikan delta E yang berbeda-beda sesuai proses transisinya. Pada akhirnya menghasilkan cahaya dengan panjang gelombang tertentu. Karakteristik ini yang kemudian diambil sebagai spektrum atom.
Simbol S, P, D, F, G, H, I, dan seterusnya, merupakan Term Symbol [3]. Term symbol ini merepresentasikan momentum angular dari interaksi dua buah elektron. Angka superscript sebelum simbol mewakili jumlah multiplikasi state (keadaan) dengan nilai 2S + 1, dengan S merupakan bilangan kuantum spin. Sedangkan subscript setelah simbol merupakan bilangan kuantum momentum angular total. Misal 2P1 maka bilangan kuantum momentum angularnya L = 1. Bilangan kuantum spin S = ½, dan nilai momentum angular totalnya adalah J = 1. pada kasus atom He dan atom Hg, interaksi dua elektron terluarnya membentuk singlet dan triplet. Artinya terjadi multiplikasi state singlet (1) dan triplet (3) sehingga nilai superscript sebelum simbol termnya adalah 1
dan 3, bilangan kuantum spin S nya adalah 0 dan 1.
Transisi yang terjadi pada keadaan elektron, tidak sembarang pindah ke keadaan tingkat energi ke tingkat energi lainnya. Namun, ada suatu state yang apabila transisi ke state tertentu akan memberikan nilai probabilitas nol (tidak mungkin). Transisi hanya dapat terjadi apabila Δ S=0 dan Δ L=0,•}1. Aturan ini disebut Selection Rule.[5]
Lampu yang tidak diketahui tersebut, dengan membandingkan dengan referensi didapat atom Helium[4]. Terlihat pula beberapa kemiripan pada tabel 2 dan 3.
Efek Zeeman adalah spliting spektrum akibat adanya medan magnet luar. Apabila ada medan magnet luar, maka akan mempengaruhi momentum sudut (orbital) pada elektron sehingga memberikan nilai energi yang sedikit berbeda saat transisi. Sehingga spektrum terspliting menjadi 3 bagian.
Fine structure adalah kelompok garis yang diamati dalam spektrum unsur-unsur tertentu, seperti hidrogen dan helium, disebabkan oleh berbagai coupling dari bilangan kuantum azimut dan bilangan kuantum momentum sudut. Adanya pemisahan garis spektrum utama atom menjadi dua atau lebih komponen, masing-masing mewakili panjang gelombang yang berbeda. Fine structure dihasilkan ketika sebuah atom memancarkan cahaya saat transisi dari satu tingkat energi ke tingkat energi yang lain. Garis pembagi fine structure muncul dari interaksi gerakan orbital elektron dengan mekanika kuantum spin elektron. Tingkat energi dari setiap unsur yang diberikan adalah terkuantisasi (yaitu hanya tingkat energi diskrit yang tersedia) spektrum optik muncul sebagai rangkaian garis bukannya spektrum kontinu. Dengan setiap baris mengaitkan tiga bilangan yaitu, n (bilangan kuantum utama), l (bilangan kuantum azimut) dan j (bilangan kuantum momentum sudut).
Konsep fine structure lebih berpengaruh pada percobaan ini.
V. Kesimpulan
Hasil percobaan diperoleh nilai panjang gelombang spektrum Hg dan He pada tabel 1,2, dan 3, beserta energi transisi dan transisinya pada tabel 4-12.
Lampu yang tidak diketahui jenisnya dicocokkan dengan spektrum berdasarkan referensi didapatkan bahwa lampu tersebut adalah lampu He.
VI. Pustaka
[1] Kasuwendi, Gunawan. 2013. Analisa Spektrum Cahaya Menggunakan Metode Grating Berbasis Mikrokontroler AVR. Jurusan Teknik Elektro, Fakultas Teknik, Universitas Kristen Maranatha.
[2]Diffraction Grating. url :
http://hyperphysics.phyastr.gsu.edu/h base/phyopt/grating.html. (diakses 13 November 2015)
[3] A. Beiser. Concept of Modern Physics 6th Edition. 2003. McGraw-Hill
[4] Atomic Spectra. url:
http://hyperphysics.phyastr.gsu.edu/h base/quantum/atspect.html#c1 (diakses 13 November 2015) [5]Project PHYSNET. Physics Blog.
Michigan State Univeristy. http://www.physnet.org/modules/pdf _modules/m316.pdf