77
Penyebaran Polen Berdasarkan Analisis SSR Membuktikan Penyerbukan
Kelapa Dalam Kalianda Normal Ke Kopyor
Pollen Dispersal Based on SSR Analysis Proves Kalianda
to Kopyor Coconut Pollinations
SITI HALIMAH LAREKENG1,2, ISMAIL MASKROMO1,3, AGUS PURWITO1, NURHAYATI ANSHORI MATTJIK1 DAN SUDARSONO SUDARSONO1
1PMB Laboratorium Departemen Agronomi dan Hortikultura, Fakultas Pertanian IPB Bogor 2Fakultas Kehutanan, Universitas Hasanuddin, Makasar
3Balai Penelitian Tanaman Palma, Manado
Jalan Meranti, Kampus IPB Darmaga, Bogor 16680, Jawa Barat, INDONESIA
E-mail: s_sudarsono@ymail.com Diterima 26 Januari 2015 / Direvisi 26 Maret 2015 / Disetujui 10 Mei 2015
ABSTRAK
Analisis paternitas digunakan untuk mengetahui pola penyebaran serbuk sari pada kelapa (Cocos nucifera L.) tipe Dalam Kalianda. Tujuan penelitian ini adalah untuk (1) mengevaluasi pola penyebaran serbuk sari dan menentukan kisaran jarak penyebaran serbuk sari pada kelapa tipe Dalam Kalianda, (2) menentukan persentase penyerbukan silang (outcrossing) dan penyerbukan sendiri (selfing) yang terjadi pada kelapa tipe Dalam Kalianda, dan (3) menentukan frekuensi pola penyerbukan silang antara kelapa tipe Dalam normal (N) dengan kelapa Dalam Kopyor (K), KxN dan KxK yang terjadi pada populasi campuran antara kelapa tipe Dalam Kopyor dan kelapa Dalam normal Kalianda. Populasi yang digunakan terdiri atas 60 pohon kelapa tipe Dalam dewasa, 21 pohon merupakan kelapa tipe Dalam berbuah normal (homozigot KK) dan 39 merupakan pohon kelapa tipe Dalam Kopyor (heterosigot Kk). Empat belas pohon (5 pohon KK dan 9 pohon Kk) digunakan sebagai tetua betina. Sebanyak 49 progeni dipanen dari 15 induk terpilih dan dikecambahkan untuk sumber DNA dalam analisis paternitas. Enam lokus marka SSR polimorfik, yaitu CnCir_B12, CnCir_86, CnCir_87, CnCir_56, CnZ_51, CnZ_18 dan empat lokus marka SNAP polimorfik, yaitu CnSUS1#14,CnSUS1#3, CnWRKY6#3 dan CnWRKY19#1 digunakan untuk menentukan genotipe seluruh progeni, seluruh kandidat tetua jantan, dan semua tetua betina yang digunakan. Hasil penelitian menunjukkan bahwa serbuk sari kelapa tipe Dalam Kalianda menyebar dengan jarak terjauh 63 m. Jarak penyebaran serbuk sari terbanyak pada jarak 40-50 m, dengan frekuensi sebesar 13 kejadian polinasi (27%). Dari 47 progeni yang dievaluasi, hanya satu (2%) progeni yang berasal dari penyerbukan sendiri (self pollination) dan 48 (98%) berasal dari penyerbukan silang. Dari progeni hasil penyerbukan silang, 24 (49,0%) progeni teridentifikasi sebagai hasil persilangan antara induk dan tetua jantan kelapa tipe Dalam kopyor heterosigot Kk, 11 (22,4%) sebagai hasil persilangan antara induk kelapa tipe Dalam Kopyor heterosigot Kk dan normal homosigot KK, 10 (20,5%) sebagai hasil persilangan antara induk kelapa tipe Dalam normal homosigot KK dan Kopyor heterosigot Kk, serta 3 (6,1%) sebagai hasil persilangan antara induk dan tetua jantan tipe Dalam normal homosigot KK.
Kata kunci : Kelapa Dalam Kopyor, kelapa Kopyor Kalianda, tingkat penyerbukan sendiri, tingkat penyerbukan silang.
ABSTRACT
Paternity analysis was applied to determine the pattern of pollen spread among Kalianda Tall coconut (Cocos nucifera L.) in Kalianda, Lampung. The objectives of this research are to (1) evaluate patterns of pollen dispersal and ranges of pollen spread, (2) determine percentage of outcrossing or selfing rates, and (3) determine the frequency of cross pollination among normal (N) to kopyor (K), KxN and KxK in the mix population of Kalianda Tall coconut at Kalianda, Lampung. The population used in this study was 60 palms, consisted of 21 Kalianda Tall Normal coconuts (homozygous KK) and 39 Kalianda Tall Kopyor coconuts (Heterozygous Kk). Fourteen palms out of those were selected as female parents. Progeny arrays (49 nuts) were harvested from 15 female parents and they were germinated. The DNA was isolated from young leaf of all adult palms and germinated coconut seedlings and they were used in paternity analysis. Six polymorphic SSR marker loci used were CnCir_B12, CnCir_86, CnCir_87, CnCir_56, CnZ_51, CnZ_18 and the four polymorphic SNAP markers used were CnSUS1#14, CnSUS1#3, CnWRKY6#1 and CnWRKY19#3. The markers were used to genotype all the progenies, the potential male and the female parents. Results of the experiment indicated pollen of Kalianda Tall Kopyor coconut farthest disperse was 63 m. Distance of the mostpollen dispersal was between 40-50 m,with the frequency of 13 pollination events (27%). Among the evaluated progenies, only one (2%) comes from self pollination event and 48 (98%) comes from cross pollination. Results of the progeny evaluation also indicated 24 progenies (49.0%) are results of outcrossing among Kalianda Tall kopyor heterozygous Kk parents, 11 progenies (22.4%) are outcrossing among kopyor heterozygous Kk female and normal homozygous KK male parents, 10 progenies (20.5%) are outcrossing among normal homozygous KK female and kopyor heterozygous Kk male parents, and 3 progenies (6.1%) are outcrossing among normal homozygous KK female and male parents.
78
PENDAHULUAN
Kelapa kopyor merupakan komoditas andalan yang bernilai ekonomi tinggi dan di-cirikan oleh endosperm (daging buah) yang ber-tekstur gembur, sebagian besar terlepas dari tem-purungnya dan mempunyai rasa yang gurih. Kelapa berbuah kopyor adalah kelapa mutan yang ditemukan di antara populasi kelapa normal (Maskromo et al., 2013, Sudarsono et al., 2014a, Sudarsono et al., 2014b). Buah kelapa kopyor umumnya dijual di tingkat petani dalam bentuk kelapa gelondongan dan dijual ke konsumen dalam bentuk gelondongan atau olahan segar yang siap saji (Hutapea et al., 2007, Novarianto et al., 2014).
Kelapa kopyor merupakan mutan alami dengan karakteristik abnormal pada endosperm-nya (Maskromo et al., 2007a, Sudarsono et al., 2011, Maskromo et al., 2012a, Maskromo et al., 2013, Sudarsono et al., 2014a, Sudarsono et al., 2014b). Sifat endosperm kopyor dikendalikan oleh alel resesif mutan k sedangkan sifat endosperm normal dikendalikan oleh alel dominan K. Buah kelapa kopyor mempunyai embrio sigotik dengan geno-tipe homosigot kk dan endosperm kkk. Sebalik-nya, buah kelapa normal mempunyai embrio sigotik homosigot KK atau heterosigot Kk (Novarianto et al., 2014). Di Filipina, Thailand, Sri Lanka, India, Vietnam, dan Kamboja juga dila-porkan adanya kelapa mutan dengan endosperm abnormal yang terkenal dengan nama kelapa Makapuno, Maphrao Kathi, Dikiri Pol, Thairu Tengai, Dua Sap, dan Dong Kathim (Wattanayothin, 2005; Wattanayothin, 2010; Chomchalow, 2013, Novarianto et al., 2014). Kelapa mutan Makapuno mempunyai fenotipe endosperm abnormal karena tidak terekspresinya gen galaktosidase pada endospermnya (Samonthe et al., 1989). Sebaliknya, penyebab terjadinya fenotipe abnormal pada kelapa kopyor belum diketahui, apakah karena tidak aktifnya gen galaktosidase atau karena mutasi pada gen tertentu yang fungsinya me-ngatur perkembangan jaringan tanaman (re-gulatory gene), termasuk perkembangan endos-perm (Sudarsono et al., 2014a, Sudarsono et al., 2014b).
Kelapa dikelompokkan menjadi dua tipe ber-dasarkan pola penyerbukan, karakter mor-fologi dan tinggi pohon, perbedaan kuantitatif dan kualitatif dalam komponen buah, serta umur berbunga pertama. Kelapa memiliki tipe bunga berumah satu (monoecious). Meskipun ada dalam satu tandan bunga, secara fisik bunga jantan dan betinanya terpisah (Perera et al., 2010). Selain itu,
bunga jantan dan betina mempunyai periode antesis dan reseptif yang bervariasi (Deb Mandal dan Shyamapada, 2011, Maskromo et al., 2011). Kelapa tipe Dalam (Typica) cenderung menyerbuk silang karena tidak terjadi overlap antara periode antesis dan masa reseptif bunga betina dalam satu tandan bunga yang sama. Setelah penyerbukan, perkembangan buah hingga siap dipanen memer-lukan waktu hingga 12 bulan. Kelapa tipe Genjah (Nana) cenderung menyerbuk sendiri karena adanya overlapping antara fase antesis bunga jantan dan masa reseptif bunga betinanya (Deb Mandal dan Shyamapada, 2011, Maskromo et al., 2011).
Survei yang dilaksanakan Balai Penelitian Kelapa (Balitka) pada tahun 2006 berhasil meng-identifikasi keberadaan kelapa kopyor tipe Dalam dan kelapa kopyor tipe Genjah (Maskromo et al., 2012a, Maskromo et al., 2013, Maskromo et al., 2014, Maskromo et al., 2015). Kelapa kopyor tipe Dalam terdapat di Kalianda (Lampung Selatan), Ciomas (Bogor), Sumenep dan Jombang (Jawa Timur), serta Pati (Jawa Tengah). Populasi per-tanaman kelapa tipe Dalam Kopyor dalam jumlah banyak ditemukan di Dukuh Seti, Kabupaten Pati (Jawa Tengah), Sumenep (Jawa Timur), dan Kalianda (Lampung Selatan) (Maskromo et al., 2012a, Maskromo et al., 2013, Maskromo et al., 2014, Sudarsono et al., 2014a, Sudarsono et al., 2014b, Maskromo et al., 2015).
Kabupaten Lampung Selatan merupakan salah satu sentra kelapa tipe Dalam di Provinsi Lampung, dengan total areal pertanaman pada tahun 2010 seluas 34.730 ha dengan produksi 30 435.60 ton (Maskromo et al., 2012b). Hasil pen-dataan di lapangan menunjukkan diantara per-tanaman kelapa tipe Dalam normal yang digu-nakan untuk produksi kopra ternyata terdapat kelapa tipe Dalam Kopyor yang tersebar diantara pertanaman kelapa tipe Dalam normal (Maskromo et al., 2012b, Sudarsono et al., 2014a, Sudarsono et al., 2014b). Asal usul pertanaman kelapa tipe Dalam Kopyor ini tidak dapat ditelusuri, tetapi populasi kelapa tipe Dalam Kopyor ini telah didaftarkan sebagai varietas lokal dengan nama Kelapa Puan Kalianda. Kelapa tipe Dalam Kopyor Kalianda heterosigot Kk berpotensi untuk dikem-bangkan karena mempunyai kuantitas endosperm yang lebih banyak dibanding dengan kelapa Genjah Kopyor Pati (Sudarsono et al., 2011).
Kelapa tipe Dalam Kopyor yang ditemukan di daerah Kalianda, Lampung Selatan secara alami hanya menghasilkan buah kopyor 1-2 butir per tandan (Sudarsono et al., 2014a, Sudarsono et al., 2014b). Hal ini diduga berkaitan dengan sifat kelapa tipe Dalam yang cenderung menyerbuk silang dan adanya pertanaman campuran antara
79
kelapa tipe Dalam Kopyor (genotipe heterosigotKk) dengan kelapa tipe Dalam normal (genotipe homosigot KK). Kedua hal tersebut diduga me-ningkatkan peluang bertemunya alel dominan K yang mengendalikan sifat endosperm normal dengan alel resesif k yang mengendalikan sifat kopyor. Gabungan dari gamet dengan alel K dan k menghasilkan buah dengan konstitusi embrio sigotik heterosigot Kk dan endosperm dengan fenotipe normal (Sudarsono et al., 2014a, Sudarsono et al., 2014b, Novarianto et al., 2014).
Pengaruh negatif keberadaan kelapa tipe Dalam normal homosigot KK terhadap produksi buah kopyor dapat dievaluasi dengan mempelajari penye-baran serbuk sari diantara pertanaman kelapa tipe Dalam Kalianda. Marka molekuler seperti marka SSR (Lebrun et al., 2001, Rajesh et al., 2008, Martinez et al., 2010, Perera, 2010, Ribeiro et al., 2010, Sajib et al., 2012, Yao et al., 2013) dan marka SNAP (Larekeng et al., 2015) pada kelapa telah dikembangkan sebelumnya. Keberadaan marka molekuler memudahkan analisis ke-ragaman genetik (Mondini et al., 2009, Park et al., 2009) dan penyebaran serbuk sari pada berbagai spesies tanaman (Austerlitz et al., 2004, Prabha et al., 2011) yang sebelumnya relatif sulit dilakukan. Analisis penyebaran serbuk sari dibantu marka molekuler memberi peluang untuk mengidentifi-kasi kandidat tetua dari progeni yang dianalisis secara langsung serta telah diteliti pada sejumlah tanaman tahunan, seperti Pinus flexilis (Schuster dan Mitoon, 2000), Quercus garryana (Marsico et al., 2009) dan kelapa tipe Genjah Kopyor (Larekeng et al., 2015). Analisis penyebaran serbuk sari yang dilakukan berbasis marka molekuler memberi peluang untuk mengidentifikasi kandidat tetua dari progeni yang dianalisis sehingga pola penyer-bukan (selfing atau outcrossing) dan tingkat selfing atau outcrossing-nya dapat ditentukan (Milleron et al., 2012; Larekeng et al., 2015). Khusus untuk tanaman kelapa, hasil analisis penyebaran serbuk sari relatif masih terbatas dan baru dilakukan pada kelapa tipe Genjah (Larekeng et al., 2015). Analisis pola penyebaran serbuk sari pada kelapa tipe Dalam dan berbagai topik penelitian lainnya saat ini masih dalam proses evaluasi (Sudarsono et al., 2014c, Maskromo et al., 2014, Maskromo et al., 2015).
Analisis penyebaran serbuk sari pada kelapa tipe Dalam Kopyor Kalianda dapat dilakukan meng-ikuti prosedur yang telah umum digunakan (Burczyk dan Koralewski, 2005; Carneiro et al., 2011) dan perlu dilakukan untuk pengembangan kelapa kopyor di Kabupaten Lampung Selatan. Selain itu, analisis penyebaran serbuk sari pada kelapa tipe Dalam Kopyor Kalianda juga
diper-lukan untuk mengembangkan model penyebaran serbuk sari pada kelapa tipe Dalam lainnya. Tujuan penelitian ini untuk (1) mengevaluasi pola penyebaran serbuk sari dan menentukan kisaran jarak penyebaran serbuk sari pada kelapa tipe Dalam Kalianda, (2) menentukan persentase pe-nyerbukan silang (outcrossing) dan pepe-nyerbukan sendiri (selfing) yang terjadi pada kelapa tipe Dalam Kalianda, dan (3) menentukan frekuensi pola penyerbukan silang antara kelapa tipe Dalam normal (N) dengan kelapa Dalam Kopyor (K), K x N dan K x K yang terjadi pada populasi campuran antara kelapa tipe Dalam Kopyor dan normal Kalianda.
BAHAN DAN METODE
Penelitian dilaksanakan mulai bulan Juli 2013 hingga Agustus 2014. Kegiatan lapangan dilakukan di kebun kelapa tipe Dalam Kopyor di Desa Agom Jaya, Kecamatan Kalianda, Kabupaten Lampung Selatan, Lampung. Posisi GPS untuk kebun kelapa tipe Dalam Kopyor yang digunakan adalah S 5 39.462 E 105 34.962. Kegiatan analisis molekuler dilakukan di Laboratorium Biologi Molekuler Tanaman (PMB Lab), Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Pemetaan Populasi, Pemilihan Tetua dan Pemanenan Progeni
Populasi tanaman kelapa tipe Dalam yang ada di lokasi sebanyak 282 pohon. Posisi seluruh tanaman kelapa tipe Dalam di lapangan dicatat dengan menggunakan Garmin GPS dan dipeta-kan dengan perangkat lunak pemetaan Map Source versi 76C5x. Dari total kelapa tipe Dalam yang ada, dipilih populasi contoh yang merupa-kan pertanaman campuran antara kelapa tipe Dalam Kopyor (heterosigot Kk) yang berpotensi menghasilkan buah kopyor dengan kelapa tipe Dalam normal (homosigot KK) yang hanya meng-hasilkan buah kelapa normal.
Populasi contoh terdiri atas total 60 pohon kelapa tipe Dalam dewasa, 21 pohon diantaranya berbuah normal (homozigot KK) dan 39 pohon berbuah kopyor (heterozigot Kk). Selain sebagai calon tetua jantan, 14 pohon diantara populasi contoh tersebut (5 pohon KK dan 9 pohon Kk) digunakan sebagai tetua betina. Dari setiap tetua betina terpilih dipanen satu tandan, dengan kisaran jumlah buah per tandan antara 2 - 10 buah. Empat puluh enam pohon kelapa dewasa lainnya, yang ada di sekitar 14 pohon induk hanya di-evaluasi sebagai calon tetua jantan.
80
Tabel 1. Lokus marka molekuler yang digunakan untuk identifikasi genotipe contoh tanaman kelapa, runutan nukleotida primer dan referensi rujukan untuk primernya.
Table 1. Molecular marker loci used for genotyping the coconut samples, the primer nucleotide sequences, and their references.
Lokus
Loci
Primer Runutan nukleotida
Nucleotide sekuences
Publikasi
Reference
CnCir_87 F ATAACATCCTCCAACCTG Lebrun et al., 2001 R GACTGAATCCAACCCTT Lebrun et al., 2001 CnCir_86 F CCACTTGAGACTTGAAAC Lebrun et al., 2001 R ACTCACGCAAATATACTCA Lebrun et al., 2001 CnZ-18 F ATGGTTCAGCCCTTAATAAAC Lebrun et al., 2001 R GAACTTTGAAGCTCCCATCAT Lebrun et al., 2001 CnZ_51 F CTTTAGGGAAAAAGGACTGAG Lebrun et al., 2001 R ATCCATGAGCTGAGCTTGAAC Lebrun et al., 2001 CnCir_B12 F GCTCTTCAGTCTTTCTCAA Lebrun et al., 2001 R CTGTATGCCAATTTTTCTA Lebrun et al., 2001 CnCir_56 F AACCAGAACTTAAATGTCG Lebrun et al., 2001 R TTTGAACTCTTCTATTGGG Lebrun et al., 2001 CnSus1#14 Ref. GCTGAAAGTCACTGAAAAGGTAG Larekeng et al., 2015
Alt GCTGAAAGTCACTGAAAAGGTAC Larekeng et al., 2015 R AAATTATTAAGAATGTCATGGTTTC Larekeng et al., 2015 CnSus1#3 Ref. GAATGAGATGCTACAAAGAATAAATAAG Larekeng et al., 2015 Alt GAATGAGATGCTACAAAGAATAAATAAA Larekeng et al., 2015 R TCTGTTCTAAATGGAACGCG Larekeng et al., 2015 WRKY19#1 Ref. CGTCTTCTGCAAACTAAGCTCA Larekeng et al., 2015 Alt GTCTTCTGCAAACTAAGCTCG Larekeng et al., 2015 R ATGATATATATACAAGACTACGCCGAT Larekeng et al., 2015 WRKY 6#3 Ref. ATAAATATCACATATCCCTGAGCAA Larekeng et al., 2015 Alt TATAAATATCACATATCCCTGAGCAG Larekeng et al., 2015 R CTACAGGTATTGTTAAATGTGCCA Larekeng et al., 2015
Keterangan/Note: F – primer forward (forward primer), R – primer reverse (reverse primer), Ref – primer referensi (reference primer), dan Alt – primer alternatif (alternate primer).
Genotyping tetua dan progeni
Total DNA tanaman contoh diisolasi meng-gunakan metode CTAB (Rohde et al., 1995) dengan modifikasi (Larekeng et al., 2015). Contoh daun muda atau embrio sigotik kelapa (0,3-0,4 g) digerus dengan larutan penyangga lisis (2 ml) dengan penambahan PVP (0,007 g) dan 2-mer-captoetanol (10 μl). Hasil gerusan jaringan di-inkubasi dalam waterbath pada suhu 65°C selama 60 menit. Campuran diendapkan dengan sentri-fugasi menggunakan Eppendorf Centrifuge 5416 dengan kecepatan 11000 rpm selama 10 menit. Supernatan dipindahkan ke tabung eppendorf baru dan ditambahkan kloroform:isoamil-alkohol (24:1) sebanyak volume supernatan. Setelah dicampur perlahan dan merata selama 3 menit, contoh disen-trifugasi dengan kecepatan 11000 rpm selama 10 menit. Setelah sentrifugasi, supernatan dipindah-kan ke tabung yang baru. Setelah itu, ke dalam tabung Eppendorf ditambahkan sodium asetat (0.1x volume supernatan) dan isopropanol dingin (2x volume total supernatan). Setelah diinkubasi dalam freezer selama satu malam, suspensi disen-trifugasi dengan kecepatan 11000 rpm selama 10
menit hingga diperoleh endapan DNA. Endapan DNA dibilas dengan 500 μl etanol dingin (70%), disentrifugasi dan dikeringkan. Endapan DNA yang telah kering disuspensikan dalam aquabidest. Kontaminan RNA dihilangkan dengan perlakuan RNase mengikuti tahapan prosedur standar (Larekeng et al., 2015). Pasangan primer SSR diseleksi dari 36 lokus SSR (Lebrun et al., 2001) dan 6 pasang primer yang paling polimorfik (Larekeng et al., 2015) digunakan untuk genotyping tetua dan progeni yang dievaluasi. Empat lokus marka SNAP yang dikembangkan berdasarkan keragam-an nukleotida gen SUS dkeragam-an WRKY juga digunakkeragam-an genotyping tetua dan progeni. Pengembangan marka SNAP berbasis gen SUS dan WRKY dilakukan mengikuti tahapan kegiatan yang telah dilakukan pada berbagai tanaman (Esteras et al., 2012, Sutanto et al., 2014). Gen SUS dan WRKY dapat dijadikan sebagai marka yang polimorfik untuk kelapa (Herera et al., 2007, Sukendah et al., 2009). Daftar pasangan primer dan runutan sequence oligonukleotidanya disajikan pada Tabel 1.
81
Reaksi amplifikasi PCR dengan total reaksi12,5 µl, yang mengandung 2 µl (25 ng/µl) DNA template, 50 nM masing-masing primer, 6,25 µl PCR Ready Mix (KAPA, Biosystem), dan 3 µl ddH2O. Tahapan amplifikasi dilakukan sebagai berikut: denaturasi awal pada suhu 95°C selama 3 menit, diikuti 35 siklus amplifikasi yang masing-masing siklus terdiri atas denaturasi pada 95°C selama 15 detik, penempelan primer temperaturnya disesuai-kan dengan masing-masing pasangan primer selama 15 detik, dan pemanjangan primer pada suhu 72°C selama 5 detik, serta diakhiri dengan pemanjangan primer pada suhu 72°C selama 10 menit sesuai rekomendasi kit PCR KAPA Bio-system.
Visualisasi produk hasil amplifikasi PCR untuk masing-masing lokus marka SSR dilakukan dengan elektroforesis gel poliakrilamid 6% meng-gunakan Buffer SB 1x (Brody dan Kern, 2004) dan pewarnaan gel dengan perak nitrat. Tahapan pe-warnaan gel dengan perak nitrat dilakukan meng-ikuti metode Creste et al. (2001) yang dimodifikasi (Tinche et al. 2014). Visualisasi produk hasil ampli-fikasi PCR untuk masing-masing lokus marka SNAP dilakukan dengan elektroforesis gel agarosa (1%) menggunakan larutan penyangga TBE 1x. Visualisasi DNA-nya dilakukan dengan menggu-nakan pewarnaan gel red. Visualisasi mengguna-kan UV transluminesen dan elektroforegram di foto menggunakan kamera digital. Penentuan genotipe setiap individu yang dievaluasi dila-kukan berdasarkan skoring keragaman alel.
Identifikasi Kandidat Tetua Jantan
Setiap contoh progeni yang dipanen dike-tahui dengan pasti induknya tetapi perlu diten-tukan tetua donor serbuk sarinya (tetua jantan) diantara pohon dewasa yang ada di sekitarnya. Identifikasi tetua donor serbuk sari dilakukan dengan menganalisis genotipe setiap progeni dan membandingkannya dengan seluruh genotipe tanaman dewasa yang dievaluasi, yang berpotensi sebagai pendonor serbuk sari. Data genotipe semua progeni dan tanaman dewasa digunakan untuk menentukan kandidat tetua jantan yang dicari. Penentuan kandidat tetua jantan yang terpilih untuk masing-masing progeni dilakukan dengan analisis paternitas menggunakan perang-kat lunak CERVUS versi 2.0 (Marshall et al., 1998). Analisis paternitas dilakukan melalui tiga tahapan, yaitu penghitungan frekuensi alel, simulasi untuk menentukan tingkat keberhasilan identifikasi kan-didat tetua jantan, dan penentuan kankan-didat tetua jantan terpilih untuk masing-masing progeni. Hasil analisis frekuensi alel memberikan luaran
nilai frekuensi untuk masing-masing alel pada setiap lokus marka, polymorphic information content (PIC), serta tingkat heterozigositas populasi yang dievaluasi. Hasil analisis simulasi memberikan hasil nilai tingkat kepercayaan penentuan kan-didat tetua jantan berdasarkan data yang tersedia, dan hasil analisis penentuan kandidat tetua menghasilkan identitas tetua jantan untuk setiap progeni yang dievaluasi. Kandidat tetua jantan yang teridentifikasi dikelompokkan dengan ting-kat kepercayaan > 95% (*), 80-95% (+) atau < 80% (-).
Analisis Pola Penyebaran Serbuk Sari
Induk dan tetua jantan yang teridentifikasi sebagai donor serbuk sari setiap progeni dipetakan posisinya berdasarkan peta sebaran tanaman dewasa yang telah dilakukan sebelumnya. Jarak antara masing-masing induk dan tetua donor serbuk sari yang teridentifikasi dihitung menggu-nakan perangkat lunak Map Source. Jarak antar tetua dan posisinya digunakan untuk meng-ilustrasikan pola penyebaran serbuk sari di lokasi penelitian. Penyerbukan sendiri (selfing) didefinisi-kan jika tetua jantan yang teridentifikasi sama dengan induknya. Sebaliknya, penyerbukan silang (outcrossing) jika induk dan tetua jantan yang men-jadi donor serbuk sarinya terdiri atas dua tanaman dewasa yang berbeda. Penyerbukan silang bisa dikelompokkan dengan kategori penyerbukan silang antar kelapa tipe Dalam Kopyor heterosigot Kk, antar Kopyor heterosigot Kk dengan normal homosigot KK, antar normal homosigot KK dengan Kopyor heterosigot Kk atau antar normal homosigot KK. Frekuensi terjadinya selfing, outcrossing untuk berbagai kategori persilangan ditentukan berdasarkan identitas tetua betina dan tetua jantan dari hasil analisis paternitas.
HASIL DAN PEMBAHASAN Genotyping Tetua dan Progeni
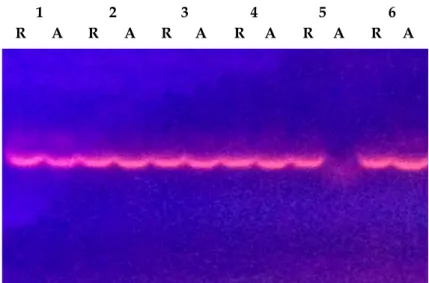
Analisis molekuler menggunakan marka SSR dan SNAP yang dilakukan terhadap populasi tetua dan progeninya menunjukkan bahwa seluruh marka yang diuji mampu menghasilkan pita alel polimorfik. Contoh hasil amplifikasi PCR dengan menggunakan pasangan primer SSR CnCir_56 atau pasangan primer SNAP WRKY6_3 dengan alel yang polimorfik pada populasi kelapa tipe Dalam Kalianda dapat dilihat pada Gambar 1 dan 2. Pada Gambar 1 menunjukkan keberadaan individu dengan konstitusi genetik homosigot 1/1 (contoh no. 10), homosigot 2/2 (contoh no.12),
82
1
2
3
4
5
6
7
8
9 10 11 12
M
1
2
3
Alele #
4
Gambar 1. Hasil pewarnaan perak nitrat DNA hasil amplifikasi PCR menggunakan marka SSR
pada lokus CnCIR 56. Kolom no. 1-12: hasil untuk contoh tanaman 1 sampai dengan
12 dan M: penanda 1 kb DNA.
Figure 1.
Results of silver nitrate staining of PCR amplified DNA using CnCir-56 SSR locus. Column
no. 1-12: results of plant sample 1 to 12 and M: 1 kb DNA ladder marker.
1 2 3 4 5 6
R A R A R A R A R A R A
Gambar 2. Hasil pewarnaan dengan gel red DNA hasil amplifikasi PCR menggunakan marka
SNAP pada lokus CnWRKY6_3. Kolom no. 1-6: hasil untuk contoh tanaman 1 sampai
dengan 6. R: hasil amplifikasi dengan pasangan primer reference dan A: hasil
amplifikasi dengan pasangan primer alternate.
Figure 2.
Results of gel red staining of PCR amplified DNA using CnWRKY6_3 SNAP locus. Column
no. 1-6: results of plant sample 1 to 6. R: amplified product from reference primer pair and A:
amplified product from alternate primers.
homosigot 4/4 (contoh no. 3, 5, 6, 9, 11), heterosigot 1/4 (contoh no. 2, 4), heterosigot 2/3 (contoh no. 1), atau heterosigot 3/4 (contoh no. 8, 9) berdasarkan hasil analisis marka SSR pada lokus CnCir_56. Gambar 2 menunjukkan individu dengan konstitusi heterosigot untuk alel referensi dan alternatif (contoh no. 1, 2, 3, 4 dan 6) dan homosigot untuk alel referensi (contoh no. 5) berdasarkan hasil analisis marka SNAP pada lokus WRKY6_3. Analisis genotipe setiap individu yang dievaluasi dengan marka SSR dan SNAP dilakukan dengan pendekatan yang sama.
Masing-masing lokus marka SSR yang dievaluasi mempunyai jumlah alel antara 2 – 5 alel per lokus sedangkan marka SNAP-nya hanya 2 alel per lokus (Tabel 2). Hasil analisis marka molekuler untuk populasi contoh kelapa tipe Dalam Kalianda memberikan nilai PIC (Tabel 2) masing-masing lokus yang berkisar antara 0,37-0,73 untuk marka SSR dan antara 0,36-0,38 untuk marka SNAP. Perbedaan nilai Perbedaan jumlah alel per lokus antara marka SSR dan SNAP juga berdampak pada besarnya peluang jumlah indi-vidu yang homosigot atau heterosigot untuk masing-masing
83
Tabel 2. Jumlah alel, individu heterosigot dan homosigot; proporsi heterozigositas yangdiamati (O) dan yang diharapkan (E) serta nilai polymorphic information content (PIC) pada 10 lokus marka molekuler yang digunakan untuk mengevaluasi populasi kelapa tipe Dalam Kalianda.
Table 2. Number of alleles, number of heterozygous and homozygous individuals; observed (O) and expected (E) heterozygosity; and polymorphic information content (PIC) for 10 molecular marker loci used to evaluate Kalianda Tall coconut population.
Nama lokus Locus name Jumlah alel Allele number Jumlah Number of Heterozigositas Heterozygosity PIC Heterosigot Heterozygous Homosigot Homozygous O E CnCir_87 2 57 53 0.52 0.49 0.37 CnCir_86 4 41 69 0.37 0.49 0.46 CnZ-18 4 80 30 0.73 0.65 0.60 CnZ_51 5 74 35 0.68 0.78 0.73 CnCir_B12 5 60 50 0.55 0.63 0.55 CnCir_56 5 68 42 0.62 0.71 0.66 CnSus1#14 2 71 38 0.65 0.48 0.36 CnSus1#3 2 75 35 0.68 0.48 0.36 WRKY19#1 2 108 2 0.98 0.50 0.38 WRKY 6#3 2 104 5 0.95 0.50 0.37
lokus markanya. Populasi kelapa Dalam Kalianda yang dianalisis sebagian besar mempunyai konstitusi genetik heterosigot untuk marka SNAP (>95%) sehingga persentase heterosi-gositas yang diamati (Ho) jauh lebih besar dari nilai heterosigositas harapan (He)-nya (Tabel 2).
Untuk marka SSR, nilai Ho dan He-nya tidak terlalu berbeda (Tabel 2). Meskipun sejumlah lokus hanya mempunyai nilai PIC 0,36-0,38, rataan nilai PIC untuk semua lokus masih mendekati angka 0,5 sehingga seluruh marka molekulernya dapat digu-nakan secara efektif untuk melakukan analisis paternitas pada populasi tanaman kelapa tipe Dalam Kalianda.
Identifikasi Tetua Jantan yang Menjadi Donor Serbuk Sari
Analisis paternitas dilakukan untuk meng-identifikasi tetua jantan yang mendonasikan ser-buk sari dalam pembentukan buah yang dipanen dari pohon induk terpilih. Hasil analisis paternitas yang dilakukan dapat menentukan identitas tetua jantan dari 49 progeni yang di-panen. Penentuan identitas tetua jantan berhasil dilakukan dengan tingkat keyakinan 95% untuk 10 progeni (20,4%), 80-95% untuk 24 progeni (49,0%), dan < 80% untuk 15 progeni (30,6%) tetapi tetap mempunyai nilai LOD (log of odd) positif. Besarnya nilai LOD sejalan dengan besarnya peluang tetua teridentifi-kasi sebagai tetua yang sebenarnya (Marshall et al., 1998).
Berdasarkan identitas pasangan induk dan tetua jantan yang teridentifikasi, ditentukan
rang-kuman skema dan tipe penyerbukan untuk semua progeni yang dipanen dari induk terpilih pada populasi kelapa tipe Dalam Kalianda. Hasil yang diperoleh menunjukkan adanya satu (2%) progeni hasil penyerbukan sendiri dan 48 (98%) progeni hasil penyerbukan silang. Diantara progeni hasil penyerbukan silang, 24 (49,0%) progeni teriden-tifikasi sebagai hasil persilangan antara induk dan tetua jantan kelapa tipe Dalam Kopyor heterosigot Kk, 11 (22,4%) progeni sebagai hasil persilangan antara induk kelapa tipe Dalam Kopyor hete-rosigot Kk dengan normal homosigot KK, 10 (20,5%) progeni sebagai hasil persilangan antara induk kelapa tipe Dalam normal homosigot KK dan Kopyor heterosigot Kk, serta 3 (6,1%) progeni hasil persilangan antara induk dan tetua jantan tipe Dalam normal homosigot KK (Tabel 3).
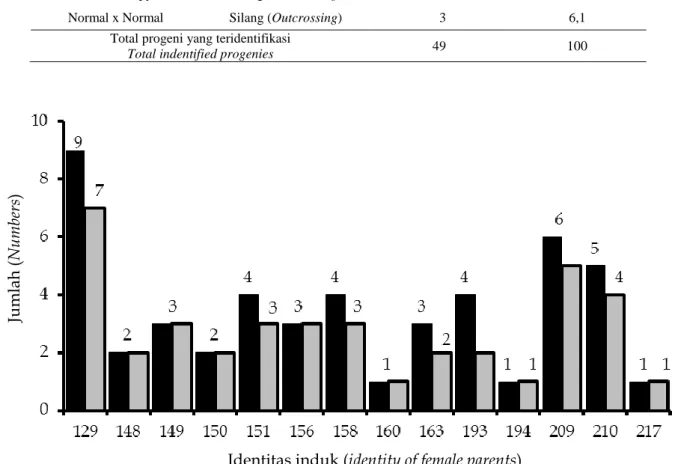
Jumlah progeni yang dipanen dari induk serta jumlah tetua jantan yang berkontribusi sebagai donor serbuk sari untuk masing-masing induk kelapa tipe Dalam Kalianda dapat dilihat pada Gambar 3. Jumlah buah yang dipanen dari masing-masing induk yang teridentifikasi tetua jantannya berkisar antara 1 – 9 buah per induk. Jumlah tetua jantan yang berkon-tribusi sebagai donor serbuk sari berkisar antara 1 – 7 tetua jantan untuk satu induk tertentu. Dari induk no. 210, 209, dan 129, masing-masing dipanen sebanyak 5, 6, dan 9 buah. Buah yang dipanen dari induk no. 210, 209, dan 129, masing-masing mempunyai donor serbuk sari dari 4, 5, dan 7 tetua jantan yang ber-beda.
84
Tabel 3. Skema dan tipe kejadian penyerbukan yang diidentifikasi berdasarkan hasil analisis penyebaran serbuk sari pada populasi tanaman Kelapa tipe Dalam Kalianda di Kalianda, Lampung Selatan.
Table 3. Scheme and type of pollination which identified based on results of pollen dispersal analysis in the studied Kalianda Tall coconut population at Kalianda, South Lampung.
Skema Penyerbukan Pollination Scheme Tipe Penyerbukan Pollination type Kejadian penyerbukan Pollination events Frequensi Frequency Persentase Percentage
Kopyor x Kopyor Sendiri (Selfing) 1 2,0 Kopyor x Kopyor Silang (Outcrossing) 24 49,0 Kopyor x Normal Silang (Outcrossing) 11 22,4 Normal x Kopyor Silang (Outcrossing) 10 20,5 Normal x Normal Silang (Outcrossing) 3 6,1
Total progeni yang teridentifikasi
Total indentified progenies 49 100
Identitas induk (identity of female parents)
Jum
la
h
(N
um
be
rs
)
Gambar 3. Jumlah buah yang dipanen dan jumlah tetua jantan yang memberikan kontribusi serbuk sari dalam pembentukan buah dari masing-masing induk pada populasi tanaman kelapa tipe Dalam Kalianda di Kalianda, Lampung Selatan. ( ) jumlah buah yang dipanen dan ( ) jumlah tetua jantan yang memberikan kontribusi serbuk sari dalam pembentukan buah. Figure 3. Number of harvested seed nuts and number of assigned male parent contributed pollens in the
formation of seed nuts from each female parent of Kalianda Tall coconuts in Kalianda, South Lampung. ( ) Number of harvested seed nuts and ( ) Number of assigned male parents contributed pollens in the formation of harvested seed nuts.
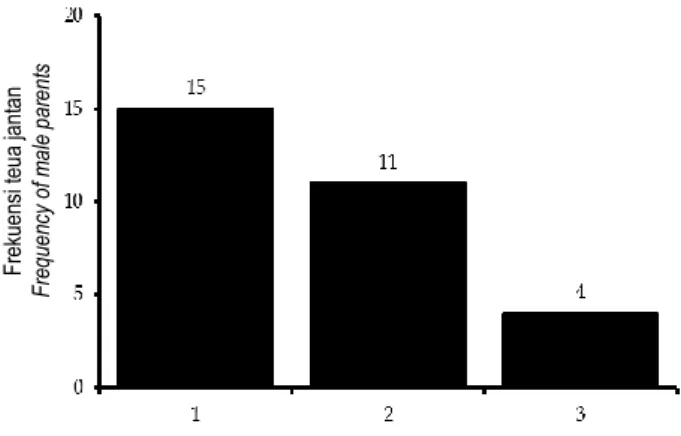
Hasil penelitian menunjukkan bahwa hanya 30 individu dari 60 individu yang dianalisis terbukti berperan sebagai donor serbuk sari untuk 49 progeni yang dipanen dari 15 induk. Dari data 49 progeni dan jumlah kontribusi serbuk sari masing-masing tetua jantan ke 14 target induk
dapat diketahui (Gambar 4) bahwa kebanyakan tetua jantan secara efektif hanya berkontribusi satu serbuk sari (15 tetua jantan) atau dua serbuk sari (11 tetua jantan). Namun demikian terdapat empat tetua jantan yang secara efektif mendonasikan tiga serbuk sari kepada induk yang dievaluasi
85
(Gambar 4), yaitu pohon kelapa tipe DalamKalianda no. 42 (Dalam normal homosigot KK), no. 150 (Dalam Kopyor heterosigot Kk), no. 192 (Dalam normal homosigot KK), dan no. 214 (Dalam Kopyor heterosigot Kk).
Jarak tanam kelapa tipe Dalam Kalianda di lokasi penelitian Desa Agom Jaya, Kecamatan Kalianda, Lampung Selatan, adalah sekitar 8-12 m. Oleh karena itu, penyerbukan kemungkinan besar dengan perantaraan serangga.
Gambar 4. Pengelompokkan tetua jantan berdasar-kan jumlah kontribusi serbuk sari yang didonasikan kepada induk disekitarnya pada pertanaman kelapa Dalam Kalianda di Agom Jaya, Lampung Selatan.
Figure 4. Grouping of the male parents based on number of contributed pollens to the surrounding female parents in the Kalianda Tall coconut population at Agom Jaya, Lampung Selatan.
Namun, tidak menutup kemungkinan bahwa angin juga berpotensi membantu penyer-bukan di lokasi tersebut. Hasil pengamatan me-nunjukkan bahwa serbuk sari menyebar dengan jarak antara 0 (self-pollination) hingga 63 m (outcros-pollination).
Hal ini sejalan dengan hasil penelitian sis-tem perkawinan pada tanaman palma Oenocarpus bataua, yang terbukti menyerbuk silang dan tidak menyerbuk sendiri dengan jarak penyebaran serbuk sari antara 303 m hingga 1263 m (Ottewell et al., 2012). Penyebaran serbuk sari umumnya dibantu oleh berbagai spesies serangga dan se-bagian kecil oleh angin pada 77 jenis palma lain-nya (Barfod et al., 2011).
Frekuensi terjadinya polinasi untuk masing-masing kelas jarak antara induk dengan tetua jantan disajikan pada Gambar 5. Kelas jarak antar tetua yang terbesar untuk kejadian penyerbukan di lokasi penelitian adalah antara 40 – 50 m (13 progeni dari 49 progeni (27%) yang diuji). Kontri-busi donor serbuk sari yang berdekatan dengan induk (<10 m) justru relatif sedikit jumlahnya, yaitu hanya 4 progeni (8%) dari 49 progeni yang diuji. Demikian halnya untuk jarak antar tetua yang > 50 m, hanya ada 10 progeni (20%) diantara 49 progeni yang diuji (Gambar 5).
Gambar 5. Jumlah penyerbukan dalam setiap kelas jarak antara tetua jantan dan tetua betina pada tanaman kelapa tipe Dalam Kali-anda di Agom Jaya, Kalianda, Lampung Selatan.
Figure 5. Number of pollination events in the each distances class among assigned male and female parents in the Kalianda Tall coconut population at Agom Jaya, Kalianda, South Lampung.
Analisis Pola Penyebaran Serbuk Sari
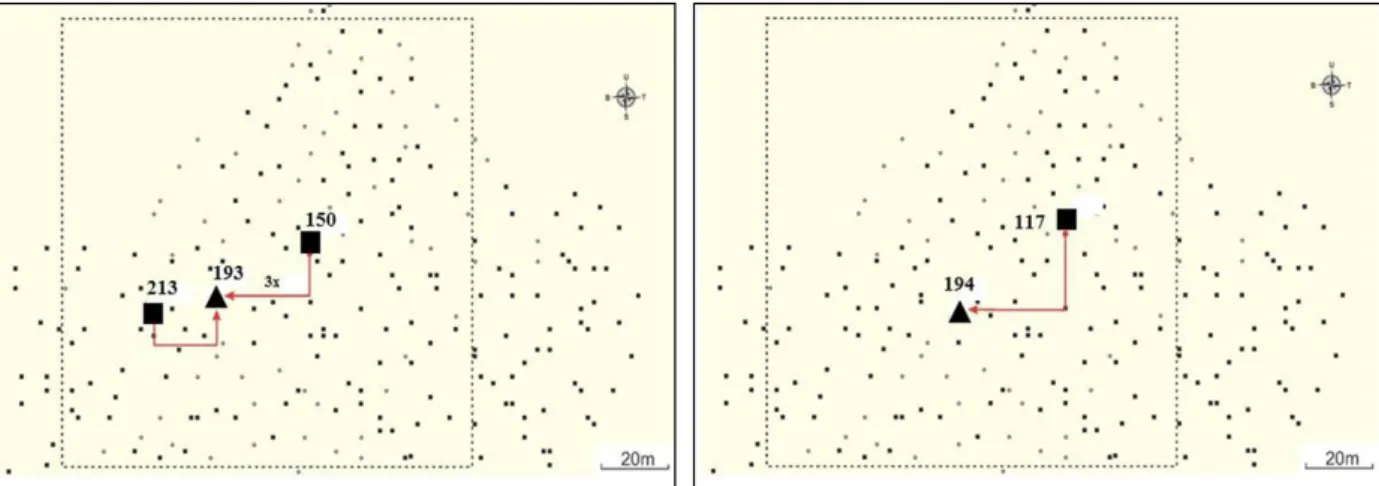
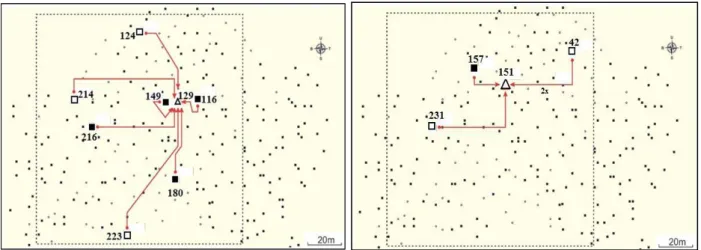
Pola penyerbukan yang ada dapat dikate-gorikan menjadi empat kelompok, yaitu: (1) Induk kelapa tipe Dalam Kopyor heterosigot Kk diser-buki oleh kelapa tipe Dalam Kopyor heterosigot Kk (Gambar 6), (2) Induk kelapa tipe Dalam Kopyor heterosigot Kk diserbuki oleh kelapa tipe Dalam normal homosigot KK (Gambar 7), (3) Induk kelapa tipe Dalam normal homosigot KK diserbuki oleh kelapa tipe Dalam Kopyor hete-rosigot Kk (Gambar 8) atau (4) Induk kelapa tipe Dalam Normal homosigot KK diserbuki oleh kelapa tipe Dalam Normal homosigot KK (Gambar 8). Pola kelompok (1) direpresentasikan oleh induk kelapa tipe Dalam no. 193 dan 194; pola kelompok (2) direpresentasikan oleh induk kelapa tipe Dalam no. 149 dan 163, sedangkan pola kelompok (3) dan (4) direpresentasikan oleh induk kelapa tipe Dalam no. 129 dan 151.
Jarak antara tetua jantan dan betina (m)
Class distances among male and female parents
Fr ek ue ns i ( fre qu en cy )
Sebaran jumlah serbuk sari yang dikontribusikan oleh tetua jantan
Number of contributed pollens by male parents
Fr ek ue ns i t eu a ja nt an Fr eq ue nc y of m ale p ar en ts
86
Gambar 6. Posisi tetua jantan yang mendonasikan serbuk sari pada pembentukan buah dari (A) induk no. 193 dan (B) 194 berdasarkan hasil analisis paternitas. Simbol mengindikasikan posisi: ( ) induk kelapa tipe Dalam Kopyor heterosigot Kk dan ( ) tetua jantan kelapa tipe Dalam Kopyor heterosigot Kk.
Figure 6. Positions of the assigned male parents dona-ting pollen in seed nut formation from (A) female parent no. 193 and (B) 194 based on paternity analysis. Symbols represent position of: ( )Tall Kopyor heterozygous Kk female parent and ( )Tall Kopyor heterozygous Kk assigned male parent.
Gambar 7. Posisi tetua jantan, diduga mendona-sikan serbuk sari pada pembentukan buah dari (A) induk no. 149 dan (B) 163 berdasarkan hasil analisis paternitas. Simbol mengindikasikan posisi : ( ) induk tipe Dalam Kopyor heterosigot Kk, ( ) tetua jantan tipe Dalam Kopyor heterosigot Kk, dan ( ) tetua jantan tipe Dalam normal homosigot KK.
Figure 7. Position of assigned male parents donating pollens in the formation of harvested seed nuts from (A) female parent no. 149 and (B) 163 based on paternity analysis. Symbols represent position of: ( ) Tall kopyor hetero-zygous Kk female parent, ( ) heterozygous Kk assigned male parent, and ( ) Normal homozygous KK assigned male parent.
Dalam Gambar 7 dapat ditunjukkan bahwa hasil penyerbukan antara induk kelapa tipe Dalam Kopyor heterosigot Kk dengan donor serbuk sari kelapa Dalam normal Kk menghasilkan 100% buah normal, terdiri atas 50% buah normal heterosigot Kk dan 50% buah normal homosigot KK.
Pohon induk kelapa tipe Dalam kopyor heterosigot Kk yang posisinya berada di sekitar pohon kelapa tipe Dalam kopyor heterosigot Kk
kemungkinan besar menerima donasi serbuk sari yang berasal dari kelapa tipe Dalam kopyor heterosigot Kk lainnya (pola penyerbukan Kelompok 1). Dalam penelitian ini, beberapa buah yang dipanen dari pohon kelapa tipe Dalam Kopyor heterosigot Kk no. 193 dan 194 terbukti hanya mendapatkan donasi serbuk sari dari kelapa tipe Dalam Kopyor heterosigot Kk (pola penyer-bukan Kelompok 1), yaitu dari tetua jantan kelapa
87
Gambar 8. Posisi tetua jantan diduga mendonasikan serbuk sari pada pembentukan buah yangdipanen dari (A) induk no. 129 dan (B) 151 berdasarkan hasil analisis paternitas. Simbol mengindikasikan posisi: ( ) induk kelapa tipe Dalam normal homosigot KK, ( )tetua jantan tipe Dalam Kopyor heterosigot Kk, dan ( ) tetua jantan tipe Dalam normal homosigot KK. Figure 8. Position of assigned male parents donating pollens in the formation of seed nuts from (A) female
parent no. 129 and (B) 151 based on paternity analysis. Symbols represent position of: ( ) Tall normal homozygous KK female parent, ( ) Tall Kopyor heterozygous Kk assigned male parent, and ( ) Tall normal homozygous KK assigned male parent.
tipe Dalam Kopyor heterosigot Kk no. 117 untuk induk no. 194 dan dari tetua jantan kelapa tipe Dalam Kopyor heterosigot Kk no. 150 dan 213 untuk induk no 193.
Buah yang dipanen dari masing-masing induk kelapa Dalam Kopyor heterosigot Kk dan teridentifikasi tetua jantannya sebanyak 1-4 buah per pohon. Gambar 6 merupakan representasi posisi pohon induk tipe Dalam Kopyor heterosigot Kk yang menerima serbuk sari dari kelapa tipe Dalam Kopyor heterosigot Kk berdasarkan hasil analisis paternitas untuk populasi kelapa tipe Dalam Kalianda, di Kalianda, Lampung Selatan.
Pohon induk kelapa tipe Dalam Kopyor heterosigot Kk yang posisinya berada di sekitar pohon kelapa tipe Dalam normal homosigot KK dapat menerima donasi serbuk sari yang berasal dari kelapa tipe Dalam kopyor heterosigot Kk atau Normal homosigot KK (pola penyerbukan Kelom-pok 1). Dalam penelitian ini, beberapa buah yang dipanen dari pohon kelapa tipe Dalam Kopyor heterosigot Kk no. 149 dan 163 terbukti mendapat-kan donasi serbuk sari dari kelapa tipe Dalam Kopyor heterosigot Kk dan normal homosigot KK (pola penyerbukan Kelompok 1). Buah yang dipanen dari masing-masing induk heterosigot kopyor dan teridentifikasi tetua jantannya seba-nyak 3 buah per pohon. Dari jumlah tersebut, jumlah buah yang serbuk sarinya berasal dari kelapa Dalam normal homosigot KK berkisar antara 1 – 2 buah per pohon. Gambar 7 merupakan
representasi pohon induk tipe Dalam Kopyor heterosigot Kk yang menerima serbuk sari dari kelapa tipe Dalam Kopyor heterosigot Kk dan juga dari pohon normal homosigot KK berdasarkan hasil analisis pa-ternitas untuk populasi kelapa tipe Dalam Kalianda, di Kalianda, Lampung Selatan.
Pohon induk kelapa tipe Dalam normal homosigot KK yang posisinya berada di sekitar pohon kelapa tipe Dalam Kopyor heterosigot Kk berpotensi menerima donasi serbuk sari yang berasal dari kelapa tipe Dalam Kopyor (pola penyerbukan Kelompok 3) atau Dalam normal (pola penyerbukan Kelompok 4). Dalam penelitian ini, buah yang dipanen dari pohon kelapa tipe Dalam normal homosigot KK no. 129 dan no. 151 terbukti mendapatkan donasi serbuk sari dari kelapa tipe Dalam Kopyor heterosigot Kk (pola penyerbukan Kelompok 3) dan dari Dalam normal homosigot KK (pola penyerbukan Kelompok 4). Buah yang dipanen dari masing-masing induk kelapa no. 129 dan no. 151 dan teridentifikasi induk jantannya berkisar antara 4 – 7 buah per pohon. Dari jumlah tersebut, buah yang donor serbuk sarinya merupakan kelapa tipe Dalam Kopyor heterosigot Kk berkisar antara 1 – 4 buah per pohon sedangkan yang berasal dari Dalam normal homosigot KK sebanyak 3 buah per pohon. Persilangan kelapa Dalam normal homosigot Kk dengan kelapa Dalam Kopyor heterosigot Kk menghasilkan 100% buah normal yang embrio
88
sigotiknya terdiri dari 50% homosigot KK dan 50% heterosigot Kk. Gambar 8 merepresentasikan contoh pohon induk kelapa tipe Dalam Normal homosigot KK yang menerima serbuk sari dari kelapa Dalam Kopyor heterosigot Kk dan Dalam normal homosigot KK berdasarkan hasil analisis paternitas yang telah dilakukan.
Salah satu populasi kelapa tipe Dalam ber-buah kopyor ditemukan di Kecamatan Kalianda, Kabupaten Lampung Selatan (Mahmud, 2000). Di daerah sentra produksi kelapa tipe Dalam Kopyor seperti Lampung Selatan dan Sumenep, petani memperbanyak bibit kelapa kopyor dari pohon-pohon penghasil buah kopyor (pohon-pohon kopyor heterosigot Kk). Pengembangan tanaman kelapa berbuah kopyor ini dapat terjadi karena pohon kopyor petani selain menghasilkan buah kopyor dengan embrio sigotik homosigot kk, juga meng-hasilkan buah normal dengan embrio sigotik hete-rosigot Kk yang membawa alel pengendali sifat kopyor dan buah normal homosigot KK yang tidak membawa alel pengendali sifat kopyor. Buah kopyor bergenotipe homosigot kk bersifat letal dan jika dibibitkan tidak dapat berkecambah. Buah normal dengan embrio sigotik heterosigot Kk jika dibibitkan dapat berkecambah dan berkembang menjadi pohon kelapa kopyor heterosigot Kk yang berpotensi menghasilkan buah kopyor. Sebaliknya, buah normal dengan embrio sigotik homosigot KK jika dibibitkan dapat berkecambah dan berkem-bang menjadi pohon kelapa tetapi tidak dapat menghasilkan buah kopyor. Pola segregasi yang sama juga terjadi pada kelapa mutan Makapuno (Santos, 1999).
Pertanaman kelapa tipe Dalam berbuah kopyor (tanaman heterosigot Kk) di Kalianda, Lampung Selatan tercampur dengan kelapa tipe Dalam berbuah normal (tanaman homosigot KK). Pola pertanaman tersebut memungkinkan terjadi-nya persilangan alami antar heterosigot Kk dengan heterosigot Kk (pola penyerbukan Kelompok 1) atau dengan homosigot KK (pola penyerbukan Kelompok 2) yang ada disekitarnya. Selain itu, persilangan antara kelapa tipe Dalam dengan genotipe homosigot KK dengan tanaman hete-rosigot Kk (pola penyerbukan Kelompok 3) atau homosigot KK (pola penyerbukan Kelompok 4) yang ada di sekitarnya juga dapat terjadi sebagai-mana ditunjukkan dalam hasil penelitian ini. Pola penyerbukan seperti itu terjadi karena kelapa tipe Dalam pada umumnya cenderung menyerbuk silang akibat pada tandan yang sama periode ke-matangan (reseptif) bunga betina tidak bersamaan dengan periode matangnya (antesis) bunga jantan (Maskromo et al., 2011).
Buah kopyor terbentuk ketika gamet betina yang membawa alel k dan dua inti polar dengan alel kk dibuahi oleh gamet jantan yang membawa alel k, sehingga terbentuk buah dengan embrio sigotik homosigot kk dan endosperm homosigot kkk (Novarianto et al., 2014). Oleh karena itu, buah kopyor hanya mungkin terbentuk jika terjadi penyerbukan antara induk kopyor heterosigot Kk dengan tetua jantan heterosigot Kk (pola penyer-bukan Kelompok 1).
Buah kopyor tidak akan dihasilkan jika penyerbukan terjadi antara pohon induk hete-rosigot Kk dengan tetua jantan homosigot KK atau sebaliknya (pola penyerbukan Kelompok 2 atau 3). Pada penyer-bukan tersebut, buah yang terbentuk semuanya (100%) mempunyai fenotipe endosperm normal. Embrio sigotik pada buah normal hasil penyerbukan antara Kk x KK atau KK x Kk, mempunyai genotipe heterosigot Kk (50%) atau homosigot KK (50%). Oleh karena itu, pohon kopyor heterosigot Kk yang ditanam tercampur dengan pohon normal homosigot KK berpotensi mengalami penurunan hasil buah kopyor yang dipanen (buah kopyor < 25% dari total buah yang dipanen). Dalam penelitian ini berhasil dibuktikan pada pertanaman kelapa campuran, donor serbuk sari kelapa tipe Dalam homosigot KK dapat menyerbuki pohon induk tipe Dalam Kopyor hete-rosigot Kk sehingga berpotensi menurunkan hasil buah kopyor. Keberadaan pohon normal me-nurunkan kualitas bibit kelapa kopyor yang dihasilkan. Bibit kelapa kopyor dihasilkan dari buah normal yang mempunyai embrio sigotik dengan genotipe heterosigot Kk atau homosigot KK. Seperti penjelasan sebelumnya, persilangan antara pohon kopyor hetero-sigot Kk dengan pohon normal homosigot KK meningkatkan persentase buah normal yang embrio sigotiknya mempunyai genotipe homosigot KK dari 25% menjadi 50%, selanjutnya, benih kopyor yang embrio sigotiknya mempunyai genotipe hete-rosigot Kk menurun menjadi 50% dari total benih yang dipanen (Maskromo dan Novarianto, 2007b). Oleh karena itu, benih kopyor yang dipanen dari per-tanaman campuran pohon kelapa kopyor heterosigot Kk dengan pohon normal homosigot KK berpotensi menurun kualitasnya karena per-sentase buah normal dengan genotipe embrio sigotik homosigot KK meningkat dan heterosigot Kk menurun (Sudarsono et al., 2014b).
Berbagai hal yang dapat dilakukan untuk mencegah pengaruh negatif pohon normal ho-mosigot KK tersebut (Sudarsono et al., 2014a, Sudarsono et al., 2014b) antara lain dengan: (1) menebang pohon normal homosigot KK yang ada, (2) memanfaatkan mayang yang dihasilkan dari
89
pohon normal homosigot KK untuk menghasilkangula kelapa, atau (3) melakukan emaskulasi bunga jantan dari pohon normal homosigot KK agar tidak menjadi donor serbuk sari dengan alel K.
Penyerbukan antara induk kelapa tipe Dalam normal homosigot KK dengan donor serbuk sari dari kelapa tipe Dalam Kopyor hete-rosigot Kk (pola penyerbukan Kelompok 3) meng-hasilkan 100% buah normal, tetapi embrio sigotik-nya 50% homosigot KK dan 50% heterosigot Kk. Jika buahnya dibibitkan maka akan diperoleh bibit campuran yang terdiri atas 50% bibit kelapa normal homosigot KK dan 50% bibit kelapa kopyor heterosigot Kk. Bibit kelapa kopyor hete-rosigot Kk jika ditanam di lapangan dapat meng-hasilkan buah kopyor dengan persentase hasil 25% buah kopyor per tandan. Sebaliknya, hasil penyer-bukan antara induk kelapa tipe Dalam normal homosigot KK dengan donor serbuk sari dari kelapa tipe Dalam normal homosigot KK (pola penyerbukan Kelompok 4) menghasilkan 100% buah normal dengan embrio sigotik homosigot KK. Jika buahnya dijadikan sebagai benih maka didapatkan 100% benih kelapa normal.
Pembentukan buah kopyor merupakan contoh fenomena xenia pada kelapa. Pembentukan buah kopyor pada kelapa lebih ditentukan oleh genotipe tanaman donor serbuk sari dan bukan induknya.
Teknik kultur jaringan telah digunakan untuk menghasilkan bibit kelapa kopyor ho-mosigot kk dengan menanam embrio sigotik yang diisolasi dari buah kopyor. Meskipun secara alami buah kopyor tidak dapat berkecambah, tetapi embrio sigotik mampu tumbuh dan berkembang jika dikulturkan secara in vitro (Sukendah et al., 2008, Sudarsono et al., 2014a, Sudarsono et al., 2014b). Bibit kelapa kopyor homosigot kk berpotensi menghasilkan buah kopyor 100% per tandannya, dengan catatan tidak terjadi konta-minasi serbuk sari yang membawa alel K. Namun demikian, harga bibit kelapa kopyor homosigot kk hasil kultur jaringan tersebut masih relatif mahal (antara Rp500.000,- hingga Rp1.000.000,- per bibit). Harga bibit yang mahal tersebut membuat bibit hasil kultur embrio belum terjangkau oleh petani.
Pohon kelapa kopyor homosigot kk dapat ditanam sebagai sumber serbuk sari yang mem-bawa alel k. Petani dapat menanam 5-10 pohon kopyor homosigot kk untuk setiap 50-100 pohon kopyor heterosigot Kk yang telah ada. Penanaman pohon kopyor homosigot kk sebagai sumber serbuk sari pembawa alel k dapat meningkatkan produksi buah kopyor dari pohon kelapa kopyor heterosigot Kk dari 25% hingga menjadi 50%. Selain itu, kualitas bibit kopyor yang dihasilkan
meningkat dengan meningkatnya proporsi buah normal yang genotipe embrio sigotiknya hete-rosigot Kk (Sudarsono et al., 2014b).
KESIMPULAN
Serbuk sari kelapa tipe Dalam Kalianda menye-bar dengan jarak terdekat 0 m dan terjauh 63 m, tetapi jarak penyebaran serbuk sari ter-banyak berkisar pada jarak 40 – 50 m. Umumnya kelapa tipe Dalam Kalianda tergolong menyerbuk silang (outcrosser). Sebanyak 98% progeni yang dipanen dari kelapa tipe Dalam Kalianda meru-pakan hasil penyerbukan silang (outcrossing) dan hanya 2% terbukti sebagai hasil penyerbukan sendiri (selfing). Pada populasi cam-puran antara kelapa tipe Dalam Kopyor heterosigot Kk dan Normal homosigot KK, terbukti terjadi persilangan antar Kopyor Kk, antara Kopyor Kk dengan normal KK, antara normal KK dengan Kopyor Kk, dan antara normal homosigot KK. Dalam pe-nelitian ini, 49,0% progeni merupakan hasil per-silangan Kk x Kk, 22,4% hasil perper-silangan Kk x KK, 20,5% hasil persilangan KK x Kk, dan 6,1% hasil persilangan KK x KK.
UCAPAN TERIMA KASIH
Sebagian dari penelitian ini didukung oleh Direktorat Jenderal Pendidikan Tinggi, Kemen-terian Pendidikan dan Kebudayaan, Republik Indonesia melalui skim penelitian “Proyek Hi-LINK Kelapa Kopyor – tahun 2012-2014” yang berjudul “Peningkatan Produksi Buah Kopyor dengan Bantuan Polinator Lebah Madu dan Produksi Bibit Kopyor True-To-Type Melalui Persilangan Terkontrol,” dibawah koordinasi Prof.Dr. Sudarsono. Penelitian ini digunakan oleh penulis utama untuk penyusunan dokumen diser-tasi. Dalam studi S3-nya, penulis mendapat dukungan dana dari Beasiswa BPPS dan dari Program Hibah Doktor, Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan, Republik Indonesia. Penulis meng-ucapkan terima kasih kepada Bapak Siswanto, Dinas Perkebunan Kabupaten Lampung Selatan atas bantuan teknis di lapangan yang telah di-berikan.
DAFTAR PUSTAKA
Austerlizer, F., C.W. Dick., E.K. Klein, S.O. Muratorio, P.E. Smouse, and V.L. Sork. 2004. Using a genetic marker to estimate the
90
pollen dispersal curve. Molecularecology. 13:937-954.
Barfod, S.A., Melanie Hagen and Finn Borchsenius. 2011. Twenty-five years of progress in under-standing pollination mechanisms in palms (Arecaceae). Annals of Botany 108: 1503–1516, 2011 doi:10.1093/aob/mcr192. Brody, J.R. and S.E. Kern. 2004. History and
principles of conductive media for standard DNA electrophoresis. Analytical Bio-chemistry 333(1): 1–13.
Burczyk, J. and T. Koralewski. 2005. Parentage versus two-generation analyses for estimating pollen-mediated gene flow in plant population. Mol Ecol. 14:2525-2537. Carneiro, F.S., A.E.B. Lacerda, M.R. Lemes, R.
Gribel, M. Kanashiro, L.H.O. Wadtand, A.M. Sebbenn. 2011. Effects of selective logging on the mating system and pollen dispersal of Hymenaea courbaril L. (Leguminosae) in the Eastern Brazilian Amazon as revealed by microsatellite analysis. Forest Ecology and Management. 262:1758-1765.
Chomchalow, N. 2013. Curd coconut: Its mystery and potentialities. International J. Coconut Research and Development (CORD) 29(2):46-51.
Creste, S., A.N. Tulmann and A. Figueira. 2001. Detection of single sequence repeat poly-morphism in denaturing polyacrylamide sequencing gels by silver staining. Plant Mol Biol Reporter 19:299-306.
DebMandal, M. and M. Shyamapada. 2011. Coconut (Cocos nucifera L.: Arecaceae): In health pro-motion and disease prevention. Asian Pacific Journal of Tropical Medicine.4(3):241-247.
Esteras, C., P. Gomez, J.M. Antonio, B. Jose, V.D. Nelly, R. Cristina, N. Fernando and P. Belen. 2012. High-throughput SNP genotyping in Cucurbita pepo for map construction and quantitative trait loci mapping. BMC Genomics 2012, 13:80.doi:10.1186/1471-2164-13-80.
Herrera, M.M., W.M. Alan, W.B. James, N.K. David, and J.S. Raymond. 2007. Usefulness of WRKY genederived markers for assessing genetic population structure: An example with Florida coconut cultivars. Scientia Horticulturae 115:19–26.
Hutapea, T.P., N. Mashud dan I. Maskromo. 2007. Keragaan usahatani dan analisis finansial kelapa kopyor di Indonesia. Buletin Palma 33 : 45-57. Puslitbangbun. Badan Litbang Pertanian.
Larekeng, S,H., I. Maskromo, A. Purwito, N,A. Mattjik, and S. Sudarsono. 2015. Pollen dispersal and pollination patterns studies in Pati Kopyor Coconut using molecular marker. International J. Coconut Research and Development (CORD). 31(1):46-60. Lebrun, P., L. Baudouin, T. Bopurdeix, J.L. Konan,
J.H.A. Barker, C. Aldam, A. Herran, and E. Ritter. 2001. Construction of linkage map of the Rennell Island Tall coconut type (Cocos nucifera L.) and QTL analysis for yield characters. Genome. 44:962-970.
Mahmud, Z. 2000. Petunjuk teknis budidaya kelapa kopyor.Departemen Kehutanan dan Perkebunan. Jakarta (ID): Dirjen Perke-bunan.
Marshall, T.C., J. Slate, L.E.B. Krilek and J.M. Pemberton. 1998. Statistical confidence for likehood based paternity inference in nature populations. Mol Ecol. 7:639-655.
Marsico, T.D., J.H. Jessica, and J. Romero-Saverson. 2009. Patterns of seed dispersal and pollen flow Quercus garryana (Fagaceae) following post-glacial climatic changes. J. Biogeogr. 36(5):929-941.
Martinez., T.R., L. Baudoin, A. Berger, and M. Dollet. 2010. Characterization of genetic diversity of tall coconut (Cocos nucifera L.) in the Dominican Republic using microsatellite (SSR) marker. Tree Genetics & Genomes. 6(1):73-81. Doi: 10.1007/S11295-009-0229-6. Maskromo, I., H. Novarianto dan N. Mashud.
2007a. Potensi pengembangan kelapa kopyor di Indonesia. Warta Penelitian dan Pengembangan Tanaman Industri 13(1). Maskromo, I. dan H. Novarianto. 2007b.
Perbanyakan kelapa kopyor secara alami.
Dalam: Mashud, N, E.T. Tenda,
Miftahorcahman, J.S. Warroka, J.C. Alouw, J. Mawikere, dan J. Kumaunang (eds.) Monograf Kelapa Kopyor. Balai Penelitian Tanaman Kelapa dan Palma Lain. Pusat Penelitian dan Pengembangan Perkebunan. Badan Litbang Pertanian. hlm. 9-18.
Maskromo, I., H. Novarianto, Sudarsono. 2011. Fenologi pembungaan tiga varietas kelapa genjah kopyor Pati. Di dalam: Roedhy P, Slamet S, Anas D, Nurul K, Dewi S, Sintho WA, editor. Prosiding Seminar PERHORTI Kemandirian Produk Hortikultura untuk Memenuhi Pasar Domestik dan Ekspor; 2011. Nov 23-24; Lembang, Indonesia. Bogor (ID): Perhimpunan Hortikultura Indonesia. Hlm 1002-1010.
Maskromo, I., H. Novarianto, D. Sukma dan Sudarsono. 2012a. Potensi hasil plasma
91
nutfah kelapa kopyor asal Kalianda, Pati,Sumenep dan Jember. Prosiding Seminar Nasional Pemanfaatan SDG Lokal Men-dukung Industri Perbenihan Nasional. Bandung, 10 Desember 2011. pp.499-506. Maskromo, I., Sudarsono, H. Novarianto. 2012b.
Potensi produksi pohon induk kelapa dalam kopyor asal Kalianda, Lampung Selatan. Prosiding Simposium dan Seminar Bersama PERAGI-PERHORTI-PERIPI-HIGI
Mendukung kedaulatan pangan dan energi yang berkelanjutan. 2012. Bogor (ID) : Hlm 430-436.
Maskromo, I., H. Novarianto, Sukendah, D. Sukma, dan Sudarsono. 2013. Productivity of three Dwarf kopyor coconut varieties from Pati, Central Java, Indonesia. International J. on Coconut R & D 29(2):19-28.
Maskromo, I., H. Novarianto, Sukendah, D. Sukma dan Sudarsono. 2014. Keragaman komponen buah dan kuantitas endosperm kelapa dalam Kopyor Kalianda dan kelapa Genah Kopyor Pati. Buletin Palma 15(2):75-83. Maskromo, I., E.T. Tenda, M.A. Tulalo, H.
Novarianto, D. Sukma, Sukendah, dan Sudarsono. 2015. Keragaman fenotipe dan genetik tiga varietas kelapa genjah kopyor asal Pati Jawa Tengah. Jurnal Penelitian Tanaman Industri (Jurnal LITTRI) 21(1):1-8. Milleron Matias, Unai Lopez de Heredia, Zaida
Lorenzo, Ramon Perea, Aikaterini Dounavi, Jesus Alonso, Luis Gil, Nikos Nanos. 2012. Effect of canopy closure on pollen dispersal in a wind-pollinated species (Fagus sylvatica L.). Plant.Ecology. 213:1715-1728.
Mondini, L., A. Noorani, and M.A. Pagnota. 2009. Assessing plant genetic diversity by molecular tools. Review Diversity J. 1:19-35. Novarianto, H., I. Maskromo, D. Dinarti, and
Sudarsono. 2014. Production technology for Kopyor coconut seednuts and seedlings in Indonesia. International Journal on Coconut R & D. 30(2):31-40.
Ottewell, K., E. Grey, F. Castillo and J. Karubian. 2012. The pollen dispersal kernel and mating system of an insect-pollinated tropical palm, Oenocarpus bataua. Heredity 109:332-339.
Park, Y.J., J.K. Lee, and N.S. King. 2009. Simple Sequence Repeat Polymorphisms (SSRPs) for evaluation of molecular diversity and germplam classification of minor crops. Molecul. J. 14: 4546-4569.
Perera, L. 2010. Hybrid testing and variety identi-fication of coconut (Cocos nucifera L.) in
Srilangka using microsatellite marker.Inter-national Journal on Coconut R & D. 26(1): 39-46.
Perera, P.I.P., V. Hocher, L.K. Weerakoon, D.M.D. Yakandawala, S.C. Fernando, and J.L. Verdeil. 2010. Early inflorescence and floral develop-ment in Cocos nucifera L. (Arecaceae: Arecoideae). South African J. Bot. 76:482-492. Doi: 10.1016/ j.sajb.2010.03.006.
Prabha, S.S., E.P. Indira, and P.N. Nair. 2011. Con-temporary gene flow and matting system analysis in natural teak forest using micro-satellite markers. Current Science 101 (9):1213-1219.
Rajesh, M.K., V. Arunachalam, P. Nagarajan, P. Lebrun, K. Samsudeen, and C. Thamban. 2008. Genetic survey of 10 Indian coconut landraces by Simple Sequence Repeats (SSRs). Scientia Horticulturae 118:282–287. Ribeiro, E.F., L. Boaudoin, P. Lebrun, L.J. Chaves,
C. Brondani, M.I. Zucchi, and R. Vencovsky. 2010. Population structure of Brazilian tall coconut (Cocos nucifera L.) by microsatellite markers. Genetic and Molecular Biology. 33(4):696-702.
Sajib, A.M., M.M. Hossain, A.T.M.J. Mosnaz, H. Hossain, M.M. Islam, M.S. Ali, S.H. Prodhan. 2012. SSR marker-based molecular charac-terization and genetic diversity analysis of aromatic landreces of rice (Oryza sativa L.). J. BioSci. Biotech. 1(2): 107-116. Samonthe, L.J., E.M.T. Mendoza, L.L. Ilag, N.D. De
La Cruz, and D.A. Ramirez. 1989. Galactomannan degrading enzyme in maturing normal and Makapuno and germinating normal coconut endosperm. Phytochemistry 28:2269-2273.
Santos, G.A. 1999. Potential use of clonal propagation in coconut improvement program. In Oropeza C, Verdiel JL, Ashburner GR, Cardena R, and Samantha JM (eds.) Current Advances in Coconut Biotechnology – Current Plant Science and Biotechnology in Agriculture. Kluwer Acad. Publ., London. Pp. 419-430.
Schuster, W.S.F. and J.B. Mitoon. 2000. Paternity and gene dispersal in limberpine (Pinus flexilis James). Heredity. 84:348-361.
Sudarsono, H. Novarianto and I. Maskromo. 2011. Diversity of endosperm quantity among Kalianda Tall coconut. Poster presented at International Seminar on Natural Resources, Climate Change, and Food Security (ISNAR C2FS), Surabaya, INDONESIA. 27-28 June 2011.
92
Sudarsono, Sudrajad, H. Novarianto, M.L.A. Hosang, D. Sukma, D. Dinarti, M.R. Rahayu, I. Maskromo, dan Yuliasti. 2014a. Pen-dekatan genomik dan molekuler untuk pengembangan kultivar unggul kelapa eksotik asal Indonesia, penyediaan bibit dan pengendalian hamanya. Laporan Akhir KKP3N. IPB bekerjasama dengan Badan Penelitian dan Pengembangan Pertanian dan PATIR – BATAN, INDONESIA.
Sudarsono, Sudrajad, H. Novarianto, M.L.A. Hosang, D. Dinarti, M.R. Rahayu, dan I. Maskromo. 2014b. Produksi bibit kopyor true to type dengan persilangan terkontrol dan peningkatan produksi buah kopyor dengan polinator lebah madu. Laporan Akhir Program Hi Link. Bogor (ID): Institut Pertanian Bogor.
Sudarsono, I. Maskromo dan H. Novarianto. 2014c. Status penelitian dan pengembangan kelapa Kopyor di Indonesia. Prosiding Konferensi Nasional Kelapa (KNK) VIII. Jambi, 21-22 Mei 2014. Badan Litbang Pertanian. Hlm. 53-64.
Sukendah, Sudarsono, Witjaksono, dan Khumaida N. 2008. Perbaikan teknik kultur embryo (Cocos nucifera L.) asal Sumenep Jawa Timur melalui penambahan bahan aditif dan pengujian periode sub-kultur. Bul. Agron. 36(1):16-23.
Sukendah, H. Volkaert and Sudarsono. 2009. Isolation and analysis of DNA fragment of genes related to Kopyor trait in coconut plant. Indonesian J. Biotech. 14(2):1169-1178. Sutanto, A., D. Sukma, C. Hermanto, and
Sudarsono. 2014. Isolation and characte-rization of Resistance Gene Analogue (RGA) from Fusarium resistant banana cultivars. Emirates J. Food and Agriculture. 26(6):508-518.
Tinche, Dwi Asmono, D. Dinarti, Sudarsono. 2014. Keragaman genetik kelapa sawit (Elaeis guineensis Jacq.) Populasi Nigeria Berdasar-kan Analisis Marka SSR. Buletin Palma. 15 (1):14-23.
Wattanayothin, S. 2005. The study on curd coconut hybrids. J. TNCEL 1(3):6-7.
Wattanayothin, S. 2010. Variety improvement of Makapuno. Proceedings of the XLIV COCOTECH Meeting, 5-9 July 2010, Samui Island, Thailand. pp. 96-108.
Yao, S.D.M., K.J.L. Konan, N.D. Pokou, K.J.N. Konan, A.E. Assali, R.S. Sie, and B.I.A. Zoro. 2013. Assessment of the genetic diversity conser-vation in three tall coconut (Cocos nucifera L.) accessions regenerated by controlled polli-nation, using microsatellite markers. African J. Biotechnol. 12(20): 2808-2815. Doi: 10.5897/AJB11.3608.