BAB 2
TINJAUAN PUSTAKA
2.1. Sejarah Perkembangan Perusahaan
PT. Tirta Sibayakindo merupakan perusahaan yang bergerak di bidang pengolahan Air Minum Dalam Kemasan (AMDK).Awalnya, industri air minum di Indonesia diprakarsai oleh Almarhum Tirto Utomo. Beliau mendirikan perusahaan dengan nama PT. Golden Mississippi yang memiliki pabrik di Bekasi, Jawa Barat . Pada tahun 1989 nama PT. Golden Mississippi diganti menjadi PT. AQUA Golden Mississippi (AGM). PT. AGM ini merupakan perusahaan pertama di Indonesia yang bergerak di bidang pengolahan Air Minum Dalam Kemasan dengan merk dagang “AQUA”.
pada tahun 1990 kepada PT. Tirta Sibayakindo (Berastagi) sebagai pabrik ke-5 di Indonesia.
Tanggal 4 September 1998 merupakan hari bersejarah bagi PT. AQUA Group, karena salah satu produsen raksasa air minum dalam kemasan yang berpusat di Paris, Prancis melakukan kerjasama yaitu Group Danone yang diwakili oleh Danone Asia.
1.1. Permasalahan
1. Berapakah kadarkesadahan dan alkalinitas pada air minum dalam kemasan hasil pengolahan PT. Tirta Sibayakindo.
2. Bagaimanakah perbandingan antarakadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo dengan SNI.
1.2. Tujuan
1. Untuk mengukur kadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindoselama lima hari mulai pada tanggal 09Februari sampai 13 Februari 2016.
2. Untuk membandingkan kadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo dengan SNI.
3.
1.3.Manfaat
1. Dapat mengetahui kadar kesadahan dan kadar alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo.
2.2. Definisi Air
Air merupakan sumber daya alam yang diperlukan untuk hajat hidup yang banyak, bahkan oleh semua makhluk hidup. Oleh karena itu, sumber daya air harus dilindungi agar tetap dapat dimanfaatkan dengan baik oleh manusia serta makhluk hidup yang lain. Pemanfaatan air untuk berbagai kepentingan harus dilakukan secara bijaksana, dengan memperhitungkan kepentingan generasi sekarang maupun generasi mendatang. Aspek pengamatan dan pelestarian sumber daya air harus ditaman pada segenap pengguna air (Effendi,2003).
Pada prinsipnya, jumlah air dialam ini tetap dan mengikuti suatu aliran yang dinamakan “ cyclus hydrologie”. Dengan adanya penyinaran matahari, maka semua air yang ada pada permukaan bumi akan bersatu dan berada ditempat yang tinggi yang sering dikenal dengan nama awan. Oleh angin, awan ini akan terbawa makin lama makin tinggi dimana temperatur diatas semakin rendah, yang menyebabkan titik-titik air jatuh kebumi sebagai hujan. Air hujan ini sebagian mengalir kedalam tanah jika menjumpai lapisan rapat air, maka perserapan akan berkurang, dan sebagian air akan mengalir diatas lapisan rapat air ini. Jika air ini keluar pada permukaan bumi, umumnya berbentuk sungai-sungai dan jika melalui suatu tempat rendah (cekung) maka air akan berkumpal, membentuk suatu danau atau telaga. Tetapi banyak diantaranya yang mengalir kelaut kembali dan kemudian akan mengikuti siklus hidrologi ini (Sutrisno,1994).
menyebabkan penurunan kualitas air. Kondisi ini menimbulkan gangguan, kerusakan, dan bahaya bagi semua makhluk hidup yang bergantung pada sumber daya air.Oleh karena itu, pengolahan sumber daya air sangat penting agar dimanfaatkan secara berkelanjutan dengan tingkat mutu yang diinginkan. Salahsatu langkah pengelolaan yang dilakukan adalah pemantauan dan interprestasi data kualitas air, mencakup kualitas fisika, kimia, dan biologi.
Berdasarkan Peraturan Pemerintah Republik Indonesia No. 20 tahun 1990 tentang Pengendalian Pencemaran Air mendefenisikan kualitas air sebagai sifat air dan kandungan makhluk hidup, zat, energi, atau komponen lain didalam air. Kualitas air dinyatakan dengan beberapa parameter, yaitu parameter fisika (suhu, kekeruhan, padatan terlarut dan sebagainya), parameter kimia (pH, BOD,COD, kadar logam, dan sebagainya). Dan parameter biologi (keberadaan plankton, bakteri, dan sebagainya).
Berdasarkan peraturan Pemerintah No.20 tahun 1990 mengelompokkan kualitas air menjadi beberapa golongan menurut peruntukkannya. Adapun penggolongan air menurut Effendi (2003) adalah sebagai berikut :
1. Golongan A, yaitu air yang dapat digunakan sebagai air minum secara langsung, tanpa pengolahan terlebih dahulu.
2. Golangan B, yaitu air yang dapat digunakan sebagai air baku air minum. 3. Golongan C, yaitu air yang dapat digunakan untuk keperluan perikanan
dan pertenakan.
2.3. Sumber Air
Menurut Sutrisno (1994), secara garis besar dapat dikatakan air bersumber dari :
1. Air Laut
Air yang dijumpai didalam alam berupa air laut sebanyak 80% , sedangkan sisanya berupa air tanah/daratan, es, salju, dan hujan. Air laut mempunyai sifat asin, karena mengandung garam NaCl. Kadar NaCl dalam air laut 3%. Dengan keadaan ini, maka air laut tidak memenuhi syarat untuk air minum.
2. AirAtmosfir
Dalam keadaan murni, sangat bersih, karena dengan adanya pengotoran udara yang disebabkan oleh kotoran-kotoran industri/debu dan lain sebagainya. Maka untuk menjadikan air hujan sebagai sumber air minum hendaknya pada waktu menampung air hujan jangan dimulai pada saat mulai turun, karena masih mengandung banyak kotoran.
3. Air Permukaan
Air permukaan ada dua macam yakni : 1. Air sungai
Dalam penggunaannya sebagai air minum, haruslah mengalami suatu pengolahan yang sempurna, mengingat bahwa air sungai ini pada umumnya mempunyai derajat pengotoran yang tinggi sekali. Debit yang tersedia untuk memenuhi kebutuhan akan air minum pada umumnya dapat mencukupi.
2. Air rawa atau danau
Kebanyakan air rawa ini berwarna yang disebabkan oleh adanya zat-zat organik yang telah membusuk, misalnya asam humus yang larut dalam air yang menyebabkan warna kuning coklat.
3. Air Tanah
Air tanah adalah air yang berasal dari permukaan yang merembes kedalam tanah, yang terdapat didalam ruang-ruang butir antara butir-butir tanah didalam lapisan bumi. Suatu saat air ini akan memenuhi lapisan tanah yang keras dan kuat, maka air ini akan keluar permukaan sebagai mata air.
Air tanah terbagi antara : 1. Air tanah dangkal
merupakan air tanah dangkal dimana air tanah ini dimanfaatkan sebagai air minum melalui sumur-sumur dangkal.
2. Air tanah dalam
Terdapat setelah lapis rapat air yang pertama. Pengambilan air tanah dalam, tidak semudah pada air tanah dangkal. Dalam hal ini harus digunakan bor dan memasukkan pipa kedalamnya sehingga dalam suatu kedalaman (biasanya antara 100-300 m) akan didapatkan suatu lapis air. Kualitas air tanah dalam pada umumnya lebih baik dari air dangkal, karena penyaringannya lebih sempurna dan bebas dari bakteri. Susunan dari unsur-unsur kimia tergantung pada lapis-lapis tanah yang dilalui. Jika melalui tanah kapur, maka air itu akan menjadi sadah, karena mengandung Ca(HCO3)2 dan Mg(HCO3)2.
3. Mata air
Mata air adalah air tanah yang keluar dengan sendirinya kepermukaan tanah. Mata air yang berasal dari tanah dalam, hampir tidak terpengaruh oleh musim dan kualitasnya sama dengan keadaan air tanah dalam.
2.4. Karakteristik Air
Menurut Effendi (2003), air memiliki karakteristik yang tidak dimiliki oleh senyawa kimia lain, karakter tersebut antara lain :
2. Perubahan suhu air berlangsung lambat sehingga air memiliki sifat sebagai penyimpan panas yang sangat baik.
3. Air memerlukan panas yang tinggi pada proses penguapan. Penguapan adalah proses perubahan air menjadi uap air.
4. Air merupakan pelarut yang baik.
5. Air memiliki tegangan permukaan yang tinggi.
6. Air merupakan satu-satunya senyawa yang merenggang ketika membeku.
2.5. Air Minum
Air minum adalah air yang melalui proses pengolahan atau tanpa proses pengolahan yang memenuhi syarat kesehatan dan dapat langsung di minum (Kepmenkes, RI. 2002).Air minum yang baik dan aman untuk kesehatan jika memenuhi persyaratan fisika, mikrobiologis dan kimiawi sesuai dengan parameter yang ditentukan oleh Permenkes RI No.492/Menkes/Per/IV/2010.
2.5.1. Syarat-Syarat Air Minum
Air minum yang ideal seharusnya jernih, tidak berwarna, tidak berasa, dan tidak berbau. Air minum pun seharusnya tidak mengandung kuman patogen dan segala yang membahayakan kesehatan manusia. Tidak mengandung zat kimia yang dapat mengubah fungsi tubuh, tidak dapat secara estetis, dan dapat merugikan secara ekonomis. Air itu seharusnya tidak korosif, tidak meninggalkan endapan pada seluruh jaringan distribusinya.
Menurut Sutrisno (1994), dari segi kualitas air minum harus memenuhi : a. Syarat Fisik
1. Air tidak boleh berbau
Air minum yang berbau selain tidak estetis juga tidak akan disukai oleh masyarakat. Bau air dapat member petunjuk akan kualitas air. Misalnya, bau amis dapat disebabkan oleh tumbuhnya Algae.
2. Air tidak boleh berasa
Air minum biasanya tidak memberi rasa/tawar. Air minum yang tidak tawar dapat menunjukkan kehadiran berbagai zat yang dapat membahayakan kesehatan. Rasa logam/amis, rasa pahit, asin, dan sebagainya. Efeknya tergantung pada penyebab timbulnya bau tersebut.
3. Air tidak boleh berwarna
Air minum sebaiknya tidak berwarna untuk alasan estetis dan untuk mencegah keracunan dari berbagai zat kimia maupun mikroorganisme yang berwarna.
4. Kekeruhan
5. Suhu air hendaknya dibawah sela udara (sejuk ± 25ºC) agar :
- Tidak terjadi pelarutan kimia yang ada pada saluran/pipa yang dapatmembahayakan kesehatan
- Menghambat reaksi-reaksi biokimia didalam saluran/pipa - Mikroorganisme patogen tidak mudah berkembang biak - Bila diminum air dapat menghilangkan dahaga.
6. Jumlah zat padat terlarut (TDS)
TDS biasanya terdiri dari zar organik, garam anorganik dan gas terlarut. Bila TDS bertambah maka kesadahan akan naik pula.
b. Syarat Kimia
Air minum tidak boleh mengandung racun, zat-zat mineral atau zat-zat kimia tertentu dalam jumlah melampaui batas yang telah ditentukan.
c. Syarat Bakteriologik
Air minum tidak boleh mengandung bakteri-bakteri penyakit (patogen) dan tidak boleh mengandung bakteri-bakteri golongan Coli melebihi batas-batas yang telah ditentukan yaitu 1 Coli/100 ml air.Bakteri golongan Coli ini bersal dari usus besar (feaces) dan tanah.
Bakteri patogen yang mungkin ada dalam air antara lain adalah : - Bakteri typshum
- Vibrio colereae - Bakteri dysentriae - Entamoeba histolyhes
Air yang mengandung Coli dianggap telah terkontaminasi (tercemar) dengan kotoran manusia.
2.5.2. Manfaat Mineral Dalam Air Minum
Air minum menjadi sumber air yang utama dibutuhkan oleh tubuh.Namun harus di ingat, bahwa air di alam selalu mengandung zat-zat terlarut terutama mineral.Maka secara alamiah air yang di minum harus memenuhi syarat tertentu, yakni tidak mengandung zat-zat berbahaya, seperti racun khususnya logam-logam toksis misalnya timbal, kadmium, merkuri, dan juga tidak boleh ada bakteri yang patogen.Sebaliknya, air minum harus mengandung mineral utama seperti kalsium, magnesium, dan kalium.
2.6. Kesadahan
Kesadahan berasal dari kata sadah yang berarti mengandung kapur, jadi kesadahan air adalah adanya kandungan kapur yang berlebih pada air yangdisebabkan oleh lapisan tanah kapur yang dilaluinya. Jenis sumber air yang banyak mengandung sadah air tanah khususnya air tanah dalam. Air sadah dapat menyebabkan sabun sukar berbuih, hal ini diakibatkan oleh kandungan natriumstearat (C17H35COONa) dalam sabun yang beraksi dengan ion-ion Mg2+dan Ca2+
Mg
yang membentuk busa buih yang mengendap,
2+
Karena sabun diendapkan, maka busa sabun baru akan terbentuk bila semua ion-ion magnesium dan kalsium telah terendapkan. Ini berarti untuk mencuci diperlukan sabun dengan jumlah yang banyak (Kusuma, 2007).
(aq)
Kesadahan pada dasarnya dapat dibedakan menjadi dua jenis yaitu :
1. Kesadahan sementara
CaCO3(s) + CO2(s) + H2O Ca(HCO)
2. Kesadahan tetap
3(aq)
Kesadahan tetap adalah kesadahan yang disebabkan oleh ion Ca2+danMg2+yang berikatan dengan ion Cl-, SO42-, NO-3, contohnya CaCl2, MgSO4
Istilah kesadahan digunakan untuk menunjukkan kandungan garam kalsium dan magnesium yang terlarut, dinyatakan sebagai ekuivalen (setara) kalsium karbonat. Air sadah adalah air yang mengandung beberapa jenis mineral yaitu Ca, Mg, Sr, Fe dan Mn yang konsentrasinya tinggi sehingga mengakibatkan air menjadi keruh dan dapat mengurangi daya kerja sabun serta menimbulkan kerak pada dasar ketel. Kesadahan air dikenal dengan nama kekerasan air atau (hard water).
. Kesadahan tetap terjadi ketika air melewati daerah bebatuan yang mengandung magnesium sulfat dan kalsium klorida. Kesadahan ini tidak dapat dihilangkan hanya dengan pendidihan atau dengan penambahan kapur mati,tetapi dapat dihilang dengan penambahan soda basuh atau menggunakan proses permutit (yang juga dapat dipakai untuk air sadah sementara) (Kusuma,2007). Kesadahan ini disebut juga kesadahan non karbonat yang dapat dihilangkan dengan cara pertukaran ion.
Menurut Gabriel (2001), berdasarkan kadar kalsium dalam air maka tingkat kesadahan air digolongkan dalam 4 (empat) kelompok yaitu :
1. Kadar CaCO3 2. Kadar CaCO
terdapat dalam air0-75 mg/l disebut air lunak (soft water)
3
3. Kadar CaCO
terdapat dalam air 75-150 mg/l disebut moderately hard water
3
4. Kadar CaCO
terdapat dalam air 150-300 mg/l disebut hard water
Kesadahan (hardness) adalah merupakan sifat air yang disebabkan oleh adanya ion-ion (kation) logam valensi dua. Kation-kation ini dapat bereaksi dengan sabun membentuk endapan (presipitasi) maupun dengan anion-anion yang terdapat didalam air membentuk kerak air dan endapan atau karat pada peralatan logam.Kesadahan dalam air terutama disebabkan oleh ion-ion Ca2+dan Mg2+juga oleh Mn2+, Fe2+
Pada umumnya airsadah berasal dari daerah dimana lapisan tanah atas (topsoil) tebal, dan ada pembentukan batu kapur. Yang dimaksuddengan kesadahan total adalah kesadahan yang disebabkan oleh adanya ion Ca
dan semua kation yang bermuatan dua ( Santika, 1987).
2+ dan Mg2+secara bersama-sama. Ini disebabkan karena kebanyakankesadahan dalam air alam adalah disebabkan oleh dua kation tersebut.Sedangkan perairan lunak berada pada wilayah dengan lapisan tanah dan tipis dan batuan kapur relatif sedikit atau bahkan tidak ada (Effendi, 2003).
2.6.1. Penentuan Kesadahan Air
Kesadahan total yaitu jumlah ion-ion Ca2+ dan Mg2+
ion-ion kesadahan dan beberapa jenis ion lainnya. Pasangan tersebut lebih kuat dari pada hubungan antara indikator dengan ion-ion kesadahan. Oleh karena itu, pada pH 10 jumlah molekul EDTA yang ditambahkan sebagai titran sama (ekuivalen) dengan jumlah ion-ion kesadahan dalam sampel, dan molekul indikator terlepas dari ion kesadahan (Santika, 1984).Eriochrom Black T (EBT) adalah jenis indikator yang berwarna merah muda dan bila berada dalam larutan yang mengandung ion kalsium dan magnesium pada pH 10.
2.6.2. Metode Penghilangan Kesadahan Air
Beberapa metode penghilangan kesadahan air yaitu, pendidihan, penambahan kapur mati, penambahan soda pencuci, dan proses pertukaran ion.
1. Pendidihan
Jika air dididihkan, hanya kesadahan sementara yang dapat dihilangkan. Bikarbonat dipecah menjadi karbonat, air dan karbon dioksida, berikut persamaanya:
Ca(HCO3)2 CaCO3↓ + H2O + CO
Kalsium Kalsium Air karbonat
2
bikarbonat Karbonat dioksida
Karbonat adalah endapan dan oleh karena itu tidak bereaksi dengan sabun dan keluar dari larutan.
2. Penambahan kapur mati ( Proses Clark )
kapur tersebut hanya mampu untuk menetralkan bikarbonat dan terbentuk kalsium karbonat yang tidak larut.
Ca(HCO3)2 + Ca(OH)2 2 CaCO3↓ + 2 H2
Kalsium Kalsium Kalsium Air
O
Bikarbonat hidroksida karbonat
(air sadah) (kapur mati) (tidak larut)
3. Penambahan soda pencuci
Metode ini menghilangkan kesadahan sementara dan kesadahan tetap.Soda pencuci (natrium karbonat) bereaksi dengan garam kalsium danmagnesium dalam air sadah membentuk garam natrium yang larut dan garam kalsium dan magnesium yang tidak larut yang tertinggal sebagai endapan.
CaSO4 + Na2CO3 CaCO3↓ + Na2SO
Kalsium Natrium Kalsium Sodium
4
Sulfat karbonat karbonat sulfat
(air sadah) (soda pencuci) (tidak larut) (larut) 4. Proses pertukaran ion
Metode ini digunakan dalam rumah tangga dan industri untuk menghilangkan kesadahan sementara dan kesadahan tetap. Proses ini meliputi penggunaan resin alami dan resin buatan seperti zeolit. Air sadah dilewatkan melalui kolomyang diisi resin dan ion-ion kalsium dan magnesium dalam air ditukar ion natrium dalam resin (Gaman, 1992 ).
Titrasi kompleksometri atau kelatometri adalah suatu jenis titrasi dimana reaksi antara bahan yang dianalisis dan titrat akan membentuk suatu senyaw da dari dua komponen yang membent yang hendak diamati (Anonim, 2012).
Titrasi kompleksometri meliputi reaksi pembentukan ion-ion kompleks ataupun pembentukan molekul netral yang terdisosiasi dalam larutan.Persyaratan mendasar terbentuknya kompleks demikian adalah tingkat kelarutan tinggi.Contoh dari kompleks tersebut adalah kompleks logam dengan EDTA. Menurut
Achmad Mursyidi dan Abdul Rohman (2008), cara-cara titrasi dengan EDTAterbagi menjadi 5, yaitu :
1. Titrasi langsung merupakan metode yang paling sederhana dan seringdipakai, misalnya dapat pH 10 lalu ditambahkan indikator logamyang sesuai dan dititrasi langsung dengan larutan baku dinatrium edetat.
3. Titrasi substitusi, cara ini dilakukan bila ion logam tersebut tidak memberikan titik akhir yang jelas apabila dititrasi secara langsung atau dengan titrasi kembali, atau juga jika ion logamtersebut membentuk kompleks dengan dinatrium edetat lebih stabil daripada logam lain sepertimagnesium dan kalsium.
4. Titrasi tidak langsung, cara titrasi tidak langsung dapat digunakan untuk menentukan kadar ion-ion seperti anion yang tidak bereaksi dengan pengkelat. Sebagai contoh barbiturat tidak bereaksidengan EDTA akan tetapi secara kuantitatif dapat diendapkan dengan ion merkuri dalamkeadaan basa sebagai ion kompleks 1:1. Setelah pengendapan dengan kelebihan Hg(II),kompleks dipindahkan dengan cara penyaringan dan dilarutkan kembali dalam larutan bakuEDTA berlebihan. Larutan baku Zn(II) dapat digunakan untuk menitrasi kelebihan EDTA inimenggunakan indikator yang sesuai untuk mendeteksi titik akhir.
5. Titrasi alkalimetri, pada metode ini proto dari dinatrium edetat (Na2H2Y) dibebaskan oleh logam berat dan dititrasi dengan larutan baku alkali. Larutan logam yang ditetapkan dengan metode ini sebelum dititrasi harus dalam suasana netralterhadap indikator yang dipergunakan.Penetapan titik akhir menggunakan indikator asam-basaatau secara potensiometri.
2.7. Alkalinitas
perairan adalah anion bikarbonat (HCO3-), karbonat (CO3-), dan hidroksida (OH-). Garam dari asam lemah lain seperti : Borat (H2BO3-), silikat (HSiO3-), fosfat (HPO42-dan HPO4-), sulfida (HS-), dan ammonia (NH3
Pada keadaan tertentu (siang hari) adanya ganggang dan lumut dalam air dapat menyebabkan turunnya kadar karbondioksida dan bikarbonat. Dalam keadaan seperti ini kadar karbonat dan hidroksida naik, dan menyebabkan pH larutan naik. Jika kadar alkalinitas tinggi (dibandingkan dengan kadar Ca
) juga memberikan kontribusi terhadap alkalinitas dalam jumlah sedikit. Meskipun banyak komponen penyebab alkalinitas perairan, penyebab utama dari alkalinitas tersebut adalah: (1) hidroksida, (2) karbonat, dan (3) bikarbonat.
2+ dan Mg2+ yaitu kadar kesadahan rendah) air menjadi agresif dan menyebabkan kerak pada pipa, sebaliknya alkalinitas yang rendah dan tidak seimbang dengankesadahan tinggi maka dapat menyebabkan kerak CaCO3
Alkalinitas berperan dalam menentukan kemampuan air untuk mendukung pertumbuhan alga dan kehidupan air lainnya, hal ini dikarenakan (Hidayat, 2009):
pada dinding pipa instalasi yang dapat memperkecil penampang pipa basah.
a. Pengaruh sistem buffer dari alkalinitas;
b. Alkalinitas berfungsi sebagai reservoir untuk karbon organik.Sehingga alkalinitas diukur sebagai faktor kesuburan air.
menurunkan kemasaman dan menaikan pH. Alkalinitas biasanya dinyatakan dalam satuan ppm (mg/l) kalsium karbonat (CaCO3). Air dengan kandungan kalsium karbonat lebih dari 100 ppm disebut sebagai alkalin, sedangkan air dengan kandungan kurang dari 100 ppm disebut sebagai lunak atau tingkat alkalinitas sedang. Pada umumnya lingkungan yang baik bagi kehidupan ikan adalah dengan nilai alkalinitas diatas 20 ppm (Dewi, 2007).
2.7.1. Penentuan Alkalinitas Air
Penentuan alkalinitas biasanya menggunakan H2SO4 0,02 N sebagai titran. Satu milliliter asam ini setara dengan 1 mg CaCO3. Perkalian nilai alkalinitas total dengan 10 akan menghasilkan nilai alkalinitas total dengan satuan mg/liter CaCO3 pada 100 ml air sampel. Perkalian nilai alkalinitas total dengan 0,599 menghasilkan nilai ion karbonat dalam satuan mg/liter. Perkalian nilai alkalinitas total dengan 1,219 menghasilkan ion bikarbonat dalam satuan mg/liter. Perkalian alkalinitas total dengan 0,02 menghasilkan nilai alkalinitas total dengan satuan mili-ekuivalen/liter (cole,1988).
2.7.2. Peranan Alkalinitas
Alkalinitas berperan dalam hal-hal sebagai berikut : 1. Sistem Penyangga
mengonversi karbonat menjadi bikarbonat dan bikarbonat menjadi asam karbonat. Hal ini dapat menjadikan perairan dengan nilai alkalinitas total tinggi tidak mengalami perubahan pH secara drastis (Cole,1988).
2. Koagulasi Bahan Kimia
Bahan kimia yang digunakan dalam proses koagulasi air atau limbah bereaksi dengan air membentuk endapan hidroksida yang tidak larut. Ion hidrogen yang dilepaskan bereaksi dengan ion-ion penyusun alkalinitas, sehingga alkalinitas berperan sebagai penyangga untuk mengetahui kisaran pH yang optimum bagi penggunaan koagulan. Dalam hal ini nilai alkalinitas sebaiknya berada pada kisaran optimum untuk mengikat ion hidrogen yang dilepaskan pada proses koagulasi.
3. Pelunakan air
Alkalinitas adalah parameter kualitas air yang harus dipertimbangkan dalam menentukan jumlah soda abu dan kapur yang diperlukan dalam proses pelunakan dengan metode pengendapan. Pelunakan air bertujuan untuk menurunkan kesadahan.
4. Pengendalian Korosi
Alkalinitas merupakan parameter yang sangat penting termasuk didalam pengendalian korosi.Hal itu harus diketahui disamping itu untuk pengelompokkan dalam Lengelier Saturasi indeks.
Banyak para agen yang mencegah pengecekan terhadap campuran limbah yang disebabkan (hidroksida) alkalinitas untuk penerimaan air. Sebaiknya pH alkalinitas ialah suatu faktor yang penting didalam penentuan kemampuan dari limbah untuk pengolahan secara biologi.
2.7.3. Titrasi Asam Basa
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titrant. Kadar larutan asam ditentukan dengan menggunakan larutan basa atau sebaliknya. Titrant ditambahkan titer tetes demi tetes sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titer tepat habis bereaksi) yang biasanya ditandai dengan berubahnya warna indikator. Keadaan ini disebutsebagai “titik ekuivalen”, yaitu titik dimana konsentrasi asam sama dengan konsentrasi basa atau titik dimana jumlah basa yang ditambahkan sama dengan jumlah asam yang dinetralkan : [H+] = [OH-]. Sedangkan keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indikator disebut sebagai “titik akhir
titrasi”. Titik akhir titrasi ini mendekati titik ekuivalen, tapi biasanya titik akhir
titrasi melewati titik ekuivalen. Oleh karena itu, titik akhir titrasi sering disebut juga sebagai titik ekuivalen.
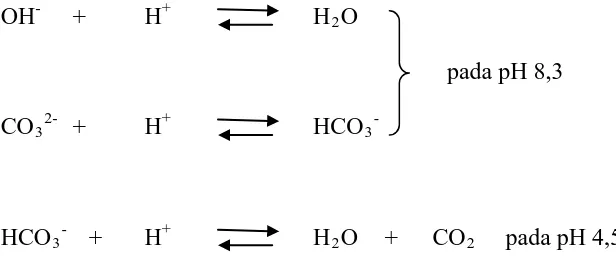
Alkalinitas ditetapkan melalui titrasi asam basa. Asam kuat seperti asam sulfat dan asam klorida (H
Pada saat titik ekuivalen ini maka proses titrasi dihentikan, kemudian catat volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titran, volume dan konsentrasi titer maka bisa dihitung konsentrasi titran tersebut.
2SO4 dan HCl) menetralkan zat-zat alkaliniti yang
Titik akhir ini dapat ditentukan oleh :
1. Jenis indikator yang dipilih dimana warnanya berubah-ubah pada pH titik akhir titrasi (pH ekuivalensi)
2. Perubahan nilai pH meter waktu titrasi asam basa dimana lengkungan pada grafik pH vs volum asam memperlihatkan titik akhir titrasi/titik ekuivalensi.
Reaksi yang terjadi adalah sebagai berikut :
OH- + H+ H2
pada pH 8,3 O
CO32- + H+ HCO3-