PENENTUAN KESADAHAN DAN ALKALINITAS PADA AIR MINUM DALAM KEMASAN HASIL PENGOLAHAN PT. TIRTA
SIBAYAKINDO
KARYA ILMIAH
TERKELIN BR TARIGAN 132401166
PROGRAM STUDI D3 KIMIA DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2016
PENENTUAN KESADAHAN DAN ALKALINITAS PADA AIR MINUM DALAM KEMASAN HASIL PENGOLAHAN PT. TIRTA
SIBAYAKINDO
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh gelar AhliMadya
TERKELIN BR TARIGAN 132401166
PROGRAM STUDI D3 KIMIA DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2016
PERSETUJUAN
Judul : Penentuan Kesadahan Dan Alkalinitas Pada Air Minum Dalam Kemasan Hasil Pengolahan
PT. Tirta sibayakindo
Kategori : Karya Ilmiah
Nama : Terkelin Br Tarigan
Nomor Induk Mahasiswa : 132401166
Program Studi : Diploma (D3) Kimia
Departemen : Kimia
Fakultas : Matematika Dan IlmuPengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Juli 2016
Diketahui
Program Studi D3 Kimia Pembimbing,
Ketua,
Dra. Emma Zaidar,M.Si Drs. Ahmad Darwin,M.Sc NIP. 19550918198701200 NIP. 1952111619 80031001
Diketahui/disetujui
Departemen Kimia FMIPA USU
Dr.Rumondang Bulan,MS NIP. 195408301985032001
PERNYATAAN
PENENTUAN KESADAHAN DAN ALKALINITAS PADA AIR MINUM DALAM KEMASAN HASIL PENGOLAHAN PT. TITRA
SIBAYAKINDO
KARYA ILMIAH
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2016
TERKELIN BR TARIGAN 132401166
PENGHARGAAN
Puji dan syukur Penulis panjatkan kepada Tuhan Yang Maha Esa atas segala berkat dan penyertaanNya sehingga Penulis dapat menyelesaikan Karya Ilmiah ini dalam waktu yang telah ditetapkan sebagai salah satu syarat untuk menyelesaikan pendidikan program Diploma (D3) Kimia di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Medan.
Penulis juga mengucapkan terima kasih secara khusus yang tak terhingga kepada kedua Orang Tua Penulis yang telah mendidik, memotivasi dan memberi dukungan moril, spiritual, maupun materil sehingga Penulis dapat menyelesaikan Karya Ilmiah ini.
Terima kasih kepada bapak Drs. Ahmad Darwin,M.Sc selaku pembimbing penyelesaian Karya Imiah ini yang telah memberikan panduan dan meluangkan waktu serta pikirannya dalam memberi petunjuk, saran dan bimbingan untuk menyempurnakanKarya Imiah ini.
Ucapan terima kasih juga ditujukan kepada :
1. Ibu Dr. Rumondang Bulan,MS selaku Ketua Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
2. Ibu Dra. Emma Zaidar,M.Si selaku ketua Program Studi D3 Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
3. Seluruh Dosen dan staff pegawai khususnya program studi Kimia Ilmu Matematika dan Ilmu Pengetahuan Alam yang telah mendidik dan memberi bimbingan kepada penulis selama masa perkuliahan.
4. Seluruh staff dan karyawan PT. TIRTA SIBAYAKINDO, terutama di bagian Laboratorium Fisika-Kimia, Laboratorium Mikrobiologi, Laboratorium Incoming Kemasan, dan QA Inprosses yang telah menyempatkan waktu untuk membimbing selama Penulis melaksanakan Praktek Kerja Lapangan.
5. Teman-teman seperjuangan jurusan D3 Kimia stambuk 2013, serta senior dan junior D3 Kimia yang telah memberikan motivasi kepada Penulis.
Penulis menyadari bahwa cara penulisan Karya Ilmiah ini serta isinya masih jauh dari sempurna. Penulis dalam hal ini dengan kerendahan hati sangat mengharapkan masukan berupa kritik maupun saran dari pembaca yang bersifat membangun demi kesempurnaan Karya Ilmiah ini.
Akhir kata dengan segala kerendahan hati, Penulis mengharapkan Karya Ilmiah ini akan bermanfaat bagi kita semua.
Penulis
PENENTUAN KESADAHAN DAN ALKALINITAS PADA AIR MINUM DALAM KEMASAN HASIL PENGOLAHAN PT. TITRA
SIBAYAKINDO
ABSTRAK
Penentuan kesadahan dan alkalinitas pada air minum dalam kemasan hasil pengolahan PT. Tirta Sibayakindo menggunakan metode titrasi kompleksometri dan titrasi asam basa yang dilakukan selama lima hari. Hasil analisa yang diperoleh untuk kadar kesadahan (hardness) hari pertama= 60,05 mg/l, hari kedua
= 57,34 mg/l, hari ketiga = 64,85 mg/l, hari keempat = 64,85 mg/l, dan hari kelima = 61,05 mg/l. Dan untuk kadar alkalinitas hari pertama = 43,60 mg/l, hari kedua = 38,60 mg/l, hari ketiga = 45,00 mg/l , hari keempat = 39,00 mg/l , dan hari kelima = 41,60 mg/l. Nilai kesadahan dan alkalinitas pada air minum dalam kemasan hasil pengolahan PT. Tirta Sibayakindo telah memenuhi syarat mutu air minum menurut SNI.
DETERMINATION OF HARDNESS AND ALKALINITY ON BOTTLED DRINKING WATER PROCESSING RESULT PT. TIRTA
SIBAYAKINDO
ABSTRACT
Determination of hardness and alkalinity on bottled drinking water processing results PT. Tirta Sibayakindo using complexometric titration and acid base titration performed for five days. The analysis results obtained for hardness (hardness) for first day = 60,05 mg /l, second day = 57,34 mg /l, third day = 64,85 mg /l, fourth day = 64,85 mg /l, and fifth day = 61,05 mg /l. And for alkalinity the first day = 43,60 mg /l, second day = 38,60 mg /l, third day = 45,00 mg /l, fourth day = 39,00 mg / l, and fifth day = 41,60 mg /l. Value hardness and alkalinity on bottled drinking water processing results PT. Tirta Sibayakindo qualified drinking water quality according to SNI.
DAFTAR ISI
Halaman
Persetujuan i
Pernyataaan ii
Penghargaan iii
Abstrak iv
Abstrack v
Daftar Isi vi
Daftar Tabel viii
Daftar Lampiran ix
Bab 1.Pendahuluan
1.1.Latar Belakang 1
1.2.Permasalahan 3
1.3.Tujuan 3
1.4.Manfaat 3
Bab 2. Tinjauan Pustaka
2.1. Sejarah PT. Tirta Sibayakindo 4
2.2. Definisi Air 5
2.3. Sumber-sumber Air 7
2.4. Karakteristik Air 10
2.5. Air Minum 10
2.5.1. Syarat-syarat Air Minum 11
2.5.2. Manfaat Mineral Dalam Air Minum 13
2.6. Kesadahan 14
2.6.1. Penentuan Kesadahan Air 17
2.6.2. Metode Penghilangan Kesadahan Air 17
2.6.3. Titrasi Kompleksometri 19
2.7. Alkalinitas 21
2.7.1. Penentuan Alkalinitas Air 22
2.7.2. Peranan Alkalinitas 23
2.7.3. Titrasi Asam Basa 24
Bab3. Metodologi Percobaan
3.1. Alat dan Bahan 26
3.1.1 Alat 26
3.1.2. Bahan 26
3.2.Pembuatan Reagensia 27
3.2.1. Pembuatan Larutan Standar EDTA 0,01 N 27 3.2.2. Pembuatan Larutan Standar CaCo3 0,01 N 27 3.2.3. Standarisasi Larutan Standar EDTA 0,01 N 27 3.2.4. Pembuatan Indikator Eriocrome Black T (EBT) 28
3.2.5. Pembuatan Larutan Standar H2SO4 0,02 N 28 3.2.6. Pembuatan Larutan Standar Na2CO3 28 3.2.7. Standarisasi Larutan Standar H2SO4 0,02 N 28 3.2.8.Pembuatan Indikator Bromo Cressol Green (BCG) 28
3.3. Prosedur Kerja 29
3.3.1. Penentuan Kesadahan 29
3.3.2. Penentuan Alkalinitas 29
3.4. Perhitungan 30
Bab4. Hasil dan Pembahasan
4.1.Hasil 31
4.2. Pembahasan 34
Bab5. Kesimpulan dan Saran
5.1. Kesimpulan 36
5.2. Saran 37
Daftar Pustaka
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1. Hasil Perhitungan Kadar Kesadahan 34
4.2. Hasil Perhitungan Kadar Alkalinitas 35
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lamp
1. Persyaratan Mutu AMDK 41
2. Peraturan Menkes Republik Indonesia 42
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Air merupakan senyawa kimia yang sangat penting bagi kehidupan makhluk hidup di bumi ini. Fungsi air bagi kehidupan tidak dapat digantikan oleh senyawa lain. Penggunaan air yang utama dan sangat vital bagi kehidupan adalah sebagai air minum.Hal ini untuk memenuhi kebutuhan air dalam tubuh. Menurut Notoadmodjo (2003), sekitar 55-60% berat badan orang dewasa terdiri dari air, untuk anak-anak sekitar 65% dan untuk bayi sekitar 80%. Kebutuhan sehari-hari terhadap air berbeda-beda untuk tiap tempat dan tingkatan kehidupan. Semakin tinggi taraf kehidupan, semakin meningkat jumlah kebutuhan akan air. Air minum merupakan kebutuhan manusia paling penting. Kebutuhan air minum setiap orang bervariasi dari 2,1 liter hingga 2,8 liter per hari, tergantung pada berat badan dan aktivitasnya. Namun, agar tetap sehat, air minum harus memenuhi persyaratan fisik, kimia, maupun mikrobiologi.
Menurut WHO dalam Depkes (2006) beberapa data menyebutkan bahwa volume kebutuhan air bersih bagi penduduk rata-rata di dunia berbeda. Di negara maju, air yang dibutuhkan adalah lebih kurang 500 liter/orang/hari, sedangkan di Indonesia (kota besar) sebanyak 200-400 liter/orang/hari dan di daerah pedesaan hanya 60 liter/orang/hari. Sejalan dengan kemajuan dan peningkatan taraf kehidupan, maka jumlah penyediaan air selalu meningkat untuk setiap saat.
Pengadaan air bersih untuk kepentingan rumah tangga seperti untuk air minum, air mandi dan sebagainya harus memenuhi persyaratan yang sudahditentukan peraturan Internasional (WHO dan APHA) ataupun peraturan nasional dan setempat. Dalam hal ini kualitas air bersih di Indonesia harus memenuhi persyaratan yang tertuang di dalam Kepmenkes RI No.
907/Men.Kes/SK/VII/2002 dimana setiap komponen yang diperkenankan berada di dalamnya harus sesuai. Hal inilah yang menjadi alasan mengapa air minum dalam kemasan (AMDK) yang disebut-sebut menggunakan air pegunungan banyak dikonsumsi. Namun, harga AMDK dari berbagai merek yang terus meningkat membuat konsumen mencari alternatif baru yang murah. Faktanya, kita terkadang kurang memperhatikan kualitas mutu air minum yang kita konsumsi.Berdasarkan hal tersebut, maka penulis ingin menganalisa apakah kesadahan dan alkalinitas pada air minum dalam kemasan hasil pengolahan PT.
Tirta Sibayakindo sesuai dengan syarat mutu SNI.
BAB 2
TINJAUAN PUSTAKA
2.1. Sejarah Perkembangan Perusahaan
PT. Tirta Sibayakindo merupakan perusahaan yang bergerak di bidang pengolahan Air Minum Dalam Kemasan (AMDK).Awalnya, industri air minum di Indonesia diprakarsai oleh Almarhum Tirto Utomo. Beliau mendirikan perusahaan dengan nama PT. Golden Mississippi yang memiliki pabrik di Bekasi, Jawa Barat . Pada tahun 1989 nama PT. Golden Mississippi diganti menjadi PT.
AQUA Golden Mississippi (AGM). PT. AGM ini merupakan perusahaan pertama di Indonesia yang bergerak di bidang pengolahan Air Minum Dalam Kemasan dengan merk dagang “AQUA”.
Pada tahun 1983, dengan mulai meluasnya distribusi AQUA maka diputuskan untuk memisahkan bagian distribusi dan bagian produksi dengan menunjuk PT. Wirabuana Internet. Sebelumnya untuk eksport ke beberapa Negara ASEAN yang mulai dirintis tahun 1987 diganti nama sendiri oleh PT. AQUA Golden Mississippi. Sebagai upaya untuk lebih mendekatkan diri kepada konsumen, pada tahun 1984 dilakukan dispensi pabrik yang pertama dengan dibuka pabrik “AQUA” yang ke-2 di Pandaaan Jawa Timur, yaitu PT Tirta Jaya Mas Unggul. Dengan luasnya pemasaran produk “AQUA” di masyarakat dan pasaran yang hampir menjangkau seluruh pelosok Indonesia, perusahaan memberi lisensi untuk memproduksi “AQUA” oleh PT. Tirta Dewata Semesta (Bali) tahun1987. PT. Panida Utama di Ciburial-Sukabumi (Jawa Barat) tahun 1987 dan
pada tahun 1990 kepada PT. Tirta Sibayakindo (Berastagi) sebagai pabrik ke-5 di Indonesia.
Tanggal 4 September 1998 merupakan hari bersejarah bagi PT. AQUA Group, karena salah satu produsen raksasa air minum dalam kemasan yang berpusat di Paris, Prancis melakukan kerjasama yaitu Group Danone yang diwakili oleh Danone Asia.
Pada tanggal 16 Oktober 2000, setelah bergabung dengan Danone semua anak perusahaan AQUA Group diganti menjadi PT. Tirta Investama kecuali PT.
AQUA Golden Mississippi, PT. Tirta Sibayakindo dan PT. Varia Industri Tirta.
1.1. Permasalahan
1. Berapakah kadarkesadahan dan alkalinitas pada air minum dalam kemasan hasil pengolahan PT. Tirta Sibayakindo.
2. Bagaimanakah perbandingan antarakadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo dengan SNI.
1.2. Tujuan
1. Untuk mengukur kadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindoselama lima hari mulai pada tanggal 09Februari sampai 13 Februari 2016.
2. Untuk membandingkan kadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo dengan SNI.
3.
1.3.Manfaat
1. Dapat mengetahui kadar kesadahan dan kadar alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo.
2. Dapat mengetahui perbandingan antara kadar kesadahan dan alkalinitas pada air minum dalam kemasan PT. Tirta Sibayakindo dengan SNI.
2.2. Definisi Air
Air merupakan sumber daya alam yang diperlukan untuk hajat hidup yang banyak, bahkan oleh semua makhluk hidup. Oleh karena itu, sumber daya air harus dilindungi agar tetap dapat dimanfaatkan dengan baik oleh manusia serta makhluk hidup yang lain. Pemanfaatan air untuk berbagai kepentingan harus dilakukan secara bijaksana, dengan memperhitungkan kepentingan generasi sekarang maupun generasi mendatang. Aspek pengamatan dan pelestarian sumber daya air harus ditaman pada segenap pengguna air (Effendi,2003).
Pada prinsipnya, jumlah air dialam ini tetap dan mengikuti suatu aliran yang dinamakan “ cyclus hydrologie”. Dengan adanya penyinaran matahari, maka semua air yang ada pada permukaan bumi akan bersatu dan berada ditempat yang tinggi yang sering dikenal dengan nama awan. Oleh angin, awan ini akan terbawa makin lama makin tinggi dimana temperatur diatas semakin rendah, yang menyebabkan titik-titik air jatuh kebumi sebagai hujan. Air hujan ini sebagian mengalir kedalam tanah jika menjumpai lapisan rapat air, maka perserapan akan berkurang, dan sebagian air akan mengalir diatas lapisan rapat air ini. Jika air ini keluar pada permukaan bumi, umumnya berbentuk sungai-sungai dan jika melalui suatu tempat rendah (cekung) maka air akan berkumpal, membentuk suatu danau atau telaga. Tetapi banyak diantaranya yang mengalir kelaut kembali dan kemudian akan mengikuti siklus hidrologi ini (Sutrisno,1994).
Saat ini masalah utama yang dihadapi oleh sumber daya air meliputi kuantitas air yang sudah tidak mampu memenuhi kubutuhan yang terus meningkat dan kualitas air untuk keperluan domestik yang semakin turun. Kegiatan industri, domestik, dan kegiatan yang lain berdampak negatif terhadap sumber daya air,
menyebabkan penurunan kualitas air. Kondisi ini menimbulkan gangguan, kerusakan, dan bahaya bagi semua makhluk hidup yang bergantung pada sumber daya air.Oleh karena itu, pengolahan sumber daya air sangat penting agar dimanfaatkan secara berkelanjutan dengan tingkat mutu yang diinginkan.
Salahsatu langkah pengelolaan yang dilakukan adalah pemantauan dan interprestasi data kualitas air, mencakup kualitas fisika, kimia, dan biologi.
Berdasarkan Peraturan Pemerintah Republik Indonesia No. 20 tahun 1990 tentang Pengendalian Pencemaran Air mendefenisikan kualitas air sebagai sifat air dan kandungan makhluk hidup, zat, energi, atau komponen lain didalam air.
Kualitas air dinyatakan dengan beberapa parameter, yaitu parameter fisika (suhu, kekeruhan, padatan terlarut dan sebagainya), parameter kimia (pH, BOD,COD, kadar logam, dan sebagainya). Dan parameter biologi (keberadaan plankton, bakteri, dan sebagainya).
Berdasarkan peraturan Pemerintah No.20 tahun 1990 mengelompokkan kualitas air menjadi beberapa golongan menurut peruntukkannya. Adapun penggolongan air menurut Effendi (2003) adalah sebagai berikut :
1. Golongan A, yaitu air yang dapat digunakan sebagai air minum secara langsung, tanpa pengolahan terlebih dahulu.
2. Golangan B, yaitu air yang dapat digunakan sebagai air baku air minum.
3. Golongan C, yaitu air yang dapat digunakan untuk keperluan perikanan dan pertenakan.
4. Golongan D, yaitu air yang dapat digunakan untuk keperluan pertanian, usaha diperkotaan, industri, dan pembangkit tenaga listrik.
2.3. Sumber Air
Menurut Sutrisno (1994), secara garis besar dapat dikatakan air bersumber dari :
1. Air Laut
Air yang dijumpai didalam alam berupa air laut sebanyak 80% , sedangkan sisanya berupa air tanah/daratan, es, salju, dan hujan. Air laut mempunyai sifat asin, karena mengandung garam NaCl. Kadar NaCl dalam air laut 3%. Dengan keadaan ini, maka air laut tidak memenuhi syarat untuk air minum.
2. AirAtmosfir
Dalam keadaan murni, sangat bersih, karena dengan adanya pengotoran udara yang disebabkan oleh kotoran-kotoran industri/debu dan lain sebagainya.
Maka untuk menjadikan air hujan sebagai sumber air minum hendaknya pada waktu menampung air hujan jangan dimulai pada saat mulai turun, karena masih mengandung banyak kotoran.
3. Air Permukaan
Air permukaan adalah air hujan yang mengalir dipermukaan bumi. Pada umumnya air permukaan ini akan mendapat pengotoran selama pengalirannya, misalnya oleh lumpur, batang-batang kayu, daun-daun, kotoran industri kota dan sebagainya.Setelah mengalami suatu pengotoran pada suatu saat air permukaan itu akan mengalami suatu proses pembersihan sendiri. Udara yang mengandung oksigen atau gas O2 akan membantu mengalami proses pembusukan yang terjadipada air permukaan yang telah mengalami pengotoran, karna selama dalam perjalanan, O2 akan meresap kedalam air permukaan.
Air permukaan ada dua macam yakni : 1. Air sungai
Dalam penggunaannya sebagai air minum, haruslah mengalami suatu pengolahan yang sempurna, mengingat bahwa air sungai ini pada umumnya mempunyai derajat pengotoran yang tinggi sekali. Debit yang tersedia untuk memenuhi kebutuhan akan air minum pada umumnya dapat mencukupi.
2. Air rawa atau danau
Kebanyakan air rawa ini berwarna yang disebabkan oleh adanya zat-zat organik yang telah membusuk, misalnya asam humus yang larut dalam air yang menyebabkan warna kuning coklat.
3. Air Tanah
Air tanah adalah air yang berasal dari permukaan yang merembes kedalam tanah, yang terdapat didalam ruang-ruang butir antara butir-butir tanah didalam lapisan bumi. Suatu saat air ini akan memenuhi lapisan tanah yang keras dan kuat, maka air ini akan keluar permukaan sebagai mata air.
Air tanah terbagi antara : 1. Air tanah dangkal
Air tanah dangkal terjadi karena daya proses peresapan air dari permukaan tanah. Lumpur akan bertahan, demikian pula dengan sebagian bakteri, sehinggaair tanah akan jernih tetapi lebih banyak mengandung zat kimia (garam-garam yang larut) karena melalui lapisan tanah yang mempunyai unsur-unsur kimia tertentu untuk masing-masing lapisan tanah. Lapisan tanah ini berfungsi sebagai saringan.
Disamping penyaringan, pengotoran juga masih terus berlangsung, terutama pada muka air yang dekat muka tanah, setelah lapisan rapat air, air yang terkumpul
merupakan air tanah dangkal dimana air tanah ini dimanfaatkan sebagai air minum melalui sumur-sumur dangkal.
2. Air tanah dalam
Terdapat setelah lapis rapat air yang pertama. Pengambilan air tanah dalam, tidak semudah pada air tanah dangkal. Dalam hal ini harus digunakan bor dan memasukkan pipa kedalamnya sehingga dalam suatu kedalaman (biasanya antara 100-300 m) akan didapatkan suatu lapis air. Kualitas air tanah dalam pada umumnya lebih baik dari air dangkal, karena penyaringannya lebih sempurna dan bebas dari bakteri. Susunan dari unsur-unsur kimia tergantung pada lapis-lapis tanah yang dilalui. Jika melalui tanah kapur, maka air itu akan menjadi sadah, karena mengandung Ca(HCO3)2 dan Mg(HCO3)2.
3. Mata air
Mata air adalah air tanah yang keluar dengan sendirinya kepermukaan tanah. Mata air yang berasal dari tanah dalam, hampir tidak terpengaruh oleh musim dan kualitasnya sama dengan keadaan air tanah dalam.
2.4. Karakteristik Air
Menurut Effendi (2003), air memiliki karakteristik yang tidak dimiliki oleh senyawa kimia lain, karakter tersebut antara lain :
1. Pada kisaran suhu yang sesuai bagi kehidupan, yakni 0ºC (32ºF) – 100ºC, air berwujud cair.
2. Perubahan suhu air berlangsung lambat sehingga air memiliki sifat sebagai penyimpan panas yang sangat baik.
3. Air memerlukan panas yang tinggi pada proses penguapan. Penguapan adalah proses perubahan air menjadi uap air.
4. Air merupakan pelarut yang baik.
5. Air memiliki tegangan permukaan yang tinggi.
6. Air merupakan satu-satunya senyawa yang merenggang ketika membeku.
2.5. Air Minum
Air minum adalah air yang melalui proses pengolahan atau tanpa proses pengolahan yang memenuhi syarat kesehatan dan dapat langsung di minum (Kepmenkes, RI. 2002).Air minum yang baik dan aman untuk kesehatan jika memenuhi persyaratan fisika, mikrobiologis dan kimiawi sesuai dengan parameter yang ditentukan oleh Permenkes RI No.492/Menkes/Per/IV/2010.
2.5.1. Syarat-Syarat Air Minum
Air minum yang ideal seharusnya jernih, tidak berwarna, tidak berasa, dan tidak berbau. Air minum pun seharusnya tidak mengandung kuman patogen dan segala yang membahayakan kesehatan manusia. Tidak mengandung zat kimia yang dapat mengubah fungsi tubuh, tidak dapat secara estetis, dan dapat merugikan secara ekonomis. Air itu seharusnya tidak korosif, tidak meninggalkan endapan pada seluruh jaringan distribusinya.
Atas dasar pemikiran tersebut dibuat suatu standar air minum yaitu suatu peraturan yang memberi petunjuk tentang konsentrasi sebagai parameter yang sebaiknya diperbolehkan didalam air minum (Slamet, 1994).
Menurut Sutrisno (1994), dari segi kualitas air minum harus memenuhi : a. Syarat Fisik
1. Air tidak boleh berbau
Air minum yang berbau selain tidak estetis juga tidak akan disukai oleh masyarakat. Bau air dapat member petunjuk akan kualitas air. Misalnya, bau amis dapat disebabkan oleh tumbuhnya Algae.
2. Air tidak boleh berasa
Air minum biasanya tidak memberi rasa/tawar. Air minum yang tidak tawar dapat menunjukkan kehadiran berbagai zat yang dapat membahayakan kesehatan. Rasa logam/amis, rasa pahit, asin, dan sebagainya. Efeknya tergantung pada penyebab timbulnya bau tersebut.
3. Air tidak boleh berwarna
Air minum sebaiknya tidak berwarna untuk alasan estetis dan untuk mencegah keracunan dari berbagai zat kimia maupun mikroorganisme yang berwarna.
4. Kekeruhan
Kekeruhan air disebabkan oleh zat padat yang tersuspensi, baik yang bersifat anorganik maupun organik. Zat anorganik, biasanya berasal dari lapukan tanaman dan hewan. Buangan industri juga dapat menyebabkan kekeruhan. Zat organik dapat menjadi makanan bakteri, sehingga mendukung perkembang biakannya.
5. Suhu air hendaknya dibawah sela udara (sejuk ± 25ºC) agar :
- Tidak terjadi pelarutan kimia yang ada pada saluran/pipa yang dapatmembahayakan kesehatan
- Menghambat reaksi-reaksi biokimia didalam saluran/pipa - Mikroorganisme patogen tidak mudah berkembang biak - Bila diminum air dapat menghilangkan dahaga.
6. Jumlah zat padat terlarut (TDS)
TDS biasanya terdiri dari zar organik, garam anorganik dan gas terlarut.
Bila TDS bertambah maka kesadahan akan naik pula.
b. Syarat Kimia
Air minum tidak boleh mengandung racun, zat-zat mineral atau zat-zat kimia tertentu dalam jumlah melampaui batas yang telah ditentukan.
c. Syarat Bakteriologik
Air minum tidak boleh mengandung bakteri-bakteri penyakit (patogen) dan tidak boleh mengandung bakteri-bakteri golongan Coli melebihi batas-batas yang telah ditentukan yaitu 1 Coli/100 ml air.Bakteri golongan Coli ini bersal dari usus besar (feaces) dan tanah.
Bakteri patogen yang mungkin ada dalam air antara lain adalah : - Bakteri typshum
- Vibrio colereae - Bakteri dysentriae - Entamoeba histolyhes
- Bakteri enteritis (penyakit perut)
Air yang mengandung Coli dianggap telah terkontaminasi (tercemar) dengan kotoran manusia.
2.5.2. Manfaat Mineral Dalam Air Minum
Air minum menjadi sumber air yang utama dibutuhkan oleh tubuh.Namun harus di ingat, bahwa air di alam selalu mengandung zat-zat terlarut terutama mineral.Maka secara alamiah air yang di minum harus memenuhi syarat tertentu, yakni tidak mengandung zat-zat berbahaya, seperti racun khususnya logam-logam toksis misalnya timbal, kadmium, merkuri, dan juga tidak boleh ada bakteri yang patogen.Sebaliknya, air minum harus mengandung mineral utama seperti kalsium, magnesium, dan kalium.
Ada beberapa mineral yang terdapat di dalam air minum dengan kadar potensial untuk menopang kesehatan yakni kalsium, magnesium, florida, selenium, kuprum, dan kalium. Kontribusi air minum sebagai sumber mineral yang diperlukan dibandingkan dengan kontribusi makanan lainnya berkisar 1- 20%. Mineral kalsium dan magnesium merupakan yang paling banyak yakni sampai 20% dari yang diperlukan tubuh berasal dari air minum. Tingkat penyerapan kalsium dari air minum yang mengandung kalsium yang tinggi sebanding dengan penyerapan kalsium dari susu. Air minum yang mengandung 300 mg kalsium per liter menyumbangkan kalsium yang setara dengan kalsium dari satu gelas susu (Silalahi, 2014).
2.6. Kesadahan
Kesadahan berasal dari kata sadah yang berarti mengandung kapur, jadi kesadahan air adalah adanya kandungan kapur yang berlebih pada air yangdisebabkan oleh lapisan tanah kapur yang dilaluinya. Jenis sumber air yang banyak mengandung sadah air tanah khususnya air tanah dalam. Air sadah dapat menyebabkan sabun sukar berbuih, hal ini diakibatkan oleh kandungan natriumstearat (C17H35COONa) dalam sabun yang beraksi dengan ion-ion Mg2+dan Ca2+ yang membentuk busa buih yang mengendap,
Mg2+(aq) + 2C17H35COO- (aq) Mg(C17H35COO)2(aq)
Ca2+(aq) + 2C17H35COO-(aq) Ca(C17H35COO)2(aq)
Karena sabun diendapkan, maka busa sabun baru akan terbentuk bila semua ion-ion magnesium dan kalsium telah terendapkan. Ini berarti untuk mencuci diperlukan sabun dengan jumlah yang banyak (Kusuma, 2007).
Kesadahan pada dasarnya dapat dibedakan menjadi dua jenis yaitu :
1. Kesadahan sementara
Kesadahan sementara adalah kesadahan yang disebabkan oleh ion Ca2+dan Mg2+ yangberikatan dengan ion karbonat dan bikarbonat.Air sadah sementara dapatterjadi secara alami ketika air hujan melarutkan sedikit karbon dioksida, sehingga air hujan itu mengandung asam karbonat. Ketika air hujan ini melewati daerah berkapur air tersebut akan menyerap dan menghilangkan kapur sehingga terbentuk hidrogen-karbonat larut.
CaCO3(s) + CO2(s) + H2O Ca(HCO)3(aq)
2. Kesadahan tetap
Kesadahan tetap adalah kesadahan yang disebabkan oleh ion Ca2+danMg2+yang berikatan dengan ion Cl-, SO42-, NO-3, contohnya CaCl2, MgSO4. Kesadahan tetap terjadi ketika air melewati daerah bebatuan yang mengandung magnesium sulfat dan kalsium klorida. Kesadahan ini tidak dapat dihilangkan hanya dengan pendidihan atau dengan penambahan kapur mati,tetapi dapat dihilang dengan penambahan soda basuh atau menggunakan proses permutit (yang juga dapat dipakai untuk air sadah sementara) (Kusuma,2007). Kesadahan ini disebut juga kesadahan non karbonat yang dapat dihilangkan dengan cara pertukaran ion.
Istilah kesadahan digunakan untuk menunjukkan kandungan garam kalsium dan magnesium yang terlarut, dinyatakan sebagai ekuivalen (setara) kalsium karbonat. Air sadah adalah air yang mengandung beberapa jenis mineral yaitu Ca, Mg, Sr, Fe dan Mn yang konsentrasinya tinggi sehingga mengakibatkan air menjadi keruh dan dapat mengurangi daya kerja sabun serta menimbulkan kerak pada dasar ketel. Kesadahan air dikenal dengan nama kekerasan air atau (hard water).
Menurut Gabriel (2001), berdasarkan kadar kalsium dalam air maka tingkat kesadahan air digolongkan dalam 4 (empat) kelompok yaitu :
1. Kadar CaCO3 terdapat dalam air0-75 mg/l disebut air lunak (soft water) 2. Kadar CaCO3 terdapat dalam air 75-150 mg/l disebut moderately hard
water
3. Kadar CaCO3 terdapat dalam air 150-300 mg/l disebut hard water
4. Kadar CaCO3 terdapat dalam air 300 mg/l ke atas disebut very hard water
Kesadahan (hardness) adalah merupakan sifat air yang disebabkan oleh adanya ion-ion (kation) logam valensi dua. Kation-kation ini dapat bereaksi dengan sabun membentuk endapan (presipitasi) maupun dengan anion-anion yang terdapat didalam air membentuk kerak air dan endapan atau karat pada peralatan logam.Kesadahan dalam air terutama disebabkan oleh ion-ion Ca2+dan Mg2+juga oleh Mn2+, Fe2+dan semua kation yang bermuatan dua ( Santika, 1987).
Pada umumnya airsadah berasal dari daerah dimana lapisan tanah atas (topsoil) tebal, dan ada pembentukan batu kapur. Yang dimaksuddengan kesadahan total adalah kesadahan yang disebabkan oleh adanya ion Ca2+ dan Mg2+secara bersama-sama. Ini disebabkan karena kebanyakankesadahan dalam air alam adalah disebabkan oleh dua kation tersebut.Sedangkan perairan lunak berada pada wilayah dengan lapisan tanah dan tipis dan batuan kapur relatif sedikit atau bahkan tidak ada (Effendi, 2003).
2.6.1. Penentuan Kesadahan Air
Kesadahan total yaitu jumlah ion-ion Ca2+ dan Mg2+ yang dapat ditentukan melalui titrasi dengan EDTA sebagai titran dan menggunakan indikator yang peka terhadap semua kation tersebut.
Pada penentuan kesadahan air, diperlukan modifikasi dari cara titrasi larutan Mg-Ca murni, karena dalam air sering dijumpai pengotoran oleh ion besi dan logam-logam lain. Penggunaan indikator Eriocrome Black T atau Calmagit akan terjadi indikator oleh ion besi karena bereaksi setara. Oleh sebab itu, penambahan buffer pH 10 jumlah molekul EDTA dapat membuat pasangan kimiawi dengan
ion-ion kesadahan dan beberapa jenis ion lainnya. Pasangan tersebut lebih kuat dari pada hubungan antara indikator dengan ion-ion kesadahan. Oleh karena itu, pada pH 10 jumlah molekul EDTA yang ditambahkan sebagai titran sama (ekuivalen) dengan jumlah ion-ion kesadahan dalam sampel, dan molekul indikator terlepas dari ion kesadahan (Santika, 1984).Eriochrom Black T (EBT) adalah jenis indikator yang berwarna merah muda dan bila berada dalam larutan yang mengandung ion kalsium dan magnesium pada pH 10.
2.6.2. Metode Penghilangan Kesadahan Air
Beberapa metode penghilangan kesadahan air yaitu, pendidihan, penambahan kapur mati, penambahan soda pencuci, dan proses pertukaran ion.
1. Pendidihan
Jika air dididihkan, hanya kesadahan sementara yang dapat dihilangkan.
Bikarbonat dipecah menjadi karbonat, air dan karbon dioksida, berikut persamaanya:
Ca(HCO3)2 CaCO3↓ + H2O + CO2
Kalsium Kalsium Air karbonat
bikarbonat Karbonat dioksida
Karbonat adalah endapan dan oleh karena itu tidak bereaksi dengan sabun dan keluar dari larutan.
2. Penambahan kapur mati ( Proses Clark )
Kapur mati (kalsium hidroksida) juga hanya memisahkan kesadahan sementara.Kapur harus ditambah pada jumlah yang telah diperhitungkansehingga
kapur tersebut hanya mampu untuk menetralkan bikarbonat dan terbentuk kalsium karbonat yang tidak larut.
Ca(HCO3)2 + Ca(OH)2 2 CaCO3↓ + 2 H2O
Kalsium Kalsium Kalsium Air
Bikarbonat hidroksida karbonat (air sadah) (kapur mati) (tidak larut)
3. Penambahan soda pencuci
Metode ini menghilangkan kesadahan sementara dan kesadahan tetap.Soda pencuci (natrium karbonat) bereaksi dengan garam kalsium danmagnesium dalam air sadah membentuk garam natrium yang larut dan garam kalsium dan magnesium yang tidak larut yang tertinggal sebagai endapan.
CaSO4 + Na2CO3 CaCO3↓ + Na2SO4
Kalsium Natrium Kalsium Sodium
Sulfat karbonat karbonat sulfat
(air sadah) (soda pencuci) (tidak larut) (larut) 4. Proses pertukaran ion
Metode ini digunakan dalam rumah tangga dan industri untuk menghilangkan kesadahan sementara dan kesadahan tetap. Proses ini meliputi penggunaan resin alami dan resin buatan seperti zeolit. Air sadah dilewatkan melalui kolomyang diisi resin dan ion-ion kalsium dan magnesium dalam air ditukar ion natrium dalam resin (Gaman, 1992 ).
2.6.3. Titrasi Kompleksometri
Titrasi kompleksometri atau kelatometri adalah suatu jenis titrasi dimana reaksi antara bahan yang dianalisis dan titrat akan membentuk suatu senyawakompleks. Senyawa kompleks ini disebut kelat dan terjadi akibat titran dan titrat yang saling mengkompleks.Kelat yang terbentuk melalui titrasi terdiri dari dua komponen yang membentuk ligan dan tergantung pada titran serta titrat yang hendak diamati (Anonim, 2012).
Titrasi kompleksometri meliputi reaksi pembentukan ion-ion kompleks ataupun pembentukan molekul netral yang terdisosiasi dalam larutan.Persyaratan mendasar terbentuknya kompleks demikian adalah tingkat kelarutan tinggi.Contoh dari kompleks tersebut adalah kompleks logam dengan EDTA. Menurut Achmad Mursyidi dan Abdul Rohman (2008), cara-cara titrasi dengan EDTAterbagi menjadi 5, yaitu :
1. Titrasi langsung merupakan metode yang paling sederhana dan seringdipakai, misalnya dapat pH 10 lalu ditambahkan indikator logamyang sesuai dan dititrasi langsung dengan larutan baku dinatrium edetat.
2. Titrasi kembali, cara ini penting untuk logam yang mengendap dengan hidroksida pada pH yangdikehendaki untuk titrasi. Untuk senyawa yang tidak larut misalnya sulfat, kalsium oksalat,untuk senyawa yang membentuk kompleks yang sangat lambat dan ion logam yang membentuk kompleks lebih stabil dengan natrium edetat daripada dengan indikator. Pada keadaan demikian,dapat ditambahkan larutan baku dinatrium edetat berlebihan kemudian larutan di dapat pada pHyang diinginkan dan kelebihan dinatrium edetat dititrasi kembali dengan larutan baku ion logam.
3. Titrasi substitusi, cara ini dilakukan bila ion logam tersebut tidak memberikan titik akhir yang jelas apabila dititrasi secara langsung atau dengan titrasi kembali, atau juga jika ion logamtersebut membentuk kompleks dengan dinatrium edetat lebih stabil daripada logam lain sepertimagnesium dan kalsium.
4. Titrasi tidak langsung, cara titrasi tidak langsung dapat digunakan untuk menentukan kadar ion-ion seperti anion yang tidak bereaksi dengan pengkelat. Sebagai contoh barbiturat tidak bereaksidengan EDTA akan tetapi secara kuantitatif dapat diendapkan dengan ion merkuri dalamkeadaan basa sebagai ion kompleks 1:1. Setelah pengendapan dengan kelebihan Hg(II),kompleks dipindahkan dengan cara penyaringan dan dilarutkan kembali dalam larutan bakuEDTA berlebihan. Larutan baku Zn(II) dapat digunakan untuk menitrasi kelebihan EDTA inimenggunakan indikator yang sesuai untuk mendeteksi titik akhir.
5. Titrasi alkalimetri, pada metode ini proto dari dinatrium edetat (Na2H2Y) dibebaskan oleh logam berat dan dititrasi dengan larutan baku alkali. Larutan logam yang ditetapkan dengan metode ini sebelum dititrasi harus dalam suasana netralterhadap indikator yang dipergunakan.Penetapan titik akhir menggunakan indikator asam-basaatau secara potensiometri.
2.7. Alkalinitas
Alkalinitas adalah pengukuran kapasitas air untuk menetralkan tambahan asam tanpa penurunan nilai pH larutan. Sama halnya dengan larutan buffer, alkaliniti merupakan pertahanan air terhadap pengasaman.Penyusun alkalinitas
perairan adalah anion bikarbonat (HCO3-), karbonat (CO3-), dan hidroksida (OH-).
Garam dari asam lemah lain seperti : Borat (H2BO3-), silikat (HSiO3-), fosfat (HPO42-dan HPO4-), sulfida (HS-), dan ammonia (NH3) juga memberikan kontribusi terhadap alkalinitas dalam jumlah sedikit. Meskipun banyak komponen penyebab alkalinitas perairan, penyebab utama dari alkalinitas tersebut adalah: (1) hidroksida, (2) karbonat, dan (3) bikarbonat.
Pada keadaan tertentu (siang hari) adanya ganggang dan lumut dalam air dapat menyebabkan turunnya kadar karbondioksida dan bikarbonat. Dalam keadaan seperti ini kadar karbonat dan hidroksida naik, dan menyebabkan pH larutan naik. Jika kadar alkalinitas tinggi (dibandingkan dengan kadar Ca2+ dan Mg2+ yaitu kadar kesadahan rendah) air menjadi agresif dan menyebabkan kerak pada pipa, sebaliknya alkalinitas yang rendah dan tidak seimbang dengankesadahan tinggi maka dapat menyebabkan kerak CaCO3 pada dinding pipa instalasi yang dapat memperkecil penampang pipa basah.
Alkalinitas berperan dalam menentukan kemampuan air untuk mendukung pertumbuhan alga dan kehidupan air lainnya, hal ini dikarenakan (Hidayat, 2009):
a. Pengaruh sistem buffer dari alkalinitas;
b. Alkalinitas berfungsi sebagai reservoir untuk karbon organik.Sehingga
alkalinitas diukur sebagai faktor kesuburan air.
Alkalinitas secara umum menunjukkan konsentrasi basa atau bahan yang mampu menetralisir kemasamaan dalam air. Secara khusus, alkalinitas sering disebut sebagai besaran yang menunjukkan kapasitas pem-bufffer-an dari ion bikarbonat, dan sampai tahap tertentu ion karbonat dan hidroksida dalam air.
Ketiga ion tersebut di dalam air akan bereaksi dengan ion hidrogen sehingga
menurunkan kemasaman dan menaikan pH. Alkalinitas biasanya dinyatakan dalam satuan ppm (mg/l) kalsium karbonat (CaCO3). Air dengan kandungan kalsium karbonat lebih dari 100 ppm disebut sebagai alkalin, sedangkan air dengan kandungan kurang dari 100 ppm disebut sebagai lunak atau tingkat alkalinitas sedang. Pada umumnya lingkungan yang baik bagi kehidupan ikan adalah dengan nilai alkalinitas diatas 20 ppm (Dewi, 2007).
2.7.1. Penentuan Alkalinitas Air
Penentuan alkalinitas biasanya menggunakan H2SO4 0,02 N sebagai titran.
Satu milliliter asam ini setara dengan 1 mg CaCO3. Perkalian nilai alkalinitas total dengan 10 akan menghasilkan nilai alkalinitas total dengan satuan mg/liter CaCO3
pada 100 ml air sampel. Perkalian nilai alkalinitas total dengan 0,599 menghasilkan nilai ion karbonat dalam satuan mg/liter. Perkalian nilai alkalinitas total dengan 1,219 menghasilkan ion bikarbonat dalam satuan mg/liter. Perkalian alkalinitas total dengan 0,02 menghasilkan nilai alkalinitas total dengan satuan mili-ekuivalen/liter (cole,1988).
2.7.2. Peranan Alkalinitas
Alkalinitas berperan dalam hal-hal sebagai berikut : 1. Sistem Penyangga
Bikarbonat yang terdapat pada perairan dengan nilai alkalinitas total tinggi berperan sebagai penyangga perairan terhadap perubahan pH yang drastis. Jika basa kuat ditambahkan kedalam perairan maka basa tersebut akan bereaksi dengan asam karbonat membentuk garam bikarbonat dan akhirnya menjadi karbonat. Jika asam ditambahkan kedalam perairan maka asam tersebut akan digunakan untuk
mengonversi karbonat menjadi bikarbonat dan bikarbonat menjadi asam karbonat.
Hal ini dapat menjadikan perairan dengan nilai alkalinitas total tinggi tidak mengalami perubahan pH secara drastis (Cole,1988).
2. Koagulasi Bahan Kimia
Bahan kimia yang digunakan dalam proses koagulasi air atau limbah bereaksi dengan air membentuk endapan hidroksida yang tidak larut. Ion hidrogen yang dilepaskan bereaksi dengan ion-ion penyusun alkalinitas, sehingga alkalinitas berperan sebagai penyangga untuk mengetahui kisaran pH yang optimum bagi penggunaan koagulan. Dalam hal ini nilai alkalinitas sebaiknya berada pada kisaran optimum untuk mengikat ion hidrogen yang dilepaskan pada proses koagulasi.
3. Pelunakan air
Alkalinitas adalah parameter kualitas air yang harus dipertimbangkan dalam menentukan jumlah soda abu dan kapur yang diperlukan dalam proses pelunakan dengan metode pengendapan. Pelunakan air bertujuan untuk menurunkan kesadahan.
4. Pengendalian Korosi
Alkalinitas merupakan parameter yang sangat penting termasuk didalam pengendalian korosi.Hal itu harus diketahui disamping itu untuk pengelompokkan dalam Lengelier Saturasi indeks.
5. Limbah Industri
Banyak para agen yang mencegah pengecekan terhadap campuran limbah yang disebabkan (hidroksida) alkalinitas untuk penerimaan air. Sebaiknya pH alkalinitas ialah suatu faktor yang penting didalam penentuan kemampuan dari limbah untuk pengolahan secara biologi.
2.7.3. Titrasi Asam Basa
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titrant. Kadar larutan asam ditentukan dengan menggunakan larutan basa atau sebaliknya. Titrant ditambahkan titer tetes demi tetes sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titer tepat habis bereaksi) yang biasanya ditandai dengan berubahnya warna indikator. Keadaan ini disebutsebagai
“titik ekuivalen”, yaitu titik dimana konsentrasi asam sama dengan konsentrasi basa atau titik dimana jumlah basa yang ditambahkan sama dengan jumlah asam yang dinetralkan : [H+] = [OH-]. Sedangkan keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indikator disebut sebagai “titik akhir titrasi”. Titik akhir titrasi ini mendekati titik ekuivalen, tapi biasanya titik akhir
titrasi melewati titik ekuivalen. Oleh karena itu, titik akhir titrasi sering disebut juga sebagai titik ekuivalen.Pada saat titik ekuivalen ini maka proses titrasi dihentikan, kemudian catat volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titran, volume dan konsentrasi titer maka bisa dihitung konsentrasi titran tersebut.
Alkalinitas ditetapkan melalui titrasi asam basa. Asam kuat seperti asam sulfat dan asam klorida (H2SO4 dan HCl) menetralkan zat-zat alkaliniti yang merupakan zat basa sampai titik akhir titrasi (titik ekuivalensi) kira-kira pada pH 8,3 dan pH 4,5 (Alaearts,1987).
Titik akhir ini dapat ditentukan oleh :
1. Jenis indikator yang dipilih dimana warnanya berubah-ubah pada pH titik akhir titrasi (pH ekuivalensi)
2. Perubahan nilai pH meter waktu titrasi asam basa dimana lengkungan pada grafik pH vs volum asam memperlihatkan titik akhir titrasi/titik ekuivalensi.
Reaksi yang terjadi adalah sebagai berikut :
OH- + H+ H2O
pada pH 8,3 CO32- + H+ HCO3-
HCO3- + H+ H2O + CO2 pada pH 4,5
BAB 3
BAHAN DAN METODE
3.1. Alat dan Bahan 3.1.1. Alat
- Buret automatik Brand
- Neraca analitis HWH
- Erlenmeyer 250 ml Pyrex
- Gelas ukur 50 ml Plastibrand
- Labu takar 1000 ml Pyrex - Bola karet
- Pipet volume 10 ml Pyrex
3.1.2. Bahan
- Air Minum Dalam Kemasan (AQUA) - Larutan standar EDTA 0,01 N
- Larutan Standar H2SO4 0,02 N
- Indikator BCG (Bromo Cressol Green) - Indikator EBT (Eriocrome Black T)
3.2. Pembuatan Reagensia
1. Pembuatan Reagensia Untuk Pengujian Kadar Kesadahan 3.2.1. Pembuatan Larutan Standar EDTA 0,01 N
- Ditimbang 3,723 gram EDTA - Ditambahkan 5 ml NH4OH
- Dilarutkan dengan aquadest sebayak 1 L dalam labu takar
- Dihomogenkan
3.2.2. Pembuatan Larutan Standar Kalsium Karbonat 0,01 M
- Ditimbang 1,0 gram CaCO3 dan masukkan kedalam beaker glass 500 ml - Dilarutkan dengan HCL 1:1 hingga larut
- Ditambahkan 200 ml aquadest, didihkan untuk menghilangkan CO2
- Didinginkan
- Ditambahkan beberapa tetes indikator Merah Methyl hingga berubah warna menjadi orange
- Dipindahkan kedalam labu ukur 1 L sampai tanda garis
- Dihomogenkan
3.2.3. Standarisasi Larutan Standar EDTA 0,01 N
- Dipipet 10 ml larutan standar kalsium karbonat 0,01 N dan dimasukkan kedalam erlenmeyer 250 ml
- Ditambahkan 1 ml larutan buffer hardness pH 10±0,1 - Ditambahkan 0,1 gram indikator EBT
- Dititrasi dengan larutan EDTA 0,01 N sampai terjadi perubahan warna dari merah keunguan menjadi biru
- Dicatat volume EDTA yang terpakai
3.2.4. Pembuatan Indikator EBT (Eriocrome Black T) - Ditimbang 0,2 gram EBT
- Ditambahkan 100 gram NaCl - Digerus hingga halus
- Digabung menjadi satu campuran
2. Pembuatan Reagensia Untuk Pengujian Alkalinitas 3.2.5. Pembuatan Larutan Standar H2SO4 0,02 N
- Dipipet 0,56 ml H2SO4 pekat
- Ditambahkan aquadest sebayak 1 L dalam labu takar - Dihomogenkan
3.2.6. Pembuatan Larutan Standar Na2CO3
- Ditimbang 0,2 gram Na2CO3
- Dilarutkan dengan aquades sebanyak 100 ml - Dihomogenkan
3.2.7. Standarisasi Larutan Standar H2SO4 0,02 N
- Dipipet 10 ml larutan standar Na2CO3 dan dimasukkan kedalam erlenmeyer 250 ml
- Dititrasi dengan larutan H2SO4 0,02 N sampai terjadi perubahan warna dari biru menjadi kuning
- Dicatat volume H2SO4 yang terpakai
3.2.8. Pembuatan Indikator BCG ( Bromo Cressol Green) - Ditimbang 0,1 gram BCG
- Dilarutkan dengan aquadest sebayak 100 ml
- Dihomogenkan
3.3. Prosedur Kerja
3.3.1 Penentuan Kadar Kesadahan
Penentuan kadarkesadahan pada air minum dalam kemasan menggunakan metode titrasi kompleksometri.
- Dimasukkan sampel air minum dalam kemasan kedalam erlenmeyer sebanyak 100 ml
- Ditambahkan 1 ml larutan buffer hardness pH 10±0,1 - Ditambahkan 0,1 gram indikator EBT (Eriocrome Black T)
- Dititrasi menggunakan larutan standarEDTA 0,01 N sampai terjadi perubahan warna dari ungu menjadi biru
- Dicatat volume titran yang terpakai - Dihitung kadar kesadahannya
- Diulangi perlakuan yang sama sebanyak 3 kali
- Diulangi prosedur kerja untuk hari berikutnya selama 5 hari 3.3.2 Penentuan Kadar Alkalinitas
Penentuan alkalinitas pada air minum dalam kemasan menggunakan metode titrasi asam basa.
- Dimasukkan sampel air minum dalam kemasan kedalam erlenmeyer sebanyak 100 ml
- Ditambahkan 8 tetes indikator BCG (Bromo Cressol Green)
- Dititrasi menggunakan larutan standar H2SO4 0,02 N sampai terjadi perubahan warna dari biru menjadi hijau kekuningan
- Dicatat volume titran yang terpakai - Dihitung kadar alkalinitasnya
- Diulangi perlakuan yang sama sebanyak 3 kali
- Diulangi prosedur kerja untuk hari berikutnya selama 5 hari
3.4 Perhitungan
1. Penentuan kadar total kesadahan (hardness)
Untuk menghitung kadar total kesadahan ( hardness) yang dihasilkan dari produk air minum dalam kemasan digunakan rumus sebagai berikut :
𝑇𝑜𝑡𝑎𝑙 𝐻𝑎𝑟𝑑𝑛𝑒𝑠𝑠 =𝑉(𝐸𝐷𝑇𝐴) × 𝑁(𝐸𝐷𝑇𝐴) × 100,0869 × 1000 𝑉𝑜𝑙𝑢𝑚𝑒 𝑠𝑎𝑚𝑝𝑒𝑙 (𝑚𝑙)
Dimana :
V EDTA = Volume larutan standar EDTA yang terpakai N EDTA = Normalitas larutan standar EDTA (0,01) Mr CaCO3= 100,0869
1. Perhitungan kadar total kesadahan (hardness) hari pertama - Percobaan I
Total Hardness = 6,00 x 0,01 x 100,0869 x 1000 = 60,05 mg/l 100
- Percobaan II
Total Hardness = 6,00 x 0,01 x 100,0869 x 1000 = 60,05 mg/l 100
- Percobaan III
Total Hardness = 6,00 x 0,01 x 100,0869 x 1000 = 60,05 mg/l 100
Kadar Hardness rata-rata =60,05 + 60,05 + 60,05 = 60,05 mg/l 3
Untuk hari kedua sampai kelima dilakukan perhitungan kadarkesadahan yang sama seperti pada perhitungan diatas.
2. Penentuan kadar alkalinitas
Untuk menghitung kadar alkalinitas yang dihasilkan dari produk air minum dalam kemasan digunakan rumus sebagai berikut :
𝑚𝑔 𝐶𝑎𝐶𝑂3/𝐿 = 𝑉(𝐻2𝑆𝑂4) × 𝑁(𝐻2𝑆𝑂4) × 𝐵𝐸 𝐶𝑎𝐶𝑂3 × 1000 𝑉𝑜𝑙𝑢𝑚𝑒 𝑠𝑎𝑚𝑝𝑒𝑙 (𝑚𝑙)
Dimana :
V H2SO4 = Volume larutan standar H2SO4 yang terpakai N H2SO4 = Normalitas larutan standar H2SO4 (0,02) BE CaCO3 = Berat Ekuivalen CaCO3 (50)
2. Perhitungan kadar alkalinitas hari pertama - Percobaan I
mg CaCO3/L = 4,36 x 0,02 x 50 x 1000 = 43,60 mg/l 100
- Percobaan II
mg CaCO3/L = 4,36 x 0,02 x 50 x 1000 = 43,60 mg/l 100
- Percobaan III
mg CaCO3/L =4,36 x 0,02 x 50 x 1000 = 43,60 mg/l 100
mg CaCO3/Lrata-rata = 43,60 x 43,60 x 43,60= 43,6 mg/l 3
Untuk hari kedua sampai kelima dilakukan perhitungan kadaralkalinitas yang sama seperti pada perhitungan diatas.
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil
1. Hasil analisa kadar kesadahan (hardness)
Berikut ini adalah tabel hasil analisa kadar kesadahan yang dilakukan selama lima hari mulai pada tanggal 09 Februari sampai 13 Februari 2016 menggunakan metode titrasi kompleksometri.
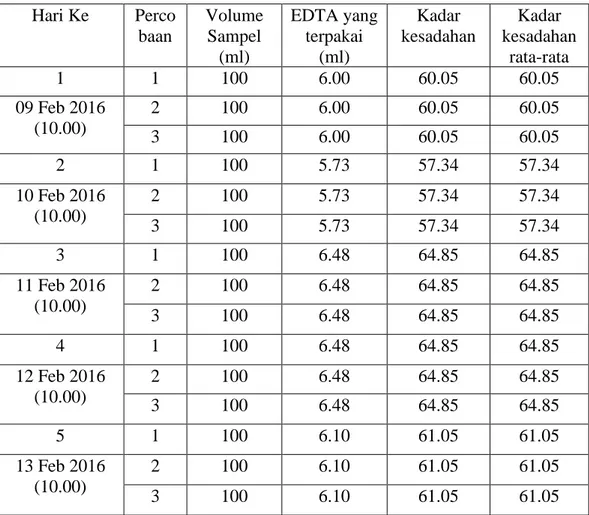
Tabel 4.1 Hasil perhitungan kadar kesadahan rata-rata pada air minum dalam kemasan di PT. Tirta Sibayakindo.
Hari Ke Perco baan
Volume Sampel
(ml)
EDTA yang terpakai
(ml)
Kadar kesadahan
Kadar kesadahan
rata-rata
1 1 100 6.00 60.05 60.05
09 Feb 2016 (10.00)
2 100 6.00 60.05 60.05
3 100 6.00 60.05 60.05
2 1 100 5.73 57.34 57.34
10 Feb 2016 (10.00)
2 100 5.73 57.34 57.34
3 100 5.73 57.34 57.34
3 1 100 6.48 64.85 64.85
11 Feb 2016 (10.00)
2 100 6.48 64.85 64.85
3 100 6.48 64.85 64.85
4 1 100 6.48 64.85 64.85
12 Feb 2016 (10.00)
2 100 6.48 64.85 64.85
3 100 6.48 64.85 64.85
5 1 100 6.10 61.05 61.05
13 Feb 2016 (10.00)
2 100 6.10 61.05 61.05
3 100 6.10 61.05 61.05
2. Hasil analisa kadar alkalinitas
Berikut ini adalah tabel hasil analisa kadar alkalinitas yang dilakukan selama lima hari mulai pada tanggal 09 Februari sampai 13 Februari 2016 menggunakan metode titrasi asam basa.
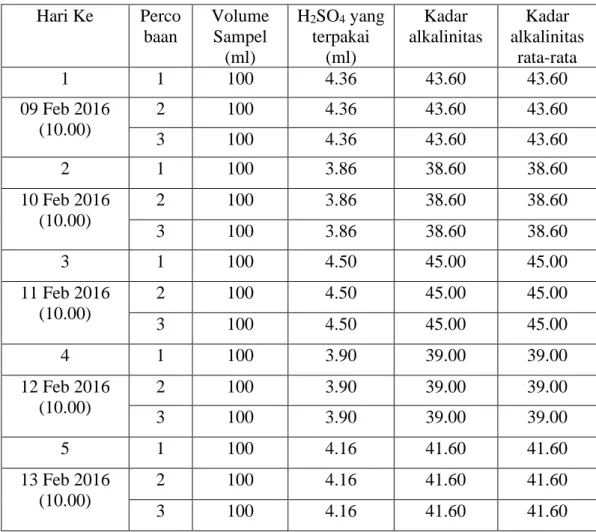
Tabel 4.2 Hasil perhitungan kadar alkalinitas rata-rata pada air minum dalam kemasan di PT. Tirta Sibayakindo.
Hari Ke Perco baan
Volume Sampel
(ml)
H2SO4 yang terpakai
(ml)
Kadar alkalinitas
Kadar alkalinitas
rata-rata
1 1 100 4.36 43.60 43.60
09 Feb 2016 (10.00)
2 100 4.36 43.60 43.60
3 100 4.36 43.60 43.60
2 1 100 3.86 38.60 38.60
10 Feb 2016 (10.00)
2 100 3.86 38.60 38.60
3 100 3.86 38.60 38.60
3 1 100 4.50 45.00 45.00
11 Feb 2016 (10.00)
2 100 4.50 45.00 45.00
3 100 4.50 45.00 45.00
4 1 100 3.90 39.00 39.00
12 Feb 2016 (10.00)
2 100 3.90 39.00 39.00
3 100 3.90 39.00 39.00
5 1 100 4.16 41.60 41.60
13 Feb 2016 (10.00)
2 100 4.16 41.60 41.60
3 100 4.16 41.60 41.60
4.2. Pembahasan
Tujuan dilakukannya pengawasan mutu yaitu untuk menentukan kualitas air minum dalam kemasan yang akan dipasarkan. Secara langsung maupun tidak langsung, pencemaran akan berpengaruh terhadap kualitas air. Sesuai dengan dasar pertimbangan penetapan kualitas air minum, usaha pengolahan terhadap air yang digunakan oleh manusia sebagai air minum berpedoman pada standar kualitas air. Oleh karena itu sebelum air minum dalam kemasan dipasarkan maka terlebih dahulu harus dianalisa secara fisika, kimia dan mikrobiologi sesuai dengan yang ditetapkan oleh WHO dan memenuhi standar SNI.
Penentuan kadar kesadahan (hardness) dilakukan dengan metode titrasi kompleksometri. Dan penentuan kadar alkalinitas dilakukan dengan metode titrasi asam basa. Dari hasil analisa yang diperoleh, kadar kesadahan (hardness) dan kadar alkalinitas pada produk masih sesuai dengan standar mutu yang telah ditetapkan di PT. Tirta Sibayakindo. Dalam hal ini Penulis menganalisa kadar kesadahan (hardness) dan kadar alkalinitas selama lima hari yaitu, untuk kadar kesadahan (hardness) hari pertama= 60,05 mg/l, hari kedua = 57,34 mg/l, hari ketiga = 64,85 mg/l, hari keempat = 64,85 mg/l, dan hari kelima = 61,05 mg/l.
Dan untuk kadar alkalinitas hari pertama = 43,60 mg/l, hari kedua = 38,60 mg/l, hari ketiga = 45,00 mg/l , hari keempat = 39,00 mg/l , dan hari kelima = 41,60 mg/l.
Kadarkesadahan (hardness) dan kadar alkalinitas sangat mempengaruhi kualitas air minum dalam kemasan, dimana kesadahan adalah gambaran kation logam divalent. Kation-kation ini dapat bereaksi dengan sabun membentuk endapan maupun dengan anion-anion yang terdapat dalam air
membentukkaratpada peralatan logam.Air tanah pada umunya mengandung bahan-bahan metal terlarut, seperti Na, Mg, Ca, dan Fe.Air yang mengandung komponen-komponen tersebut dalam jumlah tinggi disebut air sadah (Arthana, 2007).
Alkalinitas adalah kapasitas air untuk menetralkan tambahan asam tanpa penurunan nilai pH larutan (Alaerts).Alkalinitas sering disebut sebagai besaran yang menunjukkan kapasitas pem-bufffer-an dari ion bikarbonat, dan sampai tahap tertentu ion karbonat dan hidroksida dalam air. Ketiga ion tersebut di dalam air akan bereaksi dengan ion hidrogen sehingga menurunkan keasaman dan menaikkan pH.Nilai alkalinitas yang baik berkisar antara 30-500 mg/liter CaCO3.
BAB 5
KESIMPULAN DAN SARAN
5.1.Kesimpulan
Dari hasil percobaan dapat disimpulkan bahwa :
1. Penentuan kadar kesadahan dengan menggunakan titrasi kompleksometri diperoleh hasil hari pertama = 60,05 mg/l, hari kedua = 57,34 mg/l, hari ketiga
= 64,85 mg/l , hari keempat = 64,85 mg/l , dan hari kelima = 61,05 mg/l. Dan untuk penentuan kadar alkalinitas yang dilakukan dengan menggunakan titrasi asam basa diperoleh hasil hari pertama= 43,60 mg/l, hari kedua = 38,60 mg/l, hari ketiga = 45,00 mg/l, hari keempat = 39,00, dan hari kelima = 41,60. Dari hasil penentuan kadar kesadahan dan alkalinitas yang diperoleh dari percobaan pada tanggal 09 Februari sampai 13 Februari 2016 masih sesuai dengan standar mutu yang telah ditetapkan di PT. Tirta Sibayakindo.
2. Penentuan kadar kesadahan dan alkalinitas pada air minum dalam kemasan menurut SNI maksimal berkisar 500 mg/l CaCO3, sedangkan kadar kesadahan dan alkalinitas pada air minum dalam kemasan di PT. Tirta Sibayakindo masih dibawah dari kadar maksimal yang ditetapkan oleh SNI, sehingga air minum dalam kemasan yang diperoleh di PT. Tirta Sibayakindo masih sesuai dengan standar mutu yang telah ditetapkan menurut SNI.
5.2. Saran
1. Dari penentuan kesadahan, titik akhir titrasi sulit dicapai apabila menggunakan indikator yang mempunyai pH rendah akanmenghasilkan kerja yang tidak sesuai dengan reaksi logam ligan, oleh karena itu titrasi logam- logam ini dengan EDTA dilakukan pada larutan buffer ammonia pH= 10.
2. Dari penentuan alkalinitas , metode titrasi asam basa sangat dipengaruhi oleh perubahan pH titrasi. Oleh karena itu untuk menunjukkan pH haruslah digunakan indikator yang sensitif terhadap perubahan nilai pH selama titrasi berlangsung.
DAFTAR PUSTAKA
Alaerts,G. 1987. Metoda Penelitian Air.Surabaya: Usaha Nasional.
Arthana, I.W. 2007. Studi Kualitas Air Beberapa Mata Air Di Sekitar Bedugul, Bali: Bumi Lestari
Anonim. Titrasi Kompleksometri. http://Id. Wikipedia. Org/ 16 Mei 2012
Cole, G.A. 1988. Texbook of Limnologi.Third Edition. Waveland Press, Inc., Illionis, USA.
Efendi, H. 2003. Telaah Kualitas Air.Yogyakarta : Kalsius.
Fox, M. 1998. Healthy Water. Portsmouth: Healthy Water Research.
Gabriel, J. F. 2001. Fisika Lingkungan. Jakarta: Hipokrates.
Gaman,M. 1992. Ilmu Pangan, Penghantar Ilmu Pangan, Nutrisi dan Mikrobiologi. Edisi II. Yogyakarta: Gadjah Mada University Press.
Hardjadi, W. 2001. Ilmu Kimia Analitik Dasar. Cetakan Ketiga. Jakarta : PT. Gramedia
Khopkar,S.M.1990. Konsep Dasar Kimia Analitik. Universitas Indonesia Press.
Jakarta
Kozisek, F. 2005. Health Risks From Drinking Demineralised Water. Dalam:
Nutrients In Drinking Water. (2005). Switzerland: WHO Library Cataloguing In Publication Data.
Notoatmodjo, 2003. Ilmu Kesehatan Masyarakat. Penerbit Rineka Cipta, Jakarta Slamet, J.S. 1994. Kesehatan Lingkungan. Cetakan Pertama. Bandung Gadjah
Mada University Press.
Silalahi, J. 2014. Dampak Negatif Air Minum Reverse Osmosis (RO) Terhadap Kesehatan.Medan : Balai POM.
Sutrisno, C.T. 2004.Teknologi Penyediaan Air Bersih. Jakarta: Rineka Cipta
Rohman, A. 2008.Pengantar Kimia Farmasi Analisis Volumetri dan Gravimetri.
Yogyakarta : Gadjah Mada University Press.
Santika, S.S.1984. Metoda Penelitian Air. Surabaya: Penerbit Usaha Nasional.
LAMPIRAN
Lampiran 1.Persyaratan Mutu Air Minum Dalam Kemasan (AMDK) menurut SNI01-3553-2006
No. Kriteria uji Satuan
Persyaratan
Air Mineral Air Demiral 1 Keadaan
1.1 Bau - Tidak berbau Tidak berbau
1.2 Rasa Normal Normal
1.3 Warna Unit Pt-Co Maks. 5 Maks. 5
2. Ph - 6,0 – 8,5 5,0 – 7,5
3. Kekeruhan NTU Maks. 1,5 Maks. 1,5
4. Zat yang terlarut mg/l Maks. 500 Maks.10
5. Zat organic (KmnO4) mg/l Maks. 1,0 -
6. Total organik karbon mg/l - Maks. 0,5
7. Nitrat (sebagai NO3) mg/l Maks. 45 -
8. Nitrit (sebagai NO2) mg/l Maks. 0,005 -
9. Amonium (NH4) mg/l Maks. 0,15 -
10. Sulfat (SO4) mg/l Maks. 200 -
11. Klorida (Cl) mg/l Maks. 250 -
12. Fluorida (F) mg/l Maks. 1 -
13. Sianida (CN) mg/l Maks. 0,05 -
14. Besi (Fe) mg/l Maks. 0,1 -
15. Mangan (Mn) mg/l Maks. 0,05 -
16. Klor bebas (Cl2) mg/l Maks. 0,1 -
17. Kromiun (Cr) mg/l Maks. 0,05 -
18. Barium (Ba) mg/l Maks. 0,7 -
19. Boron (B) mg/l Maks. 0,3 -
20. Selenium (Se) mg/l Maks. 0,01 -
21 Cemaran logam
21.1 Timbal (Pb) mg/l Maks. 0,005 Maks. 0,005
21.2 Tembaga (Cu) mg/l Maks. 0,5 Maks. 0,5
21.3 Kadmium (Cd) mg/l Maks. 0,003 Maks. 0,003
21.4 Raksa (Hg) mg/l Maks. 0,001 Maks. 0,001
21.5 Perak (Ag) mg/l - Maks. 0,025
21.6 Kobalt (Co) mg/l - Maks. 0,01
22 Cemaran mikroba :
22.1 Bakteri bentuk koli APM/100ml < 2 < 2
22.2 Salmonella - Negatif/100ml Negatif/100ml
22.3 Pseudomonas aeruginosa Koloni/ml Nol Nol
Keterangan *) Di Pabrik **) Di Pasaran
Lampiran 2. Peraturan Menteri Kesehatan Republik Indonesia
Nomor : 416/MENKES/PER/IX/1990 Tanggal : 3 September 1990 Tentang Daftar Persyaratan Kualitas Air Minum
DAFTAR PERSYARATAN KUALITAS AIR MINUM
No PARAMETER Satuan Kadar Maksimum
yang diperbolehkan
Keterangan
1 2 3 4 5
A 1.
2.
3.
4.
5.
6.
FISIKA Bau
Jumlah zat padat terlarut (TDS) Kekeruhan Rasa Suhu Warna
- mg/L
Skala NTU -
0C Skala TCU
- 1.000
5 -
Suhu udara ± 300C 15
Tidak berbau -
- Tidak berasa
- - B
a 1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
KIMIA
Kimia Anorganik Air raksa
Alumunium Arsen Barium Besi Fluorida Kadnium Kesadahan(CaCO3) Klorida Kromium, Valensi 6 Mangan Natrium Nitrat, sebagai N Nitrit, sebagai N Perak pH
mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L mg/L
mg/L mg/L mg/L mg/L mg/L mg/L mg/L
0,001 0,2 0,05
1,0 0,3 1,5 0,005
500
250 0,05
0,1 200 10 1,0