LAPORAN TAHUNAN
HIBAH BERSAING
JUDUL:
PENGEMBANGAN APLIKASI SENYAWA DERIVAT KALKON
BERSUBSTITUEN BROMO PADA KANKER LEHER RAHIM
DAN KANKER PAYUDARA MELALUI PENDEKATAN
KOMBINASI DENGAN AGEN KEMOTERAPI
Tahun ke 1 dari rencana 2 tahun
Dibiayai oleh DIPA Direktorat Penelitian Pengabdian kepada
Masyarakat Nomor DIPA-023.04.1.673453/2015, tanggal
14 Nopember 2014, DIPA revisi 01 tanggal 03 Maret 2015.
Skim : Penelitian Hibah Bersaing Tahun Anggaran 2015
Nomor : 062/SP2H/PL/DIT.LITABMAS/II/2015
Tanggal 5 Pebruari 2015
Ketua/Anggota Tim
Dra. Retno Arianingrum, M.Si 0015126803 Prof. Dr. Indyah Sulistyo Arty, MS 0006045104
UNIVERSITAS NEGERI YOGYAKARTA
OKTOBER 2015
3
Pengembangan Aplikasi Senyawa Derivat Kalkon Bersubstituen Bromo Pada Kanker Leher Rahim dan Kanker Payudara Melalui Pendekatan
Kombinasi dengan Agen Kemoterapi
RINGKASAN
Kanker leher rahim dan kanker payudara merupakan neoplasma malignan dengan insiden tinggi dan banyak menyebabkan kematian bagi penderitanya. Upaya untuk menemukan obat kanker yang bertarget molekuler spesifik perlu terus dilakukan untuk meningkatkan efektivitasnya, mengurangi efek samping dan resistensi terhadap agen kemoterapi seperti Doksorubisin. Perkembangan terapi kanker dewasa ini mengarah pada kombinasi agen kemoterapi dan agen kemopreventif. Kalkon (1,3-difenilpropen-1-on) telah banyak di teliti sebagai senyawa terapetika, khususnya sebagai obat antitumor. Pada umumnya kalkon dan derivatnya beraksi sebagai agen kemopreventif dengan menghambat proliferasi sel, menghambat siklus sel dan induksi apoptosis. Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on merupakan senyawa derivat kalkon bersubtituen bromo, yang telah terbukti memiliki aktivitas sitotoksik pada sel kanker leher rahim, namun belum dikaji lebih lanjut aplikasinya pada sel lain dan potensinya sebagai agen ko-kemoterapi. Tujuan jangka panjang dari penelitian ini adalah mengkaji aplikasi senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on sebagai agen ko-kemoterapi dengan Doksorubisin pada sel kanker leher rahim HeLa dan sel kanker payudara T47D. Pada tahun pertama dilakukan: (1) investigasi aktivitas sitotoksik senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, dokso-rubisin, dan kombinasinya dengan metode MTT [3-(4,5-dimethylthiazol-2-yl)-2.5-dipheniltetrazolium bromide] assay; (2) pengamatan morfologi sel menggunakan mikroskop fase kontras dan pengamatan apoptosis dengan metode flowcytometri; serta (3) pengamatan ekspresi protein yang berperan dalam mekanisme apoptosis (Bcl-2 dan Bax) dengan teknik immunositochemical analysis.
Hasil penelitian menunjukkan bahwa senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on bersifat sitotoksik pada sel HeLa dan sel T47D dengan IC50 berturut-turut sebesar 50 M dan 45 M. Nilai IC50
Doksorubisin diperoleh sebesar 6 M pada sel HeLa dan 185 nM pada sel T47D. Kombinasi senyawa tersebut dengan Doksorubisin di bawah nilai IC50 pada
umumnya memberikan efek sinergi hingga sinergi kuat pada sel HeLa, dan mendekati aditif hingga sinergi pada sel T47D. Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on pada pemakaian tunggal dan kombinasinya dengan Doksorubisin dapat memacu terjadinya apoptosis baik pada sel HeLa maupun sel T47D. Jalur pemacuan apoptosis adalah dengan dengan menurunkan ekspresi Bcl-2 dan meningkatkan ekspresi Bax pada sel HeLa dan T47D.
Kata kunci : Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, ko-kemoterapi, doksorubisin, HeLa, dan T47D, apoptosis, Bcl-2, dan Bax.
4 PRAKATA
Puji Syukur Alhamdulillaah, kami panjatkan kehadirat Allah S.W.T, atas segala Rahmat dan Hidayah-Nya sehingga kegiatan penelitian berjudul “Pengembangan Aplikasi Senyawa Derivat Kalkon Bersubstituen Bromo Pada Kanker Leher Rahim dan Kanker Payudara Melalui Pendekatan Kombinasi dengan Agen Kemoterapi” pada Tahun pertama ini dapat terlaksana dengan baik. Kegiatan ini terselenggaran atas bantuan dana DIKTI melalui program Penelitian Hibah Bersaing tahun 2015. Terlaksananya kegiatan ini juga tidak terlepas dari bantuan berbagai pihak. Oleh karena itu pada kesempatan ini kami mengucapkan terima kasih kepada :
1. Rektor UNY yang telah memberi kesempatan kepada kami untuk melaksanakan kegiatan penelitian ini
2. Ketua Lembaga Penelitian dan Pengabdian kepada Masyarakat (LPPM) UNY atas kepercayaan dan kesempatan yang diberikan untuk kegiatan penelitian ini.
3. Dekan FMIPA UNY atas ijin yang telah diberikan.
4. Kepala Laboratorium Parasit Fakultas Kedokteran Universitas Gadjah Mada atas ijin dan perkenannya.
5. Teknisi di laboratorium laboratorium Parasit Fakultas Kedokteran UGM atas bantuannya dalam pelaksanaan penelitian ini
6. Berbagai pihak yang tidak dapat kami sebutkan satu per satu
“Tiada gading yang tak retak”, kami pun menyadari masih terdapat kekurangan-kekurangan baik dalam pelaksanaan kegiatan maupun penulisan laporan kemajuan ini, untuk itu kami mengharapkan saran dan kritik dari berbagai pihak.
Yogyakarta, Nopember 2015 Tim Peneliti
5 DAFTAR ISI Hal HALAMAN SAMPUL………….………. 1 HALAMAN PENGESAHAN .………. 2 RINGKASAN ……… 3 PRAKATA………..……… 4 DAFTAR ISI……….. 5 DAFTAR TABEL……….. 6 DAFTAR GAMBAR………. 7 DAFTAR LAMPIRAN……….. 10 BAB I. PENDAHULUAN………. 11 A. Latar Belakang……… 11
B. Batasan dan Rumusan Masalah……… 13
BAB II. TINJAUAN PUSTAKA……….. 15
A. Kanker, Daur Sel, dan Apoptosis …….……… 15
B. Pengobatan Kanker dan Masalah Resistensi……….. 17
C. Potensi Senyawa Kalkon dan Derivatnya Sebagai Antikanker ………. 19
D. Roadmap Penelitian ………..……….. 19
BAB III. TUJUAN DAN MANFAAT PENELITIAN .……….. 22
A. Tujuan Penelitian ……… 22
B. Manfaat Penelitian……….. 22
BAB IV. METODE PENELITIAN……….. 24
A. Lokasi Penelitian ………….……… 24
B. Rancangan Penelitian ……….…………. 24
C. Subyek dan Obyek Penelitian ……….. 24
D. Penelitian Tahun Pertama……….. 24
BAB V. HASIL DAN PEMBAHASAN……….. 29
A. Hasil Penelitian……….……… 29
B. Pembahasan ……….……… 47
BAB VI. RENCANA TAHAPAN BERIKUTNYA……….. 53
BAB VII.KESIMPULAN DAN SARAN ……….. 56
A. Kesimpulan…….……….………. 56
B. Saran……….……… 56
DAFTAR PUSTAKA……….. 57
6
DAFTAR TABEL
Halaman Tabel 1. Rancangan penelitian tahun pertama……….. 25 Tabel 2. Persen viabilitas sel HeLa pada perlakuan kombinasi
senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2- propen-1-on dan Doksorubisin pada berbagai variasi
konsentrasi………. 32
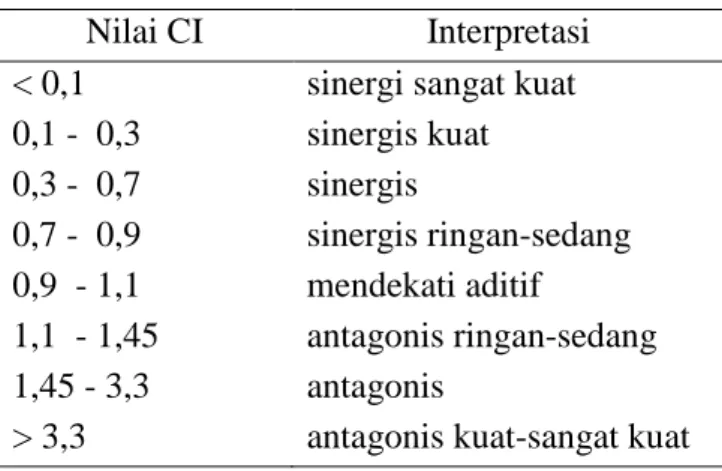
Tabel 3. Interpretasi nilai indeks kombinasi (CI) ……… 34 Tabel 4. Hasil perhitungan nilai CI pada perlakuan kombinasi senyawa
1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi terhadap
sel HeLa……… 34 Tabel 5. Persen viabilitas sel T47D perlakuan kombinasi senyawa
1-(4’-bromo-fenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi. ………… 38 Tabel 6. Hasil perhitungan nilai CI pada perlakuan kombinasi senyawa
1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi………… 40 Tabel 7. Pengaruh perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok-
si-3-metoksifenil)-2-propen-1-on terhadap kematian sel HeLa
menggunakan Annexin dengan pembacaan Flowcytometer……. 41 Tabel 8. Pengaruh perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok-
si-3-metoksifenil)-2-propen-1-on, Doksorubisin dan kombinasi keduanya terhadap kematian sel HeLa menggunakan Annexin
dengan pembacaan Flowcytometer………. 42
Tabel 9. Pengaruh perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok- si-3-metoksifenil)-2-propen-1-on terhadap kematian sel T47D
menggunakan Annexin dengan pembacaan Flowcytometer…… 43 Tabel 10. Pengaruh perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok-
si-3-metoksifenil)-2-propen-1-on, Doksorubisin dan kombinasi keduanya terhadap kematian sel T47D menggunakan Annexin dengan pembacaan Flowcytometer……… 44
7
DAFTAR GAMBAR
Halaman Gambar 1. Struktur senyawa 1-(4’-bromofenil)-3-(4-hidroksi
-3-metoksifenil)-2-propen-1-on……… 21
Gambar 2. Bagan alir penelitian pada tahun pertama……… 28 Gambar 3. Hubungan konsentrasi senyawa 1-(4’-bromofenil) -3-
(4-hidroksi-3-metoksifenil)-2-propen-1-on dengan viabilitas
sel HeLa ………. 29
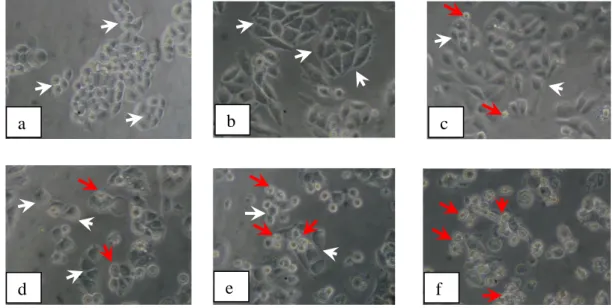
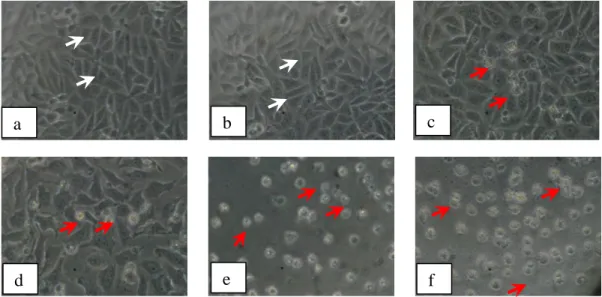
Gambar 4. Morfologi sel HeLa: (a) tanpa perlakuan (kontrol sel) dan dengan perlakuan senyawa1-(4’-bromofenil)
-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on konsentrasi : (b) 5 M, (c) 10 M, (d) 20 M, (e) 40 M, dan (f) 60 M. Tanda panah putih menunjukkan sel hidup, dan panah
merah menunjukkan sel yang mati……….. 30
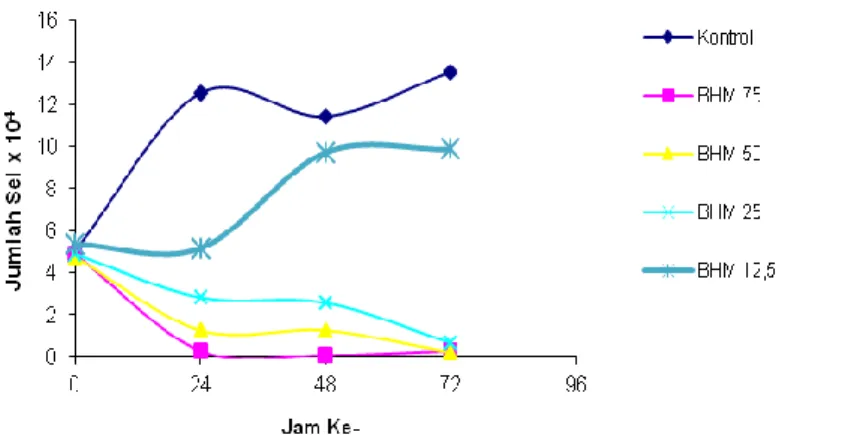
Gambar 5. Efek penghambatan proliferasi sel HeLa karena perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2- propen-1-on (BHM) pada konsentrasi 12, 5; 25; 50;
dan 75 M dengan waktu inkubasi 0, 24,48, dan 72 jam …….. 31 Gambar 6. Hubungan konsentrasi Doksorubisin dengan viabilitas
sel HeLa ………. 31
Gambar 7. Morfologi sel HeLa : (a) tanpa Perlakuan (kontrol sel) dan dengan perlakuan Doksorubisin konsentrasi : (b) 0,625 M, (c) 1,25 M, (d) 2,5 M, (e) 5 M, (f) dan 10 M.
Tanda panah putih menunjukkan sel hidup, dan panah
merah menunjukkan sel yang mati……… 32 Gambar 8. Profil viabilitas sel HeLa perlakuan kombinasi senyawa
1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsentrasi 3,125; 6,25; 12,5; dan 25 M) dan
Doksorubisin (konsentrasi 0,375; 0,75; 1,5; dan 3 M). ……….. 33 Gambar 9. Morfologi sel HeLa: (a) tanpa perlakuan (kontrol sel);
(b) perlakuan senyawa1-(4’-bromofenil) -3-(4-hidrok- si-3-metoksifenil)-2-propen-1-on konsentrasi 25 M, (c) perlakuan Doksorubisin 3 M, (d) perlakuan kombinasi senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-
metoksifenil)-2-propen-1-on 25 M dan Doksorubisin 3 M…. 34 Gambar 10. Nilai CI perlakuan kombinasi senyawa 1-(4’-bromofenil)
-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsentrasi 3,125; 6,25; 12,5; dan 25 M) dan Doksorubisin (konsentrasi 0,375; 0,75; 1,5; dan 3 M) pada kultur sel HeLa……… 35 Gambar 11. Hubungan konsentrasi senyawa 1-(4’-bromofenil) -3-
8
sel T47D ………. 35
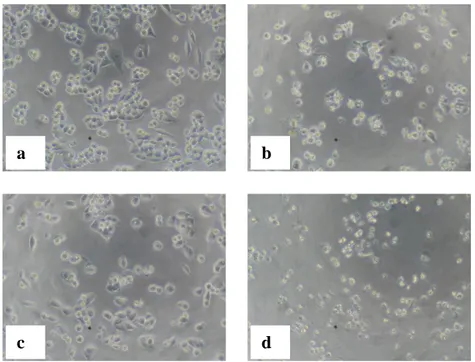
Gambar 12. Morfologi sel T47D: (a) tanpa perlakuan (kontrol sel) dan dengan perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok- si-3-metoksifenil)-2-propen-1-on, konsentrasi : (b) 5 M,
(c) 10 M, (d) 20 M, (e) 40 M,(f) dan 60 M……… 36 Gambar 13. Efek penghambatan proliferasi sel T47D karena
perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksi- fenil)-2-propen-1-on (BHM) pada konsentrasi 11,25; 22,5; 45; dan 67,5 M dengan waktu inkubasi 0, 24,48, dan 72 jam ……. 37 Gambar 14. Hubungan konsentrasi Doksorubisin dengan viabilitas sel T47D. 38 Gambar 15. Morfologi sel T47D : (a) tanpa perlakuan (kontrol sel) dan
dengan perlakuan Doksorubisin konsentrasi : (b) 50 nM,
(c) 100 nM, (d) 150 nM, (e) 200 nM, (f) dan 250 nM………. 38 Gambar 16. Profil viabilitas sel T47D perlakuan kombinasi senyawa
1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen- 1-on (konsen-trasi 2,8125; 5,625; 11,25; dan 22,5 M) dan Doksorubisin (konsentrasi 11,5625; 23,125; 46,25;
dan 92,65 nM)……….. 39
Gambar 17. Morfologi sel T47D: (a) tanpa perlakuan (kontrol sel); (b) perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi -3-metoksifenil)-2-propen-1-on konsentrasi 22,5 M, (c) perlakuan Doksorubisin 92,5 nM, (d) perlakuan
kombinasi senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksi- fenil)-2-propen-1-on 22,5 M dan Doksorubisin 92,5 M…. 40 Gambar 18. Nilai CI perlakuan kombinasi senyawa 1-(4’-bromofenil)
-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsentrasi 2,8125; 5,625; 11,25; dan 22,5 M) dan Doksorubisin (konsentrasi 11,5625; 23,125; 46,25; dan 92,65 nM)
pada Sel T47D……….. 41
Gambar 19. Pengaruh perlakuan senyawa 1-(4’-bromofenil)
-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap
proses apoptosis pada sel HeLa……….. 42
Gambar 20. Pengaruh perlakuan senyawa 1-(4’-bromofenil) -3-(4- hidroksi-3-metoksifenil)-2-propen-1-on terhadap proses
apoptosis pada sel T47D……… 43
Gambar 21. Efek perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidroksi -3-metoksifenil)-2-propen-1-on, doksorubisin, dan
kombinasi keduanya terhadap ekspresi Bcl-2 pada sel HeLa. (a). Kontrol sel tanpa perlakuan sampel yang tidak dicat dengan antibodi, (b) Kontrol sel (tanpa perlakuan sampel yang dicat dengan antibodi), (c) Perlakuan tunggal 1-(4’- bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 12,5 M, (d) Perlakuan tunggal doksorubisin 1,5 M,
9
dan (e) Perlakuan kombinasi keduanya. Pengamatan dibawah mikroskop cahaya perbesaran 400x (Bcl-2 positif
panah penuh , negatif panah putus-putus ---> )……….. 45 Gambar 22. Efek perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok-
si-3-metoksifenil)-2-propen-1-on, doksorubisin, dan kombinasi keduanya terhadap ekspresi Bax pada sel HeLa. (a). Kontrol sel tanpa perlakuan sampel yang tidak dicat dengan antibodi, (b) Kontrol sel (tanpa perlakuan sampel yang dicat dengan antibodi), (c) Perlakuan tunggal 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 12,5 M,
(d) Perlakuan tunggal doksorubisin 1,5 M, dan
(e) Perlakuan kombinasi keduanya. Pengamatan dibawah mikroskop cahaya perbesaran 400x (Bax positif panah
penuh , negatif panah putus-putus --->……….. 46 Gambar 23. Efek perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok-
si-3-metoksifenil)-2-propen-1-on, doksorubisin, dan
kombinasi keduanya terhadap ekspresi Bcl-2 pada sel T47D. (a). Kontrol sel tanpa perlakuan sampel yang tidak dicat dengan antibodi, (b) Kontrol sel (tanpa perlakuan sampel yang dicat dengan antibodi), (c) Perlakuan tunggal 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 11,25 M,
(d) Perlakuan tunggal doksorubisin 46,25 nM, dan (e) Perlakuan kombinasi keduanya. Pengamatan dibawah mikroskop cahaya perbesaran 400x (Bcl-2 positif panah
penuh , negatif panah putus-putus ---> ) ……….. 47 Gambar 24. Efek perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidrok-
si-3-metoksifenil)-2-propen-1-on, doksorubisin, dan kombinasi keduanya terhadap ekspresi Bax pada sel T47D. (a). Kontrol sel tanpa perlakuan sampel yang tidak dicat dengan antibodi, (b) Kontrol sel (tanpa perlakuan sampel yang dicat dengan antibodi), (c) Perlakuan tunggal 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 11,25 M,
(d) Perlakuan tunggal doksorubisin 46,25 nM, dan (e) Perlakuan kombinasi keduanya. Pengamatan dibawah mikroskop cahaya perbesaran 400x (Bax positif panah
10
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data Perhitungan Viabilitas Sel HeLA Perlakuan Senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksi-
fenil)-2-propen-1-on……… 61
Lampiran 2. Data Perhitungan Efek Penghambatan Proliferasi Sel HeLa Perlakuan Senyawa 1-(4’-bromofenil) -3-(4-hidroksi-
3-metoksifenil)-2-propen-1-on ……… 62
Lampiran 3. Data Perhitungan Viabilitas Sel HeLa Perlakuan
Doksorubisin ……….. 64
Lampiran 4. Uji Sitotoksik Kombinasi Senyawa 1-(4’-bromofenil) -3- (4-hidroksi-3-metoksifenil)-2-propen-1-on dan
Doksorubisin pada Sel HeLa ………. .65
Lampiran 5. Data Perhitungan Viabilitas Sel T47D Perlakuan Senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksi-
fenil)-2-propen-1-on……… 66
Lampiran 6. Data Perhitungan Efek Penghambatan Proliferasi Sel T47D Perlakuan Senyawa 1-(4’-bromofenil) -3-(4-hidroksi-
3-metoksifenil)-2-propen-1-on ……… 67
Lampiran 7. Data Perhitungan Viabilitas Sel T47D Perlakuan
Doksorubisin ……….. 69
Lampiran 8. Uji Sitotoksik Kombinasi Senyawa 1-(4’-bromofenil) -3- (4-hidroksi-3-metoksifenil)-2-propen-1-on dan
Doksorubisin pada Sel T47D ………. 70
Lampiran 9 Personalia Tenaga Peneliti
Lampiran 10. Publikasi pada “International Conference ICB Pharma II “Current Breakthrough in Pharmacy Material and Analyses” Lampiran 11. Draf HKI dan Publikasi
Lampiran 12. Surat Perjanjian Internal Pelaksanaan Penelitian Desentralisasi SKIM: Penelitian Hibah Bersaing
Lampiran 13. Berita Acara Pelaksanaan Seminar Proposal dan Instrumen Penelitian
11 BAB 1 PENDAHULUAN
A. Latar Belakang
Kanker merupakan penyakit yang ditandai dengan pertumbuhan yang tidak terkontrol dan penyebaran dari sel yang abnormal (American Cancer Society, 2012). Menurut WHO, angka kematian yang disebabkan oleh penyakit kanker semakin meningkat dari tahun ke tahun. Dilaporkan terdapat lebih dari 10 juta kasus kanker per tahun di dunia, bahkan International Agency for Research on Cancer (IARC) memperkirakan pada tahun 2030 akan ada sekitar 21,4 juta penderita kanker tersebar di seluruh dunia. Kanker payudara dan kanker leher rahim merupakan kelompok kanker penyebab kematian pertama dan kedua di dunia pada wanita (WHO, 2009). Berdasarkan sepuluh kanker primer pada wanita di Indonesia, kanker leher rahim menempati posisi pertama mencapai 28,66%, diikuti kanker payudara mencapai 17,77% (Tjindarbumi dan Mangunkusumo, 2002).
Beberapa metode untuk pengobatan kanker telah dilakukan, diantaranya pembedahan, kemoterapi dan penyinaran (radiasi). Namun, masing-masing metode mempunyai kelemahan, sehingga tingkat keberhasilannya masih rendah (King, 2000). Kegagalan yang sering terjadi pada pengobatan melalui kemoterapi disebabkan karena rendahnya selektivitas obat anti kanker dan adanya fenomena resistensi sel kanker terhadap agen kemoterapi (drug-resistence) (Wong et al., 2006). Resistensi terhadap obat anti kanker payudara, leher rahim, kolon, prostat dan leukemia banyak ditemukan (Davis et al., 2003). Oleh karena itu, pengembangan dan penemuan pengobatan kanker yang spesifik, khususnya kanker payudara dan kanker leher rahim perlu terus diupayakan.
Salah satu agen kemoterapi kanker yang telah diketahui menimbulkan resistensi adalah Doksorubisin. Senyawa golongan antrasiklin ini diberikan pada berbagai jenis kanker. Selain menimbulkan resistensi, Doksorubisin dapat menyebabkan kardiotoksisitas pada penggunaan jangka panjang (Ferreira et al., 2008). Salah satu alternatif untuk mengatasi resistensi adalah melalui kombinasi
12
agen kemoterapi dengan agen kemopreventif sehingga dapat meningkatkan keberhasilan terapi.
Kalkon (1,3-difenilpropen-1-on) adalah jenis keton dengan ikatan tidak jenuh yang telah banyak di teliti sebagai senyawa terapetika, khususnya sebagai obat antitumor. Bahkan disebutkan oleh karena aktivitasnya sebagai ”high therapeutic index”, kalkon di anggap sebagai ”the new era of medicines” dalam kapasitasnya sebagai antitumor, antibakterial, dan anti-inflamatory (Afzal et al., 2008). Disebutkan pula bahwa sebagian besar target utama dari senyawa-senyawa kalkon adalah mempengaruhi daur sel (Boumendjel et al., 2009).
Shen et al., (2007) telah membuktikan bahwa struktur dasar kalkon (1,3-difenilpropen-1-on) menghambat aktivasi nuclear factor kappa (NF-B). NF-B merupakan faktor transkripsi yang sangat berperan dalam pengembangan dan progresi kanker, karena NF-B mengatur banyak gen yang terlibat dalam inflamasi, cell survival, proliferasi sel, invasi, angionegenis, dan metastasis (Sen et al., 1986). Penghambatan aktivasi NF-B tersebut menyebabkan adanya induksi apoptosis, penghambatan siklus sel, dan menurunkan ekspresi Bcl-XL sebagai downstream target dari NF-B pada kultur sel kanker kandung kemih T24 dan HT-1376, serta sel payudara MCF-7 dan MDA-MB-231 (Hsu et al., 2006). Penggunaan agen yang mampu menghambat NF-κB seperti senyawa kalkon akan memberikan keuntungan ganda pada terapi antikanker, yaitu dapat meminimalkan resistansi dan sekaligus sebagai agen antikanker.
Arty, Arianingrum dan Atun (2012), berhasil mensintesis senyawa derivat kalkon yang mengandung substituen gugus bromo, yaitu senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on. Hasil uji sitotoksik terhadap kultur sel leher rahim HeLa menunjukkan bahwa senyawa ini berpotensi sebagai antikanker dengan IC50 sebesar 9,6 g/mL (kategori sangat aktif).
Senyawa ini juga terbukti memiliki aktivitas sebagai antioksidan yang sangat kuat (Arty et al., 2013). Kedua aktivitas tersebut diduga merupakan kontribusi adanya gugus hidroksil dan bromo yang bersifat elektronegatif. Sejauh ini penelitian yang dilakukan masih terbatas pada uji sitotoksik pada sel HeLa dan uji antioksidan.
13
Penelitian-penelitian tersebut menjadi dasar awal pemikiran untuk mengembangkan aplikasi senyawa derivat kalkon bersubstituen bromo ini sebagai sebagai obat antikanker pada kultur sel kanker yang lain, khususnya pada sel T47D yang banyak digunakan sebagai model sel kanker payudara. Demikian juga perlu dikembangkan aplikasinya sebagai agen ko-kemoterapi obat antikanker seperti Doksorubisin yang sering menimbulkan resistensi. Penelitian yang akan dilakukan meliputi penelusuran mekanisme aksi dan target molekuler dari senyawa ini baik pada pemakaian tunggal maupun kombinasinya dengan Doksorubisin, akan diarahkan pada bagaimana pengaruhnya terhadap pemacuan apoptosis, penghambatan daur sel (cell cycle arrest), ekspresi protein yang berpengaruh pada mekanisme apoptosis (Bcl-2 dan Bax) dan proses daur sel (cyclin).
B. Batasan dan Rumusan Masalah
Berdasarkan latar belakang permasalahan di atas, maka ruang lingkup penelitian ini dibatasi pada mempelajari potensi senyawa derivat kalkon bersubstituen bromo, yaitu 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on sebagai agen antikanker dan agen ko-kemoterapi Doksorubisin pada kultur sel kanker leher rahim HeLa dan sel payudara T47D. Fokus penelitian yang diamati adalah hal-hal yang berkaitan dengan faktor penghambatan sel kanker, yaitu aktivitas sitotoksik, kemampuan dalam memacu apoptosis, menghambat daur sel, dan mempengaruhi ekspresi protein yang terlibat dalam apoptosis (Bcl-2 dan Bax), dan proses daur sel (cyclin), baik pada penggunaan secara tunggal maupun bila dikombinasikan dengan Doksorubisin. Dengan demikian rumusan masalah dalam penelitian ini adalah :
Pada tahun pertama :
1. Bagaimana aktivitas sitotoksik senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya pada sel HeLa dan sel T47D?
2. Bagaimana efek perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya terhadap pemacuan apoptosis pada sel HeLa dan sel T47D ?
14
3. Bagaimana perubahan ekspresi protein yang mempengaruhi apoptosis (Bcl-2 dan Bax) pada sel HeLa sel T47D karena perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya ?
Pada tahun kedua :
1. Bagaimana efek perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya terhadap daur sel HeLa dan sel T47D ?
2. Bagaimana perubahan ekspresi protein regulator daur sel (cyclin D/cyclin E/ cyclin B) pada sel HeLa sel T47D akibat perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya ?
15 BAB 2
TINJAUAN PUSTAKA
A. Kanker, Daur Sel, dan Apoptosis
Penyakit kanker masih merupakan masalah kesehatan utama di dunia. World Health Organization (WHO) melaporkan bahwa pada tahun 1997, dari 50 juta kematian yang terjadi, sebanyak 12% disebabkan oleh kanker dan dua pertiganya terjadi di negara berkembang (WHO, 1998). Di Indonesia kanker merupakan penyebab kematian utama disamping penyakit menular. Jumlah penderita kanker di Indonesia terus bertambah, dari 3,8% pada tahun 1990 menjadi 4,1% pada tahun 1995 (Depkes, 1997).
Kanker adalah penyakit hasil mutasi gen atau kesalahan jalur transduksi sinyal yang memungkinkan terjadinya kerusakan sel (Petak et al., 2005). Pada sel kanker gangguan transduksi sinyal akan menyebabkan pembelahan yang berlebihan, penghambatan deferensiasi sel, dan penurunan kematian sel (apoptosis). Adanya perubahan ini, maka sel kanker akan berkembang dan menyebar ke jaringan lain sekaligus akan mengalami perubahan kromosom dan mutasi genetik. Perubahan genetik pada gen-gen yang mengatur pertumbuhan, yaitu onkogen dan gen tumor supressor merupakan perubahan yang sering terjadi (Meiyanto, 1999). Akibatnya sel akan berproliferasi terus menerus dan menimbulkan pertumbuhan jaringan yang abnormal (Lodish et al., 2000).
Setiap sel baik sel normal maupun sel kanker mengalami perkembangan melalui suatu siklus yang disebut daur sel (cell cycle). Daur sel meliputi beberapa fase, yaitu : membelah (fase proliferatif), dalam keadaan istirahat (tidak membelah, G-0) dan secara permanen tidak membelah. (Foster et al., 2001). Daur sel diawali dari masuknya sel pada fase G-1, pada fase ini sel melakukan persiapan untuk sintesis DNA (Wyllie et al., 2000). Selanjutnya pada fase S terjadi replikasi DNA sel. Di akhir fase ini sel siap memasuki fase G-2 untuk melakukan pertumbuhan dan sintesis protein yang memadai untuk dua sel. Setelah fase mitosis, sel dapat kembali ke fase G-1 untuk melanjutkan cell cycle atau memasuki fase G-0. Fase G-0 adalah fase istirahat (cell cycle arrest), dimana sel mengalami kelelahan dan berhenti membelah (quiescent cells) (Meiyanto, 2002). Sel dapat keluar dari fase G-0 dan memasuki fase G-1 kembali jika melewati
16
restriction point (R) (Pines, 1997). Untuk melewati restriction point (R) dibutuhkan CDK4/6 (cyclin dependent kinase 4/6) yang diaktivasi oleh cyclin D (CycD) (Foster et al., 2001). CycD bersama CDK4/6 akan mengaktifkan faktor transkripsi E2F dengan cara melepaskannya dari protein pRb (Lodish et al., 2000). E2F akan memacu ekspresi CycE, CycA, dan E2F yang lain. Kompleks CycE-CDK2 dan CycA-CDK2 berperan dalam fosforilasi pRb. E2F memacu ekspresi protein lain yang diperlukan dalam replikasi DNA, misalnya dihidrofolat reduktase, timidin kinase, timidilat sintase, dan DNA polimerase sehingga sel memasuki fase S (Teich, 1997). Pada fase S, terjadi aktivasi synthesis promoting factor (SPF) yaitu kompleks CycA-CDK2, yang pada akhir fase ini mengalami degradasi. Pada fase G2 akan terjadi kenaikan jumlah kompleks CycB-CDC2 yang disebut mitosis promoting factor (Gondhowiardjo, 2004).
Regulasi daur sel dihambat oleh Cyclin–dependent kinase inhibitor (CKI). Protein CKI meliputi CDK inhibitory protein/Kinase inhibitory protein (Cip/Kip) yaitu p21, p27 dan p57 yang membentuk kompleks trimerik dengan CDK2-CycE/CycA dan Inhibitor of cyclin–dependent kinase 4 (INK4) yaitu p15, p16, p18, dan p19 yang membentuk dimer dengan protein CDK4/6 (Foster et al., 2001). Tumor suppressor gene pRb dan p53 menghambat siklus sel (Teich, 1997) dan memberi kesempatan sel untuk melakukan perbaikan DNA atau apoptosis (Hanahan and Weinberg, 2000).
Gangguan pada regulator daur sel akan menyebabkan terganggunya program daur seperti halnya pada sel kanker. Pada sel kanker, daur sel sudah tidak dapat diatur lagi sehingga mengalami pembelahan terus menerus (Meiyanto, 2002). Oleh karena itu, pada perkembangan penelitian mengenai kanker, regulator-regulator cell cycle ini potensial untuk dijadikan target obat antikanker. Penghambatan terhadap CDK4/CDK6 menjadi target pengobatan kanker untuk menghambat proliferasi sel dengan menghentikan cell cycle pada fase G0 atau G1 arrested.
Sel kanker juga mampu menghindari mekanisme apotosis (program kematian sel). Apoptosis merupakan kematian sel yang terjadi akibat induksi dari sel itu sendiri. Apoptosis dapat terjadi akibat faktor intrinsik ketika sel mengalami kerusakan yang irreversibel pada DNA. Apoptosis yang terjadi akibat pemicuan
17
faktor ekstrinsik melibatkan peran reseptor tumor necrosis factor tertentu yang disebut reseptor kematian, yaitu TNF-2, reseptor CD95 (Fas/APO-1), dan reseptor TRAIL (Lodish et al., 2000). Protein yang berperan dalam regulasi apoptosis diantaranya p53, keluarga protein Bcl-2, Apaf, Caspase, inhibitor protein proapoptosis (serta reseptor yang merespon sinyal kematian. Sel yang mengalami apoptosis memiliki beberapa karakteristik antara lain peningkatan ekspresi protein proapoptosis (Bax, Bid dan Bak) dan penekanan ekspresi protein antiapoptosis (Bcl-2 dan Bcl-xL), peningkatan level sitokrom C sitosolik, aktivasi caspase, aktivasi PARP1, fragmentasi DNA, dan kerusakan membran sel. Akumulasi dari berbagai karakteristik tersebut menyebabkan munculnya badan-badan apoptosis yang terjadi akibat fragmentasi sel (Gerl and Vaux, 2005). Salah satu penyebab resistensi terhadap proapoptosis karena adanya mutasi pada protein p53 atau peningkatan aktivitas antiapoptosis misalnya pada upregulasi jalur PI3 kinase Akt/PKB.
B. Pengobatan Kanker dan Masalah Resistensi
Pengobatan kanker pada umumnya didasarkan pada upaya pengambilan jaringan kanker atau dengan mematikan sel kanker dan meminimalkan efek pengobatan terhadap sel normal disekitarnya. Saat ini pengambilan kanker yang paling utama adalah operasi, radioterapi dan kemoterapi, namun ketiga jenis pengobatan tersebut memiliki kekurangan. Operasi akan berhasil pada beberapa tumor yang telah berkembang, tetapi sulit mengobati pada stadium awal metastasis (Lodish et al, 2000). Pengobatan dengan radiasi mampu membunuh tumor lokal namun radiasi juga akan membunuh sel normal disekitarnya. Sebagian besar obat kemoterapi seperti taxol, 5-fluorourasil (5-FU) dan adriamisin memiliki target pada pembelahan sel (Boyer and Tannock, 2005), tetapi kemoterapi ini dapat menyebabkan diare dan kerontokan rambut. Agen kemoterapi ini juga tidak efektif untuk sel yang mengalami mutasi p53, sehingga perlu dikembangkan agen-agen baru untuk pengobatan kanker yang aman (Lodish et al., 2000).
Salah satu permasalahan yang sering timbul dalam terapi kanker adalah resistensi obat kemoterapi (drug-resistence) (Wong et al., 2006). Berbagai obat
18
kemoterapi yang digunakan dalam terapi kanker menjadi kurang berefek karena disebabkan oleh resistensi obat kemoterapi yang timbul di dalam sel. Doksorubisin merupakan obat kemoterapi dari golongan antrasiklin yang diberikan pada berbagai jenis kanker, seperti kanker payudara dan leukimia. Doksorubisin dapat berinterkalasi dengan DNA sehingga fungsi DNA sebagai template dan pertukaran sister chromatid terganggu dan pita DNA terputus. Obat ini juga dapat bereaksi dengan sitokrom P450 reduktase dengan adanya NADPH membentuk zat perantara. Zat perantara tersebut akan bereaksi dengan oksigen menghasilkan radikal bebas yang dapat menghancurkan sel. Aktivitas sitotoksik Doksorubisin tersebut dapat dihasilkan setelah masuk ke dalam sel kanker. Namun, penggunaannya dibatasi karena menyebabkan efek samping seperti mual, myelosuppression, aritmia, dan cardiomyopathy diikuti gagal jantung (Singal and Iliskovic, 1998).
Selain itu, seringkali ditemukan kasus toleransi dan resistensi sel kanker terhadap Doksorubisin. Resistensi obat ini disebabkan oleh pompa efflux P-glycoprotein (P-gp). P-gp merupakan salah satu jenis protein transport sel yang diekspresikan oleh gen MDR-1 (Valeria, 2005). Dalam kondisi normal, P-gp berperan dalam absorbsi, distribusi dan eliminasi obat di dalam tubuh (Matheny et al., 2001). P-gp dapat menurunkan konsentrasi zat sitotoksik di dalam sel (Valeria, 2005). Pada kasus kanker payudara, seperti pada sel MCF-7, ekspresi berlebih dari P-gp akan menurunkan konsentrasi agen kemoterapi seperti Doksorubisin, paclitaxel, dan vincristin di dalam sel melalui mekanisme pengeluaran obat (efflux) dari dalam sel, sehingga potensi sitotoksik Doksorubisin pada sel kanker akan berkurang (Wong et al., 2006). Sampai saat ini, belum ditemukan agen kombinasi yang efektif dengan efek samping yang rendah. Agen kemoterapi tambahan yang diberikan justru menambah efek samping, seperti cardiotoxicity. Peningkatan aksi obat kemoterapi seperti Doksorubisin dapat dibantu oleh adanya senyawa lain yang mampu menghambat CDK4 sebagai protein yang memacu proliferasi sel. CDK4 merupakan protein kinase yang berperan penting dalam transduksi proliferasi sel kanker. Penghambatan protein ini dapat mencegah sel berproliferasi sehingga jumlah sel kanker tidak bertambah. Perkembangan sel yang terhenti ini akan meningkatkan potensi aksi dari
19
Doksorubisin sebagai agen kemoterapi. Oleh karena itu, perlu dikembangkan senyawa yang potensial sebagai agen kombinasi dan memiliki resiko toksisitas rendah.
C. Potensi Senyawa Kalkon dan Derivatnya Sebagai Antikanker
Berdasarkan studi penelusuran literatur menunjukkan bahwa beberapa senyawa golongan flavonoid dan terpenoid telah diketahui memiliki aktivitas antitumor (Mathivadhani et. al., 2007, Kampa et al., 2004). Senyawa kalkon merupakan senyawa yang termasuk dalam famili flavonoid dan banyak di teliti sebagai therapeutic, khususnya sebagai obat antitumor. Upaya-upaya untuk melakukan eksplorasi senyawa kalkon sebagai antikanker telah dilakukan, baik dengan isolasi senyawa dari bahan alam maupun sintesis. Diantaranya senyawa flavon dan kalkon glikosida yang diisolasi dari ekstrak metanol bunga Helichrysum arenarium, senyawa-senyawa tersebut memiliki aktivitas menghambat tumor necrosis faktor- (TNF- )-induced citotoxixity pada sel L929. TNF- sangat berperan dalam pengaturan mekanisme apoptosis (Toshio, et al., 2009).
Beberapa senyawa kalkon hasil sintesis diantaranya : Trans-4-lodo,4-boranyl-chalcone memiliki aktivitas antitumor terhadap malignant glioma cell lines secara in vitro dan in vivo (Sasayama, et al., 2007); senyawa 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone bersifat antitumor terhadap enam cancer cell lines secara invitro (Ye, et al., 2004); senyawa 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone memiliki aktivitas antitumor terhadap ”solid human carcinoma xenograft model”. secara invivo (Ye, et al., 2005). Tidak kalah menariknya adalah senyawa 2-hydroxy-4- methoxychalcone yang memiliki aktivitas anti-angiogenic dan antitumor (Lee, et al, 2006).
D. Roadmap Penelitian
Arty, et al., (2000), berhasil mensintesis beberapa derivat kalkon, yaitu senyawa mono para-hidroksi kalkon yaitu : (a) 3-(4’-hidroksi-3’-metoksifenil)-1-fenil-2-propen-1-on atau MPHK A ; (b) 3-(4’-hidroksi-3’-metoksifenil)-1-(4”-metoksifenil)-2-propen-1-on atau MPHK B; (c)
1-(4”-fluorofenil)-3-(4’-hidroksi-20
3’-metoksifenil)-2-propen-1-on atau MPHK C; (d) 3-(3’, 5’-ditersierbutil-4’-hidroksifenil)-1-(4”-fluorofenil)-2-propen-1-on atau MPHK D, dan (e) 3-(3’,5’-ditersierbutil-4’-hidroksifenil)-1-(4”-kloro-fenil)-2-propen-1-on atau MPHK E. Berdasarkan uji aktivitas penghambatan lipid peroksidasi non enzimatis, dan aktivitas penghambatan siklooksigenase, senyawa-senyawa ini menunjukkan sangat poten sebagai antioksidan.
Hasil uji sitotoksisitas dari senyawa tersebut terhadap sel HeLa dan sel Raji menunjukkan bahwa senyawa MPHK A dan MPHK C atau 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on memiliki aktivitas sitotoksik dalam menghambat pertumbuhan sel HeLa dan sel Raji (Arty, 2009). Penelitian lebih lanjut terhadap senyawa MPHK A menunjukkan bahwa senyawa ini bersifat sitotoksik pada sel kanker payudara T47D, serta tidak bersifat sitotoksik terhadap sel normal Vero (Arianingrum, et al.,2010). Pada sel T47D, senyawa MPHK A bersifat antiproliferasi dengan menekan viabilitas sel, dan mempengaruhi daur sel dengan menginduksi sel pada fase G1 (Arianingrum, et al, 2012). Penelitian lebih lanjut pada senyawa MPHK C, yaitu senyawa derivat kalkon bersubstituen fluoro 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on menunjukkan bahwa senyawa ini bersifat sitotoksik pada sel HeLa dengan IC50 sebesar sebesar 34 M yang termasuk kategori aktif. Demikian juga
pada penggunaan senyawa ini dengan kombinasi Doksorubisin terbukti memberikan efek sinergi kuat. Senyawa ini baik tunggal maupun kombinasinya dengan Doksorubisin juga terbukti mampu memacu terjadinya apoptosis pada sel HeLa, sehingga mengakibatkan menurunkan viabilitas sel (Arianingrum et al., 2013). Hasil penelitian ini telah didaftarkan patennya dengan nomor P00201304740.
Arty et al (2012, dan 2013) juga telah berhasil mensintesis senyawa derivat kalkon bersubstituen bromo, yaitu 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (Gambar 1), dengan mereaksikan 4-bromoasetofenon dan vanilin melalui kodensasi aldol silang dengan katalis asam. Senyawa ini yang berbentuk kristal berwarna kuning dengan rendemen 69,83% dan titik lebur 103-106oC. Senyawa ini memiliki sifat antioksidan yang sangat kuat terhadap DPPH dengan IC50 sebesar 10,14 g/mL, dan bersifat sitotoksik yang sangat kuat
21
terhadap cancer cell lines sel HeLa dengan IC50 sebesar 9,6 g/mL sehingga
berpotensi sebagai antikanker. Sejauh ini belum dilakukan penelitian lebih lanjut dan mendalam tentang aplikasi pada sel kanker yang lain dan penggunanaanya bila di kombinasikan dengan agen kemoterapi yang lain.
Gambar 1. Struktur senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on HO HO F O CH3O Br
22 BAB 3
TUJUAN DAN MANFAAT PENELITIAN
A. Tujuan Penelitian Pada tahun pertama :
1. Menginvestigasi aktivitas sitotoksik senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya pada sel HeLa dan sel T47D.
2. Mengkaji efek perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya terhadap pemacuan apoptosis pada sel HeLa dan sel T47D.
3. Mengamati perubahan ekspresi protein yang mempengaruhi apoptosis (Bcl-2 dan Bax) pada sel HeLa sel T47D akibat perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya
Pada Tahun kedua :
1. Mengkaji efek perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, Doksorubisin, dan kombinasi keduanya terhadap daur sel HeLa dan sel T47D.
2. Mengamati perubahan ekspresi protein regulator daur sel (cyclin D/cyclin E/ cyclin B) pada sel HeLa sel T47D akibat perlakuan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, , Doksorubisin, dan kombinasi keduanya
B. Manfaat Penelitian
Penelitian ini penting dilakukan mengingat obat antikanker yang selektif dan murah masih sangat diperlukan. Terlebih insiden kanker leher rahim dan kanker payudara di Indonesia menduduki peringkat pertama dan kedua, dan seringkali terjadi toleransi dan resistensi obat. Dengan pengembangan aplikasi senyawa ini melalui pendekatan kombinasi dengan agen kemoterpi diharapkan dapat meningkatkan efektivitas kemoterapi, mengatasi masalah resistensi dan menurunkan resiko toksisitas akibat kemoterapi. Penelitian ini akan memberikan sumbangan informasi mengenai aktivitas derivat kalkon bersubstitusi bromo, baik
23
tunggal maupun kombinasi dengan agen kemoterapi Doksorubisin dalam pengobatan kanker. Hasil penelitian ini, dapat dijadikan dasar aplikasi klinik ko-kemoterapi pengobatan kanker leher rahim dan kanker payudara. Selain itu penelitian ini juga mengembangkan sistem analisis untuk ko-kemoterapi pada level molekuler.
24 BAB 4
METODE PENELITIAN
A. Lokasi Penelitian
Penelitian dilakukan di laboratorium Kimia Organik dan Biokimia Universitas Negeri Yogyakarta dan laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada.
B. Rancangan Penelitian
Rancangan dan indikator capaian terukur dari penelitian ini disajikan pada Tabel 1.
C. Subyek dan Obyek Penelitian
Subyek penelitian ini adalah senyawa derivat kalkon bersubstituen bromo, 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on. Objek peneli-tiannya adalah aplikasinya sebagai agen ko-kemoterapi Doksorubisin pada sel HeLa dan sel T47D, pada tahun pertama meliputi : (1) uji sitotoksik, (2) uji aktivitas pemacuan apoptosis, dan (3) uji pengamatan protein yang terlibat dalam apoptosis apoptosis (Bcl-2 dan Bax). Pada tahun kedua : (1) uji penghambatan daur sel, dan (2) uji pengamatan protein yang mempengaruhi daur sel (cyclin D/cyclin E/ cyclin B).
D. Penelitian Tahun Pertama
1. Uji Sitotoksik dengan MTT assay
a. Alat yang digunakan : tangki nitrogen cair, mikroskop fluoresensi, mikroskop fase kontras,mikroskop fluoresensi, penangas air, sentrifuge, inkubator CO2 , incubator, ELISA (Enzyme Linked Immunosorbent Assay)
reader, hemocytometer (New Bauer), tabung conical steril, scraper, tissue culture flask, ampul, plate, laminar airflow, pH meter, mikroplate 96 sumuran, mikropipet, vorteks, timbangan elektrik, eppendorft, pipet, dan tip.
25
Tabel 1. Rancangan penelitian tahun pertama Tahun Pertama
No Kegiatan Penelitian Metode Indikator Target Luaran 1. Uji sitotoksik tunggal :
a. Senyawa1-(4’-bromofenil)-3- (4-hidroksi-3-metoksifenil)-2-propen-1-on pada sel HeLa & sel T47D
b. Doksorubisin pada sel HeLa & sel T47D
MTT assay a. IC50 1-(4’-bromofenil)-3-(4- hidroksi-3-metoksifenil)-2-propen-1-on pada sel HeLa & sel T47D
b. IC50 Doksorubisin pada sel HeLa & sel T47D
2. Uji sitotoksik kombinasi : Senyawa 1-(4’-bromofenil)-3- (4-hidroksi-3-metoksifenil)-2-propen-1-on + Doksorubisin pada sel HeLa & sel T47D
MTT assay CI senyawa 1-(4’-bromofenil)-3-(4- hidroksi-3-metoksifenil)-2-propen-1-on + Doksorubisin pada sel HeLa & sel T47D
3. Pengamatan pemacuan apoptosis perlakuan:
a. Senyawa 1-(4’-bromofenil)-3- (4-hidroksi-3-metoksifenil)-2-propen-1-on pada sel HeLa & sel T47D
b. Doksorubisin pada sel HeLa & T47D
c. Kombinasi 1-(4’-bromofenil)- 3-(4-hidroksi-3-metoksifenil)-2-propen-1-on +Doksorubisin pada sel HeLa & T47D*)
Flowcytometry Persentase sel yang apoptosis karena perlakuan :
a. Senyawa 1-(4’-bromofenil)-3-(4- hidroksi-3-metoksifenil)-2-propen-1-on pada sel HeLa & sel T47D.
b. Doksorubisin pada sel HeLa & sel T47D
c. Kombinasi senyawa 1-(4’- bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on + Doksorubisin pada sel sel HeLa & T47D
4. Analisis ekspresi protein regulator apoptosis Bcl-2 dan Bax karena perlakuan:
a. Senyawa 1-(4’-bromofenil)-3- (4-hidroksi-3-metoksifenil)-2-propen-1-on pada sel HeLa & sel T47D
b. Doksorubisin pada sel T47D c. Kombinasi
1-(4’-bromofenil)- 3-(4-hidroksi-3-metoksifenil)-2-propen-1-on +Doksorubisin pada sel HeLa & sel T47D*)
ICC Level ekspresi protein Bcl-2 dan Bax karena perlakuan:
a. Senyawa 1-(4’-bromofenil)-3-(4- hidroksi-3-metoksifenil)-2-propen-1-on pada sel HeLa & sel T47D
b. Doksorubisin pada sel T47D c. Kombinasi senyawa
1-(4’- bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on + Doksorubisin pada sel HeLa & sel T47D
tanda *) dilakukan bila uji sitotoksisik kombinasi memberikan hasil sinergi positif
b. Bahan yang digunakan: Cell line cancer Sel HeLa dan T47D, Medium
Rosewell Park Memorial Institut (RPMI) 1640 (GIBCO BRL) untuk sel HeLa, medium penumbuh mengandung growth factor 10% dan 20% FBS (Fetal Bovine Serum) (Sigma Chem. CO. St. Louis. USA), DMEM (Dulbecco’s modified Eagle’s Medium) (Invitrogen) ntuk sel T47D, etidium
26
bromid, RNA-se, DMSO (Dimetil Sulfoksida), natrium karbonat (E.Merck), kertas saring 0,2 m, akuades, fungison dan antibiotik penisilin dan streptromisin (Sigma Chem. CO. St. Louis. USA), hepes dan tripsin (Sigma Chem. CO. St. Louis. USA). PBS (Phospat Buffer Saline), MTT (3-(4,5-dimetil tiazol-2-yl)-2,5-difenil tetra-zolium bromida), SDS (Sodium duodecyl sulphate)10% dalam HCl 0,01 N.
c. Prosedur Kerja
Sel dengan konsentrasi 1 x 104 sel/sumuran didistribusikan ke dalam plate 96 sumuran dan diinkubasi selama 24 jam untuk beradaptasi dan menempel di sumuran. Keesokannya media diambil kemudian ditambahkan 100 μl media kultur yang mengandung DMSO 0,2% (kontrol) atau sampel, inkubasi selama 24 atau 48 jam. Pada akhir inkubasi, media kultur yang mengandung sampel dibuang, dicuci dengan 100 l PBS. Kemudian ke dalam masing-masing sumuran ditambahkan 100 l media kultur yang mengandung MTT 5 mg/ml, inkubasi lagi selama 4 jam pada suhu 37°C. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan berwarna ungu. Setelah 4 jam, media yang mengandung MTT dibuang, kemudian ditambahkan larutan SDS untuk melarutkan kristal formazan. Digoyang di atas shaker selama 10 menit kemudian dibaca dengan dengan ELISA reader pada panjang gelombang 595 nm. Data absorbansi perlakuan tunggal dikonversi ke dalam persen sel. Potensi aplikasi dalam terapi kombinasi dianalisis dengan membandingkan viabilitas sel perlakuan tunggal dengan kombinasi. Data absorbansi perlakuan tunggal dikonversi ke dalam persen sel hidup dan digunakan untuk menghitung IC50. Potensi aplikasi
dalam terapi kombinasi dianalisis dengan menggunakan metode indeks kombinasi (combinatorial index method/CI) berdasarkan Chou (Reynolds and Maurer, 2005).
2. Uji Pengamatan Apoptosis dengan Flowcytometri
a. Alat yang digunakan : plate 6 well, flowcytometer, eppendorft, pipet, dan tip.
27
b. Bahan yang digunakan : 1X Working Solution (1 mL 100X Stock Solution diencerkan menjadi 1/100 dalam Phosphat Buffer Saline (PBS) dan Annexin- V-Fluos Staining Kit Roche.
c. Prosedur Kerja
Sel (kepadatan 5 X 105 sel/sumuran) ditanam dalam plate 6 well sampai 50-60 % konfluen. Setelah itu diinkubasi dengan senyawa uji selama 24 jam. Medium diambil dan dimasukkan dalam tabung sentrifus. Sel di cuci dengan tripsin 0,25% untuk melepas sel dari plate dan dilakukan inkubasi selama 3 menit dalam inkubator CO2. Kemudian ditambahkan media kultur 1 mL. Sel beserta
media kultur tersebut dipindahkan juga dalam tabung sentrifus. Selanjutnya sel yang masih tersisa dalam plate dicuci dengan PBS 2X masing-masing sebanyak 1 mL dan PBS ditambahkan dalam tabung sentrifus. Kemudian disentrifus pada 600 g selama 5 menit. Media dibuang dan sel dicuci dengan PBS 1 mL dan disentrifus pada 200 g selama 5 menit. Larutan PBS dibuang dan sel diresuspensi dengan 100 mL Annexin-V-Fluos-labelling solution yang terdiri dari (2 L Annexin-V-Fluos, 100 L buffer, dan 2 L propidium iodide ) untuk 1 kali reaksi. Inkubasi selama 10 menit pada ruang gelap dan dianalis dengan flowcytometer.
3. Uji Penghambatan Ekspresi Protein dengan Imunositokimia
a. Alat yang digunakan : coverslips, plate 24 well, incubator, mikroskop cahaya.
b. Bahan yang digunakan : Metanol (Merck), Etanol (Merck), PBS, akuades, hydrogen peroksida (H2O2), antibodi primer terhadap Bcl-2 (Biocare) dan
Bax, Starr Trek Universal HRP Detection Kit (Biocare), mayer-hemaktoksilin (Dako), xylol, enteler.
c. Prosedur Kerja
Sel (kepadatan 5 X 104 sel/sumuran) ditanam pada coverslips dalam plate 24 sampai 80 % konfluen. Setelah itu diinkubasi dengan senyawa uji selama 24 jam. Medium diambil, dicuci dengan PBS 2 kali. Selanjutnya sel dalam coverslips difiksasi dengan metanol dingin dan dicuci PBS 2 kali, kemudian dicuci dengan akuades 2 kali. Coverslips dipindahkan dalam slide kemudian ditambahkan 300 L H2O2 (1: 9 dalam akuades), kemudian diinkubasi selama 10 menit, dibuang
28
dan dicuci dengan PBS 2 kali. Selanjutnya di tambahkan 100 L Blocking (Background Snipper), inkubasi selama 15 menit pada suhu kamar, dibuang dan ditambahkan 50 L antibodi primer (Bcl-2 atau Bax) inkubasi selama 60 menit. Setelah dibuang dicuci dengan PBS 2 kali, kemudian tambahkan 100 L antibody sekunder (Trekkie Universal) inkubasi selama 20 menit pada suhu kamar. Setelah dibuang, dicuci dengan PBS 2 kali dan ditambahkan Trek Avidin-HRP, diinkubasi selama 10 menit pada suhu kamar, dibuang dan dicuci dengan PBS 2 x. Dilanjutkan dengan penambahan 100 L DAB, diinkubasi 5 menit, dibuang, dan dicuci dengan akuades. Setelah dibuang dan dibersihkan dengan tissue ditambahkan dengan 300 L mayer-hemaktoksilin dan diinkubasi 5 menit. Kemudian dicuci dengan akuades hingga bersih. Slide (preparat) dicelup dalam etanol, kemudian dicelup dalam xylol. Setelah kering ditutup dengan cover glass dan ditambahkan enteler. Ekspresi protein diamati menggunakan mikroskop. Sel yang mengekspresikan protein tertentu akan memberikan warna coklat/gelap, sedangkan yang tidak mengekspresikan protein tertentu memberikan warna ungu.
Bagan alir penelitian tahun pertama disajikan pada Gambar 2.
Gambar 2. Bagan alir penelitian pada tahun pertama Senyawa Derivat Kalkon Bersubstitusi Bromo
1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on
Uji aktivitas sitotoksik kombinasi senyawa derivat kalkon bersubstutisi bromo dan Doksorubisin pada sel HeLa & sel T47D
IC 50
% viabilitas sel & nilai CI Doksorubisin
Uji aktivitas sitotoksik senyawa derivat kalkon bersubstitusi bromo dan Doksoribisin tunggal pada sel
HeLa & sel T47D
Uji induksi apoptosis perlakuan senyawa derivate kalkon bersubstitusi bromo, Doksorubisin, dan kombinasi keduanya pada sel HeLa &
sel T47D
% sel yang mengalami apoptosis
Uji efek senyawa derivat kalkon bersubstutisi bromo, Doksorubisin, dan kombinasi keduanya terhadap ekspresi protein yang berperan
dalam apoptosis : Bcl-2 dan Bax.
Ekspresi protein Bcl-2 dan Bax TAHUN I
29 BAB V
HASIL DAN PEMBAHASAN
A. HASIL PENELITIAN 1. Uji Sitotoksik
Uji sitotoksik dilakukan untuk mengetahui sifat sitotoksik dari senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, baik pada penggunaan tunggal maupun kombinasinya dengan doksorubisin terhadap sel HeLa dan T47D. Pada penelitian ini uji sitotoksisitas dilakukan menggunakan metode MTT.
a. Uji Sitotoksik Terhadap Sel HeLa
1) Uji sitotoksik senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap sel HeLa
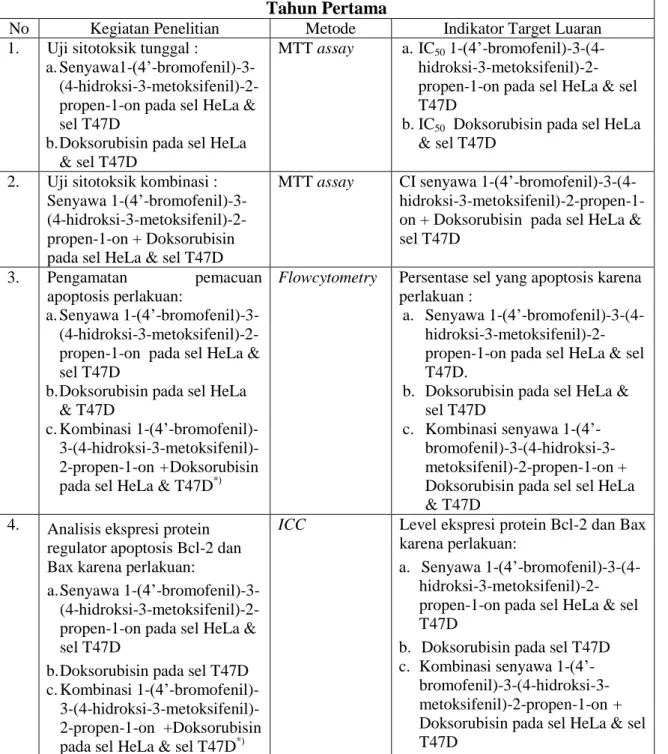
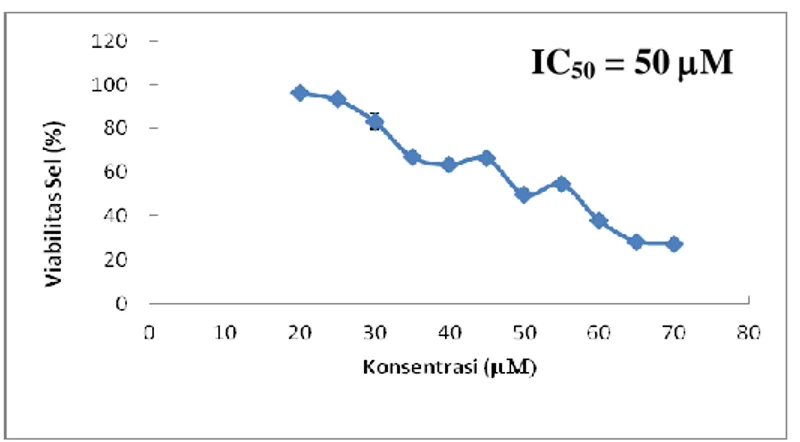
Potensi ketoksikan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap sel HeLa dinyatakan dalam bentuk grafik hubungan antara konsentrasi dengan prosentase viabilitas sel (Gambar 3), dan data selengkapnya disajikan pada Lampiran 1. Berdasarkan hasil pengamatan tersebut menunjukkan bahwa semakin tinggi konsentrasi senyawa yang diberikan, semakin renah viabilitas sel Hela atau semakin banyak jumlah sel HeLa yang mengalami kematian. Berdasarkan hasil perhitungan (Lampiran 1) diperoleh nilai IC50 dari senyawa ini terhadap sel HeLa sebesar 50 M.
Gambar 3. Hubungan konsentrasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dengan viabilitas sel HeLa
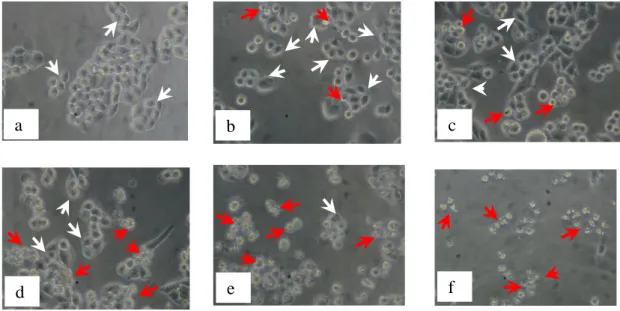
Morfologi sel HeLa karena perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on disajikan pada Gambar 4. Bila
30
dibandingkan dengan kontrol sel, nampak bahwa semakin besar konsentrasi penambahan senyawa tersebut, semakin banyak sel yang mengalamai kematian.
Gambar 4. Morfologi sel HeLa: (a) tanpa perlakuan (kontrol sel) dan dengan perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on konsentrasi : (b) 5 M, (c) 10 M, (d) 20 M, (e) 40 M, dan (f) 60 M. Tanda panah putih menunjukkan sel hidup, dan panah merah menunjukkan sel yang mati.
Uji doubling time untuk menunjukkan sifat proliferasi (Gambar 5) menunjukkan bahwa senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on mampu menekan laju pertumbuhan sel. Data selengkapnya disajikan pada Lampiran 2.
2) Uji sitotoksik Doksorubisin terhadap sel HeLa
Hasil uji sitotoksik Doksorubisin terhadap sel HeLa disajikan pada Gambar 6 dan data selengkapnya disajikan pada Lampiran 3. Viabilitas sel HeLa semakin menurun dengan meningkatnya konsentrasi Doksorubisin, dari hasil perhitungan, nilai IC50 Doksorubisin terhadap sel HeLa sebesar 6 M.
Perubahan morfologi sel HeLa karena penambahan senyawa Doksorubisin disajikan pada Gambar 7. Bila dibandingkan dengan kontrol sel,
a b
f c
31
nampak bahwa semakin besar konsentrasi penambahan Doksorubisin, semakin banyak sel yang mengalami kematian.
Gambar 5. Efek penghambatan proliferasi sel HeLa karena perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (BHM) pada konsentrasi 12, 5; 25; 50; dan 75 M dengan waktu inkubasi 0, 24,48, dan 72 jam .
Gambar 6. Hubungan konsentrasi Doksorubisin dengan viabilitas sel HeLa
3) Uji sitotoksik kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin terhadap sel HeLa
Uji sitotoksik kombinasi Doksorubisin dan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap sel HeLa dilakukan pada konsentrasi (1/16; 1/8; 1/4; dan 1/2 ) dari nilai IC50 atau dibawah nilai IC50.
Senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on yang digunakan sebesar 3,125; 6,25; 12,5; dan 25 M, sedangkan konsentrasi Doksorubisin sebesar 0,375; 0,75; 1,5; dan 3 M. Kombinasi kedua senyawa ini
32
mampu menurunkan viabilitas sel lebih rendah daripada penggunaan masing-masing senyawa secara tunggal sebagaimana ditunjukkan pada Tabel 2 .
Gambar 7. Morfologi sel HeLa : (a) tanpa Perlakuan (kontrol sel) dan dengan perlakuan Doksorubisin konsentrasi : (b) 0,625 M, (c) 1,25 M, (d) 2,5 M, (e) 5 M, (f) dan 10 M. Tanda panah putih menunjukkan sel hidup, dan panah merah menunjukkan sel yang mati.
Tabel 2. Persen viabilitas sel HeLa pada perlakuan kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi.
Viabilitas Sel (%) Doksorubisin (M) 1-(4’-bromofenil) -3- (4-hidroksi-3- metoksi-fenil)-2-propen-1-on (M) 0 0,375 0,75 1,5 3 0 100 72,39 69,05 58,55 50,09 3,125 95,80 67,39 63,87 58,12 51,20 6,25 96,85 64,73 67,14 57,07 47,87 12,5 80,54 53,55 53,86 26,87 11,12 25 50,71 9,20 5,93 5,99 5,44
Penurunan viabilitas sel tersebut juga nampak pada Gambar 8. Pada penelitian ini viabilitas sel terendah diperoleh pada kombinasi konsentrasi Doksorubisin sebesar 3 M. dan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on sebesar 25 M.
a b c
f e
33
Gambar 8. Profil viabilitas sel HeLa perlakuan kombinasi senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsen-trasi 3,125; 6,25; 12,5; dan 25 M) dan Doksorubisin (konsentrasi 0,375; 0,75; 1,5; dan 3 M).
Morfologi sel karena pengaruh perlakuan 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on tunggal, Doksorubisin tunggal dan kombinasinya disajikan pada Gambar 9.
Gambar 9. Morfologi sel HeLa: (a) tanpa perlakuan (kontrol sel); (b) perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on k-3-(4-hidroksi-3-metoksifenil)-2-propen-1-onsentrasi 25 M, (c) perlakuan Doksorubisin 3 M, (d) perlakuan kombinasi senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 25 M dan Doksorubisin 3 M.
a
d c
34
Selain itu sitotoksik kombinasi juga ditetapkan dengan menghitung indeks interaksi antara agen kemoterapi dengan 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on menggunakan persamaan :
Combination Index/CI = (D)1/(Dx)1 + (D)2/(Dx)2
D1 dan D2 adalah konsentrasi sampel yang digunakan dalam perlakuan kombinasi. (Dx)1 dan (Dx)2 adalah konsentrasi tunggal yang dapat menghasilkan efek sebesar yang ditimbulkan perlakuan kombinasi (Reynols and Maurer,2005). Angka CI yang diperoleh diinterpretasikan sebagaimana Tabel 3, sedangkan hasil perhitungannya disajikan pada Tabel 4 dan Gambar 10, sedangkan data selengkapnya di sajikan pada Lampiran 4.
Tabel 3. Interpretasi nilai indeks kombinasi (CI)
Nilai CI Interpretasi
< 0,1 sinergi sangat kuat 0,1 - 0,3 sinergis kuat 0,3 - 0,7 sinergis 0,7 - 0,9 sinergis ringan-sedang 0,9 - 1,1 mendekati aditif 1,1 - 1,45 antagonis ringan-sedang 1,45 - 3,3 antagonis
> 3,3 antagonis kuat-sangat kuat
Tabel 4. Hasil perhitungan nilai CI pada perlakuan kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi terhadap sel HeLa.
Nilai CI Doksorubisin (M) 1(4’bromofenil) - 3-(4-hidroksi-3- metoksi-fenil)-2-propen-1-on (M) 0,375 0,75 1,5 3 3,125 0,364 0,495 0,583 0,633 6,25 0,384 0,716 0,608 0,549 12,5 0,350 0,443 0,201 0,144 25 0,244 0,232 0,235 0,239
Berdasarkan perhitungan nilai CI, terlihat bahwa pada kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan
35
Doksorubisin, memberikan interprestasi sinergi (nilai CI 0,3 – 0,7) hingga sinergi kuat (nilai CI antara 0,0,3). Hasil ini membuktikan bahwa senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on berpotensi untuk digunakan sebagai agen ko-kemoterapi Doksorubisin pada sel HeLa.
b. Uji Sitotoksik Terhadap Sel T47D
1) Uji sitotoksik senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap sel T47D
Hasil uji sitotoksik senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap sel T47D disajikan pada Gambar 11 yang menggambarkan grafik hubungan antara konsentrasi dengan prosentase viabilitas sel.
Gambar 10. Nilai CI perlakuan kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsentrasi 3,125; 6,25; 12,5; dan 25 M) dan Doksorubisin (konsentrasi 0,375; 0,75; 1,5; dan 3 M) pada kultur sel HeLa.
Gambar 11. Hubungan konsentrasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dengan viabilitas sel T47D
36
Hasil pengamatan menunjukkan bahwa terdapat hubungan langsung antara perubahan konsentrasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dengan tingkat kematian sel T47D. Semakin tinggi konsentrasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, semakin rendah viabilitas sel T47D. Berdasarkan hasil perhitungan, diperoleh nilai IC50 dari senyawa ini terhadap sel T47D sebesar 45 M (Lampiran 5).
Perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on jug menyebabkan perubahan morfologi sel T47D sebagaimana disajikan pada Gambar 12. Semakin besar konsentrasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, semakin banyak sel yang mati.
Gambar 12. Morfologi sel T47D: (a) tanpa perlakuan (kontrol sel) dan dengan perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, konsentrasi : (b) 5 M, (c) 10 M, (d) 20 M, (e) 40 M,(f) dan 60 M.
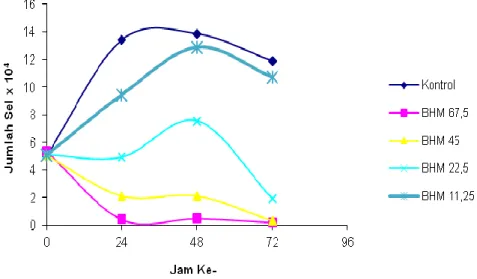
Efek penghambatan prolifaerasi (Gambar 13) menunjukkan bahwa senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on mampu menekan laju pertumbuhan sel T47D. Data selengkapnya disajikan pada Lampiran 6.
2) Uji sitotoksik Doksorubisin pada sel T47D
Hasil pengamatan uji sitotoksik Doksorubisin terhadap sel T47D (Gambar 14) menunjukkan bahwa semakin tinggi perlakuan konsentrasi
a b
f c
37
Doksorubisin, semakin rendah vibilitas sel T47D. Nilai IC50 Doksorubisin
terhadap sel T47D sebesar 185 nM (Lampiran 7).
Gambar 13. Efek penghambatan proliferasi sel T47D karena perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (BHM) pada konsentrasi 11,25; 22,5; 45; dan 67,5 M dengan waktu inkubasi 0, 24,48, dan 72 jam .
Gambar 14. Hubungan konsentrasi Doksorubisin dengan viabilitas sel T47D.
Morfologi sel T47D karena penambahan Doksorubisin (Gambar 15) menunjukkan bahwa semakin besar konsentrasi penambahan Doksorubisin, semakin banyak sel yang mengalami kematian.
38
Gambar 15. Morfologi sel T47D : (a) tanpa perlakuan (kontrol sel) dan dengan perlakuan Doksorubisin konsentrasi : (b) 50 nM, (c) 100 nM, (d) 150 nM, (e) 200 nM, (f) dan 250 nM.
3) Uji sitotoksik kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada sel T47D
Uji sitotoksik kombinasi Doksorubisin dan senyawa 1(4’bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap sel T47D pada konsentrasi (1/16; 1/8; 1/4; dan 1/2 ) dari nilai IC50. Senyawa 1-(4’-bromofenil)
-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on yang digunakan sebesar 2,8125; 5,625; 11,25; dan 22,5 M, sedangkan konsentrasi Doksorubisin sebesar 11,5625; 23,125; 46,25; dan 92,65 nM. Kombinasi kedua senyawa ini mampu menurunkan viabilitas sel lebih rendah daripada penggunaan masing-masing senyawa secara tunggal sebagaimana ditunjukkan pada Tabel 5 .
Tabel 5. Persen viabilitas sel T47D perlakuan kombinasi senyawa 1-(4’-bromo-fenil) -3-(4-hidroksi-3-metoksi1-(4’-bromo-fenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi.
Viabilitas sel (%) Doksorubisin (nM) 1(4’bromofenil) - 3-(4-hidroksi- 3-metoksi- fenil)-2-propen-1-on (M) 0 11,5625 23,125 46,25 92,65 0 100 99,34 96,01 70,67 49,12 2,8125 96,6 98,38 87,18 67,95 33,87 5,625 93,3 84,25 85,31 63,15 28,37 11,25 81,1 71,33 61,33 36,65 5,50 22,5 49,7 46,74 26,35 9,39 5,15 a b c f e d
39
Penurunan viabilitas sel pada perlakuan kombinasi juga nampak pada Gambar 16. Pada penelitian ini viabilitas sel terendah diperoleh pada kombinasi konsentrasi Doksorubisin sebesar 93 nM dan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on sebesar 23 M.
Gambar 16. Profil viabilitas sel T47D perlakuan kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsen-trasi 2,8125; 5,625; 11,25; dan 22,5 M) dan Doksorubisin (konsentrasi 11,5625; 23,125; 46,25; dan 92,65 nM).
Morfologi sel karena pengaruh perlakuan 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on tunggal, Doksorubisin tunggal dan kombinasinya terhadap sel T47D disajikan pada Gambar 17. Hasil pengamatan morfologi menunjukkan bahwa perlakuan kombinasi 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on tunggal dan Doksorubisin meningkatkan kematian sel T47D dibandingkan dengan perlakuan tunggalnya.
Berdasarkan perhitungan nilai CI (Tabel 6 dan Gambar 18), menunjukkan bahwa pada kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin, memberikan interprestasi mendekati aditif ( nilai CI antara 0,9-1,1 ) pada konsentrasi kombinasi rendah dan sinergi (( nilai CI antara 0,3-0,7 pada konsentrasi kombinasi tinggi. Dari hasil ini membuktikan bahwa senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on juga berpotensi untuk digunakan sebagai agen ko-kemoterapi Doksorubisin pada sel T47D.
40
Gambar 17. Morfologi sel T47D: (a) tanpa perlakuan (kontrol sel); (b) perlakuan senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on k-3-(4-hidroksi-3-metoksifenil)-2-propen-1-onsentrasi 22,5 M, (c) perlakuan Doksorubisin 92,5 nM, (d) perlakuan kombinasi senyawa1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 22,5 M dan Doksorubisin 92,5 M.
Tabel 6. Hasil perhitungan nilai CI pada perlakuan kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan Doksorubisin pada berbagai variasi konsentrasi.
Nilai CI Doksorubisin (nM) 1(4’bromofenil) - 3-(4-hidroksi-3- metoksi-fenil)-2-propen-1-on (M) 11,5625 23,125 46,25 92,65 2,8125 1,043 0,997 0,517 0,416 5,625 0,668 1,028 0,526 0,426 11,25 0,559 0,494 0,392 0,385 22,5 0,533 0,425 0,410 0,517
2. Uji Pengamatan Apoptosis dengan Flowcytometer a. Uji apoptosis pada sel HeLa
Pengamatan apoptosis dilakukan pada sel HeLa tanpa perlakukan, dengan perlakukan 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on, dengan perlakuan Doksorubisin, dan kombinasi keduanya pada inkubasi 24
a
d b
41
jam. Hasil pengamatan apoptosis dengan perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on selama inkubasi 24 jam pada sel HeLa disajikan pada Tabel 7 dan Gambar 19. Hasil tersebut menunjukkan bahwa semakin tinggi konsentrasi 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on semakin banyak sel HeLa yang mengalami apoptosis.
Gambar 18. Nilai CI perlakuan kombinasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on (konsen-trasi 2,8125; 5,625; 11,25; dan 22,5 M) dan Doksorubisin (konsentrasi 11,5625; 23,125; 46,25; dan 92,65 nM) pada Sel T47D.
Pada perlakuan kombinasi, konsentrasi senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on digunakan sebesar 12,5 M (¼ IC50) dan
Doksorubisin sebesar 1,5 M (¼ IC50). Hasil pengamatan apoptosis dengan
flowcytometer pada sel HeLa disajikan pada Tabel 8.
Tabel 7. Pengaruh perlakuan senyawa 1-(4’-bromofenil) -3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap kematian sel HeLa menggunakan Annexin dengan pembacaan Flowcytometer.
Perlakuan
senyawa 1-(4’-bromofenil) -3-
(4-hidroksi-3-metoksifenil)-2-propen-1-on (M)
Prosentase (%) Sel HeLa Sel Hidup Early Apoptosis Late Apoptosis Nekrosis 0 94,64 1,32 2,08 2,01 12,5 85,06 8,34 2,73 3,95 25 54,01 27,47 12,34 6,35 50 14,49 25,25 47,17 13,48