1
Mesin Imunologi Pada Kanker
A. Pendahuluan
Respon imun humoral maupun respon imun seluler terhadap antigen tumor dapat dibangkitkan dan berbagai mekanisme. Rekayasa pada imunologi berhubungan erat dengan keperluan terapi. Sistem imunologi dapat digunakan sebagai pilihan terapi kanker. Rekayasa yang berhubungan dengan sistim imunologi yang berguna untuk menghadapi sel kanker antara lain antibodi monoklonal, sitokin termasuk Lymphokine Activated Killer (LAK) dan
Tumor Infiltrating Limphocytes (TILs).
Pada penelitian terbukti bahwa sebagian besar sel efektor yang berperan dalam mekanisme anti tumor adalah sel T CD8+, yang secara fungsional berhubungan dengan CTL (Cytotoxic T Lymphocyte) yang berperan pada destruksi sel yang terinfeksi virus atau sel tumor. CTL dapat melakukan fungsi surveillance dengan mengenal dan membunuh sel yang berpotensial ganas yang mengekspresikan peptida yang berasal dari protein seluler mutan atau protein virus onkogenik yang dipresentasikan oleh molekul MHC kelas I.
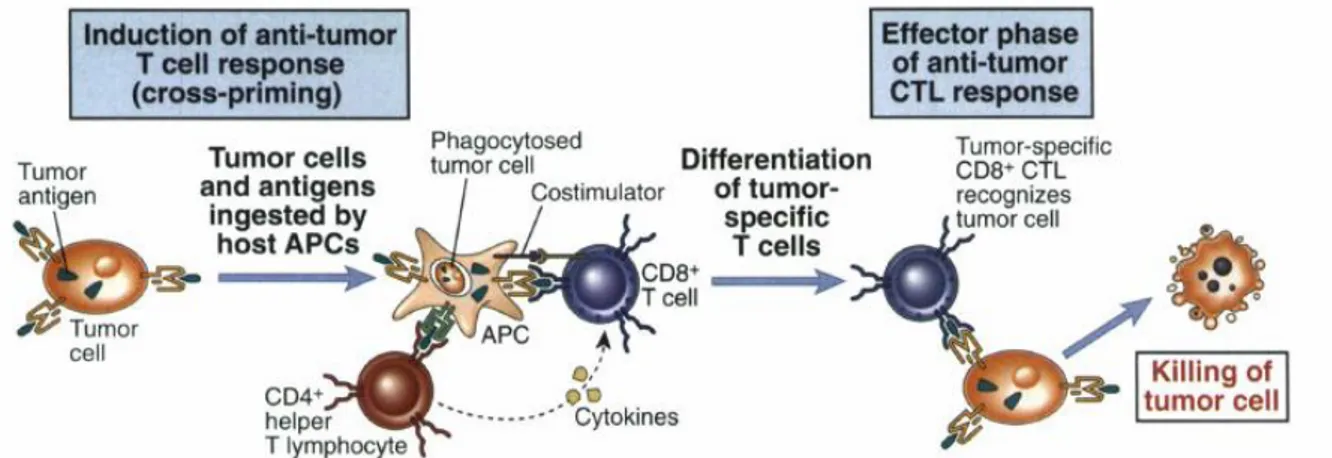
Gambar 1. Respon imun terhadap sel tumor
Antigen Presenting Cell (APC) memberikan kostimulator yang menghasilkan sinyal untuk CD8+ sel T sitotoksik untuk mendestruksi sel tumor. APCs juga mengekspresikan MHC klas II yang mengaktivasi CD4+ sel T helper T (Gambar 1). Setelah sel T sitotoksik dapat mengenali sel tumor, maka sel T akan mendestruksi sel tumor. Sistem imun seluler dapat menghancurkan sel tumor secara in vitro. Pada umumnya destruksi sel tumor melalui
2 mekanisme seluler. Mekanisme seluler pada destruksi tumor adalah melalui destruksi oleh sel T sitotoksik, dan destruksi oleh sel NK.
Limfosit yang menginfiltrasi jaringan tumor (Tumor infiltrating lymphocytes ) juga mengandung sel CTL yang memiliki kemampuan melisiskan sel tumor. Walaupun respon CTL mungkin tidak efektif untuk menghancurkan tumor, namun peningkatan respon CTL merupakan cara pendekatan terapi antitumor yang menjanjikan di masa mendatang.
Percobaan juga dilakukan dengan berbagai limfokin seperti interferon, IL-2 dan TNF yang ditujukan terhadap regresi tumor. Akhir-akhir ini telah digunakan lymphokine activated killer cells (LAK). Sel tersebut diproduksi in vitro dengan jalan membiakkan sel limfosit dari penderita (atau yang diperoleh dari tumor) dengan IL-2. Selanjutnya limfosit tersebut diinfuskan kembali kepada penderita.
Sel T CD4 atau sel T helper berperan dalam respon anti tumor dengan memproduksi berbagai sitokin yang diperlukan untuk perkembangan sel-sel CTL menjadi sel efektor. Di samping itu sel T CD4+ yang diaktivasi oleh antigen tumor dapat mensekresi TNF dan interferon γ yang mampu meningkatkan ekspresi molekul MHC kelas I dan sensitivitas tumor terhadap lisis CTL. Tumor yang mengekspresikan MHC kelas II dapat mengaktivasi sel T CD4+ spesifik tumor secara langsung. Yang lebih sering terjadi adalah bahwa APC (Antigen Presenting Cell) yang mengekspresikan molekul MHC kelas II memfagositosis, memproses dan menampilkan protein yang berasal dari sel tumor yang mati kepada sel T CD4+, sehingga terjadi aktivasi sel-sel tersebut. Limfosit T dapat mengenali beberapa antigen tumor baik yang berupa : protein yang mutan, protein ”self” yang ekspresinya berlebihan, maupun virus onkogenik.
3 Gambar 2. Tipe tumor antigen dan respon sel T
Sel NK adalah sel efektor dengan sitotoksisitas spontan terhadap berbagai jenis sel sasaran; sel-sel efektor ini tidak memiliki sifat-sifat klasik makrofag, granulosit maupun CTL, dan sitotoksisitasnya tidak bergantung pada MHC. Mekanisme lisis yang digunakan sama dengan mekanisme yang digunakan oleh sel T CD8+ untuk membunuh sel, tetapi sel NK tidak mengekspresikan T cell receptor (TCR). Sel NK dapat membunuh sel yang terinfeksi oleh virus dan sel tumor. Sel NK tidak dapat melisis sel yang mengekspresikan MHC, tetapi sebaliknya sel tumor yang tidak mengekspresikan MHC, yang misalnya terhindar dari lisis oleh CTL, justru merupakan sasaran yang baik untuk dilisis oleh sel NK. Sel NK dapat diarahkan untuk melisis sel yang dilapisi oleh imunoglobulin karena ia mempunyai reseptor Fc. Sel NK mungkin berperan dalam immune surveillance terhadap tumor yang mengekspresikan antigen virus.
Rekayasa immunologi pada kanker terbagi dua yaitu aktif dan pasif imunoterapi. Yang termasuk pasif imunoterapi pemakaian reagen anti tumor yang dibiakkan secara in vitro seperti antibodi monoklonal atau sitokin. Ada lagi yang disebut dengan adoptive selular
4 terapi yaitu pemakaian efektor seperti lymphokine activated effector cell ataupun tumor infiltrating lymphocyte.
Alasan utama pendekatan imunologi pada terapi kanker adalah bahwa terapi kanker yang saat ini digunakan memakai obat-obatan yang membunuh atau menghambat pembelahan sel, mempunyai efek yang berat pada sel normal. Sehingga terapi kanker menyebabkan morbiditas yang tinggi. Sebaliknya respon imun terhadap tumor bersifat spesifik pada antigen tumor sehingga tidak menyebabkan jejas pada sebagian besar sel normal. Oleh karenanya imunoterapi merupakan terapi tumor yang spesifik. Imunoterapi tumor bekerja dengan cara mengaktifkan respon imun host terhadap tumor (imunitas aktif) atau pemberian antibodi spesifik terhadap tumor atau sel T (imunitas pasif).
Imunoterapi pasif yaitu transfer efektor imun, termasuk tumor-specific sel T dan antibodi kepada pasien. Imunisasi pasif pada tumor cepat timbul tetapi efek imunitas yang ditimbulkannya tidak lama.
B. Terapi seluler adoptif
1. Liomfokine Acticated Killer (LAK)
Imunoterapi seluler adoptif adalah transfer sel imun yang telah dikultur yang mempunyai reaktifitas antitumor, kepada host yang mengandung tumor. Sel yang ditransfer berasal dari limfosit pasien tumor. Salah satu protokol imunoterapi seluler adoptif adalah pembuatan sel limfokine activated killer (LAK) dengan cara mengeluarkan darah perifer dari tumor pasien, kemudian mengkultur sel-sel tersebut dengan konsentrasi IL-2 yang tinggi, dan menginjeksi sel LAK kembali ke pasien.
Lymphokine activated killer cells (LAK) diproduksi in vitro dengan jalan membiakkan sel limfosit dari penderita (atau yang diperoleh dari tumor) dengan IL-2. Selanjutnya limfosit tersebut diinfuskan kembali kepada penderita.
Mesin elektroforesis digunakan untuk mengeluarkan limfosit dari penderita. Limfosit ini kemudian dirangsang dengan IL-2, dan ini akan mengubah limfosit menjadi sel LAK, yang mampu menghancurkan sel kanker tetapi tidak sel normal. Sel LAK ini bersama IL-2 diinfuskan kembali ke badan pasien sehingga akan merangsang sel LAK dalam waktu singkat. Pengembangan rekayasa genetik IL-2 rekombinan ini memungkinkan penggunaan secara klinis. Terbukti bahwa pemberian sel LAK bersamaan IL-2 dapat menyebabkan regresi massa metastase berbagai neoplasma manusia.
5
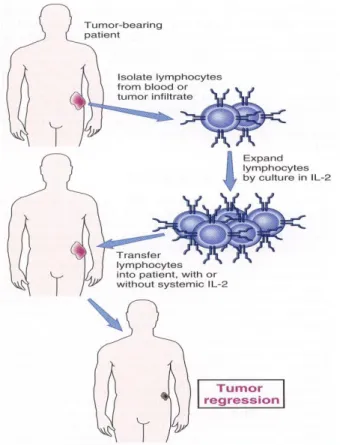
Gambar 3. Terapi seluler adoptif. Pada terapi ini, limfosit diisolasi dari darah tumor pasien, yang kemudian dikultur dengan IL-2. Hasil kultur ini kemudian diinfus kembali ke pasien.
Yang menarik adalah peran sel NK yang diaktifkan dengan stimulasi IL-2 dalam membunuh sel tumor. Sel itu disebut dengan lymphokine activated killer cells (LAK cells) dapat diperoleh secara in vitro dengan memberikan IL-2 dosis tinggi pada biakan sel limfosit darah perifer atau sel tumor infiltrating lymphocytes (TIL) yang berasal dari penderita kanker. Sel-sel yang diaktifkan oleh limfokin ini (LAK cells) menunjukkan peningkatan aktivitas sitotoksis yang sangat jelas. Besar kemungkinan bahwa sel LAK dapat digunakan dalam imunoterapi
Seperti yang telah diketahui, sel LAK berasal dari sel NK. Terapi adoptif dengan sel LAK autolog dengan kombinasi pemberian obat IL-2, meningkatkan regresi tumor pada hewan coba. Namun, percobaan terapi sel LAK belum dapat dilakukan pada kasus tumor yang metastasis, dan efikasi terapi ini sangat bervariasi pada tiap pasien. Variasi ini adalah dalam hal isolasi tumor-infiltrating lymphocytes (TILs) dari infiltrat sel radang yang terdapat di dalam dan sekeliling tumor yang diambil dari spesimen hasil reseksi operasi, dan banyaknya TILs yang tumbuh pada kultur IL-2. Pendekatan ini dilakukan karena TILs dapat meningkatkan CTLs yang spesifik terhadap tumor dan untuk aktifasi sel NK. Penelitian terapi
6 dengan memakai TILs pada manusia masih sedang berlangsung. Sebagai alternatif, telah dipertimbangkan penggunaan antigen spesifik autologus limfosit T untuk menunjukkan target tumor dan menekan toksisitas hospes.
2. Tumor Infiltration Lymphocytes
Tumor infiltrating lymphocyte (TIL) secara langsung melawan melanoma telah dipelajari dalam suatu uji klinik dan menunjukkan kemampuan menentukan lokasi tumor, dan mengkonfirmasi antigen spesifik TIL dibandingkan dengan LAK.
Beberapa sitokin memiliki aktivitas anti tumor pada tumor tertentu. Interferon (IFN) telah diteliti dapat menghambat proliferasi sel, meningkatkan ekspresi gen dan merangsang proliferasi dan sitotoksitas dari sel T sitotoksik dan sel NK. Interleukin 2 (IL-2) merangsang proliferasi dari limfosit T, sel NK, sel limphokine-activated killer" (LAK) dan tumor infiltrating lymphocytes (TILs). IL-2 digunakan dengan LAK atau dengan TILs. Adapun efek samping utama penggunaan IL-2 adalah ”capillary-leak syndrome" hasil dari hipotensi, kehilangan berat badan, edema pulmonum dan edema perifer. Interleukin 4 (IL- 4) dapat meningkatkan proliferasi limfosit T dan B. Interleukin 12 (IL-12) menunjukkan aktifitas anti tumor dengan menyebabkan proliferasi limfosit T dan sel NK.
Penelitian klinik yang sudah dilakukan adalah pemberian IL-2 dosis tinggi atau dengan kombinasi imunoterapi adoptif seluler. Setelah pemberian IL-2 jumlah limfosit T dan B dan sel NK darah meningkat. Diduga IL-2 bekerja dengan cara menstimulasi proliferasi dan aktivitas sel NK dan CTLs.
C. Antibodi monoklonal
Antibodi monoklonal yang spesifik terhadap tumor berguna dalam imunoterapi spesifik. Kemampuan antibodi sebagai ”peluru magic” menarik minat peneliti sejak lama dan masih merupakan bidang penelitian yang aktif. Antitumor antibodi menghancurkan tumor melalui mekanisme efektor yang sama dengan yang dipakai untuk menghancurkan mikroba, termasuk proses opsonisasi, fagositosis dan aktifasi sistem komplemen. Antibodi monoklonal spesifik untuk produk onkogen Her-2/Neu, yang terekspresi dalam kadar tinggi pada beberapa tumor, terbukti berhasil dalam terapi pasien kanker payudara dan sekarang telah disahkan dalam pemakaian klinik. Anti-Her-2/Neu antibodi berhubungan dengan fungsi sinyalisasi pertumbuhan pada molekul Her-2/Neu. Salah satu masalah dalam pemakaian antitumor antibodi adalah hilangnya varian antigen dari sel tumor, dimana sel tumor tidak lagi mengekspresikan antigen yang dikenali oleh antibodi. Untuk menghindari hal ini, dapat
7 dipakai campuran dari beberapa antibodi spesifik untuk bermacam-macam antigen yang diekspresikan oleh tumor yang sama.
Kohler dkk (1977), memperlihatkan kemungkinan dapat dilakukan stimulasi hibridisasi antara sel ganas plasma yang dapat hidup di dalam kultur kontinyu dan sel limfoid. Sel hibrid tersebut dapat tumbuh pada kultur dan menghasilkan antibodi dengan spesifisitas tertentu yang dapat diseleksi melalui kloning. Tehnik dasar untuk menghasilkan antibodi monoklonal diperlihatkan pada gambar dibawah.
Sel-sel dari limpa tikus yang telah diimunisasi oleh antigen asing ditempatkan pada kultur berisi sel mieloma yang tumbuh kontinyu dengan adanya glikol polietilen yang merangsang sel bergabung/fusi. Sel mieloma yang digunakan pada eksperimen ini adalah mutan yang tidak dapat mensekresi imunoglobin dan setelah diseleksi di dalam medium yang berisi Hiposantin, Aminopterin, dan Timidin (medium HAT). Sel-sel limpa normal tidak dapat tumbuh pada kultur, hanya sel-sel hibrid, hasil dari fusi yang dapat tumbuh pada media HAT. Setelah seleksi pada media HAT, sel hibrid adalah klon melalui penempatan sel individu ke dalam kultur jaringan. Antibodi disekresi oleh masing-masing klon (dikenal sebagai "hybridoma”) yang mempunyai produk spesifik.
Beberapa antibodi dapat dibuat dari sel Rodent merupakan suatu masalah jika mereka digunakan untuk pengobatan kanker pada manusia, karena mereka dapat dikenal sebagai protein asing dan akan meningkatkan respon imun yang dapat menghilangkan aktivitasnya. dengan cepat dinetralisir atau menyebabkan reaksi anafilaksis. Respon ini disebabkan oleh "Human Antimouse Antibodi" (HAMA). Kekuatan dari reaksi ini dapat diturunkan atau dieliminasi dengan menggunakan antibodi monoklonal manusia dan jika penderita yang mempunyai sel-sel limfoid digunakan sebagai pasangan fusi, monoklonal kultur "hibrydoma” yang stabil melalui fusi dari limfoid manusia dan sel mieloma tikus telah melalui kehilangan kromosom manusia yang efektif dari sel hibrid, konsekuensinya kegagalan dalam mensekresi antibodi. Masalah ini juga didapatkan dengan upaya melakukan fusi sel limfoid manusia dengan sel myeloma manusia.
8 Gambar 4. Produksi Monoklonal Antibodi
Antibodi monoklonal juga dapat meningkatkan aktivitas antitumor melalui "blocking" pada reseptor yang menginduksi proliferasi. Antibodi monoklonal mengenal permukaan determinan sel kanker manusia yang terekspresi. Namun demikian terdapat sejumlah faktor yang membatasi efektifitas terapi antibodi monoklonal.
Faktor yang mempengaruhi efektifitas antibodi monoklonal a. Antigenic Cross-Reactivity
Oleh karena banyak antigen tumor tidak bersifat “tumor-specific", antibodi monoklonal mungkin bereaksi dengan beberapa jaringan normal. Hal penting ialah toksisitas muncul
9 karena reaktivasi silang, sebagai contoh walaupun antigen diekspresikan hanya pada limfosit B atau T. Konsekuensi pengobatan limfoma dengan menggunakan antibodi monoklonal adalah limfopenia dengan imunosupresi.
b. Penetrasi tumor
Efektifitas imunoterapi dengan antibodi monoklonal tergantung dari kemampuan antibodi monoklonal untuk mencapai sel tumor. Suntikan antibodi anti tumor, dapat menyebabkan ikatan antibodi sel tumor. Hal ini berhubungan dengan ekspresi dari target antibodi dan juga faktor fisik seperti aliran darah yang ireguler dan penetrasi yang lambat dari antibodi yang besar serta pembuluh darah tumor, sering dikacaukan oleh peningkatan tekanan intersisial tumor.
c. Respon imun dari antibodi tikus
Penyebabnya adalah antibodi monoklonal dari murin atau rat sistem imun manusia dapat mengenal mereka sebagai protein asing. Pengobatannya adalah membuat "Human Antimouse Antibodies” (HAMA). Respon imun dapat langsung pada regio konstan atau variabel dari
antibodi, terdapat efek netralisasi. d. Defek dari sistem imun host
Aktifitas terapi dari antibodi monoklonal tergantung dari aktivitas sistim imun host, baik komplemen atau reseptor Fc menghasilkan sel efektor yang berfungsi dalam melisiskan sel tumor, sistem imun pada pasien dengan kanker mungkin tidak sempuma, kanker menghasilkan imunosupresi melalui berbagai mekanisme, tambahan beberapa terapi kanker seperti kombinasi kemoterapi dan radiasi. Terapi ini juga bersifat imunosupresif dan mengurangi efektifitas antibodi monoclonal.
Peningkatkan efektifitas antibodi monoklonal
1. Chimeric atau antibodi monoklonal manusia, antibodi monoklonal tikus kurang efektif jika dibandingkan dari antibodi monoklonal manusia dalam berinteraksi dengan sel efektor manusia dan komplemen manusia, selain itu antibodi monoklonal tikus dapat merangsang respon HAMA. Berdasarkan hal ini antibodi monoklonal direkayasa genetik sehingga antibodi "chimeric" atau menjadi mirip dengan manusia, berisi hanya regio variabel murin yang dikenal antigen tumor.
2. Radiolabeled antibodi monoklonal: Radoisotop yang ditempelkan pada antibodi monoklonal dibuat menjadi target radiasi sel kanker. Pasangan antibodi yang dipakai umumnya menggunakan "radioisotop long range H emitting” seperti B yodium 131 (131J), dan remium 186 (186 Re) dengan pendekatan ini masalah penetrasi tumor dapat
10 digunakan ikatan sel tumor dapat di atasi. Studi pada hewan memperlihatkan dosis radiasi dengan menggunakan "radiolabeled" spesifik lebih efektif dibanding dengan antibodi monoklonal nonspesifik. Antibodi monoklonal “radiolabeled" dapat menginduksi regresi dari beberapa keganasan hematologik.
3. Imunotoksin. Konjugasi suatu toksin pada antibodi monoclonal dapat untuk mempersiapkan sistim imun berfungsi untuk mematikan sel, tetapi masalah target pada masing-masing dan setiap sel tumor masih ada. Walaupun beberapa molekul toksin dibutuhkan dalam mematikan sel, tidak adanya ekspresi pada sel kanker dapat tercegahnya proses ini. Terdapat tiga molekul toksin yang sedang diteliti yaitu ricin, eksotoksin pseudomonas dan toksin diphtheria. Eksotoksin pseudomonas adalah protein rantai tunggal yang menghambat sintesis protein irreversibel, berikatan dengan glikoprotein permukaan sel dengan berat molekul tinggi. Saat ini toksin dimodifikasi melalui rekayasa yang menghilangkan regio molekul yang berikatan dengan jaringan hati dan berikatan dengan antibodi monoklonal lain. Toksin juga dapat berikatan dengan reseptor growth factor melalui rekayasa genetik rekombinan. Ricin adalah glikoprotein 65kDa yang berisi sub unit A dan B. Sub unit A membunuh sel melalui inaktivasi ribosom, jika subunit B bertanggungjawab tehadap ikatan sel nonspesifik. . Toksin diphtheri adalah polipeptida rantai tunggal yarg menghambat sintesis protein selular. toksin diphtheri dengan ikatan sel ditempatkan IL-2 yang telah diuji pada penderita keganasan sel T refrakter yang terekspresi pada reseptor IL-2, toksisitas termasuk domain dan peningkatan transmin hepar tetapi respon pengobatan dapat dilihat. Strategi untuk menghindari toksisitas dan imunotoksin yaitu melalui pembelahan sel kanker dari sumsum tulang untuk transplantasi autologus
4. Peningkatan fungsi efektor sitokin. Studi hewan memperlihatkan pemberian sitokin seperti, IL-2 atau GM-CSF dapat meningkatkan efektifitas terapi antibodi monoklonal. Peningkatan jumlah dan aktivitas sitokin ini tergantung dari reseptor Fc sel efektor dan peningkatan kemampuan antibodi sitotoksin seluler dependen. Sebagai contoh terapi anti idiotipe monoklonal meningkat pada penderita limfoma folikular melalui terapi konkomitan dengan interferon.
D. Vaksinasi memakai sel tumor dan antigen tumor
Imunisasi penderita tumor dengan sel tumor yang mati atau antigen tumor dapat menyebabkan peningkatan respon imun terhadap tumor. Identifikasi peptida yang dikenali oleh tumor-spesifik CTLs dan kloning gen yang mengkode tumor-spesifik antigen yang
11 dikenali oleh CTLs menghasilkan banyak kandidat untuk pembuatan vaksin tumor. Pendekatan vaksin yang mula-mula dilakukan yang sampai saat ini masih dicoba adalah imunisasi dengan memakai antigen tumor yang telah dimurnikan ditambah ajuvan. Kemudian dilakukan imunisasi dengan memakai profesional APCs seperti sel dendritik yang dimurnikan dari pasien dan diinkubasi dengan antigen tumor atau ditransfeksi dengan gen yang mengkode antigen ini, dan dengan injeksi plasmid yang mengandung cDNA yang mengkode antigen tumor (vaksin DNA).
Vaksin yang berbasis sel dan DNA adalah cara yang terbaik untuk menginduksi respon CTL karena antigen yang dikode disintesis dalam sitoplasma dan memasuki jalur MHC klas I pada antigen presentasi. Keterbatasan terapi tumor dengan vaksin adalah bahwa vaksin ini harus dapat bersifat terapeutik dan bukan hanya preventif, dan sering sulit untuk menginduksi respon imun yang kuat untuk mengeradikasi semua sel pada tumor.
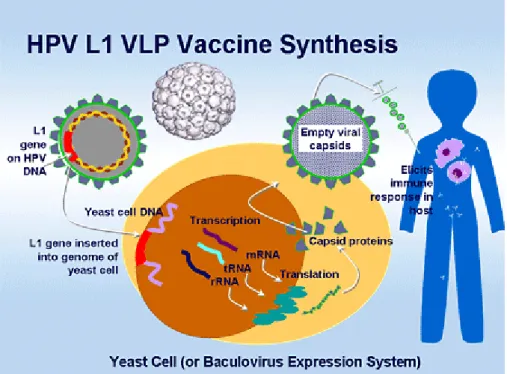
Perkembangan tumor yang diinduksi oleh virus dapat dihambat dengan vaksinasi preventif yang memakai antigen virus atau virus hidup yang dilemahkan. Pada manusia program vaksinasi terhadap virus hepatitis B (HBV) dapat menurunkan insidens karsinoma hepatoseluler yaitu kanker hepar. Kanker serviks merupakan kanker yang penting untuk pengembangan vaksin karena ekspresi antigen yang khas dari etiologi primernya yaitu human papiloma virus (HPV). Vaksinasi HPV untuk mencegah karsinoma serviks merupakan jenis rekombinan vaksin, artinya menggunakan partikel virus yaitu gen virus HPV yang digabungkan dengan gen yeast.
12 Vaksin Kanker
Telah diketahui bahwa sistem imun vertebrata dapat membedakan dirinya dan benda asing, dimana sistem imun dapat mengenali tumor sebagai benda asing. Penelitian imunologi tumor memerlukan model hewan yang mungkin saja tidak relevan dengan kanker pada manusia. Saat ini kita telah mengetahui bahwa antigen yang berhubungan dengan tumor (tumor associated antigen) memang ada dan kita dapat mengembangkan vaksin kanker melalui pengenalan terhadap protein ini pada sistem imun.
Dalam beberapa tahun terakhir banyak perusahaan biotek mengembangkan strategi pembuatan vaksin untuk melawan melanoma dan berbagai kanker lainnya. Strategi ini mempunyai 1 kesamaan yaitu menginduksi cell-mediated response terhadap tumor associated antigen. Antigen yang dipakai untuk membuat vaksin berasal dari tumor pasien atau tumor cell-lines. Caranya adalah tumor dibiopsi atau dioperasi, dikultur dan dipakai sebagai imunogen.
Pemakaian tumor yang telah diketahui sebagai sumber imunogen lebih praktis dan relatif murah. Sampel dari berbagai tumor ditumbuhkan dalam media kultur kemudian proteinnya diekstraksi sebagai sumber imunogen bagi banyak pasien. Selain lebih murah, strategi ini juga dapat menentukan imunogenisitas antigen tumor yang tumbuh pada sel kultur. Beberapa tumor dapat mengekspresikan kadar tumor-associated antigen yang tinggi dan lebih bersifat imunogenik dari lainnya. Selain itu, sel tumor ini mengekspreikan MHC klas I yang dipresentasikan oleh sebagian besar populasi sel tumor, yang berarti antigen intrasel akan dipresentasikan dengan baik. Sel kemudian diradiasi sehingga sel tersebut tidak membelah dan dipakai untuk imunisasi. Pendekatan cara ini sekarang dipakai sebagai standar pembuatan imunogen karena juga biayanya lebih murah.
Presentasi antigen merupakan hal yang sangat penting dalam strategi imunisasi dan salah satu cara meningkatkan imunisasi melawan antigen tumor adalah memanipulasi presentasi antigen. Antigen-presenting cell seperti sel dendritik merupakan kandidat yang sangat bagus dipakai dalam protokol vaksinasi. Dendreon adalah perusahaan yang pertama kali mengisolasi prekursor sel dendritik dari darah pasien, lalu memasukkan imunogen ke dalam sel dendritik dan memasukkan kembali sel dendritik yang mengandung antigen ke aliran darah pasien kanker. Perusahaan ini juga mengidentifikasi tumor-associated antigen
yang mencegah berbagai kanker. Jadi, terapi dengan sel dendritik dapat dipakai untuk berbagai jenis tumor.
13 Gambar 6. Vaksin Kanker
Variasi cara vaksinasi juga dilakukan oleh Genzyme Molecular Oncology. Pendekatannya juga memakai sel dendritik, namun tidak memakai antigen yang telah diketahui. Mereka membuat fusi sel dendritik pasien memakai polietilen glikol, dengan sel tumor yang telah diinaktifasi yang diambil dari pasien yang sama. Keuntungan dari cara ini adalah bahwa sel hibrid yang dihasilkan mempunyai antigen presenting bagi sel dendritik dan juga mengandung antigen dari sel tumor pasien. Sel dendritik kemudian akan memproses antigen tumor ini dan antigen tersebut akan dipresentasikan pada sistem imun pasien.
Cara lain namun cukup menjanjikan hasilnya adalah pendekatan yang berdasarkan pemahaman yang sejak lama, yaitu sel tumor yang bersifat imunogenik. Hewan coba yang diinjeksi dengan sel tumor yang telah mati, tidak akan menderita tumor apabila dimasukkan dalam jaringan hidup. Pada saat dasar pengetahuan ini dieksplorasi, ditemukan bahwa heat-shock protein (HSPs) berperan penting dalam sistem imun. HSPs membawa peptide imunogenik, sehingga bekerja sebagai molekul chaperon. HSPs melekat pada CD91, yaitu reseptor yang terdapat pada APCs seperti sel dendritik dan makrofag. Pada skenario ini, kompleks HSP/peptida dari sel tumor melekat pada CD91 di APCs yang kemudian diinternalisasi. HSP/peptida ini dipresentasikan kembali sebagai kompleks peptide/MHC klas I pada APC, dan menyebabkan respon sel T CD8+. Hal ini cukup menarik karena antigen eksogen biasanya dipresentasikan oleh molekul MHC klas II. Namun, penelitian lain
14 menunjukkan bahwa HSPs yang diisolasi dari jaringan tumor merupakan induser yang kuat bagi tumor-specific CTLs.
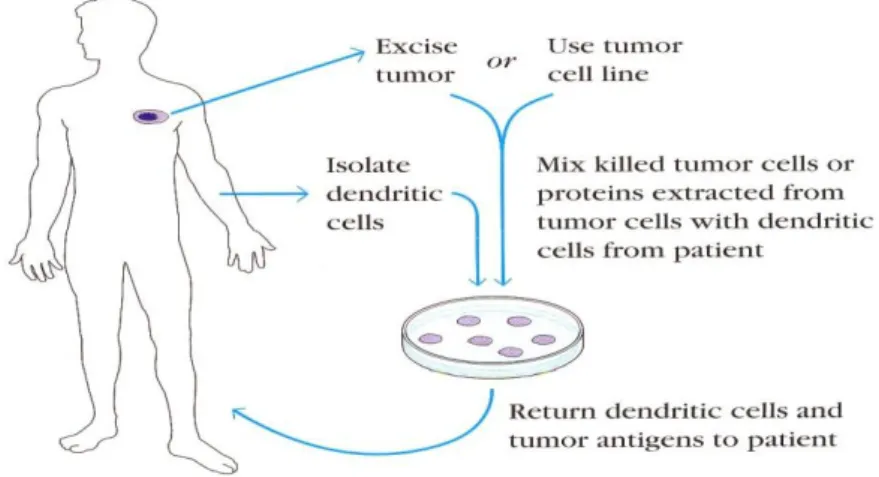
Gambar 7. Vaksin kanker. Sel tumor dikeluarkan dari pasien dan dimasukkan dalam media klutur. Alternatif lain, sel tumor yang telah diketahui (tumor cell line) pilih dan dimasukkan dalam media kultur. Sel tumor kemudian diinaktifasi dan dicampur dengan sel dendritik dari pasien dan diinjeksikan kembali ke pasien sebagai imunogen.
Mekanisme perlekatan kompleks HSP/antigen pada CD91, dan dibawa ke MHC klas I masih belum banyak diketahui. Namun telah jelas bahwa komples HSP/antigen apabila dipresentasikan pada APCs menyebabkan aktifasi sel T CD8+. Terdapat berbagai pendekatan dalam sistem imun dalam merespon antigen tumor. Dalam dekade terakhir banyak perusahaan bioteknologi yang mengembangkan vaksin kanker, dan uji klinik fase II atau fase III memberikan optimisme dalam bidang ini pada penelitian klinik.
Augmentasi imunitas host terhadap tumor dengan sitokin dan ko- stimulator
Peningkatan imunogenisitas sel tumor dengan cara transfeksi gen ko-stimulator atau gen sitokin. Sel tumor yang tidak adekuat menstimulir sel T apabila ditrasnplantasikan pada hewan coba, tidak akan ditolak dan akan bertumbuh menjadi tumor. Transfeksi sel tumor ini dengan gen yang mengkode ko-stimulator atau sitokin dapat meningkatkan imunogenisitas tumor, T-cell mediated rejection, sehingga tidak ada pertumbuhan tumor. Pada beberapa penelitian, paparan sel tumor yang sudah dimodifikasi ini menginduksi imunitas dari sel tumor yang tidak ditransfeksi.
15 Gambar 7. Peningkatan imunogenisitas sel tumor dengan transfeksi costimulator dan sitokin. (granulocyte-macrophage colony stimulating factor (GM-CSF) genes)
Imunitas seluler terhadap tumor dapat ditingkatkan dengan mengekspresikan ko stimulator dan sitokin pada sel tumor yang akan menstimulasi proliferasi dan diferensiasi limfosit T dan sel NK. Sel tumor dapat menginduksi respon imun yang lemah karena sel tumor tersebut tidak mempunyai ko-stimulator dan biasanya tidak mengekspresikan molekul MHC klas II sehingga tidak terjadi aktivasi sel T helper.
Terdapat 2 pendekatan untuk membangkitkan respon imun host terhadap tumor yaitu memberikan ko stimulasi secara artifisial pada tumor-spesifik sel T, dan pemberian sitokin eksogen yang dapat meningkatkan pertumbuhan dan aktivasi sel T, sehingga menggantikan fungsi sel T helper. Efikasi dalam meningkatkan ko stimulasi sel T dalam imunoterapi anti tumor diperlihatkan pada percobaan hewan dimana sel tumor ditransfeksi dengan gen yang mengkode molekul B7 ko stimulator. Sel tumor yang mengekspresikan B7 ini kemudian menginduksi imunitas yang melawan sel tumor.
Keberhasilan model tumor eksprimental ini menyebabkan percobaan terapi dengan memakai sampel tumor pasien in vitro, dimana sel tumor ini ditransfeksi dengan gen ko
16 stimulator, diradiasi, dan dimasukkan kembali ke pasien. Pendekatan ini berhasil meskipun jika antigen imunogenik yang terekspresi pada tumor tidak diketahui.
Sitokin dapat dipakai untuk meningkatkan respon imun adaptif dan innate terhadap tumor. Caranya adalah sel tumor ditransfeksi dengan gen sitokin untuk melokalisir efek sitokin di tempat yang diperlukan. Contohnya apabila tumor ditransfeksi dengan gen IL-2, IL-4, atau GM-CSF (Granulocyte-Macrophage-Colony Stimulating Factor), diinjeksikan pada hewan coba, maka tumor akan ditolak atau mulai berkembang dan kemudian mengecil. Pada beberapa kasus terdapat akumulasi infiltrat sel radang yang padat di sekelliling tumor yang mensekresi sitokin. Pada penelitian juga ditemukan bahwa injeksi tumor yang mensekresi sitokin menginduksi imunitas yang dimediasi oleh sel T yang kemudian melawan sel tumor. Jadi produksi lokal dari sitokin dapat meningkatkan respon sel T terhadap antigen tumor.
17 Daftar Pustaka
1. DiSaia P, Creasman WT. Tumor Imunology, Host Defense Mechanism and Biologic therapy dalam Clinical Gynecology Oncology, Mosby, Philadelphia,2007:593-607 2. Suwiyoga K. Imunologi Tumor. Dalam : Aziz MF, Andrijono, Saifuddin AB (Eds).
Buku Acuan Nasional Onkologi Ginekologi. Yayasan Bina Pustaka Sarwono Prawirohardjo. Jakarta, 2006, hal : 79-92.
3. Mader. The Lymphatic System And Body Defenses. In : Understanding Human Anatomy and Physiology. 5th Ed. McGraw-Hill. 2004. p 254-266.
4. Van de Graff. Circulatory system. In : Human Anatomy, 6th ed, The McGraw-Hill,2001, p 582-587.
5. Silbernagl S, Dispopoulos A. Immune system. In : Color atlas of physiology, 6th ed., p 94-102, Thieme. New York, 2009
6. Abbas AK, Lichtman AH, Pillai S. Immunity to tumors. In : Cellular and Molecular Immunology, 6th ed., Saunders. 2007, p 397-417.