APLIKASI BERBAGAI DOSIS BAKTERI PROTEOLITIK L1k
DALAM PAKAN UNTUK PENGENDALIAN Streptococcosis
PADA IKAN NILA Oreochromis niloticus DENGAN METODE
KOHABITASI
REZA AKBAR SANTOSO
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aplikasi Berbagai Dosis Bakteri Proteolitik L1k dalam Pakan untuk Pengendalian Streptococcosis pada Ikan Nila Oreochromis niloticus dengan Metode Kohabitasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Reza Akbar Santoso
ABSTRAK
REZA AKBAR SANTOSO. Aplikasi berbagai dosis bakteri proteolitik L1k dalam pakan untuk pengendalian Streptococcosis pada ikan nila Oreochromis niloticus dengan metode kohabitasi”. Dibimbing oleh Munti Yuhana dan Angela Mariana Lusiastuti.
Ikan nila (Oreochromis niloticus) merupakan komoditas unggulan air tawar yang banyak terserang penyakit bakterial seperti streptococcosis yang disebabkan oleh bakteri Streptococcus agalactiae. Tujuan penelitian ini adalah menguji pengaruh pemberian bakteri proteolitik L1k terhadap peningkatan respon imun ikan nila yang diinfeksi Streptococcus agalactiae N14G secara kohabitasi. Pada penelitian ini, ikan diberi pakan yang mengandung bakteri proteolitik L1k dengan beda dosis yakni 1%, 2% dan 3%. Ikan kontrol (kontrol positif dan kontrol negatif) diberikan pakan yang tidak mengandung bakteri proteolitik L1k. Setelah itu, ikan diuji tantang dengan metode kohabitasi. Perlakuan bakteri proteolitik L1k berbeda dosis 1%, 2% dan 3% dapat meningkatkan kelangsungan hidup ikan nila (berturut-turut sebesar 93.33%, 95.56%, dan 97.78%) dibanding dengan ikan kontrol positif sebesar 68.89%.
Penambahan bakteri proteolitik L1k yang berperan sebagai probiotik pada pakan ternyata dapat meningkatkan respon imun dan tingkat kelangsungan hidup ikan akibat infeksi Streptococcus agalactiae secara kohabitasi.
Kata kunci : ikan nila, bakteri proteolitik L1k, Streptococcus agalactiae N14G, kohabitasi
ABSTRACT
REZA AKBAR SANTOSO. Application several dose of proteolytic bacteria L1k in feed to controlling Streptococcosis in tilapia Oreochromis niloticus with cohabitation method. Supervised by Munti Yuhana dan Angela Mariana Lusiastuti.
Tilapia is a popular freshwater commodity were attacked bacterial disease such as streptococcosis caused by Streptococcus agalactiae. The objective of this research are to assay added treatment of bacterial proteolytic L1k toward increase immune response immune of tilapia (Oreochromis niloticus) infected by Streptococcus
agalactiae N14G with cohabitation method. In this study, fish were fed diets containing
different doses of proteolytic bacteria of L1k with the doses of 1%, 2% and 3%. Control fish (positive control and a negative control) were not given feed containing probiotic. After that, the fish tested challenged by cohabitation method. Treatment of bacteria proteolytic L1k in different doses of 1%, 2% and 3% can increase the survival rate of tilapia (respectively for 93.33%, 95.56%, and 97.78%) compared with the positive control fish by 68.89%. The addition of bacteria proteolytic L1k as probiotics to the diet may increase the immune response and survival rates of fish due to Streptococcus
agalactiae infections in cohabitation.
Keywords : tilapia, bacteria proteolytic L1k, Streptococcus agalactiae N14G, cohabitation
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perikanan
APLIKASI BERBAGAI DOSIS BAKTERI PROTEOLITIK L1k
DALAM PAKAN UNTUK PENGENDALIAN Streptococcosis
PADA IKAN NILA Oreochromis niloticus DENGAN METODE
KOHABITASI
REZA AKBAR SANTOSO
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Aplikasi Berbagai Dosis Bakteri Proteolitik L1k dalam Pakan untuk Pengendalian Streptococcosis pada Ikan Nila Oreochromis niloticus dengan Metode Kohabitasi
Nama : Reza Akbar Santoso NIM : C14090015
Disetujui oleh
Dr Munti Yuhana, SPi, MSi Pembimbing I
Dr drh Angela Mariana Lusiastuti, Msi Pembimbing II
Diketahui oleh
Dr Ir Sukenda, MSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini ialah Probiotik, dengan judul Aplikasi Berbagai Dosis Bakteri Proteolitik L1k dalam Pakan untuk Pengendalian
Streptococcosis pada Ikan Nila Oreochromis niloticus dengan metode kohabitasi.
Dalam kesempatan kali ini, penulis mengucapkan terima kasih kepada :
1. Dr Munti Yuhana, SPi, MSi dan Dr drh Angela Mariana Lusiastuti, Msi selaku dosen pembimbing yang telah banyak memberikan bimbingan selama pengerjaan penelitian ini.
2. Dosen penguji Ir. Iis Diatin, MM yang telah bersedia menguji dalam ujian skripsi.
3. Prof Dr Daniel Djokosetyanto selaku dosen pembimbing akademik yang telah banyak memberikan masukan, semangat dan motivasi.
4. Bapak Ranta, Bapak Marjanta, Mba Yuli, serta semua staf Departemen Budidaya Perairan.
5. Bapak Mikdar, bapak Edi, bapak Bambang, mas Wahyu, Ibu Hessy, serta para staf di Balai Penelitian Pengembangan Budidaya Air Tawar (BPPBAT) Sempur yang telah membantu selama penelitian berlangsung.
6. Keluarga tercinta terutama ayah Puguh Santoso, ibu Rubiyati dan adik-adikku Hafidh, Riris, Bagas tersayang serta keluarga besar yang telah banyak memberikan semangat dan motivasi kepada penulis.
7. Ulfia Rahmi Hasibuan Ami selaku partner penelitian yang telah banyak memberikan motivasi, doa dan kerja samanya dalam melakukan penelitian ini.
8. Kakak-kakak senior di LKI-BDP, Seto, Fahrul, Fierco, Devi, Wiwiek, Jubed, Wahyu, Arief, Rizky, Arest, Putri, Anindila, Anisa, Iin, Habibie, Ikhsan, Soya, Doni, Tya, Peni, Yumi, serta teman-teman BDP 46 yang telah memberikan motivasi dan pengalaman-pengalaman berkesan selama penulis menempuh pendidikan di Institut Pertanian Bogor.
Penulis berharap penelitian yang dituangkan dalam sebuah skripsi ini dapat memberikan banyak manfaat sesuai dengan yang diharapkan.
Semoga skripsi ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL ... vi DAFTAR GAMBAR ... vi DAFTAR LAMPIRAN ... vi PENDAHULUAN ... 1 Tujuan Penelitian ... 2 METODE ... 2Waktu dan Tempat ... 2
Prosedur Penelitian ... 2
Rancangan Percobaan ... 4
Prosedur Analisis Data ... 5
HASIL DAN PEMBAHASAN ... 8
Hasil ... 8
Pembahasan ... 16
KESIMPULAN DAN SARAN ... 21
Kesimpulan ... 21
Saran ... 21
DAFTAR PUSTAKA ... 22
LAMPIRAN ... 25
DAFTAR TABEL
1 Rancangan perlakuan pemberian isolat probiotik L1k dengan dosis berbeda
pada ikan nila ... 4
2 Satuan dan alat ukur kualitas air pada parameter suhu dan pH ... 6
3 Hasil pengamatan kualitas air parameter suhu dan pH ……… 16
4 Hasil BLAST bakteri proteolitik L1k ... 16
DAFTAR GAMBAR
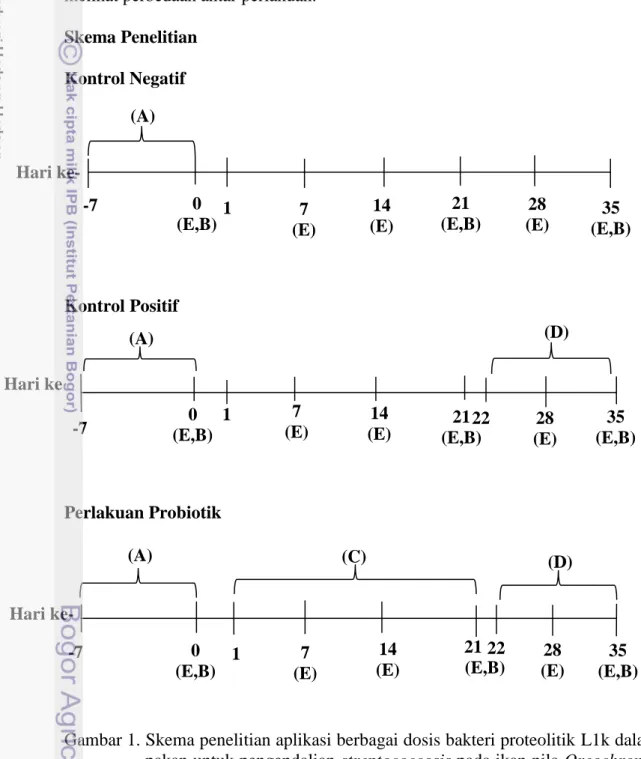
1 Skema penelitian aplikasi berbagai dosis bakteri proteolitik L1k dalam pakan untuk pengendalian streptococcosis pada ikan nila Oreochromis niloticus dengan metode kohabitasi. A = Aklimatisasi, B = Pengambilan darah, C = Pemberian pakan probiotik L1k, D = Uji tantang, E = Sampling pertumbuhan (bobot dan panjang) ... 72 Tingkat kelangsungan hidup ikan nila pada masa awal pemeliharaan sampai dengan masa akhir pemeliharaan. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 8
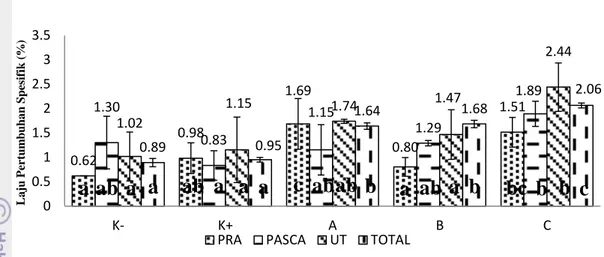
3 Laju pertumbuhan spesifik ikan nila (Pra : sebelum perlakuan bakteri proteolitik, Pasca : setelah perlakuan bakteri proteolitik, sebelum uji tantang, UT : setelah uji tantang, Total : nilai keseluruhan dari awal sampai akhir (35 hari). Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ……….. 9
4 Rasio konversi pakan ikan nila selama 35 hari pemeliharaan. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) .. 9
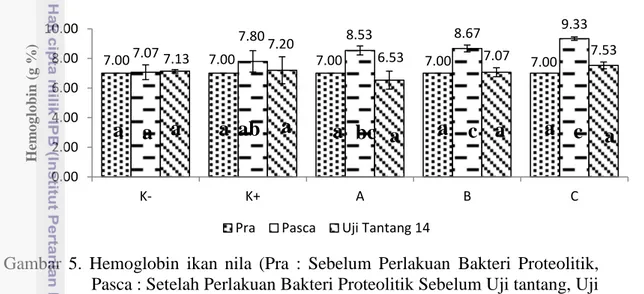
5 Hemoglobin ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 10
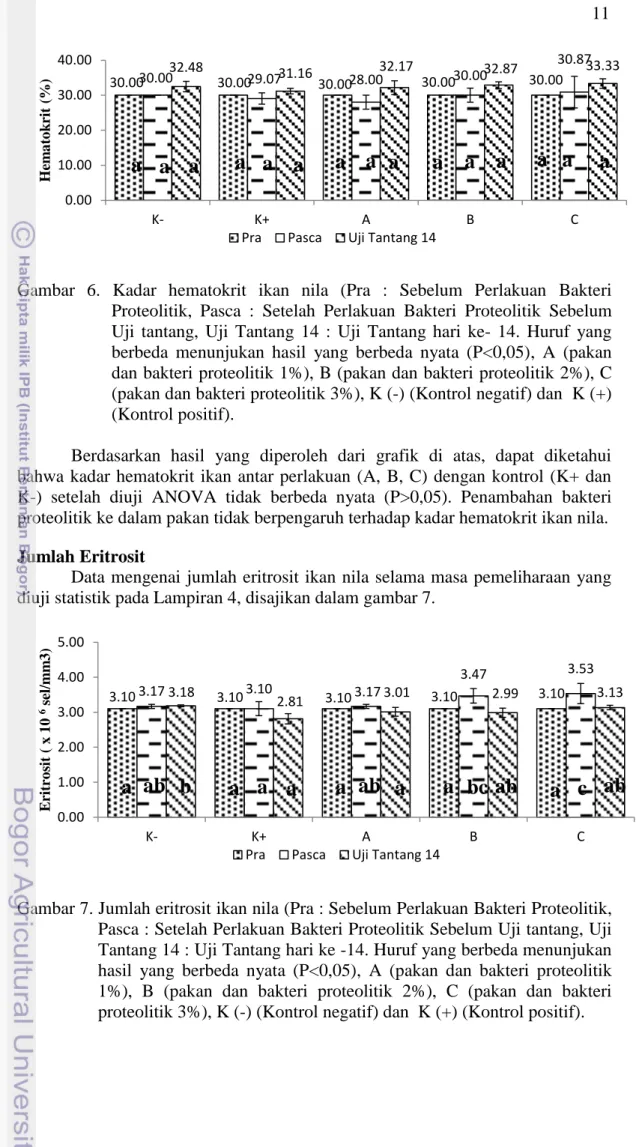
6 Kadar hematokrit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 11 7 Jumlah eritrosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik,
Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke -14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B
(pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 11 8 Jumlah leukosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik,
Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 12 9 Jumlah limfosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik,
Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 13 10 Jumlah monosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik,
Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 13 11 Jumlah neutrofil ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik,
Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke-14). Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 14 12 Indeks fagositik ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik,
Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke-14). Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif) ... 15 13 Analisa Proksimat Pakan. Kontrol 1(Pakan tanpa penambahan bakteri
proteolitik L1k difermentasi 24 jam), Pa+L1k 1 (Pakan ditambah bakteri proteolitik L1k difermentasi 24 jam), Kontrol 2 (Pakan tanpa penambahan bakteri proteolitik L1k difermentasi 48 jam), Pa+L1k 2 (Pakan ditambah bakteri proteolitik L1k difermentasi 48 jam) ... 15
DAFTAR LAMPIRAN
1 Analisis lanjut statistik terhadap tingkat kelangsungan hidup... 25 2 Analisis lanjut statistik terhadap rasio konversi pakan ... 25 3 a) Analisis lanjut statistik terhadap laju pertumbuhan spesifik sebelum
perlakuan pakan ... 26 b) Analisis lanjut statistik terhadap laju pertumbuhan spesifik setelah
c) Analisis lanjut statistik terhadap laju pertumbuhan spesifik pada akhir
perlakuan ... 26
4 a) Analisis statistik terhadap eritrosit sebelum perlakua pakan ... 27
b) Analisis lanjut statistik terhadap eritrosit setelah perlakuan pakan ... 27
c) Analisis lanjut statistik terhadap eritrosit pada saat uji tantang ... 27
5 a) Analisis statistik terhadap leukosit sebelum perlakuan pakan ... 27
b) Analisis lanjut statistik terhadap leukosit setelah perlakuan pakan ... 28
c) Analisis lanjut statistik terhadap leukosit pada saat uji tantang... 28
6 a) Analisis statistik terhadap hemoglobin sebelum perlakuan pakan ... 28
b) Analisis lanjut statistik terhadap hemoglobin setelah perlakuan pakan ... 28
c) Analisis statistik terhadap hemoglobin pada saat uji tantang ... 28
7 a) Analisis statistik terhadap hematokrit sebelum perlakuan pakan ... 29
b) Analisis statistik terhadap hematokrit setelah perlakuan pakan ... 29
c) Analisis statistik terhadap hematokrit pada saat uji tantang ... 29
8 a) Analisis statistik terhadap indeks fagositik sebelum perlakuan pakan ... 29
b) Analisis statistik terhadap indeks fagositik setelah perlakuan pakan ... 29
c) Analisis statistik terhadap indeks fagositik pada saat uji tantang ... 29
9 a) Analisis statistik terhadap limfosit sebelum perlakuan pakan ... 29
b) Analisis statistik terhadap limfosit setelah perlakuan pakan ... 30
c) Analisis statistik terhadap limfosit pada saat uji tantang ... 30
10 a) Analisis statistik terhadap monosit sebelum perlakuan pakan ... 30
b) Analisis statistik terhadap monosit setelah perlakuan pakan... 30
c) Analisis statistik terhadap monosit pada saat uji tantang ... 30
11 a) Analisis statistik terhadap neutrofil sebelum perlakuan pakan ... 30
b) Analisis statistik terhadap neutrofil setelah perlakuan pakan ... 30
PENDAHULUAN
Ikan nila Oreochromis niloticus adalah komoditas unggulan perikanan air tawar yang memiliki nilai ekonomis tinggi. Permintaan terhadap ikan nila mencakup pasar domestik dan luar negeri (Amerika dan Eropa). Produksi ikan nila setiap tahunnya mengalami peningkatan, yakni pada tahun 2010 produksi ikan nila sebesar 214.515,00 ton, kemudian meningkat pada tahun 2011 sebesar 277.518,00 ton (KKP 2011). Ikan nila juga memiliki banyak keunggulan, diantaranya memiliki kemampuan tumbuh yang relatif cepat, memiliki toleransi yang cukup luas terhadap perubahan kondisi lingkungan terutama salinitas (Yadav 2006).
Disamping beberapa keunggulan dari budidaya ikan nila tersebut, budidaya ikan nila juga masih mengalami kendala. Salah satu kendala tersebut yaitu adanya penyakit streptococcosis yang disebabkan oleh bakteri Streptococcus
agalactiae. Menurut Pasnik et al. (2009), Streptococcus agalactiae banyak
menyerang ikan di perairan umum maupun ikan dalam wadah budidaya yang menyebabkan banyak terjadinya kerusakan organ. Menurut Hernandez et al. (2009), wabah bakteri Streptococcus agalactiae bersifat akut dan dapat menyebabkan kematian tinggi hingga mencapai 100% pada ikan budidaya.
Penanggulangan penyakit pada kegiatan budidaya seperti streptococcosis masih mengandalkan antibiotik. Intensitas penggunaan antibiotik yang relatif tinggi menimbulkan berbagai permasalahan dan merupakan ancaman global bagi kesehatan terutama resistensi bakteri terhadap antibiotik. Pada awalnya resistensi terjadi di lingkungan rumah sakit, tetapi lambat laun berkembang di lingkungan masyarakat (Anonim 2008). Menurut Drlica dan Perlin (2011) dalam Anonim (2011), definisi resistensi adalah kemampuan bakteri untuk menetralisir dan melemahkan daya kerja antibiotik. Penggunaan antibiotik dalam pengobatan ikan sebenarnya telah tidak diperbolehkan karena menurut FAO/WHO/OIE (2006) penggunaan antibiotik dapat menyebabkan timbulnya resistensi mikroorganisme patogen dan meninggalkan residu pada ikan dan lingkungannya. Keputusan Menteri Kelautan dan Perikanan No. Kep.20/Men/2003 mengenai klasifikasi obat ikan yang menyatakan bahwa antibiotik termasuk jenis obat keras yang berbahaya dan dilarang digunakan pada praktek pembudidayaan ikan (Anonim 2003). Hal ini menyebabkan keresahan masyarakat terhadap keamanan pangan dan kesehatan terhadap penggunaan antibiotik.
Salah satu cara untuk mengatasi masalah penyakit tanpa menimbulkan resistensi bakteri patogen dan menimbulkan residu yaitu melalui pendekatan biologi melalui aplikasi penggunaan probiotik. Menurut Fuller (1992), probiotik merupakan makanan tambahan dalam bentuk mikroba hidup yang memberi pengaruh yang menguntungkan bagi inang dengan meningkatkan keseimbangan mikroba dalam saluran pencernaan, merubah metabolisme mikrobial dengan meningkatkan atau menurunkan aktivitas enzim dan menstimulasi imunitas melalui peningkatan kadar antibodi atau aktivitas makrofag (Irianto 2003), seperti
Lactobacillus sp., Bacillus sp., Saccharomyces cerevisiae dan Aspergillus oryzae.
Berbagai penelitian yang telah dilakukan tentang aplikasi probiotik untuk pencegahan Streptococcus agalactiae seperti isolat bakteri NP5 (Farouq 2011), isolat bakteri AN3, AL4, WY3, DMI dan KHI untuk menghambat pertumbuhan
2
Streptococcus iniae pada ikan nila (Mulyati 2010) serta isolat bakteri SKT-b
sebagai pencegahan untuk menanggulangi serangan patogen Vibrio harveyi dalam budidaya udang (Widanarni et al 2008). Penggunaan bakteri proteolitik L1k sebagai probiotik dalam penelitian ini dikarenakan isolat bakteri L1k menghasilkan survival rate paling tinggi dalam pengujian secara in vivo. Selain itu, isolat bakteri L1k dipilih karena pada uji in vitro isolat ini juga memiliki kemampuan menghambat pertumbuhan patogen paling optimal diantara isolat-isolat yang diujikan hingga kepadatan 102 CFU/ml (Firdaus 2012).
Berbagai macam metode uji tantang yang digunakan untuk menginfeksikan bakteri patogen telah banyak dilakukan seperti melalui metode penyuntikan. Pada penelitian ini peneliti menggunakan metode kohabitasi agar menyesuaikan penularan penyakit seperti di habitat aslinya (di alam). Pemilihan bakteri patogen Streptococcus agalactiae N14G dikarenakan strain bakteri ini merupakan tipe β-hemolitik yang memiliki kemampuan untuk menghemolisis darah dengan cara menghasilkan toksin hemolisin yang berupa enzim ekstrasellular (Hardi 2012).
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji pengaruh pemberian bakteri proteolitik L1k terhadap peningkatan respon imun ikan nila yang diinfeksi
Streptococcus agalactiae N14G secara kohabitasi.
METODE
Waktu dan TempatPenelitian ini dilakukan pada bulan Maret-Mei 2013 di Balai Penelitian Pengembangan Budidaya Air Tawar (BPPBAT) Sempur, Bogor, Jawa Barat, Laboratorium Kesehatan Ikan dan Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Kelautan, Institut Pertanian Bogor.
Prosedur Penelitian Persiapan Wadah
Wadah pemeliharaan untuk aklimatisasi dan perlakuan yang digunakan adalah akuarium plastik yang berdimensi 85 x 50 x 35 cm3 sebanyak 15 buah. Sebelum digunakan, akuarium plastik dicuci bersih dengan menggunakan sabun. Setelah itu akuarium plastik didesinfeksi dengan kalium permanganat (PK), lalu akuarium plastik dibilas hingga bersih. Jika sudah bersih, akuarium plastik kemudian diisi dengan air tandon hingga ketinggian 40 cm dan diaerasi kencang. Persiapan Ikan Uji
Ikan uji yang digunakan untuk penelitian adalah ikan nila (Oreochromis
niloticus) dengan bobot rata-rata 24.9±2.20 gram dan panjang rata-rata 10.9±1.33 cm/ekor sebanyak 225 ekor. Ikan-ikan tersebut didatangkan dari Instalasi Riset
3 Plasma Nutfah Perikanan Cijeruk, Bogor. Ikan dipelihara pada tiap akuarium plastik yang berukuran 85 x 50 x 35 cm3 sebanyak 15 ekor per akuarium plastik. Isolat Probiotik
Probiotik yang digunakan adalah bakteri proteolitik L1k yang diisolasi dari usus ikan lele dan telah diidentifikasi sebagai bakteri dari genus
Staphylococcus sp. (Firdaus 2012). Probiotik dikultur cair setiap dua hari sekali
dengan memasukkan satu ose penuh biakan bakteri ke dalam media TSB (Tryptic
Soy Broth) sebanyak 10 ml dan kemudian diinkubasi selama 24 jam. Pemanenan
dilakukan dengan cara pengenceran hingga kepadatan 104 CFU/ml. Isolat Bakteri Patogen
Isolat murni Streptococcus agalactiae N14G dikultur dalam media BHI (Brain Heart Infusion) agar pada cawan petri (plate), diinkubasi selama 24 jam. Jika telah tumbuh ditanam kembali ke dalam media BHI cair pada tabung sebanyak 10 ml kemudian diinkubasi selama 24 jam. Setelah 24 jam, kultur sel tersebut dapat dipanen dan digunakan sebagai isolat untuk Postulat Koch dengan kepadatan 104 CFU/ml.
Postulat Koch
Postulat Koch bertujuan untuk mengaktifkan kembali tingkat patogenitas
dari suatu bakteri patogen yang telah lama disimpan dalam kondisi laboratorium. Ikan yang digunakan untuk metode ini adalah ikan nila berbobot 25 gram/ekor. Ikan disuntikkan sel kultur Streptococcus agalactiae dengan kepadatan 104 CFU/ml dengan dosis 0,1 ml/ekor ikan, dan diamati gejala klinis ikan yang timbul hingga 5-7 hari. Setelah diketahui gejala klinis yang timbul maka ikan tersebut diisolasi kembali untuk mendapatkan bakteri patogen Streptococcus agalactiae yang diisolasi dari mata dan otak. Sel yang diambil dengan jarum ose disebar pada media BHI agar cawan petri selanjutnya diinkubasi selama 24 jam. Setelah 24 jam tumbuh koloni dengan ciri-ciri berwarna kekuningan, berlendir pekat dan mudah diambil, maka koloni hasil isolasi tersebut dipindahkan untuk ditumbuhkan kembali pada media BHI cair tabung sebanyak 10 ml selanjutnya diinkubasi selama 24 jam. Setelah masa inkubasi 24 jam tumbuh bakteri Streptococcus
agalactiae dalam tabung tersebut disuntikkan kembali pada ikan baru yang
kondisinya sehat, dan diamati selama 2-5 hari. Jika telah nampak gejala klinis yang muncul maka ikan yang diinfeksi Streptococcus agalactiae diisolasi kembali pada bagian mata dan otak. Untuk tahap selanjutnya sama dengan proses pengisolasian dan penanaman bakteri sebelumnya. Proses ini dinamakan Postulat
Koch yang diulang sebanyak 2 kali. Bakteri patogen Streptococcus agalactiae
hasil Postulat Koch yang diulang sebanyak 2 kali yang akan digunakan sebagai uji tantang dalam penelitian ini.
Uji Tantang Kohabitasi
Ikan diuji tantang secara kohabitasi dengan menyuntikkan ikan sehat berukuran 20 gram sebanyak 60 ekor. Ikan disuntik biakan Streptococcus
agalactiae N14G dengan kepadatan 104 CFU/ml. Ikan dipelihara 1-2 hari hingga menunjukkan gejala sakit. Sebelum dimasukkan ke dalam akuarium, ikan kohabitasi ditandai terlebih dahulu dengan memotong sirip ekornya. Jumlah ikan kohabitasi yang dimasukkan ke dalam akuarium berjumlah 4 ekor tiap akuarium (1 ekor per 10 L air).
4
Penyiapan Pakan Bersuplemen dan Binder
Pakan yang diberikan yakni berupa pakan komersil dengan komposisi bahan seperti campuran tepung ikan, tepung bungkil kedelai, tepung terigu, tepung polard, minyak ikan, minyak sawit, vitamin C, premix ayam. Pelet tersebut dicampur dengan isolat bakteri L1k dengan menggunakan binder berupa putih telur dengan konsentrasi sebanyak 2% (v/m) (Farouq 2011).
Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini yaitu ikan nila yang berasal dari Instalasi Riset Plasma Nutfah Perikanan Cijeruk. Bobot rata-rata ikan nila yang digunakan pada penelitian ini yaitu 22 ± 0,29 gram/ekor. Ikan nila uji ditimbang terlebih dahulu bobotnya, kemudian dimasukkan ke dalam akuarium fiber untuk selanjutnya diadaptasikan selama 1 minggu. Jumlah ikan nila di dalam setiap akuarium adalah 15 ekor.
Persiapan Pakan Uji
Pakan yang digunakan pada penelitian ini yaitu pakan komersil dengan kadar protein sebesar 28-30% (label komersial). Pencampuran bakteri proteolitik L1k ke dalam pakan yakni dengan cara menyemprotkannya menggunakan syringe sesuai dengan dosis masing masing perlakuan. Setelah itu putih telur dengan dosis 2% (v/m) dari jumlah pakan disemprotkan ke dalam wadah yang telah berisi pakan menggunakan syringe. Kemudian pakan dan bakteri proteolitik L1k tersebut diaduk secara merata dan selanjutnya dikeringanginkan. Setelah kering, pakan tersebut kemudian dikemas dan siap diberikan ke ikan uji. Analisa proksimat dilakukan untuk pakan yang diberi bakteri proteolitik L1k dengan lama fermentasi 24 dan 48 jam.
Rancangan Percobaan
Penelitian ini terdiri dari 5 perlakuan dengan 3 kali ulangan. Rancangan perlakuan penelitian dapat dilihat pada Tabel 1.
Tabel 1 Rancangan perlakuan pemberian isolat bakteri proteolitik L1k dengan dosis berbeda pada ikan nila.
Perlakuan Keterangan
K- Pemberian pakan komersil tanpa penambahan bakteri L1k (kontrol) dan tanpa diuji tantang dengan kohabitasi (4 ekor/40 L air, ikan nila diinfeksi dengan dosis 104 CFU/ml dan volume 0,1 ml/ekor)
K+ Pemberian pakan komersil tanpa penambahan bakteri L1k (kontrol) dan diuji tantang dengan kohabitasi (4 ekor/40 L air, ikan nila diinfeksi dengan dosis 104 CFU/ml dan volume 0,1 ml/ekor).
A Pemberian pakan komersil dengan penambahan bakteri proteolitik L1k (3,9 x 108) 1 % (1ml/100 g pakan) diuji tantang dengan kohabitasi (4 ekor/40 L air, ikan nila diinfeksi dengan dosis 104 CFU/ml dan volume 0,1 ml/ekor) (Putra 2010).
B Pemberian pakan komersil dengan penambahan bakteri proteolitik L1k (3,9 x 108) 2 % (2ml/100 g pakan) diuji tantang dengan kohabitasi (4 ekor/40 L air, ikan nila diinfeksi dengan dosis 104 CFU/ml dan volume 0,1 ml/ekor) (Mahious et al. 2006)
5 C Pemberian pakan komersil dengan penambahan bakteri proteolitik L1k (3,9 x 108) 3 % (3ml/100 g pakan) diuji tantang dengan kohabitasi (4 ekor/40 L air, ikan nila diinfeksi dengan dosis 104 CFU/ml dan volume 0,1 ml/ekor)
Pemberian pakan dilakukan sebanyak tiga kali dalam sehari yaitu pada pukul 08.00, 13.00, 16.00 WIB. Jumlah pakan yang diberikan sesuai dengan
Feeding Rate (FR) yang diterapkan yaitu sebesar 3 % untuk mempermudah dalam
penentuan dosis probiotik yang diberikan. Pemberian pakan dilakukan secara at
satiation dengan sisa pakan ditimbang. Selama kegiatan penelitian dilakukan
sampling bobot setiap 7 hari sekali. Penelitian ini dilakukan selama 35 hari yang merupakan kisaran waktu yang sesuai untuk mengaplikasikan bakteri proteolitik L1k dalam pakan dan uji tantang Streptococcus agalactiae N14G secara kohabitasi.
Prosedur Analisis Data Tingkat Kelangsungan Hidup Ikan
Tingkat kelangsungan hidup ikan (Survival Rate) menurut Effendie (1997), dihitung dari persentase jumlah ikan yang hidup di akhir masa pemeliharaan dibanding dengan jumlah ikan pada saat awal tebar.
Laju Pertumbuhan Spesifik Harian
Laju pertumbuhan spesifik atau Specific Growth Rate (SGR) adalah besarnya laju pertumbuhan harian ikan yang dihitung menurut Effendie (1997). Pengukuran laju pertumbuhan spesifik ikan dilakukan dengan cara menimbang bobot ikan saat awal pemeliharaan dan akhir pemeliharaan tiap minggu sekali. Rasio Konversi Pakan
Rasio konversi pakan dihitung menurut Zonneveld et al. (1991). Gambaran Darah Ikan
Pengamatan gambaran darah ikan dilakukan sebanyak 3 kali, yaitu sebelum perlakuan bakteri proteolitik, setelah selesai perlakuan bakteri proteolitik dan hari ke- 14 uji tantang. Pengambilan darah ikan dilakukan melalui vena caudal menggunakan syringe. Terlebih dahulu syringe dan tabung eppendorf dibilas dengan larutan antikoagulan, natrium sitrat 0.8% (C6H5O7Na3.2H2O). Lalu, syringe dimasukkan dari belakang anal ke arah tulang hingga menyentuh tulang belakang. Darah dihisap perlahan kemudian dimasukkan ke dalam tabung
eppendorf. Pengamatan gambaran darah ikan meliputi kadar hemoglobin,
hematokrit, eritrosit, leukosit, differensial leukosit serta indeks fagositik. Perhitungan Kadar Hemoglobin (Hb)
Perhitungan kadar hemoglobin (Hb) dilakukan dengan metode Sahli. Skala hemoglobin dapat dilihat pada skala jalur g% (kuning) yang berarti banyaknya hemoglobin dalam gram per 100 ml darah.
6
Perhitungan Kadar Hematokrit
Kadar hematokrit diukur menurut Ziskowski et al (2008). Kadar hematokrit merupakan banyaknya sel darah (digambarkan dengan padatan atau endapan) dalam cairan darah.
Perhitungan Jumlah Eritrosit
Jumlah eritrosit dihitung menurut Valenzuela et al (2006). Perhitungan Jumlah Leukosit
Jumlah leukosit dihitung menurut Blaxhall dan Daisley (1973). Differensial Leukosit
Differensial leukosit dihitung menurut Amlacher (1970). Indeks Fagositik
Indeks fagositik yang diukur mengikuti Anderson dan Siwicki (1993). Persentase sel-sel fagositik dapat dihitung dengan cara mengamati jumlah sel-sel yang memfagosit bakteri hingga berjumlah 100 sel.
Identifikasi Isolat Bakteri
Identifikasi gen 16S rRNA dilakukan untuk menentukan spesies yang mempunyai tingkat keragaman genetik yang besar diantara spesies di dalam populasi yang mempunyai lebih banyak variasi untuk memilih variasi gen tertentu yang paling sesuai. Identifikasi gen 16S rRNA meliputi proses kerja ekstraksi isolat bakteri, amplifikasi dan sekuensing hasil PCR. Metode ini dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Analisis Proksimat
Analisa proksimat pakan yang difermentasi dengan penambahan bakteri proteolitik L1K selama 24 jam dan 48 jam meliputi kadar protein, kadar lemak, kadar serat kasar, BETN, kadar air dan kadar abu menurut metode AOAC (Association of Official Agricultural Chemist) (1990). Analisa proksimat ini dilakukan di Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Kualitas Air
Kualitas air yang diamati yaitu suhu dan pH harian dilakukan setiap hari pagi dan sore di Laboratorium Basah Patologi, Balai Penelitian dan Pengembangan Budidaya Air Tawar (BPPBAT) Sempur, Bogor.
Tabel 2 Satuan dan alat ukur kualitas air pada parameter suhu dan pH.
Parameter Kualitas Air Satuan Alat
Suhu oC Termometer
7 Analisis Data
Penelitian ini menggunakan metode Rancangan Acak Lengkap (RAL) dengan lima perlakuan dengan masing-masing perlakuan terbagi menjadi tiga ulangan. Data yang diperoleh diolah dengan Microsoft Excel 2010, kemudian dilakukan uji statistik ANOVA dan apabila berbeda nyata maka dilanjutkan dengan uji Duncan menggunakan program perangkat lunak SPSS 17.0 untuk melihat perbedaan antar perlakuan.
Skema Penelitian Kontrol Negatif
Kontrol Positif
Perlakuan Probiotik
Gambar 1. Skema penelitian aplikasi berbagai dosis bakteri proteolitik L1k dalam pakan untuk pengendalian streptococcosis pada ikan nila Oreochromis
niloticus dengan metode kohabitasi. A = Aklimatisasi, B =
Pengambilan darah, C = Pemberian pakan probiotik L1k, D = Uji tantang, E = Sampling pertumbuhan (bobot dan panjang).
-7 0 (E,B) 1 21 (E,B) 7 (E) 14 (E) 28 (E) (E,B) 35 (A) Hari ke- 0 (E,B) 1 -7 21 (E,B) 7 (E) 14 (E) 22 35 (E,B) (A) (D) Hari ke (A) 0 (E,B) 7 (E) 21 (E,B) 35 (E,B) (D) (C) 14 (E) 22 Hari ke- -7 1 28 (E) 28 (E)
8
HASIL DAN PEMBAHASAN
HasilTingkat Kelangsungan Hidup Ikan
Data tingkat kelangsungan hidup ikan nila setelah selesai perlakuan pakan yang diuji statistik pada Lampiran 1, disajikan pada gambar 2.
Gambar 2. Tingkat kelangsungan hidup ikan nila pada masa awal pemeliharaan
sampai dengan masa akhir pemeliharaan. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan dari data yang diperoleh menunjukkan bahwa tingkat kelangsungan hidup ikan antar perlakuan dosis dan kontrol negatif (A, B, C dan K-) tidak berbeda nyata (P>0,05). Namun tingkat kelangsungan hidup ikan perlakuan bakteri proteolitik L1k dan kontrol negatif berbeda nyata dengan kontrol positif (P<0,05). Penambahan bakteri proteolitik L1k ke dalam pakan ternyata mampu meningkatkan tingkat kelangsungan hidup ikan nila selama pemeliharaan pada perlakuan A, B, dan C dengan nilai masing-masing sebesar 93.33%, 95.55% dan 97.78%.
Laju Pertumbuhan Spesifik Ikan
Nilai laju pertumbuhan spesifik ikan nila pada masing-masing perlakuan yang dihitung saat sebelum perlakuan bakteri proteolitik, setelah perlakuan bakteri proteolitik dan setelah uji tantang dengan metode kohabitasi diuji statistik pada Lampiran 3. 91.11 68.89 93.33 95.56 97.78 0 10 20 30 40 50 60 70 80 90 100 K- K+ A B C S in tasan (% )
b
a
b
b
b
9
Gambar 3. Laju pertumbuhan spesifik ikan nila (Pra : sebelum perlakuan bakteri proteolitik, Pasca : setelah perlakuan bakteri proteolitik, sebelum uji tantang, UT : setelah uji tantang, Total : nilai keseluruhan dari awal sampai akhir (35 hari). Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan data yang diperoleh dari grafik di atas dapat diketahui bahwa laju pertumbuhan spesifik ikan nila pada perlakuan bakteri proteolitik L1k (A, B, C) mempunyai nilai berturut-turut sebesar 1.64 %, 1.68 %, 2.06 %. Berdasarkan uji ANOVA, selama total pemeliharaan perlakuan bakteri proteolitik L1k (A,B, C) terlihat berbeda nyata (P<0,05) terhadap kontrol positif (0.95 %) dan kontrol negatif (0.89%). Penambahan bakteri proteolitik L1k ke dalam pakan memberikan pengaruh terhadap laju pertumbuhan spesifik ikan nila selama pemeliharaan. Rasio Konversi Pakan
Pengaruh pemberian probiotik dengan dosis berbeda terhadap rasio konversi pakan yang diuji statistik pada Lampiran 2, disajikan pada gambar 3 berikut ini.
Gambar 4. Rasio konversi pakan ikan nila selama 35 hari pemeliharaan. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif). 0.62 0.98 1.69 0.80 1.51 1.30 0.83 1.15 1.29 1.89 1.02 1.15 1.74 1.47 2.44 0.89 0.95 1.64 1.68 2.06 0 0.5 1 1.5 2 2.5 3 3.5 K- K+ A B C L a ju Pe rt u m b u h a n S p esi fi k ( % )
PRA PASCA UT TOTAL
a ab a a ab a a a c ab ab b a ab a b
bc b b c
2.46 2.49 1.63 1.55 1.27 0.00 1.00 2.00 3.00 K- K+ A B C Ra sio K o n v er si Pa k a n FCRa
b
b
c
c
10
Berdasarkan data yang diperoleh pada grafik di atas dapat diketahui bahwa rasio konversi pakan ikan antar perlakuan dosis bakteri proteolitik L1k A (1.63), B (1.55) dan C (1.27) berbeda nyata (P<0,05) terhadap kontrol positif (2.49) dan kontrol negatif (2.46) setelah diuji ANOVA. Perlakuan C berbeda nyata (P<0.05) terhadap perlakuan A dan B. Penambahan bakteri proteolitik L1k ke dalam pakan berpengaruh terhadap rasio konversi pakan.
Kadar Hemoglobin (Hb)
Data kadar hemoglobin ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 6, disajikan dalam gambar 5.
Gambar 5. Hemoglobin ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan data yang diperoleh pada grafik di atas dapat diketahui bahwa kadar hemoglobin ikan setelah perlakuan bakteri proteolitik sebelum uji tantang pada perlakuan B (8.67 g%) dan C (9.33 g%) setelah diuji ANOVA menunjukkan berbeda nyata (P<0,05) terhadap perlakuan kontrol positif (7.80 g%) dan kontrol negatif (7.07 g%). Penambahan bakteri proteolitik ke dalam pakan berpengaruh terhadap kadar hemoglobin ikan nila.
Kadar Hematokrit
Data mengenai hasil kadar hematokrit ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 7, disajikan dalam gambar 6.
7.00 7.07 7.00 7.00 7.00 7.00 7.80 8.53 8.67 9.33 7.13 7.20 6.53 7.07 7.53 0.00 2.00 4.00 6.00 8.00 10.00 K- K+ A B C H em o g lo bin ( g %)
Pra Pasca Uji Tantang 14
11
Gambar 6. Kadar hematokrit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan hasil yang diperoleh dari grafik di atas, dapat diketahui bahwa kadar hematokrit ikan antar perlakuan (A, B, C) dengan kontrol (K+ dan K-) setelah diuji ANOVA tidak berbeda nyata (P>0,05). Penambahan bakteri proteolitik ke dalam pakan tidak berpengaruh terhadap kadar hematokrit ikan nila. Jumlah Eritrosit
Data mengenai jumlah eritrosit ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 4, disajikan dalam gambar 7.
Gambar 7. Jumlah eritrosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke -14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
30.00 30.00 30.00 29.07 30.00 28.00 30.00 30.00 30.00 30.87 32.48 31.16 32.17 32.87 33.33 0.00 10.00 20.00 30.00 40.00 K- K+ A B C H em a to k rit ( %)
Pra Pasca Uji Tantang 14
a a a
a a a
a a a
a a a
a a
a
3.10 3.17 3.10 3.10 3.10 3.17 3.10 3.10 3.47 3.53 3.18 2.81 3.01 2.99 3.13 0.00 1.00 2.00 3.00 4.00 5.00 K- K+ A B C E rit ro sit ( x 1 0 6 s el/m m 3 )Pra Pasca Uji Tantang 14
12
Berdasarkan hasil yang diperoleh dari grafik di atas, dapat diketahui bahwa jumlah eritrosit ikan nila pada saat setelah perlakuan bakteri proteolitik setelah uji tantang berdasarkan uji ANOVA pada perlakuan B (3.47 x 106 sel/mm3) dan C (3.53 x 106 sel/mm3) terlihat berbeda nyata (P<0,05) terhadap kontrol positif (3.1 x 106 sel/mm3). Hal ini menunjukkan bahwa penambahan bakteri proteolitik berpengaruh terhadap jumlah eritrosit.
Jumlah Leukosit
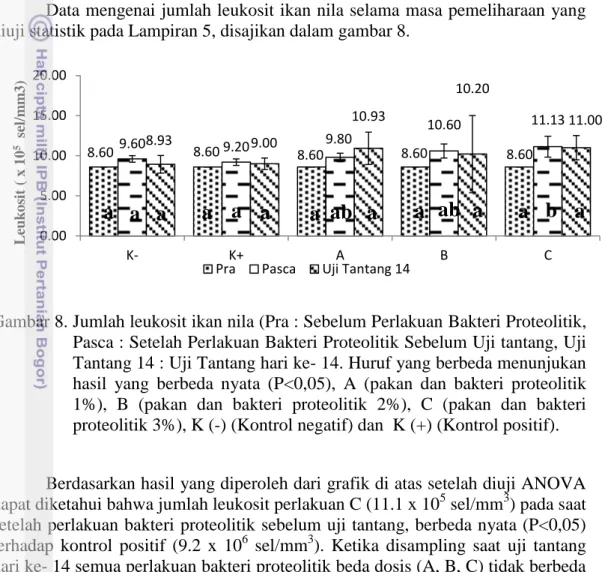
Data mengenai jumlah leukosit ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 5, disajikan dalam gambar 8.
Gambar 8. Jumlah leukosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan hasil yang diperoleh dari grafik di atas setelah diuji ANOVA dapat diketahui bahwa jumlah leukosit perlakuan C (11.1 x 105 sel/mm3) pada saat setelah perlakuan bakteri proteolitik sebelum uji tantang, berbeda nyata (P<0,05) terhadap kontrol positif (9.2 x 106 sel/mm3). Ketika disampling saat uji tantang hari ke- 14 semua perlakuan bakteri proteolitik beda dosis (A, B, C) tidak berbeda nyata (P>0.05) terhadap kontrol positif dan negatif. Hal ini menunjukkan bahwasanya penambahan bakteri proteolitik ke dalam pakan berpengaruh terhadap jumlah leukosit ikan nila.
Limfosit
Data mengenai jumlah limfosit ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 9, disajikan dalam gambar 9.
8.60 9.60 8.60 9.20 8.60 8.60 8.60 9.80 10.60 11.13 8.93 9.00 10.93 10.20 11.00 0.00 5.00 10.00 15.00 20.00 K- K+ A B C L euk o sit ( x 1 0 5 sel/m m 3 )
Pra Pasca Uji Tantang 14
13
Gambar 9. Jumlah limfosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif). Berdasarkan data yang diperoleh dari grafik di atas dapat diketahui bahwa jumlah limfosit ikan nila setelah diuji ANOVA terlihat tidak berbeda nyata (P<0,05) pada saat pengambilan sampel untuk semua perlakuan bakteri proteolitik L1k (A, B, C) terhadap kontrol positif. Pada dasarnya penambahan bakteri proteolitik L1k ke dalam pakan tidak memberikan pengaruh terhadap jumlah limfosit ikan nila.
Monosit
Data mengenai jumlah monosit ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 10, disajikan dalam gambar 10.
Gambar 10. Jumlah monosit ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke- 14. Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif). 60.33 60.33 60.33 60.33 60.33 59.67 60.33 58.00 60.33 55.33 60.67 58.67 57.33 59.33 60.33 0.00 50.00 100.00 K- K+ A B C L im fosi t (% )
Pra Pasca Uji Tantang 14
a a a
a a a
a a a
a a a
a a a
12.66 12.67 12.66 12.66 12.66 12.66 17.67 14.00 14.33 16.00 12.00 12.33 11.33 11.33 9.67 0.00 5.00 10.00 15.00 20.00 25.00 K- K+ A B C M o no sit ( %)Pra Pasca Uji Tantang 14
14
Berdasarkan data grafik di atas dapat diketahui jumlah monosit ikan nila setelah diuji ANOVA untuk semua perlakuan bakteri proteolitik (A, B, C) tidak berbeda nyata (P>0,05) terhadap kontrol positif. Penambahan bakteri proteolitik ke dalam pakan tidak berpengaruh terhadap jumlah monosit ikan nila.
Neutrofil
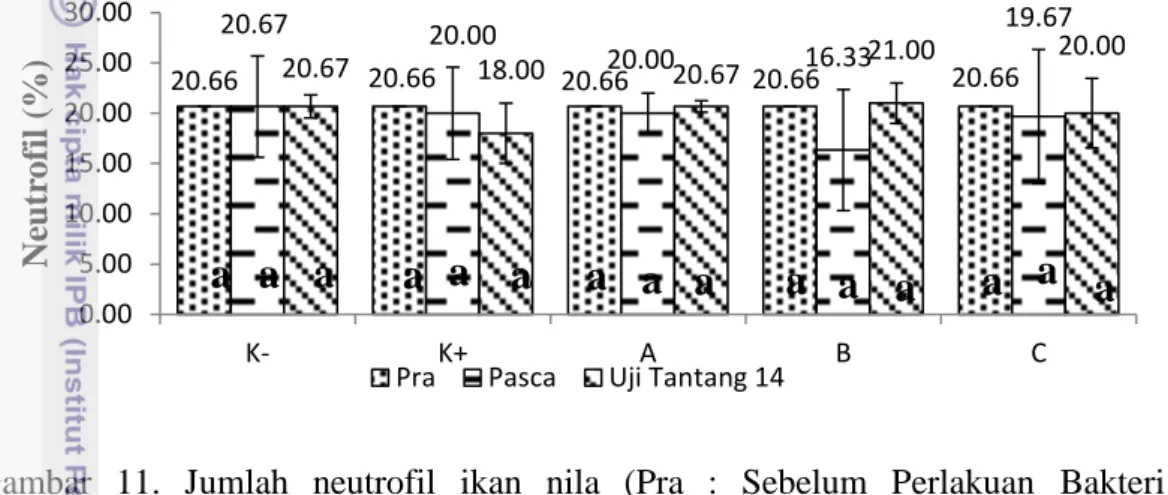
Data mengenai jumlah neutrofil ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 11, disajikan dalam gambar 11.
Gambar 11. Jumlah neutrofil ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke-14). Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan data yang diperoleh dari grafik di atas dapat diketahui bahwa jumlah neutrofil ikan nila setelah diuji ANOVA untuk keseluruhan pengambilan sampel pada semua perlakuan bakteri proteolitik L1K (A, B, C) terlihat tidak berbeda nyata (P>0,05) terhadap kontrol positif. Pada dasarnya penambahan bakteri proteolitik L1K ke dalam pakan tidak memberikan pengaruh terhadap jumlah neutrofil ikan nila.
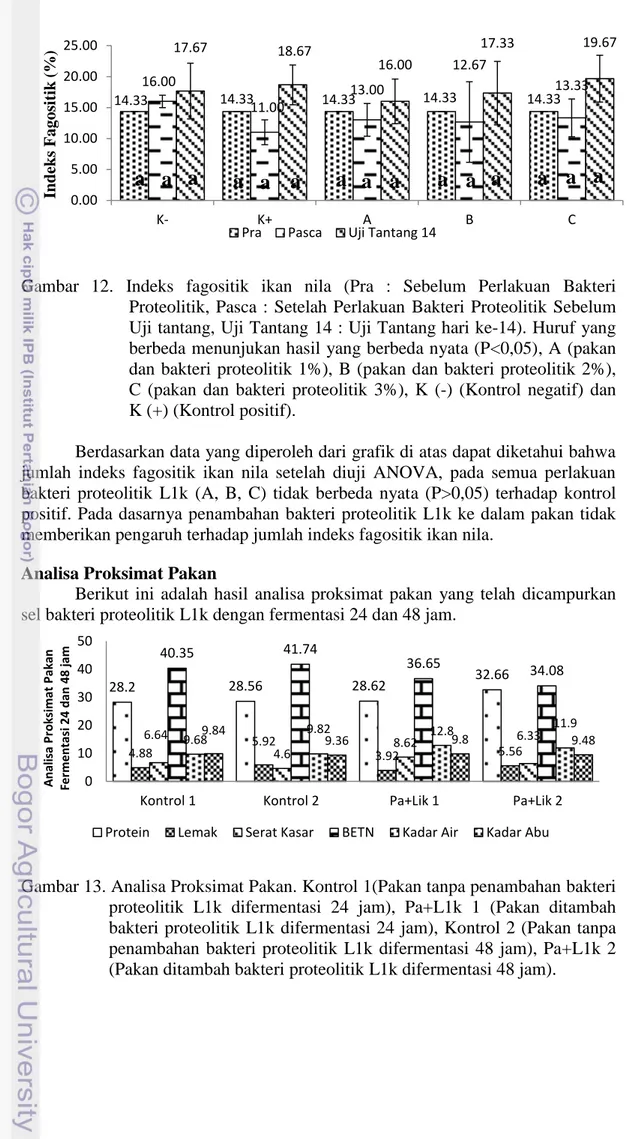
Indeks Fagositik
Data mengenai indeks fagositik ikan nila selama masa pemeliharaan yang diuji statistik pada Lampiran 8, disajikan dalam gambar 12.
20.66 20.66 20.66 20.66 20.66 20.67 20.00 20.00 16.33 19.67 20.67 18.00 20.67 21.00 20.00 0.00 5.00 10.00 15.00 20.00 25.00 30.00 K- K+ A B C Ne u tr of il ( % )
Pra Pasca Uji Tantang 14
15
Gambar 12. Indeks fagositik ikan nila (Pra : Sebelum Perlakuan Bakteri Proteolitik, Pasca : Setelah Perlakuan Bakteri Proteolitik Sebelum Uji tantang, Uji Tantang 14 : Uji Tantang hari ke-14). Huruf yang berbeda menunjukan hasil yang berbeda nyata (P<0,05), A (pakan dan bakteri proteolitik 1%), B (pakan dan bakteri proteolitik 2%), C (pakan dan bakteri proteolitik 3%), K (-) (Kontrol negatif) dan K (+) (Kontrol positif).
Berdasarkan data yang diperoleh dari grafik di atas dapat diketahui bahwa jumlah indeks fagositik ikan nila setelah diuji ANOVA, pada semua perlakuan bakteri proteolitik L1k (A, B, C) tidak berbeda nyata (P>0,05) terhadap kontrol positif. Pada dasarnya penambahan bakteri proteolitik L1k ke dalam pakan tidak memberikan pengaruh terhadap jumlah indeks fagositik ikan nila.
Analisa Proksimat Pakan
Berikut ini adalah hasil analisa proksimat pakan yang telah dicampurkan sel bakteri proteolitik L1k dengan fermentasi 24 dan 48 jam.
Gambar 13. Analisa Proksimat Pakan. Kontrol 1(Pakan tanpa penambahan bakteri proteolitik L1k difermentasi 24 jam), Pa+L1k 1 (Pakan ditambah bakteri proteolitik L1k difermentasi 24 jam), Kontrol 2 (Pakan tanpa penambahan bakteri proteolitik L1k difermentasi 48 jam), Pa+L1k 2 (Pakan ditambah bakteri proteolitik L1k difermentasi 48 jam).
14.33 14.33 14.33 14.33 14.33 16.00 11.00 13.00 12.67 13.33 17.67 18.67 16.00 17.33 19.67 0.00 5.00 10.00 15.00 20.00 25.00 K- K+ A B C Indeks F agosi tik ( % )
Pra Pasca Uji Tantang 14
a a a
a a a
a a a
a a a
a a a
28.2 28.56 28.62 32.66 4.88 5.92 3.92 5.56 6.64 4.6 8.62 6.33 40.35 41.74 36.65 34.08 9.68 9.82 12.8 11.9 9.84 9.36 9.8 9.48 0 10 20 30 40 50Kontrol 1 Kontrol 2 Pa+Lik 1 Pa+Lik 2
A n al isa Pr o ksi mat Pakan Fe rme n tasi 24 d an 48 jam
16
Berdasarkan hasil analisa proksimat grafik di atas, dapat diketahui pakan yang mempunyai kadar protein tertinggi yakni pakan yang dicampur sel bakteri L1k difermentasi selama 48 jam, Pa+L1K 2 (32.66 %). Nilai BETN Pa+L1k 2 yakni 34.08 %, serat kasar 6.33 %, lemak 5.56 %, kadar air 11.90 %, dan kadar abu 9.48 %. Dengan adanya penambahan probiotik, dapat meningkatkan kadar protein dalam pakan.
Kualitas Air
Kualitas air pada penelitian ini diukur setiap hari pada pagi dan sore hari. Parameter kualitas air yang diamati pada penelitian ini meliputi Suhu dan pH. Nilai kualitas air disajikan pada Tabel 3.
Tabel 3 Hasil pengamatan kualitas air parameter suhu dan pH
Parameter Satuan Kisaran terendah Kisaran Tertinggi
Suhu ◦C 26 28
pH - 6.5 7
Nilai kualitas air media pemeliharaan ikan nila untuk parameter suhu berkisar antara 26 – 28 0 C dan nilai pH berkisar antara 6.5 – 7.
Hasil Identifikasi Gen 16S rRNA
Berikut ini adalah tabel hasil BLAST identifikasi gen 16S rRNA bakteri proteolitik L1k (Tabel 4).
Tabel 4 Hasil BLAST bakteri proteolitik L1k L1k= 964 bp, Accession No. Spesies Maximal score Total score Query cover E value NR 043418.1 Staphylococcus lentus strain ATCC 2907 1781 1781 100% 0.0
BLAST : Basic Local Alignment Search Tool dari NCBI (National Center for Biotechnology Information)
Pembahasan
Penelitian tentang penggunaan probiotik pada akuakultur telah banyak dilakukan dari skala pembenihan hingga skala pembesaran. Penggunaan probiotik di akuakultur juga telah diuji dengan berbagai komoditas baik tawar, payau dan laut. Menurut definisi Fuller (1992) probiotik sebagai suplemen mikroba hidup dalam pakan yang memberikan efek yang menguntungkan terhadap hewan inang dengan memperbaiki keseimbangan mikroflora ususnya.
Jenis isolat probiotik yang digunakan adalah bakteri proteolitik L1k yang diisolasi dari usus ikan lele (Firdaus 2012). Berdasarkan hasil identifikasi Cowan dan Steel (1974) bakteri proteolitik ini berasal dari genus Staphylococcus. Berdasarkan uji morfologi dan mikroskopik isolat bakteri L1k termasuk Gram positif dengan morfologi sel coccus (bulat) serta penataan koloni sel diplococcus. Hasil uji biokimia juga menunjukkan hasil untuk isolat bakteri L1k seperti berikut : uji fermentatif (+), uji katalase (+), uji oksidase (-), dan bersifat non-motil. Berdasarkan hasil identifikasi molekuler terhadap gen penyandi 16S-rRNA,
17 isolat bakteri L1K diklasifikasikan sebagai Staphylococcus lentus dengan identity 100%.
Pada pengujian analisa proksimat pakan yang telah dicampur dengan isolat bakteri proteolitik L1k kemudian difermentasi selama 24 jam, dapat meningkatkan kandungan protein sebesar 28.62% dibanding dengan pakan tanpa penambahan bakteri proteolitik L1k yang memiliki kandungan protein hanya sebesar 28.20%. Pakan yang dicampur bakteri proteolitik L1k dan difermentasi selama 48 jam memiliki hasil kadar protein yang paling tinggi yakni sebesar 32.66 %. Hal ini disebabkan karena isolat bakteri probiotik L1k merupakan jenis bakteri proteolitik (Firdaus 2012). Bakteri proteolitik merupakan jenis bakteri yang memproduksi enzim protease ekstraseluler (enzim pemecah protein yang diproduksi di dalam sel kemudian dikeluarkan dari dalam sel). Menurut Yandri et
al. (2008) protease didefinisikan sebagai enzim yang berfungsi memecah ikatan
peptida untuk menghasilkan asam amino dan peptida sederhana lainnya. Aktivitas proteolitik enzim ini terjadi pada segmen usus yang umumnya menurun dari bagian depan ke arah belakang dan enzim ini resisten terhadap autolisis di dalam usus (Handajani dan Widodo 2010). Dengan adanya bantuan bakteri proteolitik yang juga berperan sebagai probiotik inilah sehingga nilai kandungan protein dalam pakan uji menjadi lebih tinggi. Hal tersebut terkait dengan pernyataan Affandi dan Tang (2002) yang menyatakan bahwa salah satu nutrien penting yang dibutuhkan oleh ikan dalam pertumbuhan adalah protein.
Metode uji tantang yang digunakan dalam penelitian ini yakni menggunakan teknik kohabitasi. Metode kohabitasi ini merupakan metode uji tantang melalui pendekatan ekologis seperti kondisi di alam. Dalam wadah ikan uji dimasukkan ikan yang telah diinfeksi patogen dengan tujuan agar ikan yang sakit tersebut menularkan patogennya dengan penularan secara horizontal ke ikan uji (lewat media air dan gesekan antar tubuh ikan). Penelitian mengenai kohabitasi ikan nila belum banyak dilakukan, yang sering dicobakan yakni pada ikan mas untuk komoditas air tawar. Taukhid et al (2010) melakukan proses uji tantang menggunakan teknik kohabitasi pada ikan mas dengan proporsi 1 ekor/6 liter air. Tetapi dalam kasus penelitian ini menggunakan proporsi 1 ekor/10 liter air.
Secara keseluruhan, hasil yang diperoleh menunjukkan bahwa tingkat kelangsungan hidup ikan nila lebih tinggi / berbeda nyata (P<0,05) secara statistik pada perlakuan yang diberi bakteri proteolitik L1k (A, B, C) terhadap kontrol positif. Hasil tersebut berbeda jauh dengan nilai kelangsungan hidup yang diperoleh pada perlakuan kontrol positif yakni hanya sebesar 68.9%. Tingkat kelangsungan hidup perlakuan dosis bakteri proteolitik L1k (A, B, C) tidak berbeda nyata (P>0,05) terhadap kontrol negatif. Tingkat kelangsungan hidup ikan nila antar perlakuan yang berbeda dosis (A, B dan C) juga tidak berbeda nyata (P>0,05). Hal ini diduga adanya peranan dari bakteri proteolitik L1k yang ditambahkan lewat pakan. Probiotik tersebut memberikan efek menguntungkan pada inang dengan memperbaiki komponen indigenous mikroflora (Lidaenni 2008) sehingga memberikan dampak kelangsungan hidup yang tinggi pada ikan nila sebagai inang. Sebagai biokontrol, probiotik berperan sebagai musuh alami yang mencegah kerusakan yang disebabkan oleh mikroorganisme merugikan sampai batas yang dapat ditoleransi (Nayak 2011). Siro (2011) menyatakan bahwa peranan bakteri biokontrol untuk mengontrol penyakit dan pencegahan bukan dimaksudkan untuk pengobatan.
18
Rasio konversi pakan (RKP) adalah suatu ukuran yang menyatakan rasio jumlah pakan yang dibutuhkan untuk menghasilkan 1 kg daging (Effendi 1997). Hasil penelitian ini, perlakuan bakteri proteolitik A (1.63), B (1.55) dan C (1.27) menunjukkan hasil berbeda nyata (P<0,05) terhadap kontrol positif (2.49) dan kontrol negatif (2.46). Perlakuan C juga menunjukkan berbeda nyata (P<0.05) terhadap perlakuan A dan B. Hal ini sesuai dengan pernyataan (Effendi 1997) yang menyatakan bahwasanya semakin kecil nilai konversi pakan maka semakin efektif pakan yang diberikan. Semakin efektif pakan yang diberikan, akan semakin tinggi pula nutrien pakan yang tercerna dan semakin besar pula kemungkinan nutrien tersebut dimanfaatkan oleh ikan untuk pertumbuhannya dan menurunkan porsi nutrien yang akan terbuang ke lingkungan.
Laju pertumbuhan spesifik ikan nila yang diberi perlakuan bakteri proteolitik L1k pada perlakuan (A (1.64 %), B (1.68 %), C (2.06 %)) berbeda nyata (P<0,05) terhadap kontrol positif (0.95 %) dan kontrol negatif (0.89 %). Perlakuan C terlihat berbeda nyata (P<0,05) terhadap perlakuan A dan B. Kualitas pakan yang baik sangat menentukan pertumbuhan dari ikan uji. Penentuan pakan yang berkualitas dapat dilihat dari besarnya kandungan protein dan tingkat kecernaan pakan oleh ikan karena adanya kandungan bakteri proteolitik L1k (probiotik) dalam pakan yang mengandung berbagai enzim seperti proteinase (Firdaus 2012) yang sangat berperan dalam proses pencernaan dan memecah ikatan peptida menjadi berbagai asam amino kompleks yang sangat mendukung untuk laju pertumbuhan ikan. Dalam peningkatan nilai nutrisi pakan, probiotik memiliki mekanisme dalam menghasilkan beberapa enzim exogenous untuk pencernaan pakan seperti amilase, protease, lipase dan selulose (Wang et al 2008). Enzim exogneous tersebut akan membantu enzim endogenous di inang untuk menghidrolisis nutrien pakan. Hal ini akan meningkatkan ketersediaan nutrien yang siap diserap dari saluran pencernaan untuk masuk ke pembuluh darah, dan akan diedarkan ke seluruh bagian tubuh dan jaringan yang membutuhkan dalam proses metabolisme selanjutnya (Aslamyah 2006). Semakin tinggi nutrien pakan yang tercerna, semakin besar pula nutrien tersebut dimanfaatkan oleh ikan untuk pertumbuhannya dan menurunkan porsi nutrien yang terbuang ke lingkungan (Putra 2010).
Berdasarkan uji gambaran darah yang telah dilakukan, didapatkan hasil kadar eritrosit ikan nila pada saat setelah perlakuan bakteri proteolitik L1k pada perlakuan B dan C terlihat berbeda nyata (P<0,05) terhadap kontrol positif dengan nilai berturut-turut sebesar 3.47 x 106 sel/mm3, 3.53 x 106 sel/mm3 dan kontrol positif sebesar 3.10 x 106 sel/mm3 serta hanya perlakuan C yang berbeda nyata (P<0.05) terhadap kontrol negatif (3.17 x 106 sel/mm3). Perlakuan C juga terlihat berbeda nyata (P<0.05) terhadap perlakuan A (3.17 x 106 sel/mm3). Pada saat uji tantang hari ke- 14 semua perlakuan dosis bakteri proteolitik L1k (A, B, C) tidak berbeda nyata (P>0.05) terhadap kontrol positif dan kontrol negatif. Hardi et al (2011) mengatakan peningkatan total eritrosit ini menandakan adanya upaya homeostatis pada tubuh ikan (infeksi patogen) tubuh memproduksi sel darah merah lebih banyak untuk menggantikan eritrosit yang mengalami lisis akibat adanya infeksi. Selain itu peningkatan jumlah eritrosit pada saat setelah pemberian bakteri proteolitik L1k menunjukkan bahwa probiotik memacu pergantian sel yang rusak (Hardi et al 2011) dan merangsang produksi eritrosit di sumsum tulang belakang. Sedangakan penurunan eritrosit menandakan terjadinya anemia pada
19
ikan. Keberadaan S. agalactiae yang memproduksi toksin hemolitik yang dapat melisis eritrosit sehingga rataan eritrosit ikan uji umumnnya menurun saat diuji tantang (Hardi et al 2011). Anemia juga berdampak pada terhambatnya pertumbuhan ikan, karena dengan rendahnya jumlah eritrosit di dalam tubuh ikan, akan menyebabkan berkurangnya suplai oksigen dan nutrien ke seluruh organ tubuh ikan sehingga mengganggu metabolisme dalam tubuh ikan.
Anemia pada makhluk hidup sangat terkait dengan adanya hemoglobin (Hb). Kadar rata-rata Hb ikan nila normal berkisar antara 6-11,01 g% (Hardi et al 2011). Kadar Hb pada penelitian ini diperoleh hasil yang berbeda nyata (P<0,05) pada perlakuan probiotik (bakteri proteolitik L1k) B (8.67 g%) dan C (9.33 g%) terhadap kontrol positif (7.8 g%) pasca pemberian probiotik (bakteri proteolitik L1k) dan sebelum uji tantang. Hal ini menunjukkan bahwa dengan adanya penambahan bakteri proteolitik L1k ke dalam pakan mampu menjaga Hb ikan nila tetap normal. Karena bakteri proteolitik L1k dapat mencegah dan menekan toksin hemolisin yang dikandung oleh bakteri patogen S. agalactiae. Toksin hemolisin ini dapat menyebabkan osmolaritas plasma darah lebih rendah sehingga menyebabkan eritrosit lisis (Hardi 2011). Selain hemoglobin, hematokrit juga erat kaitannya dengan kadar eritrosit dalam tubuh makhluk hidup. Kadar hematokrit dapat digunakan untuk tingkat stres ikan uji setelah diuji tantang, dalam kasus ini berupa kohabitasi. Menurut Hardi et al (2011), rataan kadar hematokrit ikan nila normal berkisar antara 27,3-37,8 %. Kadar hematokrit ikan antar perlakuan (A, B, C) dengan kontrol (K+ dan K-) menunjukkan tidak berbeda nyata (P>0,05). Pada uji tantang hari ke- 14, kadar hematokrit perlakuan probiotik (bakteri proteolitik L1k) A (32.17 %), B (32.87 %), C (33.33 %) kembali ke kondisi normal. Menurut Tanbiyaskur (2011), kadar hematokrit merupakan indikator jika ikan terkena infeksi, rendahnya kandungan protein pakan dan defisiensi vitamin. Selain itu menurut Orun et al (2003) yang melakukan penelitian parameter hematologi pada ikan mas menyatakan, kadar hematokrit yang rendah disebabkan oleh adanya pengaruh lingkungan seperti pengaruh suhu, DO dan kekeruhan yang menyebabkan ikan uji menjadi stres. Dalam kasus ini ikan kohabitasi tidak menyebabkan stres dengan menularkan patogen S. agalactiae lewat feses dan gesekan antar tubuh pada ikan nila uji. Bakteri proteolitik L1k yang dicampur ke dalam pakan juga dapat meningkatkan kandungan protein sehingga kadar hematokrit ikan tetap stabil.
Jumlah leukosit yang diperoleh dari hasil penelitian ini meningkat tajam pada saat setelah pemberian probiotik sebelum uji tantang. Jumlah leukosit perlakuan C (16.6 x 105 sel/mm3) berbeda nyata (P<0,05) terhadap kontrol positif (9.2 x 105 sel/mm3). Ketika disampling saat uji tantang hari ke- 14 semua perlakuan bakteri proteolitik L1k yang berbeda dosis (A, B, C) tidak berbeda nyata (P>0.05) terhadap kontrol positif dan negatif. Sakai et al. (1995) menyatakan peningkatan jumlah leukosit dapat terjadi sebagai akibat meningkatnya aktivitas pembelahan sel. Pemicu peningkatan aktivitas pembelahan sel ini dapat disebabkan karena terjadinya infeksi bakteri patogen. Menurut Hardi et al (2011), adanya infeksi S. agalactiae menyebabkan ikan mengirimkan sel leukosit lebih banyak ke areal infeksi sebagai upaya pertahanan. Sel-sel leukosit tersebut bekerja sebagai sel yang memfagosit bakteri yang ada agar tidak dapat berkembang dan menyebarkan virulensi dalam tubuh inang sehingga menyebabkan jumlah total leukosit mengalami peningkatan pasca infeksi oleh bakteri. Dalam kasus ini
20
peningkatan leukosit terjadi saat pasca pemberian bakteri proteolitik L1k (probiotik) dikarenakan leukosit menganggap probiotik yang masuk sebagai antigen kemudian dipapar untuk direkam sebagai proses kerja dari sistem imun non spesifik. Hal ini didukung oleh Martin et al (2004) yang menyatakan bahwa respon ikan terhadap stressor bergantung pada jenis stres yang dialami oleh ikan tersebut, dimana peningkatan jumlah sel darah putih, penurunan kadar hematokrit dan peningkatan neutrofil bergantung pada jenis stress yang dialami.
Differensial leukosit merupakan data yang menunjukkan kinerja sel leukosit pada ikan (Fischer et al, 2013). Hasil yang didapatkan berupa jumlah limfosit, monosit, dan neutrofil. Jumlah limfosit, monosit, dan neutrofil pada semua pengambilan sampel menunjukkan tidak berbeda nyata (P>0,05) terhadap kontrol positif dan kontrol negatif. Hal ini dikarenakan penginfeksian S. agalactiae secara kohabitasi tidak berdampak secara signifikan pada jumlah differensial leukosit. Mandal dan Mandal (2011) menyatakan bahwa eliminasi dan penghancuran patogen dilakukan oleh sel fagosit yaitu monosit yang terdapat dalam darah, makrofag yang terdapat di dalam jaringan dan sel-sel polinuclear (limfosit dan neutrofil). Monosit dapat menggandakan diri dengan cepat pada daerah inflamasi, memakan agen penyebab luka apabila terjadi serangan suatu penyakit (Mulyani 2006). Limfosit tidak bersifat fagositik namun memegang peranan penting dalam pembentukan antibodi (Schiffrin dan Hughes 2011). Limfosit sebagai sel-sel respon pertahanan tubuh yang penting, diklasifikasikan ke dalam 2 subklas : sel B (respon imun spesifik humoral) dan sel T (respon imun spesifik seluler). Sel B mempunyai kemampuan untuk bertransformasi menjadi sel plasma yaitu sel yang memproduksi antibodi (Isolauri et al 2001). Adapun sel neutrofil berperan dalam respon nonspesifik dengan melakukan fagositosis untuk menyingkirkan mikroorganisme patogen yang menyerang (Tizard 1988). Salah satu upaya dari tubuh ikan untuk mempertahankan diri terhadap serangan patogen adalah dengan menghancurkan patogen tersebut melalui proses fagositik. Leukosit yang merupakan sel fagositik sangat berperan penting dalam melawan serangan patogen. Proses terbentuknya antibodi yang spesifik terjadi karena adanya rangsangan dari antigen penginfeksi. Proses tersebut dimulai pada saat benda asing masuk ke dalam tubuh ikan, kemudian difagositik oleh makrofag. Fungsi utama makrofag yaitu pemusnahan antigen dengan cara memfagosit. Makrofag akan mengirim sinyal pada jaringan limfosit yang merupakan rangsangan untuk membentuk antibodi yang spesifik. Tujuan dari antibodi adalah untuk melumpuhkan patogen agar tidak menyebar dan menurunkan toksisitas racun sehingga lebih mudah diserang oleh sel fagosit (Erika 2008). Kiron (2012) menyatakan bahwa terjadinya peningkatan indeks fagositik mengindikasikan terjadinya peningkatan respon imun berupa peningkatan aktivitas leukosit dalam melawan serangan patogen. Nilai indeks fagositik yang tinggi menggambarkan bahwa ikan memiliki kemampuan memproduksi sel-sel fagosit dalam darah yaitu monosit dan neutrofil lebih banyak, sehingga ketika terjadi paparan mikroorganisme patogen, sel darah siap melakukan proses fagositosis. Hasil penelitian ini sejalan dengan hasil penelitian Tanbiyaskur (2011) bahwa pemberian bakteri probiotik NP5 dalam pakan, dapat meningkatkan aktivitas fagositik pada ikan nila. Peran bakteri proteolitik L1k yang utama sebagai probiotik yang menghasilkan enzim protease untuk meningkatkan kecernaan pakan sehingga tidak terlalu berdampak signifikan terhadap sistem imun seperti differensial leukosit.
21 Nayak (2010) menyatakan bahwa proses probiotik dalam menstimulir respon imun di dalam saluran pencernaan pada ikan, sedikit berbeda dengan mamalia, karena ikan tidak memiliki peyer’s patches, sekretori IgA dan sel M yang mentranspor antigen. Akan tetapi secara umum mekanisme probiotik dalam peningkatan respon imun ikan sama. Pengganti peyer’s patches pada ikan yakni GALT (Gut Associated Lymphoid Tissue) yang merupakan suatu area atau lokasi yang terletak diantara vili-vili usus yang berbentuk oval dan di dalamnya kaya akan limfosit, makrofag, sel acidophilic granulocytes (AGs), sel Ig+, sel T, granulosit dan IgM. Pengaruh dari probiotik khususnya proteolitik dalam meningkatkan sistem imun yaitu sel-sel respon imun di dalam GALT mempunyai preferensi terhadap jenis asam amino sehingga menyebabkan probiotik tersebut menempel dan berkompetisi dan menghambat bakteri patogen. Selain itu probiotik yang menempel pada GALT mengaktivasi sel-sel sistem imun dan fungsi limfosit sehingga dapat meningkatkan kapasitas perlindungan pada sistem pertahanan mukosa. Sama halnya dengan yang terjadi pada mamalia, sel-sel sistem imun tersebut kemudian akan masuk ke pembuluh darah dan terbawa ke jaringan untuk meningkatkan respon imun di seluruh tubuh ikan.
Faktor lingkungan seperti kualitas air juga menjadi suatu hal yang penting bagi berlangsungnya kegiatan budidaya. Karena adanya penyakit tidak terlepas dari pengaruh lingkungan yang buruk. Parameter kualitas air yang diuji dalam penelitian ini yaitu suhu dan pH. Menurut Kordi dan Tancung (2007), kisaran pH yang baik untuk budidaya ikan adalah 6.5-9. Tidak semua organisme akuatik mempunyai kisaran oksigen dan pH optimal yang sama. Hal ini juga dipengaruhi oleh jenis ikan, umur ikan, jenis kelamin ikan, dan habitat ikan. Selama pemeliharaan dalam penelitian ini, nilai parameter suhu dan pH ikan nila dirasa sudah optimal. Kisaran suhu optimal ikan nila 25 -30 oC (Khairuman dan Amri 2008). Nilai kisaran suhu dalam penelitian ini sesuai dengan kisaran suhu optimal untuk ikan nila.
KESIMPULAN DAN SARAN Kesimpulan
Hasil yang diperoleh menunjukkan bahwa setelah diuji tantang, ikan yang diberi pakan bersuplemen bakteri probiotik proteolitik L1k dengan dosis 1%, 2% dan 3% (v/w) dapat meningkatkan kinerja budidaya (tingkat kelangsungan hidup, laju pertumbuhan spesifik dan rasio konversi pakan). Penambahan bakteri probiotik proteolitik L1k ke dalam pakan dengan dosis 1%, 2% dan 3% tidak berbeda.
Saran
Perlu penelitian lebih lanjut mengenai aplikasi bakteri proteolitik L1k (probiotik) dalam kegiatan budidaya yang diujicobakan dengan metode rendam (imersi) secara efektif dan efisien.