7
Bab II
Tinjauan Pustaka
2.1. Limbah Cair yang Digunakan sebagai Obyek Penelitian
Limbah cair yang diolah untuk penelitian ini merupakan air buangan dari salah satu proses pada sebuah perusahaan security printing - selanjutnya disebut sebagai Perusahaan Security Printing X - yang beroperasi di kota Karawang, Jawa Barat. Proses produksi berjalan 3 (tiga) shift selama 24 jam dan hampir selalu berjalan selama 7 hari dalam satu minggu. Kuantitas air buangan harian yang dihasilkan dari mesin-mesin cetak kurang lebih adalah 12.000 liter/jam atau 288 m3/hari. Namun dari jumlah tersebut dilakukan proses recovery larutan penyapu sehingga dapat dipakai kembali ke dalam sistem cetak. Sehingga efluen yang dibuang ke badan sungai adalah sebesar kurang lebih 3.000 liter/hari. Proses produksi tersebut saat ini telah dilengkapi dengan sebuah instalasi pengolahan air limbah dengan sistem fisika - kimia.
Perbedaan mendasar limbah cair dari Perusahaan Security Printing X ini dibandingkan dengan limbah cair dari perusahaan non-security printing ataupun security printing lain terletak pada dua hal, yaitu jenis tinta yang digunakan dan keberadaan senyawa surfaktan sebagai cairan penyapu tinta (wiping solution).
2.1.1. Karakteristik Limbah Cair yang Digunakan
Selama proses produksi berjalan, instalasi recovery larutan penyapu (atau disebut sebagai instalasi penjernihan air limbah) berjalan dengan sistem closed loop, dan mengalirkan limbah cair ke lingkungan secara intermittent. Oleh karenanya karakteristik limbah cair yang dibuang ke lingkungan ini tidak akan seragam antara satu pembuangan (discharge) dengan pembuangan yang lain. Hasil uji laboratorium tentang karakteristik limbah cair yang mengacu pada Keputusan Menteri Lingkungan Hidup, Kep-51/MENLH/10/1995 tentang Baku Mutu Limbah Cair Bagi Kegiatan Industri dan Surat Keputusan Gubernur Kepala Daerah Tingkat I Jabar No. 6 Tahun 1999 lampiran III mengenai Baku Mutu Limbah Cair bagi Kegiatan Industri disajikan pada Tabel IV.1. Dari hasil uji tersebut terlihat bahwa beberapa parameter perlu menjadi perhatian utama pada
8
saat pengolahan limbah cair, yaitu COD, BOD, pH, kandungan kobalt, fenol, MBAS (Methylene Blue Alkyl Sulfonate) dan amoniak bebas.
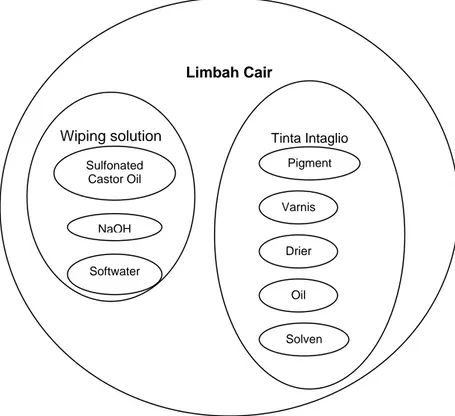
Gambar II.1. Skema komposisi limbah cair3
Karakteristik fisik limbah cair adalah berupa cairan, berwarna gelap kehitaman, jika cukup lama diendapkan cairan jernihnya memiliki warna kekuningan. Karakteristik tersebut merupakan cerminan dari komponen penyusun limbah cair, yang berupa wiping solution yang telah bercampur dengan sisa tinta cetak khusus yang dikenal dengan nama tinta intaglio. Secara kualitatif komposisi limbah digambarkan pada Gambar II.1.
2.1.1.1. Komposisi Kualitatif Limbah Cair
Komposisi kualitatif limbah cair sebagaimana gambar diatas terdiri dari wiping solution dan tinta intaglio. Dua aspek ini sangat penting untuk dapat memahami karakteristik limbah cair.
Limbah Cair Wiping solution Sulfonated Castor Oil NaOH Softwater Tinta Intaglio Pigment Varnis Drier Oil Solven
9
A. Wiping Solution
Komponen pembentuk wiping solution adalah Sulfonated Castor Oil (SCO), kaustik soda dan soft water.
Kelebihan tinta mula-mula disisihkan dengan ink-saving unit dan dikembalikan ke duct, sedangkan sisa-sisa tinta yang masih tertinggal pada area non-image pada pelat cetak akan disapu dengan sistem penyapu (Leach, 1989). Pada mesin-mesin cetak intaglio, hingga saat ini terdapat dua jenis sistem penyapu, yaitu dengan menggunakan kertas atau sejenis kain lap atau kertas (biasanya aplikasinya pada mesin cetak dengan sistem web-fed) dan dengan menggunakan larutan penyapu (wiping solution).
Pada proses yang berjalan saat ini, senyawa kimia yang digunakan sebagai penyusun wiping solution adalah sulfonated castor oil (SCO) dengan komposisi sekitar 1%; kaustik soda (NaOH), 1%; dan sisanya adalah softwater.
a. Sulfonated Castor Oil.
Merupakan salah satu turunan dari minyak jarak (Riccinus oil). Minyak jarak adalah salah satu jenis vegetable oil, dikenal sebagai castor oil yang diperoleh dari tanaman jarak (Ricinus communis). SCO diperoleh dari proses sulfonasi dengan penambahan asam sulfat (H2SO4) sehingga gugus sulfonilnya menempati
ikatan rangkap pada asam lemak dalam minyak jarak. Minyak jarak terdiri atas campuran beberapa asam lemak, dengan komponen terbesar berupa ricinoleic acid (98%).
b. Kaustik Soda
Dengan rumus kimia NaOH, berat molekul 40 dan specific gravity 2,130. Kelarutan dalam 100 bagian : dalam air dingin = 42 bagian (0oC), dalam air panas = 347 bagian (100oC), (Perry, 1985)
10
c. Softwater
Adalah air yang telah mengalami penyisihan ion positif kalsium, natrium dan magnesiumnya, sehingga tidak mengandung ion kalsium, natrium dan magnesium (atau kandungan ion Mg+ , Ca+, dan Na+ sangat rendah)4.
B. Tinta
Keunikan tinta yang digunakan pada proses ini terletak pada tinta intaglio. Tinta ini memberikan efek tactile atau teraba pada hasil cetakan yang tidak dimiliki oleh tinta lain yang digunakan pada proses cetak jenis lain. Efek tactile tersebut merupakan salah satu unsur pengaman (security features) untuk hasil cetakan.
Meskipun dari sisi pelat cetak memiliki kemiripan dengan cetak gravure, yaitu pelat cetak pada area image dibuat lebih rendah dari permukaan (gravure) sehingga mendapatkan penintaan serta memiliki sistem penyapuan kelebihan tinta, namun sifat tinta kedua proses cetak ini sangat jauh berbeda. Tidak seperti tinta gravure yang memiliki viskositas sangat rendah (daya alir kecil atau encer), tinta intaglio sangat memiliki kekakuan yang ekstrim atau secara wujud fisik tinta berupa pasta yang padat. Tinta intaglio diaplikasikan dari duct yang dipanaskan (30 – 35oC) ditransfer ke pelat yang juga dipanaskan (45 – 50oC). Tekanan tinggi diaplikasikan untuk mentransfer tinta dari pelat ke kertas (Leach, 1989).
Kuantitas tinta intaglio yang digunakan pada saat produksi sangat tergantung dari jenis hasil cetak yang diproduksi. Hasil cetakan tertentu yang memerlukan aspek pengamanan lebih banyak, hampir selalu menggunakan cetak intaglio dua sisi, sedangkan hasil cetakan lain hanya menggunakan cetak intaglio sisi muka saja. Dengan demikian, apabila dalam satu tahun produksi hasil cetakan dengan aspek pengamanan lebih banyak, maka akan dibutuhkan tinta intaglio dalam jumlah besar. 4 en.wikipedia.org/wiki/Soft water; education.melbournewater.com.au/content/glossary/glossary.asp; www.corrosionsource.com/handbook/glossary/s_glos.htm; www.water-filter-works.com/glossary.html diunduh pada tanggal 25 Desember 2007
11
Secara umum, komponen penyusun tinta adalah pigmen; dye (dyestuff); minyak (oils); resin; solven; plasticizer; wax; drier; dan zat aditif. Komponen-komponen tersebut akan dibahas satu persatu pada uraian berikut ini.
a. Pigmen.
Bahan penghasil warna pada produk cetakan yang terdapat dalam tinta cetak bisa berupa pigmen atau dye. Pigmen adalah partikel-partikel yang sangat halus yang relatif tidak larut pada media pembawanya. Pigmen dapat berupa senyawa organik atau anorganik; dapat juga berupa garam-garam logam (biasanya kalsium atau barium) dari senyawa asam kompleks. Sedangkan dye, merupakan zat pewarna yang larut dalam media yang digunakan. Dye pada umumnya berupa senyawa kompleks organik murni atau metallo-organik. Warna dye dihasilkan dari absorpsi selektif, namun demikian karena ketidakhadiran partikel diskrit di dalamnya maka tidak terjadi pemecahan cahaya dan sistem yang dihasilkan adalah transparan (Leach, 1989).
Pigmen yang digunakan untuk tinta intaglio saat ini adalah berasal dari senyawa organik. Beberapa jenis pigmen yang diprediksikan berada dalam sampel limbah cair adalah pigmen untuk yang menghasilkam warna violet, hijau, biru, dan merah sesuai dengan hasil cetakan yang dihasilkannya. Untuk warna-warna dominan biasanya digunakan pigment red 174 atau 170 (warna merah), pigment blue 15 (warna biru), pigment orange 34 (warna oranye), pigment violet 23 (warna violet) serta pigment yellow 174 (warna kuning)3. Sejauh ini tidak diperoleh keterangan lebih mendetail mengenai nomor colour index (CI) yang dapat memberikan gambaran mengenai strukstur dan rumus kimia pigmen tersebut pada pigmen-pigmen yang digunakan pada proses cetak di Perusahaan Security Printing X..
b. Solven
Pada umumnya solven yang digunakan untuk pembuatan tinta meliputi beberapa senyawa yang tergolong sebagai senyawa hidrokarbon (baik dari jenis alifatik,
12
naftanik, aromatik); alkohol monohidrat (baik dari jenis alifatik dan alisiklik); glikol; glikol eter; keton; dan ester (Leach, 1989).
c. Drier
Unsur kimia yang sering digunakan dalam drier ini adalah Cobalt, disamping unsur-unsur lain seperti Mangan, Kalsium dan Seng. Cobalt merupakan drier yang paling kuat dan paling populer digunakan. Drier yang berupa cairan pada umumnya adalah garam organik yang berikatan dengan logam berat (Leach, 1989).
2.1.2. Proses Produksi
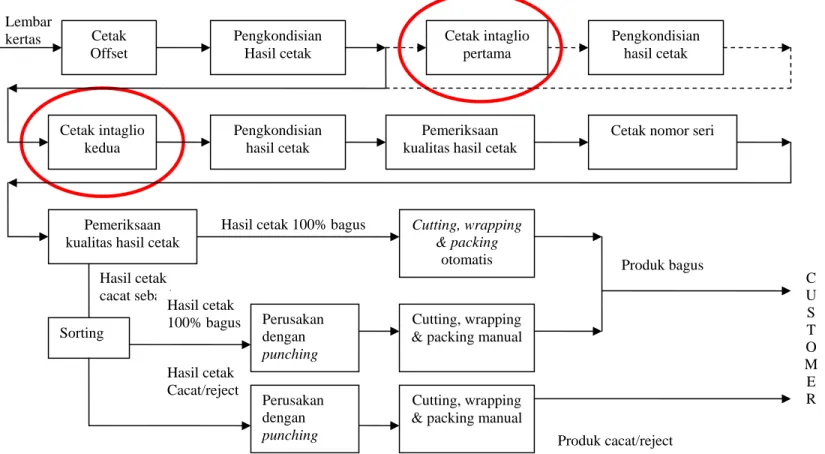
Proses produksi pada Perusahaan Security Printing X ini meliputi beberapa jenis proses cetak, yaitu offset printing, intaglio printing dan numbering. Limbah yang diteliti pada tesis ini berasal dari proses cetak intaglio. Tahapan proses cetak pada Perusahaan Security Printing X secara skematis digambarkan pada Gambar II.2.
2.1.2.1. Proses Cetak Intaglio
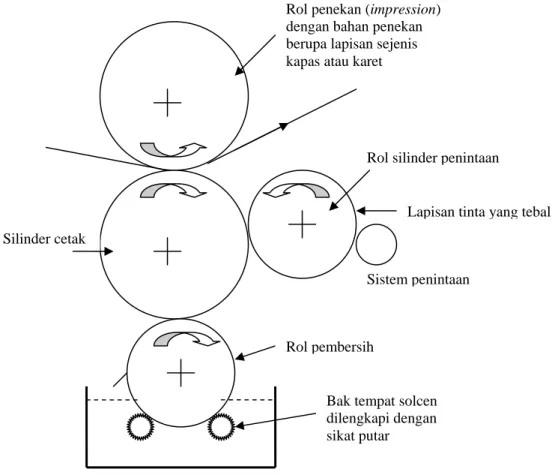
Cetak intaglio atau disebut juga sebagai recess printing merupakan proses cetak dari pelat atau silinder baja, tembaga, atau kuningan yang diukir (gravure). Cetakan dengan garis yang sangat tipis dan halus dan lapisan tinta yang sangat tebal merupakan ciri khas proses ini. Gambaran unit cetak intaglio ditunjukkan pada Gambar II.3 (Leach, 1989).
Rol tinta pada mesin cetak hampir sama dengan silinder cetak flexo, yang memiliki bagian yang menonjol yang berfungsi untuk memindahkan tinta hanya pada area gambar saja. Lapisan tinta yang sangat tebal dipindahkan sehingga area gambar yang berupa ceruk5 ukiran dipenuhi dengan tinta (Leach, 1989). Pemakaian tinta intaglio pada proses ini hanya berkisar 40%. Lebih dari 60 % diantaranya tidak terpakai dan menjadi limbah tinta. Agar penintaan tepat terjadi pada area gambar (image area) saja, maka diperlukan larutan penyapu (wiping solution) yang akan mengambil tinta yang tak terpakai sehingga larut pada larutan
5
Kata benda, yang berarti lekuk, lubang, relung yang masuk ke dinding, tembok, tanah, suatu permukaan, dll (Tim PrimaPena)
13
penyapu. Larutan penyapu inilah yang merupakan sumber limbah yang diolah dalam IPAL (Instalasi Pengolahan Air Limbah). Karena nilai ekonomisnya yang tinggi maka dilakukan upaya untuk mengambil kembali (recovery) wiping solution tersebut.
Dua hal spesifik dari sistem percetakan intaglio dapat digunakan untuk memahami karakteristik limbah yang dihasilkan, yaitu : (i) Tinta yang digunakan dalam proses cetak intaglio; dan (ii) Wiping solution.
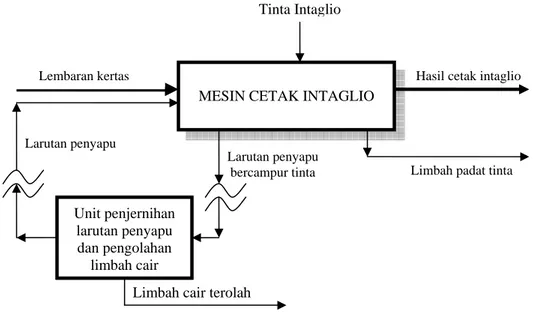
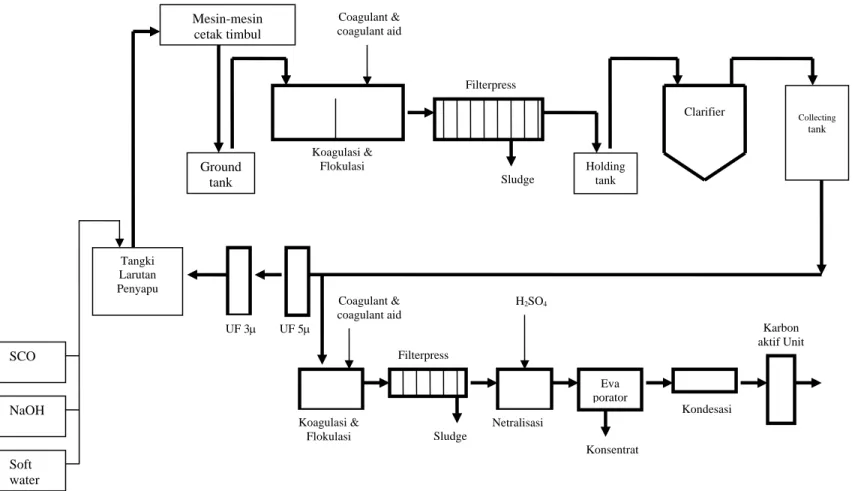
2.1.2.2. Proses Penjernihan Larutan Penyapu dan Pengolahan Limbah Cair
Sebagaimana skema pada Gambar II.5. terlihat adanya unit penjernihan larutan penyapu dan pengolahan limbah cair. Pada unit tersebut dilakukan proses pengambilan kembali (recovery) larutan penyapu yang telah tercampur dengan sisa-sisa tinta dan bahan-bahan lain untuk proses pengolahan limbah cair, yaitu larutan penyapu yang tercemar yang tidak dimaksudkan untuk didaur ulang.
2.2. Pengolahan Limbah Cair Secara Biologis
Sebagian besar efluen organik diolah secara biologis dengan menggunakan organisme untuk memanfaatkan materi organik di dalam efluen. Di dalam proses, mikroorganisme memproduksi beberapa produk / gas yang bermanfaat yang dapat digunakan sebagai bahan bakar. Tujuan dasar pengolahan ini sesungguhnya bukanlah untuk menghasilkan produk yang berguna, namun untuk mendegradasi materi organik di dalam efluen, sehingga beban BOD/COD berkurang (Rao, 2005). Proses biologis terutama ditujukan untuk menyisihkan pencemar pada limbah cair yang berupa zat-zat organik, baik yang terlarut maupun yang tidak terlarut, berbagai bentuk senyawa nitrogen, fosfor, dan material-material inert yang tidak larut dengan menyediakan kondisi lingkungan yang cocok bagi metabolisme (Benefield dan Randall, 1980).
Pada dasarnya proses biologi proses dimana terjadi pengkondisian zat-zat organik atau anorganik sebagai substrat untuk metabolisme mikroorganisme yang terlibat di dalam proses. Selain dimanfaatkan, mikroorganisme juga akan menstabilkan
14
sebagian zat organik dengan mengoksidasinya menjadi karbon dioksida (Gaudy, 1981). Sehingga dengan demikian proses biologi lebih kepada pengaturan kondisi lingkungan proses dan mengharapkan respon mikroorganisme dalam berinteraksi dengan lingkungannya sesuai dengan tujuan yag diharapkan.
Secara prinsip, penerapan proses biologi untuk pengolahan limbah cair terbagi atas proses pertumbuhan tersuspensi (suspended-growth process) dan proses pertumbuhan terlekat (attached growth process) atau biofilm. Pada pertumbuhan tersuspensi, mikroorganisme yang berperan dalam proses pengolahan dijaga dalam suspensi cair dengan metode pengadukan tertentu yang sesuai. Banyak proses pertumbuhan tersuspensi yang diterapkan untuk pengolahan limbah cair domestik perkotaan terpadu maupun pengolahan limbah cair industri dioperasikan dengan menggunakan konsentrasi oksigen terlarut (aerob). Namun demikian terdapat pula pengolahan dengan proses pertumbuhan tersuspensi yang dijalankan dalam reaktor anaerob (tidak ada oksigen), yaitu untuk limbah cair maupun sludge yang berasal dari industri dengan konsentrasi organik yang tinggi (Metcalf and Eddy, 2004). Sedangkan pada proses pertumbuhan terlekat, mikroorganisme yang berperan berada dalam posisi melekat pada medium inert seperti batu, slag, atau material khusus yang terbuat dari plastik atau keramik. Proses pertumbuhan terlekat dikenal juga sebagai fixed-film process (Metcalf dan Eddy, 2004).
Berdasarkan lingkungan proses, pengolahan biologis terbagi menjadi proses aerob dan proses anaerob. Pada proses aerob, konsentrasi oksigen terlarut berada dalam jumlah yang cukup sehingga tidak menjadi pembatas laju pertumbuhan mikroba. Sementara pada proses anaerob, oksigen terlarut kurang atau tidak terdapat dalam jumlah yang memadai sehingga materi lain selain oksigen bertindak sebagai penerima elektron.
15 Lembar kertas Hasil cetak Cacat/reject Hasil cetak cacat sebagian Hasil cetak 100% bagus
Hasil cetak 100% bagus Cetak Offset Pengkondisian Hasil cetak Cetak intaglio pertama Pengkondisian hasil cetak Cetak intaglio kedua Pengkondisian hasil cetak Pemeriksaan kualitas hasil cetak
Cetak nomor seri
Pemeriksaan kualitas hasil cetak
Cutting, wrapping & packing
otomatis
Cutting, wrapping & packing manual Perusakan dengan punching Produk cacat/reject Produk bagus C U S T O M E R Sorting Cutting, wrapping & packing manual Perusakan
dengan punching
16
Gambar II.3. Unit cetak Intaglio (Leach, 1989)
Berdasarkan konfigurasi reaktornya, proses biologis terbagi atas continuous-flow strirred reactor (CSTR) baik single stage, maupun multi stage; batch reactor; Plug-flow reactor (PFR); Packed tower; dan Rotating-disc reactor (Grady dan Lim, 1980).
2.3. Sistem pengolahan Anaerob
Pada awalnya sistem pengolahan anaerob, dalam hal ini diistilahkan sebagai oksidasi dan fermentasi anaerob, digunakan untuk mengolah limbah sludge dan limbah organik kuat. Namun demikian, penerapan sistem ini pada aliran limbah cair juga telah dilakukan dan menjadi semakin jamak dilakukan.
Proses fermentasi anaerobik merupakan proses yang menguntungkan karena rendahnya yield biomassa yang dihasilkan dan karena energi dalam bentuk metana dapat diambil dari konversi biologis dari substrat organik. Meskipun sebagian
Sistem penintaan Rol silinder penintaan
Rol pembersih
Bak tempat solcen dilengkapi dengan sikat putar
Lapisan tinta yang tebal Rol penekan (impression)
dengan bahan penekan berupa lapisan sejenis kapas atau karet
17
besar proses fermentasi dilakukan pada kisaran temperatur mesofilik (30 – 35oC), saat ini terjadi peningkatan peminatan khususnya pada fermentasi thermophilic atau sebelum fase fermentasi mesofilik.
Gambar II.4. Skema proses cetak Intaglio dan keberadaan larutan penyapu (wiping solution)3
Untuk mengolah limbah cair industri dengan beban yang tinggi, proses anaerobik ternyata mampu menjadi alternatif sebagai proses yang sangat cost-effective dibandingkan dengan proses aerobik, dengan penghematan pada aspek energi, penambahan nutrisi, dan volume reaktor. Karena efluen yang dihasilkan tidak sekualitas dengan hasil olahan dari proses aerob maka pengolahan anaerob ini pada umumnya digunakan sebagai pretreatment atau pengolahan awal, yang selanjutnya dapat diikuti dengan proses aerob.
Proses pengolahan limbah secara anaerobik merupakan metode yang efektif untuk pengolahan berbagai limbah organik. Pengolahan ini dimediasi oleh mikroorganisme fakultatif dan anaerob, dimana dengan ketiadaan oksigen, mengkonversikan materi organik menjadi produk akhir gas seperti karbon dioksida dan metana.
Hasil cetak intaglio
Limbah padat tinta
Limbah cair terolah Larutan penyapu
Larutan penyapu bercampur tinta
MESIN CETAK INTAGLIO Tinta Intaglio Lembaran kertas Unit penjernihan larutan penyapu dan pengolahan limbah cair
18
Gambar II.5. Skema aliran proses penjernihan larutan penyapu dan pengolahan limbah cair3 Karbon aktif Unit Coagulant & coagulant aid Filterpress UF 5μ Koagulasi & Flokulasi Filterpress Mesin-mesin cetak timbul Ground tank Holding tank Collecting tank Tangki Larutan Penyapu SCO NaOH Soft water Eva porator Clarifier UF 3μ Koagulasi & Flokulasi Kondesasi H2SO4 Coagulant & coagulant aid Konsentrat Sludge Sludge Netralisasi
19
2.3.1. Prinsip Umum Proses Anaerob
Secara umum, reaksi keseluruhan konversi senyawa organik secara anaerob ini adalah sebagai berikut (Bitton, 1994):
2.3.2. Tahapan pada Proses Anaerob
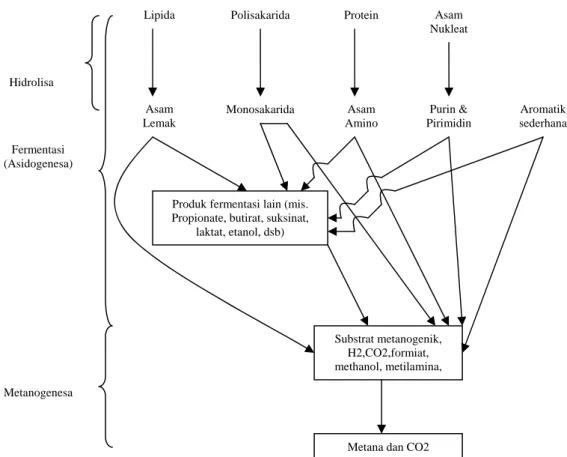
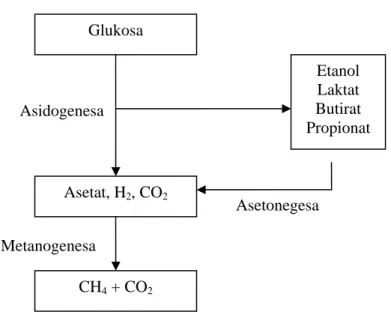
Terdapat tiga tahap dasar dari keseluruhan oksidasi limbah secara anaerob, yaitu : (1) hidrolisa; (2) fermentasi (atau disebut juga sebagai asidogenesa); dan (3) metanogenesa. Tiga tahap ini digambarkan pada Gambar II.6.
a. Hidrolisa
Tahap pertama ini dimana material partikulat dikonversi menjadi senyawa terlarut yang kemudian dapat dihidrolisa lebih lanjut menjadi monomer simpel untuk kemudian digunakan oleh bakteri untuk melakukan fermentasi, dinamakan hidrolisa. Untuk beberapa jenis limbah cair, fermentasi bisa jadi merupakan tahap awal proses anaerob .
b. Fermentasi atau Asidogenesa
Pada tahap ini asam amino, gula, dan beberapa asam lemak terdegradasi. Substrat organik menyediakan donor elektron dan akseptor. Produk utama dari tahap ini adalah asetat, hidrogen, CO2, propionat dan butirat. Propionat dan
butirat terfermentasi lebih lanjut menjadi hidrogen, CO2 dan asetat. Sehingga
produk akhir dari fermentasi ini (asetat, hidrogen dan CO2) merupakan
precursor bagi pembentukan metana (metanogenesa). c. Metanogenesa
Tahap ini dilakukan oleh sekumpulan organisme yang dikenal secara kolektif sebagai methanogens. Dua kelompok dari organisme metanogenik terlibat dalam pembentukan metana. Kelompok yang pertama disebut sebagai asetpclastic methanogens, mengubah asetat menjadi metana dan karbon dioksida. Sedangkan kelompok yang kedua, yang dinamakan hydrogen-utilizing methanogens, menggunakan hidrogen sebagai donor elektron dan CO2 sebagai ekseptor elektron untuk menghasilkan metana. Bakteri dalam
proses anaerob, yang disebut sebagai acetogens, juga mampu menggunakan CO2 untuk mengoksidasi hidrogen dan membentuk asam asetat. Namun
20
demikian, asam asetat akan terkonversi menjadi metana, sehingga dampak dari reaksi ini sangat kecil. Sebagaimana ditunjukkan pada Gambar 2.7. sekitar 72% metana yang dihasilkan dari proses anaerob berasal dari pembentukan asam asetat (Metcalf & Eddie, 2004).
2.3.3. Kelompok Bakterti pada Proses Anaerob
Mikroorganisme yang dominan dalam proses anaerob ini adalah bakteri. Sejumlah besar bakteri anaerob dan fakultatif, seperti Bacteroides, Bifidobacterium, Clostridium, Lactobacillus, Streptococcus, terlibat dalam proses hidrolisa dan fermentasi senyawa organic. Terdapat 4 (empat) kategori bakteri yang berinteraksi secara sinergi pada tranformasi material kompleks menjadi molekul yang sederhana seperti metana dan CO2 seperti yang dapat dilihat pada Gambar II.7.
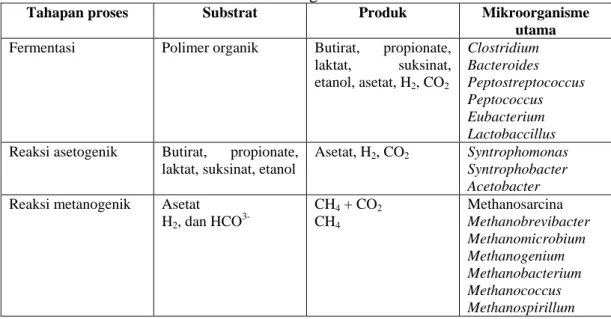
(Bitton, 1994). Beberapa strain penting methanogens menurut Krishna Nand, 1999 adalah Methanobacterium ruminantium, Methanothermo autotrophicum, Methanothermo autotrophicum (Rao, 2005). Sementara Prescott (2005) menunjukkan mikroorganisme utama yang berperan dalam tahapan reaksi biologis anaerob yang menggunakan limbah organik adalah sebagaimana Tabel II.1.
Tabel II.1. Korelasi Tahap Proses pada Anaerobik dengan Substrat, Produk, dan Mikroorganisme Utama
Tahapan proses Substrat Produk Mikroorganisme
utama
Fermentasi Polimer organik Butirat, propionate, laktat, suksinat, etanol, asetat, H2, CO2 Clostridium Bacteroides Peptostreptococcus Peptococcus Eubacterium Lactobaccillus
Reaksi asetogenik Butirat, propionate, laktat, suksinat, etanol
Asetat, H2, CO2 Syntrophomonas
Syntrophobacter Acetobacter
Reaksi metanogenik Asetat H2, dan HCO 3-CH4 + CO2 CH4 Methanosarcina Methanobrevibacter Methanomicrobium Methanogenium Methanobacterium Methanococcus Methanospirillum (Sumber : Prescott, 2005)
21
Gambar II.6. Skema proses anaerob : hidrolisa, asidogenesa, dan metanogenesa (Metcalf and Eddy, 2004)
Gambar II.7. Aliran karbon dan hidrogen pada proses anaerob (Metcalf dan Eddy, 2004) (Eckenfelder, 2000)
Substrat metanogenik, H2,CO2,formiat, methanol, metilamina,
Metana dan CO2 Produk fermentasi lain (mis.
Propionate, butirat, suksinat, laktat, etanol, dsb) Asam Lemak Monosakarida Asam Amino Purin & Pirimidin Aromatik sederhana Lipida Polisakarida Protein Asam
Nukleat Hidrolisa Fermentasi (Asidogenesa) Metanogenesa 52% Asam organik yg lebih tinggi H2 Asam Asetat CH4 Organik kompleks 4% 76% 20% 24% 28% 72% Hidrolisa dan fermentasi Tahap 1 Asetogenesa dan dehidrogenasi Tahap 2 Metanogenesa Tahap 3
22
Bakteri Hidrolitik. Kelompok bakteri ini akan memecah molekul organik
kompleks, seperti protein, selulosa, lignin, dan lipida) menjadi molekul monomer terlarut seperti asam amino, glukosa, asam lemak, dan gliserol. Proses hidrolisa molekul kompleks ini dikatalisa oleh enzim seluler seperti selulose, protease, dan lipase. Fase hidrolisis ini relatif lambat dan bisa menjadi pembatas pada proses anaerob untuk limbah cair yang mengandung senyawa selulotis seperti lignin.
Bakteri Fermentatif Asidogenik (penghasil asam). Bakteri asidogenis (bakteri
pembentuk asam) mengubah gula, asam amino, dan asam lemak menjadi asam organik (asam asetat, propionate, format, laktat, butirat, atau suksinat), alkohol dan keton (etanol, metanol, gliserol, dan aseton), CO2 dan H2. Asam asetat
merupakan produk utama fermentasi karbohidrat. Pembentukan produk fermentasi dapat bervariasi tergantung tipe bakteri dan kondisi lingkungan (pH, temperatur, dan potensial redoks).
Bakteri Asetogenik (penghasil asetat). Bakteri asetogenis (bakteri asetat dan H2)
seperti Syntrobacter wolini dan Syntrophomonas wolfet mengubah asam-asam lemak (asam propionat dan butirat) dan alkohol menjadi asetat, H2, dan CO2 yang
kemudian digunakan oleh bakteri metanogen.
Bakteri Metanogenik (penghasil metana). Bakteri ini dibagi atas dua
subkategori, yaitu Hydrogenotrophic methanogens, dan Acetotropihic methanogens. Hydrogenotrophic methanogens berperan mengkonversi hidrogen dan karbon dioksida menjadi metana sesuai dengan persamaan reaksi :
CO2 + 4H2 Æ CH4 + 2H2O
metana
Sedangkan Acetotropihic methanogens mengkonversi asetat menjadi metana melalui persamaan di bawah ini:
CH3COOH Æ CH4 + 2H2O metana
23
Gambar II.8. –Kelompok bakteri metabolis pada proses anaerob (Koster, 1988 dikutipdari Bitton, 1994)
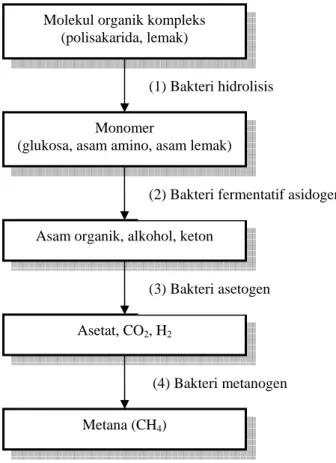
Kelompok bakteri diatas dapat digolongkan menjadi dua kelompok besar bakteri, yaitu : (1) bakteri non-metanogenik yang terdiri dari bakteri hidrolitik, bakteri asidogenik, bakteri peghasil asam dan penghasil hidrogen; dan (2) bakteri metanogenik yang terdiri dari bakteri penghasil metana (Grady dan Lim, 1980).
Senyawa organik yang akan dikonsumsi terlebih dahulu mengalami proses pelarutan dan reduksi ukuran molekul untuk dapat memudahkan traspor melewati membran sel (Grady dan Lim, 1980). Reaksi yang memungkinkan terjadinya pelarutan dan reduksi ukuran ini adalah reaksi hidrolisa yang dibantu oleh enzim sebagai katalisator yang telah terlebih dahulu dihasilkan oleh bakteri. Molekul senyawa organik hasil hidrolisa oleh bakteri non-metanogenik digunakan sebagai sumber karbon dan energi dalam reaksi yang disebut fermentasi. Produk akhir dari tahapan fermentasi adalah asam-asam volatil rantai pendek, asam-asam non volatil, dan alkohol serta H2 dan CO2, yang disebut sebagai tahapan asidogenesa
Molekul organik kompleks (polisakarida, lemak)
Monomer
(glukosa, asam amino, asam lemak)
Asam organik, alkohol, keton
Asetat, CO2, H2
(1) Bakteri hidrolisis
(2) Bakteri fermentatif asidogen
(3) Bakteri asetogen
(4) Bakteri metanogen Metana (CH4)
24
dan organisme pengubahnya disebut dengan acid-producing bacteria (bakteri penghasil asam). Gas hidrogen dihasilkan melalui tahapan hidrogenesis oleh bakteri penghasil hidrogen. Asam-asam volatil, asam-asam non-volatil dan alkohol diubah menjadi asam asetat oleh bakteri pembentuk asam, tahapan ini disebut dengan tahapan asetogenesa, untuk kemudian digunakan sebagai substrat bagi bakteri metana, dalam proses yang disebut sebagai metanogenesa.
Kelompok bakteri metanogenik ini sangat sensitif terhadap perubahan substrat, sehingga bergantung pada bakteri non-metanogenik untuk mencukupi kebutuhan substratnya.
2.3.4. Alur Degradasi Komponen Organik Secara Anaerob
Senyawa organik terdiri dari tiga kelompok utama, yaitu karbohidrat, protein, dan minyak lemak. Sebagian besar bahan organik tersebut terurai menjadi piruvat sebagai produk antara. Piruvat merupakan produk antara yang umumnya terbentuk dari penguraian karbohidrat maupun senyawa organik lainnya oleh sebagian besar mikroorganisme (Gaudy dan Gaudy, 1981). Sedangkan minyak lemak yang lebih sukar terurai, tidak menggunakan piruvat sebagai produk antara (Grady dan Lim, 1980; Gaudy dan Gaudy, 1981).
2.3.4.1. Fermentasi Alkohol
Pada fermentasi alkohol ini, glukosa dapat didegradasi menjadi piruvat dan dengan enzim piruvat dekarboksilase dan alkohol dehidrogenase yang dihasilkannya dapat membentuk etanol. Reaksi piruvat dekarboksilase menguraikan piruvat menjadi asetil-CoA. Asetil-CoA berfungsi sebagai prekursor utama pembentukan asetaldehid. Selanjutnya asetaldehid akan membentuk etanol dengan reaksi alkohol dehidrogenase. Reaksi-reaksi yang terjadi dapat dilihat sebagai berikut (Gaudy dan Gaudy, 1981):
Reaksi Piruvat dekarboksilase:
CH3COCOOH Æ HCOOH + CH3COScoA
25 Reaksi alcohol dehidrogenase:
CH3COSCoA Æ CH3COH Æ CH3CH2OH
(asetil CoAa) (asetaldehid) (etanol)
2.3.4.2. Fermentasi Laktat
Laktat merupakan produk yang sering terbentuk dari fermentasi berbagai tipe mikroorganisme (Gottschalk, 1986). Terdapat tiga jalur yang utama bagi pembentukan laktat dari glukosa, yaitu :
a. Homofermentative
C6H12O6 Æ 2 CH3CHOHCOOH
(Glukosa) (asam laktat) b. Heterofermentative
C6H12O6 Æ CH3CHOHCOOH + C2H5OH + CO2
(Glukosa) (asam laktat) (etanol) c. Bifidium
C6H12O6 Æ 3 CH3COOH + CH3CHOHCOOH
(Glukosa) (asam asetat) (laktat)
2.3.4.3. Fermentasi Butirat
Butirat dapat terbentuk dari degradasi glukosa melalui piruvat dan asetil-CoA, dengan reaksi akhir sebagai berikut :
C6H12O6 Æ CH3CH2CH2COOH + 2 CO2 + 2 H2
(Glukosa) (asam butirat)
2.3.4.4. Fermentasi Propionat dan Suksinat
Propionat juga merupakan produk utama dari fermentasi bermacam-macam bakteri anaerob. Beberapa diantara bakteri anaerob ini memfermentasi glukosa menjadi propionat, asetat dan CO2.
1,5 C6H12O6 Æ 2 CH3CH2COOH + CH3COOH + CO2
26
Akan tetapi substrat utama bagi bakteri pembentuk propionat ini adalah laktat. Terdapat dua alur pembentukan propionat dari laktat yaitu alur akrilat dan alur suksinat-propionat.
a. Alur akrilat
Pada alur akrilat akan membentuk propionat, asetat dan H2O:
3 CH3CHOHCOOH Æ 2 CH3CH2COOH + CH3COOH + H2O
(asam laktat) (asam propionat) (asam asetat) b. Alur Suksinat-Propionat
Pada alur suksinat-propionat, laktat akan membentuk propionat: 3 CH3CHOHCOOH Æ 2 CH3CH2COOH + H2O
(asam laktat) (asam propionat)
Suksinat juga merupakan produk antara pembentukan propionat, namun dapat juga sebagai produk akhir fermentasi piruvat.
2.3.4.5. Fermentasi Format
Pembentukan format dari glukosa adalah melalui piruvat. Piruvat akan membentuk format dan asetil-CoA.
CH3COCOOH Æ HCOOH + CH3OCSCoA
(asam piruvat) (asam format) (Asetil-CoA)
Pada kondisi asam (pH dibawah 7), format mudah terurai menjadi CO2 dan H2
(Gaudy dan Gaudy, 1981):
HCOOH Æ CO2 + H2
(Format)
2.3.4.6. Fermentasi Asetat
Beberapa jenis bakteri dapat memfermentasi piruvat menjadi asetat melalui asetil-CoA. Bakteri ini dapat menggunakan fosfat sebagai sumber energi sehingga asetil-CoA dapat berubah menjadi asetilfosfat yang selanjutnya akan membentuk asetat:
27
CH3OCSCoA CH3-OPO3H2 CH3COOH
(asetil-CoA) (asetilfosfat)
Selain reaksi diatas, asetat juga dapat terbentuk melalui bermacam-macam reaksi. Asetat dapat terbentuk dari etanol, laktat, propionat, dan butirat, dengan reaksi sebagai berikut (Syafila, 1991; Stams, 1980):
CH3CHOHCOO- + 2H2O CH3COO- + HCO3- + H+ + 2H2
(asam laktat) (asam asetat)
CH3CH2OH + H2O CH3COO- + H+ + 2H2
(asam laktat) (asam asetat)
CH3CH2COO- + 3H2O CH3COO- + HCO3- + H+ + 3H2
(asam propionat) (asam asetat) CH3CH2COO- + 2H2O 2CH3COO- + H+ + 2H2
(asam butirat) (asam asetat)
Asetat juga dapat terbentuk dari H2 dan CO2 (Gottschalk, 1986, dikutip dari
Tantri, 1994 ).
4H2 + 2CO2 CH3COO- + 2H2O
(asam asetat)
2.3.4.7. Fermentasi Substrat Metanogenesa
Fermentasi asam-asam yang terbentuk pada tahap metanogenesa menjadi substrat bagi proses metanogenesa dapat dilihat pada Gambar II.9.
Dari Gambar II.9. dapat dilihat bahwa substrat bagi proses metanogenesa adalah format, asetat, dan juga CO2 dan H2. Akan tetapi menurut Sahm, 1984, substrat
utama bagi metanogenesa adalah asetat. Weber, et.al., 1984, mengatakan bahwa 65% hingga 96% dari total metana yang dihasilkan pada proses anaerob berasal dari penguraian asetat (Tantri, 1994).
28
Gambar II.9. Tahapan pembentukan metana (Syafila, 1991, dikutip dari Tantri, 1994)
Pembentukan metana dari asetat dapat dilihat dari reaksi berikut (Syafila, 1991, dikutip dari Tantri, 1994):
CH3COOH Æ CH4 + H2O
(asam asetat) (metana)
Sedangkan pembentukan metana dari format dapat dilihat pada reaksi berikut (Syafila, 1991, dikutip dari Tantri, 1994):
4HCOO- + 2H2O Æ OH- + 3HCO3- + CH4
(Asam format)
Format bukan merupakan substrat utama bagi metanogenesa karena kecenderungannya untuk berubah menjadi CO2 dan H2 (Zeikus, 1977, dikutip dari
Tantri, 1994), sehingga akan membentuk metana dengan reaksi :
4CO2 + 32H2 Æ 4CH4 + 8H2O (Metana) Asetonegesa Metanogenesa Asidogenesa Asetat, H2, CO2 CH4 + CO2 Glukosa Etanol Laktat Butirat Propionat
29
2.3.5. Potensi Biodegradabilitas Beberapa Senyawa Organik Tertentu dalam Limbah Cair dengan Proses Anaerob
Sebagaimana disebutkan pada sub bab 1.1., limbah cair Perusahaan Security Printing X mengandung beberapa senyawa yang perlu mendapatkan perhatian khusus, yaitu fenol, surfaktan, kobalt, amoniak bebas dan minyak lemak. Khusus untuk minyak lemak, dari hasil uji karakterisasi terlihat bahwa kadar minyak lemak menurun cukup signifikan setelah melalui proses flokulasi-koagulasi yang dilanjutkan dengan penggunaan ultrafiltrasi 2 tahap dengan filter 2 dan 5 mikron.
Terdapat tiga golongan utama dalam senyawa organik, yaitu alifatik, aromatik dan heterosiklik. Senyawa alifatik memiliki ciri-ciri gugus terangkai lurus atau merupakan percabangan dari rantai karbon. Senyawa aromatik terangkai dalam lingkaran yang terdiri dari enam karbon yang mengandung tiga ikatan rangkap secara berselang. Sedangkan heterosiklik memiliki sebuah struktur lingkaran dengan atau tanpa struktur ikatan rangkap dan di dalamnya paling tidak satu unsur merupakan unsur lain selain karbon.
Senyawa organik yang akan dibahas berikut ini meliputi surfaktan, minyak lemak dan fenol.
2.3.5.1. Surfaktan
Nilai MBAS merepresentasikan keberadaan senyawa surfaktan pada limbah cair, terutama menunjuk pada penggunaan senyawa sulfonated castor oil (SCO) pada proses produksi. Skema alur biodegradasi surfaktan secara anaerob digambarkan pada Gambar II.10 (Vath, 1960) dikutip dari (Syafila, 1997).
2.3.5.2. Minyak Lemak
Limbah cair Perusahaan Security Printing X ini mengandung sisa-sisa tinta intaglio yang terlarutkan di dalam larutan penyapu. Salah satu komponen tinta, yaitu oil baik vegetable oil maupun petroleum oil memberikan kontribusi cukup besar terhadap nilai COD dan BOD, dilihat dari persentase keberadaan oil sebagai
30
salah satu komponen penyusun tinta. Secara global, komposisi tinta (dalam %) adalah sebagaimana Tabel II.2.
Gambar II.10. – Alur biodegradasi anaerob surfaktan (Syafila, 1997)
Minyak dan lemak merupakan bagian dari lipida yang tergolong dalam lipida sederhana. Minyak dan lemak (oil and grease) merupakan ester dari bermacam-macam asam lemak dan sebagian alkohol (gliserol). Jika dibandingkan dengan asam-asam lemak, gliserol hanya merupakan sebagian kecil dari molekul-molekul yang terlibat dalam pembentukan ester. Oleh karena itu pada umumnya sifat-sifat fisik maupun kimia lipida ditentukan oleh asam-asam lemak ini.
Tabel II.2. Persentase komponen penyusun tinta intaglio3
Komponen Tinta Persentase
Varnish
- resin
- oil (vegetable oil) - additive 15 – 40 15 – 40 0 – 4 ________ 15 – 40 Pigment 11 – 20 Extender 10 – 15 Wax 1 – 4 Dryer 2 – 4
Solvent petroleum oil 0 – 30
Materi sel inert Fungsi nonsintesis Protoplasma baru CO2, NO3, SO4 organik teroksigenasi N, P (Trace mineral) Bakteri pembentuk asam
dan metan
SURFAKTAN
Energi + H2S + organik tereduksi +
Asam Organik N2, H2,
CO2, H2O
NH3
31
Asam-asam lemak ini berada dalam alam sebagai hasil dari metabolisme mikroorganisme dari bermacam-macam senyawa atau berasal dari sebagian hewan dan tumbuhan yang mati. Dapat dilihat dari persamaan reaksi diatas bahwa jika ester terbentuk, suatu atom hidrogen dari alkohol dan satu hidroksil dari kelompok karboksil asam dikeluarkan sebagai air. Jika reaksi kebalikannya, yaitu jika minyak lemak (trigliserida) terurai menjadi asam-asam lemak dan alkohol (hidrolisa), air ditambahkan.
Asam-asam lemak rantai pendek terutama asetat, propionat, dan butirat pada umumnya diketahui sebagai asam-asam volatil karena asam-asam ini dapat menguap (terdestilasi) pada tekanan atmosfir (Gaudy dan Gaudy, 1981). Penentuan asam-asam volatil menjadi penting dalam kontrol polusi lingkungan karena asam-asam ini merupakan produk mikrobiologi dari penguraian molekul-molekul rantai panjang (makromolekul-molekul) yang sebagian besar dihasilkan dari pengolahan secara anaerob.
2.3.5.3. Fenol
Fenol merupakan senyawa aromatik yang paling penting, hadir dengan beberapa jenis yaitu monohidroksil (memiliki satu gugus hidroksil), cresol dan alkil fenol (memiliki gugus alkil), fenol yang terklorimasi, serta polihidroksi fenol (fenol dengan lebih dari satu gugus OH) gugus (memiliki satu gugus hidroksil digolongkan sebagai dalam bentuk monohidroksi fenol, cresol dan alkil fenol, serta fenol yang terklorinasi. Fenol tergolong dalam senyawa aromatik yang memiliki karakteristik adanya minimal satu cincin benzena. Probabilitas kehadiran fenol di dalam limbah cair Perusahaan Security Printing X ini berasal dari komponen penyusun pigmen dan dye di dalam tinta.
Sebuah alur degradasi benzoat dan fenol menjadi metana dan karbon dioksida dipublikasikan Evans, 1970. Asam heptanoat terbentuk dari reduksi asam sikloheksana karboksilat. Produk antara yang diajukan untuk prekursor asam heptanoat adalah 1-methylcyclohexanone yang dikonversikan menjadi heptanoat dengan penambahan air. Alur Evans ini dapat dilihat pada Gambar II.12. Suatu
32
alur untuk degradasi fenol dan asam benzoat lain berdasarkan hasil penelitian Chmielowski (1965a, 1965b, 1966) dan Williams dan Evans (1973) diajukan oleh Neufeld, 1980, sebagaimana Gambar II.11. (Syafila, 1997).
2.3.6. Penghilangan Warna pada Proses Anaerob
Industri percetakan menggunakan zat penghasil warna yaitu dari penggunaan tinta. Meyer et. al. (1981) melaporkan bahwa penghilangan warna pada kondisi anaerob relatif lebih dan menghasilkan penghilangan warna yang jauh lebih baik daripada kondisi aerob. Terdapat dua hipotesa proses penghilangan warna secara biologi dengan memanfaatkan mikroorganisme, yaitu secara ekstraselular dan intraselular (Yonas A.K., 2001).
Di Indonesia, belum ada peraturan perundangan yang membatasi konsentrasi warna limbah cair. Kep-51/MENLH/10/1995 maupun Kep Gub Jabar No. 6 Tahun 1999 tentang Baku Mutu Limbah Cair Bagi Kegiatan Industri menetapkan parameter fisika dan kimia yang umum digunakan.
Salah satu peraturan di Jerman, yaitu Wasserhaushaltsgesetz (WHG) atau Undang-Undang Air Buangan Domestik Negara Jerman, pada Appendiks 38 pasal 7a Tahun 1993 tentang batasan warna dalam air buangan menetapkan angka tembus pandang warna (Durchsichtsfarbzahl disingkat DFZ) maksimal yang diperbolehkan. Angka ini dihitung dengan menggunakan persamaan Sosath, 1999 (dikutip dari Yonas, 2001) sebagai berikut :
d V EXT
DFZ = . ... (2.1.) Dimana:
DFZ : angka tembus pandang warna (m-1) EXT : Ekstensien (Absorbancy)
V : angka pengenceran
33
2.3.7. Faktor-faktor yang mempengaruhi proses anaerob 2.3.7.1. Temperatur
Temperatur merupakan faktor lingkungan yang dapat mempengaruhi pertumbuhan mikroorganisme. Hal tersebut disebabkan karena mikroorganisme tidak mempunyai sistem pengatur suhu sel. Di dalam kultur mikroba, temperatur sel sama dengan temperatur lingkungannya sehingga semua reaksi biokimia yang terjadi di dalam sel dipengaruhi oleh temperatur lingkungannya (Esener et al, 1981).
Proses anaerob akan berjalan dengan efektif pada dua kisaran suhu, yaitu kisaran mesofilik (29 – 38oC) dan kisaran termofilik (49 – 57oC). Meskipun laju reaksi jauh lebih besar pada kisaran suhu termofilik, namun pengendalian pada temperatur yang lebih tinggi terbukti kurang ekonomis (Eckenfelder, 2000).
Gambar II.11. – Alur degradasi benzoat dan fenol menurut Evans, 1970 (Syafila, 1997) H2O CO2 CH4 CO2 Benzoat 2-oxocyclohexane-carboxylate Methyl-cyclohexanone Heptanoate Valerat Butirat Propionat Asetat Format Hidrogen Pimelate
Fenol Cyclohexanone Caproate
Adipate
34
Dalam proses penguraian bahan organik dikenal adanya tiga kelompok bakteri yang dapat melangsungkan metabolisme dalam kondisi suhu yang berbeda. Ketiga kelompok tersebut adalah kelompok bakteri cryophilic atau psychopohilic, mesophilic dan thermophilic (Tabel II.3.)
Tabel II.3. Kondisi Penguraian Bahan Organik
Kondisi Rentang suhu, oC Suhu optimum, oC
Cryophilic atau
psychopohilic
-2 ~ 30 12 ~ 18
Mesophilic 20 ~ 45 25 ~ 40
Thermophilic 45 ~ 75 55 ~ 65
Sumber : Metcalf dan Eddy, 2004
Pengolahan secara anaerob pada umumnya didesain pada kondisi mesophilic (Grady Lim, 1980). Temperatur optimum untuk proses anaerob adalah 37oC (Sixt dan Sahm, 1987). Pengolahan dengan sistem ASBR mampu mencapai lebih dari 90% penyisihan COD terlarut dan BOD5 pada rentang suhu kamar, yaitu 20°C dan
25°C (Dague et. al., 1998).
Gambar II.12. Alur degradasi fenol dan asam benzoat menurut Neufeld, 1980 (Syafila, 1997) Fenol Cyclohexanol CH3(CH2)5OH Hexanol CH3(CH2)4COOH Asam Heksanoat CH3(CH2)2COOH Asam Butirat Asam Benzoat 1-cyclohexane
carboxylate CH3(CH2)5COOH Asam Heptanoat CH3(CH2)3COOH Asam Valerat CH3CH2COOH Asam Propionat
35
2.3.7.2. pH
Beberapa jenis limbah cair mengandung materi asam atau basa sehingga diperlukan proses netralisasi sebelum dibuang ke badan air penerima ataau sebelum diolah dengan proses kimia ataupun proses biologis. Pengaruh pH dalam proses anaerob adalah terhadap aktifitas mikroorganisme. Aktifitas bakteri pada proses anaerob pada umumnya berlangsung baik pada pH 6 – 8 (Sahm, 1984). Tahap pembentukan asam stabil pada selang pH 6 – 6.5 (Sixt dan Sahm 1987), sedangkan untuk tahap pembentukan metana akan berlangsung baik pada selang pH netral ( 6,8 - 7,2). Organisme metana bekerja pada pH 6.6 hingga 7.6 dengan pH optimum mendekati 7 (Eckenfelder, 2000). Sedangkan menurut Speece, 1996, kondisi optimum pembentukan metana adalah pada pH 6,5 – 8,5 (Chaerul, 2001). Dalam lingkungan asam, kehidupan dan aktifitas bakteri metanogenik akan menurun.
Pengaruh pH terhadap populasi bakteri non-metanogenik adalah terutama terhadap jenis produk yang dihasilkan. Jika hal ini terjadi maka akan mengakibatkan berubahnya jenis substrat yang tersedia bagi kelompok bakteri metanogenik. Seperti yang telah diketahui sebelumnya, bakteri metanogenik sangat sensitif terhadap perubahan sustrat yang dihasilkan dari tahap asidogenesa. Adanya perubahan substrat ini dapat menyebabkan pertumbuhan bakteri metanogenik terganggu, sehingga pada akhirnya hal ini akan mempengaruhi proses secara keseluruhan.
Proses anaerob menghasilkan sejumlah asam-asam volatil pada tahap asidogenesa. Asam-asam tersebut akan menurunkan nilai pH reaktor jika tidak segera diubah menjadi gas metana oleh kelompok bakteri metanogenik. Penurunan pH ini akan menghambat juga pertumbuhan bakteri metanogenik. Dengan demikian, perlu dilakukan pengontrolan pH agar proses secara keseluruhan berjalan baik.
Pengontrolan pH dapat dilakukan dengan jalan mengontrolnya dari luar sistem yaitu dengan menambah bahan kimia yang dapat menaikkan atau menurunkan
36
nilai pH. Selain itu dari dalam reaktor sendiri pH dapat berjalan dengan adanya sistem penyangga (buffer system).
Dalam proses anaerob, kapasitas penyangga pada umumnya ditunjukkan dengan adanya alkalinitas. Alkalinitas ini antara lain berasal dari kelarutan CO2 dalam air
yang dihasilkan asam karbonat. Meskipun kelarutan CO2 dalam air tidak stabil,
tetapi asam karbonat yang terjadi akan membentuk reaksi kesetimbangan dengan bikarbonat yang kemudian berfungsi sebagai penyangga ion hidrogen (Sawyer dan Mc.Carty, 2003).
2.4. Circulating Bed Reactor (CBR)
Laju perubahan substrat dalam suatu bioreaktor dapat ditingkatkan dengan meningkatkan retensi biomasa dalam sistem. Retensi bakteri asetogenik dan bakteri metanogenik dapat ditingkatkan jika tegangan geser yang dihasilkan dari suatu sistem pengadukan rendah dan efektivitas pengadukan yang tinggi.
Pengadukan yang efektif dari suatu bioreaktor diperlukan agar semua elemen dalam cairan mendapatkan komposisi yang sama sehingga kondisi tiap-tiap elemen volume dalam reaktor menjadi sama (Atkinson, 1974) dan juga agar penyediaan nutrien bagi sel-sel tersedia merata. Menurut Brauer, 1979, terdapat empat fungsi pengadukan, yaitu:
1. Untuk mendapatkan pergerakan fluida yang diinginkan dalam reaktor. 2. Untuk mendapatkan luas inter fasial yang diinginkan antara gas dan cairan
dan distribusinya dalam reaktor.
3. Untuk mendapatkan kondisi-kondisi yang diinginkan dengan mengontrol diameter gelembung dan pergerakan gelembung dalam reaktor.
4. Untuk mendapatkan suatu kondisi yang memungkinkan suatu reaksi dapat berjalan dalam suatu suspensi biologis.
Salah satu sistem pengadukan adalah sistem pengadukan dengan menggunakan pengaduk mekanis dan dengan mengunakan gas yang disemburkan.
37
Salah satu desain reaktor dengan menggunakan pengadukan gas adalah CBR. Pengadukan pada CBR menggunakan gas atau resirkulasi gas yang disemburkan melalui piringan berlubang pada dasar reaktor untuk mendapatkan sirkulasi.
CBR merupakan modifikasi dari bubble column yang didasarkan pada energi pengangkatan udara untuk mendapatkan pengadukan. Pada reaktor ini udara atau gas yang diresirkulasikan dimasukkan melalui piringan berlubang pada dasar reaktor sehingga dihasilkan resirkulasi partikel dalam reaktor.
2.5. Anaerobic Sequencing Batch Reactor (ASBR)
Proses anaerobic sequencing batch reactor (ASBR) dapat dikategorikan sebagai proses pertumbuhan tersuspensi dengan reaksi dan pemisahan zat padat-zat cair dalam satu tangki, hampir sama dengan aerobic sequencing batch reactor. Speece, 1996 menyatakan bahwa keberhasilan ASBR tergantung pada terjadinya pengendapan sludge yang tergranulasi sebaik mungkin sebagaimana halnya pada proses UASB (Upflow Anaerobic Sludge Blanket). Selama periode reaksi, pengadukan yang intermitten selama beberapa menit setiap jam dilakukan untuk mendapatkan distribusi yang merata antara substrat dan padatan (Sung dan Bague, 1995). Unsur kritis pada proses ASBR adalah kecepatan pengendapan sludge selama periode pengendapan sebelum dekantasi efluen. Waktu pengendapan yang biasa digunakan adalah 30 menit (Metcalf dan Eddie, 2004).
ASBR merupakan kombinasi antara reaktor kontinyu dan batch. Rangkaian reaktor yang digunakan adalah seperti pada Gambar II.13. ASBR ini merupakan modifikasi antara proses batch dan kontinyu, yaitu memiliki tahapan-tahapan yang masing-masing tahap dijalankan secara batch. Satu siklus operasional ASBR terdiri dari 5 tahap, yaitu : (1) Fill; (2) React; (3) Settle; (4) Decant / Draw; (5) Idle.
38
Gambar II.13. – Tahapan Operasi SBR (Metcalf and Eddy, 2004)
2.6. Kinetika Pengolahan Zat Organik pada SBR
Perubahan komposisi dan konsentrasi material yang terjadi di dalam reaktor merupakan faktor penting pada pengolahan limbah cair. Perubahan ini disebabkan karena adanya transport hidrolik material ke dan dari reaktor.
Desain proses biologi pada umumnya ditekankan pada laju berbagai komponen yang disisihkan dari air buangan dan laju biomasa yang dihasilkan di dalam reaktor. Pada kebanyakan proses biologi, digunakan penggolongan berdasarkan pada laju kinetika yang terjadi. Reaksi-reaksi yang didasarkan pada kinetikanya akan cenderung memiliki kemungkinan berbagai orde reaksi yang tergantung pada jenis organisme, substrat, maupun kondisi lingkungan (Bennefield & Randal, 1980).
Hubungan antara laju reaksi, konsentrasi reaktan dan orde reaksi dapat dinyatakan dengan persamaan sebagai berikut :
(
konsentrasi)
Laju = n ... (2.2) Atau dalam bentuk logaritma:
Log (Laju) = n log (konsentrasi) ... (2.3)
Influen Efluen Pengisian (Fill) Reaksi (React) Pengendapan (Settle) Pengurasan (Decant) Stabilisasi (Idle)
39
Persamaan ini dapat diaplikasikan pada hasil eksperimen dan dapat diinterpretasikan untuk memperoleh orde reaksi dan laju reaksi. Untuk suatu orde reaksi yang konstan, apabila bentuk logaritma laju perubahan konsentrasi reaktan pada rentang waktu tertentu dialurkan sebagai fungsi logaritmis dari konsentrasi reaktan, maka akan diperolah garis lurus. Garis lurus tersebut merupakan representasi dari orde reaksi.
Tiga metode yang dapat digunakan untuk menganalisa data kecepatan reaksi adalah aljabar, diferensial dan integral (Grady & Lim, 1980). Metode aljabar digunakan untuk data pada pengoperasian CSTR dalam keadaan tunak, dimana kecepatan reaksi dapat dihitung secara aljabar dengan menggunakan persamaan neraca massa keadaan tunak. Sedangkan metode integral dan diferensial digunakan untuk pengolahan data yang diperoleh dari reaktor batch yang mengekspresikan bentuk hubungan langsung kecepatan reaksi sebagai fungsi konsentrasi (Grady & Lim, 1980)
2.6.1. Kinetika Pengolahan pada Periode Pengisian (Fill)
Pada tahap pengisian ini terdapat aliran masuk tetapi tidak ada pengeluaran. Oleh karenanya kinetika pada tahap ini dikembangkan berdasarkan sistem fed batch operation dimana umpan dimasukkan secara kontinyu tanpa adanya pengeluaran. Pada sistem pertumbuhan kultur batch konsentrasi biomasa pada waktu tertentu dapat dinyatakan dengan persamaan (Shuler & Kargi, 1992):
(
S S)
YX
X = 0 + X/S. 0 − ... (2.4) Dimana:
S0 = konsentrasi substrat awal
Yx/s = koefisien yield
X0 = konsnetrasi biomasa awal
Pada saat konsentrasi biomassa mencapai nilai maksimum (Xm), konsentrasi
40
nutrien pada laju alir Q dengan konsentrasi substrat S0, jumlah total biomasa
dalam tangki adalah Xt = V.X, dimana V adalah volume kultur pada waktu t. Laju
peningkatan volume kultur adalah :
t Q V V . 0 + = ... (2.5.) Konsentrasi biomasa dalam tangki pada waktu t adalah :
V X
X = t ... (2.6.) Laju perubahan konsentrasi biomasa adalah:
2 V dt dV X dt dX V dt dX t t ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = ... (2.7.) Pada saat steady state persamaan (2.6.) menjadi:
0 . . .Q QYS X dt dV V X dt dX m t t = = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = ... (2.8.) Jika persamaan (2.7.) diintegrasi, maka akan menjadi :
t S Y Q t X Xt = 0 + . . 0. ... (2.9.)
Ketika semua substrat telah habis dikonsumsi, S = 0, dan X = Xm = Y.S0 maka dX/dt = 0. Keadaan ini disebut quasi steady state dimana laju penguraian substrat sama dengan laju penambahan substrat dalam influen. Kesetimbangan laju penyisihan substrat adalah :
Y X S Q dt dS t . t . ' 0 μ − = ... (2.10.) Bila μ/Y = k, maka persamaan (2.9.) menjadi :
(
X YS t)
k S Q X k S Q dt dS t t t . . . . . ' 0 0 0 0 − = − + = ... (2.11.) Integrasi persamaan tersebut menghasilkan :(
)
2 0 0 0 0 . . . . ' ' S QS k X t kQS Yt S t = + − t − ... (2.12.) Dimana S’t adalah jumlah total substrat pembatas laju dalam kultur dan S0 adalahkonsentrasi substrat umpan.
Jumlah total sel dalam kultur akan meningkat secara linier seiring dengan waktu sedangkan laju dilusi dan μ akan menurun. Pada saat quasy steady state μ = D,
41
dengan D adalah laju dilusi. Ini berarti laju pertumbuhan dikontrol oleh laju dilusi pada saat quasy steady state. Meskipun demikian model ini hanya pendekatan karena μ merupakan fungsi waktu.
2.6.2. Kinetika Pengolahan pada Periode Reaksi (React)
Periode reaksi merupakan sistem batch, yaitu suatu kondisi sistem yang tertutup dengan kandungan substrat awal yang terbatas, dimana selama proses ini berlangsung tidak terdapat aliran masuk maupun yang keluar dari reaktor.
Untuk volume yang konstan, reaksi pada fasa cair, neraca massa untuk reaktan A dalam kondisi batch ideal adalah sebagai berikut (Benefield & Randall, 1980):
Massa masuk = massa keluar + massa akumulasi + massa hilang saat reaksi
(
r)
V dt dN A A = − + − 0 0 ... (2.13.) dt dC dt dN V r A A A ⎟=− ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − = − 1 ... (2.14.) Laju penggunaan substrat dalam SBR pada tahap reaksi dihitung dengan persamaan berikut: X dt dS q ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = ... (2.15.) Dimana,q = laju pemakaian substrat spesifik (per waktu)
dt dS
= laju pemakaian substrat (massa per volume per waktu) X = konsentrasi biomasa (massa per volume)
Laju pertumbuhan biomasa spesifik dihitung dengan menggunakan persamaan:
X dt dX ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = μ ... (2.16.) Dimana,
42
μ = laju pertumbuhan biomasa spesifik (per waktu)
dt dS
= laju pertumbuhan biomasa (massa per volume per waktu) X = konsentrasi bisomasa (massa per volume)
Dengan menggunakan persamaan
dS dX
Y = maka laju kematian biomasa dapat dihitung dengan persamaan:
Kd X dt dS Y X dt dX − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ = ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ . ... (2.17.) Dimana, ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ X dt dX 1
= laju pertumbuhan biomasa spesifik, μ Y = koefisien yield ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ X dt dS 1
= laju pemakaian substrat spesifik, q Kd = laju kematian (per waktu)
Persamaan (2.16.) dapat diubah menjadi
Kd q Y − = .
μ ... (2.18.)
Dengan memplotkan nilai μ terhadap q dalam sebuah grafik hubungan X dan Y maka akan diperoleh persamaan garis lurus dimana slope garis tersebut menunjukkan nilai Y dan intersep nilai Kd .
2.6.3. Kinetika Pengolahan pada Periode Stabilisasi (Idle)
Pada periode ini, sistem berjalan sebagaimana pada tahap reaksi, sehingga perhitungan kinetika dapat menggunakan persamaan (2.13.) - (2.18.).
43
2.7. Penelitian Mengenai SBR Anaerob maupun Limbah Cair dari
Perusahaan Sejenis
Penelitian mengenai ASBR telah dilakukan, beberapa diantaranya dilakukan sejak tahun 1995 hingga 1999.
Penelitian Timur, et. al. (1999) tentang keterolahan secara anerobik leachate dari landfill dengan menggunakan reaktor ASBR skala laboratorium pada suhu 35oC, dengan kisaran luas laju pembebanan volumetrik (0,4 – 9,4 gCOD/liter/hari); laju pembebanan spesifik (0,2 – 1,9 g COD/VSS/hari); variasi HRT (10 – 1,5 hari); COD pada influen sebesar 3800 – 15900 mg/l) menghasilkan efisiensi penyisihan COD pada rentang 64 – 85% (tergantung pada laju pembebanan volumetrik dan spesifik); Yield konversi biomasa harian netto sekitar 0,1 g VSS per g COD yang disisihkan; Kd sebesar 0,01 per hari; produksi volumetrik metana maksimal yang dicapai (atau maximum volumetric methane production rate (MVMP) = 1,851 per liter per hari dicapai pada laju pembebanan 9,4 g COD per liter per hari; Laju produksi metana spesifik sebagai COD sekitar 1,06 g CH4-COD g per VSS per hari di dalam reaktor. Hasil penelitian menunjukkan bahwa sekitar 83% COD yang tersisihkan selama pengolahan dikonversi menjadi metana. Yield biomasa rata-rata yang dicapai adalah 0,12 g VSS per g COD yang tersisihkan
Penelitian Dague et. al. (1998) tentang pengolahan anaerob limbah cair konsentrasi rendah (dilute wastewater) dengan menggunakan tiga buah reaktor ASBR skala laboratorium, masing-masing berkapasitas operasional 6 L. Reaktor diberi umpan substrat sintetis yang terbuat dari dry milk tanpa lemak yang diberi tambahan nutrien dan trace metals. COD dan BOD5 umpan masing-masing adalah
600 mg/L dan 285 mg/L. Data kinerja steady-state diambil selama periode waktu 2 tahun pada suhu reaktor 5; 7,5; 10; 12,5; 15; 17,5; 20; dan 25°C. Hydraulic retention times (HRTs) dijaga pada 24, 16, 12, 8, dan 6 jam. Kinetika proses steady state dan efisiensi penyisihan dievaluasi untuk berbagai kondisi. Hasil percobaan menunjukkan bahwa proses ASBR mampu mencapai lebih dari 90% penyisihan COD terlarut dan BOD5 pada suhu 20°C dan 25°C pada seluruh HRT.
44
adalah 62% dan 75%. Pada rentang suhu antara 5 hingga 25°C dan HRTs antara 24 dan 6 jam, penyisihan COD terlarut berkisar antara 62 hingga 90%, sedangkan penyisihan BOD5 mencapai 75 hingga 90%. Pada seluruh kasus, solids retention times (SRT) cukup tinggi untuk menjaga kinerja yang baik. Laju penyisihan substrat dan koefisien and half-saturation juga ditentukan untuk seluruh variasi suhu. Koefisien koreksi suhu adalah 1,08 pada kisaran suhu 7,5 hingga 25°C. Disimpulkan bahwa ASBR memiliki karakteristik yang unik yang memungkinkan penyisihan organik yang efisien selama pengolahan dilute wastewaters pada suhu rendah
Penelitian Sung et. al. (1995) untuk mengevaluasi faktor mendasar yang mempengaruhi pemisahan padatan dalam ASBR, termasuk konfigurasi reaktor, pengadukan (kontinyu atau terputus), laju pembentukan gas, konsentrasi mixed liquor suspended solids dan bioflokulasi-granulasi, dan untuk menentukan efek faktor-faktor tersebut terhadap kinerja ASBR dalam mengolah substrat sintetis terlarut (nonfat dry milk). Penelitian ini menggunakan empat buah reaktor ASBR dengan kapasitas operasonal 12 L dengan konfigurasi yang berbeda dioperasikan pada suhu konstan 35oC. ASBR merupakan proses anaerobik high rate baru (U.S. Pat. No. 5,185,079) yang tengah dikembangkan oleh Dague dan sejawatnya di Iowa State University. Sasaran dari percobaan ini adalah untuk mengevaluasi faktor mendasar yang mempengaruhi pemisahan padatan dalam ASBR, termasuk konfigurasi reaktor, pengadukan (kontinyu atau terputus), laju pembentukan gas, konsentrasi mixed liquor suspended solids dan bioflokulasi-granulasi, dan untuk menentukan efek faktor-faktor tersebut terhadap kinerja ASBR dalam mengolah substrat sintetis terlarut (nonfat dry milk). ASBR mampu mencapai lebih dari 90% pengurangan COD soluble pada substrat susu sintetis pada beban COD dari 2 hingga 12 g/L.hari pada HRT 48, 24, dan 12 jam. Konfigurasi reaktor penting dalam pembentukan sludge granular. Reaktor yang relatif tinggi-ramping memiliki kecenderungan untuk menyeleksi granul secara lebih baik dibanding reaktor yang pendek-gemuk. Namun demikian, reaktor yang lebih pendek dapat mengakumulasikan konsentrasi biomasa dengan lebih baik dibandingkan reaktor
45
yang tinggi. Pengadukan yang terputus lebih cenderung disukai dibanding pengadukan kontinyu baik dari segi penyisihan COD maupun produksi metana.
Penelitian Chaerul (2001) tentang ASBR untuk meneliti kinetika reaksi pada berbagai variasi rasio waktu pengisian terhadap waktu reaksi pada fase metanogenesa dengan menggunakan substrat buatan dari glukosa dengan beban COD influen 3200 mg/l, 15.000 mg/l, 25.000 mg/l dan 55.000 mg/l. Fase metanogenesa diperoleh dari proses biologi menggunakan efluen dari fase asidogenesa. Persentase gas metana terjadi pada beban COD 55.000 mg/l pada rasio pengisian : reaksi = 2:48, yaitu sebesar 325,24 ml/jam. Kinetika pada fase pengisian, yaitu koefisien hasil adalah 0,0669 – 0,2123 g VSS/g COD, dan laju penyisihan substrat sebesar - 0,2521 hingga -1,5896 per jam. Kinetika fase reaksi, kematian biomasa 0,0005 per jam, koefisien hasil 0,0961 g VSS/g COD, dan laju penyisihan substrat 0,0263 – 0,1152 per jam.
Penelitian mengenai limbah cair yang sejenis dengan limbah cair dengan Perusahaan Security Printing X ini yang pernah dilakukan diantaranya meneliti mengenai proses fisika-kimia, khususnya membran ultrafiltrasi (Guojun Zhang dan Zhongzhou Liu, 2003) dan (Guojun Zhang, dkk, 2004), sedangkan penelitian mengenai toksisitas efluen limbah cair yang sejenis dilakukan di China (Jinmiao Zha dan Zijian Wang, 2006).
Khusus untuk penelitian mengenai pengolahan limbah cair dari banknote printing tersebut yang memanfaatkan teknologi membran ultrafiltrasi dijelaskan sebagai berikut :
1. Guojun Zhang dan Zhongzhou Liu (2003) mengamati adanya reaksi antara Turkey Red Oil dengan ion kalsium akan menghasilkan endapan dan hal ini akan menjadi penyebab terjadinya membrane fouling. Dalam penelitiannya Guojun Zhang dan Zhongzhou Liu (2003) mengajukan metode pencucian empat-tahap yang meliputi pencucian menggunakan air demineralisasi; pencucian menggunakan larutan asam klorida (0,1 N); pencucian sekali lagi
46
dengan air demineralisasi; dan pencucian dengan larutan natrium hidroksida (1% berat), untuk membersihkan membran yang mengalami fouling (mampet) yang parah.
Tabel II.4. Data Penelitian tentang ASBR
Obyek yang diteliti Suhu Operasi COD influen Variabel lain Efisiensi penyisihan Yield Kd Peneliti Substrat sintetis terlarut (nonfat dry milk) 35oC 2 - 12 g/L.hari HRT 48, 24, dan 12 jam
> 90% - - Sung et. al. 1995 Leachate dari landfill 35oC 3800 – 15900 mg/l - 64 – 85% - 0,1 g VSS/g COD (Y konversi biomasa harian) - 0,12 g VSS/g COD (Y biomasa rata-rata) 0,01 per hari Timur, et. al., 1999 Limbah cair konsentrasi rendah dengan substrat sintetis dari dry milk tanpa lemak diberi tambahan nutrien dan trace mineral Divariasik an, meliputi: 5; 7,5; 10; 12,5; 15; 17,5; 20; dan 25°C. 600 dan 285 mg/l HRT dijaga pada 24, 16, 12, 8, dan 6 jam. - 90% penyisihan COD terlarut dan BOD5 pada suhu 20°C dan 25°C pada seluruh HRT - Pada rentang suhu antara 5 hingga 25°C dan HRTs antara 24 dan 6 jam, penyisihan COD terlarut berkisar antara 62 hingga 90%, sedangkan penyisihan BOD5 mencapai 75 hingga 90%
- - Dague et. al., 1998 Substrat buatan dari glukosa dari proses asidogenesa - 3200 mg/l; 15000 mg/l 25000 mg/l 55000 mg/l Rasio Fill:React = 2:24; 2:36; 2:48; 0,0263 – 0,1152 per jam Y = 0,0961 g VSS/g COD (fase reaksi) Y = 0,0669 – 0,2123 g VSS/g COD (fase pengisian) Kd = 0,0005 per jam (fase reaksi) Chaerul, 2001
47
2. Guojun Zhang, dkk, (2004) meneliti pengolahan lebih lanjut terhadap konsentrat yang dihasilkan dari ultrafiltrasi tahap-1 yang digunakan untuk mengolah limbah cair dari banknote printing sehingga dapat lebih terpekatkan dengan menggunakan proses vortex settling dan ultrafiltrasi tahap ke-2 dengan arah umpan yang tidak konstan. Hasil penelitian analisa ekonomi menunjukkan bahwa sistem pengolahan tersebut merupakan pilihan yang efektif dari segi biaya untuk pengolahan lebih lanjut terhadap konsentrat ultrafiltrasi tahap ke-1.