TINJAUAN PUSTAKA
Pertumbuhan garnet, fertilisasi dan cleavage. Pertumbuhan sel gamet.
Sel gamet mempakan sel-sel hapIoid yang pembentukannya berlangsung melalui proses pembelahan mitosis maupun meiosis (Gilbezt, 1988). Terbentuknya sel ketamin betina berasal dari sel germinal primordial yang berpindah menuju gonad clan -menjadi oogonia, oogonia ini masih merupakan sel diploid Melalui beberapa proses pembelahan mitosis akhirnya oosit berkembang menjadi oosit primer, pada saat profase oosit primer mulai mengalami pemhlahan meiosis. Pada saat meiosis pertarna terbentuk benda kutub pertama, setelah proses meiosis kedua, terbentuklah ootid dan benda kutub kedua, ootid merupakan sel gamet haploid. Oosit sekunder ini merupakan oosit yang dikeluarkan pada saat ovulasi (Becker, 1990; Homa d m Brown, 1992).
Proses terlepasnya oosit sekunder dari ovariurn diawali kejadian pembesaran folikei, akhimya pecah di bagian permukaan ovarium, setelah itu oosit sekunder memasuki ovidak clan tuba falopii. Semua proses pematangan oosit dan ovulasi ini berlangsung di bawah
kontrol hormonal (Wassarman, 1988). Kejadian tahaptahap pembelahan ini tidak selalu
berurutan dengan kejadian ovulasi. Biasanya pada saat diestrus bersamaan dengan waktu istirahat pembelahan sel gamet yaitu fase profase I. Daiam waktu yang cepat sebelum tejadinya ovulasi, oosit berpeluang mengalami fase meiosis tahap kedua, pa& saat itu benda kutub kedua terbentuk (Kanagawa dkk..1989).
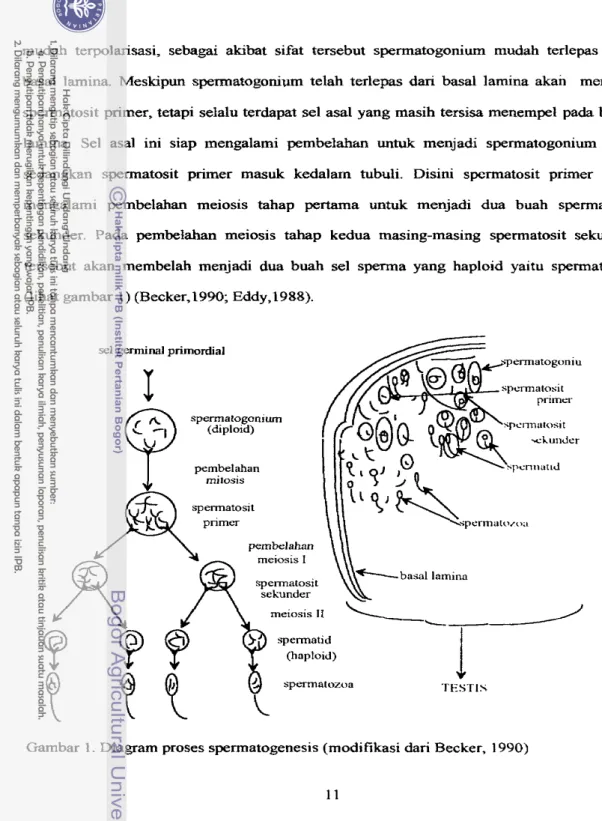
Menurut Becker { 1990) sebuah oogonium primer akan menjadi sebuah msit,
sedangkan sebuah spermatosit primer akan berkernbang menjadi empat buah spermatozoa. Spermatogonia mengalami pembelahan mitosis di tubuli seminiferi testis, spermatogonia tersebut berasosiasi dengan basal lamina dari garis epitel tubuli. Spennatogoniurn bersifat
rnudah terpolarisasi, sebagai akibat sifat tersebut spermatogonium mudah terlepas dari
basal lamina. Meskipun sperrnatogoniwn telah terlepas dan basal lamina akan menjadi spermatosit primer, tetapi seIalu terdapat sel asal yang masih tersisa menempel pa& basal lamina. Sel asztl ini siap mengalami pembelahm untuk menjadi spermatogoniwn lag, sedangkan spermatosit primer masuk kedalam tubuli. Disini spermatosit primer akan
mengalami pembelahan meiosis tahap pertarna untuk menjadi dua buah spermatosit
sekunder. Pada pembelahan meiosis tahap kedua masing-masing spermatosit sekunder tersebut akan membelah menjadi dua buah sel sperma yang haploid yaitu spermatozoa (lihat gambar 1) (Becker, 1990; Eddy,1988).
sel germinal primordial
spermatozoa TESTIS
Spermatozoa setelah mengalami pematangan, akan terlepas menuju lumen tubuli serniniferi pa& saat sudah matang (Ashdown dan Hanock, 1987; Eddy, 1988). Kedua tahap meiosis tersebut berlangsung secara seimbang dan terus menerus dimana pada akhirnya sebuah sel spermatogonium yang diploid akan menghasilkan empat buah sel spermatozoa. Secara kuantitatif pada proses spermatogenesis akan menghasilkan banyak sel gamet dibandingkan oogenesis ( H a f e ~ 1987; Gamer dan Hafez. 1987).
Oosit.
Fertilisasi dimuiai pads saat benda kutub pertama terekshaksi, saat itu pula
spermatozoa mulai melakukan penetrasi terhadap oosit yang sedang mengalami pembelahan meiosis tahap kedua. Kejadian ini t e j a d i di bagian arnpula ovidak (Yanagimachi, 1988). Pada saat memasuki ampula, sel-sel oosit terbungkus dalarn bungkusan mukosa protein yang di sebut zona pelusida dan rnasih ditempeli sel-sel granulosa berasal dari sel-sel foliket ovmi yang tertinggal, pada tahap ini sel-sel granulosa
sering disebut seI kumulus. Selanjutnya oosit yang tidak terpenetrasi dengan spermatozoa akan mengalami degenerasi (Kanagawa dlrk., 1989).
Spermatozoa.
Menurut Kanagawa dkk. (1989) meskipun jumlah total spermatozoa pada saat ejakulasi sampai ratusan juta. tetapi yany mampu sampai ke ampula tidak banyak. Ada
beberapa spermatozoa yang sampai kt: tempat fertilisasi sangat cepat kira-kira 15 menit setelah perkawinan. Setelah itu spermatozoa mengalami pembahan yang sering disebut kapasitasi. Setelah spermatozoa mengalami kapasitasi penuh, oosit sarnpai di ampula. Masa subur oosit ini sangat pendek pa& sapi 8
-
12 jam, sedangkan masa subur spermatozoa sapi berkisar 3048 jam.Keberhasilan fertilisasi banyak tergantung terhadap banyaknya spermatowa di daerah ampula bertepatan dengan adanya oosit di daerah tersebut. Hal ini menunjukkan besarnya peluang pertemuan -sit dengan spermatozoa. Sel-sel kumdus juga berfungsi
untuk membantu penangkapan spermatozoa yang berada berdekatan dengan oosit, sel-sel kumulus ini juga mempunyai peranan dalam proses kapasitasi spermatozoa. Disamping itu
morfologi spermatozoa juga sangat berperan dalam penetrasi spermatozoa terhadap zona pelusida (Liu dan Baker,1992).
Fertilisasi.
Fertilisasi merupakan suatu proses peleburan antara dua buah sel gamet yaitu oosit
dari hewan betina dan spermatozoa dari hewan jantan untuk membentuk sebuah sel tunggal
yang disebut sigot (Mc Laren, 1987). Terjadinya proses fertilisasi tersebut melalui peristiwa-peristiwa sebagai berikut :
Kapasitasi dan akrosom reaksi sperma.
Sperma masak yang berasal dari epididimis atau sperma ejakulat masih belum
mampu membuahi sel-sel telur, sperma hams melalui traktus genitalis betina berahi sebelurn meningkatkan kemampuannya untuk membuahi sel telur. Pa& saat itu sperma mengalami perubahan-perubahan fisiologis, sehingga mampu melakukan pembuahan, proses ini sering disebut kapasitasi (Yanagimachi, 1988). Selama proses kapasitasi ini sperma mengalami motilisasi dan sering disebut hiperaktifasi (Yanagimachi dalam Luconi dkk., 1996). Pada saat kapasitasi tejadi peristiwa biokimiawi dan biofisik yang kompleks antara lain meningkatnya intraseluler ca2+ bebas dan fosforilasi protein (Luconi dkk., 1996). Disamping proses kapasitasi terjadi pula reaksi akrosom, yaitu terjadinya perubahan-
perubahan fisiologis bagian akrosom
dan
kepala spermatozoa, sehlngga memudahkan
sperma menembus zona pelusida (Fulka, 1991). Setelah tejadi kedua proses tersebut
sperma berpeluang
untuk
membuahi oosit yang sudah
masak.
Proses masuknya spermatozoa ke dalrm oosit
Untuk memasuki oosit, spermatozoa
harus
melakukan penetrasi
pada
kumpulaif sel-
sel kumulus, zona pelusida
dan
membran vitelin. Spermatozoa memasuki sel-sel kurnulus
sesuai dengan kemampuan motilitas, yaitu dengan
cara
membuat akses untuk
menernbus
matriks asam hyaluronit. Spermatozoa tersebut mempunyai enzim hyaluronidase, asam ini
bermanfaat
untuk
melarutkan kumpulan set-sel kumulus. Dari keadaan ini dapat diketahui
hanya sperma tertentu yang mendapat kesempatan melakukan penetrasi pada zona pelusida
(Gray dalam Slavik
clan
Fulka, 1992). Proses penetrasi spermatozoa terhadap oosit adalah
dengan cara menempelnya spermatozoa pada dinding vitelus. Secara bertahap kepala
spermatozoa tersebut berasosiasi dengan permukaan vitelus dan akhimya tejadi fusi
dengan oosit. Setelah itu terbentuk pronukleus jantan dan
betina,
setelah melalui proses
singami yaitu kedua pronukleus tersebut rnelebur menjadi satu, terbentuklah sigot (lihat
gambar Z)(Kanagawa dkk.,1989).
Menurut Yanagimachi (1988)
hambatan sperma berikutnya adalah untuk
menembus zona pelusida yang mengandung glikoprotein.
Pada tahap ini oosit
memproduksi substansi yang disebut lirtllizin yang rnempunyai fungsi khusus untuk proses
penggumpalan
pa&saat fertilisasi. Proses penggumpalan ini tidak berlangsung lama, pada
saat ini sperma menernpel membentuk lorong sempit pada zona pelusida. Pada tahap ini
daerah akrosom mulai pecah (larut), sehingga berfungsi sebagai alat pelubang. Proses
penembusan ini berlangsung dibantu oleh enzim proteolitik sehingga spermatozoa dapat
menembus zona pelusida.
Garnbar 2. Ilustrasi proses fertilisasi secara lengkap sampai te jadinya singarni (Kanagawa
dkk., 1989)
Shamsudin clan Rodriguez-Martinez (1993) melakukan penelitian dengan menggunakan 380 oosit sapi dan diperlakukan inseminasi dengan metoda yang berbeda, temyata kisaran oosit yang teqxnetrasi 51,9 s.d. 7 4 9 persen, sedangkan tejadinya polispermi pada masing-masing perlakuan tidak menunjukkan perbedaan yang nyata.
Cieavnge.
Cleavage adalah suatu peristiwa pembelahan sel ovum yang telah dibuahi dan telah mengalami proses singami sempurna. Pembelahan sel ini berasal
dari
sel tunggal sehingga menjadi banyak sel tetapi relatif tidak diikuti pembesaran ukuran, karena pembesarannyamasih dihambat adanya zona pelusida. Sel tunggal ovum tersebut merupakan sel yang berukuran relatif sangat besar di bandingkan sel somatis (Mc Laren, 1987)
Cleavage terjadi sekitar satu hari setelah te jadinya ferttlisasi, biasanya dimulai
disekitar ampula ovidak. Pembelahan sel berlangsung secara bertahap dari dua sel sarnpai
mencapai tahap morula clan blastosis, ukuran embrio tahap momla tidak terlafu beda
dengan sigot karena selarna proses pembelahan tersebut zona pelusida tidak mengalami perubahan ukuran, sementara itu cilia pada ovidak mendorong embrio menuju uterus, pa&
saat itu embrio berkembang sarnpai tahap blastosis (Gilbert, 1988; Sukra dkk.,i989). Sel-
sel embrio atau blastomer melekat satu sama lain oleh suatu perekat yang disebut tigmotaksis (Sukra dkk., 1989).
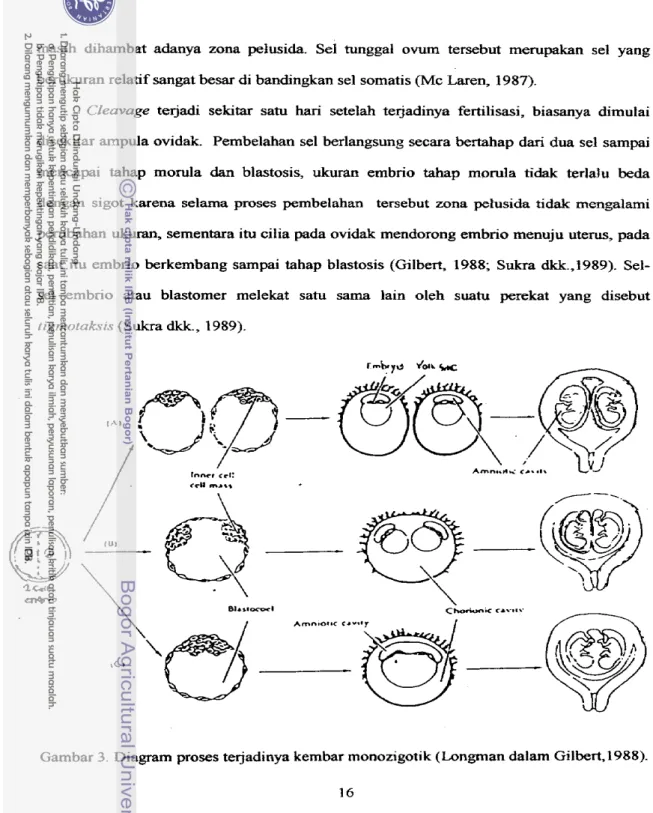
Innrl trt: Am....*-. <...,\
Gambar 3. Diagram proses te jadinya kembar monozigotik (longman dalam Gilbert,1988).
Terjadin ya kembar identik alamiah
Menurut Longman dalam Gilbert (1988), te rjadinya kembar identik secara alamiah dimunglunkan melalui beberapa peristiwa sebagai berikut:
A. Terjadinya awal kennbar sebelum terbentuknya trofektoderm, sehingga tiap kembar mempunyai chorion dan amnion sendiri.
B.Tejadinya awal kembar setelah terbentuknya trofektoderm tetapi sebelum terbentuk amnion sehingga menghasilkan kembar mempunyai kantung amnion sendiri tetapi memanfaatkan satu chorion bersama.
C.Terjadi awal kembar setelah pembentukan amnion sehingga kembar mempunyai satu kantung amnion dan chorion (Gambar 3 ) .
Pematangan garnet, fertilisasi, dan pertumbuhan ernbrio in vitro.
Fertilisasi in vifro adalah proses fertilisasi buatan yang dilakukan oleh manusia dengan memanfaatkan oosit maupun sperma diluar tub& hewan. Menurut Fulka (1991) proses fertilisasi in vitro dilakukan dengan cara membuat imitasi kondisi lingkungan yang
tejadi pada saat fertilisasi in vivo. Kondisi tersebut berupa kondisi fisiologis berupa hormonal, nutrisional, serta kondisi lainnya yang mendukung terjadinya fertilisasi. Proses ini terdiri dari pematangan oosit in vitro, kapasitasi dan turnbuh kembang embrio In vitro,
proses tersebut adalah sebagai berikut:
Pematangan oosit in vitro
(PIV).
Langkah awal dari PIV adalah seleksi oosif menurut Machatkova dkk., (1996) salah satu faktor penting dalam menyeleksi oosit adalah siMus estrus dari sapi penyumbang oosit,
menurut faktor lain yang sangat penting adalah kondisi oosit pada pertumbuhan folikelnya,
kondisi oosit
ini
berkaitan dengan metode clan lama kultur yang di gunakan
untuk
pematangan oosit (Telfer, 1996; Crozet
dkk.,
1995; Cecconi
dkk.,
1996). Metode kultur
oosit dan yang embrio banyak dikembangkan oleh para peneliti adalah conditioned medium
(Hernandez-ledezma
dkk.,
1996; Shamsudin dkk.,
1993; Duran
dkk.,
1996), Chemicaily
defined medium (Lim
dkk.,
1994; Iritani
dkk.,
1984)
dan
kokultur (Rehman
'dkk.,
1994;Goto dkk., 1988; Goto dkk., 1994;Sakkas
dkk.,
1989; Shamsudin, 1993
).Salah satu problem utama dalam fertilisasi in vitro adalah pematangan oosit.
Menurut Xu
dan
Greve (1988) pematangan oosit sapi merupakan sebuah proses
pematangan sitoplasma yang dilengkapi dengan pematangan inti sel, proses ini merupakan
bagian terpenting bagi oosit
untuk
fertilisasi. Menurut Sirard dkk.(1992) proses
pematangan melalui peristiwa meiosis tejadi secara spontan apabila oosit terlepas dari
folikelnya. Pada kultur oosit in ritro, oosit sapi berasal
dari
folikel belum masak dapat
dilakukan pematangan sampai tahap siap dibuahi meskipun rata-rata perkembanga~ya
masih sangat terbatas.
Boone clan Shapiro dalam Shamsudin dkk.(1993)
menyatakan proses pematangan
oosit adalah merupakan proses reorganisasi organela-organela tersebut di dalam sitoplasma
yang berguna
untuk
memobilisasi organela-organela dari granula kortikal menuju darrah
subplasmalema, proses ini bukan akibat pengaruh kondisi medium kultur. Kondisi
Lulturyang mempengaruhi proses pematangan oosit adalah adanya gonadotropin, steroid, slstern
buffer, komposisi gas, keadaan fisiologis, dan fisik serta parameter kimiawi lainnya.
Menurut Shamsudin
dkk.
(1993) secara berumtan proses pematangan oosit sap8
secara in vitro di bawah pengamatan light-electron microscope adalah sebagai
berikut:
Tahap I.
Organela-organela sitoplasma, sebagian besar merupakan mitokondria, membentuk kumpulan kecil dan menyebar disekitar periferi oosit. Butir-butir lemak, gelembung-
gelembung menyebar merata di bagian tengah oosit. Pada tahap ini butir-butir lam&
d m
gelembung-gelembung berjumlah lebih banyak serta berukuran lebih besar dibandingkan tahaptahap selanjutnya.
Tahap
II.
Beberapa mitokondria telah tidak berada di daerah kortikal dan menyebar di daerah ooplasma. Butir-butir lemak dan gelembung-gelembung jumlahnya berkurang serta h n n y a mengecil dan mulai pindah dari bagian tengah menuju ke periferi. Setelah 12
jam masa inkubasi semua oosit memasuki masa ini. Tahap 111.
Organela-organela sitoplasma, butir-butir lernak dan gelembung-gelembung bercampur secara merata diseluruh ooplasma. Mitokondria telah meninggalkan daerah kortikal dan bercampur dengan retiMum endoplasma. Granula-granula kortikal telab di rnobilisasikan ke dalam daerah subplasmalema. Kejadian ini tejadi setelah 20 jam di inkubasi, terlepas dari kondisi medium h l t u r .
Pamsh dkk. (1992) menambahkan untuk memahami proses meiosis hams dipaharni proses genetis maupun biokimiawi pada kontrol siklus sel, pengaturan proses pembelahan sel tersebut sangat dipengaruhi oieh beberapa reaksi kinase dan fosfatase. Sato dkk. ( 1 9 8 8 ) menyatakan bahwa dibutyril cyclic udenosin 3'5'-monophosphate ( 1 0 0 @A) mempercepat proses terbentuknya badan kutub I, namun caimodulrn antagonist w7 (20pM) justru menekan terbentuknya badan kutub I, sedangkan inti secara spontan terbentuk dengan
adanya drbutyril cyclic adenostn 3'5'-monophosphare (20 pM). Secara bersama-sama tejadi pula segmentasi, perubahan-perubahan degeneratif dengan penambahan bovine fblliculair fluid-glycosaminoglycans pada konsentrasi 250 fig/ml. Dari h a i l ini menunjukkan bahwa pemaiangan, aktivasi maupun degenerasi oosit sapi &pat dimodulasikan oleh bahan-bahan biokimiawi tersebut.
Hawk dkk. (1992) juga mencoba sel-sel kumulus pada oosit sapi temyata juga dapat meningkatkan angka fertilisasi (Lihat tabel 1). Percobaan lain juga dilakukan pada tikus oleh Eppig dkk. (1992) ternyata penambafian hormon FSH dan LH pa& medium kultur
rnernberikan pengaruh terhadap pematangan oosit.
Tabel 1. Pen& keberadaan sel-sel kurnulus pada oosit pada saat pematangan oosit terhadap tingkat fertilisasi (Hawk dkk., 1992).
LJkuran Oosit dengan kumulus ~ e n u h
-
oosit den- kurnulus sebaeian tidak di pipet di pipet tidak dip;- di pipet-Ova yg diuj i 142 121 132 135
~ e r t i l 39 6 8 81 101
polispermi 2 6 5 12
2 pronukleus 15 56 66 85
Menurut Amstrong dkk.( 1992) perbandingan tingkat pematangan oosit yang berasal dari pedet-pedet di superovulasi dan dari sapi dewasa tidak menunjukkan perbedaan yang nyata. Penelitian lain menunjukkan pada oosit sapi yang sudah mas& dapat pula
dilakukan kriopreservasi, tetapi setelah dilakukan fertilisasi in vifro keberhasilan
berkembang menjadi embrio sampai tahap blastosis lebih rendah dibandingkan embrio yang berasal dari oosit bukan hasil kriopreservasi (Otoi dkk-1992; Parks &n Ruffing,
Kapasitasi dan reaksi akrosom sperma in vitro.
Menurut Hatings dan Kay (1992) kapasitasi ini &pat pula dilakukan secara in vih.o.Iritani dkk. (1984), memodifikasi larutan Krebs bikarbonat (Lamtan KRB) untuk digunakan sebagai bahan kapasitasi spermatozoa sapi dibandingkan dengan sistem kapasitasi uterus sapi estrus, ternyata larutan KRB dapat digunakan pula sebagai bahan kapasitasi spermatozoa dengan hasil yang baik. Salah satu bahan biokimiawi yang sangat potensial sebagai aktifator &lam proses kapasitasi sperma sapi secara in virro, adalah heparin. Leclerc dkk.(1992) menambahkan disamping heparin bahan yang berperanan dalam kapasitasi sperma adalah calrnodulin (CaM), Calmodulin ini beke jasama dengan
heparin secara antagouistik daiam proses kapasitasi sperma. Heparin sebagai salah satu bahan biokimiawi yang berperan dalam proses kapasitasi juga berperan dalam proses reaksi akrosom pada kepaIa spermatozoa. Fraser (1987) ca2+ dibutuhkan untuk meningkatkan kapasitasi, akrosom reaksi, rnotilitas, penetrasi Zona pelusida dan h i garnet pada
percobaan FIV tikus.
White dkk. (1992) rnelakukan penelitian dengan mengamati perubahan-perubahan zat metabolit pada saat spermatozoa sapi sedang mengalami kapasitasi. Penelitian tersebut dilakukan dengan mengamati konsumsi oksigen dan adanya CAMP dalam spermatozoa sesaat sebelum d m setelah spermatozoa di inkubasikan dengan sistem ko-kultur dan tanpa kokultur (lihat tabel 2).Spermatozoa yang telah mengalami kapasttasi berpeluang untuk melakukan penetrasi pada zona pelusida menurut Liu clan Beker (1992) menyatakan bahwa zona pelusida rnernpunyai kemampuan yang sangat tinggi dalam menseleksi spermatozoa untuk melakukan penetrasi, meskipun spermatozoa tersebut mempunyai morfologi yang normal
Tabel 2. Konsumsi oksigen dan konsentrasi CAMP &lam spermatozoa sapi sesaat sebelum
dan sesudah inkubasi dengan ko-kulhu - dan tanpa sel ephitil ovidak sapi (White - .
dkk.
1992).Percobaan waktu Oksigen Uptake cAMf
(ml/l~~sperma/jam) (pmoU 1 08spem) inkubasi (jam) kontrol kokultur kontro t kokultur
1 0 25.3k3.1
----
12,9?3,8---
Fertilisasi in vitro.
Fertilisasi in v i ~ o adalah fertilisasi buatan yang dilakukan oleh manusia dengan memanfaatkark oosit maupun sperma diluar tubuh hewan (Kanagawa, dkk. 1989). Spermatozoa dapat rnelakukan penetrasi terhadap zona pelusida memerlukan beberapa proses biokimiawi, proses ini disamping membantu proses penetrasi juga membentuk zona pelusida blok untuk rnenghindari sigot polispermi (disarikan dari Shabanowitz dan
O'Rand,1988). Proses fertilisasi di awali dengan pengenalan masing-masing gamet (sperma-oosit) melalui molekul-molekul proteidglikoprotein pa& masing-masing membran (Vacquier d m Lee, 1993), dilanjutkan dengan proses htndrtzg Jan fusi antara sperma dan oosit (Ash dkk., 1995). Setelah tejadi penetrasi terbentuklah pronukleus jantan d m betina (Zirkin dkk.. 1989; Perreult,l990; Hoshi dkk.. 199.1; Funahashi dkk., 1994) dan diikuti singami sehingga terbentuk sigot (Kanagawa dkk, 1989). Transformasi sigot menjadi embrio dipengaruhi o$eh kondisi lingkungan maupun genetis (DeFelice, 1994). Menurut Coy dkk. (1993) untuk meningkatkan keberhasilan proses-proses tersebut diperlukan sistim inkubasi medium kultur yang cukup memenuhi sarat peristiwa -peristiwa tersebut &pat berlangsung,
Menurut Bavister dkk.il992) teknik FIV pada oosit sapi telah berkembang sampai menghasilkan embrio pada tahap akhir preimplantasi, penelitian di bidang ini banyak bermanfaat karena dapat menarnbah informasi tentang mekanisme regulator dengan mudah dan relatif murah guna memperoleh embrio untuk penelFan dan di transfer. Narnun sam+ saat ini efisiensi teknik untuk menghasilkan embrio sarnpai tahap blastosis masih belum memuaskan. De Leeuw (1992), menyatakan embrio yang dikoleksi secara in vivo
mempunyai viabiiitas yang Iebih tinggi dibandingkan secara in vitro. Parrish dkk.
(1992) mengemukakm keberhasilan perkembangan embrio tergantung pada berfungsinya kontrol siklus sel dari embrio untuk berkemhng secara in vitro. Demikian pula Sparks
dkk. (1992) kegagalan memahami secara sempuma k e b u t . untuk pertumbuhan embrio
sapi dari 1 set sampai tahap blastosis alcan menghambat pertumbuhan embrio &lam medium kultur.
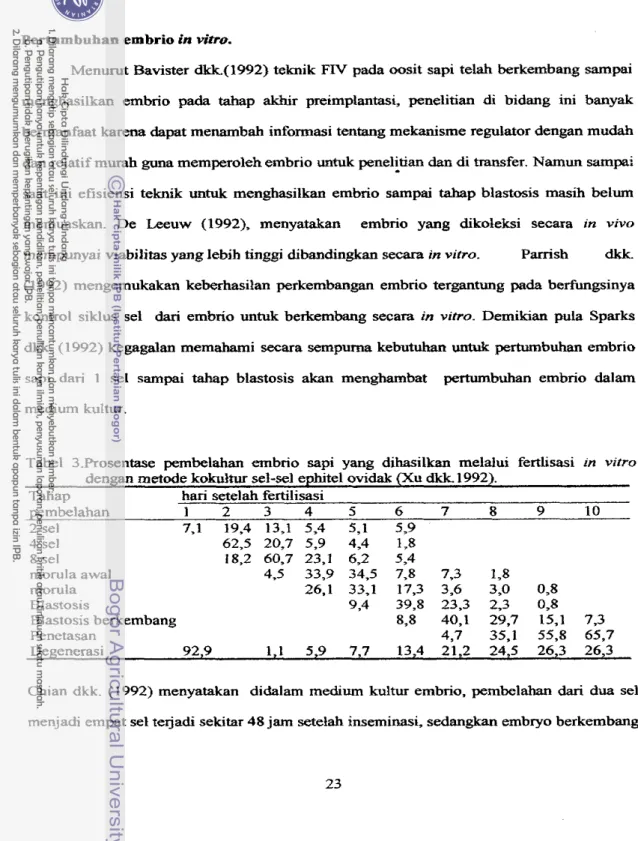
Tabel 3.Prosentase pembelahan embrio sapi yang dihasilkan melalui fertlisasi m vitro
dengan metode kokultur sel-sel ephitel ovidak (Xu dkk 1992). Tahap hari setelah fertilisasi
pembelahan 1 2 3 4 5 6 7 8 9 10 2 sel 7,l 19.4 13,l 5,4 5,l 5.9 4 sel 62,5 20,7 5,9 4,4 1,s 8 sel 18,2 60,7 23.1 6,2 5,4 morula awal 4.5 33,9 34,5 7,8 7,3 1,s morula 26.1 33,l 17.3 3,6 3,O 0,s BIastosis 9,4 39,s 23,3 2,3 0,s BIastosis berkembang 8,8 40,l 29.7 15,l 7,3 Penetasan 4,7 35,l 55,X 65,7 Degenerasi 92,9 1 , l 5,9 7,7 13,4 21,2 24,5 26,3 26,3 Chian dkk. (1992) menyatakan didalam medium kultur embrio, pembelahan dari dua sel menjadi empat sel te jadi sekitar 48 jam setelah inserninasi, sedangkan embryo berkembang
dari empat sel menjadi 16 sel memerlukan waktu 72
s.d
96jam
setelah fertilisasi. Sedangkan menurut Prokievdkk.
(1992) embrio berkembang mencapai tafiap blastosis memerlukan waktu sampai 7 hari. Xudkk.
(1992) melakukan penelitian perkembangan embrio dengan sistem kokultur menggunakan sel-sel ovidak dengan hasil seperti tampak pada tabel 3.Bahan-bahaa yang diperlukan sebagai medium kultur fertiiksi in vitro
Karbohidrat, bahan ini sangat dibutuhkan dalam semua kultur sel, baik untuk maturasi oosit, kapasitasi spermatozoa, maupun tumbuh kembang embrio (Salem dkk.,
1992; Takahashi dm First, 1992). Pada kultur embrio kebutuhan energi yang berasal dari karbohidrat meningkat, terutama dalam membentuk rongga blastosul (Kim
dkk.,
1993). Pada kultur pertumbuhan embrio sapi penambahan D-Glukosa dilakukan setelah 3 sarnpai 4 hari pascafertilisasi, karena pada masa kultur sebelumnya penambahan glukosa diperkirakan menghambat pertumbuhan sel-sel embrio (Kim dkk., 1993; Lu dkk., 1988). Pada banyak penelitian menunjukkan bahwa hanya sebagian kecil saja dari glukosa &pat dioksidasikan melalui siklus asam trikarboksilat, sebagian besar berakibat pada produksi asam laktat, asam laktat dalam jumlah berlebihan bersifat toksik buat embrio (Gardnerdkk., 1993). Meskipun demikian penambahan piruvat clan L-laktat dalam jumlah tertentu
dan dalam waktu yang tepat dapat meningkatkan produktiiitas embrio (Kim dkk., 1 9 9 3 ~ ;
Kim dkk., 1993b; Matsuyama dkk.,1993).
Brown dm Whittingham (1992) memanfaatkan laktat dan piruvat serta glukosa sebagai suplemen &lam medium perkembangan embrio in vitro. Dari pengujian peran ketiga bahan ini pada pertumbuhan ernbrio diperoleh basil sebagai berikut: Apabila ketiganya disuplementasikan kedalam medium perkembangan embrio in vifro, maka
embrio hanya tumbuh sarnpai tahap 4 sel. Apabila ditambahkan hanya piruvat saja atau laktat dan pinrvat, embrio-dapat berkembang sampai morula. Pada percobaan berikutnya perkembangan embrio in vitro disuplementasikan piruvat saj+ laktat dan piruvat atau piruvat dan glokusa untuk 24 jam pertama Pada 24 jam berikutnya embrio &transfer ke medium TJY berisi laktat, piruvat dan glukosa temyata dengan metode suplementasi
semacam ini dapat menghasilkan embrio sampai tahap blastosis. Kegagalan perkembangan
embrio untuk mencapai t a b p blastosis ini sering disebut "fenornena s e I blok", fenomena ini disebabkan karena aktifiias genom embrio pada tahap ini cukup sensitif, sehingga
mudah terhambat dalam krkembangannya apabila kondisi lingkungan dalam sistim
kulturnya yang kurang sesuai dengan sensitifitas embrio. Diperldrakan sebagai akibat defisiensi bahan tertentu pa& proses transkripsi dari genom embrio dari urutan sintesa
protein, tetapi juga sangat erat hubungannya dengan metabolisme energi, terutama adalah glukosa. Sebagai akibatnya glukosa sering dianggap sebagai faktor penting dalam fenomena sel-sel blok pada: marrnut, &us, sapi
dan
domba. Sedangkan menurut Reed dkk.(1992) dengan rnrmodikiasi sistim kokultur ternyata glukosa bukan merupakan inhibitor pertumbuhan embrio babi.Schini dan Bavister (1988) telah menemukan masalah penting dengan tanpa
memberikan glukosa dan fosfat pa& kultur embrio hamster, ternyata embrio dapat berkembang rnelewati sel blok, dua substansi ini p& cairan fisiologis dapat memberikan pengaruh keracunan pada embrio tahap 2 sel meskipun pa& level yang relatif sangat
rendah (0,lmM). Salah satu kemungkinan penyebabnya adalah secara in vivo embrio dilapisi semacam lapisan film, kemungkinan sel-sel ovidak hamster gaga1 mensekresikan glukosa dadatau fosfat dalam jumlah yang cukup, kemungkinan yang lain adalah adanya
aktifitas diabetogenik yang mengakibat ketidaksetimbangnya konsentrasi glukosa dan fosfat.
Asam amino. Menurut Thompson (1996) asam amino merupakan W a n yang sangat penting untuk pertumbuhan embrio, asam amino terdiri dari dua kelornpok yaitu : asam amino esensial dan non esensial. Telah banyak dilakukan penelitian tentang peran kedua macarn asam-amino tersebut terhadap pertumbuhan ernbrio in virro, dan juga pada
embrio pasca transfer ternyata tidak s e r n w y a dapat berperan dalam pertumbuhan embrio bahkan ada beberapa
asam
amino menghambat pertumbuhan embrio fBavister clan Arlotto, 1990; Carney dan Bavister, 1987; Van Winkle dan Campione, 1996). Asam amino yang menjadi kunci untuk peitumbuhan embrio adalah glutamin, terutama pada perwbaan tikuspa& tahap pertumbuhan 2 sel (Chatot dkk., 1989).
Konsentrasi beberapa asam amino pada cairan ovidak dan uterus jauh lebih tin& dibandingkan dengan plasma &ah, terubna glisin, taurin clan alanin (Moore dan Bondioli, 1993; Nancarrow dkk., 1992). Dari hasil percobaan yang dilakukan Moore dan Bondioli (1993) melakukan suplementasi alanin dan glisin dengan konsentrasi seperti pada cairan ovidak ternyata dapat meningkatkan angka pertumbuhan embrio. Partridge dkk.(1996)
rnenggunakan medium
MEM
esensial dan non esensial ditambahkan arginin, glutamat, serin, treonin, dan tirosin &pat meningkatkan angka blastosis.Faktor peoumbuh, menurut Tsafiiri (1988) faktor penumbuh merupakan zat yang sangat esensial bagi proses pematangan oosit maupun pertumbuhan embrio, pada proses
fertilisasi in vitro kebutuhannya dalam medium kuitur berjumlah beberapa nanogram atau
sub nanogram. Beberapa zat penurnbuh yang berperan dalam proses pematangan adalah antara lain Ephidennal growth factor
(EGF),
Transforming Growth factor-8 (TGF),Fibroblast growth factor (FGF), Platelet-derivedgrowth factor(PDGF) Insulin-like growth factor (IGF), Platelet activating factor (PAF), Embryo-derived platelet activating f ~ c t o r
(EDPAF) (Flood dkk., 1993;Larson dkk., 1992a;Larson dkk., 1992b; Zheng dan Hu, 1996; Stock clan Hansel, 1992). Melalui proses transkripsi mRNA beberapa faktor penumbuh
dibuat pada tahap perkembangan embrio yang berbeda, pada embrio kambing maupun sapi
akitifitas faktor penumbufi mempunyai karakter aktifitas autokrin atau parakrin. Menurut Fry dkk., (1992) beberapa cairan yang disekresikan oleh sel-sel epithel mengandung beberapa jenis faktor penumbuh. Dari beberapa penelitian sebenarnya faktor penumbuh dapat digunakan pada spesies yaitu tikus, hamster, kelinci, domba, babi clan sapi juga
manusia, embrio-embrio &pat berkembang meskipun tanpa penambahan War-faktor penumbuh, tetapi diantara faktor-faktor penumbuh tersebut ada yang dapat memicu pertumbuhan embrio sehingga beberapa peneliti menggunakan sebagai suplemen pada medium kultur (Carney dan Foote. 1991; Caro dan Troumon, 1986, Sirard, 1992; Slavik dkk., 1992; Vajta dkk., 1992; Zheng dan Sirard, 1992). Insulin-like Growth facror-I ( IGF- I): parakrin dan banyak dimanfaatkan pada kultur pemaiangan oosit maupun pertumbuhan embrio, pada tikus reseptor mRNA IGF-I terdapat pada embrio tahap 8 sel s.d. blastosis (Rappolu dkk., 1990). Diindikasikan bahwa IGF-I melalui proses parakrin menuju ke embrio dengan cara berinteraksi dengan reseptor insulin (Kapur dkk., 1992: Harvey dan
Kaye, 1 99 1 ).
Gonadotropin, De Smedt dkk.(1992) melakukan percobaan pematanban oosit
secara in vitro, oosit yang terdapat sel-sel kumulus di tambah dengan sel-sel granulosa. hormon FSH dan LH serta Estradiol 17
P
temyata 85 persen oosit yang berasal dari fol~kel berukuran diamater 2-6 mm berkembang sarnpai mengalami meiosis tahap metafase 11.sedangkan oosit yang berasal dari folikel berdiameter 1-2 hanya mencapai 24 persen. Diantara hormon chorionic gonadotropin (CG) yang berasal dari bangsa-bangsa equidae yang telah Iengkap diidentifikasi adalah yang berasal dari kuda. Hormon ini sering disebut pregnant mare serum gonadotropin (PMSG), hormon ini punya peran fisiologis untuk
merangsang ke rja sel-sel interstatial untck tumbuh dan berkenibang dan terbentuknya sel- sel luteal (Solomon, 1988). Hormon dengan Chorionic gonadotropin pada rnanusia (hCG) ini banyak digunakan pada percobaan s u p e m l a s i seperti dilakukan oleh Ertzeid clan Storeng (1992) superovulasi pada mencit dapat meningkatkan tingkat ovulasi tetapi juga meningkatkan abnormalitas embrio pa& post implantasi begitu pula meningkat mortalitas
fetus. Pemanfaatan hormon PMSG dan hCG sebagai suplenientasi medium pematangan oosit babi dilakukan oleh Wang (1995), dimana PMSG clan hCG disuplementasikan pada medium TCM 199 yang telah di tambah FCS 10 Persen dengan konsentrasi PMSG dan hCG masing 10 IUIml medium.
Lemak, lemak sangat dibutuhkan oleh set-sei garnet maupun ernbrio untuk hidup
dan berkembang, kebutuhan tersebut berbentuk asam lemak esensiaf, fosfolipid, lesitin dan kolesterol, lemak-lemak semacam ini banyak terkandung ddam serum (Homa dan Brown, 1992). Lemak sebenarnya pada medium kultur tidak perlu ditambahlcan secara khusus, karena kebutuhan lemak oleh sel-sel garnet maupun embrio sangat sedikit, meskipun lemak dapat digunakan sumber energi tetapi pada umumnya embrio mendapatkannya dengan metabolisme karbohidrat (Dorland dkk.,1995). Sahkan menurut Bavister dkk.(1992) telah berhasil mengkultur embrio kambing dengan medium bebas 1emak.Yoshida dkk. (1992) rnemanfaatkan cairan folikel pada percobaan pematangan oosit babi, ternyata cairan folikel dapat meningkatkan pematangan oosit. Homa dan Brown (1992) meneliti kandungan asam lemak pada cairan folikel sapi berukuran kecil (diameter 1-3mm) dan besar (diameter 7-
13mm) dan diamati pengaruhi asam lemak jenuh maupun asam lemak talc jenuh terhadap terjadinya pecahnya germinal vesikel (GVBD) dsri hasil penelitianriya rnenunjukkan, dalam batas tertentu asam linoleat dibutuhkan untuk memelihara terjadinya proses meiosis pada oosit. demikian pula penurunan konsentrasi asam linoleat selarna perkembangan foiikel juga mengharnbat pecahnya genninal vesikel.
Zat-zat bioaktif iainnya, menunit Shamsudin dkk. (1993) untuk mendapatkan program fertilisasi in virro dengan hasil yang konsisten ada dua prasarat utama yaitu: (1) kemampuan mahxasi oosit (2) kemampuan berkapasitasi untuk melakukan fungsi fisiologis berupa reaksi akrosom pada sebuah populasi sperma motil. Hanya dengan memberikan suplementasi medrurn FIV yang mengandung hyaiuronit saja, dari 88 oosit yang terfertilisasi hanya 4.5 persen. Ternyata diketahui pula bahwa membran sperma mengandung heparin binding protein, pada oosit sapi protein-protein ini tidak mungkin teraktifasi kalau W o r dekapasitasi rnasih terdapat di membran sperma Interaksi antar
asam hialuronit dengan membran sperma tersebut &pat berfungsi bila terdapat heparin. Lassale dan Testrat (1992) dengan menggunakan rnenggwnakan heparin dan glutatione (GSH) dapat rneningkatkan tingkat penetrasi sperma manusia terhadap oosit
hamster sebesar 66 persen, glutation 28 persen dan heparin saja 27 persen, sedangkan kontrol (tanpa penambahan) 46 persen.
Serum. Serum banyak sekali digunakan sebagai suplemen dalam medium antara lain serum anak sapi, BSA (Bovine serum Albumin), menurut Zheng dan Sirard (1992). serum-serum ini sangat berperan dalarn mengurangi kejadian polispermi pada fertilisasi oosit babi, begitu pula dalarn proses maturasi oosit. Disamping itu mcnurut Bakst d m Cecil (1992) menyatakan bahwa BSA &pat rneningkatkan motilitas dan fertilitas dari sperma.
Serum
drtri
beberapa tahap estrus yang digunakan untuk suplementasi medium Mtur in vitro, diharapkan serum tersebut punya spesifikasi berupa kandungan hormonal clan nutrsional yang berfimgsi &lam proses pematangan oosit seperti tampak pada tabel 4 (Widt dkk., 1992). Demikian pula Suzukidkk.
(1992) melakukan suplementasi serumestrus herbau sebesar 5 persen pcla medium kultur ur~tuk pematangan oosit, temyata
dengan menggunakan serum ini sel-sel kumulus berkembang cukup baik, perkembangan sel-sel ini sangat berkaitan erat dengan pematangan oosit. pa& saat awal kebuntingan serum sapi akan banyak mengandung progresteron, sekitar sepuluh hari setelah fertilisasi PGE2 meningkat, sedangkan PGF2a menurun, 1.B-dihydro-15 keto PGF2a (PGFM)
meningkat, demikian pula tejadi sekresi embryonic iuteorropin oleh ernbrio blastosis, peristiwa ini sangat berperan dalarn pemeliharaan tumbuh kembang embrio blastosis in
vivo.(Choi dkk., 1987; Neswender dan Nett, 1988).
Tabel 4. Pengaruh serum fetus sapi terhadap kejadian penetrasi sperma pa& oosit in vitro ( ~ i d t dkk., 1992).
Konsentrasi jumlah jumlah oosit terpenetrasi
serum
fertus sapi oosit % PVS VS IPN 2PN
0 5 0 12 3 3 0 0
M i w r a l dan unsur jaraog, mineral yang dibutuhkan di dalam medium kultur rnerupakan elernen anorganik jarang, misalnya ~a*'. Unsur ini terikat dalarn bentuk Calmodulin berperan sebagai ko-faktor dalam berbagai proses kultur oosit, embrio maupun kapasitasi sperma (Leclerc dkk., 1992; Fraser, 1987).
Pemanfaatan sel-sel kumulus dalam sistim kokultur
Konsentrasi sel-se1 granulosa rendah (sekitar 1 s.d. 5 x
lo6
seI/ml) ditambah gonadotropin atau serum menstimulasi berlangsung kembali proses meiosis (Lu dkk., 1987;Sirard dan Beladeau, 1990 ), tetapi secara in vivo mereka tetap menjaga untuk tidak tejadi meiosis. Dari penelitian Sirard dkk.(1992) peningkatan konsentrasi sel-sel granulosa (5 s.d. 100 x lo6 seVm1) dalam TCM 199 yang disuplementasi 10 persen FCS terhyata rneningkatkan penghambtan berlangsung kembali proses meiosis (dari 2 persen sampai 80 persen). Selain sel-sel granulosa, sel-sel lain yang banyak dimanfaatkan untuk kultur embrio dengan sistem kokultur adalah sel-sel kurnulus. Menurut Sirard dkk.(1992), sel-sel kumulus juga mempunyai sinyal penghambat proses berlangsung kembali proses meiosis, tetapi akm tercuci dalam
medium
M t u r yang bervolurne relatif besar. Lu dkk. (1987) menambahkan tejadi interaksi sinergis antara sel-sel kumdus dengan dbc AMP d a l m mediumP N ,
nukleotida ini menghambat berlangsung proses meiosis, tetapi bila CAMP ditambahkan maka proses meiosis berlangsung kembali. Secara in vitro peningkatan CAMP mengakibatkan sel-sel kumulus terekspansi sedangkan meningkatnya CAMP akan mengaktifasi proses meiosis.O.M.I. ( o o c p e maturation inhibitor) merupakan peptida penghambat proses berlangsungnya proses miosis yang disekresi sel-sel granulosa (Tsafriri dkk., 1975; Sato
dan Ishibashi, 1990). Hubungan yang sangat dekat antara sel-sel granulosa dan sel-sel kumulus disekitar oosit akan tetap mernpertahankan oosit tidak mengalami miosis. Apabila hubungan ini sudah merenggang oieh faktor-faktor pematangan oosit dan atau sel-sel
kumulus terekspansi akan mengakibatkan gap junction dengan cepat menurun jurnlahnya
dari sel-sel tersebut, sebagai akibatnya akses penghambatan berlangsungnya meiosis berkurang drastis.
Embrio kembar identik buatan (Kloning embrio).
Menurut Yang dan Enderson (1992) kemajuan dibidang mikromanipulasi embrio di
luar tub& induk dalam sepuluh tahun terakhir ini telah berkembang dengan sangat cepat, salah saol jenis mikromanipulasi embrio tersebut adalah pembuatan kembar identik dengan metoda spIitting.Westhusin dkk. (1992) daim m e l a k u h l manipulasi embrio dilal,vkan manipulasi oosit terlebih dahulu dengan membuat oosit paruh. Demikian pula Taniguchi dan Kanagawa (1992) memanfiaatkan msit paruh
dalam
melakukan percobaan manipulasi embrio.Rekayasa embrio adalah m e ~ p a k a n
usaha
manusia untuk merubah dan memanipulasi keadaan embrio dengan tujuan-tujuan tertentu. Rekayasa embrio ini antaralain addah penyayatan embrio, pemisahan blastomer-biastomer embrio, pemindahan embrio dari zona pellusida, agregasi embrio, pembuatan embrio partenot, sexing, transfer
inti baik pada embrio rnaupun msit.(Kono
dkk.
1992; Ozil dkkf982; Woolliam clan Wilmut, 1989; Yang clan Anderson, i 992).Menurut Shelton (1 988) tujuan utama memproduksi kembar i&ntik adalah untuk meningkatkan produktifitas ternak untukmemenuhi kebutuhan protein hewani masyarakat, penggunaan teknologi baru ini sangat
bermanfaat karena dapat mernpercepat regenerasi dan evaluasi genetik.
Salah satu manfaa! lain produksi embrio kembar a&lah untuk efisiensi produksi
terutama pa& indusm sapi perah maupun potong, efis~ensi tersebut berupa efisiensi angka reproduksi (Davis dkk.. 1 989: Bredbacka dkk., 1992; Shelton dkk.,1988; Wooliam dan Wilmut, f 989), sedangkan menurut Guerra-Martinez dkk.(1987) pembuatan kembar identik
akan meningkatkan efisiensi biologis dan ekonomis sebesar 20 s.d.25 persen pada produksi sapi potong. Menurut Smith dkk.(1982) clan Reid dkk. (1986) serta Cady dan Van Vleck (1978) produksi kembar identik meningkatkan our put berat sapih per ekor sapi. tetapi
sering meningatlcan masalah menejerial, seperti sering terjadinya distokia, kerusakan plasenta, clan akan memperpanjang breeding interval serta ketidak cukupan produksi susu untuk M e t .
Masalah utama pa& saat mikromanipulasi embrio sapi untuk memproduksi kembar adalah terjadinya kerusakamkerusakan pada sel-sel blastomer, meskipun sel-sel tersebut akan berkembang kembali tahap cleavage awal sehingga terbentuk blastosis. Metode produksi kembar dengan biseksi dapat clilakukan pada embrio tahap morula akhir atau blastosis awal (Ozil dkk., 1982; Ozil, 1983).
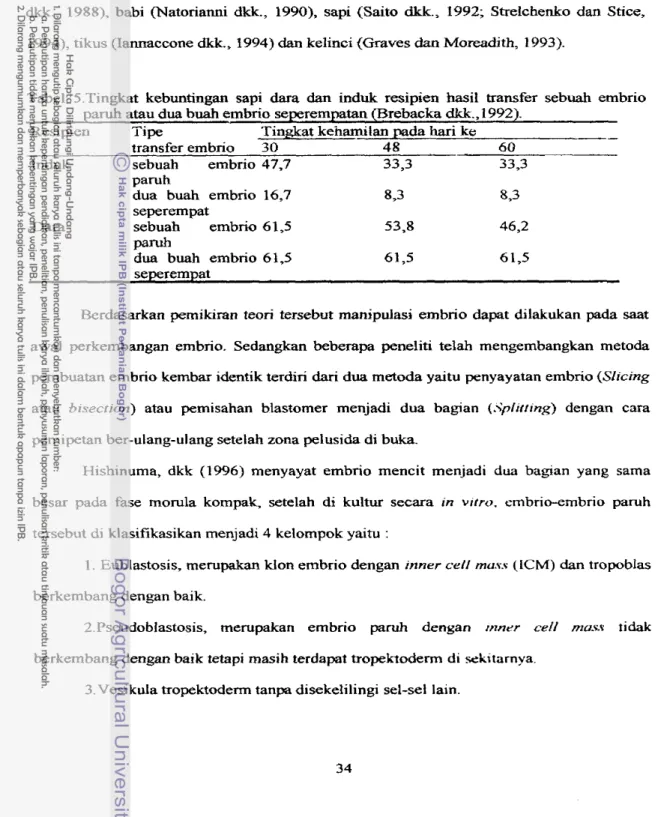
Brebbacka dkk(1992) membandingkan pemunbuhan embrio kembar dua dan
kembar empat, setelah di transfer masing-masing dengan sebuah embrio pstruh pa& seekor induk dan masing-masing dua buah embrio seperempatan, viabilitas embrio pada pengamatan kehamilan hari ke 35, 48 dan 6 0 dihasilkan tingkat kehamilan seperti tertera pada tabel 5.
Menurut Davidson (1986) pada umumnya pa& marnalia rekayasa embrio dilakukan sebelum tahap blastosis, karena blastomer-blastomer ernbrio pada a t ini rnasih bersifat totipoten atau belum mempunyai karakteristik maupun takdir tetap, sehingga pemisahan blastomer ataupun penyayatan embrio untuk memproduksi embrio kembar identik tidak menghilangkan integritas hewan di waktu dewasa. Palmer (1978) menarnbahkan berdasarkan kemampuan ini rnaka kerusakan yang texjadi pada salah satu sel blastomer mampu digantikan sel blastomer lain tanpa memgikan keteraturan proses perkembangan embrio secara lengkap. Dengan kata lain kerusakan blastomer yang terja& pada awal perkembangan embrio tidak &pat dilacak pada perkembangan lanjut sebab tidak
menimbulkan bekas yang nyata. Kultur set-set ernbrio semacam ini sudah pernah dilakukan pada beberapa marnaiia seperti mencit ( Evans d m Kaufman, 1981). marmut (Doetschman
dkk., 1988), babi (Natorianni dkk., 1990), sapi (Saito dkk., 1992; Strelchenko dan Stice, 19941, tikus (Iannaccone dkk., 1994)
dan
kelinci (Graves dan Moreadith, 1993).Tabel 5.Tingkat kebuniingan sapi dara dan induk resipien hasil transfer sebuah embrio par& atau dua buah embrio seperempatan (Brebacka
dkk.,
1992).Resipien
-.
JlPe Tingkat kehamilan pada hari ke -transfer embrio 30 48 60
Induk sebuah embrio 47,7 33,3 33,3
paruh
dua buah embrio 16,7 8 3 8 3
seperernpat
Dara sebuah embrio 61,5 53,8 46,2
paruh
dua buah ernbrio 61,s 61,5 61,5
Berdasarkan pemikiran teori tersebut manipulasi embrio dapat dilakukan pada saat awal perkembangan embrio. Sedangkan beberapa peneliti telah mengembangkan metoda pembuatan embrio kembar identik terdiri dari dua metoda yaitu penyayatan embrio (Slicing atau bisection) atau pemisahan blastomer menjadi dua bagian (.<piitling) dengan cara pemipetan ber-ulang-ulang setelah zona pelusida di buka.
Hishinuma, dkk (1996) menyayat embrio mencit menjadi dua bagan yang sama besar pada fase morula kompak, setelah di kultur secara in vrtro. embrio-embrio pamh
tersebut di klasifikasikan menjadi 4 kelompok yaitu :
1 . Eublastosis, merupakan klon embrio dengan inner cell muss (ICM) dan tropoblas berkembang dengan baik.
2.Pseudoblastosis, merupakan embrio paruh dengan tt7nt.r c e N mas.% tidak
berkembang dengan baik tetapi masih terdapat tropektoderm di wkitarnya. 3. Vesjkula tropektoderm tanpa disekelilingi sei-sel lain.