IV HASIL DAN PEMBAHASAN
4.1 Reidentifikasi Vaksin AI H5N1
Vaksin AI H5N1 inaktif strain Legok diekstraksi RNAnya dan diidentifikasi subtipe virus AI-nya berdasarkan gen hemaglutinin (HA) dan neuraminidase (NA). Reidentifikasi ini penting dilakukan untuk mengetahui bahwa master seed yang digunakan memiliki hemaglutinin H5 dan neuraminidase N1. Vaksin AI yang beredar di Indonesia harus terdaftar di Departemen Pertanian dan diuji mutunya di BBPMSOH (Lampiran 1). Spesifikasi master seed yang digunakan dalam produksi vaksin harus identik dengan keterangan dalam label vaksin (Ditjennak 2007).
Reidentifikasi vaksin AI H5N1 inaktif strain Legok dengan uji RT-PCR menggunakan primer H5 (Lee & Suarez 2004) dan primer N1 menunjukkan hasil positif terhadap virus AI subtipe H5N1. Gambaran pita DNA H5 berada pada 55 pb sesuai dengan primer subtipe H5 (Gambar 8) dan pita DNA N1 berada pada 120 pb sesuai dengan primer subtipe N1 (Gambar 9). Hasil ini menunjukkan bahwa vaksin tersebut menggunakan master seed H5N1. Master seed ini adalah virus AI yang berasal dari isolat lapang saat wabah AI pertamakali terjadi di Indonesia. Isolat berasal dari ayam yang terinfeksi oleh virus AI subtipe H5N1 dari daerah Legok, Banten. Penggunaan isolat tersebut sebagai master seed vaksin produksi lokal merupakan kebijakan pemerintah RI saat keadaan darurat untuk mengatasi wabah AI saat itu walaupun master seed vaksin AI yang direkomendasikan oleh OIE harus berasal dari isolat virus yang Low
Pathogenic Avian Influenza (LPAI) (OIE 2004).
Beberapa kejadian menunjukkan bahwa tidak semua primer H5 dapat digunakan untuk melacak subtipe H5N1. Konfirmasi yang paling tepat untuk menentukan primer adalah dengan mengetahui urutan nukleotida gen HA dan NA (Suwarno et al. 2006).
1 2 3 4 M
Gambar 8 Uji Identitas Vaksin AI H5N1 inaktif Strain Legok dengan uji RT-PCR menggunakan Primer subtipe H5 (produk 55 pb): 1. Kontrol negatif; 2. Kontrol negatif H5; 3. Vaksin; 4. Kontrol positif H5; M. Marker 50 pb (Invitrogen)
4 3 2 1 M
Gambar 9 Uji Identitas Vaksin AI H5N1 inaktif Strain Legok dengan uji RT-PCR menggunakan Primer subtipe N1 (produk 120 pb): 1. Kontrol negatif; 2. Kontrol negatif N1; 3. Kontrol positif N1; 4. Vaksin; M. Marker 100 pb (Invitrogen)
4.2 Produksi Antibodi Poliklonal Avian Influenza H5N1 (Ab1) Pada Marmut
Antibodi poliklonal AI H5N1 dalam serum marmut dapat dideteksi dengan uji Agar Gel Presipitasi (AGP) dan uji hambatan hemaglutinasi (HI) (OIE 2005).
4.2.1 Reidentifikasi Serum Anti AI H5N1 (Ab1) 120 bp 250 pb 200 pb 150 pb 400 pb 300 pb 200 pb 100 pb 100 pb 55 pb 50 pb
Reidentifikasi serum anti AI H5N1 (Ab1) dengan uji AGP menunjukkan reaksi
positif terhadap antigen AI H5N1 dengan terbentuknya garis presipitasi (Gambar 10). Hasil ini menunjukkan bahwa telah terbentuk antibodi yang homolog terhadap virus AI H5N1 yang diimunisasikan.
Gambar 10 Reaksi Presipitasi Serum Marmut Spesifik Terhadap Antigen Virus Avian
Influenza H5N1 Pada Uji Agar Gel Presipitasi: Ag. Antigen AI H5N1; 1.
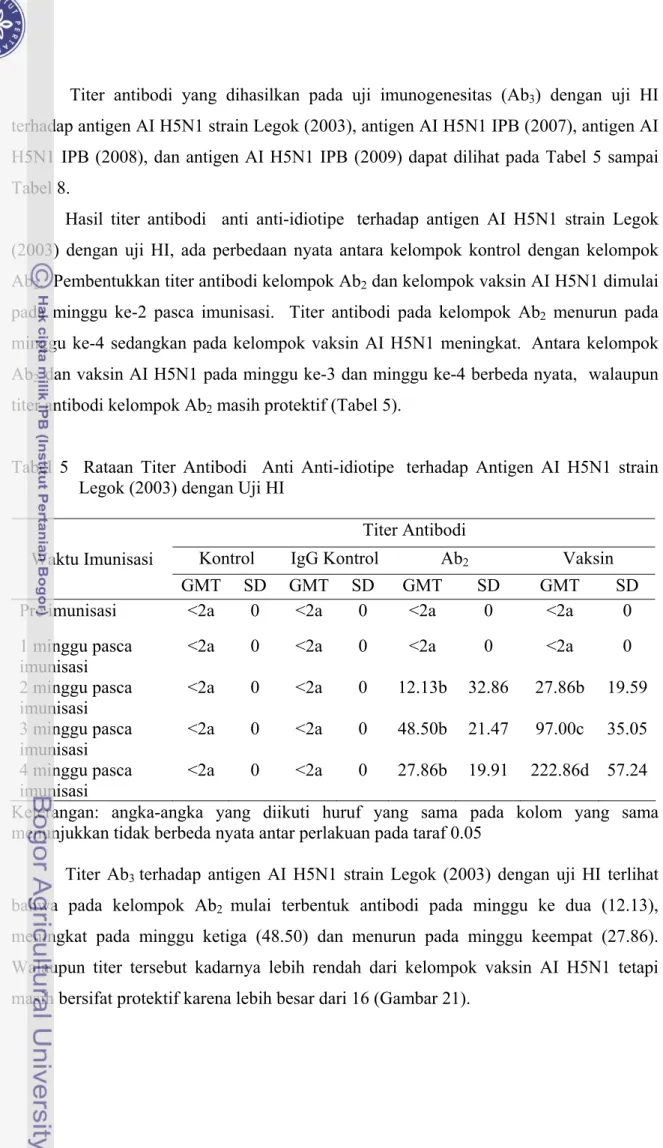
Serum marmut 1; 2. Serum marmut 2; 3. Serum marmut 3; 4. Serum marmut 4; 5. Serum marmut 5; 6. Serum marmut 6; ( ) Garis presipitasi Keberadaan antibodi poliklonal Avian Influenza H5N1 dideteksi dengan uji HI. Hasil titer antibodi dapat dilihat pada Tabel 4 dan Gambar 11. Titer antibodi yang terbentuk satu minggu setelah imunisasi ke tiga sebesar 1351.12 (210.4) . Claassen et al. (2007), mengukur titer antibodi yang dihasilkan oleh ayam layer (white leghorn) SPF terhadap beberapa vaksin AI subtipe H5N1 produksi lokal yang berisi master seed virus AI H5N1 strain Legok. Titer antibodi yang dihasilkan setelah vaksinasi dan diuji dengan HI adalah tinggi yaitu 28-11. Li et al. (2005) dalam penelitiannya mengatakan bahwa hasil titer antibodi terhadap virus AI sebanyak 2 10 (1024) adalah tinggi dan dapat dilakukan panen serum untuk penelitian selanjutnya.
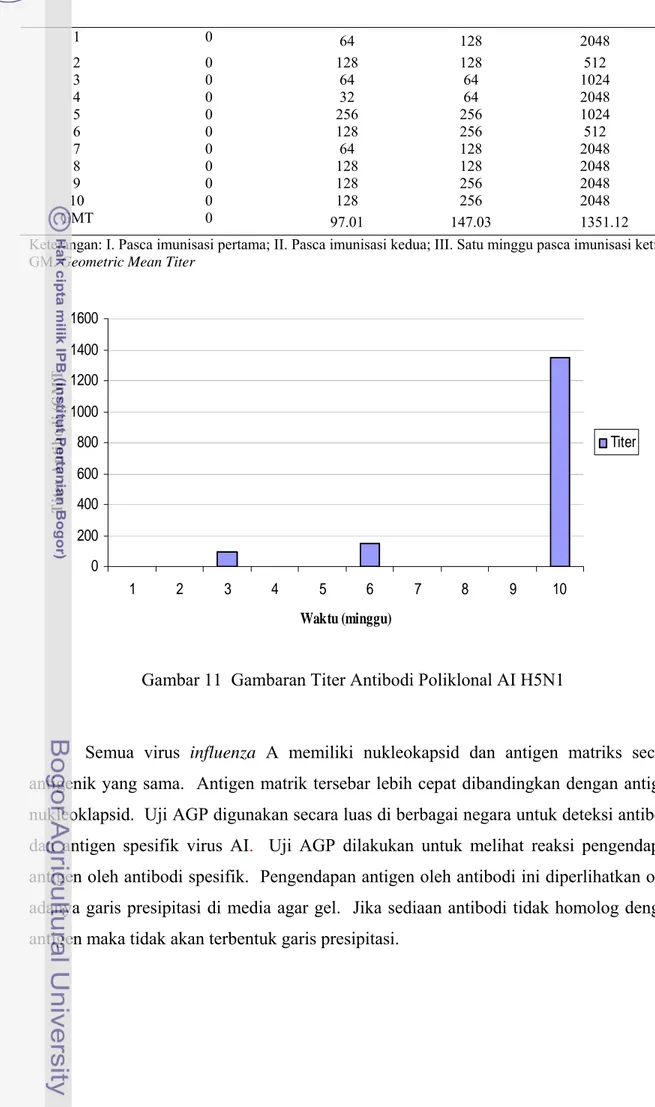
Tabel 4 Titer Antibodi Poliklonal AI H5N1 dengan Uji HI Titer Antibodi
Marmut
Pre imunisasi I II III
Ag 1 4 5 2 6 3
1 0 64 128 2048 2 0 128 128 512 3 0 64 64 1024 4 0 32 64 2048 5 0 256 256 1024 6 0 128 256 512 7 0 64 128 2048 8 0 128 128 2048 9 0 128 256 2048 10 0 128 256 2048 GMT 0 97.01 147.03 1351.12
Keterangan: I. Pasca imunisasi pertama; II. Pasca imunisasi kedua; III. Satu minggu pasca imunisasi ketiga; GM. Geometric Mean Titer
0 200 400 600 800 1000 1200 1400 1600 1 2 3 4 5 6 7 8 9 10 Waktu (minggu) T ite r A n ti b o d i (G M T Titer
Gambar 11 Gambaran Titer Antibodi Poliklonal AI H5N1
Semua virus influenza A memiliki nukleokapsid dan antigen matriks secara antigenik yang sama. Antigen matrik tersebar lebih cepat dibandingkan dengan antigen nukleoklapsid. Uji AGP digunakan secara luas di berbagai negara untuk deteksi antibodi dan antigen spesifik virus AI. Uji AGP dilakukan untuk melihat reaksi pengendapan antigen oleh antibodi spesifik. Pengendapan antigen oleh antibodi ini diperlihatkan oleh adanya garis presipitasi di media agar gel. Jika sediaan antibodi tidak homolog dengan antigen maka tidak akan terbentuk garis presipitasi.
Penggunaan uji AGP dalam penelitian ini karena teknik imunopresipitasi merupakan salah satu cara yang masih dipakai untuk menganalisis atau mengukur kadar antigen atau antibodi. Antibodi yang direaksikan dengan antigen spesifik membentuk kompleks yang tidak larut (presipitat) yang dapat dianalisis dengan berbagai cara. Reaksi presipitasi dapat dilangsungkan dalam media cair maupun media semisolid (gel). Ada beberapa hal yang harus dipertimbangkan dalam teknik imunopresipitasi. Hal yang paling menentukan adalah spesifisitas antiserum atau antibodi yang digunakan dan larutan standar yang stabil dengan kadar yang pasti. Reaksi imunopresipitasi juga dipengaruhi oleh berbagai faktor, diantaranya adalah aviditas antibodi. Aviditas antibodi menentukan derajat stabilitas kompleks antigen-antibodi pada tempat pengikatan (antigen binding
site). Kompleks antigen-antibodi yang terbentuk cenderung berdisosiasi bila antibodi
mempunyai aviditas yang lemah, sebaliknya makin tinggi aviditas antibodi makin stabil kompleks yang terbentuk. Faktor-faktor lain yang berpengaruh misalnya suhu, pH dan molaritas larutan yang dipakai, dan yang tidak boleh diabaikan adalah perbandingan antara konsentrasi antigen dengan antibodi dalam reaksi.
Perbandingan konsentrasi antigen dengan antibodi merupakan faktor terpenting dalam reaksi presipitasi. Pembentukkan presipitasi terjadi apabila antara konsentrasi antigen dengan antibodi tercapai keseimbangan. Kondisi antigen berlebihan akan mengakibatkan melarutnya kembali komplek yang terbentuk (postzone effect), sedangkan antibodi berlebihan menyebabkan komplek antigen antibodi tetap ada dalam larutan tanpa membentuk presipitasi (prozone effect) (Kresno 2001). Hasil penelitian ini terlihat bahwa pembentukkan garis presipitasi antara antigen dan antibodi karena kosentrasi antigen dan antibodi seimbang (zone ekivalen) (Gambar 10). Titer antibodi terhadap AI H5N1 adalah
28-11 (Tabel 4), sedangkan titer antigen AI H5N1 standar sebesar 28-9.
Pembentukan antibodi dipengaruhi beberapa faktor, yaitu: imunogenesitas, kualitas, bentuk kelarutan stimulan, spesies hewan yang di injeksi, rute imunisasi, dan
sensitifitas assay (Bellanti 1993). Imunisasi terhadap marmut pada penelitian ini dilakukan sebanyak 3 kali. Tujuannya adalah untuk membentuk kondisi hiperimun pada marmut, sehingga dihasilkan antibodi dengan titer tinggi. Vaksin inaktif umumnya diperlukan dua atau tiga kali vaksinasi untuk memperoleh titer antibodi tinggi. Vaksinasi pertama adalah untuk memperkenalkan dan kedua sebagai booster atau ulangan sangat
diperlukan, supaya daya imunitasnya cukup tinggi (Roitt 2003; Rantam 2005). Titer antibodi yang tertinggi pada penelitian ini dicapai satu minggu setelah imunisasi ke tiga.
Hemaglutinasi adalah fenomena aglutinasi sel darah merah oleh virus tertentu antara lain oleh virus influenza, sebagian besar virus Myxo beberapa virus Pox (Variola, Vaccinia dan Ectromelia), semua virus Reo, sebagian besar virus Toga, beberapa virus Entero dan lainnya. Bagian virus yang mengaglutinasi sel darah merah disebut hemaglutinin. Virus akan menempel pada permukaan sel darah merah melalui hemaglutinin tanpa menembus masuk ke dalam sel tersebut. Tempat virus menempel pada permukaan sel darah merah merupakan reseptor yang terdiri dari karbohidrat (mukopolisakarida) bersifat seperti lem dan sifat kimiawinya mirip musin pada saluran pernafasan. Hemaglutinasi terjadi karena banyak virus melekat pada sel darah merah dan bila dua sel darah merah yang mengandung partikel virus pada permukaannya bersentuhan mereka saling menempel melalui jembatan protoplasma yang terbentuk antara kedua sel tersebut. Lama kelamaan terbentuk massa yang cukup besar besar terdiri dari sel darah merah yang saling berdekatan (aglutinasi) dan karena massa tersebut cukup berat secara perlahan-lahan akan mengendap ke dasar tabung atau microplate.
Hemaglutinasi oleh virus dapat dihambat oleh antibodi yang spesifik terhadap virus tersebut, sehingga uji hambatan hemaglutinasi digunakan untuk mengetahui dan mengukur adanya antibodi dalam serum. Batas akhir aktivitas penghambatan adalah pengenceran tertinggi dari serum yang masih dapat menghambat secara sempurna penggumpalan sel darah merah. Uji hambatan hemaglutinasi merupakan salah satu uji serologik yang sederhana, cepat dan memiliki sensitiftas yang tinggi untuk deteksi antibodi virus AI (OIE 2008; Capua & Alexander 2009).
Antibodi yang terbentuk akibat paparan antigen dapat mempengaruhi produksi antibodi selanjutnya. Titer antibodi masih rendah pada tahap respon permulaan. Antibodi yang terbentuk akan merangsang sel B yang mempunyai kapasitas memproduksi antibodi dengan afinitas tinggi. Antibodi yang baru terbentuk merupakan faktor penting untuk mendorong proses maturasi afinitas, hal ini terjadi karena antibodi yang terbentuk akan berkompetisi dengan reseptor antigen pada sel B untuk mengikat antigen, sehingga yang terangsang adalah sel B yang mempunyai daya ikat tinggi
terhadap antigen atau berafinitas tinggi, karena itu titer antibodi yang dihasilkan juga tinggi.
Vaksin inaktif diperlukan dalam jumlah banyak untuk dapat merangsang respon antibodi. Respon antibodi tergantung dari antigen yang berada dalam vaksin. Hubungan antara kandungan antigen dalam vaksin inaktif dan respon antibodi penting untuk mengetahui penggunaan vaksin yang optimal (Maas et al. 2007).
Antibodi yang dihasilkan dari imunisasi marmut dengan vaksin AI H5N1 inaktif strain Legok adalah antibodi poliklonal karena antibodi ini dihasilkan oleh turunan dari beberapa sel B yang mengenali epitop berbeda pada antigen yang sama (Alberts et al. 2002). Menurut Roitt (2003), antibodi poliklonal dihasilkan dengan cara menyuntikkan antigen ke dalam tubuh hewan lalu memurnikan antibodi dari serum darah. Antibodi ini umumnya bereaksi dengan banyak epitop Berdasarkan definisinya antibodi poliklonal adalah antibodi yang diperoleh dari hiperimun, disebut juga serum hiperimun dan dapat bereaksi dengan sejumlah determinan antigen yang berbeda pada antigen (bereaksi pada banyak epitop).
4.2.2 Pemurnian Imunoglobulin G Anti AI H5N1 (Ab1)
Pemurnian Imunoglobulin G dilakukan dengan menggunakan Montage Antibody
Purification Kit & Spin Column with Procep A (Millipore). Pemurnian dilakukan untuk
mendapatkan IgG murni sehingga memudahkan proses pemotongan F(ab)2 dari Fc. Kit
ini mempergunakan protein A, yaitu protein dinding sel Staphylococcus aureus yang akan berikatan dengan bagian Fc dari IgG.
Reidentifikasi IgG AI H5N1 dengan uji AGP menunjukkan reaksi positif dengan antigen AI H5N1, ditunjukkan dengan terbentuknya garis presipitasi (Gambar 12). Hal ini berarti bahwa terjadi reaksi serologi yang homolog antara IgG H5N1 dengan antigen AI H5N1 karena IgG AI H5N1 merupakan antibodi spesifik terhadap virus AI H5N1. Konsentrasi IgG AI H5N1 yang diperoleh sebesar 8 mg/ml.
3 2
Ag
Gambar 12 Reaksi Presipitasi Imunoglobulin G Marmut Spesifik Terhadap Antigen Virus Avian Influenza H5N1 Pada Uji Agar Gel Presipitasi: Ag. Antigen AI H5N1; 1,2,3,4,5. IgG AI H5N1; ( ) Garis presipitasi
Imunoglobulin G (IgG) adalah klas imunoglobulin yang terdapat dalam konsentrasi tertinggi dalam serum darah dan mempunyai afinitas yang tinggi untuk berikatan dengan antigen. Imunoglobulin G mampu menetralisasi virus dengan cara mengaglutinasi dan mempresipitasikan antigen (Alberts et al. 2002; Roitt 2003).
4.2.3 Pemotongan Imunoglobulin G AI H5N1 dan Pemurnian Fragmen F(ab)2 Pemotongan Imunoglobulin G (IgG) dengan pepsin untuk memperoleh fragmen F(ab)2 yang selanjutnya akan dimurnikan. Enzim pepsin hampir menghancurkan bagian
fragmen Fc tetapi tidak menghancurkan kedua fragmen Fab (Gambar 13).
Gambar 13 Skema Pemotongan Imunoglobulin dengan Enzim Pepsin: A. Imunoglobulin yang dipotong dengan enzim pepsin; B. Fragmen Fc; C. Fragmen F(ab)2
Pemurnian fragmen F(ab)2 dengan desalting menggunakan Amicon Ultra 15.
Protein dengan berat molekul < 30 kDa akan berada pada bagian bawah dan protein dengan berat molekul yang lebih tinggi akan berada di bagian atas. Fragmen F(ab)2 akan
berada pada bagian atas, karena protein ini memiliki berat molekul 110 kDa. Fragmen F(ab)2 kemudian didialisis untuk menghilangkan garam yang terdapat pada larutan
protein. Dialisis dilakukan menggunakan PBS pH 8,0 selama 24 jam. Proses dialisis ini 4
5 6
pepsin
A B C
Daerahpengikatanantigen
Antibodi
akan menyebabkan molekul-molekul garam keluar melalui pori-pori tabung secara bertahap hingga konsentrasi garam di dalam dan di luar tabung dialisis menjadi sama. Fragmen F(ab)2 hasil pemurnian ini kemudian di analisa profil pita proteinnya
menggunakan Sodium Dodecyl Sulphonat Polyacrylamide Gel Electrophoresis (SDS-PAGE) dan diukur konsentrasinya dengan spektrofotometer ultraviolet.
Profil pita protein Imunoglobulin G dan fragmen F(ab)2 dapat dilihat pada
Gambar 14 dan 15. Imunoglobulin G mempunyai berat molekul 150 kDa dan fragmen F(ab)2 mempunyai berat molekul 110 kDa.
Pengukuran konsentrasi fragmen F(ab)2 dengan menggunakan spektrofotometer
ultra violet diperoleh hasil sebesar 1 mg/ml. Jumlah ini cukup untuk digunakan sebagai antigen, guna menginduksi terbentuknya antibodi anti-idiotipe pada kelinci. Dosis antigen berkisar antara 10-100 µg (Leenars et al. 1997; Paryati 2006; Poetri et al. 2008). Secara in vivo dengan 100 µg fragmen F(ab)2 dapat mencegah virus AI H5N1 (Lu et al.
2006), namun untuk antigen protein dianjurkan memakai dosis antara 50-1000 µg (Leenars et al. 1994). M 1 2 3 4 5 220 100 60 50 40 30 25 20 15 10 M 1 2 225 150 100 75 50 35 25 15 10
Gambar 14 Profil pita protein Imunoglobulin G yang telah dipurifikasi: M. Marker (Invitrogen); 1. IgG Ab1;
2. IgG kelinci kontrol; 3. IgG Ab2; 4. IgG Ab2; 5. IgG kelinci
standar (Promega)
Gambar 15 Profil pita protein Fragmen F(ab)2: M.
Marker (Promega); 1. F(ab)2 ; 2. F(ab)2
dan Fc
Fragmen F(ab)2 adalah antibodi AI H5N1 (Ab1) dan digunakan untuk
mengimunisasi kelinci untuk produksi antibodi anti-idiotipe (Ab2). Fragmen F(ab)2 ini
mampu mengikat antigen seperti antibodi asal dan masih bersifat divalen. Fragmen ini masih dapat mempresipitasikan antigen karena masih mempunyai kedua binding site (tempat ikatan) (Roitt 2003)
Menurut Rantam (2003), SDS-PAGE adalah protein dielektrophoresis dalam detergen ionik yaitu SDS. Detergen ini akan mengikat residu hidrophobik dari bagian belakang peptida secara komplit, dengan demikian protein SDS-komplek migrasi melalui poliakrilamid tergantung dari berat molekulnya. Ada dua sistem pada SDS yaitu kontinyu (Weber & Osbon) dan diskontinyu (Laemli). Sistem kontinyu, campuran protein dilapiskan pada bagian atas (bands pada bagian atas dari separating gel), sehingga kelemahan pada sistem ini akan terjadi resolusi dengan sampel. Penelitian ini menggunakan sistem diskontinyu, dimana protein migrasi dengan cepat melaui pelarut ion pada stacking gel dan separating gel. Protein terkonsentrasi pada garis tipis berupa pita atau band yang tipis.
Lebih lanjut Rantam (2003) menyatakan bahwa Polyacrylamide Gel
Electrophoresis (PAGE) adalah merupakan standar metode pengujian terhadap berat
molekul protein, struktur subunit dan kemurnian protein. Poliakrilamid adalah matrix pilihan untuk memisahkan protein yang mempunyai berat molekul antara 500-250.000 Dalton. Pori-pori pada matrik dibentuk oleh rantai cross-linking linear polyacrylamid dengan bis acrylamide. Ukuran pori-pori berkurang sesuai dengan peningkatan total presentasi acrylamide atau peningkatan derajat presentasi konsentrasi campuran dengan
bisacrylamide. Dengan pembuatan atau pemilihan total konsentrasi yang tepat akan
menentukan pula ukuran yang tepat terhadap ukuran protein yang diinginkan. Jadi semakin tinggi total presentasi akan menghalangi pergerakan protein ke dalam gel, begitu juga bila terlalu rendah total presentasi akan mengakibatkan pergerakan protein menjadi
terlalu cepat bergerak melalui gel yang mengakibatkan didapatkan protein spesifik rendah dan tidak sesuai dengan protein yang diinginkan. Awal terjadinyapolimerasi biasanya disempurnakan oleh ammonium persulfat dan dikatalisa oleh N,N,N,N-Tetramethylethylenediamine (TEMED).
Antibodi (Ab1) murni satu spesies yang disuntikkan ke spesies yang berbeda akan
dikenali sebagai antigen asing dan menimbulkan respon humoral (Ab2) yang kuat
(Harlow & Lane 1988; Roitt 2003). Penggunaan fragmen F(ab)2 dari antibodi sebagai
Ab1 dapat meningkatkan spesifisitas dan mengurangi heterogenitas antibodi yang akan
terbentuk dari hasil imunisasi menggunakan Ab1 sebagai antigen. Imunisasi dengan
fragmen Fab IgG menunjukkan respon yang lebih besar dibandingkan imunisasi dengan IgG yang disebabkan sifat menghambat bagian Fc (Roitt 2003).
4.3 Produksi Antibodi Anti-Idiotipe (Ab2) Pada Kelinci
Fragmen F(ab)2 dari marmut atau disebut juga Ab1 digunakan untuk menginduksi
antibodi anti-idiotipe (Ab2). Fragmen ini diemulsikan dengan menggunakan FCA yaitu
Freund’s adjuvant bentuk lengkap dan diimunisasikan pada kelinci. Dua ekor kelinci di
imunisasi dengan Ab1, dan satu ekor kelinci sebagai kontrol. Satu minggu kemudian
fragmen F(ab)2 diemulsikan dengan FIA yaitu Freund’s adjuvant bentuk tidak lengkap.
Serum kelinci diperiksa keberadaan antibodi terhadap Ab1 dengan uji AGP.
Akibat rangsangan antibodi (Ab1) akan terbentuk antibodi dengan urutan asam
amino khas yang diekspresikan sebagai epitop unik pada regio variabel molekul antibodi (Ab2). Idiotipe pada Ab2 digunakan sebagai dasar pembuatan vaksin yang potensial
untuk melawan agen infeksius (Kennedy & Attanasio 1990).
Identifikasi serum kelinci dengan uji AGP menunjukkan terbentuknya garis presipitasi antara Ab1 dengan serum kelinci, hasil ini menunjukkan bahwa Ab2 memiliki
kemiripan antigenic determinant dengan virus AI yang digunakan sebagai master seed vaksin. Antibodi anti-idiotipe ini selanjutnya dimurnikan IgG-nya
Pemurnian IgG kelinci dilakukan dengan menggunakan Montage Antibody
Purification Kit & Spin Column with Procep A (Millipore). Pemurnian dilakukan
untuk mendapatkan IgG murni. Imunoglobulin G kelinci adalah antibodi anti-idiotipe (Ab2) yang merupakan antibodi poliklonal yang mengandung antibodi dengan
spesifisitas, afinitas dan isotipe yang berbeda. Antibodi poliklonal relatif stabil dan bereaksi dengan sejumlah antigen determinan yang berbeda, sehingga mengakibatkan terbentuknya komplek antigen-antibodi yang lebih besar dan mudah mempresipitasikan antigen.
Karakterisasi antibodi anti-idiotipe (Ab2) dilakukan dengan mengukur berat
molekul dengan SDS-PAGE. Imunoglobulin G kelinci mempunyai berat molekul 150 kDa (Gambar 15).
4.3.2 Reidentifikasi Antibodi Anti-idiotipe (Ab2)
Hasil pemurnian Ig G kelinci selanjutnya diidentifikasi dengan uji AGP. Identifikasi menunjukkan reaksi positif yang ditandai dengan terbentuknya garis presipitasi antara Ab1 dan Ab2, artinya telah terbentuk antibodi terhadap Ab1 (Gambar
16).
Gambar 16 Antibodi Anti-idiotipe Sebagai Imunogen: Ab1. Antibodi AI H5N1; Ab2.
Antibodi anti-idiotipe; ( → ) garis presipitasi
Adanya garis presipitasi merupakan adanya reaksi homolog antara Ab1 dan Ab2.
Daerah variabel suatu antibodi yang mengikat antigen bersifat antigenik dan dapat menstimulasi terbentuknya antibodi terhadap daerah variabel itu sendiri jika disuntikkan
Ab1 Ab2 Ab2 Ab2 Ab2 Ab2 Ab2
pada hewan yang berbeda spesiesnya atau bahkan pada hewan yang sama spesiesnya (Migliorini & Schwartz 1988; Roitt 2003).
Antibodi ini disebut sebagai antibodi anti-idiotipe (Ab2) Avian Influenza H5N1.
Akibat stimulasi antigen terhadap sel B akan terbentuk antibodi yang makin lama makin bertambah. Pada kadar tertentu, idiotipe dari antibodi tersebut akan bertindak sebagai stimulus imunogenik yang mengakibatkan terbentuknya anti-idiotipe. Anti-idiotipe yang terbentuk dengan sendirinya mirip antigen asal, karena itu dinamakan internal image dari antigen asal.
Antibodi Ab2 ini dapat digunakan sebagai antigen pengganti karena memiliki
karakteristik yang sama dengan antigen aslinya terlihat dengan terbentuknya reaksi identitas parsial antara antibodi anti-idiotipe AI H5N1 dengan antigen H5N1 (Gambar 17). Reaksi ini menunjukkan virus AI H5N1 mempunyai determinan antigen yang sama dengan antibodi anti-idiotipe AI H5N1. Menurut Jerne 1985, daerah hipervariabel dari imunoglobulin dapat bersifat sebagai antigen dan antibodi yang terbentuk dari antigen tersebut merupakan antibodi anti-idiotipe yang dapat berikatan secara langsung dengan paratope atau daerah pengikatan antigen dari Ab1. Hasil uji AGP ini membuktikan
bahwa Ab2 mempunyai kemampuan untuk meniru struktur antigen aslinya sehingga Ab2
dapat digunakan sebagai imunogen dalam pencegahan infeksi virus AI H5N1. Abu-Shakra et al. 1997 mengatakan bahwa molekul imunoglobulin yang merupakan protein bersifat antigenik sehingga hewan yang diimunisasi dengan imunoglobulin akan menghasilkan antibodi anti imunoglobulin yang dapat mencegah terjadinya penyakit. Preparasi vaksin untuk mengontrol infeksi viral dengan menggunakan prinsip antibodi anti-idiotipe telah dikembangkan dengan penelitian (Tackaberry et al. 1992; Zhou et al. 1994; Huang et al. 1995; Lin & Zhou 1995; Kennedy et al. 1996).
Gambar 17 Reaksi Identitas Parsial Imunoglobulin G Kelinci Spesifik Terhadap Ab1
dan Antigen Virus Avian Influenza H5N1: Ag. Antigen H5N1; Ab1. antibodi
AI H5N1; Ab2. Antibodi anti-idiotipe; ( ) garis presipitasi
Konsentrasi IgG kelinci diukur dengan spektrofotometer ultraviolet yang diperoleh sebesar 8 mg/ml. Imunoglobulin G kelinci ini digunakan sebagai imunogen pengganti virus AI H5N1 yang diemulasikan dengan Freund’s adjuvant untuk imunisasi ayam SPF umur 4 minggu.
Adjuvan adalah substansi yang jika dicampurkan dengan antigen kemudian disuntikkan akan bekerja memperbesar imunogenesitas antigen sehingga akan memperkuat respon imun terhadap benda asing yang masuk ke dalam tubuh (Kuby 1997). Penggunaan adjuvan di dalam penelitian ini bertujuan untuk meningkatkan respon imun tubuh sehingga antibodi yang terbentuk cukup banyak. Adjuvan membantu imunogen yang kurang imunogenik dalam menggertak sistem imun tubuh. Adjuvan digunakan untuk meningkatkan respon imun apabila antigen memiliki imunogenesitas rendah atau apabila jumlah antigen sedikit. Adjuvan juga dapat berfungsi sebagai depot antigen karena adjuvan sebagai pembawa antigen menuju lokasi sistem imun dan melepaskannya sedikit demi sedikit, sehingga masa pembentukan antibodi berlangsung lebih lama (Leenaars et al. 1994).
Penggunaan adjuvan untuk memacu respons imun dengan afinitas yang tinggi dengan cara memperluas permukaan antigen dan memperlambat pelepasan antigen dalam tubuh, sehingga pembentukan antibodi lebih optimal. Adjuvan memperluas permukaan antigen dan memperlama penyimpanan antigen di dalam tubuh sehingga
Ag Ab1 Ab2 1 2 3
memberi kesempatan pada sistem limfoid untuk menuju antigen sehingga antibodi akan diproduksi dalam jangka waktu lama (Bellanti 1993; Rantam 2005).
Akibat stimulasi antigen terhadap sel B akan terbentuk antibodi yang makin lama makin bertambah. Idiotip dari antibodi tersebut akan bertindak sebagai stimulus imunogenik yang mengakibatkan terbentuknya ant-idiotipe. Anti-idiotipe yang terbentuk juga mempunyai idiotip hingga akan merangsang terbentuknya anti anti idiotipe dan seterusnya.
Freund’s Complete Adjuvant berupa emulsi antigen cairan dalam minyak mineral
mengandung mikobakterium mati karena pemanasan. Freund’s Incomplete Adjuvant yaitu emulsi antigen cairan dalam minyak mineral tapi tidak mengandung mikobakterium.
4. 4 Imunogenesitas “Kandidat Vaksin” (Antibodi Anti-idiotipe)
Imunoglobulin G kelinci (Antibodi anti-idiotipe/Ab2) yang diperoleh dari serum
kelinci kemudian diimunisasikan ke ayam SPF (uji imunogenesitas). Uji imunogenesitas dilakukan dengan membandingkan kelompok kandidat vaksin antibodi anti-idiotipe dengan kelompok kontrol, kelompok IgG kelinci kontrol, dan kelompok vaksin AI H5N1. Antibodi anti-idiotipe (Ab2) sebagai antigen diemulsikan dalam adjuvan yang
bertujuan untuk meningkatkan respon imun ayam. Emulsi antigen dengan CFA dan IFA dapat sebagai depot antigen sehingga pembentukkan antibodi akan berlangsung terus.
Pengujian imunogenesitas dilakukan untuk mengetahui sifat imunogenik antibodi anti-idiotipe dari IgG kelinci terhadap ayam sebagai hewan target. Metode ini merupakan uji potensi vaksin AI yang mengacu pada Farmakope Obat Hewan Indonesia (FOHI) (Ditjennak 2007). Vaksin AI H5N1 sebagai pembanding adalah vaksin dengan strain yang sama dengan Ab2. Serum ayam dikoleksi sampai 4 minggu dengan interval 1
minggu.
Paratop pada Ab2 adalah idiotop Ab1. Idiotop pada Ab2 menimbulkan
pembentukkan Ab3 (Kennedy & Attanasio 1990). Antibodi yang diperoleh dari serum
ayam merupakan antibodi anti anti-idiotipe (Ab3), selanjutnya dilakukan uji HI untuk
mengetahui titer antibodinya dan uji serum netralisasi untuk mengetahui titer antibodi secara in vitro.
. Untuk mengetahui reaksi spesifik antara Ab3 dan antigen AI H5N1 serta reaksi
antara Ab2 dan Ab3 dilakukan pengujian dengan uji AGP. Adanya garis presipitasi pada
Gambar 18 mengambarkan adanya reaksi homolog antara Ab3 dan antigen AI H5N1 dan
terbentuknya garis presipitasi (Gambar 19) menggambarkan adanta reaksi homolog antara Ab2 dan Ab3.
Reaksi spesifik antara Ab3 dan antigen AI H5N1 menunjukkan bahwa pada serum
ayam telah terbentuk antibodi yang sama dengan Ab1 dan mampu berikatan secara
spesifik dengan antigen AI H5N1. Antibodi anti-idiotipe mengandung internal image atau merupakan mimikri dari antigen AI H5N1 yang dapat menginduksi Ab3 spesifik
terhadap antigen aslinya. Kemampuan meniru struktur antigen aslinya merupakan landasan penggunaan antibodi anti-idiotipe sebagai antigen (Shoenfeld 2004).
Ab3
Gambar 18 Reaksi Spesifik antara Antibodi Anti Anti-idiotipe dengan Antigen AI H5N1: Ab3. Antibodi anti
anti-idiotipe; Ag. Antigen AI
H5N1; ( ) garis
presipitasi
Gambar19 Reaksi Spesifik antara Antibodi Anti-idiotipe dengan Antibodi Anti
Anti-idiotipe: Ab2. Antibodi
anti-idiotipe; Ab3. Antibodi anti
anti-idiotipe; ( ) garis presipitasi
Roitt (2003) menggambarkan regulasi idiotipik respon imun yaitu interaksi idiotipe dan anti-idiotipe yang terdapat pada antibodi dan reseptor sel T. Telah dilakukan penelitian sebagai berikut: antigen disuntikkan pada hewan pertama dan antibodi terbentuk Ab1 (idiotipe) dimurnikan dan disuntikan pada hewan ke-2, Ab2 (anti-idiotipe)
Ag Ab3 Ab2 Ab3 Ab3 Ab3 Ab3 Ab3
dimurnikan dan digunakan untuk imunisasi hewan ke-3 dan seterusnya. Secara konsisten ditemukan bahwa Ab2 mengenal idiotipe (Ab1) yang juga jelas ditemukan pada Ab3. Ab4
bersifat seperti Ab2 dalam mengenali idiotipe yang serupa pada Ab1 dan Ab3., jadi
meskipun Ab1 dan Ab3 sama-sama idiotipe, hanya fraksi kecil Ab3 bereaksi dengan
antigen asal. Hasil ini terlihat bila idiotipe tersebut Id yang bereaksi silang (Id umum) berada pada sejumlah antibodi yang bervariasi (secara tidak langsung adalah reseptor B) dengan spesifisitas berbeda. Antibodi anti-idiotipe (Ab2) bila disuntikkan pada hewan
ke-3 akan bereaksi dengan semua sel B pembawa Id1 dan hanya sebagian saja yang mempunyai spesifisitas sama dengan serum asal (Gambar 20).
Gambar 20 Regulasi idiotipik dari respon imun: Ab1 yang dihasilkan oleh rangsangan
antigen disuntikan kepada hewan ke-dua untuk menghasilkan Ab2, yang
dimurnikan dan disuntikkan ke hewan 3, dan seterusnya. Ab2 dan Ab4
masing-masing bereaksi dengan idiotip pada Ab1 dan Ab3 tetapi bagian dari Ab3
bereaksi dengan antigen asal. (Sumber: Roitt (2003))
4.4.1 Uji Serologi Antibodi Anti Anti-idiotipe (Ab3) dengan Uji HI
Antibodi yang diperoleh dari serum ayam merupakan antibodi anti anti-idiotipe (Ab3), selanjutnya dilakukan uji serologi dengan uji HI. Uji hambatan hemaglutinasi
dilakukan terhadap beberapa antigen, yaitu antigen AI H5N1 strain Legok (2003), antigen AI H5N1 IPB (2007), antigen AI H5N1 IPB (2008), dan antigen AI H5N1 IPB
(2009). Ab
Ab3
Titer antibodi yang dihasilkan pada uji imunogenesitas (Ab3) dengan uji HI
terhadap antigen AI H5N1 strain Legok (2003), antigen AI H5N1 IPB (2007), antigen AI H5N1 IPB (2008), dan antigen AI H5N1 IPB (2009) dapat dilihat pada Tabel 5 sampai Tabel 8.
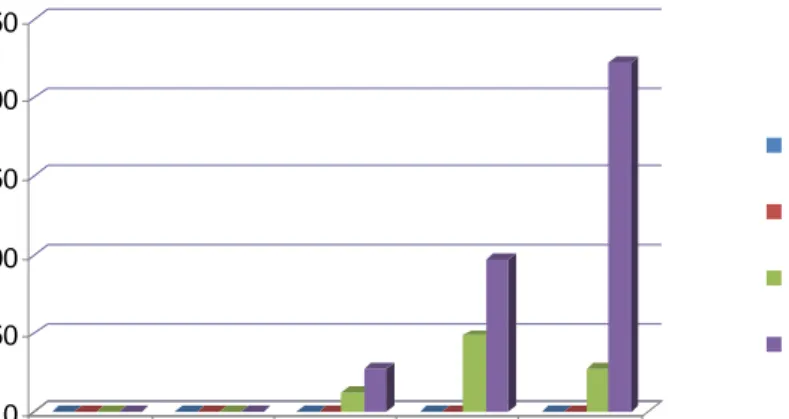
Hasil titer antibodi anti anti-idiotipe terhadap antigen AI H5N1 strain Legok (2003) dengan uji HI, ada perbedaan nyata antara kelompok kontrol dengan kelompok Ab2. Pembentukkan titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 dimulai
pada minggu ke-2 pasca imunisasi. Titer antibodi pada kelompok Ab2 menurun pada
minggu ke-4 sedangkan pada kelompok vaksin AI H5N1 meningkat. Antara kelompok Ab2 dan vaksin AI H5N1 pada minggu ke-3 dan minggu ke-4 berbeda nyata, walaupun
titer antibodi kelompok Ab2 masih protektif (Tabel 5).
Tabel 5 Rataan Titer Antibodi Anti Anti-idiotipe terhadap Antigen AI H5N1 strain Legok (2003) dengan Uji HI
Titer Antibodi
Kontrol IgG Kontrol Ab2 Vaksin
Waktu Imunisasi
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2a 0 1 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 <2a 0 2 minggu pasca
imunisasi <2a 0 <2a 0 12.13b 32.86 27.86b 19.59 3 minggu pasca imunisasi <2a 0 <2a 0 48.50b 21.47 97.00c 35.05 4 minggu pasca imunisasi <2a 0 <2a 0 27.86b 19.91 222.86d 57.24 Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap antigen AI H5N1 strain Legok (2003) dengan uji HI terlihat
bahwa pada kelompok Ab2 mulai terbentuk antibodi pada minggu ke dua (12.13),
meningkat pada minggu ketiga (48.50) dan menurun pada minggu keempat (27.86). Walaupun titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 tetapi masih bersifat protektif karena lebih besar dari 16 (Gambar 21).
0 50 100 150 200 250 R a ta an ti te r A b ( G M T ) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 21 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen H5N1 strain
Legok (2003) dengan Uji HI
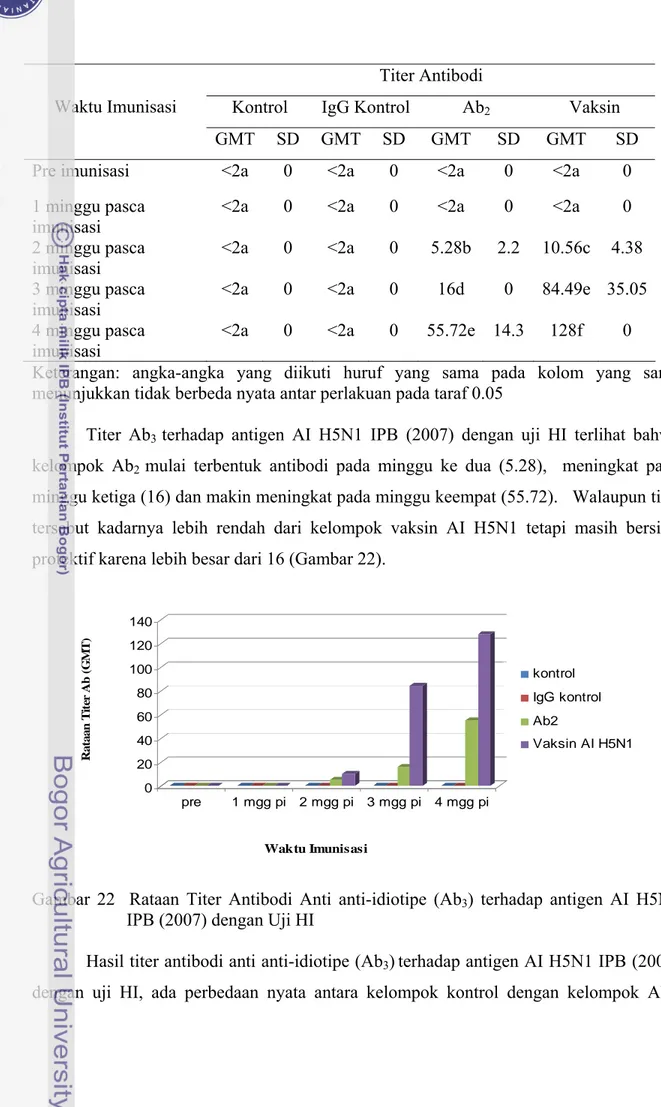
Hasil titer antibodi anti anti-idiotipe (Ab3)terhadap antigen AI H5N1 IPB (2007)
dengan uji HI, ada perbedaan nyata antara kelompok kontrol dengan kelompok Ab2.
Pembentukkan titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 dimulai pada
minggu ke-2 pasca imunisasi. Titer antibodi pada kelompok Ab2 dan kelompok vaksin
AI H5N1 meningkat pada minggu ke-3 dan ke-4 pasca imunisasi. Antara kelompok Ab2
dan vaksin AI H5N1 pada minggu ke-3 dan minggu ke-4 berbeda nyata, walaupun titer antibodi kelompok Ab2 masih protektif (Tabel 6).
Tabel 6 Rataan Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 IPB
Titer Antibodi
Kontrol IgG Kontrol Ab2 Vaksin
Waktu Imunisasi
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2a 0 1 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 <2a 0 2 minggu pasca
imunisasi
<2a 0 <2a 0 5.28b 2.2 10.56c 4.38 3 minggu pasca
imunisasi <2a 0 <2a 0 16d 0 84.49e 35.05
4 minggu pasca imunisasi
<2a 0 <2a 0 55.72e 14.3 128f 0 Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap antigen AI H5N1 IPB (2007) dengan uji HI terlihat bahwa
kelompok Ab2 mulai terbentuk antibodi pada minggu ke dua (5.28), meningkat pada
minggu ketiga (16) dan makin meningkat pada minggu keempat (55.72). Walaupun titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 tetapi masih bersifat protektif karena lebih besar dari 16 (Gambar 22).
0 20 40 60 80 100 120 140 R a ta a n T ite r A b (G M T ) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 22 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen AI H5N1
IPB (2007) dengan Uji HI
Hasil titer antibodi anti anti-idiotipe (Ab3)terhadap antigen AI H5N1 IPB (2008)
Pembentukkan titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 dimulai pada
minggu ke-2 pasca imunisasi. Titer antibodi pada kelompok Ab2 dan kelompok vaksin
AI H5N1 meningkat pada minggu ke-3 dan menurun pada minggu ke-4 pasca imunisasi. Antara kelompok Ab2 dan vaksin AI H5N1 pada minggu ke-2 tidak berbeda nyata,
sedangkan pada minggu ke-3 dan minggu ke-4 berbeda nyata, walaupun titer antibodi kelompok Ab2 masih protektif (Tabel 7)
Tabel 7 Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 IPB (2008)
dengan Uji HI
Titer Antibodi
Kontrol IgG Kontrol Ab2 Vaksin
Waktu Imunisasi
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2a 0 1 minggu pasca
imunisasi <2a 0 <2a 0 <2a 0 <2a 0 2 minggu pasca imunisasi <2a 0 <2a 0 6.06b 2.2 6.96b 7.2 3 minggu pasca imunisasi <2a 0 <2a 0 42.22c 17.53 73.52d 28.62 4 minggu pasca imunisasi <2a 0 <2a 0 24.25c 8.8 27.86c 7.2 Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap antigen AI H5N1 IPB (2008) dengan uji HI terlihat bahwa
pada kelompok Ab2 mulai terbentuk antibodi pada minggu ke dua (6.06), meningkat
pada minggu ketiga (42.22) dan menurun pada minggu keempat (24.25). Walaupun titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 tetapi masih bersifat protektif karena lebih besar dari 16 (Gambar 23).
0 10 20 30 40 50 60 70 80 R at aan t it er A b ( G M T) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 23 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen AI H5N1
IPB (2008) dengan Uji HI
Hasil titer antibodi anti anti-idiotipe (Ab3)terhadap antigen AI H5N1 IPB (2009)
dengan uji HI, ada perbedaan nyata antara kelompok kontrol dengan kelompok Ab2.
Pembentukkan titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 dimulai pada
minggu ke-2 pasca imunisasi. Titer antibodi pada kelompok Ab2 dan kelompok vaksin
AI H5N1 meningkat pada minggu ke-3 dan makin meningkat pada minggu ke-4 pasca imunisasi. Antara kelompok Ab2 dan vaksin AI H5N1 pada minggu ke-2 berbeda nyata,
sedangkan pada minggu ke-3 dan minggu ke-4 tidak berbeda nyata, walaupun titer antibodi kelompok Ab2 masih protektif (Tabel 8).
Tabel 8 Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Antigen AI H5N1 IPB (2009)
Titer Antibodi
Kontrol IgG Kontrol Ab2 Vaksin
Waktu Imunisasi
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2a 0 1 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 <2a 0 2 minggu pasca
imunisasi <2a 0 <2a 0 6.96b 1.79 12.12c 4.38 3 minggu pasca
imunisasi
<2a 0 <2a 0 21.11cd 8.76 24.25de 8.76 4 minggu pasca
imunisasi
<2a 0 <2a 0 36.76ef 14.3 55.71f 39.19 Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap antigen AI H5N1 IPB (2009) dengan uji HI terlihat bahwa
pada kelompok Ab2 mulai terbentuk antibodi pada minggu ke dua (6.96), meningkat
pada minggu ketiga (21.11) dan makin meningkat pada minggu keempat (36.76). Walaupun titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 tetapi masih bersifat protektif karena lebih besar dari 16 (Gambar 24).
0 10 20 30 40 50 60 R a ta a n T ite r A b (G M T ) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 24 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap antigen AI H5N1
IPB (2009) dengan Uji HI
Secara gambaran umum pada kelompok kontrol dan kelompok IgG kontrol tidak menghasilkan titer antibodi terhadap antigen AI H5N1 karena dalam penelitian ini menggunakan ayam SPF. Hasil tersebut juga menunjukkan bahwa tidak ada reaksi kontaminasi dari kelompok antibodi anti-idiotipe dan vaksin AI H5N1. Kelompok
antibodi anti-idiotipe titer antibodi muncul pada minggu ke-2 pasca imunisasi dan meningkat pada minggu ke-3 pasca imunisasi. Titer tersebut menunjukkan bahwa ayam pada kelompok antibodi anti-idiotipe mempunyai kekebalan yang baik terhadap AI H5N1, demikian juga dengan kelompok vaksin AI H5N1. Antara perlakuan kelompok Ab2 dengan kelompok vaksin AI H5N1 tidak ditemukan perbedaan yang nyata sehingga
antibodi anti-idiotipe prospektif sebagai kandidat vaksin.
Antigen yang diimunisasikan pada hewan akan menginduksi terbentuknya antibodi sekitar 1-2 minggu pasca imunisasi. Penurunan kadar antibodi dalam serum merupakan cermin dari hilangnya populasi sel plasma penghasil antibodi spesifik. Sekali berdiferensiasi penuh, sel plasma mati setelah 3-6 hari dan Ig yang dihasilkan ini menurun perlahan-lahan karena proses katabolisme (Tizard 1995). Menurut Alberts et al. (2002), antibodi yang terbentuk oleh sel B akan bertahan melawan agen infeksi dengan mengikat virus.
4.4.2 Uji Serologi Antibodi Anti Anti-idiotipe (Ab3) dengan Uji SN
Antibodi yang diperoleh dari serum ayam merupakan antibodi anti anti-idiotipe (Ab3), juga dilakukan uji serologi secara in vitro dengan uji SN pada sel lestari dari ginjal
anjing (MDCK). Uji serum netralisasi (SN) dilakukan terhadap beberapa isolat, yaitu isolat AI H5N1 strain Legok (2003), isolat AI H5N1 IPB (2005) dan isolat A/Goose/Bojonggenteng/IPB2-RS/2006.
Persiapan sebelum melakukan uji SN adalah dengan menumbuhkan virus AI dari isolat-isolat tersebut pada telur ayam berembrio TAB SPF umur 9 hari, dilanjutkan dengan menumbuhkan dan memperbanyak virus AI pada sel MDCK. Hasil propagasi virus AI pada sel MDCK selanjutnya digunakan untuk uji serologi. Pertumbuhan virus AI pada sel MDCK dapat dilihat pada Gambar 26 dimana terlihat adanya efek sitopatik (Cythopathic Effect/CPE), sedangkan pada Gambar 25 terlihat sel MDCK normal.
Gambar 25 Biakan sel Madin Darby Canine Kidney (MDCK) kontrol (Objektif 40x)
Gambar 26 Sel MDCK yang diinfeksi oleh virus AIH5N1: A. Efek sitopatik hari pertama, B. Efek sitopatik hari ke-dua, C. Efek sitopatik hari ke-tiga (Objektif 40x)
Titer antibodi yang dihasilkan pada uji imunogenesitas (Ab3) dengan uji SN
terhadap isolat AI H5N1 strain Legok (2003), isolat AI H5N1 IPB (2005), dan A/Goose/Bojonggenteng/IPB2-RS/2006 dapat dilihat pada Tabel 9 sampai Tabel 11.
Hasil titer antibodi anti anti-idiotipe (Ab3)terhadap isolat AI H5N1 strain Legok
(2003) dengan uji SN, ada perbedaan nyata antara kelompok kontrol dengan kelompok Ab2 . Pembentukkan titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 dimulai
pada minggu ke-2 pasca imunisasi. Titer antibodi pada kelompok Ab2 dan kelompok
vaksin AI H5N1 meningkat pada minggu ke-3 dan makin meningkat pada minggu ke-4 pasca imunisasi. Antara kelompok Ab2 dan vaksin AI H5N1 pada minggu ke-2,3 dan 4
berbeda nyata, walaupun titer antibodi kelompok Ab2 masih protektif (Tabel 9)
Tabel 9 Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Isolat AI H5N1 strain Legok
(2003) dengan Uji SN
Titer Antibodi
Kontrol IgG Kontrol Ab2 Vaksin
Waktu Imunisasi
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2a 0 1 minggu pasca
imunisasi <2a 0 <2a 0 <2a 0 <2a 0 2 minggu pasca
imunisasi
<2a 0 <2a 0 5.28b 2.1 13.93c 9.79 3 minggu pasca
imunisasi <2a 0 <2a 0 16c 8.76 42.22d 17.52 4 minggu pasca
imunisasi
<2a 0 <2a 0 24.25cd 8.76 97.00e 35.05 Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap isolat AI H5N1 strain Legok (2003) dengan uji SN terlihat
bahwa pada kelompok Ab2 mulai terbentuk antibodi pada minggu ke dua (5.28),
meningkat pada minggu ketiga (16) dan makin meningkat pada minggu keempat (24.25). Walaupun titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 tetapi masih bersifat protektif karena lebih besar dari 16 (Gambar 27).
0 20 40 60 80 100 R a ta a n T it er A b ( G M T ) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 27 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap isolat AI H5N1
Strain Legok (2003) dengan Uji SN
Hasil titer antibodi anti anti-idiotipe (Ab3)terhadap isolat AI H5N1 IPB 2005
dengan uji SN, ada perbedaan nyata antara kelompok kontrol dengan kelompok Ab2 .
Pembentukkan titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 dimulai pada
minggu ke-2 pasca imunisasi. Titer antibodi pada kelompok Ab2 dan kelompok vaksin
AI H5N1 meningkat pada minggu ke-3 dan makin meningkat pada minggu ke-4 pasca imunisasi. Antara kelompok Ab2 dan vaksin AI H5N1 pada minggu ke-3 dan minggu
ke-4 tidak berbeda nyata. Titer antibodi kelompok Ab2 masih protektif (Tabel 10).
Tabel 10 Titer Antibodi Anti Anti-idiotipe (Ab3)terhadap Isolat AI H5N1 IPB 2005
dengan Uji SN
Kontrol IgG Kontrol Ab2 Vaksin
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2a 0 1 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 <2a 0 2 minggu pasca
imunisasi <2a 0 <2a 0 4.00b 0 6.96bc 4.89 3 minggu pasca imunisasi <2a 0 <2a 0 9.18c 3.57 10.56c 4.38 4 minggu pasca imunisasi <2a 0 <2a 0 18.38d 7.15 21.11d 8.76 Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap isolat AI H5N1 IPB (2005) dengan uji SN terlihat bahwa pada
kelompok Ab2 mulai terbentuk antibodi pada minggu ke dua (4.00), meningkat pada
minggu ketiga (9.18) dan makin meningkat pada minggu keempat (18.38). Walaupun titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 tetapi masih bersifat protektif karena lebih besar dari 16 (Gambar 28).
0 5 10 15 20 25 Ra ta a n t it er Ab ( G M T) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 28 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap isolat AI H5N1 IPB
(2005) dengan Uji SN
Hasil titer antibodi anti anti-idiotipe (Ab3) terhadap isolat
A/Goose/Bojonggenteng/IPB2-RS/2006 dengan uji SN adalah antara kelompok kontrol dengan kelompok Ab2 berbeda nyata. Pembentukkan titer antibodi kelompok Ab2
dimulai minggu 4 pasca imunisasi dan kelompok vaksin AI H5N1 dimulai minggu ke-3 pasca vaksinasi. Titer antibodi baik pada kelompok Ab2 dan kelompok vaksin AI
H5N1 berbeda nyata. Titer antibodi kelompok Ab2 dan kelompok vaksin AI H5N1 tidak
protektif (Tabel 11).
Tabel 11 Titer Antibodi Anti Anti-idiotipe (Ab3) terhadap Isolat
A/Goose/Bojonggenteng/IPB2-RS/2006 dengan Uji SN
Titer Antibodi
Kontrol IgG Kontrol Ab2 Vaksin
Waktu Imunisasi
GMT SD GMT SD GMT SD GMT SD
Pre imunisasi <2a 0 <2a 0 <2a 0 <2 0 1 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 <2 0 2 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 <2 0 3 minggu pasca
imunisasi
<2a 0 <2a 0 <2a 0 4.00b 0 4 minggu pasca
imunisasi
<2a 0 <2a 0 4.00b 0 8.00c 0
Keterangan: angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata antar perlakuan pada taraf 0.05
Titer Ab3 terhadap isolat A/Goose/Bojonggenteng/IPB2-RS/2006 dengan uji SN
terlihat bahwa pada kelompok Ab2 mulai terbentuk antibodi pada minggu keempat (4.00)
pasca imunisasi. Titer tersebut kadarnya lebih rendah dari kelompok vaksin AI H5N1 dan lebih kecil dari 16, menunjukkan bahwa Ab2 tidak protektif terhadap isolat tersebut
0 2 4 6 8 R at aan T it er A b ( G M T ) pre 1 mgg pi 2 mgg pi 3 mgg pi 4 mgg pi Waktu Imunisasi kontrol IgG kontrol Ab2 Vaksin AI H5N1
Gambar 29 Rataan Titer Antibodi Anti anti-idiotipe (Ab3) terhadap isolat
A/Goose/Bojonggenteng/IPB2-RS/2006 dengan uji SN
Hasil uji serologi in vitro dengan uji SN menunjukkan bahwa titer antibodi anti anti-idiotipe (Ab3) antara perlakuan Ab2 dengan vaksin AI H5N1 tidak ditemukan
perbedaan yang nyata terhadap isolat AI H5N1 strain Legok (2003) dan isolat AI H5N1 IPB (2005) sehingga antibodi-anti-idiotipe prospektif sebagai kandidat vaksin, sedangkan pada antara perlakuan Ab2 dengan vaksin AI H5N1 tidak ditemukan
perbedaan yang nyata terhadap isolat A/Goose/Bojonggenteng/IPB2-RS/2006, akan tetapi strain ini tidak terlindungi karena titer antibodi kurang dari 16, jadi antibodi anti-idiotipe (Ab2) tidak prospektif sebagai kandidat vaksin karena antara kelompok kontrol
dan perlakuan tidak terdapat perbedaan yang nyata.
Uji serologi sangat penting dilakukan untuk memeriksa titer atau kadar antibodi pada ayam yang telah diimunisasi oleh vaksin AI. Seekor ayam dapat dinyatakan kebal terhadap penyakit AI jika memiliki titer antibodi serendah-rendahnya 4 (log 2) atau 24 atau 16. Sementara itu kelompok peternakan ayam dinyatakan kebal terhadap AI jika lebih dari 90 % memiliki titer antibodi pasca imunisasi serendah-rendahnya 16 (Ditjennak 2007).
Virus influenza A tumbuh dengan baik secara in vivo pada TAB dan in vitro pada
mengandung antibodi terhadap berbagai patogen khususnya virus AI. Biakan sel yang sering digunakan adalah biakan sel primer (sel fibroblas ayam, sel ginjal, sel hati) dan biakan sel lestari seperti MDCK. Uji serum netralisasi dengan menggunakan beberapa isolat AI H5N1 pada sel MDCK untuk mengetahui apakah Ab3 mampu menetralisasi
virus AI. Uji ini (in vitro) penting dilakukan mengingat idealnya vaksin AI harus diuji tantang pada hewan target (in vivo) yang harus menggunakan fasilitas kandang
Biosecurity Level 3 (BSL 3).
Sel MDCK merupakan sel lestari yang berasal dari epitel ginjal anjing. Sel MDCK diperoleh dari American Tissue Culture Collection 34 (ATCC). Sel ini telah banyak digunakan untuk isolasi virus AI karena virus AI sangat produktif dan mudah tumbuh. Biakan sel tersebut setiap saat dapat disiapkan untuk kepentingan produksi antigen dalam jumlah banyak, dibandingkan telur ayam berembrio SPF selain harganya mahal juga tidak selalu siap pada saat diperlukan untuk pengujian karena harus menunggu umur embrio yang tepat saat inokulasi (9-11 hari). Biakan sel dalam bidang virologi, seringkali digunakan untuk perbanyakkan virus, mengetahui kandungan virus dan diagnosa penyakit. Teknik ini menjadi pilihan karena penggunaan telur ayam berembrio masih mengandung bermacam-macam kontaminasi mikroba (Park et al. 2001). Meskipun demikian teknik biakan sel memerlukan ketrampilan khusus dan harus steril(Tobita et al. 1975).
Berdasarkan rekomendasi dari ATCC sel MDCK harus dikembangkan dengan menggunakan medium Eagle yang dilengkapi 10% Fetal Calf Serum (FCS). Selain untuk propagasi virus, sel MDCK digunakan pula untuk uji serologik, yaitu untuk mengetahui antibodi terhadap virus AI dengan menggunakan uji serum neutralisasi (SN) (WHO 2002). Uji SN telah banyak digunakan di laboratorium diagnostik baik untuk
screening maupun untuk titrasi antibodi, sehingga dapat diketahui keterpaparan hewan
oleh virus tersebut. Pemakaian sel MDCK sangat disarankan mengingat peraturan tentang
animal welfare yang melarang penggunaan hewan coba apabila penelitian tersebut masih
dapat menggunakan sel lestari asal hewan. Titer antibodi adalah pengenceran serum tertinggi yang dapat menetralisasi virus (Maas et al. 2007).
Menurut Reina et al. 1997, sel MDCK adalah biakan sel yang paling sensitif (100%) untuk digunakan sebagai pertumbuhan virus AI dibandingkan sel Vero (green
monkey continous cell line) (71.4 %) dan sel MRC-S (human lung embryonated cells )
(57.1 %). Biakan sel MDCK baik digunakan untuk diagnosa virus influenza (Clavijo et
al. 2002) dan produksi vaksin influenza (Liu et al. 2009). Penggunaan sel MDCK dalam
produksi vaksin AI H5N1 inaktif lebih cepat dan hasilnya lebih baik dibandingkan dengan TAB (Hu et al. 2008).
Pertumbuhan virus AI H5N1 pada sel MDCK ditandai dengan terbentuknya efek sitopatik (Cytophatogenic Effect/CPE). Pengamatan dilakukan setiap hari hingga hari ke-7. Efek sitopatik virus AI akan terbentuk dalam waktu 32 jam (Wanasawaeng et al. 2009) sampai 72 jam. Efek sitopatik terlihat pada hari pertama kemudian akan meningkat pada hari ke 3 (Shankar et al. 2009). Perubahan sel diawali dengan degenerasi, sel-sel bentuknya bundar kemudian nekrosa (Shankar et al. 2009; Wanasawaeng et al. 2009). Efek sitopatik isolat AI H5N1 strain Legok (2003) A/Goose/Bojonggenteng/IPB2-RS/2006 terbentuk pada hari ke pertama dan isolat AI H5N1 IPB (2005) terbentuk pada hari ke-2 (Gambar 26).
Menurut Shankar et al. (2009), virus AI yang tidak patogen (LPAI) tidak akan memproduksi CPE pada sel MDCK, tetapi virus AI yang ganas (HPAI) akan membentuk CPE pada sel MDCK. Isolat AI H5N1 Legok (2003) termasuk subtipe HPAI H5N1 (Wiyono et al. 2004). Isolat AI H5N1 IPB (2005) termasuk HPAI yang terdaftar dalam bank isolat pathogen FKH IPB. Isolat A/Goose/Bojonggenteng/IPB2-RS/2006 (H5N1) adalah virus AI subtipe H5N1 yang berhasil diisolasi dari unggas air subklinis dipeternakan skala rumah tangga di Jawa Barat yang secara molekuler, urutan asam aminonya menunjukkan virus HPAI (Susanti et al. 2008).
Antibodi anti-idiotipe (Ab2) dari kelinci merupakan antibodi poliklonal yang
mengandung antibodi dengan spesifisitas, afinitas dan isotipe yang berbeda. Antibodi poliklonal relatif lebih stabil, sehingga secara keseluruhan aktivitasnya tidak begitu berpengaruh walaupun titernya sedikit menurun. Antibodi poliklonal bereaksi dengan sejumlah antigen determinan yang berbeda pada antigen sehingga rekativitas multipel ini dapat mengakibatkan terbentuknya kompleks antigen-antibodi yang besar maka terjadi presipitasi antigen. Antibodi monoklonal, karena sifatnya yang monospesifik kurang mempresipitasi antigen (Burgess 1995; Paryati et al. 2006). Menurut Lin dan Zhou (1995) antibodi anti-idiotipe yang hanya bereaksi terhadap epitop tunggal agen infeksius
mampu memberikan perlindungan protektif terhadap antigen yang memiliki banyak epitop, selain itu antibodi anti-idiotipe juga mampu meniru sifat antigenik sehingga dapat digunakan sebagai imunogen yang dapat menimbulkan respon spesifik terhadap agen infeksius.
Antibodi anti-idiotipe (Ab2) mampu menginduksi titer antibodi pada hewan target
dan kadarnya masih mampu melindungi terhadap virus AI. Menurut Roitt (2003) senyawa yang bersifat imunogenik apabila mampu merangsang pembentukkan antibodi spesifik yang bersifat protektif terhadap senyawa tersebut dan meningkatkan respon kekebalan selular. Antibodi anti-idiotipe (Ab2) bersifat imunogenik karena mampu
merangsang pembentukkan antibodi spesifik yang bersifat protektif terhadap virus AI H5N1. Kemampuan Ab2 kelinci untuk menginduksi antibodi pada ayam menunjukkan
bahwa Ab2 bersifat internal image dan mampu menembus barrier spesies (Zhou et al.
1990).
Anders et al (1989) mengatakan bahwa penggunaan virus influenza sebagai model
untuk preparasi antibodi anti-idiotipe merupakan penelitian yang sangat menarik. Antibodi anti-idiotipedigunakan sebagai imunogen atau antigen. Antibodi anti-idiotipe dapat digunakan sebagai vaksin alternatif untuk penyakit yang disebabkan oleh agen infeksius yang ganas, berbahaya dan sulit dibiakkan juga tidak mengandung resiko adanya agen infeksius yang dapat menimbulkan penyakit pada hewan yang divaksinasi (Lin & Zhou 1995).
Penggunaan antibodi anti-idiotipe sebagai vaksin dapat dipertimbangkan, walaupun titer antibodi yang terbentuk lebih rendah bila dibandingkan dengan vaksin virus AI. Perbedaan titer antibodi tersebut dapat dipengaruhi oleh perbedaan imunogen, misalnya derajat keasingan. Sistem imun dari suatu individu akan lebih cepat terbentuk terhadap antigen atau virus dibandingkan dengan antibodi anti-idiotipe, karena antibodi merupakan komponen tubuh normal pada suatu individu. Produksi vaksin pada vaksin komersil umumnya diberikan bahan lain sebagai tambahan atau pengawet. Bahan-bahan tambahan yang terdapat di dalam vaksin seperti benzetonium khlorida, etilen glicol, glutamat, neomycin, fenol, streptomycin, atau thimerosal. Bahan-bahan tersebut dapat membuat vaksin lebih awet, stabil pada panas, cahaya, dan kondisi lingkungan lainnya.
Oleh karena itu perlu dipertimbangkan penambahan bahan lain terhadap antibodi anti-idiotipe agar dapat meningkatkan sifat imunogeniknya dan stabil pada lingkungan.
Vaksin AI yang digunakan saat ini adalah vaksin inaktif. Vaksin inaktif yaitu vaksin yang dihasilkan melalui pengrusakan virulensinya tapi imunogenitasnya masih ada (Rantam 2005). Infektifitas virus dihilangkan sedangkan imunogenesitasnya dipertahankan dengan cara; (1) fisika misalnya dengan pemanasan, radiasi (2) kimia, dengan bahan kimia fenol, betapropiolakton, formaldehid. Proses inaktifasi virus harus dilakukan dengan sempurna agar tidak terjadi pencemaran virus di lingkungan.
Penggunaan antibodi anti-idiotipe sebagai vaksin perlu dipertimbangkan karena vaksin antibodi anti-idiotipe relatif lebih stabil dan aman. Pengembangan antibodi spesifik H5N1 merupakan strategi alternatif untuk pencegahan dan kontrol wabah AI di masa datang (Lu et al. 2006). Vaksin antibodi anti-idiotipe dapat mengatasi resiko yang mungkin timbul akibat penggunaan virus AI sebagai bahan vaksin, mengingat virus AI H5N1 merupakan virus yang infeksius dan ganas. Vaksin antibodi anti-idiotipe dapat sebagai pilihan yang tepat dalam program vaksinasi AI karena proses pembuatan vaksin antibodi anti-idiotipe yang aman dan virus tidak mencemari lingkungan, sehingga tidak beresiko akan tersebarnya kembali virus infektif dan tidak akan menimbulkan wabah penyakit. Vaksin antibodi anti-idiotipe relatif stabil karena tidak akan mengalami mutasi. Hal ini disebabkan vaksin antibodi anti-idiotipe dibuat berdasarkan pengenalan antigen oleh antibodi yang dapat menghasilkan imunitas spesifik untuk mencapai tujuan imunisasi (Vizcaino 2004).