Potensi Agen Hayati dalam Menghambat Pertumbuhan Phytium sp. secara In Vitro
Liza Octriana
Balai Penelitian Tanaman Buah Tropika, Jl. Raya Solok Aripan Km. 8 PO Box 5, Solok 27301 Telp. (0755) 20137; Faks. (0755) 20592; *E-mail: lizaoctriana@ymail.com
Diajukan: 29 Juli 2011; Diterima: 15 November 2011
ABSTRACT
The Potential of Biological Agents to Inhibit Growth of
Phytium sp. In Vitro. The study aimed at testing the potential of some antagonistic fungi isolated from durian seedlings media to inhibit growth of Phytium sp. Research was done at the Central Laboratory of Tropical Fruit Research Solok in July-September 2009 by using a complete randomized design with 5 treatments and 4 replications. Tests was conducted by dual culture method on PDA. The results showed that Gliocladium sp.,
Trichoderma sp.a, Trichoderma sp.b, Aspergilus sp., and
Penicillium sp. can inhibit growth of Phytium sp., with growth inhibition of 50, 49.5, 47, 48, and 38.3% respectively. Inhibition mecanism of Gliocladium sp., and Trichoderma sp. were competition, antibiosis, lisis, and parasitism, while Penicillium sp. was antibiosis. Gliocladium sp., Trichoderma sp.a, Trichoderma sp.b, Aspergilus sp., and Penicillium sp. can be used as biological agents to control pathogenic fungi Phytium sp.
Keywords: Antagonistic fungi, Phytium sp., in vitro.
ABSTRAK
Penelitian bertujuan untuk menguji potensi beberapa cendawan antagonis hasil isolasi dari media pembibitan durian dalam menghambat pertumbuhan Phytium sp. Penelitian dilakukan di Laboratorium Balai Penelitian Tanaman Buah Tropika Solok pada bulan Juli-September 2010. Penelitian disusun dalam rancangan acak lengkap dengan 5 perlakuan dan 4 ulangan. Pengujian daya antagonis cendawan dilakukan dengan metode dual culture yang diinokulasikan pada media PDA. Hasil penelitian menunjukkan bahwa Gliocladium sp., Trichoderma sp.a, Trichoderma sp.b., Aspergilus sp., dan Penicillium sp. dapat menghambat pertumbuhan Phytium sp. secara in vitro, dengan daya hambat masing-masing 50; 49,5; 47; 48; dan 38,3% secara berurutan. Mekanisme antagonis Gliocladium sp. dan Trichoderma sp. adalah kompetisi, antibiosis, lisis, dan parasitisme, sedangkan Penicillium sp. hanya bersifat antibio-sis. Gliocladium sp., Trichoderma sp., Aspergilus sp., dan Penicillium sp. dapat digunakan sebagai agen hayati untuk mengendalikan cendawan patogen Phytium sp.
Kata kunci: Cendawan antagonis, Phytium sp., in vitro.
PENDAHULUAN
Pengendalian patogen yang aman dan tidak mencemari lingkungan adalah pengendalian biologi dengan penggunaan agen hayati. Saat ini terus di-kembangkan cara pengendalian patogen dengan menggunakan agen hayati seperti cendawan antago-nis. Pada umumnya jenis agen hayati yang dikem-bangkan adalah mikroba alami, baik yang hidup sebagai saprofit di dalam tanah, air dan bahan orga-nik, maupun yang hidup di dalam jaringan tanaman (endofit) yang bersifat menghambat pertumbuhan dan berkompetisi dalam ruang dan nutrisi dengan patogen sasaran (Supriadi, 2006).
Telah banyak diisolasi berbagai jenis cenda-wan yang bersifat antagonis terhadap patogen tular tanah, namun penelitian tentang cendawan antago-nis pada Phytium sp. masih kurang. Phytium sp. adalah cendawan tular tanah penyebab penyakit pa-da benih berbagai jenis tanaman.
Suatu jenis cendawan, untuk dapat ditetapkan sebagai agen hayati pengendali patogen tanaman harus dilakukan pengujian keefektifannya dalam kondisi terbatas dan homogen, misalnya secara in
vitro dalam cawan petri. Jika menunjukkan potensi
antagonis dapat menghambat pertumbuhan dan per-kembangan cendawan patogen, dilakukan pengujian lanjutan ke lapang sehingga dapat dikembangkan secara komersial. Mekanisme antagonis yang sering terjadi adalah parasit, antibiosis, lisis, dan kompetisi (Winarsih dan Syafrudin, 2001).
Diperkirakan masih banyak jenis cendawan tanah yang bersifat antagonis terhadap Phytium sp., oleh karena itu dilakukan penelitian untuk menguji keefektifan cendawan antagonis hasil isolasi dari media pembibitan campuran tanah, pukan, dan sekam.
BAHAN DAN METODE
Penelitian dilaksanakan di laboratorium Balai Penelitian Tanaman Buah Tropika Solok pada bulan Juli-September 2009. Penelitian disusun dalam ran-cangan acak lengkap dengan 5 perlakuan dan 4 ulangan. Cendawan yang diuji daya antagonisnya adalah koleksi yang didapat dari hasil isolasi media pembibitan durian, sedangkan Phytium sp. yang di-gunakan adalah hasil isolasi dari bibit durian yang terserang penyakit.
Isolasi cendawan antagonis dilakukan dengan cara pengenceran (soil dilution plate). Sampel tanah sebanyak 1 g dimasukkan ke dalam tabung reaksi, ditambah air steril hingga volume 10 ml, lalu dishaker. Suspensi yang sudah dishaker dipipet se-banyak 1 ml, lalu dimasukkan ke dalam tabung reaksi yang telah berisi 9 ml air steril. Pengenceran seri dilakukan sampai 10-3. Suspensi sebanyak 1 ml dikulturkan ke dalam cawan petri yang telah berisi media PDA (Mardinus, 2006). Masing-masing cen-dawan yang tumbuh pada media PDA kemudian di biakkan secara tunggal, lalu diidentifikasi berdasar-kan Barnett dan Hunter (1998).
Pengujian daya antagonis cendawan dilaku-kan dengan metode biadilaku-kan ganda (dual culture) (Dharmaputra et al., 1999), yaitu dengan cara mengambil masing-masing cendawan biakan murni
Phytium sp. dan cendawan antagonis uji
mengguna-kan cork borer diameter 4 mm. Kemudian diinoku-lasikan pada cawan petri yang berisi medium PDA secara berhadapan dengan jarak 30 mm (Gambar 1). Skema penempatannya adalah sebagai berikut:
Pengamatan yang dilakukan adalah: a. Laju pertumbuhan cendawan
Masing-masing cendawan uji diambil dengan
cork borer ukuran diameter 4 mm, kemudian
diinokulasikan secara tunggal pada cawan petri ukuran diameter 90 mm yang berisi media PDA. Laju pertumbuhan cendawan diketahui dengan cara mengukur pertambahan diameter koloni masing-masing cendawan setiap hari setelah inokulasi (hsi) sampai hari ke-4 hsi.
b. Persentase hambatan, diukur pada hari ke-8 sete-lah inokulasi dan dihitung persentasenya dengan rumus:
R1-R2
Hambatan (%) = R
1
x 100%
c. Mekanisme antagonis menurut Farida (1992) meliputi:
• Kompetisi antara cendawan antagonis uji de-ngan cendawan patogen yang dibiakkan seca-ra ganda (dual culture) setiap hari dalam memperebutkan ruang, makanan dan oksigen dengan melihat diantara kedua cendawan ter-sebut mana yang lebih cepat memenuhi cawan petri diameter 90 mm.
• Antibiosis, dengan melakukan pengukuran le-bar zona kosong (hambatan) yang terbentuk, dan melihat ada/tidaknya perubahan warna pada medium akibat senyawa antibiotik yang dihasilkan cendawan uji.
• Lisis dan parasitisme, dengan mengamati hifa cendawan antagonis uji yang tumbuh di atas hifa cendawan patogen dengan cara mengam-bil potongan hifa 1 cm x 1 cm di tempat ber-temunya kedua cendawan tersebut, diletakkan pada gelas objek untuk diamati di bawah mikroskop.
HASIL DAN PEMBAHASAN
Hasil identifikasi diketahui nama dan karak-teristik makroskopis masing-masing cendawan antagonis uji dapat dilihat pada Tabel 1.
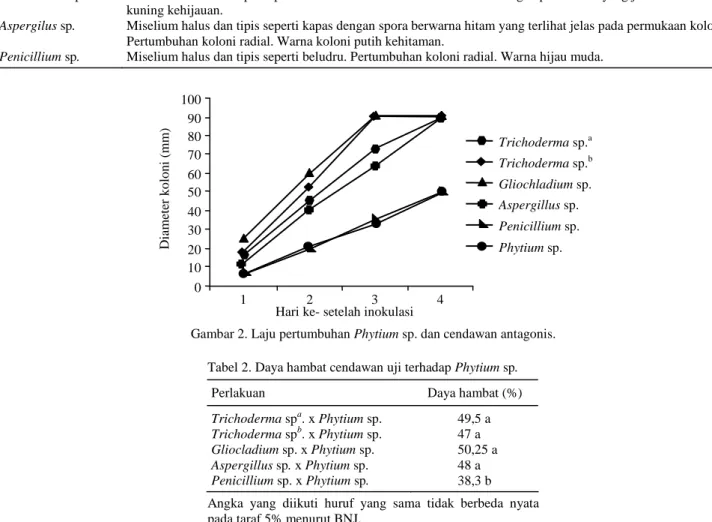
Cendawan antagonis seharusnya mempunyai kecepatan tumbuh yang cepat sehingga dapat meng-ungguli cendawan patogen dalam penguasaan ruang dan akhirnya dapat menekan pertumbuhan patogen. Hal ini dapat dilihat dengan membandingkan per-tumbuhan masing-masing agen hayati dan patogen pada biakan tunggal. Gliocladium sp. mempunyai
Gambar 1. Skema penempatan cendawan patogen dengan cendawan antagonis uji dengan metode dual culture. P = potongan koloni cendawan patogen, A = potongan koloni cendawan antagonis uji, R1 = jari-jari koloni
patogen yang menjauhi koloni cendawan antagonis uji, R2 = jari-jari koloni patogen yang mendekati koloni
cendawan antagonis uji. P A R1 R2
kecepatan tumbuh yang paling tinggi dibandingkan dengan cendawan antagonis lainnya dan Phytium sp.
Kecepatan pertumbuhan yang tinggi menen-tukan aktivitas mikroorganisme antagonis terhadap patogen target. Pada hari ke-3 setelah inokulasi
Gliocladium sp. dan Trichoderma sp.b telah meme-nuhi cawan petri, sedangkan Trichoderma sp.a dan
Aspergillus sp. memenuhi cawan petri pada hari
ke-4 (Gambar 2.) Diameter koloni Gliocladium sp. dan
Trichoderma sp.b pada hari ke-3, yaitu 90 mm, se-dangkan diameter koloni Aspergillus sp. 64 mm dan
Trichoderma sp.b 73 mm. Phytium sp. dan Peni-cillium sp. mempunyai kecepatan tumbuh yang
lambat, pada hari ke-4 setelah inokulasi baru ber-ukuran 50 mm. Oleh karena pertumbuhan
Gliocla-dium sp., Trichoderma sp., dan Aspergillus sp. yang
berbeda sangat nyata dengan Phytium diharapkan ke-3 cendawan ini dapat digunakan sebagai pengen-dali dalam menghambat pertumbuhan Phytium sp.
Daya hambat Gliocladium sp. terhadap
Phy-tium sp. paling tinggi dibandingkan dengan
cenda-wan uji lainnya (Tabel 2). Kemampuan mengham-bat ini dimungkinkan karena kemampuannya ber-kompetisi dalam memperebutkan ruang serta zat makanan sehingga tumbuh dengan cepat dan meng-hambat pertumbuhan cendawan patogen Phytium sp. Di samping pertumbuhan koloni Gliocladium sp. yang lebih cepat dibandingkan dengan lainnya, cendawan tersebut juga menghasilkan senyawa gliovirin dan viridin yang mampu menekan pertum-buhan patogen (Rahardjo dan Djatnika, 2001).
Tabel 1. Karakteristik cendawan antagonis uji. Nama cendawan Karakteristik makroskopis
Trichoderma sp. Miselium halus tebal seperti beludru, pertumbuhan koloni radial dengan pola cincin yang jelas. Warna hijau-putih.
Gliocladium sp. Miselium halus dan tipis seperti beludru. Pertumbuhan koloni radial dengan pola cincin yang jelas. Warna koloni kuning kehijauan.
Aspergilus sp. Miselium halus dan tipis seperti kapas dengan spora berwarna hitam yang terlihat jelas pada permukaan koloni. Pertumbuhan koloni radial. Warna koloni putih kehitaman.
Penicillium sp. Miselium halus dan tipis seperti beludru. Pertumbuhan koloni radial. Warna hijau muda.
Gambar 2. Laju pertumbuhan Phytium sp. dan cendawan antagonis. Tabel 2. Daya hambat cendawan uji terhadap Phytium sp.
Perlakuan Daya hambat (%)
Trichoderma spa. x Phytium sp. Trichoderma spb. x Phytium sp. Gliocladium sp. x Phytium sp. Aspergillus sp. x Phytium sp. Penicillium sp. x Phytium sp. 49,5 a 47 a 50,25 a 48 a 38,3 b
Angka yang diikuti huruf yang sama tidak berbeda nyata pada taraf 5% menurut BNJ.
1 2 3 4 Hari ke- setelah inokulasi
0 10 20 30 40 50 60 70 80 90 100 Di amet er k o lo n i (mm) Trichoderma sp.a Gliochladium sp. Trichoderma sp.b Aspergillus sp. Penicillium sp. Phytium sp.
Gliocladium sp., Trichoderma sp., dan Aspergillus sp. pada biakan ganda tumbuh sangat
cepat berkompetisi dengan Phytium sp. yang meng-akibatkan miselium cendawan patogen terdesak, tidak mendapatkan ruang untuk tumbuh, sehingga
Phytium sp. tidak berkembang, bahkan miselium Gliocladium sp. dan Trichoderma sp. pada hari ke-8
tumbuh di atas cendawan patogen. Kemampuan berkompetisi ini juga merupakan faktor penting dalam menentukan aktivitas cendawan antagonis. Kompetisi antara agen hayati dengan patogen me-nyebabkan patogen tidak punya ruang untuk tempat hidupnya, sehingga pertumbuhannya terhambat.
Pengamatan secara makroskopis pada hari ke-5 setelah inokulasi, hifa kedua cendawan (cenda-wan antagonis uji dengan Phytium sp.) telah ber-temu. Trichoderma sp. dan Gliocladium sp. yang diuji juga bersifat lisis dan parasitisme. Mekanisme lisis ditandai dengan berubahnya warna hifa cenda-wan patogen menjadi bening dan kosong, kemudian ada yang putus, dan akhirnya hancur. Konidia cen-dawan antagonis dapat menyerang hifa cencen-dawan patogen bahkan ada yang mampu menembus hifa cendawan patogen kemudian memanfaatkan isi sel untuk nutrisi cendawan antagonis (Talanca, 2005). Hifa cendawan antagonis dapat membuat pautan atau lilitan terhadap hifa cendawan patogen sehing-ga hifa patogen putus-putus dan hancur.
Trichoderma sp. mempunyai kemampuan
se-bagai parasit dan bersifat antibiosis karena meng-hasilkan enzim yang secara aktif mendegradasi sel-sel patogen, sehingga menyebabkan lisisnya sel-sel-sel-sel cendawan patogen dan mengeluarkan trikotoksin yang dapat mematikan cendawan patogen (Saragih
et al., 2006; Liswarni et al., 2007). Djatnika (2010)
menyatakan bahwa Trichoderma menekan patogen dengan empat mekanisme, yaitu dihasilkannya chitinase, beta 1,3 glukanase, mikoparasit, dan kompetisi penggunaan nitrogen dan karbon.
Se-dangkan Gliocladium sp. menghasilkan senyawa gliovirin dan viridin sehingga dapat menghambat pertumbuhan Phytium sp.
Dari hasil pengamatan diketahui bahwa
Aspergilus sp. tumbuh cepat berkompetisi dalam
memperebutkan ruang dan makanan dengan
Phytium sp. dan bersifat antibiosis membentuk zona
bening antara Aspergilus sp. dan Phytium sp. se-hingga menghambat pertumbuhan cendawan pato-gen Phytium sp. Sedangkan Penicillium tumbuh lambat hampir sama dengan cendawan patogen
Phytium sp., tetapi bersifat antibiosis menghasilkan
senyawa berwarna merah bata yang menghalangi pertumbuhan Phytium sp.
KESIMPULAN
Gliocladium sp., Trichoderma sp., Peni-cillium sp., dan Aspergilus sp. yang diuji berpotensi
digunakan sebagai agen hayati untuk mengendali-kan cendawan patogen Phytium sp. Daya hambat
Gliocladium sp., Trichoderma sp., dan Aspergilus
sp. yang diuji dalam menghambat pertumbuhan
Phytium sp. secara invitro lebih baik dibandingkan
dengan Penicillium sp. Mekanisme antagonis
Gliocladium sp. dan Trichoderma sp. adalah
kom-petisi, antibiosis, lisis, dan parasitisme, sedangkan
Penicillium hanya bersifat antibiosis.
DAFTAR PUSTAKA
Barnett, H.L. and B.B. Hunter. 1998. Illustrated Genera of Imperfect Fungi. Fourth Edition. St. Paul Minnesota, APS Press.
Dharmaputra, O.S., A.W. Gunawan, R. Wulandari, dan T. Basuki. 1999. Cendawan kontaminan dominan pada bedengan jamur merang dan interaksinya dengan jamur merang secara invitro. J. Mikro. Indonesia 4(1):14-18.
Tabel 3. Mekanisme antagonis agen hayati terhadap Phytium sp.
Perlakuan Kompetisi Antibiosis Lisis dan parasitisme
Trichoderma sp.ax Phytium sp. Trichoderma sp.bx Phytium sp. Gliocladium sp. x Phytium sp. Aspergillus sp. x Phytium sp. Penicillium sp. x Phytium sp. + + + + - + + + + + + + + - -
Djatnika. 2010. Cendawan Penyelamat Pisang Medan. Trubus Maret 2010/XL.
Farida, S. 1992. Penggunaan jamur saprob tanah untuk mengendalikan Fusarium oxysporum pada tanaman tomat (Lycopersicum esculenta). J. IPM 2(1):24-29. Liswarni, Y., F. Rifai, dan Fitriani. 2007. Efektivitas
beberapa spesies Trichoderma untuk mengendalikan penyakit layu pada tomat, yang disebabkan oleh Fusarium oxysporum f.sp lycopersici Sacc. Manggaro 8(1):39-42.
Mardinus. 2006. Jamur Patogen Tumbuhan. Universitas Andalas Padang.
Rahardjo I.B. dan I. Djatnika. 2001. Pengendalian hayati bercak daun Xanthomonas sp. pada tanaman sedap malam dengan Pseudomonas fluorescens, Gliocladium sp. dan Trichoderma sp. J. SAIN TEKS. Edisi Khusus, Oktober, 2001. Universitas Semarang. hlm. 301-310.
Saragih, Y.S., F.H. Silalahi, dan A.E. Marpaung. 2006. Uji resistensi beberapa kultivar markisa asam terhadap layu fusarium. J. Hort. 16(4):321-326.
Supriadi. 2006. Analisis resiko agen hayati untuk pengen-dalian patogen tanaman. J. Litbang Pertanian 25(3):75-80.
Talanca, A.H. 2005. Uji berbagai media biakan massal Trichoderma spp. dan aktifitas Trichoderma sp. Terformulasi terhadap cendawan patogen tular tanah. J. Stigma XII(4):600-605.
Winarsih, S. dan Syafrudin. 2001. Pengaruh pemberian Trichoderma viride dan sekam padi terhadap penya-kit rebah kecambah di persemaian cabai. J. Ilmu Pertanian Indonesia 3(1):49-55.