STABILITAS DAN EFEKTIVITAS BIOSENSOR GLUKOSA
BERBASIS Escherichia coli MENGGUNAKAN IMOBILISASI
GLUTARALDEHIDA
RARAS PUNGKI HAPSARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
RARAS PUNGKI HAPSARI. Stabilitas dan Efektivitas Biosensor Glukosa
Berbasis Escherichia coli Menggunakan Imobilisasi Glutaraldehida. Dibimbing
oleh DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan
TRIVADILA
Penelitian ini menganalisis glukosa dehidrogenase (GDH) yang terimobilisasi
pada elektrode pasta karbon sel bakteri Escherichia coli. Voltametri siklik
digunakan untuk mengkaji perilaku katalitik dari biosensor. Analisis yang
digunakan untuk pengoptimuman aktivitas glukosa dehidrogenase adalah metode
permukaan respons. Kondisi optimum aktivitas GDH sel bakteri E. coli tanpa
taut-silang glutaraldehida ialah , suhu 30
oC, pH 6, konsentrasi glukosa 10,25
mM, dan konsentrasi pirolokuinolina kuinon
(PQQ) 3,05 µM. Di sisi lain, kondisi
optimum aktivitas GDH sel bakteri E. coli taut-silang glutaraldehida ialah , suhu
30
oC, pH 6, konsentrasi glukosa 10,25 mM, konsentrasi PQQ 3,05 µM, dan
glutaraldehida 12,5 µL. Reaksi kinetika GDH yang dikatalisis oleh glukosa
mengikuti kinetika Lineweaver-Burk. Nilai K
M appsel bakteri E. coli taut-silang
glutaraldehida lebih kecil sebesar 1,1162 mM dibandingkan dengan tanpa
taut-silang glutaraldehida sebesar 1,9007 mM. Stabilitas aktivitas GDH sel bakteri E.
coli silang glutaraldehida lebih tinggi 68% dibandingkan dengan tanpa
taut-silang glutaraldehida.
ABSTRACT
RARAS PUNGKI HAPSARI. Stability and Effectiveness of Glucose Biosensor
Based on Escherichia coli Using Immobilized Glutaraldehyde. Supervised by
DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, and TRIVADILA
The immobilization glucose dehydrogenase (GDH) cells from Escherichia coli
cross-linking glutaraldehyde on a carbon paste electrode were studied. Cyclic
voltammetry are employed to investigate the catalytic behavior of the biosensor.
The analysis used for the optimization of GDH activity was response surface
method. Optimum conditions for GDH activity was at temperature 30
oC, pH 6,
glucose 10.25 mM, and pyrroloquinoline quinone
(PQQ) 3.05µM for E. coli cells
without cross-link with glutaraldehyde. On the other hand, the optimum
conditions for GDH activity of E. coli cells cross-linked with glutaraldehyde was
at temperature 30
oC, pH 6, glucose 10.25 mM, PQQ 3.05 µM, and glutaraldehyde
12.5 µL. Dehydrogenase reaction kinetics of GDH catalyzed by glucose followed
the Lineweaver-Burk kinetics. K
M appvalue of bacterial E. coli cells cross-linked
with glutaraldehyde at 1.1162 mM was smaller than without cross-link, which
was 1.9007 mM. Stability of activity GDH E. coli cells cross-linked with
glutaraldehyde was 68% higher than that without cross-link.
STABILITAS DAN EFEKTIVITAS BIOSENSOR GLUKOSA
BERBASIS Escherichia coli MENGGUNAKAN IMOBILISASI
GLUTARALDEHIDA
RARAS PUNGKI HAPSARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
menggunakan imobilisasi glutaraldehida
Nama : Raras Pungki Hapsari
NIM :
G44070021
Disetujui
Pembimbing I
Dr. Dyah Iswantini Pradono, M. Agr
NIP 19670730 199103 2 001
Pembimbing II
Pembimbing III
Dr. Novik Nurhidyat
Trivadila, S. Si, M. Si
NIP 19771029 200502 2 001
Diketahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, M.S.
NIP 19501227 197603 2 002
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 Agustus 1988 dari ayah Harun
dan bunda Lestari Rahayu. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2005 penulis lulus dari SLTPN 178 Jakarta Selatan. Tahun 2007
penulis lulus dari SMAN 47 Jakarta Selatan dan pada tahun yang sama lulus
seleksi masuk IPB melalui jalur minat dan bakat (USMI). Penulis memilih mayor
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Kimia
Lingkungan pada tahun ajaran 2010/2011, serta mata kuliah Kimia Fisik pada
tahun ajaran 2011/2012. Penulis juga pernah mengikuti kegiatan Praktik
Lapangan di UPT BPP Biomaterial, Lembaga Ilmu Pengetahuan Indonesia (LIPI)
Cibinong dari bulan Juni hingga Agustus 2010.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan
karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan sejak bulan Maret adalah Biosensor, dengan judul
Stabilitas dan efektivitas biosensor glukosa berbasis Escherichia coli
menggunakan imobilisasi glutaraldehida.
Terima kasih penulis ucapkan kepada Dr. Dyah Iswantini Pradono, M. Agr,
Dr. Novik Nurhidayat, dan Trivadilla, S. Si, M.Si selaku pembimbing, serta
Weniarti, M.Si yang telah banyak memberi saran. Di samping itu, penghargaan
penulis sampaikan kepada Ibu Ai, Bapak Nano, dan Bapak Mail, Staf
Laboratorium Kimia Fisik. Ibu Heny Purwaningsih selaku kepala Laboratorium
Bersana kimia, Bapak Wawan, Bapak Eko, staf Laboratoriun Bersama Kimia. Ibu
Neri, Ibu Erna, Ibu Ratih, dan Bapak Acun di PUSLIT Biologi LIPI yang telah
membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan
kepada Ayah, Bunda, kakak serta seluruh keluarga atas doa dan kasih sayangnya
serta teman-teman seperjuangan di mayor Kimia angkatan 2007.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Tempat dan Waktu Penelitian ... 2
METODOLOGI ... 2
Bahan dan Alat ... 2
Lingkup Kerja ... 2
Media Luria Broth (LB) ... 2
Isolat Bakteri E. coli ... 3
Elektrode Pembanding Ag/AgCl ... 3
Elektrode Pasta Karbon ... 3
Imobilisasi Enzim ... 3
Tanpa Glutaraldehida ... 3
Taut-silang Glutaraldehida ... 3
Pengukuran Elektrokimia ... 3
Pengoptimuman Aktivitas GDH Sel Bakteri E. coli Terimobilisasi ... 4
Parameter Kinetika ... 4
Stabilitas Aktivitas GDH Sel Bakteri E. coli ... 5
HASIL DAN PEMBAHASAN ... 5
Pengoptimuman Aktivitas GDH Terimobilisasi ... 5
Sel
Bakteri
E. coli ... 5
Sel
Bakteri
E. coli taut-silang Glutaraldehida ... 7
Kinetika Enzim Glukosa Dehidrogenase Imobilisasi ... 8
Stabilitas Enzim Glukosa Dehidrogenase Sel Bakteri E. coli ... 9
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Pengoptimuman aktivitas GDH sel bakteri E. coli ... 4
2 Pengoptimuman aktivitas GDH sel bakteri E. coli taut-silang glutaraldehida .. 4
3 Nilai parameter kinetika sel bakteri E. coli ... 9
DAFTAR GAMBAR
Halaman
1 Reaksi oksidasi dengan katalis PQQGDH dan mediator Q
o... 5
2 Alur kontur aktivitas GDH sel bakteri E. coli ... 6
3 Alur kontur aktivitas GDH taut-silang glutaraldehida ... 7
4 Hubungan konsentrasi glukosa dengan aktivitas GDH ... 8
5 Linearitas konsentrasi glukosa dengan aktivitas GDH ... 8
6 Alur Lineweaver-Burk sel bakteri E. coli imobilisasi ... 8
7 Taut-silang enzim pada gugus asam amino dengan glutaraldehida ... 9
8 Stabilitas sel bakteri E. coli ... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir umum penelitian ... . 14
2 Bagan alir kerja ... 15
3 Pembuatan elektrode pasta karbon dan imobilisasi sel bakteri E. coli ... 16
4 Voltamogram siklik sel bakteri E. coli terimobilisasi ... 17
5 Voltamogram siklik taut-silang dengan glutaraldehida terimobilisasi... 18
6 Pengoptimuman sel bakteri E. coli ... 19
7 Pengoptimuman sel bakteri E. coli taut-silang glutaraldehida ... 20
8 Kinetika enzim glukosa dehidrogenase sel bakteri E. coli ... 21
9 Stabilitas sel bakteri E. coli ... 22
PENDAHULUAN
Latar Belakang
Diabetes melitus (DM) adalah penyakit metabolik yang ditandai dengan tingginya kadar glukosa darah yang mengakibatkan kerusakan sekresi insulin. Insulin merupakan hormon yang dilepaskan pankreas yang bertanggung jawab dalam mempertahankan kadar gula dalam darah secara normal. Insulin kemudian masuk ke dalam sel sehingga dapat berguna sebagai energi atau disimpan sebagai cadangan energi. Ketika sekresi hormon insulin ke dalam darah terganggu, maka kadar glukosa di dalam darah tinggi sehingga melewati batas normal dan dapat menyebabkan penyakit DM.
Batas kadar glukosa yang dianggap normal
dalam darah ialah 80_110 mg/dLpada saat
puasa dan setelah makan sebesar 110_160
g/dL. Data statistik dari International
Diabetes Federation (IDF) menyatakan
bahwa saat ini terdapat 230 juta penderita diabetes. Angka ini diperkirakan akan terus meningkat hingga 3% atau sekitar 7 juta orang setiap tahunnya. Menurut WHO (2006), jumlah penderita DM mencapai 194 juta jiwa dan diperkirakan meningkat menjadi 333 juta pada tahun 2025. Indonesia menempati urutan keempat jumlah penderita diabetes terbesar di dunia setelah India, Cina, dan Amerika Serikat, dengan prevalensi 8,6% dari total penduduk. Terapi yang dapat digunakan untuk penyakit DM adalah suntik insulin atau pemakaian obat. Penyuntikan insulin harus dilakukan secara hati-hati, sedangkan terapi dengan latihan jasmani biasanya dilakukan bagi pasien yang gagal meregulasi darahnya. Kelebihan dosis insulin yang disuntikkan dapat mengakibatkan shock bahkan kerusakan otak secara permanen (Desriani 2003). Oleh karena itu, dibutuhkan suatu alat pengukur kadar glukosa darah yang dapat menetapkan konsentrasi gula darah, sehingga dosis insulin yang akan diinjeksi dapat ditentukan.
Awalnya, gula darah yang berbentuk glukosa diukur secara kimiawi menggunakan
paper strip yang dapat berubah warna karena
reaksi kimia dengan glukosa. Produk tersebut banyak mengandung kelemahan seperti akurasi rendah, kecepatan pengukuran lambat, serta ukurannya relatif besar. Untuk mengatasi kelemahan ini, digunakan mikrob penghasil enzim sebagai sensor untuk mengukur kadar glukosa yang disebut sensor mikrob. Alat pengukur atau sensor yang berbasis pada molekul biologis dikenal dengan istilah
biosensor (Desriani 2003). Keuntungan sensor mikrob antara lain biaya yang lebih murah karena tidak diperlukan isolasi dan pemurnian enzim aktif serta lebih stabil.
Biosensor di dunia pertama kali dikembangkan oleh Leland Clark tahun 1956. Clark menggunakan enzim glukosa oksidase (GOD) yang bereaksi spesifik dengan glukosa dan secara alamiah dihasilkan dari jamur
Aspergillus niger. Mekanisme kerja enzim ini
sangat bergantung pada keberadaan oksigen. Akibatnya, alat pengukur kadar gula dalam darah memberikan hasil yang berbeda dari individu yang sama. Hal tersebut, mendorong penggantian enzim GOD dengan enzim glukosa dehidrogenase (GDH). Enzim GDH spesifik terhadap substrat glukosa dan aktivitasnya tidak dipengaruhi oleh kadar oksigen (Turner 2002). PQQGDH merupakan alternatif baru yang digunakan sebagai biosensor glukosa. PQQGDH tidak dipengaruhi kadar oksigen, juga memiliki aktivitas yang tinggi. Struktur kristal pirolokuinolina kuinon (PQQ) diketahui merupakan gugus prostetik enzim GDH. Pengikatan PQQ terhadap enzim GDH terjadi melalui interaksi polar (Ourbrie et al. 1999). Perkembangan biosensor hingga saat ini, biosensor glukosa berbasis nanotabung karbon (CNT) ensembel nanoelektrode (NEEs). Glukosa oksidase terimobilisasi pada CNT NEEs melalui ikatan kovalen kimia karbodiimida dengan membentuk hubungan antara residu amina amida dan gugus asam karboksilat di ujung CNT (Lin et al. 2004).
Penelitian yang telah dilakukan menggunakan mikrob sebagai sumber utama, yaitu Escherichia coli KRGL dan Bacillus
subtilis KRGS. E. coli telah diketahui
menghasilkan GDH-A. Enzim PQQGDH-A merupakan enzim yang dimanfaatkan dan diaplikasikan sebagai biosensor glukosa (Witarto dan Sode 2001). Namun, enzim GDH yang ada pada E. coli berada dalam bentuk apo-GDH (enzim yang belum aktif) dan tidak memiliki kemampuan menghasilkan PQQ. Oleh karena itu, diperlukan penambahan PQQ dari luar untuk mengubah apo-GDH menjadi holo-GDH, yaitu enzim yang aktif. Holo-GDH yang dihasilkan mempunyai aktivitas yang besar (Matsushita
et al. 1997; Iswantini et al. 1998). Aktivitas
GDH yang dihasilkan oleh sel bakteri E. coli KRGS memiliki aktivitas terbesar dibandingkan B. subtilis KRGL baik dengan metode spektrofotometri maupun metode elektrokimia (Trivadila 2006).
2
Metode elektrokimia digunakan dalam pengoptimuman aktivitas enzim GDH (Ikeda
et al. 1998) yang terdiri dari voltametri dan
amperometri. Keunggulan metode ini adalah lebih sensitif, jumlah contoh yang sedikit dapat terdeteksi dengan baik. Selain itu, jumlah enzim yang dihasilkan oleh suatu isolat bakteri E. coli dapat ditentukan (Iswantini et al. 1998).
Menurut Trivadila (2006) setelah 6 jam,
aktivitas GDH yang dihasilkan oleh sel E. coli KRGS mencapai keadaan tunak selama 120 detik setelah ditambahkan glukosa dan mencapai 58% dari aktivitas maksimum. Kestabilannya lebih rendah dibandingkan dengan kestabilan aktivitas GDH yang dihasilkan oleh E. coli K-12 (IFO3301) yang mencapai 70% (Iswantini et al. 2000). Kestabilan aktivitas GDH yang menurun memerlukan pengoptimuman terhadap proses imobilisasi enzim. Salah satu faktor penurun aktivitas adalah pengaruh logam berat.
Imobilisasi enzim menggunakan taut-silang oleh glutaraldehida sangat populer (Ramanavičius et al. 1997). Imobilisasi enzim dengan taut-silang antarmolekul telah banyak digunakan dalam biosensor (Divya et al. 1998). Taut-silang dengan glutaraldehida digunakan dalam kombinasi dengan teknik imobilisasi lainnya. Hal ini meningkatkan stabilitas biosensor (Khan & Wernet 1997). Teknik imobilisasi langsung menggunakan glutaraldehida memberikan sensitivitas lebih tinggi bila dibandingkan dengan imobilisasi pada membran poli(hidroksietil metakrilat), pHEMA (Othman et al. 2006). Konsentrasi glutaraldehida memengaruhi proses imobilisasi enzim tersebut secara optimum. Penaut-silang paling umum digunakan adalah glutaraldehid kelompok aldehida yang bereaksi dengan gugus amin dari rantai samping protein. Keuntungan menggunakan glutaraldehida sebagai reagen biofungsional, yaitu harganya relatif murah dan sering digunakan secara komersial (Mateo et al. 2004). Oleh karena itu, penelitian ini menggunakan imobilisasi glutaraldehida untuk meningkatkan kestabilan dan efektivitas biosensor glukosa berbasis E. coli.
Tujuan Penelitian
Penelitian bertujuan menentukan kestabilan aktivitas enzim glukosa dehidrogenase yang dihasilkan oleh isolat bakteri E. coli KRGS dan efektivitas biosensor glukosa menggunakan imobilisasi glutaraldehida.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Maret sampai Agustus 2011 di Laboratorium Kimia Fisik, Laboratorium Bersama Kimia, Departemen Kimia, kampus IPB Darmaga dan Pusat Penelitian Biologi, Cibinong Science
Center.
METODOLOGI
Bahan dan Alat
Alat-alat yang digunakan adalah eDAQ potensiostat-galvanostat yang dilengkapi perangkat lunak Echem v2.1.0, laminar air
flow, inkubator, high speed refrigated centrifuge KUBOTA 6500, autoklaf, pipet
mikro, sel elektrokimia, serta alat-alat kaca yang lazim di laboratorium.
Bahan-bahan yang digunakan ialah mikrob sel E. coli KRGS yang diperoleh dari koleksi LIPI Mikrobiologi, tripton, ekstrak khamir,
agar, akuades, alkohol 70%, NaCl, MgSO4,
glukosa, PQQ, 2,3-dimetoksi-5-metil-1,4
benzokuinon (Qo), larutan bufer fosfat, gas N2
larutan glutaraldehida (GA, 50% dalam H2O),
larutan albumin serum sapi (BSA) 5%.
Lingkup kerja
Penelitian terdiri atas pembuatan media, peremajaan bakteri, pembuatan elektrode pembanding Ag/AgCl, pembuatan elektrode pasta karbon, dan imobilisasi enzim. Lingkup kerja secara lengkap dapat dilihat pada Lampiran 1-3.
Media Luria Broth (LB) (Trivadila 2006)
Media LB agar miring dibuat dari tripton, ekstrak khamir, NaCl, dan agar. Sebanyak 1 L media dibuat dengan 10 g tripton, 5 g ekstrak khamir, 5 g NaCl, dan 15 g agar serta ditambahkan akuades hingga 1 L. Media dipanaskan hingga homogen dan mencair, kemudian dituangkan ke dalam tabung reaksi masing-masing 5 mL. Tabung reaksi ditutup dengan sumbat, lalu disterilisasi dengan autoklaf selama ± 2 jam. Setelah itu, tabung diletakkan pada rak miring hingga dingin dan padat. Media selanjutnya digunakan untuk meremajakan sel bakteri. Pembuatan media LB cair sama seperti LB agar miring, tetapi tanpa diberikan agar.
3
Isolat Bakteri E. coli (Trivadila 2006)
Bakteri E. coli ditumbuhkan pada media LB agar miring, diinkubasi selama 1 hari pada
suhu 37 oC. Bakteri yang tumbuh selanjutnya
ditanam ke 10 mL media LB cair sebagai
starter, diinkubasi hingga mencapai nilai
OD610= 0,5. Sebanyak 0,5 mL starter
diinokulasi ke dalam 50 mL media LB cair dan diikunbasi. E. coli dipanen dengan disentrifugasi pada kecepatan 10 000 rpm selama 15 menit. Pelet dipisahkan dari supernatan, dicuci 2 kali dengan air distilasi, dan diresuspensikan dengan NaCl 0,85%.
Elektrode Pembanding Ag/AgCl
Proses elektrolisis dilakukan pada kawat perak (Ag) dalam larutan NaCl 3 M. Kawat Ag yang telah terlapisi dengan AgCl selanjutnya dimasukkan ke dalam badan elektrode yang telah terisi larutan KCl 3 M. Elektrode pembanding Ag/AgCl yang dibuat selanjutnya dikualifikasi kinerjanya dengan
elektrolit pendukung KMnO4 0,1 M
menggunakan teknik voltametri siklik. Pengukuran ini menggunakan elektrode kerja platinum dan elektrode bantu kawat platinum.
Elektrode Pasta Karbon (Trivadila 2006)
Elektrode pasta karbon dibuat dari campuran grafit dengan parafin cair (2:1) hingga membentuk pasta. Kemudian pasta karbon dimasukkan ke dalam badan elektrode hingga memadat sampai ke permukaan kaca. Permukaan kaca elektrode dihaluskan dan dibersihkan dengan ampelas dan kertas minyak.
Imobilisasi enzim
Tanpa Glutaraldehida (Trivadila 2006)
Isolat bakteri E. coli yang telah diresuspensikan dengan NaCl 0,85% dihomogenkan. Sebanyak 5 µL larutan sel bakteri diteteskan pada permukaan elektrode pasta karbon, didiamkan hingga pelarutnya menguap. Selanjutnya, permukaan elektrode dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektrode kemudian direndam dalam larutan garam (NaCl fisiologis) pada suhu 5
oC ketika tidak digunakan, untuk memberikan
keadaan yang sama dengan lingkungan sebenarnya. Elektrode dapat langsung
digunakan untuk pengukuran aktivitas GDH secara elektrokimia.
Taut-silang Glutaraldehida
Sebanyak 5, 9, 13, 16, dan 20 µL glutaraldehida 5% (diencerkan dengan 0,1 M bufer fosfat, pH 6,5) dicampurkan dengan 1 µL 5% BSA dan dengan 35, 31, 27, 24, dan 20 µL dari larutan sel bakteri (sel bakteri E.
coli yang telah diresuspensikan dengan NaCl
0,85%). Setelah pencampuran menyeluruh, sebanyak 5 µL larutan campuran sel bakteri diteteskan pada permukaan elektrode pasta karbon, didiamkan hingga pelarutnya menguap. Selanjutnya, permukaan elektrode dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektrode kemudian direndam dalam larutan garam (NaCl fisiologis) pada suhu 5
oC ketika tidak digunakan, untuk memberikan
keadaan yang sama dengan lingkungan sebenarnya. Elektrode dapat langsung digunakan untuk pengukuran aktivitas GDH secara elektrokimia.
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan menggunakan seperangkat alat eDAQ potensiostat-galvanostat yang dilengkapi perangkat lunak Echem v2.1.0. Elektrode yang digunakan ialah elektrode Ag/AgCl sebagai elekrode rujukan, platinum sebagai
counter, dan elektrode pasta karbon-sel
bakteri tanpa glutaraldehida serta taut-silang dengan glutaraldehida sebagai elektrode kerja. Parameter pengukuran dibuat sebagai berikut:
Mode : Cyclic Initial : -400 mV Final : -400 mV Rate : 250 mV/s Step W : 20 ms Upper E : 500 mV Lower E : -400 mV Range : 5 V
Sebanyak 1 mL larutan bufer fosfat ditambahkan ke dalam sel elektrokimia dan puncak arus anode yang terbentuk diamati sebagai blangko. Selanjutnya, ditambahkan
100 µL Qo 5 mM, glukosa, PQQ, dan MgSO4
10 mM. Sebelum dilakukan pengukuran, larutan dideaerasi dengan mengalirkan gas nitrogen selama ± 1 menit. Setelah penambahan setiap zat ke dalam larutan, perubahan arus yang terjadi diamati hingga mencapai arus keadaan tunak secara runut.
4
Pengoptimuman Aktivitas GDH Sel Bakteri E. coli Terimobilisasi
Optimasi yang dilakukan adalah optimasi
suhu (25-35 oC), pH (5-7), konsentrasi
glukosa (0,5-20 mM), konsentrasi PQQ (0,1-6 µM), dan glutaraldehida (5-20 µL). Metode permukaan respons (RSM) digunakan untuk pengoptimuman aktivitas GDH. Metode ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas pada
perangkat lunak statistika Minitab.v.15English. Selanjutnya percobaan
dilakukan sesuai dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas optimumnya. Tabel 1 dan 2 menampilkan kombinasi faktor-faktor peubah bebas untuk pengoptimuman aktivitas GDH sel bakteri E.
coli yang terimobilisasi tanpa glutaraldehida
dan dengan taut-silang glutaraldehida. Tabel 1 Kombinasi suhu, pH, [glukosa],
[PQQ] untuk pengoptimuman aktivitas GDH sel bakteri E. coli terimobilisasi Suhu (oC) pH [Glukosa] (mM) [PQQ] (µM) 28 5,5 5,4 1,6 33 5,5 5,4 1,6 28 6,5 5,4 1,6 33 6,5 5,4 1,6 28 5,5 15,1 1,6 33 5,5 15,1 1,6 28 6,5 15,1 1,6 33 6,5 15,1 1,6 28 5,5 5,4 4,5 33 5,5 5,4 4,5 28 6,5 5,4 4,5 33 6,5 5,4 4,5 28 5,5 15,1 4,5 33 5,5 15,1 4,5 28 6,5 15,1 4,5 33 6,5 15,1 4,5 25 6,0 10,3 3,1 35 6,0 10,3 3,1 30 5,0 10,3 3,1 30 7,0 10,3 3,1 30 6,0 0,5 3,1 30 6,0 20,0 3,1 30 6,0 10,3 0,1 30 6,0 10,3 6,0 30 6,0 10,3 3,1 30 6,0 10,3 3,1 30 6,0 10,3 3,1 30 6,0 10,3 3,1 30 6,0 10,3 3,1 30 6,0 10,3 3,1 30 6,0 10,3 3,1
Tabel 2 Kombinasi suhu, pH, [glukosa], [PQQ], dan glutaraldehida untuk pengoptimuman aktivitas GDH sel bakteri E. coli taut-silang glutaraldehida terimobilisasi Suhu (oC) pH [Glukosa] (mM) [PQQ] (µM) (µL) GA 28 5,5 5,4 1,6 16 33 5,5 5,4 1,6 9 28 6,5 5,4 1,6 9 33 6,5 5,4 1,6 16 28 5,5 15,1 1,6 9 33 5,5 15,1 1,6 16 28 6,5 15,1 1,6 16 33 6,5 15,1 1,6 9 28 5,5 5,4 4,5 9 33 5,5 5,4 4,5 16 28 6,5 5,4 4,5 16 33 6,5 5,4 4,5 9 28 5,5 15,1 4,5 16 33 5,5 15,1 4,5 9 28 6,5 15,1 4,5 9 33 6,5 15,1 4,5 16 25 6,0 10,3 3,1 13 35 6,0 10,3 3,1 13 30 5,0 10,3 3,1 13 30 7,0 10,3 3,1 13 30 6,0 0,5 3,1 13 30 6,0 20,0 3,1 13 30 6,0 10,3 0,1 13 30 6,0 10,3 6,0 13 30 6,0 10,3 3,1 5 30 6,0 10,3 3,1 20 30 6,0 10,3 3,1 13 30 6,0 10,3 3,1 13 30 6,0 10,3 3,1 13 30 6,0 10,3 3,1 13 30 6,0 10,3 3,1 13 30 6,0 10,3 3,1 13 Parameter Kinetika
Penentuan parameter kinetika dilakukan setelah diperoleh kondisi optimum aktivitas GDH. Parameter kinetika enzim GDH sel bakteri E. coli yang diimobilisasi ditentukan dengan menggunakan persamaan Michaelis-Menten: ] [ ] [ glukosa m K glukosa maks I +
5
Imaks adalah respon arus maksimum yang
terukur, KM adalah tetapan Michaelis-Menten,
dan [glukosa] adalah konsentrasi glukosa. Persamaan Michaelis-Menten yang didapat dibuat turunannya, yaitu alur Lineweaver-Burk. Prosedur pengukurannya sama, namun pada uji kinetika konsentrasi substrat glukosa divariasikan, yaitu antara 0,5- 20 mM.
Stabilitas Aktivitas GDH Sel Bakteri E. coli
Stabilitas aktivitas enzim GDH ditentukan setelah didapatkan kondisi optimum aktivitas GDH. Penentuan stabilitas dilakukan pada bakteri E. coli tanpa glutaraldehida dan taut-silang dengan glutaraldehida. Proses pengukuran sama seperti tahap pengoptimuman. Namun, pengukuran dilakukan setiap 2 jam sekali hingga 48 jam.
HASIL DAN PEMBAHASAN
Pengoptimuman Aktivitas GDH Terimobilisasi
Pengoptimuman Aktivitas GDH Sel Bakteri E. coli
Hasil pengoptimuman aktivitas GDH ditunjukkan dengan voltamogram siklik pada Lampiran 4 dan 5 (tanpa maupun dengan taut-silang glutaraldehida). Voltamogram siklik yang diperoleh lalu dianalisis sehingga kenaikan puncak arus oksidasi didapatkan. Gambar 1 menunjukkan reaksi yang terjadi
antara glukosa dengan Qo sebagai mediator.
Arus yang dihasilkan berasal dari elektron yang dihasilkan pada proses oksidasi langsung glukosa membentuk asam glukonat dengan GDH sebagai katalis (Trivadila 2006). Enzim glukosa akan teroksidasi, elektron yang
dilepaskan akan ditangkap oleh Qo. Fungsi Qo
sebagai mediator. Enzim yang teroksidasi membentuk asam glukonat dan elektron yang terlepas (tereduksi) merupakan nilai arus yang terbaca. Hasil tersebut, kemudian diolah dengan menggunakan rancangan percobaan RSM seperti terlihat dalam Lampiran 6. Parameter-parameter yang dioptimumkan,
yaitu pH (5-7), suhu (25-35 oC), konsentrasi
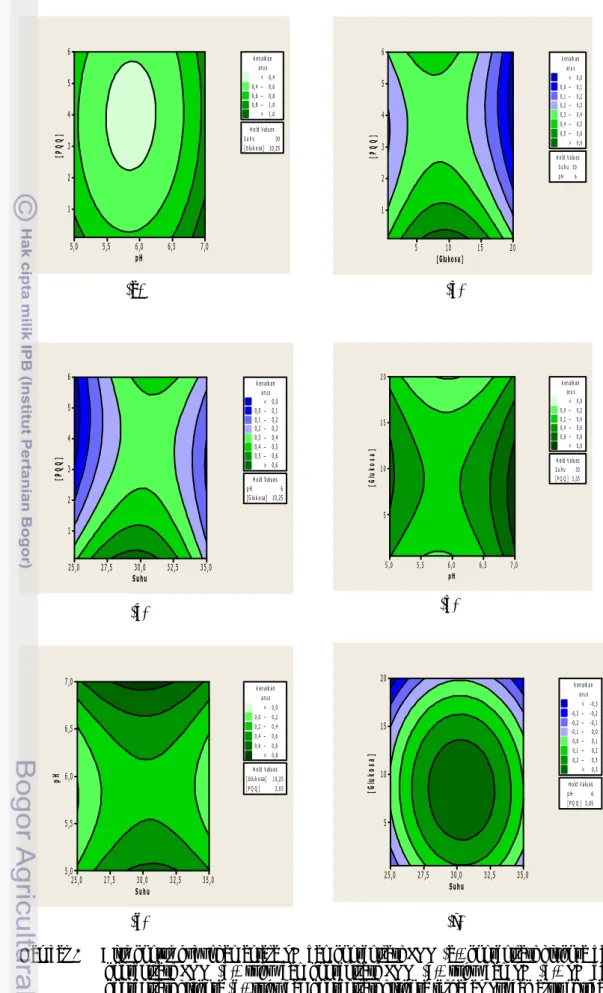
glukosa (0,5-20 mM), dan konsentrasi PQQ (0,1-6,0 µM). Gambar 2 menunjukkan alur kontur hubungan antara berbagai faktor dan puncak arus oksidasi yang dihasilkan. Berdasarkan hasil pengoptimuman didapatkan bahwa kondisi optimum aktivitas GDH sel
bakteri E. coli adalah suhu 30 oC, pH 6,
konsentrasi glukosa 10,25 mM, dan konsentrasi PQQ 3,05 µM.
Jika dibandingkan dengan penelitian yang dilakukan oleh Iswantini et al. (2011), aktivitas GDH sel bakteri E. coli optimum pada pH 6,5 larutan bufer fosfat, konsentrasi PQQ 4,6 µM, dan konsentrasi glukosa 20 mM. Hal ini membuktikan bahwa hasil pengoptimuman puncak arus sangat dipengaruhi oleh proses imobilisasi yang dilakukan. Ito et al. (2002), melaporkan hasil optimasi pH larutan bufer fosfat terhadap aktivitas GDH yang dihasilkan oleh sel E. coli K-12 (IFO3301), dengan pH optimum pada 6,5-7. Parameter yang sangat mempengaruhi dalam pengoptimuman puncak arus yang dihasilkan adalah pH dan suhu. Pergeseran pH terjadi karena enzim terimobilisasi pada matriks yang memiliki perbedaan muatan (Trivadila 2011). Selain itu, adanya perlakuan suhu juga mempengaruhi terhadap puncak arus yang dihasilkan. Pergeseran suhu terjadi karena imobilisasi enzim mengakibatkan ketidakhomogenan sehingga terjadi penyimpangan pada Plot Arrhenius (Bisswanger 2008).
Gambar 1 Reaksi oksidasi dengan katalis
6 pH [P QQ] 7,0 6,5 6,0 5,5 5,0 6 5 4 3 2 1 Suhu 30 [Glukosa] 10,25 Hold Values > – – – < 0,4 0,4 0,6 0,6 0,8 0,8 1,0 1,0 arus kenaikan [Glukosa] [P Q Q ] 20 15 10 5 6 5 4 3 2 1 Suhu 30 pH 6 Hold Values > – – – – – – < 0,0 0,0 0,1 0,1 0,2 0,2 0,3 0,3 0,4 0,4 0,5 0,5 0,6 0,6 arus kenaikan Suhu [PQQ ] 35,0 32,5 30,0 27,5 25,0 6 5 4 3 2 1 pH 6 [Glukosa] 10,25 Hold Values > – – – – – – < 0,0 0,0 0,1 0,1 0,2 0,2 0,3 0,3 0,4 0,4 0,5 0,5 0,6 0,6 arus kenaikan Suhu pH 35,0 32,5 30,0 27,5 25,0 7,0 6,5 6,0 5,5 5,0 [Glukosa] 10,25 [PQQ] 3,05 Hold Values > – – – – < 0,0 0,0 0,2 0,2 0,4 0,4 0,6 0,6 0,8 0,8 arus kenaikan pH [G lu ko sa ] 7,0 6,5 6,0 5,5 5,0 20 15 10 5 Suhu 30 [PQQ] 3,05 Hold Values > – – – – < 0,0 0,0 0,2 0,2 0,4 0,4 0,6 0,6 0,8 0,8 arus kenaikan Suhu [G lu ko sa ] 35,0 32,5 30,0 27,5 25,0 20 15 10 5 pH 6 [PQQ] 3,05 Hold Values > – – – – – – < -0,3 -0,3 -0,2 -0,2 -0,1 -0,1 0,0 0,0 0,1 0,1 0,2 0,2 0,3 0,3 arus kenaikan
Gambar 2 Alur kontur hubungan antara pH dan konsentrasi PQQ (a), konsentrasi glukosa dan konsentrasi PQQ (b), suhu dan konsentrasi PQQ (c), suhu dan pH (d), pH dan konsentrasi glukosa (e), suhu dan konsentrasi glukosa terhadap puncak arus oksidasi (f).
(a) (b)
(c) (d)
(f) (e)
7
Pengoptimuman Aktivitas GDH sel Bakteri
E. coli Taut-silang dengan Glutaraldehida
Parameter yang dioptimumkan untuk aktivitas sel bakteri E. coli taut-silang dengan
glutaraldehida meliputi suhu (25-35 oC), pH
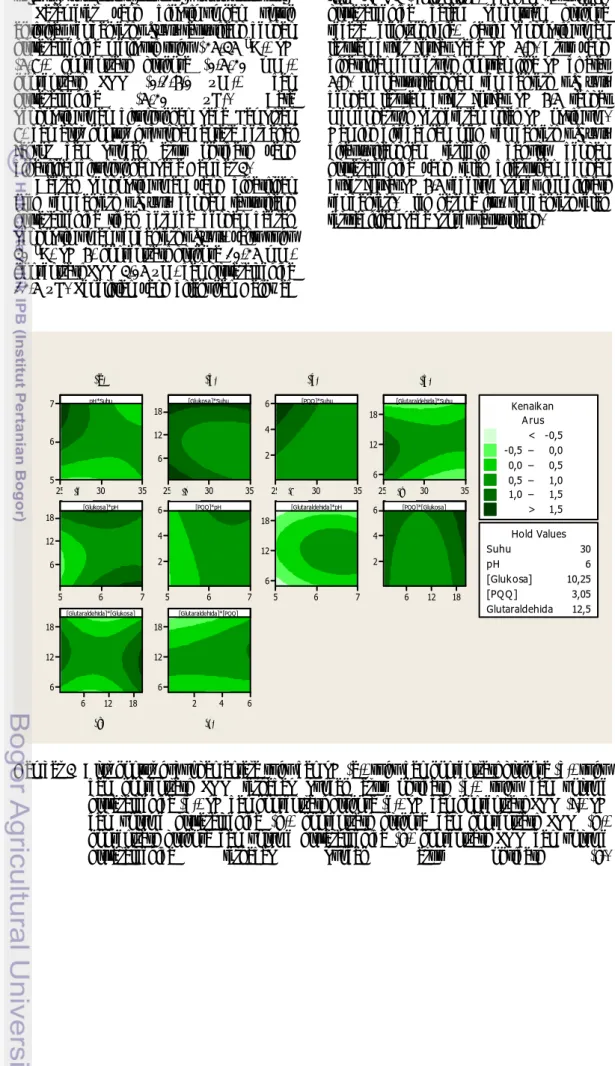
(5-7), konsentrasi glukosa (0,5-20 mM), konsentrasi PQQ (0,1-6,0 µM), dan glutaraldehida (5-20 µL). Data pengoptimuman ditunjukkan pada Lampiran 7, dan alur kontur hubungan antara berbagai faktor dan puncak arus oksidasi yang dihasilkan ditunjukkan pada Gambar 3.
Daerah pengoptimuman yang dihasilkan oleh sel bakteri E. coli dengan taut-silang glutaraldehida tidak berbeda dengan daerah pengoptimuman sel bakteri E. coli, yaitu suhu
30 oC, pH 6, konsentrasi glukosa 10,25 mM,
konsentrasi PQQ 3,05 µM, dan glutaraldehida 12,5 µL. Penelitian yang dilakukan Gaikwad
et al. (2006) terhadap imobilisasi GOD pada
film PANI (polianilina) dengan taut-silang glutaraldehida dalam penentuan glukosa secara elektrokimia, hasil pengoptimuman larutan bufer fosfat pada pH 5,8. Arus yang dihasilkan cenderung konstan jika pH di atas 5,8. Menaut-silangkan sel bakteri E. coli dengan larutan bufer fosfat pH 6,5 sangat memengaruhi pergeseran nilai pH optimum. Hal ini disebabkan oleh sel bakteri E. coli ditaut-silangkan terlebih dahulu dengan glutaraldehida yang telah dilarutkan dengan bufer fosfat pH 6,5 sebelum proses imobilisasi sel bakteri. Oleh karena itu, sel bakteri telah terstabilkan pada proses taut-silang.
pH*Suhu 35 30 25 7 6 5 [Glukosa]*Suhu 35 30 25 18 12 6 [PQQ]*Suhu 35 30 25 6 4 2 [Glutaraldehida]*Suhu 35 30 25 18 12 6 [Glukosa]*pH 7 6 5 18 12 6 [PQQ]*pH 7 6 5 6 4 2 [Glutaraldehida]*pH 7 6 5 18 12 6 [PQQ]*[Glukosa] 18 12 6 6 4 2 [Glutaraldehida]*[Glukosa] 18 12 6 18 12 6 [Glutaraldehida]*[PQQ] 6 4 2 18 12 6 Suhu 30 pH 6 [Glukosa] 10,25 [PQQ] 3,05 Glutaraldehida 12,5 Hold Values > – – – – < -0,5 -0,5 0,0 0,0 0,5 0,5 1,0 1,0 1,5 1,5 Arus Kenaikan
Gambar 3 Alur kontur hubungan antara suhu dan pH (a), suhu dan konsentrasi glukosa (b), suhu dan konsentrasi PQQ terhadap puncak arus oksidasi (c), suhu dan volume glutaraldehida (d), pH dan konsentrasi glukosa (e), pH dan konsentrasi PQQ (f), pH dan volume glutaraldehida (g), konsentrasi glukosa dan konsentrasi PQQ (h), konsentrasi glukosa dan volume glutaraldehida (i), konsentrasi PQQ dan volume glutaraldehida terhadap puncak arus oksidasi (j).
(a) (b) (c) (d)
(e (f (g (h
8
Jika dibandingkan dengan hasil pengoptimuman sel bakteri E. coli tanpa taut-silang glutaraldehida pH optimum, yang dihasilkan sama. Oleh karena itu, penambahan glutaraldehida, serta diduga adanya keberadaan protein-protein lain dalam ekstrak tidak memengaruhi kekuatan ionik dan nilai pI bersihnya sehingga tidak menggeser nilai pH optimumnya.
Kinetika Enzim Glukosa Dehidrogenase Imobilisasi
Kespesifikan enzim GDH dapat dilihat dengan melakukan penentuan parameter kinetika enzim, yaitu tetapan
Michaelis-Menten nyata (KM app) dan laju reaksi nyata
(Vmaks app) yang dianalogikan dengan arus
maksimum nyata (Imaks app). Parameter kinetika
enzim ini ditentukan dengan mengukur aktivitas enzim GDH dengan variasi konsentrasi substrat glukosa 0,5-20 mM pada kondisi optimum masing-masing enzim. Data pengukuran aktivitas enzim GDH ditunjukkan pada Lampiran 8.
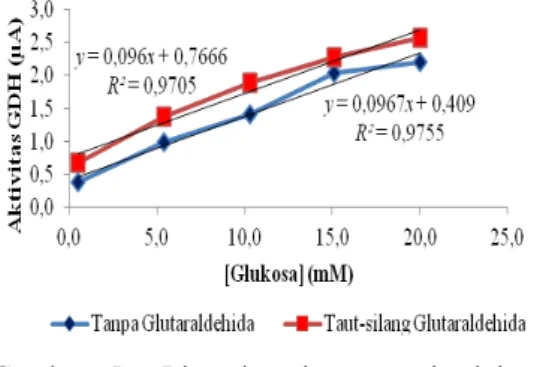
Gambar 4 mempelihatkan hubungan konsentrasi substrat dengan aktivitas GDH sel bakteri E. coli tanpa maupun dengan taut-silang glutaraldehida. Bentuk kurva menunjukkan aktivitas GDH yang dihasilkan sesuai dengan persamaan Michaelis-Menten.
Gambar 4 Hubungan konsentrasi glukosa dengan aktivitas GDH.
Reaksi terjadi dalam 2tahap: pada kisaran
konsentrasi 0,5-20 mM reaksi berada pada fase pertama, yaitu tidak semua sisi aktif GDH mengikat substrat glukosa. Sementara, fase kedua terjadi pada kisaran 20-30 mM, tapak aktif GDH telah mengikat substrat glukosa. Penambahan konsentrasi glukosa yang lebih tinggi tidak memengaruhi aktivitas GDH.
Gambar 5 memperlihatkan linearitas hubungan antara konsentrasi glukosa dan aktivitas enzim GDH. Aktivitas GDH tanpa
glutaraldehida memiliki linearitas yang lebih tinggi dibandingkan yang dengan taut-silang
dengan glutaraldehida. Namun, nilai R2
keduanya tidak jauh berbeda. Hal ini menunjukkan bahwa sel bakteri E. coli yang terimobilisasi taut-silang dengan glutaraldehida pada permukaan elektrode pasta karbon berpotensi sebagai reagen biofungsional untuk menaut-silangkan enzim.
Gambar 5 Linearitas konsentrasi glukosa dengan aktivitas GDH.
Penentuan parameter-parameter kinetika
enzim, yaitu KM app dan Imaks app menggunakan
metode Lineweaver-Burk. Gambar 6 menunjukkan kurva Lineweaver-Burk, yaitu
pa I
/
1 dengan 1/[glukosa].
Gambar 6 Alur Lineweaver-Burk sel bakteri
E. coli imobilisasi.
Nilai KM app ditampilkan pada Tabel 3.
Nilai KM app sel bakteri E. coli taut-silang
glutaraldehida lebih kecil dibandingkan
dengan KM app tanpa taut-silang glutaraldehida.
Namun, nilai Imaks app taut-silang glutaraldehida
lebih besar dibandingkan dengan tanpa
glutaraldehida. Nilai KM app dan Imaks app yang
kecil membuktikan bahwa laju reaksi katalitik dari GDH yang dihasilkan oleh sel bakteri E.
coli lebih lambat dibandingkan yang dengan
taut-silang glutaraldehida.
Perbedaan nilai KM app yang dihasilkan
disebabkan oleh imobilisasi taut-silang dengan glutaraldehida terjadi antar molekul.
9
Proses reaksi yang terjadi ialah glutaraldehida bereaksi dengan hidroksil organik pembawa dan dengan residu asam amino di dalam lisin.
Tabel 3 Nilai parameter kinetika sel bakteri E. coli Metode GDH sel bakteri E.
coli
Taut-silang Glutaraldehida
Imaks app
(µA) (mM) KM app Imaks app(µA) K(mM) M app Lineweaver
-Burk
1,7931 1,9007 2,1404 1,1162
Nilai KM app yang dihasilkan oleh Gaikwad
et al. (2006) dalam imobilisasi GOD pada
film PANI taut-silang glutaraldehida dengan penentuan glukosa secara elektrokimia
sebesar 11,11 mM. Nilai KM tersebut lebih
besar dari penelitian ini. Nilai KM merupakan
ukuran kuat dan lemahnya enzim mengikat
substrat. Jika KM kecil, enzim mengikat kuat
substrat sehingga dengan substrat yang sedikit cukup untuk menjenuhkan enzim. Sebaliknya,
nilai KM besar berarti enzim tidak terlalu
mengikat kuat substrat sehingga substrat yang dibutuhkan untuk menjenuhkan enzim lebih banyak. Dari hasil penelitian ini, dapat disimpulkan bahwa keberadaan glutaraldehida dapat meningkatkan puncak arus anodik sehingga memiliki potensi sebagai reagen biofungsional untuk meningkatkan efektivitas biosensor glukosa berbasis E. coli.
Stabilitas Enzim Glukosa Dehidrogenase sel Bakteri E. coli
Stabilitas dan selektivitas sangat diperlukan dalam imobilisasi enzim. Faktor yang dipengaruhi terhadap enzim yang terimobilisasi, yaitu substrat, metode imobilisasi, dan reagen biofungsional yang digunakan. Enzim sangat sensitif oleh pH dan suhu yang ekstrim sehingga mudah terdenaturasi. Hal yang perlu diperhatikan dalam proses imobilisasi adalah sifat dari enzim bebas, jenis materi pendukung yang digunakan, metode aktivasi pendukung, dan perekatan enzim. Keuntungan enzim yang diimobilisasi dibandingkan dengan enzim bebas adanya peningkatan stabilitas dan pemisahan produk mudah dari media reaksi sehingga tidak perlu dilakukan proses lebih lanjut seperti penginaktifan atau penghilangan enzim, dan penurunan biaya produksi (Norouzian 2003). Aktivitas enzim dipengaruhi oleh stabilitasnya. Bakteri E. coli merupakan bakteri gram negatif. Kebanyakan sel-sel bakteri gram negatif memiliki
glutathione (tripeptida sistein) sistem buffer
yang memungkinkan untuk memodulasi
perubahan oksidasi/reduksi oleh rangsangan eksternal atau internal dalam sel (Sode et al. 2000). Enzim dapat distabilkan dengan menggunakan suatu pengikat taut-silang berupa glutaraldehida. Taut-silang glutaraldehida telah digunakan secara luas untuk menghindari penurunan aktivitas enzim. Oleh karena itu, penelitian ini menggunakan imobilisasi taut-silang dengan reagen biofungsional glutaraldehida.
Senyawa-senyawa aldehida reaksi pada kedua ujung glutaraldehida bereaksi dengan kelompok amino bebas (kelompok ε-amino, kelompok amino N-terminal) enzim. Gambar 7 menunjukkan reaksi yang terjadi pada enzim dengan glutaraldehida.
Gambar 7 Taut-silang enzim pada gugus asam amino dengan
glutaraldehida.
Penelitian yang dilakukan oleh Gaikwad et
al. (2007), imobilisasi GOD (glukosa
oksidase) pada film komposit polyanilin-polivinil sulfonat (Pani-PVS) menggunakan taut-silang glutaraldehida memiliki stabilitas yang lebih besar. Stabilisasi sel bakteri E. coli dilakukan pada 0 jam hingga 12 jam setiap 2 jam lalu 24 jam dan 48 jam. Gambar 8 menunjukkan stabilitas sel bakteri E. coli baik tanpa maupun taut-silang glutaraldehida hingga 48 jam. Gambar tersebut menunjukkan presentase stabilitas sel bakteri E. coli baik tanpa maupun taut-silang glutaraldehida memiliki aktivitas yang tinggi saat waktu 0 jam sebesar 100%. Saat waktu 2 jam aktivitas GDH tanpa glutaraldehida turun hingga 58,92% sedangkan taut-silang glutaraldehida masih mencapai 100%.
Aktivitas GDH sel bakteri E. coli tanpa glutaraldehida setelah 4 jam tidak ada puncak arus oksidasi yang dihasilkan. Jika dibandingkan sel bakteri yang ditaut- silangkan dengan glutaraldehida puncak arus oksidasi yang dihasilkan masih ada hingga 48 jam. Menurut Trivadila (2006), aktivitas GDH turun setelah 6 jam. Hal ini membuktikan bahwa adanya glutaraldehida yang
ditaut-10
silangkan dengan sel bakteri E. coli dapat meningkatkan stabilitas enzim.
Gambar 8 Stabilisasi E. coli.
Adanya penambahan BSA dapat mengurangi denaturasi enzim. Prosesnya, dengan cara menggunakan BSA untuk memblok kelebihan gugus fungsional yang aktif. Dengan demikian, gugus fungsional yang aktif dari permukaan komplementer tanpa adanya penambahan aktivitas (Cao 2005). Adanya ikatan taut-silang intramolekul yang berlebihan di dalam enzim dapat dihindari sehingga taut-silang antarmolekul enzim dan stabilisasi dapat ditingkatkan. Penggunaan larutan bufer fosfat dalam proses taut-silang dengan glutaraldehida juga menyebabkan enzim mengalami stabilisasi.
Menurut Tanriseven dan Dogan (2002), metode baru imobilisasi untuk β-galactosidase yang berasal dari Aspergillus oryzae menghasilkan aktivitas relatif 56% dan stabilitas hingga 35 hari tanpa penurunan aktivitas. Jika dibandingkan dengan penelitian ini, stabilitas aktivitas sel bakteri E. coli taut-silang glutaraldehida nilainya lebih kecil. Hal ini disebabkan penambahan gelatin dan gliserol yang memiliki fungsi yang sama seperti BSA. Penelitian ini hanya dilakukan penambahan BSA sebanyak 1 µL sedangkan Tanriseven dan Dogan (2002) penambahan gelatin sebanyak 1 gram dan 4 mL gliserol. Oleh karena itu, stabilitas yang dihasilkan cukup berbeda. Dari uji stabilisasi, dapat disimpulkan bahwa taut-silang menggunakan glutaraldehida dapat meningkatkan stabilisasi aktivitas GDH sel bakteri E. coli sebesar 68%.
SIMPULAN DAN SARAN
Simpulan
Penggunaan glutaraldehida sebagai reagen biofungsional taut-silang untuk sel bakteri E.
coli yang diimobilisasi pada permukaan
elektrode pasta karbon dapat meningkatkan aktivitas dan stabilitas GDH dalam biosensor glukosa. Adanya glutaraldehida sebagai reagen biofungsional menghasilkan aktivitas relatif GDH sel bakteri E. coli sebesar 68%.
Nilai KM sel bakteri E. coli taut-silang dengan
glutaraldehida lebih kecil daripada nilai KM
tanpa taut-silang glutaraldehida. Hal ini menunjukkan afinitas sel bakteri E. coli tanpa taut-silang glutaraldehida lebih rendah dibandingkan dengan taut-silang glutaraldehida. Stabilitas aktivitas GDH yang ditaut-silangkan dengan glutaraldehida lebih stabil daripada tanpa taut-silang glutaraldehida hingga 48 jam.
Saran
Penelitian lanjutan perlu dilakukan pada parameter analtik, yaitu keterulangan (repeatibility). Sebab penelitian ini, nilai keterulangan yang dihasilkan rentangnya cukup lebar.
DAFTAR PUSTAKA
Bisswanger H. 2008. Enzyme Kinetics
Principles and Methods. Weinheim:
Wiley-VCH Verlag GmbH & Co. KGaA.
Cao LQ. 2005. Immobilized enzyme: science or art Current Opinion. Chem Biol 9: 217-226.
Desriani. 2003. PQQGDH (piroloquinoline quinone glucose dehidroginase) sebagai biosensor glukosa pada pengobatan penyakit diabetes mellitus [Makalah]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Divya PS, Savitri D dan Mitra CK. 1998. Covalent immobilization onto glassy carbon matrix-implications in biosensor design. J Bioscien 23: 131-136.
Gaikwad et al. 2006. Immobilization of GOD on electrochemically synthesized PANI film by cross-linking via glutaraldehyde
11
for determination of glucose. Int J
Electrochem Scien 1: 425-434.
Gaikwad et al. 2007. Development of PANI-PVS-GOD electrode by potentiometric method for determination of glucose. Int
J Electrochem Scien 2: 488 – 497.
Ikeda et al. 1998. Electrochemical monitoring of in vivo reconstitution of glucose dehydrogenase in Escherichia coli cells with externally added pyrroloquinoline quinone. J Electroanal Chem 449: 219-224.
Iswantini D, Kato K, Ikeda T, 1998. Electrochemical measurements of glucose dehydrogenase activity exhibited by Escherichia coli cells; effectsof the addition of pyrroloquinoline quinone, magnesium or calcium ions and ethylenediaminetetraacetic acid.
Bioelectrochem and Bioenerg 46:
249-254.
Iswantini D, Kano K, IkedaT. 2000. Kinetics and thermodynamic of activation of quinoprotein apoenzyme in vivo and catalytic activity of the activated enzyme in Escherichia coli cells. Biochem J 350: 917-923.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor using selected Indonesian bacteria. Microbiol Indones 5: p9-14.
Itoh Y, Yamazaki S, Karno K, Ikeda T. 2002.
Escherichia coli and its application in a
mediated amperometric glucose sensor.
Biosens Bioelect 17: 993-998.
Khan GF, Wernet W. 1997. Design of enzyme electrodes for extended use and storage life. Anal. Chem. 69: 2682-2687.
Lin Y, Lu F, Tu Y, dan Ren Z. 2004. Glucose biosensors based on carbon nanotube nanoelectrode ensembles. Nano Letters 4: 2.
Matsushita K et al. 1997. Escherichia coli is unable to produce pyrroloquinoline quinine (PQQ). Microbiol 143: 3149-3156.
Mateo C, Palomo JM, van Langen LM, van Rantwijk F, dan Sheldon RA. 2004. A
new, mild crosslinking methodology to prepare crosslinked enzyme aggregates.
Biotech Bioeng 86 (3): 273-276.
Norouzian D. 2003. Enzyme immobilization: the state of art in biotechnology. Iranian
J Biotech 1 (4): 197-206.
Othman N, Abu Bakar F, Salleh AB, Heng LY, Wagiran R. 2006. Preliminary investigation on a histamine biosensor constructed from diamine oxidase immobilised onto an oxygen probe.
Malaysia J Anal Scienc 10: 137-142.
Ourbrie A, Rozeboom H, Kaulk K, Dijksrtra B. 1999. Crystal structure of the biosensor glucose dehydrogenase.
[terhubung berkala]. http://www.xray.c2/ecm/abstract/d/4/371
_htm. [4 Febuari 2011].
Ramanavičius A, Meškys R, Laurinavičius V. 1997. Immobilization and investigation of sarcosine oxidase and creatine amidinohydrolase. Biol 1 : 77 – 80.
Sode K et al. 2000. Increasing the thermal stability of the water-soluble pyrroloquiniline quinone glucose dehydrogenase by single amino acid replacement. Enzyme Microbial Tech 26: 491-498.
Tanriseven A, Dogan S. 2002. A novel method for the immobilization of β-galactosidase. Proc Biochem 38: 27-30. Trivadila. 2006. Aktivitas glukosa
dehidrogenase pada tiga isolat bakteri Indonesia terpilih yang diimobilisasi untuk pengembangan biosensor glukosa [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococus radiodurans diimobilisasi
pada permukaan elektrode pasta karbon dan parameter kinetikanya [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Turner APF. 2002. Biosensor: past, present, and future. [terhubung berkala]. http://www.cranfield.ac.uk/health/resear
12
chareas/biosensorsdiagnostics/page1879 5.html. [4 Februari 2011].
[WHO] World Health Organization. 2006. Witarto AB, Sode K. 2001. Increasing the
hydrophobic interaction between terminal W-motifs enhances the stabiliy of salmonella thypimurium sialidase: a general strategy for the stabilization of β-propeller protein fold. Protein Eng 14: 891-896.
14
Lampiran 1 Bagan alir umum penelitian
Penanaman dan peremajaan bakteri E. coli
Pemanenan bakteri E. coli
Uji aktivitas GDH sel bakteri E. coli (metode elektrokimia)
Pengoptimuman tanpa glutaraldehida Pengoptimuman taut-silang glutaraldehida
Uji stabilitas GDH sel bakteri E. coli (metode elektrokimia)
15
Lampiran 2 Bagan alir kerja
Sel bakteri E. coli
Ditanam pada media LB agar miring (inkubasi 1 hari,suhu 37 o
C) Ditanam pada 10 mL media
LB cair (starter) (inkubasi 1hari, suhu 37 oC)
Inokulasi pada 250 mL media LB cair (inkubasi
suhu 37 o C, 1 hari) Pemanenan (sentrifugasi kecepatan 1000 rpm suhu 5 oC, 15 menit) Pelet (sel) Resuspensi ditambahkan 1 mL NaCl 0,85% Supernatan Metode Elektrokima
Uji aktivitas GDH sel bakteri E. coli
Uji stabilitas GDH sel bakteri E. coli
Pengoptimuman tanpa glutaraldehida
Pengoptimuman taut-silang glutaraldehida
16
Lampiran 3 Pembuatan elektrode pasta karbon dan imobilisasi sel bakteri E. coli
Parafin cair: grafit (1:2)
Campuran digerus hingga membentuk pasta dan dimasukkan ke dalam badan elektrode hingga padat permukannya
Permukaan karbon dihaluskan dengan amplas dan kertas minyak
Sebanyak 5 µL suspensi sel bakteri E.
coli diimobilisasi (tanpa dan taut-silang
glutaraldehida) pada permukaan elektrode
Permukaan dikeringudarakan lalu dilapisi dengan membran dialisis
Ditutup dengan jaring nilon dengan parafin
Elektrode disimpan dalam larutan NaCl 0,85%, suhu 5 oC (tidak digunakan)
17
Lampiran 4 Voltamogram siklik sel bakteri E. coli terimobilisasi
11.efwdat : Page 7
Mode: Cyclic, Initial E: -400mV, Final E: -400mV, Rate: 250mV/ s, Step W: 20ms, Upper E: 500mV, Lower E: -400mV, Cycles: 10 (15 Jul 2011, 21:46:49) -20 -10 0 10 20 i1 ( μA) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V)
Bufer fosfat (a) a + Qo (b) b + Glukosa (c) c + PQQ (d) d + MgSO4
Lampiran 5 Voltamogram siklik taut-silang dengan glutaraldehida terimobilisasi
ode: Cyclic, Initial E: -400mV, Final E: -400mV, Rate: 250mV/s, Step W: 20ms, Upper E: 500mV, Lower E: -400mV, Cycles: 10 (15 Jul 2011, 21:48:26) -20 0 10 20 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V) 11.efwdat : Page 29
Mode: Cyclic, Initial E: -400mV, Final E: -400mV, Rate: 250mV/s, Step W: 20ms, Upper E: 500mV, Lower E: -400mV, Cycles: 10 (15 Jul 2011, 21:50:01) -20 0 0 10 20 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V) 11.efwdat : Page 40 -20 -0 10 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V) 11.efwdat : Page 42
Mode: Cyclic, Initial E: -400mV, Final E: -400mV, Rate: 250mV/s, Step W: 20ms, Upper E: 500mV, Lower E: -400mV, Cycles: 100 (15 Jul 2011, 21:53:26) 0 10 20 i 1 ( ?A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V)
18
Lampiran 5 Voltamogram siklik taut-silang dengan glutaraldehida terimobilisasi
1.efwdat : Page 4
Mode: Cyclic, Initial E: -400mV, Final E: -400mV, Rate: 250mV/ s, Step W: 20ms, Upper E: 500mV, Lower E: -400mV, Cycles: 10 (22 Jul 2011, 17:30:20) -40 -20 0 20 40 i1 ( μA) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V)
Bufer fosfat (a) a + Qo (b) b + Glukosa (c) c + PQQ (d) d + MgSO4
Lampiran 6 Pengoptimuman sel bakteri E. coli
-40 -20 0 20 40 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V) -40 -20 0 20 40 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V) -40 -20 0 20 40 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V) Mode: Cyclic, Initial E: -400mV, Final E: -400mV, Rate: 250mV/s, Step W: 20ms, Upper E: 500mV, Lower E: -400mV, Cycles: 100 (22 Jul 2011, 17:36:48) -40 -20 0 20 40 i1 ( ? A) -0,6 -0,4 -0,2 0 0,2 0,4 0,6 E (V)
19
Suhu (oC) pH [Glukosa] (mM) [PQQ] (µM) Ipa (µA)
28 5,5 5,4 1,6 0,258 33 5,5 5,4 1,6 0,468 28 6,5 5,4 1,6 0,659 33 6,5 5,4 1,6 0,369 28 5,5 15,1 1,6 0,406 33 5,5 15,1 1,6 0,379 28 6,5 15,1 1,6 0,061 33 6,5 15,1 1,6 0,083 28 5,5 5,4 4,5 0,479 33 5,5 5,4 4,5 0,645 28 6,5 5,4 4,5 0,252 33 6,5 5,4 4,5 0,306 28 5,5 15,1 4,5 0,200 33 5,5 15,1 4,5 0,053 28 6,5 15,1 4,5 0,076 33 6,5 15,1 4,5 0,309 25 6,0 10,3 3,1 0,067 35 6,0 10,3 3,1 0,204 30 5,0 10,3 3,1 0,308 30 7,0 10,3 3,1 1,385 30 6,0 0,5 3,1 0,026 30 6,0 20,0 3,1 0,334 30 6,0 10,3 0,1 0,846 30 6,0 10,3 6,0 0,394 30 6,0 10,3 3,1 0,571 30 6,0 10,3 3,1 0,509 30 6,0 10,3 3,1 0,550 30 6,0 10,3 3,1 0,265 30 6,0 10,3 3,1 0,233 30 6,0 10,3 3,1 0,252 30 6,0 10,3 3,1 0,196
20 Suhu (oC) pH [Glukosa] (mM) [PQQ] (µM) Glutaraldehida (µL) Ipa (µA) 28 5,5 5,4 1,6 16 0,2545 33 5,5 5,4 1,6 9 0,2400 28 6,5 5,4 1,6 9 1,2100 33 6,5 5,4 1,6 16 0,5200 28 5,5 15,1 1,6 9 0,4357 33 5,5 15,1 1,6 16 0,3900 28 6,5 15,1 1,6 16 0,1500 33 6,5 15,1 1,6 9 0,2700 28 5,5 5,4 4,5 9 0,6700 33 5,5 5,4 4,5 16 0,5000 28 6,5 5,4 4,5 16 1,4500 33 6,5 5,4 4,5 9 0,3400 28 5,5 15,1 4,5 16 0,4900 33 5,5 15,1 4,5 9 0,3100 28 6,5 15,1 4,5 9 1,0900 33 6,5 15,1 4,5 16 0,2300 25 6,0 10,3 3,1 13 1,2670 35 6,0 10,3 3,1 13 1,0300 30 5,0 10,3 3,1 13 0,0100 30 7,0 10,3 3,1 13 1,1600 30 6,0 0,5 3,1 13 0,7000 30 6,0 20,0 3,1 13 2,5420 30 6,0 10,3 0,1 13 0,7500 30 6,0 10,3 6,0 13 1,2900 30 6,0 10,3 3,1 5 0,1600 30 6,0 10,3 3,1 20 0,0175 30 6,0 10,3 3,1 13 1,0136 30 6,0 10,3 3,1 13 0,8410 30 6,0 10,3 3,1 13 0,5300 30 6,0 10,3 3,1 13 0,5259 30 6,0 10,3 3,1 13 0,2100 30 6,0 10,3 3,1 13 0,6364
21
[Glukosa] (mM)
Ipa (µA) 1/[Glukosa]
(mM-1) 1/Ipa (µA-1) E. coli Taut-silang glutaraldehida E. coli Taut-silang glutaraldehida 0,5 0,376 0,667 2,00 2,660 1,499 5,4 0,986 1,378 0,19 1,014 0,726 10,3 1,403 1,886 0,10 0,713 0,530 15,1 2,035 2,268 0,07 0,491 0,441 20,0 2,207 2,559 0,05 0,453 0,391
22
Lampiran 9 Stabilitas sel bakteri E. coli
Waktu (jam) Presentase stabilisasi (% µA)
E. coli Taut-silang glutaraldehida
0 100 100 2 58,97 100 4 11,59 87,87 6 78,78 8 72,72 10 66,67 12 57,57 24 36,36 48 12,12
![Tabel 1 Kombinasi suhu, pH, [glukosa], [PQQ] untuk pengoptimuman aktivitas GDH sel bakteri E](https://thumb-ap.123doks.com/thumbv2/123dok/4307843.3157759/12.892.514.734.234.913/tabel-kombinasi-suhu-glukosa-untuk-pengoptimuman-aktivitas-bakteri.webp)