TINJAUAN PUSTAKA
1. Biologi dan life history Kakap merahBioIogr' reproduktar
Kakap merah (Red snapper), Lutjanus mdabaricus (Fam. LutJanidae), adalah ikan demersal yang umumnya hidup bergerombol di area berlumpur keras clan berasosiasi secara terbuka dengan komunitas karang terutama yang didominasi sponge dan gorgonian (Sale, 1991; Kailoloa et al., 1993). Di daerah tropik genera Lutjanus biasanya hidup di perairan dangld sampai kedalaman 500 m tergantung ukuran dan jenis ikannya. Ikan dewasa reproduktif umumnya sedentary (demersal) tetapi pemijahan berlangsung di mna pelagik, stadia telur bersifat planktonik dan biasanya pendek (Thresher, 1 99 1).
Musim pemijahan L. malabaricus dan L. erythropterus te rjadi hampir bersamaan. Di Great Barrier Reef pemijahan berlangsung selama musim semi dan musim panas dengan pmcak sekitar
akhu:
m u s h semi dan awal musim panas (antara Oktober-Januari); kedua spesies mernijah pada malam hari (McPherson et al., 1992). Di Vanuatu puncak pemijahan L malabaricus dan Pristipomoides multidens terjadi pada akhir musim semi (Brouard dan G r a n d p e a 1994). Menurut Grimes (1987) pemijahan ikan lutjanid (termasuk ketiga species di atas) dapat terjadi beberapa kaii setahm (serial spawners). Kematangan seksual L. malabaricus dan L. erythropterus di Great Barrier Reef tercapai pada ukuran-65-75% dari ukuran maksimum, atau masing-masing 573 cm FL dan 48,6 cm
FL
(McPherson et al., 1992), sedang di Vanuatu L. malabaricus matang pada ukuran 35 cm (Brouard dan Grandperrin,Rnjauan Pustaka 8 1984). Belum ada penelitian yang mendalam tentang biologi reproduksi dan musim pemijahan ikan kakap di Indonesia, namun di sekitar Bawean Djamal et al. (1993) melaporkan bahwa jenis L. malabaricus mencapai tingkat pematangan telur (maturation) pada ukuran lebih
dari
2,75 kg, fekunditas antara 4,5-9,O juta telur.Belum banyak informasi tentang daerah pemijahan dan daerah asuhan juvenil kakap merah. Di paparan barat-laut Australia dan area berlumpur keras Laut A r a b Kailoloa et al. (1993) dan Leis (1987) menemukan bahwa stadia larva dan juvenil L. malabaricus banyak ditemukan di perairan pantai yang dangkal dan kontinental terbuka dengan kedalaman antara 40-75 m, sedang larva Pristipomoides banyak
ditemukan di continental shelfdan slope sebelah luar. Kelimpahan larva sangat besar dan semakin besar dengan bertambahnya kedalaman (Williams dalam Leis, 1991). Larva bergerak ke permukaan pada malam hari dan ke dasar selama siang har~.
Pergerakan (m'grasi)
Terdapat pergerakan interreefal
dari
ikan-ikan yang mendiami habitat pantai ke arah lepas pantai (migrasi horisontal), pergerakan ini seiiring dengan bertambahnya umur dan pertumbuhan. Jarak yang dicapai selama migrasi ditentukan oleh kedalaman dan lebsir continental shelf (Williams, 199 1). Elliot (1996) menegaskanbahwa pergerakan L. malabaricus adalah terbatas. Didasarkan pada studi tagging dan genetik Powles
dan
Warlen (1997) juga menemukan bahwa pergerakan L.campechanus ti& terlalu jauh dari daerah pemijahan; ikan dewasa berpijah di
Rnjauan Pustaka 9 al. (1997) terdapat migrasi
dari
sejumlah besar P. multidens dari perairan sebelah utara Australia ke perairan wilayah tirnur Indonesia.Umur dan pertumbuhan
Beberapa hasil penelitian umur dan pertumbuhan genus Lutjanus dan Pristipomoides di beberapa perairan dengan menggunakan metode yang berbeda- beda disajikan pada Lampiran 1. Telah diketahui bahwa dugaan umur tahunan pada ikan tropik umumnya sulit dilakukan karena tidak membentuk lingkaran tahunan (annual rings) dalam struktur otolith, dan pola microstructurenya juga sulit diinterpretasi karena pertumbuhan hariannya (daily growth increments) sangat kecil (Pannella, 1974; Brothers et al., 1975; Morales-Nin dan Ralston, 1990; Campana, 1985; Lloyd et at., 1996). Mesh demikian dengan tehnologi khusus dapat diduga urnur ikan-ikan tropik walaupun pada ikan berumur panjang (longer-lived fishes) seperti Lutjanidae underestimate. Dugaan umur ikan Lutjanidae ini berkisar antara 3 tahun lebih sampai 32 tahun tergantung spesies. Perturnbuhan umumnya sangat lambat dengan nilai K (parameter pertumbuhan, laju pertumbuhan) antara 0.13-0.39 per tahun. Di Great Barrier Reef ikan jantan L. adetii dan L. quinquelineatus turnbuh lebih besar dibanding ikan betina (Newman et al., 1996). Menurut Edvktrds (1985), umur dan parameter pertumbuhan L. rnalabaricus bervariasi menurut area dan Qdalam suatu area sendiri. Belum ada studi umur dan pertumbuhan ikan lutjanid berdasarkan struktur keras otolith atau vertebrae di Indonesia.
Kebiasaan makan
Ikan Lutjanidae umumnya merupakan predator aktif pada malam hari (nocturnal) dan pisivor @od consumption) yang penting selain
ikan
h a n g seperti Holocentridae, Serranidae dan Lethrinidae (Sale, 1991). Mangsa berupa invertebrata dan ikan-ikan mobil yang tinggal dan beragrdgasi di sekitar h a n g (Choat dan Bellwood, 1991). Menurut Sumiono et al. (2000) selain Stomatopoda, Gastropods dan invertebrata lain, L. malabaricus memangsa kepiting, larva ikan dan udang; L. erythropterus memangsa kepiting dan larva ikan; sedang L. sebae memangsa udang.Struktur Populasi
Data struktur genetik populasi sangat membantu dalam menetapkan rencana manajemen stok yang tepat. Elliot (1996) dan Lloyd et al. (1996) mengembangkan studi tersebut bagi perikanan Kakap merah (Red snapper, L. malabaricus) laut dalam dan ikan gandola (Gold-band snapper, P. multidens) di Australia berdasarkan metode allozyme dan polimorfisme DNA mitochondria. Hasil penelitian menunjukkan bahwa
di perairan sebelah utara Australia ditemukan penstrukturan genetik yang jelas dari populasi L. malabaricus (multiple stocks); populasi pantai timur Queensland berbeda (distinc) dengan populasi Teluk Karpentaria dan paparan barat laut (Elliot, 1996). Stok P. multidens yang ditemukan di perairan Indonesia dan Australia juga berbeda; untuk populasi Australia sendiri stok di selutar Kimberley (wilayah barat daya Australia) berbeda secara genetik dengan stok Teluk Karpentaria dan wilayah barat (Lloyd et al., 1996). Perbedaan ini diduga berhubungan dengan sifat menetap secara
alami yang terbentuk merighti perubahan geologi
dan
fluktuasi permukaan laut (sea level) atau tingkat penangkapan di masa sebelurnnya. Dari penelitian terakhir dengan menggunakan genom mtDNA di wilayah timur Indonesia (Bali, Nusatenggara dan L. Arafura) dan perairan sebelah utara Australia (kerjasama penelitian antara pemerintah Indonesia, dilaksanakan oleh Balai Besar Budidaya Pantai Gondol Bali dan Balai Penelitian Perikanan h u t Jakarta, dengan Australia, dilaksanakan oleh CSIRO-ACIAR), diperkirakan terdapat empat unit stok yang berbeda secara genetik (discrete group) dari populasi L. malabaricusdan
L. erythropterus serta empat atau lima unit stok dari P. multidens. Perlu konfimasi lebih lanjut tentang batas sebaran geografis dari setiap unit stok (Anonim, 2001).2. Distribusi dan perikanan
Kakap merah (L. malabaricus) tersebar luas di perairan Indo-Pasifik barat, yaitu dari Kepulauan Fiji sampai Laut Arabia dan dari Australia sampai Jepang (Allen, 1985). Di Indonesia, data distribusi-kelimpahan yang cukup lengkap untuk species L. malabaricus (sebelumnya dengan narna Lutjanus sanguineus dan telah Qkoreksi oleh Pauly et al., 1996) dapat diperoleh
dari
hasil survey demersal (trawl) dengan menggunakan KM. MutiaraN
di Laut Jawa dim Laut Cina Selatan bagian selatan tahun 1976-1979 (Loose dan Dwiponggo, 1977; Beck dan Sudradjat, 1978; Sudradjat dan Beck, 1978; Dwiponggo dan Badrudin, 1980).Di wilayah ini L. malabaricus dapat dijumpai harnpir Q setiap stasiun trawl namun dengan kelimpahan bervariasi (Lampiran 2), kelimpahan lebih tinggi
nnjauan Pusraka 12 cendenmg ditemukan
di
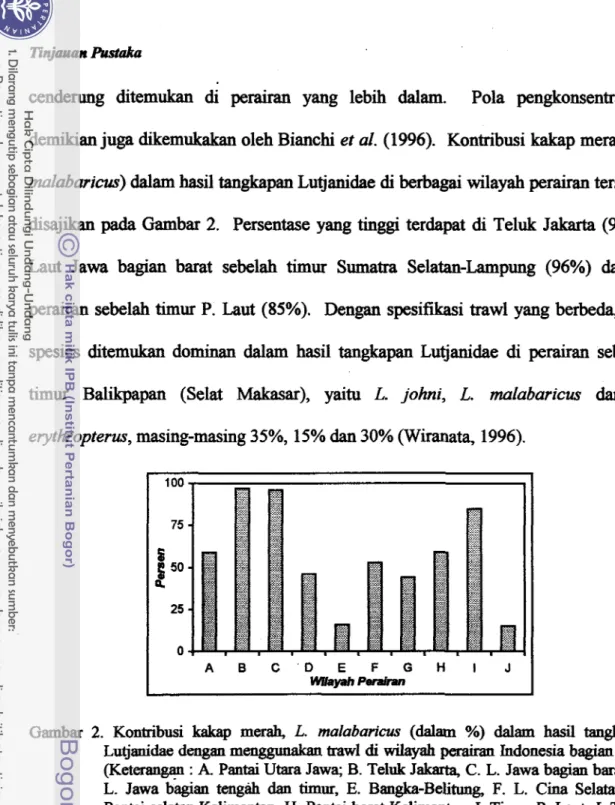
perairan yang lebih dalam. Pola pengkonsentrasian demikian juga dikemukakan oleh Bianchi et al. (1996). Kontribusi kakap merah (L. malabaricus) dalam hasil tangkapan Lutjanidae di berbagai wilayah perairan tersebut disajikan pada Gambar 2. Persentase yang tinggi terdapat di Teluk Jakarta (97%), Laut Jawa bagian barat sebelah tirnur Sumatra Selatan-Lampung (96%) dan di perairan sebelah timur P. Laut (85%). Dengan spesifikasi trawl yang berbeda, tiga spesies ditemukan dominandalam
hasil tangkapan Lutjanidae di perairan sebelah timur Balikpapan (Selat Makasar), yaitu L. johni, L. malabaricus dan L. erythropterus, masing-masing 35%, 15% dan 30% (Wiranata, 1996).Gambar 2. Kontribusi kakap merah, L. malabarim (dalam %) dalam hasil tanskapan
Lutjanidae dengan men- trawl di wrlayah perairan Indonesia bagian barat (Keterangan : A. Pantai Utara Jawa; B. Teluk Jakarta, C. L. Jawa bagian barat, D. L. Jawa bagian tengzih dan timur, E. Bangka-Belitung, F. L. Cina Selatau, G.
Pantai selatan Kalimautan, H. Pantai barat Kalimantan, I. Timur P. Laut, J. Timur
BWapan).
Aktivitas penangkapan kakap merah di Indonesia telah berkembang sejak sepuluh tahun terakhir, daerah penangkapan juga sernakin luas. Di wilayah barat daerah penangkapan terdapat di Kep. Seribu, P. Bangka, L. Cina Selatan, L. Jawa bagian
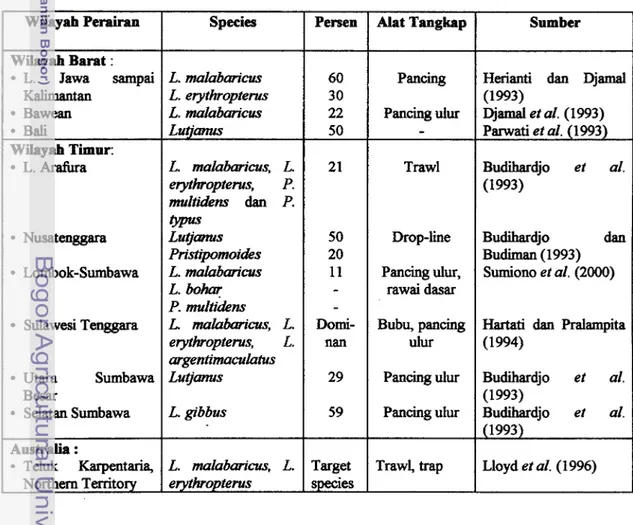
timur dan perairan sebelali timur Balikpapan; sedang di wilayah tirnur terdapat di L. Arafura, Nusa Tenggara dan Sulawesi Tenggara. Penangkapan umumnya dilakukan secara tradisional dengan alat tangkap pancing ulur (handline), dropline, rawai dasar (bottom longline), gillnet dasar (bottom gillnet) dan bubu (trap) (small-scalefishery); sedang penangkapan dengan menggunakan trawl (skala menengah) terutama dilakukan di wilayah b u r Indonesia. Dari beberapa laporan kontribusi kakap merah dalam hasil tangkapan Lutjanidae oleh berbagai sistim perikanan di Indonesia bervariasi seperti tercantum pada Tabel 1.
Tabel 1. Kontribusi kakap merah, L. malabaricus (dalam %) dalm h a d tantangan
Lutjanidae di beberapa wilayah perairan Indonesia dan Australia
Wilayah Perairan Wilayah Barat : L. Jawa sampai Kalimantan Bawean Bali Wilayah Timur: L. ArafUra Nusatenggara Lombok-Sumbawa Sulawesi Tenggara Utara Sumbawa Besar Selatan Sumbawa Australia : Teluk Karpentaria, Northern Territory Species L. malabmancus L. erythropterus L. malabmicus Lutjrmus L. malabaricus, L. erythropterus, P. multidens dan P. trpus L u t j m s Pristrpomoides L. malabmClllcus L. b o M P. multidens L. malabaricus, L. erythropterus, L. argentimacuhtus L u @ m s L. gibbus L. malabm.cus. L. erythroptems Persen 60 30 22 50 21 50 20 11 - Domi- nan 29 59 Target species Alat Tangkap Pancing Pancing ulur
-
Trawl Drop-line Pancing ulur, rawai dasar Bubu, pancing ulur Pancingulur Pancing ulur Trawl, trap SumberHerianti dan Djamal (1993) Djamal et al. (1993) Parwati et al. (1993) Budihardjo et al. (1 993) Budihardjo dan Budiman (1 993) Sumiono et al. (2000)
Hartati dan Pralampita (1 994) Budihardjo et al. (1993) Budihardjo et al. (1 993) Lloyd et al. (1996)
3. Konsep 'Stok'
Dalam ilrnu perikanan populasi ikan yang dieksploitasi di suatu wilayah perairan umumnya disebut stok yang dalam pengertian ekologi sinonim dengan populasi atau sekelompok individu ikan
dari
suatu spesies. Berlandaskan defmisi tersebut diasumsikan bahwa stok ikan selalu melimpah (harvestable surplus) serta memiliki pola rekrutmen dan mortalitas yang jelas. Konsep demikian telah mendominasi manajemen perikanan selama 50 tahun (Gulland. 1983), yaitu manajemen peIlkanan untuk kondisi sesaat (short-term management). Dalam sejarah perikanan sering terjadi kesalahan pengelolaan yang berakibat kolapsnya perikanan akibat kesalahan dalam mendefinisikan stok, misalnya problem klasik stok tercampur (mixed stock) pada perikanan Atlantic salmon (Salmo salar), adanya dua stok pemijah (spawning stocks) pada Atlantic herring (Clupea harengus) (Bermingham, 1990), dan berbagai problem perikanan lain yang kesemuanya berhubungan dengan subdivisi populasi ikan dan unit stok. Allendorf et al. (1987) telah menegaskan bahwa strategi manajemen perilcanan yang tepat hams rnempertimbangkan struktur genetik populasi mengingat kenyataan adanya unit-unit populasi (breeding units atau unit stok) yang secara genetik terpisah dan menimbulkan adanya variasi dalam pemijahan, rekrutmen dan karakteristik biologi lainnya dari stok ikan yang dieksploitasi. Sehubungan dengan ha1 tersebut secara genetik dalam suatu unit stok (subpopulasi) tidak terdapat rintangan aliran gen (gene flow), tetapi diantara unit stok terdapat rintangan yang membatasi aliran gen. Prinsip ini melandasi manajemen perikanan berbasis stokTinjauan -aka 15 untuk menjamin hasil yang optimum dan berkelanjutan serta konservasi sumber daya (long-term management). Mustafa dalam Mustafa (1999) juga menegaskan konsep pengelolaan perikanan berbasis stok berdasarkan fakta adanya variabilitas yang tinggi dalam diversitas genetik pada ikan laut serta pengetahuan bahwa pada suatu populasi dengan sebaran geografi yang luas dan kontinu ternyata tidak selalu homogen secara genetik dan kemungkinan terdapat batas-batas breeding (breeding barrier) karena terdapat lebih dari satu stok pernijah (multiple spawning). Ditambahkan, pada populasi ikan yang terdiri dari stok-stok diskrete dimana masing-masing memberi hasil yang bebas satu sama lain, konsep stok tersebut pada dasarnya sangat penting untuk tujuan menyeimbangkan impak pemanenan dan upaya mencapai stabilitas ekonomi. Heincke dan Hjort (dalam Sinclair, 1988) sebelumnya telah mengusulkan bahwa spesies hams dikelola pada tingkatan subspesifik.
Beberapa d e f ~ s i stok telah diusulkan dengan latar belakang berbeda-beda. Manager perikanan mendefinisikan, "Stok adalah kelompok ikan yang dieksploitasi di suatu area spesifik atau oleh metode spesifik W e r y stock)" (Smith et al., 1990). Definisi ini mempermudah dalam pengumpulan data hasil tangkapan dan upaya (catch-eflort data), tetapi tidak mencerminkan pen- spesies yang jelas. Terkait dengan ha1 ini Ihsen et al. (1981) mengusulkan konsep stok biologi (biology stock) : "Stok adalah sekelompok individu intraspesifik yang melakukan perkawinan acak (random mating) dengan integritas spatial dan temporal". Berdasarkan konsep stok biologi tersebut dapat dibedakan antara stok dengan derajat integritas rendah
Tinjauan fistaka 16 yang disebut stok panenah (harvest stock) dan stok dengan derajat integritas tinggi yang disebut stok genetik (genetic stock). Tekanan penangkapan pada suatu stok panenan dianggap tidak berpengaruh pada stok panenan lainnya (Gauldie, 1988); sedang stok genetik merupakan unit yang terisolasi secara reproduksi dan berbeda secara genetik dengan stok lainnya (Ovenden, 1990). Menurut konsep stok genetik diversitas genetik antar dan intra populasi merupakan bagian dari biodiversitas. Dalam pelaksanaannya, aplikasi unit stok dalam manajemen perilcanan juga bergantung pada data populasi yang tersedia untuk memperkirakan stok secara terpisah, dan pembatas sosio-esonomi dan politik.
4. Struktur Genetik Populasi
Unit stok, sekelompok individu atau sub kelompok dari suatu species yang merniliki kesamaan dalam struktur atau pola genetik (genetic pool), dapat dipelajari berdasarkan fiekuensi genetik dari setiap gen yang terlibat dalam ekspresi fenotipik. Pada tingkat molekuler (DNA) ikan laut menunjukkan variabilitas genetik walaupun dalam derajat yang lebih rendah dibanding ikan air tawar baik pada level supraspesifik maupun taksa kelompok individu (populasi dan subpopulasi) dimana pada tingkat protein (studi a l Z o ~ e ) tidak terlihat. Menurut Graves et al. dalam Saunders et al. (1986), terdapat variabilitas genetik yang disebabkan oleh aliran gen (gene flow) inter-oseanik serta menimbulkan diferensiasi genetik.
Berdasarkan sifat polirnorfisme DNA mitochondria, variabilitas genetik populasi ditunjukkan oleh d m ukuran divergensi, yaitu divergensi didalam populasi
Rnjauan Plrstaka 17
(variabilitas intrapopulasz) dan variabilitas antar populasi (divergensi interpopulasi). Model matematiknya diturunkan dari model infinite-allele (dari produk elektroforesis) yang diterapkan pada data situs restriksi (restriction site). Variabilitas intrapopulasi dinyatakan dengan parameter diversitas haplotipe atau diversitas nukleon (h), banyaknya nukleomorf (unit polimorfisme pada nukleon yang terdapat dalam bentuk pola situs restriksi), jurnlah rata-rata perbedaan situs restriksi, jumlah segregasi situs restriksi atau jumlah situs restriksi polimorfis dalam sejumlah sample nukleon. Nukleon merupakan suatu segmen DNA, identik dengan gen dalam DNA inti (nuclear DNA), yang dicirikan oleh peta situs restriksi, restriction site map, atau jumlah dan ukuran fiagmen DNA. Divergensi interpopulasi dipelajari berdasarkan parameter jarak genetik (genetic distance, 6) dan analisis statistik (sampling varian) terhadap perbedaan situs restriksi (Nei dan Tajima, 1981). Nei dan Tajima (1981) menambahkan bahwa variabilitas genetik nukleon berhubungan dengan laju mutasi per nukleon dimana perubahan situs restriksi terjadi secara evolusioner dan disebabkan oleh substitusi, insersi (insertion) atau penghapusan (deletion) nukleotida. Jenis dan jumlah enzim restriksi yang sama digunakan dalam analisis sampel untuk membandingkan nilai parameter diantara nukleon atau organisme yang berbeda.
Variasi mtDNA intra dan interspesifik berdasarkan analisis enzim restriksi telah banyak dilaporkan, antara lain pada manusia digunakan untuk mencirikan populasi lokal, membedakan ciri individu, variasi etnik, pengelompokan etnik dan menduga hubungan evolusioner dari kelompok-kelompok etnik tersebut, serta menentukan
Tinjman PksCaRa 18
bentuk-bentuk morf
~ ~ D N A
khusus
untuk kemudian mengelompokkamya kedalam group menurut skala geografik (Bermingham, 1990). Studi variabilitas mtDNA pada Teleostei dan Invertebrata dilaporkan oleh beberapa peneliti, antara lain Bermingham dan Avise (1986), Saunders et al. (1986), Ferris dan Berg (1987), Gyllensten dan Wilson (1987), Renno et al. (1990), Elliot (1996), Lloyd et al. (1996), Lloyd et al. (1999), Effenberger dan Suchentrunk (1 999).5. FiIogenetik Molekuler
Studi analisa DNA telah diterapkan pada berbagai bidang seperti kedokteran, forensik, arkeologi, farmasi, pertanian, peternakan dan perikanan. Dalam bidang perikanan genom mtDNA digunakan untuk mengukur hubungan kekerabatan diantara takson baik di dam maupun lingkungan budidaya, studi taksonomi dan genetika populasi (Ferris dan Berg, 1987; Bermingham, 1990; Billington dan Hebert, 1990). Kelebihan dari penggunaan mtDNA ini dikarenakan mtDNA tidak dipen- perubahan lingkungan dan faktor pertumbuhan serta lebih sensitif Hampir semua bagian tubuh dapat digunakan sebagai jaringan contoh dan dapat digunakan dalam waktu lama meskipun prosedurnya rumit dan mahal. Penggunaan tehnik molekuler tingkat DNA juga menambah dimensi baru dalam penyusunan filogeni dan reklasifikasi filogeni organisme karena lebih teliti dan akurat, selain itu telah melahirkan interes baru dalam pengujian tentang hipotesis mekanisme evolusi.
Algoritma dasar dalam rekonstruksi pohon filogenetik didasarkan pada asumsi bahwa bila satu gen pada sepasang spesies atau populasi berevolusi secara clocklike
i
Tinjauan Ptcsfaka
fahion dengan derajat hivergemi gen menyimpang selama t generasi, maka diperkirakan gen terpisah dani nenek moyang umumnya selama generasi (Hartl dan Clark, 1997). Asumsi ini dipakai dalam menerapkan metode rekonstruksi pohon filogenetik yang didasarkan pada ukuran jarak genetik.
Salah satu metode yang sederhana adalah metode jarak rata-rata, Unweighted pair-group method with arithmetic mean (UPGMA method) atau disebut metode least square. Dengan asumsi bahwa seluruh sekuen berevolusi dengan iaju sama metode ini meminimalkan deviasi dari jumlah kuadrat statistik (sum of square). Topologi pohon disusun berdasarkan rnatrik jarak secara berpasangan (pairwise distances matrzk), sedang pengklusteran dimulai dari takson yang memiliki jarak genetik terkecil hingga terbesar. Panjang percabangan diduga menurut cara Fitch- Margoliash dalam Hartl dan Clark (1997).
6. Struktur dan fungsi DNA mitochondria (mtDNA)
Mitochondria merupakan organel sitoplasma yang urnum terdapat dalam sel eukariot, bersifat semiotonom, yakni mempunyai DNA dan ribosome sendiri sehingga mampu melakukan sintesis enzim untuk berlangsungnya proses-proses di dalam organel ihi sendiri. Ukuran dan struktur mirip sel bakteri, terbungkus oleh dua lapis membran dimana membran dalam membentuk lipatan (sista) sebagai tempat berlangsungnya respirasi. Berbeda dengan DNA inti yang berbentuk garis (linear nuclear DNA), pada Vertebrata genom mtDNA berupa spesies duplek (pilin ganda) yang kompak berbentuk lingkaran tertutup (circular mitochondrial DNA), kecuali
Tinjauan Pustaka 20
pada beberapa spesies Alga dan Ciliata yang berbentuk garis. Genom mtDNA tersusun sebagai unit translasi dengan kode genetik tersendiri yang berbeda dengan kode genetik universal dalam inti (Ferris dan Berg, 1987; Bermingham, 1990; Billington dan Hebert, 1991), dan merupakan molekul polimer yang terikat secara kovalen berukuran antara 15.000-1 8.000 bp (base pairs, pasang basa).
Genom mtDNA terbagi menjadi dua daerah, yaitu daerah coding (90 % dari seluruh genom)
dan
daerah non coding (10 %) yang terdiri dari non coding majordan
minor. Daerah coding terdiri dari 37 gen dimana 2 gen mengkode RNA ribosome (12s rRNA, 16s rRNA), 22 gen mengkode RNA transfer dan 13 gen mengkode polipeptida (protein). Daerah non coding major merupakan awal replikasi rantai berat (H-strand) dm awal tmnskripsi kedua rantai; sedang suatu segrnen kecil dan spesifik dari daerah non coding minor yang disebut D-loop (displacement loop) atau daerah kontrol (control region) merupakan awal replikasi L-strand, posisinya 5,7 kb dari awal replikasi H-strand. Region D-loop terbentuk akibat penggantian rantai berat (H-strand) pada rantai induk dan membentuk struktur 3-strand (triplex D-loop).Region D-loop bersifat hipervariabel (laju evolusi tinggi) dibanding region lainnya, ini disebabkan oleh substitusi basa, insersi dan delesi yang terjadi sangat cepat. Sifat ini sangat baik untuk menerangkan hubungan filogenetik =tar populasi. Laju substitusi nukleotide pada manusia kira-kira 2,8-5 kali, pada bovine mencapai 10 kali lebih cepat dibanQng region lainnya. Menurut Brown et al. dalam Ferris clan
Berg (1987), laju evolusi mtDNA pada Marnmalia mencapai 5-10 kali lebih cepat dibanding laju evolusi DNA inti.
Pada sel eukariotik jumlah molekul mtDNA sangat sedikit, yakni hanya 1 % dari DNA total (DNA inti dan mtDNA) atau antara 5-10 untai per organel, tetapi jumlah ini dapat digandakan sehingga mudah diisolasi dan purifikasi. Meskipun jumlahnya sedikit tetapi sangat penting bagi biologi perikanan karena memiliki derajat polimorfisme tinggi (laju evolusi cepat) serta memiliki informasi dan ciri genetik lebih banyak. Sifat ini sesuai untuk pemecahan masalah ekologis yang terkait unit populasi, filogeografik, stock discreteness, pola migrasi, hibridisasi antar stok, sistimatik dan sebagai penanda genetik stok (genetic marking of stocks) (Ferris dan Berg, 1987; Bermingharn, 1990).
Genom mtDNA bersifat haploid dan ditunurkan secara generatif melalui sel telur (maternal inheritence), tetapi distribusinya bersifat bebas selektif (selective independent) terhadap genom inti (Ferris dan Berg, 1987). Sifat maternal inheritence berarti tidak mengalami rekombinasi seperti DNA inti sehingga variasi intra- individual (heteroplasmi) amat jarang terjadi. Oleh karena itu genom mtDNA selain digunakan dalam studi variasi genetik populasi,. identifikasi stok dan migrasi ikan, juga sangat membantu dalam penelusuran garis keturunan maternal dan sebagai
Tinjauan Pustaka 22 7.
Enzim
restriksi (rekction endonuclease)Enzim restriksi adalah enzim yang dapat memotong DNA pada sekuen spesifik sehingga dihasilkan fiagmen-fragmen nukleotida yang lebih pendek dengan ukuran tertentu (enzim pemotong). Enzim restriksi dapat mengenal sekuen 4-baa, 5-basa atau 6-basa,
dan
akan memotong molekul DNA di tempat manapun yang dikenal. Pemotong 4-baa biasanya menghasilkan 3-6 kali lebih banyak fiagmen dibanding pemotong 6-basa (Ferris dan Berg, 1987). Dapat dilcatakan, enzim restriksi merupakan 'tool' prinsip dalam analisis genom mtDNA.Enzirn restriksi dapat diisolasi dari mikroorgamsme (bakteri), misalnya enzim Xba I diisolasi dan Xanthomonas badrii. Enzim ini dapat mengenal
dan
memotongsekuen nukleotida TACTAGA (tanda '^' menunjukkan titik pemotongan atau cleavage). Pada Salmo gairdneri pemotongan enzim Xba I menghasilkan 6 fiagmen dengan ukutan masing-masing 5690,3080, 2310, 1480 dan 690 bp (Gyllensten dan Wilson, 1987); pada genus Salmo enzim Mbo I ("GATC) dapat mengenal
dan
menghasilkan fiagmen 25 bp.Keuntungan utama dari tehnik restriksi adalah hanya diperlukan material sangat sedikit, lebih sensitif (memunglunkan deteksi fragmen 30 bp)
dan
dapat mendeteksi mtDNA dari DNA sellular; narnun demikian diperlukan lebih banyak jenis enzimrestiksi. Tehnik lain seperti Southern yang dilakukan melalui prosedur endlabeling (dikembangkan oleh Brown) memakan waktu lebih lama (Ferris dan Berg, 1987). Disamping tehnik restriksi, perkembangan manipulasi DNA terutama ditunjang oleh
- Tinjauan fistaka 23
berkembangnya teknologi DNA rekombinan (genetic engineering)
dan
tehnik PCR (Polymerase Chain Reaction).8. Analisa DNA dan Tehnik
PCR
(Polymerase Chain Reaction)Prosedur awal dalam analisa mtDNA dilakukan untuk memecah genom DNA menjadi fi-agmen-fi-agmen spesifik yang ukurannya kecil (ekstraksi). Tahap berikutnya adalah isolasi dan amplifikasi. Isolasi adalah tahap pemisahan sekuen DNA target (mtDNA) dari total DNA hasil ekstraksi (DNA inti dan mtDNA), sedang amplifikasi yaitu proses perbanyakan (sintesis) sekuen mtDNA. Isolasi dan amplifikasi dapat dilakukan secara in vitro dengan menggunakan tehnik PCR (Polymerase Chain Reaction), atau in vivo melalui t e h k kloning pada sel hidup. Tahap ekstraksi clan isolasi merupakan tahapan penting yang sangat menentukan keberhasilan analisis. Jaringan contoh yang digunakan dapat berupa hati, otot, sirip, darah, sel kultur atau jaringan lain, baik dalam kondisi segar, telah difiksasi ataupun beku. Penggunaan jaringan dalam keadaan beku atau diawet biasanya dipilih karena prosedur analisa hams dilaksanakan di tempat yang bersih dengan menggunakan peralatan khusus.
Pada prinsipnya t e h k PCR adalah proses enzimatis untuk memperbanyak DNA dengan memanfaatkan sifat replikasi DNA dan perubahan fisik DNA terhadap suhu. Proses ini dibantu dengan enzim Tag-DNA polymerase pada tahap ekstensi polinukleotida primer (Stansfield, 1983; Alberts et al., 1989; Arnheim, 1990; Lewin, 1994; Gelfand dalam Erlich, 1989; Zyskind dan Bernstein, 1993). Replikasi
Rnjauan Pustaka 24
terjadi jika terdapat untai tunggal DNA yang bertindak sebagai cetakan (template)
dan
energi pembangun basa (dNTP). Enzirn DNA polimerase membantu dalam pembentukan DNA untai lainnya yang merupakan komplemen dari template DNA. Reaksi in. h a m dimulai dengan suatu pemula (primer) yang merupakan potongan pendek DNA terdiri dari 20-30 nukleotida. Primer melakukan hibridisasi pita secara berpasangan dengan sekuen tertentu yang mengapit (flanking) daerah DNA target amplifikasi pada tiap pita DNA.Siklus pokok PCR berlangsung dalam tiga tahap, yaitu denaturasi template pada suhu tinggi (94-97 "C), annealing oligonukleotida primer pada suhu rendah (55-72 "C),
dan
ekstensi DNA-polimerase primer pada ujung 3' yang berlangsung pada suhu intermediate (72 "C). Siklus diulang sebanyak 25-30 kali. Pada tahap denaturasi, untai DNA pilin ganda dibuka melalui pemanasan sehingga pita DNA terpisah; pada tahap annealing terjadi pelekatan primer pada template DNA; akhirnya pada tahap ekstensi enzim Taq-DNA polymerase aktif memperpanjang primer membentuk untaian pasangan basa sepanjang sekuen DNA target. Dari keseluruhan proses jurnlah DNA target yang dihasilkan meningkat secara eksponensial karena template yang baru akan terbentuk pada setiap siklus.Kelebihan tehnik PCR adalah proses isolasi cepat, jurnlah sekuen DNA yang dihasilkan dapat mencapai 300.000 kopi, sangat sensitif dalam mendeteksi sekuen DNA target dari sampel dan tidak memerlukan enzim lain selarna siklus. Selain itu, suhu tinggi dalam sintesa DNA (75 "C) dapat meningkatkan stringency sehingga
Tinjauan Pustaka 25
meminimumkan ekstensi primer yang talc sebanding dengan template (Zyskind dan Bernstein, 1993). Dalam prosedur PCR ini, struktur sekunder dari template DNA yang dapat menghalangi aktivitas enzim polimerase juga akan direduksi melalui denaturasi sekuen pada suhu tinggi; namun demikian beberapa faktor hams diperhatikan supaya pita-pita yang dihasilkan baik dan utuh, antara lain konsentrasi DNA, ukuran clan komposisi basa primer dan suhu hbridisasi (kondisi PCR). Kombinasi antara tehnik PCR dengan pnggunaan enzim restriksi atau tehnik sequensing nukleotida mampu menghasilkan karakter data DNA yang sangat membantu menjelaskan hubungan filogenetik diantara takson. Penggunaan enzim restriksi untuk memotong sekuen mtDNA teramplifikasi (metode RFLP, Restriction Fragment Length Polymorphism) diterapkan untuk melihat perbedaan profil dan ukuran fiagmen DNA dari individu yang berbeda; sedang tehmk lain, yaitu metode fingerprinting RrLPD (Random Ampl$ed Polymorphic DNA) diterapkan untuk
melihat perbedaan hasil amplifikasi dari individu yang berbeda dengan menggunakan primer tertentu &oh et al., 1999).