(Vigna radiata L), TEMPE KACANG HIJAU, DAN BUBUR KACANG HIJAU
Rochani Iswandari
PROGRAM STUDI GIZI MASYARAKAT DAN SUMBERDAYA KELUARGA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR 2006
radiata L), Tempe Kacang Hijau, dan Bubur Kacang Hijau. (Dibawah bimbingan
HIDAYAT SYARIEF dan EDDY SETYO MUDJAJANTO).
Tujuan umum penelitian ini adalah mengkaji kandungan isoflavon pada kacang hijau (Vigna radiata L) dan hasil olahannya yaitu tempe kacang hijau dan bubur kacang hijau. Tujuan khusus penelitian ini adalah mempelajari pembuatan tempe kacang hijau, menentukan jumlah konsentrasi ragi pada pembuatan tempe kacang hijau melalui uji organoleptik, menganalisis komponen aktif isoflavon pada kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau serta mengetahui kandungan gizi pada kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau meliputi kadar air, kadar abu, protein, lemak, dan total karbohidrat.
Penelitian ini dilakukan dalam dua tahap yaitu penelitian pendahuluan dan penelitian lanjutan. Penelitian pendahuluan meliputi (1) memilih sampel kacang hijau dan ragi tempe (2) mempelajari pembuatan tempe dari bahan baku kacang hijau. Pada tahap ini dilakukan trial and error untuk mempelajari cara pembuatan tempe kacang hijau.
Sampel kacang hijau adalah kacang hijau biji besar yang dibeli di swalayan Grand, di Bogor. Biji sampel berbentuk bulat silindris dengan ujung
tumpul, berwarna hijau tua dengan panjang kurang lebih (0.5-0.8) cm dan mudah dikelupas kulitnya setelah direndam. Ragi yang digunakan adalah ragi tempe yang biasa dipakai oleh pengusaha tempe kedelai di desa Ciherang, Margajaya, Bogor Barat. Ragi berupa serbuk atau butiran-butiran kecil berwarna putih kecoklatan.
Penelitian lanjutan terdiri dari empat tahap yaitu (1) membuat tempe dengan metoda terpilih dari penelitian pendahuluan dan membuat bubur kacang hijau (2) melakukan uji organoleptik tempe kacang hijau mentah (3) menganalisis senyawa isoflavon pada kacang hijau segar, tempe kacang hijau, dan bubur
kacang hijau dengan metode Kromatografi Cairan Kinerja Tinggi (HPLC) (4) menganalisis kandungan gizi pada kacang hijau segar, tempe kacang hijau, dan
bubur kacang hijau meliputi kadar air & abu (metode oven biasa), kadar lemak (metode Soxhlet), kadar protein (metode semi Kjedahl), dan total karbohidrat (by difference).
Keseluruhan trial and error yang telah dilakukan menghasilkan metode/cara pembuatan tempe kacang hijau per 1 kg berat kacang hijau mentah terdiri dari pemilihan biji kacang hijau, perendaman air kondisi asam (pH ± 4-5) selama 24 jam, pengelupasan kulit dan pencucian dengan tangan, perendaman air mendidih selama 15 menit, pendinginan, pemberian ragi, pembungkusan, dan penyimpanan selama 48 jam pada suhu 27ºC-33ºC.
Uji organoleptik dilakukan terhadap tempe kacang hijau mentah. Uji ini dilakukan untuk mengetahui pengaruh penambahan konsentrasi ragi terhadap penerimaan tempe kacang hijau mentah meliputi warna, aroma, tekstur, kepadatan, dan kekompakan. Hasil uji digunakan untuk menentukan standar formula jumlah konsentrasi ragi pada pembuatan tempe kacang hijau. Uji organoleptik dilakukan di Laboratorium Organoleptik, Program Studi GMSK, IPB dengan 30 panelis dan dua kali ulangan perlakuan. Penetapan jumlah konsentrasi
Hasil uji organoleptik diolah menggunakan SPSS versi 11.5 for windows. Data yang diperoleh diuji menggunakan Kruskal Wallis Test dan uji lanjut perbandingan berganda Tukey. Uji Kruskal Wallis digunakan untuk mengetahui pengaruh penambahan konsentrasi ragi terhadap warna, aroma, tekstur, kepadatan, dan kekompakan tempe kacang hijau mentah. Paired samples t-test digunakan untuk menentukan apakah kandungan senyawa isoflavon pada 100 g kacang hijau segar sebelum dan sesudah pengolahan (fermentasi dan perebusan) berbeda.
Hasil uji lanjut perbandingan berganda Tukey diketahui bahwa penambahan konsentrasi ragi 0.05%, 0.1%, dan 0.2% tidak berbeda nyata pada α=0.05 terhadap warna tempe kacang hijau. Penambahan konsentrasi ragi 0.1%, 0.15%, dan 0.2% tidak berbeda nyata pada α=0.05 terhadap aroma. Penambahan konsentrasi 0.05%, 0.1%, 0.15%, dan 0.2% tidak berbeda nyata terhadap tekstur, kepadatan, dan kekompakan tempe kacang hijau mentah. Kelima parameter, konsentrasi 0.1%, 0.15%, dan 0.2% tidak berbeda nyata dalam arti konsentrasi tersebut menghasilkan tempe dengan kualitas yang baik, walaupun pada warna konsentrasi 0,1% tidak sebaik dengan konsentrasi 0.15%. Secara prinsip ekonomi dipilih konsentrasi ragi 0.1% untuk pembuatan tempe kacang hijau yang baik mengingat konsentrasi 0.1% mendominasi empat dari lima parameter.
Jumlah isoflavon pada kacang hijau segar adalah 70.74 mg per 100 g bahan terdiri dari daidzein 35.88 mg, genistein 21.81 mg, dan glisitein 13.05 mg. Jumlah isoflavon pada tempe kacang hijau adalah 59.00 mg per 100 g bahan yaitu
daidzein 29.09 mg, genistein 18.16 mg, dan glisitein 11.76 mg. Bubur kacang
hijau mengandung 14.44 mg isoflavon per 100 g bahan (daidzein 6.01 mg,
genistein 5.91 mg, dan glisitein 2.52 mg).
Kandungan isoflavon tempe kacang hijau yang berasal dari 100 g kacang hijau segar adalah 71.59 mg/121.36 g tempe. Hasil uji Paired sample t-test menunjukkan bahwa kandungan isoflavon 100 g kacang hijau segar sebelum dan sesudah fermentasi (menjadi tempe) tidak berbeda nyata pada α=0.05. Hal ini berarti peningkatan kandungan isoflavon pada proses fermentasi tidak terlalu signifikan. Pengolahan perebusan pada kacang hijau menyebabkan kandungan isoflavon mengalami penurunan. Kandungan isoflavon bubur kacang hijau yang berasal dari 100 g kacang hijau segar adalah 48.67 mg/336.58 g bubur. Uji Paired
samples t-test menunjukkan bahwa kandungan isoflavon 100 g kacang hijau segar
sebelum dan sesudah perebusan (menjadi bubur) berbeda nyata pada α=0.05. Hal ini berarti pengolahan menggunakan suhu 98ºC dapat menurunkan kandungan isoflavon.
Analisis proksimat yang dilakukan menunjukkan hasil sebagai berikut : kadar air kacang hijau segar 12.10% (bb), tempe kacang hijau 64.32% (bb), dan bubur kacang hijau 81.92% (bb). Kadar abu kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau masing-masing 3.5% (bk), 0.70% (bk) dan 3.10% (bk). Kandungan lemak kacang hijau segar 0.56% (bk), tempe kacang hijau 0.56% (bk), dan bubur kacang hijau 0.44% (bk). Kadar protein kacang hijau segar 24.78% (bk), tempe kacang hijau 41.92% (bk), dan bubur kacang hijau 23.62% (bk) dan total karbohidrat pada kacang hijau segar 70.98% (bk), tempe kacang hijau 56.81% (bk), dan bubur kacang hijau 72.84% (bk).
(Vigna radiata L), TEMPE KACANG HIJAU, DAN BUBUR KACANG HIJAU
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Program Studi Gizi Masyarakat dan Sumberdaya Keluarga,
Fakultas Pertanian, Institut Pertanian Bogor
Oleh : Rochani Iswandari
A54101075
PROGRAM STUDI GIZI MASYARAKAT DAN SUMBERDAYA KELUARGA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR 2006
ii
BUBUR KACANG HIJAU Nama Mahasiswa : Rochani Iswandari
Nomor Pokok : A54101075
Menyetujui :
Dosen Pembimbing I Dosen Pembimbing II
Prof. Dr. Ir. Hidayat Syarief, MS Ir. Eddy Setyo Mudjajanto NIP. 130 516 871 NIP. 131 760 849
Mengetahui : Dekan Fakultas Pertanian
Prof. Dr. Ir. Supiandi Sabiham, M.Agr. NIP 130 422 692
iii
memberikan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi ini. Shalawat dan salam tidak lupa tercurah kepada Rasulullah Muhammad SAW dan pengikutnya hingga akhir zaman.
Penulis menyampaikan ucapan terima kasih kepada Prof. Dr. Ir. Hidayat Syarief, MS dan Ir. Eddy Setyo Mudjajanto sebagai dosen Pembimbing Skripsi yang telah meluangkan waktu, memberikan masukan berupa saran, kritik, dan perbaikan sehingga penulis dapat menyelesaikan skripsi ini. Dr. Ir. Lilik Kustiyah, MS sebagai dosen pemandu seminar; Feti, Muna, Wara, dan Tini Sabrina sebagai pembahas seminar; serta Dr. Ir. Budi Setiawan, MS sebagai dosen penguji.
Terima kasih untuk Almarhum Bapak (Kamto Suharjo), Ibu tercinta (Murjanah), Keluarga Bapak Ibu Marno, Mas Har, Mbak May, Mas Anto, Mbak Ita, Mas Dono, Mbak Sul, Mas Abdi, Mbak Sri, Mas Koko, Mas Teguh dan istri serta ponakan semua, Mas Akhmad, Bapak Ibu Gresik, Mbak Us, Isa, Khoiro dan Hakam atas kasih sayang, perhatian, bimbingan, bantuan, doa dan dorongan semangat untuk terus menuntut ilmu. Mas Luges atas ide penelitiannya. Mas Budi, dek Rochmad, Ella, Dedet, Vidya, Dina, Ina, Cipta Usaha Mandiri Crew, Indria, Nofa, Veejay, Wulan, Jihad, Endah, Nia, Ika, Ade, Wawan, Adi, Eka, Ratnasari, Ria, Eva dan Yulia atas bantuan dan kerjasamanya. Temen-temen GMSK angkatan 38, 39, 40, dan alih jenjang 40 atas kebersamaannya. Pak Dadang, Pak Asep dan Ocha atas ilmunya. Temen-temen kost DC 9 BS, Adinda Balio, Griya Mahasiswa, ASAD dan KKP Sukamakmur. Special to Almarhumah Nova, Ibu Netti, Pak Bibit, Bu Dede, Pak Huri, Bu Ade, Bu Ana, Mbak Wati, Bu Ito, Bu Tatik, Teh Yati, Bu Umi, Mas Rena, dan Pak Ugan. Pak Mashudi, Bu Rizki, Pak Lalu, Mas Afdan dan Mas Yudi atas bimbingan selama di Laboratorium. Pak Damuri sekeluarga sebagai pemilik pabrik tempe di Ciherang.
Akhirnya penulis mengucapkan terimakasih kepada semua pihak yang telah membantu. Semoga Allah membalas semua kebaikan yang telah diberikan. Penulis berharap karya ini diridhoi Allah dan dapat bermanfaat bagi semua pihak.
Bogor, Januari 2006
iv
Rochani Iswandari, lahir di Klaten, 14 Januari 1982 adalah mahasiswi Program Studi Gizi Masyarakat dan Sumberdaya Keluarga, Fakultas Pertanian, Institut Pertanian Bogor. Penulis adalah anak ketujuh dari enam bersaudara dari keluarga Bapak Alm. Kamto Suharjo dan Ibu Murjanah. Pendidikan SD ditempuh dari tahun 1989 sampai 1994 di SDN Karang I Wedi Klaten. Tahun 1995 melanjutkan pendidikan di SLTP Negeri 2 Klaten hingga tahun 1998 dan melanjutkan pendidikan di SMU Negeri 1 Klaten sampai tahun 2001. Penulis diterima sebagai mahasiswi IPB pada tahun 2001 melalui jalur UMPTN (Ujian Masuk Perguruan Tinggi Negeri). Selama menjadi mahasiswi penulis aktif di berbagai organisasi kemahasiswaan yaitu BEM Faperta IPB, KSR IPB, Pramuka IPB, Bina Desa HIMAGITA IPB dan HPMB. Penulis juga aktif dalam berbagai kegiatan kepanitiaan yang ada di kampus IPB.
Penulis menjabat sebagai Manajer Pemasaran pada kelompok wirausaha ”Cipta Usaha Mandiri”. Penulis menjadi juara III bersama Dedet Handayani dalam Lomba Karya Tulis Ilmiah Mahasiswa bidang Pendidikan tingkat IPB 2003 dengan judul ”Dongeng Sebagai Sarana Pemberdayaan Lansia Dalam Pendidikan Karakter Anak”. Penulis menjadi duta IPB dalam Temu Bhakti KSR Se-Indonesia II di UNILA, Lampung (2003) dan menjadi duta IPB dalam Raimuna Nasional di Yogyakarta (2003). Penulis menjadi fasilitator Bina Keluarga Dhuafa dan Pustaka Minat Mandiri kerjasama GMSK dan Yayasan Cahaya Keluarga (2003-2004). Penulis dan empat rekan lainnya (Dedet, Dina, Ratu Ina, dan Vidya) mendapat gelar Juara Poster Ilmiah Terbaik pada Pekan Ilmiah Mahasiswa Nasional (PIMNAS) XVIII 2005 di Universitas Andalas, Padang dengan judul ”Sosialisasi dan Pemasaran Kamaboko dalam Rangka Upaya Peningkatan Nilai Tambah Produk Ikan Patin”. Penulis menjadi asisten muda tidak tetap pada Mata Kuliah Higiene Pangan Nabati, Kewirausahaan, dan Manajemen Jasa Makanan dan Gizi (2005). Penulis juga menjadi Konselor Usaha kerjasama P2SDM LPPM IPB, Yayasan DAMANDIRI dan Yayasan INDRA (2005). Penulis menjadi asisten peneliti pada Survei Perbaikan Gizi dan Kesehatan Masyarakat peserta Special
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 3 Kegunaan... 3 TINJAUAN PUSTAKA ... 4 Isoflavon ... 4 Kacang Hijau ... 7 Fermentasi ... 10 Tempe ... 11
Bubur Kacang Hijau... 14
BAHAN DAN METODE ... 16
Tempat dan Waktu ... 16
Bahan dan Alat ... 16
Metode Penelitian ... 16
a. Penelitian Pendahuluan ... 16
1. Pemilihan Sampel Kacang Hijau... 17
2. Trial and Error Proses Pembuatan Tempe Kacang Hijau .. 17
b. Penelitian Lanjutan ... 18
Rancangan Percobaan ... 19
Pengolahan dan Analisis Data ... 19
HASIL DAN PEMBAHASAN ... 20
Penelitian Pendahuluan ... 20
Metode Pembuatan Tempe Kacang Hijau ... 20
Penelitian Lanjutan ... 26
Uji Organoleptik ... 26
Kandungan Isoflavon ... 32
Kandungan Gizi ... 37
KESIMPULAN DAN SARAN ... 43
Kesimpulan ... 43
Saran ... 44
DAFTAR PUSTAKA ... 45
vi
1. Komposisi zat gizi kacang hijau mentah dan rebus per 100 g bahan ...
9
2. Komposisi zat gizi kacang hijau dan kedelai per 100 g bahan...…..…..
9
3. Hasil uji Kruskal Wallis dan uji perbandingan berganda Tukey pada tempe kacang hijau mentah ...
26
4. Kandungan isoflavon pada kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau per 100 g bahan ……..
33
5. Kandungan isoflavon pada kacang hijau segar per 100 g bahan ...…...
34
6. Kandungan isoflavon pada tempe kacang hijau per 100 g bahan ...…...
34
7. Kandungan isoflavon pada bubur kacang hijau per 100 g bahan ...…...
36
8. Hasil analisis proksimat kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau (%bb) ...…………...
37
9. Hasil analisis proksimat kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau (%bk) ...
37
10. Formulir uji organoleptik ... 50
vii
1. Struktur senyawa isoflavon ... 5
2. Proses pembuatan tempe kedelai ... 15
3. Biji kacang hijau yang digunakan pada penelitian ... 17
4. Ragi yang digunakan pada pembuatan tempe kacang hijau ... 17
5. Mesin penggiling dan pengelupas kedelai dan kacang hijau .. 21
6. Tempat penyimpanan tempe kedelai dan tempe kacang hijau 24 7. Metode pembuatan tempe kacang hijau modifikasi pembuatan tempe kedelai ... 25 8. Rata-rata skor penerimaan warna tempe kacang hijau dengan beberapa penambahan konsentrasi ragi ... 27 9. Rata-rata skor penerimaan aroma tempe kacang hijau dengan beberapa penambahan konsentrasi ragi ... 28 10. Rata-rata skor penerimaan tekstur tempe kacang hijau dengan beberapa penambahan konsentrasi ragi ... 29 11. Rata-rata skor penerimaan kepadatan tempe kacang hijau dengan beberapa penambahan konsentrasi ragi ... 30 12. Rata-rata skor penerimaan kekompakan tempe kacang hijau dengan beberapa penambahan konsentrasi ragi ...…... 30 13. Tempe kacang hijau dengan berbagai konsentrasi ragi ... 31
14. Tempe kacang hijau ... 31
15. Irisan tempe kacang hijau dengan berbagai konsentrasi ragi . 32 16. Kepadatan dan kekompakan tempe kacang hijau ... 32
17. Alat HPLC (High Performance Liquid Chromatography) ... 33
18 Metode pembuatan bubur kacang hijau ... 56
viii
1. Formulir uji mutu organoleptik tempe kacang hijau mentah 50 2a. Rekapitulasi hasil data uji mutu organoleptik tempe kacang
hijau mentah ulangan 1 ...
51
2b. Rekapitulasi hasil data uji mutu organoleptik tempe kacang hijau mentah ulangan 2 ...
52
3. Hasil uji Kruskal Wallis pengaruh penambahan konsentrasi ragi terhadap warna tempe kacang hijau ...
53
4. Hasil uji Kruskal Wallis pengaruh penambahan konsentrasi ragi terhadap aroma tempe kacang hijau ...
53
5. Hasil uji Kruskal Wallis pengaruh penambahan konsentrasi ragi terhadap tekstur tempe kacang hijau ...
53
6. Hasil uji Kruskal Wallis pengaruh penambahan konsentrasi ragi terhadap kepadatan tempe kacang hijau ...
54
7. Hasil uji Kruskal Wallis pengaruh penambahan konsentrasi ragi terhadap kekompakan tempe kacang hijau ...
54
8. Hasil uji perbandingan berganda Tukey pengaruh penambahan konsentrasi ragi terhadap warna tempe kacang hijau ...
55
9. Hasil uji perbandingan berganda Tukey pengaruh penambahan konsentrasi ragi terhadap aroma tempe kacang hijau ...
55
10. Proses pembuatan bubur kacang hijau ... 56 11. Metoda analisis senyawa isoflavon ... 57 12a. Peak standar kandungan isoflavon kacang hijau segar pada
analisis HPLC ……….
59
12b. Peak sampel ulangan 1 kandungan isoflavon kacang hijau
segar pada analisis HPLC ………...
59
12c. Peak sampel ulangan 2 kandungan isoflavon kacang hijau
segar pada analisis HPLC ………...
60
13a. Peak standar kandungan isoflavon tempe kacang hijau pada
analisis HPLC ……….
60
13b. Peak sampel ulangan 1 kandungan isoflavon tempe kacang
hijau pada analisis HPLC ………...
61
13c. Peak sampel ulangan 2 kandungan isoflavon tempe kacang
hijau pada analisis HPLC ………...
ix
14b. Peak sampel ulangan 1 kandungan isoflavon bubur kacang
hijau pada analisis HPLC ………...
62
14c. Peak sampel ulangan 2 kandungan isoflavon bubur kacang
hijau pada analisis HPLC ………..
63
15 Hasil Paired sample t-test kandungan isoflavon pada 100 g
kacang hijau segar sebelum dan sesudah fermentasi (menjadi tempe) ...
63
16 Hasil Paired sample t-test kandungan isoflavon pada 100 g
kacang hijau segar sebelum dan sesudah perebusan (menjadi bubur) ...
63
17. Metode analisis zat gizi ... 64
18. Hasil analisis proksimat tempe kacang hijau dengan konsentrasi ragi 0.1% ...
Latar Belakang
Isoflavon adalah golongan senyawa isoflavonoid yaitu subkelas senyawa flavonoid yang memiliki 15 atom C dan merupakan golongan senyawa fenol alami terbesar (Suradikusumah, 1989). Distribusi isoflavon terbatas pada tumbuhan kacang-kacangan (leguminosae) (Harbone, 1996). Pada tanaman kacang-kacangan terdapat ratusan isoflavon (Dewick, 1994). Isoflavon tidak terdapat pada mikroorganisme seperti bakteri, algae, jamur, dan lumut (Markham, 1988).
Isoflavon di alam ditemukan dalam bentuk glikosida berupa daidzin,
genistin, glisitin, acetyldaidzin, dan acetylgenistin. Selain bentuk glikosida
isoflavon juga ditemukan dalam bentuk aglikonnya yaitu daidzein, genistein, dan
glisitein (Wuryani, 1992). Perubahan senyawa isoflavon dalam bentuk glikosida
menjadi aglikon disebabkan adanya proses perendaman dan fermentasi terutama pada pembuatan tempe. Hal ini karena adanya kemampuan kapang tempe menghasilkan enzim β-glikosidase. Enzim ini berperan dalam mengubah senyawa isoflavon dalam bentuk glikosida (genistin dan daidzin) menjadi senyawa isoflavon dalam bentuk aglikonnya (genistein dan daidzein) (Koswara, 1995). Pawiroharsono (1995), mengatakan pada proses perendaman dan fermentasi terjadi pembebasan senyawa aglikon dengan pola yang identik. Namun, pembebasan senyawa selama proses fermentasi tempe lebih besar bila dibandingkan dengan proses perendaman.
Isoflavon dilaporkan memiliki khasiat farmakologi. Sifat fisiologis aktif dari senyawa isoflavon antara lain antifungi, antioksidan, antihemolisis, dan antikanker. Konsumsi isoflavon sejumlah 1.5-2.0 mg/kg/bb/hari berfungsi sebagai antikanker pada tubuh (Wang & Murphy, 1994). Kemampuan antikanker dari senyawa isoflavon, terutama genistein dan daidzein akhir-akhir ini telah banyak dibuktikan pada beberapa penelitian di luar negeri. Studi epidemiologi di Jepang menemukan bahwa konsumsi isoflavon bermanfaat mengurangi konsentrasi kolesterol serum pada hiperkolesterolemia sehingga dapat menurunkan insiden kanker payudara (Aldercreutsz, 1998 & Golberg, 1996). Coward, Barnes, Setchell
dan Barnes (1993) menyatakan bahwa isoflavon dan glikosida dapat menghambat pertumbuhan sel kanker prostat pada pria. Penelitian lain menemukan bahwa komponen biokimia ini bermanfaat potensial untuk mencegah penyakit jantung (Anthony, Clarkson, & Williams, 1998), menghambat perkembangan atherosklerosis sehingga dapat mencegah penyakit kardiovaskular (Golberg, 1996), meningkatkan densitas massa tulang sehingga mencegah osteoporosis (Anderson & Carner, 1997), dan mereduksi sindrom pascamenopouse pada wanita (Knight, Wall, & Eden, 1996).
Penelitian tentang kandungan isoflavon pada tumbuhan terutama kacang-kacang masih sedikit dilakukan. Kandungan isoflavon pada kacang-kacang-kacang-kacangan yang telah diteliti antara lain pada kacang kedelai (Glycine max), kacang koro (Phaseolus lunatus), dan kacang panjang (Vigna angularis) (Harborne, 1996).
Pentingnya manfaat isoflavon bagi kesehatan manusia dan masih sedikitnya penelitian tentang isoflavon mendorong peneliti untuk melakukan studi kandungan isoflavon pada jenis kacang-kacangan lain, dalam hal ini adalah kacang hijau (Vigna radiata L).
Ketersediaan kacang hijau melimpah di Indonesia. Kacang hijau menduduki urutan ketiga dalam tanaman kacang-kacangan setelah kedelai dan kacang tanah. Permintaan terhadap komoditi kacang hijau termasuk stabil, karena penggunaannya kontinu setiap hari dan sepanjang tahun. Jenis olahan kacang hijau antara lain kecambah kacang hijau, bubur kacang hijau, makanan bayi, kue dan pangan tradisional, minuman kacang hijau, tahu, sun, tepung hunkue, dan sayuran (Soeprapto & Sutarman, 1990).
Perhitungan jumlah senyawa isoflavon dalam bahan pangan diperlukan untuk mengetahui potensi senyawa isoflavon sebagai antikanker sehingga selain perlu dilakukan analisis secara kualitatif diperlukan juga analisis secara kuantitatif. Penelitian ini akan menganalisis kandungan isoflavon baik jenis maupun jumlahnya pada kacang hijau segar, dan kacang hijau hasil olahan yaitu pengolahan dengan cara fermentasi (tempe kacang hijau) dan dengan panas/perebusan (bubur kacang hijau).
Tempe adalah produk hasil fermentasi kacang-kacangan dengan menggunakan kapang Rhizopus oligosporus dan Rhyzopus oryzae. Banyak jenis
kacang-kacangan yang dapat digunakan dalam penelitian untuk pembuatan produk tempe, diantaranya kacang merah, kacang koro, kacang beras, kecipir, lamtoro, dan biji-bijian lain (Matthews, 1989). Karakteristik yang dimiliki kacang hijau tidak berbeda jauh dengan karakteristik kacang kedelai sehingga kacang hijau berpotensi untuk diolah menjadi tempe.
Bubur kacang hijau adalah makanan yang paling banyak dikonsumsi dan digemari karena selain enak rasanya juga mudah dalam pembuatannya. Pengolahan bubur kacang hijau hanya memerlukan proses perendaman dan pemasakan dengan panas (perebusan).
Tujuan Tujuan Umum
Tujuan umum penelitian ini adalah mengkaji kandungan isoflavon pada kacang hijau (Vigna radiata L) dan hasil olahannya yaitu tempe kacang hijau dan bubur kacang hijau.
Tujuan Khusus
a. Mempelajari pembuatan tempe kacang hijau.
b. Menentukan jumlah konsentrasi ragi pada pembuatan tempe kacang hijau melalui uji organoleptik.
c. Menganalisis komponen aktif isoflavon pada kacang hijau segar, tempe kacang hijau dan bubur kacang hijau.
d. Mengetahui kandungan gizi pada kacang hijau segar, tempe kacang hijau, dan bubur kacang hijau meliputi kadar air, kadar abu, protein, lemak, dan total karbohidrat.
Kegunaan
Tempe kacang hijau dan bubur kacang hijau diharapkan dapat memenuhi kebutuhan masyarakat akan gizi dan isoflavon. Hasil penelitian ini dapat dijadikan acuan data primer tentang kandungan isoflavon pada kacang hijau baik dalam bentuk segar maupun hasil pengolahan yaitu pengolahan secara fermentasi (tempe kacang hijau) dan pengolahan dengan panas/perebusan (bubur kacang hijau).
Isoflavon
Flavonoid merupakan kelompok fenol dengan sebuah cincin aromatik dan satu atau lebih gugus hidroksil yang tersebar di alam. Senyawa fenol cenderung larut dalam air karena paling sering dijumpai bergabung dengan gula (glikosida) dan biasanya terdapat dalam rongga sel. Kurang lebih dua ribu jenis golongan flavonoid tersebar di alam (Goldberg, 1996).
Flavonoid merupakan kelompok molekul organik yang tersebar di hampir seluruh bagian tanaman. Hampir semua bagian tanaman yaitu daun, akar, kayu, tepung sari, nektar, bunga, buah dan biji dapat mengandung flavonoid (Markham, 1988). Penyebaran jenis flavonoid terbesar terdapat pada angiospermae (tumbuhan berbiji tertutup). Flavonoid mempunyai potensi sebagai antioksidan (Goldberg, 1996).
Penyebaran flavonoid pada tumbuhan yang secara taksonomi berkaitan mempunyai kecenderungan kuat menghasilkan flavonoid dengan jenis serupa. Informasi yang berguna tentang jenis flavonoid yang ditemukan pada tumbuhan yang sedang ditelaah dapat diperoleh dengan melihat pustaka mengenai telaah flavonoid terdahulu dalam tumbuhan yang berkaitan, misalnya dari marga atau suku yang sama (Markham, 1988).
Isoflavon adalah salah satu senyawa yang termasuk dalam golongan isoflavonoid. Isoflavonoid mengandung 15 atom C yang menyusun konfigurasi
diphenylpropane skeleton sebagai struktur dasarnya termasuk sub-kelas flavonoid.
Penyebaran isoflavon terbatas di alam dan biasanya terdapat dalam kelompok tanaman kacang-kacangan atau leguminosae dan tidak terdapat pada mikroorganisme seperti bakteri, alga, jamur, dan lumut (Markham, 1988). Di dunia tanaman, tidak diketahui secara pasti mengapa kacang-kacangan tertentu mengandung isoflavon. Fungsi biologi isoflavon di dalam siklus hidup tanaman juga tidak diketahui secara pasti (Dewick, 1994).
Isoflavon merupakan salah satu metabolit sekunder. Metabolit sekunder adalah hasil metabolisme yang disintesis oleh beberapa mikroba tertentu yang tidak merupakan kebutuhan pokok mikroba untuk hidup dan tumbuh. Namun,
metabolit sekunder dapat juga berfungsi sebagai nutrien darurat untuk bertahan hidup (Judoamidjojo, Darwis, & Gumbira, 1992).
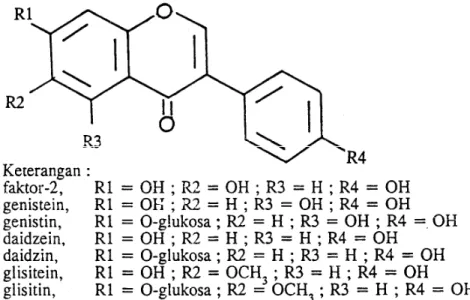
Isoflavon mempunyai struktur kimia hampir sama dengan estrogen. Isoflavon sering disebut fitoestrogen atau estrogen nabati (Pakasi 2000). Struktur kimia senyawa isoflavon terlihat pada Gambar 1.
Gambar 1. Struktur senyawa isoflavon (Naim dkk, 1974)
Kaufman, Duke, Brielman, Boik, dan Okuhira (1997) melaporkan bahwa bagian vegetatif tanaman yaitu biji, batang, daun, tunas, dan akar kacang-kacangan mengandung genistein dan daidzein. Tanaman kacang-kacang-kacangan tersebut termasuk varietas kacang panjang, kacang kapri, semanggi, kacang kedelai, kacang hijau, dan buncis.
Isoflavon pada kedelai terdapat dalam empat bentuk, yaitu dalam bentuk aglikon : daidzein, genistein, dan glisitein; bentuk glikosida : daidzin, genistin, dan glisitin; bentuk asetilglikosida : asetildaidzin, asetilgenestin, dan
asetilglisitin; dan bentuk malonilglikosida : malonildaidzin, 6-0-malonilgenestin, dan 6-0-malonilglisitin (Wang & Murphy, 1994). Gyorgy,
Murata, dan Ikehata (1964) telah mengisolasi dan mengidentifikasi senyawa isoflavon spesifik pada tempe kedelai, yaitu faktor-2 (6,7,4’-trihidroksiisoflavon),
genistein (5,7,4 trihidroksiisoflavon), daidzein (7,4’ dihidroksiisoflavon), dan glisitein.
Pawiroharsono (1995) menyatakan bahwa pada proses perendaman dan fermentasi kedelai terjadi pembebasan senyawa aglikon dengan pola yang identik. Namun, pembebasan senyawa selama proses fermentasi tempe lebih besar bila dibandingkan dengan proses perendaman.
Senyawa isoflavon dalam bentuk glikosida (daidzin, genistin, dan glisitin) terhidrolisis menjadi senyawa isoflavon dalam bentuk aglikon (daidzein,
genistein, dan glisitein) dan glukosa oleh enzim β-glikosidase. Hidrolisis mudah
terjadi karena asam. Keasaman (pH) 5 adalah pH yang optimum bagi enzim β-glikosidase untuk beraktifitas.
Hidrolisis dapat terjadi selama perendaman pada pH lebih dari 3,5 atau kurang dari 9. Menurut Ewan, Morr, dan Seo (1992), perendaman dalam air panas sangat efektif untuk mengaktifkan enzim β-glikosidase sehingga terjadi hidrolisis. Pada proses fermentasi hidrolisis disebabkan kemampuan kapang menghasilkan enzim β-glikosidase yang berperan dalam mengubah isoflavon dalam bentuk glikosida menjadi bentuk aglikonnya (Koswara, 1995).
Sifat fisiologis aktif dari senyawa isoflavon antara lain antifungi, antioksidan, antihemolisis, dan antikanker. Pada tahun 1976, Naim dkk melaporkan bahwa isoflavon dapat menghambat aksi lipoksigenase dan mencegah hemolisis peroksidatif eritrosit domba (secara in vitro). Perbedaan aktivitas antihemolitik dan antioksidan dari sejumlah isoflavon disebabkan oleh perbedaan struktur pada masing-masing isoflavon tersebut.
Coward et al. (1993) menyatakan bahwa isoflavon dan glikosida dapat menghambat pertumbuhan sel kanker payudara pada wanita dan sel kanker prostat pada pria. Penelitian laboratorium menunjukkan, genistein menghambat pertumbuhan sel-sel kanker prostat yang tergantung dan tidak tergantung pada androgen (senyawa yang mempunyai khasiat seperti hormon laki-laki) di dalam tabung reaksi. Genistein juga dapat menghambat potensi penjalaran/penyebaran sel-sel kanker prostat yang lepas dari hambatan pertumbuhan sel. Genistein menghambat aktivitas 5-alfa-reduktase, yakni enzim pengubah hormon laki-laki testosteron menjadi dihidrotestosteron (bentuk androgen lebih aktif) yang merangsang pertumbuhan jaringan prostat, pada sel-sel muda jaringan kulit alat kelamin dan jaringan prostat yang membesar.
Wanita Asia yang makanannya rata-rata mengandung 60-100 mg isoflavon, hanya sedikit mengalami keluhan menopause. Menopause terjadi akibat adanya penurunan kadar estrogen pada wanita (Winarsi, 2004). Setchell dan Aedin (1999) mengemukakan bahwa senyawa fitoestrogen dalam isoflavon dapat berfungsi mengatasi masalah menopause seperti hot flushes (semburan panas dari dada sampai wajah), mencegah penyakit kardiovaskuler, dan osteoporosis.
Isoflavon menstimulasi aktivitas osteoblastik (pembentukan sel-sel tulang) melalui aktivitas reseptor-reseptor estrogen dan meningkatkan produksi hormon pertumbuhan: insulin-like growth factor -1 (IGF-1) sehingga membantu pembentukan tulang (Herman, 2001).
Kacang Hijau Botani
Kacang hijau (Phaseolus radiatus L atau Vigna radiata L) atau biasa disebut golden gram, green gram, mungo, dan mungbean termasuk famili
leguminosae dan sub famili phapilonaceae, genus phaseolus, dan spesies radiatus
(Marzuki, 1977). Kacang hijau merupakan salah satu tanaman yang berumur pendek (± 60 hari). Tanaman ini mudah tumbuh hampir di seluruh tempat, baik dataran rendah maupun dengan ketinggian 500 meter di atas permukaan laut (Soeprapto & Sutarman, 1990).
Tanaman kacang hijau berbatang tegak dengan ketinggian sangat bervariasi antara 30 sampai dengan 60 cm. Cabangnya menyamping pada batang utama, berbentuk bulat dan berbulu, warna batang dan cabangnya hijau tetapi ada juga yang ungu. Sifat-sifat tanaman kacang hijau antara lain lebih tahan kekeringan, lebih sedikit hama dan penyakit yang menyerang, dapat dipanen pada umur 55-60 hari, dapat ditanam pada tanah yang kurang subur, dan lebih kecil resiko kegagalan panen secara totalnya (Soeprapto, 1993).
Buah/polong kacang hijau berbentuk bulat silindris atau pipih dengan ujung runcing atau tumpul. Polong muda berwarna hijau tua atau hijau kelam dan setelah tua, polong berwarna hitam atau coklat jerami dengan panjang 6-15 cm dan tiap polong berisi 6-16 biji bulat agak memanjang. Polong umumnya lebih kecil dibandingkan dengan kacang-kacangan lainnya (Kay, 1979). Warna biji
kebanyakan hijau kusam atau hijau mengkilap, beberapa ada yang berwarna kuning, coklat, dan hitam (Soeprapto, 1993).
Biji kacang hijau secara umum terdiri dari tiga bagian yaitu kulit, endosperma, dan lembaga. Kulit melindungi biji dari kekeringan, kerusakan fisik, mekanik, serangan kapang dan serangga. Endosperma merupakan biji yang mengandung cadangan makanan untuk pertumbuhan lembaga. Lembaga akan membesar saat pertumbuhan biji tersebut (Soeprapto & Sutarman, 1990).
Prospek Komoditi Kacang Hijau di Indonesia
Permintaan terhadap komoditi kacang hijau termasuk stabil, karena penggunaannya kontinu setiap hari dan sepanjang tahun. Di Indonesia pemanfaatan kacang hijau masih terbatas yaitu sebagian besar digunakan untuk sayuran, sedikit digunakan untuk bahan baku minuman dan makanan bayi. Perdagangan kacang hijau dalam negeri hanya dikenal dua macam mutu yaitu kacang hijau berbiji besar dan kacang hijau berbiji kecil. Kacang hijau biji besar digunakan untuk bubur dan tepung sedangkan biji kecil digunakan untuk tauge. Proses pengolahan kacang hijau relatif sederhana dan kacang hijau merupakan bahan makanan yang bergizi tinggi sehingga konsumsi kacang hijau mudah ditingkatkan (Sumarno, 1991).
Kandungan Gizi Kacang Hijau
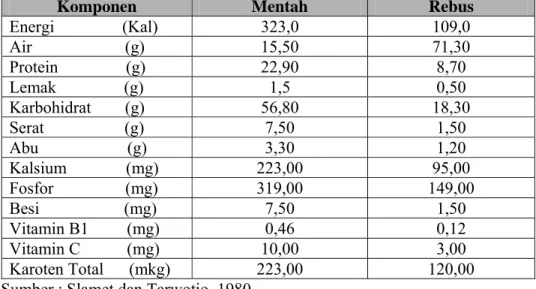
Kacang hijau mempunyai manfaat yang sangat penting karena mempunyai nilai gizi yang cukup baik. Karbohidrat merupakan bagian terbesar pada kacang hijau yaitu 62,5% sehingga dapat digunakan sebagai sumber energi. Karbohidrat tersusun atas pati, gula, dan serat kasar. Menurut Rahayu (1993), pati kacang hijau terdiri dari 28,8% amilosa dan 71,2% amilopektin. Kacang hijau merupakan sumber protein yaitu 22,2%, vitamin A 9 IU, vitamin B1 150-400 IU dan mineral yang meliputi kalsium, belerang, mangan, dan besi. Tabel komposisi kimia kacang hijau dalam 100 g bahan dapat dilihat pada Tabel 1. Komposisi kimia kacang hijau bila dibandingkan dengan kacang kedelai dapat dilihat pada Tabel 2.
Tabel 1. Komposisi zat gizi kacang hijau mentah dan rebus per 100 g bahan
Komponen Mentah Rebus
Energi (Kal) 323,0 109,0 Air (g) 15,50 71,30 Protein (g) 22,90 8,70 Lemak (g) 1,5 0,50 Karbohidrat (g) 56,80 18,30 Serat (g) 7,50 1,50 Abu (g) 3,30 1,20 Kalsium (mg) 223,00 95,00 Fosfor (mg) 319,00 149,00 Besi (mg) 7,50 1,50 Vitamin B1 (mg) 0,46 0,12 Vitamin C (mg) 10,00 3,00 Karoten Total (mkg) 223,00 120,00 Sumber : Slamet dan Tarwotjo, 1980.
Tabel 2. Komposisi zat gizi kacang hijau dan kedelai per 100 g bahan
Komposisi Kacang Hijau Kacang Kedelai
Energi (Kal) 345,0 331,0 Protein (g) 22,2 34,9 Lemak (g) 1,2 18,1 Karbohidrat (g) 62,9 34,8 Kalsium (mg) 125,0 227,0 Fosfor (mg) 320,0 595,0 Besi (mg) 6,7 8,0 Vitamin A (SI) 20 14,0 Vitamin C (mg) 6,0 0 Vitamin B1 (mg) 0,64 1,07 Air (g) 10 7,5
Sumber : Direktorat Gizi Depkes RI, 1994. Zat Antigizi pada Kacang Hijau
Zat antigizi pada kacang hijau antara lain tripsin inhibitor, hemaglutinin, dan asam fitat (Matthews, 1989). Kerusakan zat antigizi terjadi melalui proses pemanasan.
Tripsin inbibitor yang terdapat pada kacang hijau dapat dihilangkan atau dihancurkan selama proses pengolahan dengan menggunakan panas sehingga nilai gizi kacang hijau meningkat ketika dimasak. Proses ini akan menghancurkan asam amino sulfur. Kerusakan antitripsin oleh panas tergantung pada suhu, lama pemanasan, ukuran partikel, dan kadar air bahan yang dipanaskan (Astawan, 2004).
Kacang hijau mempunyai daya cerna protein yang tinggi yaitu 81. Daya cerna dipengaruhi adanya inhibitor tripsin dan aktivasi enzim tripsin serta adanya tanin atau polifenol (Nurdiani, 2003). Biji kacang hijau yang telah direbus atau diolah dan kemudian dikonsumsi mempunyai daya cerna yang tinggi dan rendah daya flatulensinya. Flatulensi disebabkan oleh oligosakarida seperti raffinosa,
stakiosa, dan ferbakosa. Perendaman kacang-kacangan dalam air, proses
perkecambahan, dan fermentasi mencegah timbulnya flatulensi (Astawan, 2004). Zat antigizi lain yaitu hemaglutinin dan asam fitat. Hemaglutinin dapat menggumpalkan sel darah merah dan bersifat toksik. Toksisitas hemaglutinin dapat dihancurkan melalui proses pemanasan pada suhu 100ºC. Asam fitat dapat membentuk kompleks dengan Fe atau unsur-unsur mineral, terutama Zn, Mg, dan Ca menjadi bentuk yang tidak larut dan sulit diserap tubuh sehingga mengurangi ketersediannya dalam tubuh karena menjadi sangat sulit dicerna. Proses fermentasi dapat meningkatkan ketersediaan unsur besi bagi tubuh. Hal ini penting untuk mencegah anemia gizi besi (Astawan, 2004). Proses perendaman dalam air panas dan fermentasi dapat menurunkan kandungan asam fitat karena terjadi hidrolisis asam fitat menjadi inositol dan asam fosfat oleh enzim fitase yang diaktifkan selama perendaman dan fermentasi (Koswara, 1995).
Fermentasi
Fermentasi adalah proses kimiawi yang kompleks sebagai akibat pertumbuhan maupun metabolisme mikroba yang merubah bahan-bahan mentah yang murah bahkan tidak berharga menjadi produk-produk yang bernilai ekonomi tinggi. Proses kimiawi yang terjadi disebabkan oleh enzim dan enzim yang berperan dihasilkan oleh mikroorganisme atau telah ada dalam bahan pangan. Fermentasi bahan makanan menyebabkan perubahan fisik dan kimia yang menguntungkan seperti flavor, aroma, tekstur, daya cerna, dan daya simpan (Rachman, 1989).
Fermentasi merupakan suatu proses oksidasi karbohidrat anaerob atau anaerob sebagian (Desrosier, 1988) dan merupakan hasil kegiatan beberapa jenis organisme diantara beribu-ribu jenis bakteri, khamir, dan kapang yang telah
dikenal. Jadi mikroba yang digunakan dalam proses fermentasi merupakan unsur penentu terhadap berhasil atau tidaknya proses fermentasi bersangkutan.
Hasil fermentasi merupakan bagian penting dalam menu makanan penduduk dunia. Fermentasi mengakibatkan hilangnya karbohidrat dari bahan pangan, tetapi kerugian ini dapat tertutup oleh keuntungan yang diperoleh. Protein, lemak, dan polisakarida dapat dihidrolisis sehingga bahan pangan hasil fermentasi mempunyai daya cerna yang lebih tinggi. Fermentasi menyebabkan perubahan flavor yang dipertimbangkan lebih disukai daripada bahan bakunya (Buckle, Edwards, Fled & Wootton, 1987).
Sifat-sifat bahan pangan hasil fermentasi ditentukan oleh mutu dan sifat-sifat asal bahan pangan, perubahan yang terjadi sebagai hasil fermentasi mikroorganisme dan interaksi yang terjadi di antara kegiatan-kegiatan tersebut dan zat-zat yang merupakan pembentuk bahan pangan tersebut. Fermentasi oleh organisme yang dikehendaki memberi flavor, bentuk yang bagus, dan tekstur bahan pangan yang difermentasi (Buckle et al., 1987).
Tempe
Tempe merupakan makanan asli Indonesia. Tempe sudah dikenal masyarakat sejak berabad-abad silam. Tempe dinilai oleh para ahli bernilai gizi tinggi. Penelitian oleh bangsa Indonesia maupun para pakar mancanegara seperti Jepang, Eropa, dan Amerika banyak membuktikan keunggulan manfaat tempe. Bahan dasar tempe adalah kedelai. Namun demikian, tempe dapat dibuat dengan bahan dasar lain seperti jenis kacang-kacangan dan biji-bijian serta ampas (Koswara, 1995).
Proses pembuatan tempe kedelai terdiri dari beberapa tahap antara lain pembersihan bahan, perendaman, pengupasan, perebusan, pencampuran laru, dan pembungkusan. Lama perendaman bervariasi, biasanya berkisar 8-12 jam, bahkan ada yang sampai 2-3 hari. Pada saat perendaman, air yang diabsorbsi oleh kedelai mendekati dua kali berat keringnya. Selama fermentasi asam oleh bakteri, pH turun hingga 5.3-4.5. Hal ini memberikan kondisi yang baik untuk pertumbuhan kapang tempe terutama Rhyzopus oligosporus dan dapat mencegah perkembangan bakteri lain yang dapat membusukkan kedelai (Steinkraus, 1983).
Pemasakan atau perebusan bertujuan untuk melunakkan biji kedelai yang keras, sehingga memudahkan miselium kapang melakukan penetrasi dan dapat tumbuh pada kedelai. Lama perebusan biasanya berkisar 60 menit. Pengupasan kulit ari dilakukan agar kapang dapat tumbuh sempurna pada kedelai. Pengupasan dapat dilakukan secara basah dengan tangan setelah proses hidrasi (Steinkraus, 1983).
Pembuatan tempe menggunakan beberapa inokulum. Inokulum tempe merupakan inokulum spora kapang dan memegang peranan penting karena dapat mempengaruhi mutu tempe yang dihasilkan. Jenis kapang yang memegang peranan utama dalam pembuatan tempe adalah Rhyzopus oryzae dan Rhyzopus
oligosporus. Kapang lain yang terdapat pada tempe adalah R. stolonifer dan R. arrhizus (Koswara, 1995).
Miselium R. oryzae jauh lebih panjang daripada R. oligosporus sehingga tempe yang dihasilkan kelihatan lebih padat daripada apabila R. oligosporus yang digunakan. R. oligosporus memegang peranan terbesar pada peningkatan nilai gizi protein. R. oligosporus mensintesis enzim protease lebih banyak selama fermentasi, sedangkan R. oryzae mensintesis enzim amilase lebih banyak. Proses fermentasi sebaiknya memakai keduanya dengan kadar R. oligosporus lebih banyak (1 : 2). Interaksi antar kapang yang terdapat dalam inokulum masih banyak yang belum diketahui, antara lain pengaruhnya terhadap pola metabolisme dan mekanisme pembentukan senyawa yang khas untuk citarasa tempe (Rachman, 1989).
Perubahan kimiawi menguntungkan dialami saat bahan dasar diproses menjadi tempe. Tempe memiliki kandungan gizi yang lebih tinggi dibanding bahan bakunya. Tempe sangat mudah dicerna, sehingga baik untuk orang yang terkena gangguan pencernaan. Kapang Rhyzopus sp yang dipakai pada pembuatan tempe, mampu memproduksi enzim yang memecah senyawa organik kompleks menjadi lebih sederhana, sehingga mudah diserap tubuh. Proses pembuatan tempe juga akan menghambat bahkan menghentikan aktivitas zat antigizi. Hal ini membuktikan bahwa tempe aman dan menyehatkan untuk dimakan (Koswara, 1995).
Pembungkusan tempe dapat dilakukan dengan kantong plastik. Bungkusan tersebut diatur peletakannya di atas nyiru yang kering. Pembungkusan dalam kantong plastik jangan sampai rapat agar bagian dalam substrat cukup memperoleh udara. Kapang tempe membutuhkan banyak oksigen untuk pertumbuhannya. Bahan yang telah dibungkus difermentasi pada suhu kamar 30-37°C di tempat yang agak gelap. Suhu ruangan sebaiknya dijaga jangan sampai lebih dari 40°C. Suhu yang terlalu tinggi menyebabkan pertumbuhan kapang tidak sempurna. Pemeraman merupakan bagian terpenting dari proses fermentasi. Kondisi lingkungan akan menentukan spora kapang tumbuh normal atau tidak.
Kondisi pemeraman yang sesuai menyebabkan miselium kapang tumbuh dan mengeluarkan enzim protease, lipase, dan amilase ke lingkungan sekitarnya. Enzim-enzim tersebut akan menguraikan protein, lemak, dan karbohidrat yang terdapat dalam kepingan-kepingan bahan menjadi senyawa yang lebih sederhana seperti asam amino, asam lemak, dan glukosa (Sarwono, 2002)
Pemeraman dilakukan selama semalam kemudian keesokan harinya plastik di tusuk-tusuk dengan kawat agar udara segar dapat masuk ke dalam bahan tempe. Bahan tersebut kemudian diperam kembali selama satu hari dua malam sehingga terbentuk tempe segar yang diharapkan. Waktu fermentasi jika diperpanjang lagi menyebabkan warna tempe akan menjadi hitam karena permukaannya dipenuhi spora kapang.
Tempe yang sudah jadi, miseliumnya tumbuh mengelilingi setiap keping biji bahan sehingga kepingan-kepingan itu menjadi satu kesatuan yang kompak. Lebatnya miselium memberikan ujud seperti kapas pada tempe yang dihasilkan. Kesatuan massa miselium yang kompak tersebut tidak rusak pada saat tempe dipotong-potong. (Sarwono, 2002). Tempe segar yang bagus tampak padat dan permukaannya rata diliputi jamur yang tebal dan bila dipegang terasa kenyal atau agak keras serta warnanya putih bersih. Kepingan-kepingan bijinya rata, sama besar, dan tampak rapat antara satu dengan yang lainnya.
Daya simpan tempe tidak lama hanya sekitar lima jam dan cepat membusuk dalam suhu ruang karena jamur tempe masih hidup. Tempe siap dikonsumsi setelah proses fermentasi selama tiga hari. Kesegaran tempe
berlangsung antara pukul 06.00-11.00 di tempat terbuka atau suhu ruangan. Lewat waktu itu kondisi dan rasanya sudah mulai berubah. Rasa gurihnya menurun. Penampilannya tampak lebih kering jika tempe dijual dalam keadaan terbuka sehingga kurang menarik lagi bagi konsumen (Sarwono, 2002).
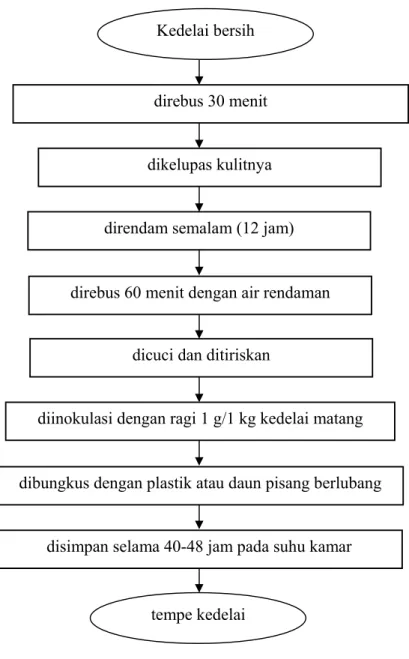
Tempe yang sudah mulai berubah warna (agak kehitaman) pertanda tempe sudah terlalu matang. Tempe tersebut sebaiknya langsung dimasak atau disimpan dalam ruang pendingin dengan suhu di bawah 5ºC, kecuali jika dijadikan tempe busuk. Daya simpan dalam lemari pendingin bisa diperpanjang maksimum tiga hari pada suhu yang rendah sekali atau bisa dibekukan, hanya saja pembekuan akan menurunkan kualitas tekstur dan citarasa tempe. Bagan pembuatan tempe kedelai dapat dilihat pada Gambar 2.
Bubur Kacang Hijau
Pengolahan kacang hijau yang biasa dilakukan masyarakat adalah dalam bentuk bubur kacang hijau. Prinsip pembuatan bubur kacang hijau adalah pemasakan menggunakan panas. Pada proses pemanasan ini, zat gizi yang sangat berpengaruh adalah protein. Pengaruh pemanasan protein ada dua jenis yaitu pengaruh positif dan negatif. Pengaruh positif yaitu meningkatkan daya guna protein antara lain dengan menginaktifkan atau menurunkan aktifitas protein inhibitor. Penurunan aktivitas tersebut jelas menyebabkan nilai biologis protein meningkat. Proses pemanasan dengan derajat panas tertentu dapat memperbaiki nilai protein legume dan hal itu merupakan pemanasan yang menguntungkan (Nurasa, 1991).
Kacang-kacangan yang direndam dalam air terlebih dahulu selama beberapa waktu dan pengukusan pada tekanan atmosfer dapat menghancurkan antitripsinnya. Perebusan lebih efektif daripada pengukusan dalam menghancurkan antitripsin (Muchtadi, 1989).
Penurunan daya emulsifier, daya stabilisator protein, daya pembentukan buih, kelarutan, dan sebagainya merupakan pengaruh negatif dari proses pemanasan selama proses pengolahan. Pengaruh negatif akibat pemanasan terhadap protein antara lain ditunjukkan dengan nilai gizi, dekstruksi protein sehingga menghilangkan fungsi dan sifat protein yang diharapkan.
Pembuatan Tempe Kedelai
Gambar 2. Proses pembuatan tempe kedelai (Koswara, 1995) direbus 30 menit
dikelupas kulitnya
dicuci dan ditiriskan
dibungkus dengan plastik atau daun pisang berlubang
tempe kedelai Kedelai bersih
direndam semalam (12 jam)
diinokulasi dengan ragi 1 g/1 kg kedelai matang
disimpan selama 40-48 jam pada suhu kamar direbus 60 menit dengan air rendaman
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Pengolahan Pangan dan Percobaan Makanan, Laboratorium Analisis Kimia Gizi dan Laboratorium Organoleptik, Program Studi Gizi Masyarakat dan Sumberdaya Keluarga, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian juga dilaksanakan di Rumah Produksi Tempe Kedelai desa Ciherang, Margajaya, Bogor Barat serta di Laboratorium Biokimia Enzimatik dan Uji Pasca Panen, Balai Penelitian Pasca Panen, Departemen Pertanian, Cimanggu. Penelitian dilaksanakan pada bulan Juni sampai Oktober 2005.
Bahan dan Alat
Bahan baku utama penelitian pendahuluan adalah kacang hijau biji besar. Bahan baku lainnya adalah ragi tempe yang biasa dipakai oleh pengusaha tempe kedelai di desa Ciherang, Bogor Barat. Bahan tambahan adalah daun pisang sebagai pembungkus tempe kacang hijau. Bahan utama pada penelitian lanjutan adalah tempe kacang hijau yang telah dihasilkan pada penelitian pendahuluan dan bubur kacang hijau (bahan baku kacang hijau sama dengan bahan baku tempe) yang diolah pada penelitian lanjutan. Bahan yang dipakai untuk analisis zat gizi adalah aquades, methanol, n-heksana, chloroform, dan amoniak.
Alat yang digunakan adalah timbangan, kompor, panci, dandang, sendok, dan nyiru untuk penelitian pendahuluan. Penelitian lanjutan menggunakan alat untuk analisis gizi dan isoflavon antara lain HPLC, buret, erlenmeyer, soxhlet, labu lemak, labu kjedahl, kertas saring hulls, dan alat bantu lainnya untuk uji organoleptik (pisau, piring).
Metode Penelitian
Penelitian ini dilakukan dalam dua tahap, yaitu penelitian pendahuluan dan penelitian lanjutan.
Penelitian Pendahuluan
Penelitian pendahuluan meliputi (1) memilih sampel kacang hijau dan ragi tempe (2) melakukan trial and error untuk mempelajari cara pembuatan tempe kacang hijau. Tahap-tahap penelitian pendahuluan adalah sebagai berikut :
1. Pemilihan Sampel Kacang Hijau dan Ragi Tempe
Sampel Kacang Hijau. Sampel kacang hijau adalah kacang hijau biji besar yang dibeli di swalayan Grand, di Bogor. Biji sampel berbentuk bulat silindris dengan ujung tumpul, berwarna hijau tua dengan panjang kurang lebih (0.5-0.8)cm dan mudah dikelupas kulitnya setelah direndam. Kacang hijau yang telah dipilih kemudian dibersihkan dari kotoran atau biji-biji lain yang bercampur.
(0.5-0.8)cm
Gambar 3. Biji kacang hijau yang digunakan pada penelitian
Ragi Tempe. Ragi merupakan kumpulan spora/benih kapang tempe yang penting dalam pembuatan tempe karena dapat mempengaruhi mutu tempe yang dihasilkan (Koswara, 1995). Ragi yang digunakan adalah ragi tempe yang biasa dipakai oleh pengusaha tempe kedelai di desa Ciherang, Margajaya, Bogor Barat. Ragi tempe berupa serbuk atau butiran-butiran kecil berwarna putih kecoklatan.
Gambar 4. Ragi yang digunakan pada pembuatan tempe kacang hijau 2. Trial and Error Proses Pembuatan Tempe Kacang Hijau.
Cara pembuatan ini mengacu pada pembuatan tempe kedelai (Koswara, 1995). Cara pembuatan tempe kedelai dapat dilihat pada Gambar 2. Pembuatan dimulai dari membersihkan kedelai dari kotoran yang tidak diinginkan kemudian dicuci dengan air dan direbus selama 30 menit. Kedelai rebus dikupas kulitnya dengan menginjak-nginjaknya dalam air, kemudian dicuci dan direndam dalam air pada suhu kamar selama 24 jam. Kedelai direbus kembali selama 1 jam dengan air
perendamnya kemudian ditiriskan. Kedelai yang telah dingin diinokulasi dengan ragi tempe (1 g untuk 1 kg kedelai matang) kemudian dibungkus dengan daun pisang atau plastik berlubang dan disimpan pada suhu kamar selama 40-48 jam.
Trial and error yang dilakukan pada proses pembuatan tempe kacang hijau
dengan berat mentah 1 kg adalah pada proses perendaman, pelunakan kacang hijau, pemberian ragi, pembungkusan dan penyimpanan.
Biji kacang hijau direndam menggunakan air biasa atau air suhu ruang (pH ± 7) dan air bekas rendaman kedelai semalam (pH 4.1) selama 1 jam, 2 jam, 3 jam, 4 jam, 5 jam, 6 jam, dan 12 jam. Pelunakan kacang hijau dilakukan dengan (1) perebusan pada suhu 98ºC selama 1 menit, 2 menit, 3 menit, 4 menit, 5 menit, 8 menit, dan 10 menit, (2) pengukusan pada air mendidih selama 15 menit, 20 menit, 25 menit, dan 30 menit, (3) perendaman dalam air mendidih selama 5 menit, 10 menit, 15 menit, 20 menit, 25 menit, dan 30 menit.
Penetapan jumlah ragi berdasarkan standar jumlah ragi yang digunakan pada pembuatan tempe kedelai yaitu 1 g ragi/1 kg berat kedelai matang (Koswara, 1995). Hasil perhitungan jumlah ragi yang digunakan adalah 0.05%, 0.1%, 0.15%, dan 0.2%. Hasil tempe dengan penambahan ragi yang berbeda-beda ini kemudian diujikan kepada panelis untuk mendapatkan standar formula konsentrasi ragi yang digunakan pada pembuatan tempe kacang hijau.
Pembungkusan dilakukan menggunakan plastik (PP) berlubang, daun pisang berlubang, dan daun pisang tidak berlubang. Penyimpanan tempe kacang hijau dilakukan di laboratorium dan di pabrik tempe.
Penelitian Lanjutan
Penelitian lanjutan terdiri dari empat tahap yaitu (1) membuat tempe dengan metoda terpilih dari penelitian pendahuluan dan membuat bubur kacang hijau dengan metode Lilian (2005) (Lampiran 10), (2) melakukan uji organoleptik tempe kacang hijau mentah, (3) menganalisis senyawa isoflavon pada kacang hijau segar, tempe kacang hijau dan bubur kacang hijau dengan metode Kromatografi Cairan Kinerja Tinggi (HPLC) (Lampiran 11), (4) menganalisis kandungan gizi pada kacang hijau segar, tempe kacang hijau dan bubur kacang hijau meliputi kadar air & abu (metode oven biasa), kadar lemak (metode
Soxhlet), kadar protein (metode Semi Kjedahl), dan total karbohidrat (by difference) (metode terlampir pada Lampiran 17).
Rancangan Percobaan
Rancangan percobaan yang digunakan pada uji organoleptik tempe kacang hijau mentah adalah RAL (Rancangan Acak Lengkap) dengan dua kali ulangan perlakuan. Perlakuan percobaan pada pembuatan tempe kacang hijau adalah banyaknya jumlah ragi yang digunakan yaitu A1 (0.05%), A2 (0.1%), A3 (0.15%),
dan A4 (0.2%) (4 taraf perlakuan). Parameter yang diamati adalah warna, aroma,
tekstur, kepadatan, dan kekompakan. Model matematis sebagai berikut : Yij = µ + τi + εij
Dengan :
Yij = pengamatan pada perlakuan ke-i dan ulangan ke-j
i = 1, 2, 3, 4 j = 1, 2
µ = nilai rata-rata umum τI = pengaruh perlakuan ke-i
εij = galat percobaan perlakuan ke-i dan ulangan ke-j
Pengolahan dan Analisis Data
Uji organoleptik bertujuan untuk menentukan standar formula konsentrasi ragi yang digunakan pada pembuatan tempe kacang hijau yang selanjutnya akan dianalisis kandungan isoflavon dan kandungan gizinya. Hasil uji organoleptik diolah menggunakan SPSS versi 11.5 for windows. Data yang diperoleh diuji menggunakan Kruskal Wallis Test dan uji lanjut perbandingan berganda Tukey. Uji Kruskal Wallis digunakan untuk mengetahui pengaruh penambahan konsentrasi ragi terhadap warna, aroma, tekstur, kepadatan, dan kekompakan tempe kacang hijau mentah. Paired samples t-test digunakan untuk menentukan apakah kandungan senyawa isoflavon pada kacang hijau segar sebelum pengolahan (fermentasi dan perebusan) dengan sesudah pengolahan (menjadi tempe dan bubur) berbeda.
Metode Pembuatan Tempe Kacang Hijau
Tahap-tahap pembuatan tempe kacang hijau berbeda dengan pembuatan tempe kedelai. Hasil trial and error pada proses pembuatan tempe kacang hijau dengan berat mentah 1 kg adalah sebagai berikut :
Perendaman
Air Rendaman. Biji kacang hijau direndam menggunakan air biasa atau air suhu ruang (pH ± 7). Hasil yang didapatkan ternyata tidak memuaskan. Biji kacang hijau masih agak keras sehingga sulit untuk dikelupas kulitnya. Air rendaman yang digunakan selanjutnya adalah air bekas rendaman kedelai selama semalam (pH 4.1). Hasil yang didapatkan adalah biji kacang hijau lunak, sehingga mudah dikelupas kulitnya. Nilai pH air rendaman kedelai 4.1 (asam) karena adanya pertumbuhan bakteri asam laktat. Hal ini memberikan kondisi yang baik untuk pertumbuhan kapang tempe terutama Rhyzopus oligosporus dan dapat mencegah perkembangan bakteri lain yang dapat membusukkan kedelai (Steinkraus, 1983). Hasil terbaik perendaman adalah biji kacang hijau direndam dalam air bekas rendaman kedelai semalam. Alternatif lain yang dapat digunakan adalah air kondisi asam dengan kisaran pH ± 4-5. Asam-asam yang dapat digunakan misalnya asam cuka atau asam laktat.
Lama Perendaman. Perendaman dilakukan selama 1 jam, 2 jam, 3 jam, 4 jam, 5 jam, 6 jam, dan 12 jam. Tujuan perendaman adalah agar biji kacang hijau menggembung dan kulit luarnya empuk (Sarwono, 2002). Semakin lama waktu perendaman, biji kacang hijau semakin empuk dan kulit kacang hijau mudah dikelupas. Hasil terbaik trial and error adalah 12 jam. Lama perendaman ini sama dengan lama perendaman pada tempe kedelai.
Pengelupasan Kulit
Pembuatan tempe kedelai secara tradisional menggunakan kaki untuk mengelupas kulit kedelai. Cara tersebut menimbulkan kesan tidak higienis. Namun, akhir-akhir ini sudah banyak pengelupasan dilakukan secara modern yaitu dengan menggunakan mesin atau alat pemecah dan penggiling kedelai. Pengelupasan kulit kacang hijau pada penelitian ini menggunakan tangan.
Pengelupasan dengan mesin dapat dilakukan apabila kacang hijau dalam jumlah besar. Mesin yang digunakan adalah mesin khusus penggiling dan pengelupas kacang hijau atau bisa menggunakan mesin penggiling dan pengelupas kedelai.
Gambar 5. Mesin penggiling dan pengelupas kedelai dan kacang hijau Pelunakan Kacang Hijau
Perebusan. Perebusan pada pembuatan tempe kedelai dilakukan selama 30 menit. Cara ini tidak dapat diterapkan pada biji kacang hijau karena kacang hijau yang direbus selama 30 menit, bijinya hancur menjadi bubur. Trial and
error yang dilakukan adalah kacang hijau direbus pada suhu 98ºC selama 1 menit,
2 menit, 3 menit, 4 menit, 5 menit, 8 menit, dan 10 menit. Hasil perebusan terbaik adalah 3 menit dengan kondisi biji kacang hijau empuk tidak lembek. Namun, perlakuan perebusan ini berdampak pada hasil tempe yang kurang baik. Tempe yang dihasilkan lebih cepat membusuk karena kadar air kacang hijau terlalu tinggi. Menurut Sarwono (2002) dalam proses fermentasi, kapang membutuhkan oksigen yang cukup untuk pertumbuhannya. Biji kedelai yang terlalu basah akan menghambat penyebaran oksigen sehingga pertumbuhan miselium kapang sulit berkembang.
Pengukusan. Alternatif lain untuk pelunakan biji kacang hijau adalah dengan penetrasi panas atau uap melalui proses pengukusan. Trial and error yang dilakukan adalah biji kacang hijau dikukus pada air mendidih selama 15 menit, 20 menit, 25 menit, dan 30 menit. Hasil terbaik pengukusan 20 menit karena biji dalam keadaan empuk tidak lembek. Hasil tempe dengan metode pengukusan
sama dengan metode perebusan yaitu tempe kurang baik. Hal ini karena rendahnya kadar air pada biji kacang hijau. Menurut Sarwono (2002) selain oksigen, pertumbuhan kapang memerlukan suhu dan kelembaban yang cocok. Bahan kedelai masak calon tempe harus cukup mengandung air. Apabila saat menanaknya terlalu kering sehingga kelembaban kurang, mengakibatkan substrat kedelai sukar ditembus dan dilapukkan oleh miselium kapang. Hal ini berlaku juga pada biji kacang hijau.
Perendaman dengan air mendidih. Cara lain yang dilakukan pada trial
and error untuk melunakkan biji kacang hijau adalah dengan merendamnya pada
air mendidih. Perendaman dilakukan selama 5 menit, 10 menit, 15 menit, 20 menit, 25 menit, dan 30 menit. Hasil terbaik adalah 15 menit dengan kondisi kadar air biji kacang hijau yang cukup sehingga kapang dapat tumbuh dengan baik dan menghasilkan tempe yang baik. Perbedaan perlakuan perebusan dengan perendaman air mendidih adalah pada saat perebusan suhu air konstan dan cenderung naik karena pemanasan terus berlangsung. Suhu yang tinggi ini menyebabkan penetrasi air terhadap kacang hijau dan absorbsi kacang hijau terhadap air berlangsung cepat. Hal ini yang menyebabkan kadar air biji kacang hijau tinggi walaupun telah ditiriskan. Pada perendaman air mendidih, suhu air berangsur-angsur turun dari 98°C menjadi 50°C pada menit kelima belas. Turunnya suhu menyebabkan penetrasi air terhadap kacang hijau berlangsung lambat. Hal ini yang menyebabkan kacang hijau mempunyai kadar air yang cukup.
Pendinginan
Pendinginan dilakukan pada nampan yang bersih agar terhindar dari kontaminan mikroorganisme. Nampan yang digunakan adalah nyiru yang terbuat dari bambu karena mempercepat proses pendinginan dan penyerapan kadar air. Pemberian ragi
Formulasi tempe kacang hijau pada penelitian ini adalah banyaknya jumlah ragi yang digunakan. Penetapan jumlah ragi berdasarkan standar jumlah ragi yang digunakan pada pembuatan tempe kedelai yaitu 1 g ragi/1 kg berat kedelai matang (Koswara, 1995).
Pembungkusan
Trial and error yang dilakukan adalah pembungkusan dengan plastik
berlubang, daun pisang berlubang, dan daun pisang tidak berlubang. Plastik yang digunakan adalah plastik PP (Polypropylene) dengan alasan (1) plastik ini biasa dipakai pada pembuatan tempe kedelai (2) penampilan fisik plastik PP lebih
transparan atau bening dibandingkan dengan plastik PE (Polyethylene) (3) permeabilitas terhadap uap air hampir sama dengan PE, namun permeabilitas
PP terhadap gas oksigen lebih baik (4) plastik PP sama dengan PE yaitu aman dan diperbolehkan kontak langsung dengan makanan karena tidak beracun (Sarwono dan Saragih, 2003). Hasil tempe kacang hijau dengan pembungkus plastik kurang memuaskan bila dibandingkan dengan pembungkus daun pisang, karena sesuai dengan sifatnya plastik lebih bisa menahan panas (semi isolator). Panas yang tertahan menyebabkan suhu fermentasi menjadi tinggi. Akibatnya miselium kapang lebih cepat mati dan tempe lebih cepat membusuk, walaupun pada awalnya dengan tingginya suhu dapat mempercepat pertumbuhan kapang.
Tempe kacang hijau dengan pembungkus daun pisang berlubang hasilnya lebih baik daripada daun pisang tidak berlubang. Hal ini disebabkan pertukaran udara pada daun pisang berlubang lebih baik sehingga suhu fermentasi tidak terlalu tinggi dan sesuai dengan pertumbuhan kapang.
Penyimpanan
Di Laboratorium. Percobaan penyimpanan tempe di laboratorium Pengolahan Pangan lantai 2, Program Studi GMSK, IPB menghasilkan hasil yang kurang baik karena suhu kamar terlalu rendah (25°C) sehingga pertumbuhan kapang lambat. Penyimpanan tempe pada suhu inkubator di Laboratorium Analisis Kimia Gizi lantai 3, Program Studi GMSK, IPB cepat membusuk karena suhu yang terlalu tinggi (38°C-40°C).
Di Pabrik Tempe. Penyimpanan yang dilakukan di tempat penyimpanan tempe kedelai milik pabrik tempe kedelai desa Ciherang, Margajaya, Bogor Barat menghasilkan tempe yang paling baik. Suhu penyimpanan berkisar antara 27°C - 33°C. Penyimpanan ini dilakukan mengingat suhu ruangan sudah sesuai dengan suhu fermentasi dan pertumbuhan kapang tempe.
Gambar 6. Tempat penyimpanan tempe kedelai dan tempe kacang hijau Keseluruhan trial and error yang telah dilakukan menghasilkan metode/cara pembuatan tempe kacang hijau dengan berat mentah 1 kg seperti pada Gambar 7 yaitu terdiri dari pemilihan biji kacang hijau, perendaman air kondisi asam pH ± 4-5, pengelupasan kulit dan pencucian dengan tangan, perendaman air mendidih selama 15 menit, pendinginan, pemberian ragi, pembungkusan, dan penyimpanan selama 48 jam pada suhu 27ºC-33ºC.
Pembuatan Tempe Kacang Hijau
* Metode yang asli : direbus selama 30 menit
** Metode yang asli : direndam dalam air biasa pada suhu ruang selama 12 jam kemudian direbus 60 menit dengan air perendamnya Gambar 7. Metode pembuatan tempe kacang hijau (Vigna radiata L) modifikasi
pembuatan tempe kedelai (Koswara, 1995)
direndam dalam air kondisi asam (pH ± 4-5) selama 12jam*
dikelupas kulit arinya dan dicuci
direndam air mendidih selama 15 menit**
ditiriskan kemudian didinginkan di atas nampan bersih
diinokulasi dengan ragi
dibungkus dengan daun pisang berlubang
disimpan masing-masing dalam suhu ruang (27-33)ºC selama 48 jam
tempe kacang hijau kacang hijau tanpa kulit (putih)
Penelitian Lanjutan Uji Organoleptik
Uji organoleptik dilakukan terhadap tempe kacang hijau mentah untuk mengetahui pengaruh penambahan konsentrasi ragi terhadap penerimaan tempe meliputi warna, aroma, tekstur, kepadatan, dan kekompakan. Hasil uji digunakan untuk menentukan standar formula jumlah konsentrasi ragi pada pembuatan tempe kacang hijau. Uji dilakukan di Laboratorium Organoleptik, Program Studi Gizi Masyarakat dan Sumberdaya Keluarga, Fakultas Pertanian, Institut Pertanian Bogor dengan 30 panelis dan dua kali ulangan perlakuan. Hasil uji diolah dengan
Kruskal Wallis Test dan uji lanjut perbandingan berganda Tukey.
Bahan baku tempe adalah 1 kg kacang hijau mentah. Bobot kacang hijau menjadi ± 1250 g setelah mengalami perendaman dan pengupasan. Bobot ini kemudian dibagi empat bagian masing-masing ± 312.5 g dan ditambahkan ragi pada masing-masing bagian 0.05%, 0.1%, 0.15%, dan 0.2%. Bobot ± 321.5 g kacang hijau kupas dan matang dihasilkan 15 bungkus kacang hijau sebelum menjadi tempe dengan berat per bungkus ± 20.81 g. Tempe yang dihasilkan memiliki berat per bungkus ± 20.29 g. Lima belas tempe ini diiris menjadi 2 bagian sehingga dihasilkan 30 irisan tempe yang kemudian diujikan kepada 30 panelis. Pada hari yang berbeda dibuat tempe dengan metode yang sama kemudian diujikan lagi kepada 30 panelis. Hasil uji organoleptik dapat dilihat pada Tabel 3 berikut ini :
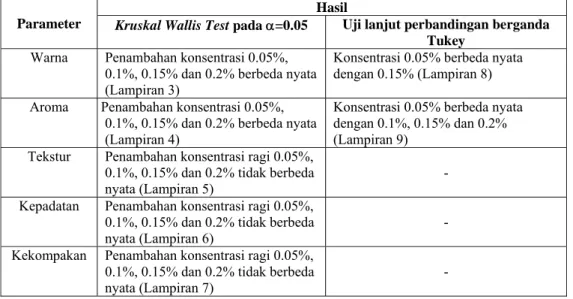
Tabel 3. Hasil uji Kruskal Wallis dan uji perbandingan berganda Tukey pada tempe kacang hijau mentah
Hasil
Parameter Kruskal Wallis Test pada α=0.05 Uji lanjut perbandingan berganda Tukey
Warna Penambahan konsentrasi 0.05%, 0.1%, 0.15% dan 0.2% berbeda nyata (Lampiran 3)
Konsentrasi 0.05% berbeda nyata dengan 0.15% (Lampiran 8) Aroma Penambahan konsentrasi 0.05%,
0.1%, 0.15% dan 0.2% berbeda nyata (Lampiran 4)
Konsentrasi 0.05% berbeda nyata dengan 0.1%, 0.15% dan 0.2% (Lampiran 9)
Tekstur Penambahan konsentrasi ragi 0.05%, 0.1%, 0.15% dan 0.2% tidak berbeda
nyata (Lampiran 5) -
Kepadatan Penambahan konsentrasi ragi 0.05%, 0.1%, 0.15% dan 0.2% tidak berbeda
nyata (Lampiran 6) -
Kekompakan Penambahan konsentrasi ragi 0.05%, 0.1%, 0.15% dan 0.2% tidak berbeda
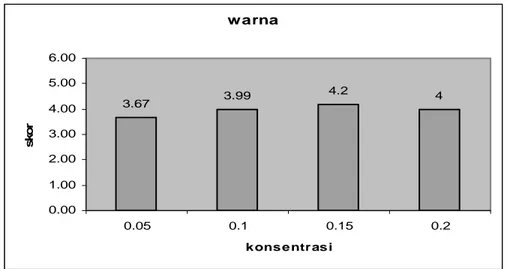
Warna. Tingkat kecerahan warna yang dinilai adalah sangat kusam, kusam, agak kusam, agak putih (cerah), putih (cerah), dan sangat putih (cerah). Skor warna pada uji organoleptik berkisar 3.67 – 4.2 (agak putih/agak cerah) (Gambar 8). Berdasarkan Tabel 3 di atas dapat dijelaskan bahwa semakin banyak jumlah ragi yang ditambahkan akan menghasilkan jumlah miselium kapang yang semakin lebat sehingga warna tempe tampak semakin putih (cerah). Faktor-faktor yang mempengaruhi diantaranya cuaca yang baik bagi pertumbuhan optimum kapang dan ketersediaan energi yang cukup bagi kapang untuk dapat tumbuh dengan baik. Pertumbuhan kapang yang baik akan menghasilkan warna putih pada tempe. Menurut Sarwono (2002) lebatnya miselium kapang memberikan wujud seperti kapas pada tempe yang dihasilkan. Hasil uji lanjut diketahui bahwa penambahan konsentrasi ragi 0.05% tidak berbeda nyata dengan 0.2%. Hal ini diduga pada konsentrasi 0.2% jumlah ragi melebihi batas optimum dari ketersediaan energi yang ada sehingga menyebabkan beberapa miselium kapang mati dan mempengaruhi kualitas warna tempe. Grafik penambahan konsentrasi ragi terhadap warna tempe kacang hijau dapat dilihat sebagai berikut :
Gambar 8. Rata-rata skor penerimaan warna tempe kacang hijau dengan beberapa penambahan konsentrasi ragi
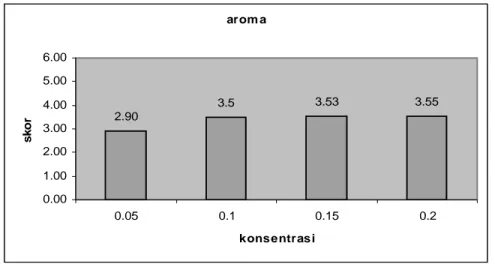
Aroma. Aroma yang dinilai dari sangat tidak segar, tidak segar, agak tidak segar, agak segar, segar, sampai segar sekali. Skor aroma pada uji organoleptik adalah 2.90 – 3.55 (agak tidak segar sampai agak segar) (Gambar 9). Menurut Anwar, Sulaeman dan Kustiyah (1999) proses fermentasi menyebabkan sejumlah protein, lemak dan karbohidrat mengalami degradasi menjadi fraksi-fraksi yang
warna 3.67 3.99 4.2 4 0.00 1.00 2.00 3.00 4.00 5.00 6.00 0.05 0.1 0.15 0.2 k ons e ntras i sko r
lebih sederhana dan lebih mudah dicerna dari pada bahan asalnya. Protein akan dihidrolisis oleh enzim protease menjadi peptida-peptida, pepton-pepton, asam-asam amino dan amoniak, demikian pula lemak atau trigliserida oleh enzim lipase diubah menjadi asam-asam lemak, alkohol atau ester. Beberapa komponen tersebut bersama-sama dengan komponen-komponen volatile dapat membentuk
flavour yang khas. Hal ini berarti semakin banyak jumlah ragi yang ditambahkan
maka semakin banyak pula komponen kacang hijau yang mengalami degradasi. Penambahan konsentrasi 0.1%, 0.15%, dan 0.2% tidak berbeda nyata terhadap aroma. Hal ini diduga bahwa selang 0.1% sampai 0.2% masih memberikan tingkat kesegaran yang sama terhadap aroma tempe kacang hijau, selebihnya dari konsentrasi tersebut akan menimbulkan bau yang tidak sedap karena nutrien yang tersedia pada tempe kacang hijau tidak sebanding dengan jumlah kapang yang tumbuh. Hal ini juga menandakan bahwa konsentrasi 0.1% adalah konsentrasi minimum yang dapat menimbulkan aroma yang khas pada tempe kacang hijau. Grafik penambahan konsentrasi ragi terhadap aroma tempe kacang hijau dapat dilihat sebagai berikut :
Gambar 9. Rata-rata skor penerimaan aroma tempe kacang hijau dengan beberapa penambahan konsentrasi ragi
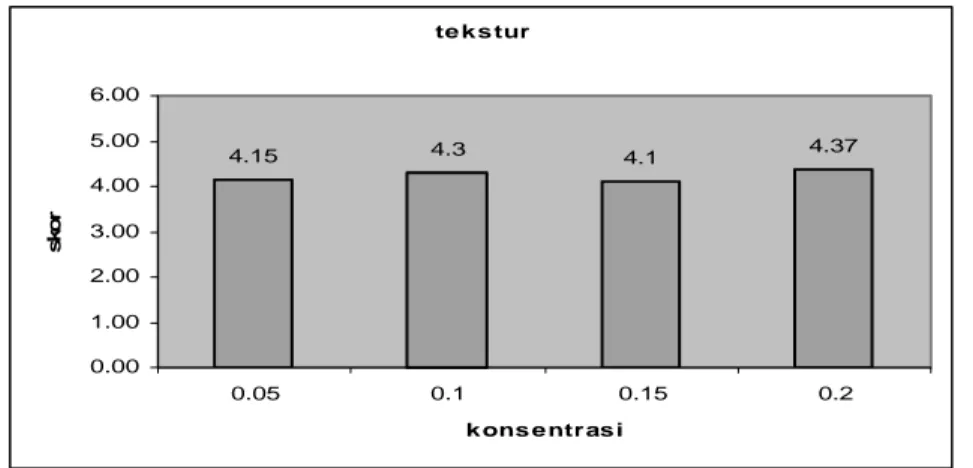
Tekstur. Tekstur tempe kacang hijau yang dinilai pada uji organoleptik adalah sangat lunak, lunak, agak lunak, agak keras/kenyal, keras, dan keras sekali. Skor tekstur berkisar dari 4.15 – 4.37 (kenyal/agak keras) (Gambar 10). Menurut Sarwono (2002) tempe yang sudah jadi, miseliumnya tumbuh mengelilingi setiap keping biji sehingga kepingan-kepingan itu menjadi satu kesatuan yang kompak.
arom a 2.90 3.5 3.53 3.55 0.00 1.00 2.00 3.00 4.00 5.00 6.00 0.05 0.1 0.15 0.2 konsentrasi sk o r
Hal ini berarti semakin banyak ragi yang ditambahkan, semakin kompak tekstur tempe yang dihasilkan. Hasil uji pada Tabel 3 diduga disebabkan batas waktu fermentasi pada masing-masing konsentrasi penambahan ragi pada tempe sama, tepat dan sesuai dengan pertumbuhan kapang. Kapang akan dapat tumbuh dengan baik bila berada pada suhu yang sesuai dengan disertai jumlah energi yang memadai. Waktu fermentasi yang sama disertai dengan pertumbuhan kapang yang baik, dihasilkan tekstur tempe yang sama-sama baik (kenyal/ agak keras). Menurut Sarwono (2002) tempe yang baik apabila dipegang terasa kenyal atau agak keras. Grafik penambahan konsentrasi ragi terhadap tekstur tempe kacang hijau dapat dilihat sebagai berikut :
Gambar 10. Rata-rata skor penerimaan tekstur tempe kacang hijau dengan beberapa penambahan konsentrasi ragi
Kepadatan. Kepadatan tempe berhubungan dengan rapat tidaknya jarak antar kepingan-kepingan kacang hijau. Tingkat kepadatan dimulai sangat tidak padat, tidak padat, agak tidak padat, agak padat, padat, dan padat sekali. Skor kepadatan pada uji organoleptik berkisar 4.39 – 4.69 (agak padat sampai padat) (Gambar 11). Penilaian panelis terhadap kepadatan tempe kacang hijau sama untuk semua konsentrasi ragi. Grafik penambahan konsentrasi ragi terhadap kepadatan tempe kacang hijau dapat dilihat sebagai berikut :
te k s tur 4.15 4.3 4.1 4.37 0.00 1.00 2.00 3.00 4.00 5.00 6.00 0.05 0.1 0.15 0.2 k ons e ntras i sk o r
Gambar 11. Rata-rata skor penerimaan kepadatan tempe kacang hijau dengan beberapa penambahan konsentrasi ragi
Kekompakan. Kekompakan tempe yang dimaksud berhubungan dengan rapat tidaknya miselia-miselia kapang yang tumbuh diantara kepingan-kepingan kacang hijau.Tingkat kekompakan yang dinilai terdiri dari sangat tidak kompak, tidak kompak, agak tidak kompak, agak kompak, kompak, dan kompak sekali. Skor kekompakan pada uji organoleptik adalah 3.85 – 4.27 (agak kompak) (Gambar 12). Konsentrasi antara 0.05% sampai 0.2% memberikan tingkat kekompakan yang sama. Menurut Sarwono (2002) tempe yang sudah jadi, miseliumnya tumbuh mengelilingi setiap keping biji sehingga kepingan-kepingan itu menjadi satu kesatuan yang kompak. Grafik penambahan konsentrasi ragi terhadap kekompakan tempe kacang hijau dapat dilihat sebagai berikut :
Gambar 12. Rata-rata skor penerimaan kekompakan tempe kacang hijau dengan beberapa penambahan konsentrasi ragi
k e padatan 4.39 4.35 4.37 4.69 0.00 1.00 2.00 3.00 4.00 5.00 6.00 0.05 0.1 0.15 0.2 k ons e ntr as i sk or k e k om pak an 3.85 4.27 4.2 4.19 0.00 1.00 2.00 3.00 4.00 5.00 6.00 0.05 0.1 0.15 0.2 k ons e ntras i sko r