189
Penggunaan Enzim Peroksidase dari Daun Mangkokan
untuk Penurunan Kadar Fenol
Santi Nur Handayani, Zusfahair dan Rofika Diah Rizaeni Program Studi Kimia Jurusan MIPA FST UNSOED Purwokerto
ABSTRAK
Penelitian ini bertujuan untuk mengetahui aktivitas peroksidase dari daun mangkokan dan pemanfaatannya untuk menurunkan kadar fenol pada kondisi optimum yang meliputi konsentrasi fenol, pH, suhu, dan waktu kontak optimum. Penelitian dimulai dengan mengekstraksi enzim peroksidase dari daun mangkokan untuk memperoleh ekstrak kasar enzimnya. Enzim yang diperoleh selanjutnya digunakan untuk menentukan kondisi optimum dalam menurunkan kadar fenol dengan adanya hidrogen peroksida. Penentuan kondisi optimum yang dilakukan meliputi penentuan konsentrasi fenol, pH, suhu, dan waktu kontak optimum. Kadar fenolnya dianalisis dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum 505 nm. Hasil penelitian menunjukkan bahwa konsentrasi fenol optimum pada penelitian ini adalah 150 mg/L, dimana penurunan kadar fenolnya mencapai 12,2136 %. Reaksi menggunakan konsentrasi fenol optimum 150 mg/L mencapai optimal pada pH 7 dengan penurunan kadar fenol sebesar 15,6266 %. Penurunan kadar fenol dengan konsentrasi optimum 150 mg/L, pH optimum 7 mencapai optimum pada temperatur 25oC, yaitu sebesar 16,2879 % dan waktu kontak optimum tercapai pada 180 menit atau 3 jam dengan penurunan kadar fenol sebesar atau 19,0039 %.
Kata kunci : Peroksidase, daun mangkokan, fenol ABSTRACT
This research is aimed to know the peroxidase activity from mangkokan leaf with activator and the application to removal phenol at the optimum conditions, such as phenol concentration, pH, temperature, and contact of time. At begin this research was extracted the peroxidase from mangkokan leaf to obtained the crude extract of peroxidase. The crude extract of peroxidase was used in determination the optimal conditions to removal phenols from aqueous solution in the presence of hydrogen peroxide. The optimal conditions were including phenol concentration, pH, temperature, and contact of time. Phenol that have removed was analyzed used the spectrophotometer in maximum wavelength 505 nm. The result showed that optimum phenol concentration is 150 mg/L that can removed phenol until 12.2136 %. The reaction with phenol 150 mg/L is optimal at pH 7 that required 15.6266 % of phenol removal. Phenol removal in phenol 150 mg/L and pH 7 is optimal at temperature 25oC which achieved or 16.2879 % and has optimal contact of time at 180 minutes or 3 hours which achieved 19.0039 %.
Keywords : Peroxidase, mangkokan leaf, phenol PENDAHULUAN
Salah satu bahan pencemar yang berbahaya bagi makhluk hidup dan lingkungannya serta sering dijumpai di perairan adalah limbah organik seperti fenol dan derivatnya. Senyawa fenol dan derivatnya biasanya terdapat pada air buangan sejumlah industri seperti industri konversi batu bara, kilang minyak, resin, plastik, pengolahan cat dan kayu (Singh and Singh, 2002). Keberadaan senyawa ini pada konsentrasi tertentu dapat menyebabkan gangguan fisiologis terhadap ikan, menghambat beberapa aktivitas mikroorganisme dan beberapa biota laut pada proses nitrifikasi.
Berbagai cara telah dilakukan untuk menanggulangi limbah cair fenol, yaitu secara kimia, fisika, dan biologi seperti penggunaan katalis TiO2, ozon, elektrokimia, dan enzim peroksidase.
Penggunaan enzim lebih menguntungkan karena tidak menghasilkan reaksi samping sehingga ramah lingkungan, bersifat efektif dalam jumlah sedikit, bekerja secara selektif terhadap substrat tertentu, tidak berubah selama reaksi, laju reaksi tinggi, dan dapat beroperasi pada range pH yang luas, serta prosesnya lebih mudah dikontrol (Kinsley and Nicell, 2000).
Sumber enzim peroksidase seperti lobak, kedelai, dan horseradish merupakan sumber enzim peroksidase yang komersial. Ketiga sumber peroksidase tersebut sulit didapatkan di Indonesia, oleh karena itu, perlu dikembangkan aplikasi enzim peroksidase bersumber dari berbagai tanaman asli
190 Indonesia. Menurut penelitian yang telah dilakukan Parsono (2007), enzim peroksidase dapat diisolasi dari daun pohon mangkokan berupa ekstrak kasar dengan aktivitas sebesar 9,704 U/mg pada suhu 250C dan 4,414 U/mg pada pH 8. Penelitian ini bertujuan untuk optimalisasi enzim peroksidase dari daun mangkokan untuk menurunkan kadar fenol.
METODE PENELITIAN Bahan dan Alat
Bahan penelitian yang digunakan adalah daun mangkokan (Nothopanax scuttellarium Merr.), H2O2, NH4OH, fenol, H2SO4, pirogalol, Na-fosfat, asam sitrat, Na-sitrat , Tris (hydroxymethyl)
aminomethane, HCl, 4-aminoantipirin, eter, kalium ferisianida, dan aquades. Alat-alat yang digunakan dalam penelitian ini adalah tabung reaksi, gelas ukur, gelas piala, pipet tetes, pipet volumetrik, filler, tabung sentrifugasi, labu ukur, kain kasa, pipet mikro, corong pisah, alat sentrifugasi, neraca analitik, shaker, shaker incubator, pH-meter,dan spektrofotometer UV-Vis.
Prosedur Kerja
Ekstraksi Enzim Peroksidase (Zusfahair and Diastuti, 1998)
Sebanyak 10 g daun mangkokan dilarutkan dalam 60 mL aquades bebas mineral pada suhu kamar, kemudian dihancurkan dengan blender untuk memperoleh sari kasar. Sari kasar daun mangkokan yang diperoleh kemudian disaring dengan kain kasa lalu disentrifugasi dengan kecepatan 4000 rpm selama 20 menit. Supernatan yang diperoleh merupakan ekstrak kasar enzim peroksidase. Penurunan Kadar Fenol Oleh Enzim Peroksidase dan H2O2 (Kennedy, et. al., 2002)
Penentuan Panjang Gelombang Maksimum Fenol
Sebanyak 10 mL larutan fenol 1 mg/L dimasukkan ke dalam gelas piala secara duplo, kemudian ditambahkan 0,25 mL larutan NH4OH 0,5 N. Larutan tersebut diatur pH-nya menjadi 7,9±0,1
dengan larutan penyangga fosfat. Campuran larutan ditambahkan 0,1 mL larutan 4-aminoantipirin 2% sambil diaduk dan ditambahkan 0,1 mL larutan kalium ferisianida 8% sambil diaduk, kemudian didiamkan selama 15 menit. Campuran larutan tersebut diukur absorbansinya pada panjang gelombang 495-505 nm. Panjang gelombang dimana absorbansinya maksimum merupakan panjang gelombang maksimum fenol.
Penentuan Konsentrasi Fenol Optimum
Sebanyak 20 mL larutan fenol dengan konsentrasi 25, 50, 75, 100, 125, 150, 175, 200 dan 250 mg/L dimasukkan dalam gelas piala. Larutan fenol pada sampel kemudian ditambah 5 mL larutan ekstrak kasar enzim, sedangkan larutan kontol ditambahkan enzim setelah 3 jam perlakuan. Larutan ekstrak kasar enzim yang digunakan adalah larutan enzim dengan penambahan aktivator Fe3+ sehingga konsentrasi akhir larutan enzimnya menjadi 10-2,5. Ditambahkan juga 20 mL hidrogen peroksida yang perbandingan konsentrasi molarnya 1:1 dengan konsentrasi fenol. Larutan campuran dikocok selama 3 jam dengan kecepatan 50 rpm/menit pada suhu kamar. Larutan selanjutnya disentrifugasi untuk memisahkan endapan dari larutan. Penurunan kadar fenolnya ditentukan dengan metode menurut SNI 06-6989.21.
Penentuan pH Optimum
Sebanyak 20 mL larutan fenol konsentrasi optimum dimasukkan ke dalam gelas piala dengan variasi pH antara 4-9. Preparasi fenol pada pH 4 dan 5 menggunakan buffer sitrat, preparasi fenol pada pH 6 dan 7 menggunakan buffer natrium fosfat, dan preparasi fenol pada pH 8 dan 9 menggunakan buffer Tris-HCl. Larutan fenol pada sampel kemudian ditambahkan 5 mL larutan ekstrak kasar enzim, sedangkan penambahan larutan enzim pada kontrol dilakukan setelah 3 jam perlakuan. Ditambahkan juga 20 mL hidrogen peroksida yang perbandingan konsentrasi molarnya 1:1 dengan konsentrasi fenol. Larutan campuran dikocok selama 3 jam dengan kecepatan 50 rpm/menit pada suhu kamar. Larutan selanjutnya disentrifugasi untuk memisahkan endapan dengan larutan. Penurunan kadar fenolnya ditentukan dengan metode menurut SNI 06-6989.21.
Penentuan Suhu Optimum
Sebanyak 20 mL larutan fenol konsentrasi optimum pada pH optimum dimasukkan ke dalam gelas piala, kemudian pada sampel ditambahkan 5 mL larutan ekstrak enzim kasar, sedangkan pada kontrol larutan enzim ditambahkan setelah 3 jam perlakuan. Ditambahkan juga 20 mL hidrogen peroksida yang perbandingan molarnya 1:1 dengan konsentrasi fenol. Larutan campuran dikocok selama 3 jam dengan kecepatan 50 rpm/menit pada variasi suhu, yaitu 15, 20, 25, 30, dan 35oC. Larutan selanjutnya disentrifugasi untuk memisahkan endapan dengan larutan. Penurunan kadar fenolnya ditentukan dengan metode menurut SNI 06-6989.21.
191 Sebanyak 20 mL larutan fenol konsentrasi optimum pada pH optimum dimasukkan ke dalam gelas piala, kemudian pada sampel ditambahkan 5 mL larutan ekstrak enzim kasar, sedangkan penambahan larutan enzim pada kontrol dilakukan setelah 3 jam perlakuan. Ditambahkan juga 20 mL hidrogen peroksida yang perbandingan molarnya 1:1 dengan konsentrasi fenol. Larutan campuran dikocok pada suhu optimum dengan kecepatan 50 rpm/ menit dengan variasi waktu kontak 0, 30, 60, 90, 120, 150, 180, 210, dan 240 menit. Penurunan kadar fenolnya ditentukan dengan metode menurut SNI 06-6989.21.
Penentuan Kadar Fenol (SNI 06-6989.21, 2004)
Larutan fenol hasil diencerkan hingga 25 kali. Sebanyak 10 mL larutan fenol hasil kemudian dimasukkan ke dalam gelas piala secara duplo, kemudian ditambahkan 0,25 mL larutan NH4OH 0,5
N. Larutan tersebut diatur pH-nya menjadi 7,9±0,1 dengan larutan penyangga fosfat. Campuran larutan ditambahkan 0,1 mL larutan 4-aminoantipirin 2% sambil diaduk dan ditambahkan 0,1 mL larutan kalium ferisianida 8% sambil diaduk, kemudian didiamkan selama 15 menit. Campuran larutan tersebut diukur absorbansinya pada panjang gelombang maksimum.
HASIL DAN PEMBAHASAN Ekstraksi Enzim Peroksidase
Ekstraksi dapat digunakan sebagai tahap awal proses isolasi dan pemurnian suatu enzim dengan tujuan untuk mendapatkan ekstrak kasar enzim. Menurut Bollag et.al. (1991), prinsip dari teknik ekstraksi enzim terdiri dari dua tahap, yaitu pencucian dengan larutan pengekstrak dan sentrifugasi.
Ekstraksi enzim peroksidase dari daun mangkokan diawali dengan menambahkan 60 mL aquades ke dalam 10 gram daun mangkokan. Campuran tersebut dihaluskan dengan cara diblender dalam keadaan dingin kemudian disaring dengan kain kasa untuk menghilangkan bahan-bahan ekstraseluler yang tidak diinginkan (Bollag, et.al., 1991). Sari kasar yang diperoleh disentrifugasi dalam keadaan dingin dengan kecepatan 4000 rpm selama 20 menit. Supernatan yang diperoleh berwarna hijau bening merupakan ekstrak kasar enzim peroksidase.
Penurunan Kadar Fenol oleh Enzim Peroksidase dan H2O2
Kerja enzim peroksidase untuk menurunkan kadar fenol dipengaruhi oleh konsentrasi fenol, pH, suhu, dan waktu kontaknya.
Penentuan Konsentrasi Fenol Optimum
Kecepatan suatu reaksi yang menggunakan enzim pada konsentrasi enzim yang tetap tergantung pada konsentrasi substrat. Hal ini berhubungan dengan pembentukan kompleks enzim-substrat dimana diperlukan adanya kontak antara sisi aktif enzim dengan enzim-substrat. Bila konsentrasi substrat diperbesar, maka makin banyak substrat yang berhubungan dengan sisi aktif enzim sehingga kecepatan reaksi bertambah. Semua sisi aktif enzim akan jenuh oleh substrat pada suatu batas konsentrasi substrat tertentu sehingga penambahan konsentrasi substrat tidak mengakibatkan penambahan jumlah hasil reaksi (Poedjiadi, 2006). Penentuan konsentrasi optimum fenol sebagai substrat untuk peroksidase dari daun mangkokan perlu dilakukan terlebih dahulu untuk mengetahui batas kejenuhan enzim terhadap substratnya.
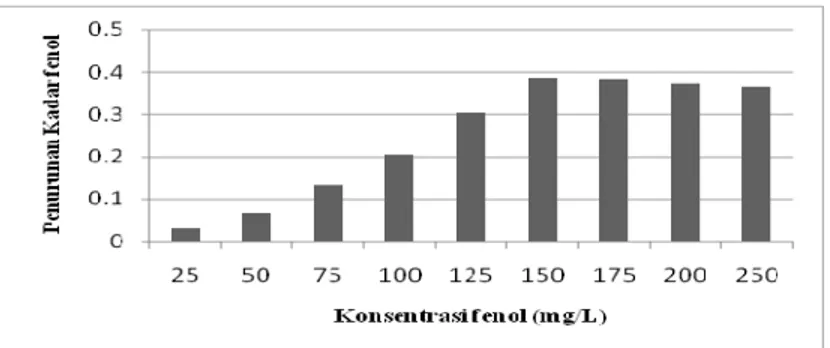
Grafik penurunan kadar fenol pada penentuan konsentrasi fenol optimum ditunjukkan pada Gambar 1.
Gambar 1. Penurunan kadar fenol oleh enzim peroksidase dari daun mangkokan dan H2O2 pada
penentuan konsentrasi fenol optimum
Penurunan kadar fenol pada konsentrasi fenol 25 mg/L memiliki nilai yang paling kecil yaitu 0,0307 mg/L. Penurunan kadar fenol semakin meningkat dengan meningkatnya konsentrasi fenol dan mencapai optimum pada konsentrasi fenol 150 mg/L dengan penurunan sebesar 0,386 mg/L atau 12,2136 %. Bila konsentrasi ditingkatkan lagi maka penurunan kadar fenolnya tidak maksimal lagi. Fenol dengan konsentrasi 150 mg/L digunakan untuk penentuan kondisi optimum penurunan kadar fenol selanjutnya.
192 Penentuan pH Optimum
Enzim bekerja pada kisaran pH tertentu, dimana pada pH optimum enzim memiliki struktur 3 dimensi yang tepat dan konformasi terbaik (keadaan ionisasi yang tepat pada sisi aktif enzim) sehingga enzim dapat mengikat dan mengolah substrat dengan kecepatan maksimum (Sadikin, 2002). Enzim maupun substrat dapat mengalami perubahan muatan listrik bila di luar pH optimum yang mengakibatkan enzim tidak dapat mengikat substrat. Kondisi lingkungan yang asam atau di bawah pH optimum akan menyebabkan kelebihan ion H+ yang akan berikatan dengan sisi aktif enzim atau sisi lain enzim yang bermuatan negatif sehingga struktur enzim menjadi terbuka. Kondisi lingkungan yang basa atau di atas pH optimum akan terjadi kekurangan ion H+ yang menyebabkan substrat cenderung terprotonasi. Kondisi di luar pH optimum tersebut mengakibatkan tidak terjadi kontak enzim dengan substrat sehingga tidak terbentuk kompleks enzim-substrat (Schlegel and Schmidt, 1994).
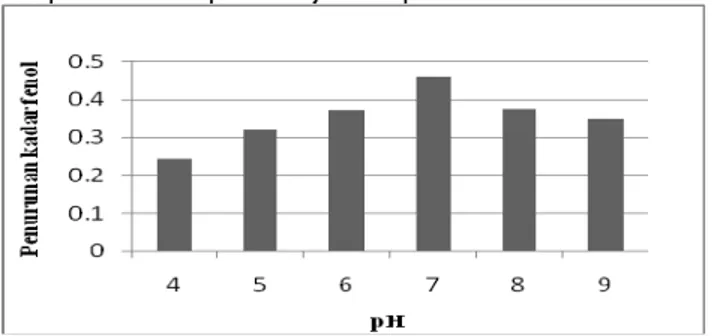
Grafik penurunan kadar fenol pada variasi pH ditunjukkan pada Gambar 2.
Gambar 2. Penurunan kadar fenol oleh enzim peroksidase dari daun mangkokan dan H2O2 pada
penentuan pH optimum
Berdasarkan hasil yang diperoleh dapat disimpulkan bahwa aktivitas peroksidase dari daun mangkokan dalam menurunkan kadar fenol memiliki pH optimum 7 atau pH netral, dimana penurunannya mencapai 0,4595 mg/L atau 15,6266 %. Aktivitas peroksidase dari sumber yang lainnya dalam menurunkan kadar fenol umumnya memiliki pH optimum berkisar pada pH netral. Aktivitas peroksidase dari horseradish memiliki pH optimum 7 untuk menurunkan kadar fenol (Nicell, et. al., 2000). Aktivitas peroksidase dari kedelai dalam menurunkan kadar fenol memiliki pH optimum 8 (Bodalo, et. al., 2006).
Penentuan Suhu Optimum
Suhu yang sangat rendah dapat menyebabkan terhentinya kerja enzim walaupun tidak merusak enzim, dimana enzim dan substrat tidak memiliki energi kinetik untuk melakukan benturan membentuk kompleks enzim-substrat sehingga tidak terbentuk produk. Bila suhu dinaikkan sedikit demi sedikit, benturan enzim dan substrat membentuk kompleks enzim-substrat semakin besar sehingga terbentuk produk yang semakin banyak. Keadaan ini tercapai sampai dicapainya suhu optimum enzim, yaitu suhu yang memberikan aktivitas maksimum bagi kerja enzim. Bila suhu ditingkatkan lagi melebihi suhu optimum, maka enzim terdenaturasi sehingga jumlah enzim yang aktif menghasilkan produk berkurang (Fruton and Simmonds, 1963).
Grafik penurunan kadar fenol pada variasi suhu dapat dilihat pada Gambar 3.
Gambar 3. Penurunan kadar fenol oleh enzim peroksidase dari daun mangkokan dalam H2O2 pada
penentuan suhu optimum
Data yang diperoleh menunjukan bahwa suhu optimum untuk aktivitas enzim peroksidase dari daun mangkokan dalam menurunkan kadar fenol adalah 25oC. Penurunan kadar fenolnya mencapai 0,4702 mg/L dengan persentase sebesar 16, 2879 %. Enzim peroksidase dari horseradish untuk
193 menurunkan kadar fenol memiliki suhu optimum 20 0C (Nicell, et. al., 2000). Peroksidase dari kedelai memiliki suhu optimum 25 0C (Bodalo, et. al., 2006). Suhu optimum enzim peroksidase dari Coprinus cinereus adalah 20 0C (Masuda, et. al., 2000).
Penentuan Waktu Kontak Optimum
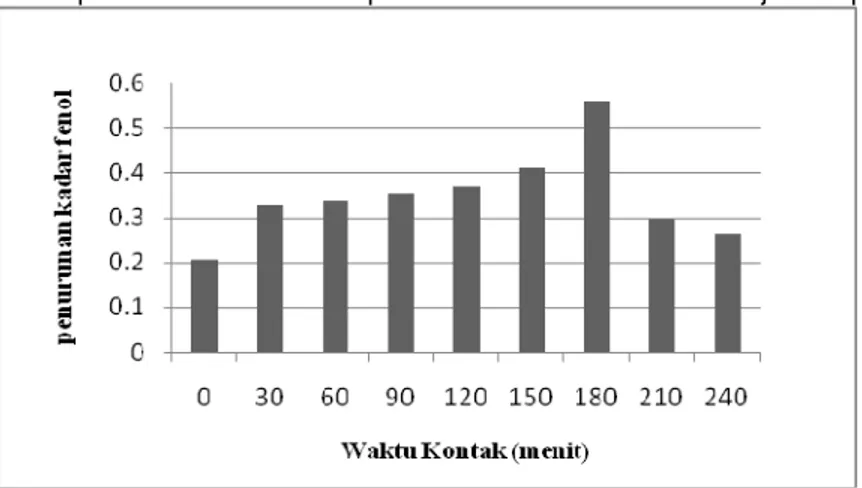
Grafik penurunan kadar fenol pada variasi waktu kontak ditunjukkan pada Gambar 4.
Gambar 4. Penurunan kadar fenol oleh enzim peroksidase dari daun mangkokan dan H2O2 pada
penentuan waktu kontak optimum
Enzim peroksidase dari daun mangkokan pada menit ke-nol telah bekerja menurunkan kadar fenol walaupun penurunan kadar fenolnya kecil, hanya sebesar 0,2083 mg/L atau 7,2758 %. Penurunan kadar fenolnya semakin meningkat setiap 30 menit dan mencapai maksimum pada menit ke-180 yaitu mencapai 0,5571 mg/L atau 19, 0039 %. Penurunan kadar fenolnya turun secara tajam pada menit ke-210 yaitu hanya 0,2967 mg/L atau 10,3222 %. Penurunan kadar fenol yang semakin menurun setelah 180 menit mungkin disebabkan kestabilan enzim yang menurun sehingga kontak enzim dengan substratnya juga menurun.
Menurut Kennedy et. al. (2002), waktu 3 jam dalam menurunkan kadar fenol dengan enzim peroksidase merupakan waktu yang cukup untuk mencapai reaksi yang sempurna. Waktu kontak untuk penurunan kadar fenol menggunakan peroksidase dari horseradish adalah sekitar 3 jam (Nicell, et. al.,2000). Penurunan kadar fenol menggunakan enzim peroksidase dari lobak memiliki waktu kontak optimum selama 3 jam (Vazquez, et. al., 2002).
KESIMPULAN DAN SARAN Kesimpulan
Persentase penurunan kadar fenol dengan enzim peroksidase dari daun mangkokan pada konsentrasi fenol optimum 150 mg/L, pH optimum 7, dan suhu optimum 25oC selama waktu kontak optimum 3 jam adalah 19,0039 %.
Saran
Perlu dilakukan pemurnian lebih lanjut terhadap enzim peroksidase dari daun mangkokan sehingga aktivitasnya lebih tinggi dalam menurunkan kadar fenol.
DAFTAR PUSTAKA
Bodalo, A., J.L. Gomez, E. Gomez, J. Batisda, and M.F. Maximo. 2006. Comparison of Commercial
Peroxidases for Removing Phenol from Water Solution.http://www.sciencedirect.com/science_ob=ArticleURL&_udi=B6V74-4H68NHS-5.
Diakses tanggal 28 November 2007.
Bollag, D. M., M.D. Rozycki, and S. S. Edelstein. 1991. Protein Method. Second Edition. Wiley Liss. New York.
Fruton, J.S. and S. Simmonds. 1963. General Biochemistry. John Wiley and Sons, Inc. New York. Kennedy, K., K. Elemany, and M. Warith. 2002. Optimisation of Soybean Peroxidase Treatment of
2,4-dichlorophenol. http://www.wrc.org.za. Diakses tanggal 1 Desember 2007.
Kinsley, C. And J.A. Nicell. 2000. Treatment of Aqueous Phenol with Soybean Peroxidase in The Presence of Polyethylene Glycol.
194 http://www.sciencedirect.com/science_ob=ArticleURL&udi=B6V24-3YRVR62-7. Diakses tanggal 28 November 2007.
Masuda, M., A. Sakurai, and M. Sakakibara. 2000. Effect of Reaction and Precipitation Using Coprinus cinereus Peroxidase. http://www.sciencedirect.com/science?_ob=ArticleURL&udi=B6TG1-42G6M8J-2. Diakses tanggal 28 November 2007.
Nicell, J. A., K. W. Saadi, and I. D. Buchanan. 2000. Phenol Polymerization and Precipitation by Horseradish Peroxidase Enzym and An Additve. http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6V24-3YYT6BS-1B. Diakses tanggal 11 Januari 2008)
Parsono, M.T. 2007. Karakterisasi Enzim Peroksidase dari Daun Pohon Mangkokan (Nothopanax scutellarium Merr.). SKRIPSI. Program Sarjana MIPA UNSOED. Purwokerto. (Tidak Dipublikasikan).
Poedjiadi, A., 2006. Dasar-Dasar Biokimia. Penerbit Universitas Indonesia. Jakarta.
Schlegel, H. G. and K. Schmidt. 1994. Mikrobiologi Umum. Edisi VI. UGM-Press. Yogyakarta.
Singh, N. and J. Singh. 2002. An Enzymatic Method for Removal of Phenols from Industrial Wastewater Using Turnip Peroxidase. http://www.informaworld.com/smpp/content=a713645668~db=all. Diakses tanggal 28 November 2007.
Sadikin, M. 2002. Teknologi Fermentasi. PAU_IPB. Bogor.
SNI 06-6989.21. 2004. Air dan Air Limbah. Bagian 21: Cara Uji Kadar Fenol Secara Spektrofotometri ICS 13.060.50. http://www.bsn.or.id/sni/sni_detail.php?sni_id=7239. Diakses tanggal 1 Desember 2007.
Vazquez, M. A. D., M. A. O. Tovar, B. E. G. Almendarez, and C. Regalado. 2002. Removal of Aqueous Phenolic Compounds From A Model System by Oxidative Polymerization with Turnip (Brassica napus L var purple top white globe) Peroxidise.
http://www3.interscience.wiley.com/cgi-bin/abstract/101525752/ABSTRACT?CRETRY=1&SRETRY=0. Diakses Tanggal 11 Januari 2008.
Zusfahair and H. Diastuti. 1998. “Ekstraksi Enzim Peroksidase dari Buah Nanas (Ananas comusus)”. Majalah Ilmiah UNSOED Nomor 4 Thn. XXIV Edisi Desember 1998. Penerbit Lembaga Penelitian UNSOED. Purwokerto.