Karya Tulis Ilmiah
Disusun oleh:
Jamaludin Al Anshori, S.Si., M.Sc.
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Padjadjaran
Karya Tulis Ilmiah
Mengetahui Bandung, April 2009
Kepala Lab. Kimia Organik Penyusun
Tati Herlina,MSi. Jamaludin Al Anshori, S.Si., M.Sc.
i
ABSTRAK
Siklisasi intramolekuler sitronelal menjadi isopulegol merupakan tahap penting dalam sintesis mentol. Beberapa jenis katalis zirkonia diuji coba pada reaksi ini. Zirkonium hidroksida dan zirkonia terfosfatisasi memiliki aktifitas dan selektifitas yang sangat baik. TPD amonia dan IR piridin menandakan adanya asam kuat Lewis bersama asam lemah Brønsted. Asam kuat lainnya seperti zirkonia tersulfatisasi, Amberlyst dan Nafion sangat aktif tetapi selektifitasnya terhadap isopulegol sangat rendah. Katalis tersebut menimbulkan reaksi samping seperti dehidrasi, cracking dan eterifikasi isopulegol. Silika dengan keasaman Lewis yang lemah menghasilkan aktifitas yang sangat rendah. Adanya keasaman Lewis dan Brønsted merupakan sifat dasar yang diperlukan pada reaksi ini. Mekanisme reaksi yang diusulkan adalah melalui proses interaksi awal molekul sitronelal terhadap asam Lewis zirkonium melalui oksigen aldehid dan elektron π pada ikatan rangkap, maka konfigurasi yang stabil akan tercapai melalui siklisasi. Protonasi aldehid melalui situs asam Brønsted tetangga mengakibatkan proses siklisasi menjadi isopulegol.
ii
ABSTRACK
The Intramolecular cyclization of citronellal toward isopulegol is an important step in the synthesis of menthol. Several zirconia-based catalysts were evaluated for this reaction. Zirconium hydroxides and phosphate zirconia had very good activity and selectivity. Ammonia TPD and pyridine IR studies indicate the presence of strong Lewis together with weak Brønsted acid sites. Other strong acids like sulfated zirconia, Amberlyst, and Nafion were very active but the selectivity toward isopulegol was poor. They catalyzed side reactions such as dehydration, cracking, and etherification of isopulegol. Silica, with only weak Lewis acidity, showed very low activity. The presence of both Lewis and Brønsted sites is therefore essential for the reaction. A reaction mechanism is proposed where the citronellal molecule binds to a zirconium Lewis acid site via the aldehyde oxygen and the π-electrons of the double bond so that the right configuration is attained for cyclization. Subsequent protonation of the aldehyde via a neighbouring Brønsted acid site initiates the cyclization to isopulegol.
Key Words: citronellal; cyclization; isopulegol; dual acid sites—Lewis and Brønsted; zirconium hydroxide; phosphated zirconia.
iii
DAFTAR ISI……….
DAFTAR GAMBAR………
DAFTAR TABEL……….
DAFTAR ISTILAH DAN SINGKATAN………
BAB I PENDAHULUAN……….
BAB II TINJAUAN UMUM………
2.1. Terpenoida………...……….……….
2.1.1. Monoterpena……….………..………..
2.2. Sitronelal dan Isopulegol……….………...
2.3. Siklisasi Sitronelal………..………
BAB III TINJAUAN KHUSUS……….
3.1. Latar Belakang……….………...
3.2. Persiapan dan Karakterisasi……….………...
3.3. Siklisasi Katalitik Sitronelal…….………..
3.4. Hasil dan Pembahasan………
3.5. Rentang Suhu………
3.6. Aktifitas Katalis………..………..
BAB IV KESIMPULAN………....
DAFTAR PUSTAKA……….
iv
Gambar 2.2 Sitronelal, Isopulegol dan Mentol………...………...
Gambar 2.3 Siklisasi dari sitronelal………...
Gambar 2.4 Adisi trans dan mekanisme siklisasi………..
Gambar 2.5 Mekanisme siklisasi sitronelal menjadi isopulegol...
Gambar 2.6 Sintesis isopulegol epoksida dari sitronelal dengan katalis Ti-MCM-41………
Gambar 3.1 Katalis Padatan Asam Lainnya………..
Gambar 3.2 Distribusi ukuran pori ZrO2-0-300 (○), ZrO2-0-500 (●)………...
Gambar 3.3 Distribusi ukuran pori ZrO2-16-300 (○), ZrO2-16-500 (●)……..
Gambar 3.4 Distribusi ukuran pori ZrO2-0-500-SO4 (□), ZrO2-0-500-PO4 (■).
Gambar 3.5 Spektra IR piridin setelah pengkondisian pada suhu 100˚C (a)ZrO2-0-300, (b) ZrO2-16-300, (c) ZrO2-0-500, (d) ZrO2
-16-500, (e) ZrO2-0-500-PO4 dan (f) ZrO2-16-500-PO4………..
Gambar 3.6 Tampilan TPD amonia dari zirkonia dan zirkonia terfosfatisasi (a) ZrO2-0-500, (b) ZrO2-0-500-PO4, (c) ZrO2-4-500 dan (d)
ZrO2-4-500-PO4………...
Gambar 3.7 Tampilan TPD amonia dari (a) silika, (b) beta zeolit dan (c) zirkonia tersulfatisasi………
Gambar 3.8 Spektra IR piridin setelah pengkondisian pada suhu 100˚C dari (a) silika, (b) beta zeolit, (c) sirkonia tersulfatisasi, (d) K10 dan (e) Clayzic……….
Gambar 3.9 Rendemen isopulegol pada katalis berbeda setelah 10 menit reaksi kecuali silika (4 jam)………..
Gambar 3.10 Mekanisme reaksi siklisasi sitronelal menjadi isopulegol dengan katalis zirkonium hidroksida………...…….
v
vi
Digestasi : Proses pembentukan partikel koloid yang lebih besar
GC-MS : Gas Chromatography-Mass Spectroscopy
1H-NMR : Proton-Nuclei Magnetic Resonance
IR : Infrared
Kalsinasi : Proses pemanasan untuk pembentukan struktur yang teratur
TPD : Temperature Programmed Desorption
XRF : X-Ray Fluorescence
XRD : X-Ray Diffraction
ZrO2-D-T : Zirkonia Hidrat dengan D adalah lama hari didigestasi dan T
1
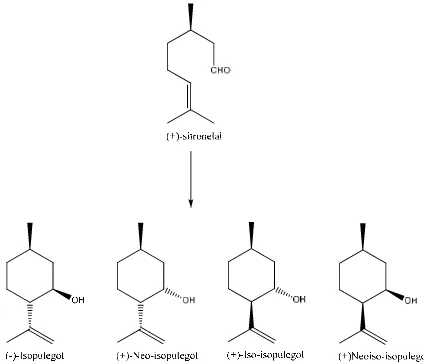
Sitronelal merupakan senyawa monoterpena yang mempunyai gugus
aldehid, ikatan rangkap dan rantai karbon yang memungkinkan mengalami reaksi
siklisasi aromatisasi (Iryanti, 2005). Isopulegol merupakan terpena alkohol,
C10H18O, yang digunakan untuk membuat komposisi wewangian (Bauer et al.,
1988). Isopulegol dibentuk dari siklisasi sitronelal, sama dengan sitronelal yang
mempunyai 2 karbon kiral yang akan membetuk pusat asimetrik produk dengan 4
stereoisomer yang berbeda (Gambar 1.1). Isopulegol merupakan tahapan yang
penting dalam membentuk mentol (C10H20O) yang memiliki harum peppermint.
Delapan optik aktif mentol, hanya mentol yang diturunkan dari hidrogenasi
(-)-isopulegol yang memiliki rasa peppermint dan juga berasa dingin. Tetapi isomer
lainnya tidak memiliki sifat menyejukan.
Beberapa katalis homogen dan heterogen yang telah diteliti memiliki
keaktifan dalam reaksi siklisasi. Katalis homogen seperti rhodium
tris(trifenilfosfin) yang diteliti oleh Sakai dan Oda (1972), sama baiknya dengan
kompleks karbonil molybdenum dan tungsten seperti
(PhCH2(Et)3N+[Mo(CO)4ClBr2]-, Mo(CO)5(OTf)2, [Mo(CO)4Br2]2,
PhCH2(Et)3N+[W(CO)4ClBr2]-, dan W(CO)5(OTf)2 yang telah diteliti sebelumnya
oleh Kočovský et al. (1999). Dengan menggunakan katalis tersebut, cis
-diastereoisomer, (+)-neoisopulegol terbentuk lebih banyak. Kelompok ligan yang
bulky dalam pergeseran hubungan kompleksnya membentuk (-)-isopulegol
menjadi (+)-neoisopulegol. Skadium triflorometanasulfonat telah diteliti Jensen et
al. (2000) merupakan katalis efisien untuk selektifitas siklisasi sitronelal menjadi
isopulegol. Reaksi dikondisikan pada di bawah suhu normal. Pada -78˚C, hasil
yang didapat >95%, sedangkan pada suhu kamar 58% hal ini disebabkan reaksi
berkaitan dari pembentukan isopulegol dengan sitronelal.
Padatan “super asam” seperti zirkonia tersulfatisasi juga diteliti sebagai
katalis reaksi siklisasi. Walaupun memiliki konversi yang tinggi sebanyak 96%,
selektifitas terhadap isopulegol hanya 46% dengan produk utama menjadi
isopulegol eter dan sitronelal. Ketika zirkonia tersulfatisasi dilapiskan pada
saringan molekul karbon selektifitas meningkat menjad 60%. Hal ini menjelaskan
bahwa pengaruh besar eklusi berbanding besar pori yang lebih kecil menghalangi
pembentukan isopulegol eter (Yadav and Nair, 1998).
Zeolit dengan besar pori yang berbeda, seperti clioptilolite, mordenite, dan
isomerisasi sitronelal. Aktifitas berkaitan dengan sisi keasaman Brønsted. Zeolit
dengan besar pori yang lebih kecil memiliki aktifitas yang kecil pula dibanding
dengan ukuran pori yang besar, yang dapat meningkatkan selektifitas terhadap
isopulegol eter.
Pengulangan dari literatur yang telah dilakukan mengindikasikan bahwa
sisi keasaman diperlukan dalam siklisasi dan zirkonium memiliki sifat katalis
yang istimewa. Sifat dari sisa keasaman berhubungan dengan keasaman Lewis
dan Brønsted. Pada penelitian penggunaan katalis zirkonia yang
bermacam-macam untuk reaksi siklisasi seperti zirkonia diketahui memiliki sisi asam Lewis
dan sebagian kecil asam Brønsted setelah dikalsinasi pada 200˚C (Nakano et al.,
1979). Sama dengan zirkonium hidroksida yang memiliki lebih banyak gugus
hidroksil dibanding zirkonia, perbandingan kedua zat tersebut menarik untuk
diteliti. Sebelumnya telah diteliti mendigestasi pengendapan zirkonium hidroksida
segar dari larutan induk mempengaruhi besar pori dan keasaman dari sampel.
Keasaman juga dapat dimodifikasi dengan memfosfatisasi atau sulfatisasi sirkonia
(Chuah et al., 2000). Pada penelitian ini, akan dibandingkan dengan menggunakan
katalis resin tersulfonasi yang komersial dipasaran, seperti Amberlyst 15 dan
Nafion SAC 13. Sebagai tambahan, beta zeolit dan montmorillonite K10 juga
dipergunakan sebagai katalis untuk mempelajari efek mikropori dan struktur pori
4 BAB II TINJAUAN UMUM 2.1. Terpenoida
Terpenoida merupakan komponen-komponen tumbuhan yang mempunyai
bau dan dapat diisolasi dari bahan nabati dengan penyulingan disebut sebagai
minyak atsiri. Sebagian besar terpenoid mempunyai kerangka karbon yang
dibangun oleh dua atau lebih unit C-5 yang disebut unit isoprena (Gambar 2.1).
Unit C-5 ini dinamakan demikian karena kerangka karbonnya sama seperti
senyawa isoprena (Lenny, 2006).
Gambar 2.1 Satuan unit terpenoid
2.1.1. Monoterpenoid
Monoterpenoid merupakan senyawa “essence” dan memiliki bau yang
spesifik yang dibangun oleh 2 unit isopren atau dengan jumlah atom karbon 10.
Lebih dari 1000 jenis senyawa monoterpenoid telah diisolasi dari tumbuhan
tingkat tinggi, binatang laut, serangga dan binatang jenis vertebrata dan struktur
senyawanya telah diketahui. Senyawa monoterpenoid banyak dimanfaatkan
sebagai antiseptik, ekspektoran, spasmolotik dan sedatif. Di samping itu
monoterpenoid yang sudah dikenal banyak dimanfaatkan sebagai bahan pemberi
aroma makan dan parfum dan ini merupakan senyawa komersial yang banyak
2.2. Sitronelal dan Isopulegol
Sitronelal merupakan senyawa monoterpena yang mempunyai gugus
aldehid, ikatan rangkap dan rantai karbon yang memungkinkan mengalami reaksi
siklisasi aromatisasi (Iryanti, 2005). Isopulegol merupakan terpena alkohol,
C10H18O, digunakan untuk membuat komposisi wewangian (Gambar 2.2) (Bauer
et al., 1988). Isopulegol dibentuk dari siklisasi sitronelal. Sama dengan sitronelal
yang mempunyai 2 karbon kiral yang akan membetuk pusat asimetrik produk
dengan 4 stereoisomer yang berbeda. Isopulegol merupakan tahapan yang penting
dalam membentuk mentol (C10H20O) yang memiliki harum peppermint. Delapan
optik aktif mentol, hanya mentol yang diturunkan dari hidrogenasi
(-)-isopulegol yang memiliki rasa peppermint dan juga berasa dingin (Gambar 2.2).
Tetapi isomer lainnya tidak memiliki sifat menyejukan.
Gambar 2.2 Sitronelal, Isopulegol dan Mentol
2.3. Siklisasi Sitronelal
Reaksi karbonil-ene adalah metode sintesis yang berguna sekali karena
pembentukan dari ikatan C-C dengan konstruksi dari 2 pusat kiral. Salah satu
studi intramolekul reaksi ini adalah siklisasi dari sitronelal. Dengan isomer utama
karena merupakan salah satu sintesis mentol. Lainnya juga, isopulegol digunakan
untuk sintesis feromon (Moreira and Corrêa, 2000).
Beberapa katalis homogen dan heterogen yang telah diteliti memiliki
keaktifan dalam reaksi siklisasi. Katalis homogen seperti rhodium
tris(trifenilfosfin) yang diteliti oleh Sakai dan Oda (1972), sama baiknya dengan
kompleks karbonil molybdenum dan tungsten seperti
(PhCH2(Et)3N+[Mo(CO)4ClBr2]-, Mo(CO)5(OTf)2, [Mo(CO)4Br2]2,
PhCH2(Et)3N+[W(CO)4ClBr2]- dan W(CO)5(OTf)2 yang telah diteliti sebelumnya
oleh Kočovský et al. (1999). Dengan menggunakan katalis tersebut, cis
-diastereoisomer, (+)-neoisopulegol terbentuk lebih banyak. Kelompok ligan yang
bulky dalam pergeseran hubungan kompleksnya membentuk (-)-isopulegol
menjadi (+)-neoisopulegol. Untuk katalis yang digunakan kembali, lebih baik
diektrak dari fasa air. Katalis asam Lewis heterogen seperti ZnCl2, ZnBr2, AlCl3,
SbCl3, SnCl4, dan TiCl4 memberikan pemisahan yang mudah dan katalis tersebut
membentuk produk utama (-)-isopulegol. Khususnya ZnBr2, memiliki efesiensi
70% dan selektifitas 94% terhadap (-)-isopulegol (Nakatani and Kamashima,
1978).
Arata dan Matsuura (1989) meneliti padatan asam tidak dipengaruhi
hidrolisis seperti Si-Al2O3, FeSO4, NiSO4, Ti(SO4)2, Zr(SO4)2 dan Al2O3 juga
memiliki selektifitas yang tinggi (>90%) dan konversi (65-91%) terhadap
isomerisasi sitronelal menjadi isopulegol. Berbeda jauh dengan CaO yang
memiliki aktifitas yang rendah, hal ini menandakan pentingnya sisi asam Lewis.
dengan katalis ini semua, lebih baik dalam jumlah perbandingan 0,34-0,42 katalis
dan sitronelal yang dipergunakan (Kroop et al., 1995).
Andrade et al. (2004) dalam penelitiannya menemukan katalis niobium
pentaklorida (NbCl5), tantalum pentaklorida (TaCl5), dan indium triklorida (InCl3)
untuk digunakan dalam reaksi siklisasi (R)-sitronelal menjadi suatu campuran
isopulegol dan neoisopulegol (Gambar 2.3). Pada suhu –40˚C dan durasi reaksi 6
jam, katalis NbCl5 merupakan katalis asam lewis yang paling aktif dengan nilai
konversi 98% serta rasio iso:neo sebesar 1:1,2 sedangkan InCl3 merupakan katalis
asam lewis paling selektif dengan nilai konversi 89% serta rasio iso:neo sebesar
4,3:1.
Aggarwal et al. (1998) telah menemukan Skandium trifluorometansulfonat
(5-10 mol%) sebagai katalis efisien untuk reaksi intermolekular karbonil-ene dan
siklisasi intramolekular sitronelal. Kondisi siklisasi sitronelal menjadi isopulegol
terbaik dilakukan pada suhu –78˚C, jumlah katalis sekitar 5-10% dalam pelarut
diklorometana selama 1-1,5 jam dapat menghasilkan produk >95% dan rasio
isomer isopulegol:isomer lainnya sebesar 94:6.
Berdasarkan hasil penelitian Jensen et al. (2000) bahwa katalis SnCl4
dalam diklorometana juga dapat digunakan untuk mensintesis (S)-sitronelal
menjadi isopulegol sebesar 85% pada T 0˚C, sedangkan Da Silva et al. (2004)
menggunakan katalis H3PW12O40/SiO2 untuk mengkonversi (+)-sitronelal menjadi
(-)-isopulegol dan (+)-neo-isopulegol sebagai produk utama hampir 100% dengan
total selektifitas antara 95-100%, 80%-nya selektif terhadap (-)-isopulegol.
a
NbCl5, TaCl5 atau InCl3
Gambar 2.3 Siklisasi dari sitronelal
Reaksi siklisasi intramolekular sitronelal bisa terjadi dengan mereaksikan
sitronelal dengan HCl, H2SO4, asam asetat anhidrida dan dengan pengaruh Al2O3
aktif bersifat asam, zeolit, bentonit maupun lempung aktif menghasilkan
isopulegol yang merupakan senyawa prekursor pembentukan mentol melalui
reaksi hidrogenasi katalitik Raney-Ni (Priatmoko, 1990).
Padatan “super asam” seperti zirkonia tersulfatisasi juga diteliti sebagai
katalis reaksi siklisasi. Walaupun memiliki konversi yang tinggi sebanyak 96%,
selektifitas terhadap isopulegol hanya 46% dengan produk utama menjadi
isopulegol eter dan sitronelal (Gambar 2.4). Ketika zirkonia tersulfatisasi
dilapiskan pada saringan molekul karbon selektifitas meningkat menjadi 60%. Hal
ini menjelaskan bahwa pengaruh besar eklusi berbanding besar pori yang lebih
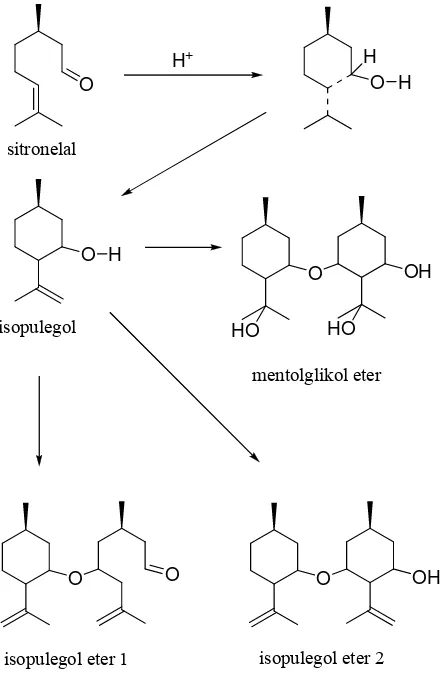
Dalam publikasinya Mäki-Arvela, et al. (2004) menyimpulkan bahwa
zeolit dan bahan-bahan mesopori sangat bagus digunakan untuk siklisasi sitronelal
menjadi isopulegol pada atmosfer nitrogen dalam pelarut sikloheksana. Produk
siklisasi tertinggi diperoleh dengan menggunakan bahan mesopori dan zeolit
cincin 12 yang memiliki keasaman Brønsted tinggi, sedangkan produk siklisasi
terendah diperoleh dengan menggunakan silika yang tidak memiliki keasaman
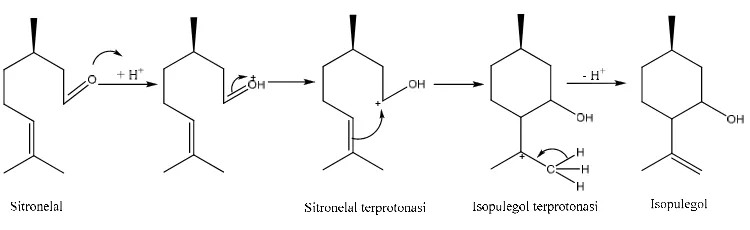
Brønsted. Pengaruh asam Brønsted ini terlihat pada skema mekanisme reaksi
siklisasi sitronelal menjadi isopulegol yang disajikan pada Gambar 2.5.
O O H
H
O H
OH O
O O
OH O
H+
isopulegol
isopulegol eter 1 isopulegol eter 2 mentolglikol eter
HO HO
sitronelal
Gambar 2.5 Mekanisme siklisasi sitronelal menjadi isopulegol
Stereoselektifitas terhadap masing-masing isomer isopulegol hanya
dipengaruhi oleh kestabilan senyawa intermediet isopulegol terprotonasi, bukan
dipengaruhi oleh tinggi rendahnya konsentrasi asam Brønsted, asam lewis dan
daerah permukaan tertentu suatu katalis.
Zeolit dengan besar pori yang berbeda, seperti clioptilolite, mordenite, dan
faujasite, telah diteliti dalam pelarut yang berbeda oleh Fuentes et al. (1989) untuk
isomerisasi sitronelal. Aktifitas berkaitan dengan sisi keasaman Brønsted. Zeolit
dengan besar pori yang lebih kecil memiliki aktifitas yang kecil pula dibanding
dengan ukuran pori yang besar, yang dapat meningkatkan selektifitas terhadap
isopulegol eter. Mengikuti reaksi fasa-gas dari sitronelal dengan isopropanol lewat
faujasite pertukar-ion telah diteliti oleh Shabtai et al. (1984). Pembentukan
isopulegol lebih banyak dihasilkan oleh besar pori yang lebih besar dalam LiX
dan NaX (diameter ionik <2Å) yang memberikan sekat yang baik untuk
membentuk cincin dari siklisasi. Jika zeolit ditukarkan dengan kation yang
meruah, seperti Ba2+, Rb+ dan Cs+ (diameter ionik 2,7-3,4Å) memiliki besar
efektifitas pori yang lebih kecil dan zat yang dikatalisis akan membentuk reduksi
(MPV). Zirkonium-penukar montmorillonite telah diteliti sebagai katalis reaksi
siklisasi dengan stereoselektifitas 90% terhadap (-)-isopulegol dengan sedikit
kandungan (+)-neoisopulegol selama 24 jam dalam pelarut asetonitril pada 80˚C
dengan hasil 91% (Tateiwa et al., 1997).
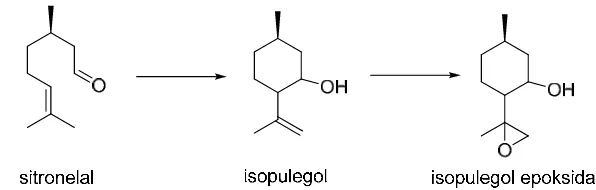
Guidotti et al. (2000) dalam publikasinya menyatakan telah berhasil
menkonversi sitronelal menjadi isopulegol epoksida menggunakan katalis
titanium silikat mesoporus (Ti-MCM-41) dalam satu rangkaian proses sekaligus
dengan rendemen 68%. Dalam tahapan siklisasi sitronelal menjadi isopulegol
yang memakan waktu 6 jam digunakan toluena sebagai pelarut, kemudian
ditambahkan tert-butilhidroksiperoksida (TBHP) dan asetonitril untuk
menkonversi isopulegol menjadi isopulegol epoksida selama 18 jam sebesar 76%
dan selektivitas 90% (Gambar 2.6).
Gambar 2.6 Sintesis isopulegol epoksida dari sitronelal dengan katalis Ti-MCM-41
Setelah ditemukannya katalis asimetris tris(2,6-diarilfeniloksi)aluminium
oleh Iwata et al. (2002) atas nama perusahaan Takasago, konversi siklisasi
(+)-sitronelal menjadi (-)-isopulegol bisa mencapai 95% dengan stereoselektifitas
hampir 100%. Sebelumnya digunakan katalis ZrBr2 yang dapat menkonversi
(+)-sitronelal menjadi (-)-isopulegol secara kuantitatif dengan kapasitas produksi per
Iosif, et al. (2004) berhasil menkonversi sitronelal menjadi mentol
menggunakan katalis bifungsional Ir/H-Beta zeolit. Ir/H-Beta merupakan katalis
heterogen yang paling aktif dan selektif untuk satu langkah sintesis mentol dari
sitronelal. Dengan mereaksikan sitronelal dengan katalis 3% Ir/H-Beta dalam
atmosfir nitrogen selama 4 jam, kemudian dialirkan hidrogen dapat menghasilkan
produk dengan selektivitas 95% terhadap isomer mentol, 75%-nya adalah
(-)-mentol, dimana rasio isomernya (mentol:neomentol:isomentol) adalah 75:20:5.
Jika logamnya diganti, 3% Ru/H-Beta dapat menghasilkan 70% sitronelol, 3%
Pd/H-Beta dapat menghasilkan 69% 3,7-dimetiloktanal, 3% Pt/H-Beta dapat
menghasilkan 56% mentol dan 3% Rh/H-Beta dapat menghasilkan 55% mentol.
Yuntong et al. (2007) telah berhasil mensintesis mentol dari sitronelal
dengan menggunakan katalis bifungsional Ni/Zr-Beta dan Zr-beta/Ni-MCM-41,
dimana diastereoselektifitasnya mencapai 90-94% terhadap (±)-mentol dengan
rendemen mentol total 86-97%. Pembentukan mentol paling efektif dilakukan
dengan menggunakan katalis Ni 3-5% (b/b) terimfregnasi dalam Zr-beta, dua jam
pertama sitronelal dikonversi menjadi isopulegol. Konversi semakin menurun
seiring dengan semakin besarnya konsentrasi nikel, dari 96% untuk 3% Ni/Zr-beta
menjadi 44% untuk 15% Ni/Zr-beta. Penurunan aktivitas ini disebabkan oleh
tertutupnya sebagian pusat aktif Zr oleh Ni yang terimfregnasi. Sebaliknya
kecepatan hidrogenasi isopulegol menjadi mentol semakin meningkat dengan
semakin tingginya konsentrasi Ni terimfregnasi. Selektivitas maksimal terhadap
menghasilkan produk hidrogenasi yang sangat rendah dan sebaliknya jika berkisar
antara 5-15% meningkatkan pembentukan sitronelol dan 3,7-dimetiloktanol.
14
BAB III
TINJAUAN KHUSUS
3.1. Latar Belakang
Sifat dari sisa keasaman berhubungan dengan keasaman Lewis dan
Brønsted. Pada penelitian penggunaan katalis zirkonia yang bermacam-macam
untuk reaksi siklisasi seperti zirkonia diketahui memiliki sisi asam Lewis dan
sebagian kecil asam Brønsted setelah dikalsinasi pada 200˚C (Nakano et al.,
1979). Sama dengan zirkonium hidroksida yang memiliki lebih banyak gugus
hidroksil dibanding zirkonia, perbandingan kedua zat tersebut menarik untuk
diteliti. Sebelumnya telah diteliti mendigestasi pengendapan zirkonium hidroksida
segar dari larutan induk mempengaruhi besar pori dan keasaman dari sampel.
Keasaman juga dapat dimodifikasi dengan memfosfatisasi atau sulfatisasi sirkonia
(Chuah et al., 2000). Pada penelitian ini, akan dibandingkan dengan dengan
katalis resin tersulfonasi yang komersial di pasaran, seperti Amberlyst 15 dan
Nafion SAC 13. Sebagai tambahan, beta zeolit dan montmorillonite K10 juga
dipergunakan sebagai katalis untuk mempelajari efek mikropori dan struktur pori
Amberlyst Nafion
Silika Gel
Montmorillonite Beta Zeolit (Robson,
Gambar 3.1 Padatan Asam Lainnya
3.2. Persiapan dan Karakterisasi
Zirkonia hidrat dipersiapkan dengan cara mengendapkan larutan
zirkonium klorida 10% dengan amoniak 5M (ca. 50% berlebih) (Chuah et al.,
1998). Sebagian endapan diambil dan dicuci dengan amonium nitrat sampai
bebas klorida, selanjutnnya dicuci dengan akuades dan dikeringkan pada 100˚C.
Sisa dari bahan sebelumnya direfluks pada 100˚C selama 4 dan 16 hari. Kemudian
masing-masing sampel, disaring, dicuci, dikeringkan dan dikalsinasi pada 300˚C
dan 500˚C selama 12 jam. Sampel-sampel ini diberi label ZrO2-D-T dimana D
adalah lama hari didigestasi dan T adalah suhu kalsinasi.
Zirkonia fosfat dipersiapkan berdasarkan penelitian Spielbauer et al.
(1997). Zirkonia hidrat didigestasi selama 4 dan 16 hari dicuci sampai bebas
klorida dan dikeringkan pada 100˚C, kemudian disuspensikan dalam larutan
(NH4)2HPO4 (8%wt) selama 1 jam dengan pengadukan konstan. Kemudian
kandungan air diuapkan dan dikalsinasi pada 500˚C. Beberapa zirkonia tanpa
didigestasi pada 500˚C diperlakukan sama dengan prosedur penempelan gugus
fosfat. Zirkonia sulfat dibuat dengan cara merendam zirkonia hidrat kering dalam
H2SO4 0,25 N selama 1 jam pada suhu kamar menggunakan 5 ml per gram
padatan. Padatan yang dihasilkan disaring dan dikeringkan pada 100˚C. kemudian
dikalsinasi pada 500˚C selama 12 jam. Kandungan fosfor dan sulfur ditentukan
dengan ICP-AES dan XRF. Beta zeolit dipersiapkan berdasarkan penelitian
Robson (1998). Setelah zeolit dikalsinasi pada 550˚C, dilakukan proses
dilakukan kalsinasi pada 500˚C untuk mendapatkan bentuk-H. Silika gel 60
(Merck), Ambelyst 15 (Fluka), Nafion SAC-13 (Aldrich), Montmorillonite K10
(Fluka) dan Clayzik (seng klorida dalam montmorillonite) digunakan sebagai
penerima.
Luas permukaan, distribusi ukuran pori dan volume pori ditentukan
dengan adsorpsi nitrogen dengan menggunakan Quantrachrome NOVA 2000.
Fase serbuk kristalin dari sampel ditentukan dengan XRD menggunakan Siemens
D5005 difraktometer (Cu anoda dalam 40 kV dan 40 mA).
Temperature-programed desorption amonia digunakan untuk menentukan keasaman suatu
sampel. Sebanyak 0,2 gram sampel ditempatkan dalam reaktor kuarsa dan
dipersiapkan dalam helium pada 600˚C selama 2 jam sebelum didinginkan pada
suhu kamar. Amonia dimasukkan dengan helium sebelum TPD diukur.
Pemanasan diatur 20˚C min-1 dipergunakan untuk melepaskan amonia. Pelepasan
gas-gas dianalisa dengan menggunakan quadropole spekroskopi massa (Hiden
HAL 201) parallel terhadap reaktor dengan perbedaan antar-muka tekanan yang
berbeda. Sifat situs keasaman diidentifikasi dengan Spektroskopi Inframerah
pengadsorpsian piridin pada sampel (Chuah et al., 1999). Sampel tipis dihitung
dalam taksiran sel Pyrex IR dengan sel NaCl. Spektroskopi Bruker Equnox 55
digunakan dengan resolusi 2 cm-1. Sampel divakum dalam 300˚C selama 2 jam
sebelum didinginkan pada suhu kamar dan dikenai piridin pada 22 mbar. Piridin
berlebih dipompa keluar dan sampel divakum sampai 10-3 mbar selama 30 menit
di dalam kondisi vakum selama 30 menit dan didinginkan pada suhu kamar
sebelum diukur dengan inframerah dan sampel lainnya diukur pada 200˚C.
3.3. Siklisasi Katalitik dari Sitronelal
Campuran rasemat sitronelal (sigma) digunakan sebagai prekursor yang
mengandung 87% (±)-sitronelal dengan 13% isopulegol. Campuran reaksi
mengandung 2,0 gram sitronelal (13 mmol), 15 ml toluena dan 1 ml nitrobenzena
(internal standar) ditempatkan dalam labu dasar bulat dengan sekat, kondensor
refluks dan penutup. Dalam campuran ini, 100 mg katalis kering (150˚C,
didiamkan semalam) dimasukkan. Reaksi siklisasi dilakukan pada suhu 110˚C
pada kondisi udara bebas dengan pengadukan. Sampel diambil berdasarkan
perbedaan waktu reaksi dan produk dianalisis dengan kromatografi gas
(HP-Inowax PEG kolom kapiler (0,25 mm, 30 m). konversi dari sitronelal dikoreksi
oleh isopulegol yang terkandung sebelumnya. Perbedaan isomer diidentifikasi
dengan GC-MS (Shimadu) dan 1H-NMR menggunakan spektrofotometer Bruker
AMX500 (500MHz). Sebagai pembanding, R-(+)-sitronelal (Aldrich) disiklisasi
dengan menggunakan katalis zirkonia. Dengan menggunakan NMR kiral
pergeseran pelarut, eouropium tris
{3-(hepta-floropropilhidroksimetilena-(+)-kamporat}, membuktikan adanya stereokimia pada karbon pada posisi 3 yang
tidak dipengaruhi oleh reaksi.
3.4. Hasil dan Pembahasan
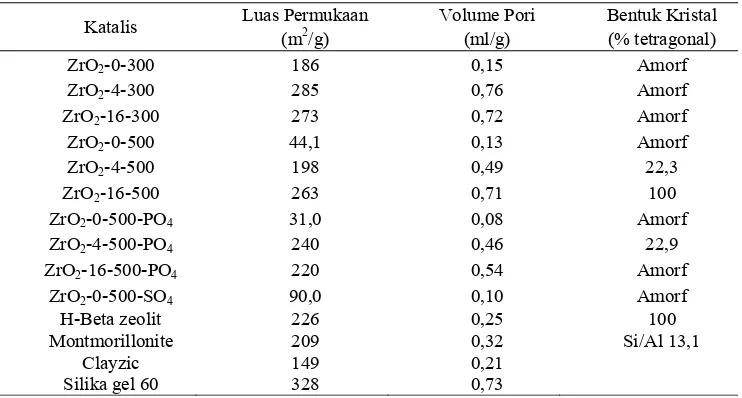
Zirkonium hidroksida yang dikeringkan pada 300˚C memiliki luas
permukaan 186 sampai 285 m2/g (Tabel 3.1). Luas permukaan dan porositas dari
Kenaikan porositas ditandai oleh pembentukan jaringan pori akibat oksolasi antara
gugus hidroksil zirkonium hidroksida (Chuah et al., 2000). Dehidrasi gugus
hidroksida pada 500˚C menghasilkan pembentukan zirkonia. Luas permukaan
ZrO2-0-500 sangat rendah yaitu 44,1 m2/g jika dibandingkan terhadap luas
permukaan zirkonia yang didigestasi selama 4 dan 16 hari sebesar 198 dan 265
m2/g. Tingginya luas permukaan zirkonia yang didigestasi dapat diakibatkan 2
pengaruh. Selama digestasi hidroksida pada pH 9, beberapa silika dari alat gelas
larut dan masuk ke dalam sampel. Zirkonia yang dibentuk setelah 4 hari digestasi
mengandung 0,4% silika sedangkan sampel 16 hari memiliki 3,5% silika
(dianalisis degan XRF). Pengendapan silika dengan cara ini mempengaruhi
kestabilan luas permukaan zirkonia yang diperoleh. Digestasi hidroksida juga
bertujuan untuk menghilangkan situs permukaan yang rusak, yang bertanggung
jawab terhadap proses penggumpalan selama kalsinasi. Hal ini akan menghasilkan
luas permukaan zirkonia yang lebih baik.
Tabel 3.1 Sifat-sifat bentuk permukaan katalis
Katalis Luas Permukaan Volume Pori Bentuk Kristal
(m2/g) (ml/g) (% tetragonal)
ZrO2-0-300 186 0,15 Amorf
ZrO2-4-300 285 0,76 Amorf
ZrO2-16-300 273 0,72 Amorf
ZrO2-0-500 44,1 0,13 Amorf
ZrO2-4-500 198 0,49 22,3
ZrO2-16-500 263 0,71 100
ZrO2-0-500-PO4 31,0 0,08 Amorf
ZrO2-4-500-PO4 240 0,46 22,9
ZrO2-16-500-PO4 220 0,54 Amorf
ZrO2-0-500-SO4 90,0 0,10 Amorf
H-Beta zeolit 226 0,25 100
Montmorillonite 209 0,32 Si/Al 13,1 Clayzic 149 0,21
Semua bentuk zirkonium hidroksida hasil analisa sinar-x adalah amorf,
untuk semua yang dipanaskan sampai 300˚C. Tetapi setelah dipanaskan sampai
500˚C, mayoritas zirkonia yang diperoleh membentuk kristal. Zirkonia yang
dibentuk dari pengendapan langsung hidroksida, ZrO2-0-500, menghasilkan
campuran bentuk monoklinik dan tetragonal (77%:23%). Rata-rata ukuran kristal
adalah 110Å. Zirkonia yang dibentuk dari hasil digestasi hidroksida selama 4 dan
16 hari berturut-turut menghasilkan 100% tetragonal dan amorf. Ukuran kristal
pada ZrO2-4-500 adalah 48Å, lebih kecil dibanding zirkonia yang tidak
didigestasi.
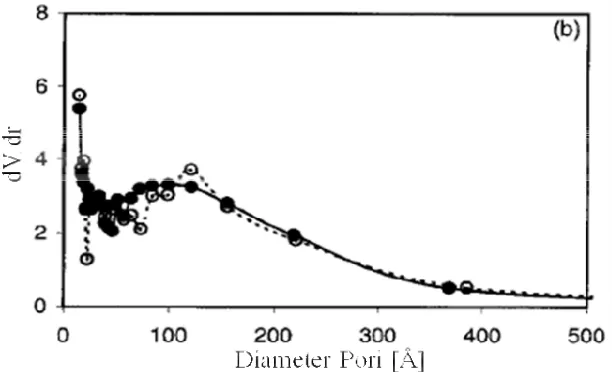
Dari hasil adsorpsi isotermis nitrogen, distribusi ukuran pori
diperhitungkan dengan metode Barret, Joyner dan Halenda. Pada ZrO2-0-300,
ukuran pori menjadi lebih besar dari mikropori menjadi 50Å (Gambar 3.2).
Gambar 3.3 Distribusi ukuran pori ZrO2-16-300 (○), ZrO2-16-500 (●)
Setelah dikalsinasi untuk membentuk zirkonia, pori yang lebih kecil hilang
meninggalkan yang berukuran 40-150Å dengan rata-rata ukuran pori sekitar 90Å.
Volume pori berkurang dari 0,15 menjadi 0,13 ml/g setelah membentuk zirkonia.
Hiroksida yang didigestasi, ZrO2-4-300 dan ZrO2-16-300, lebih baik karena
mampu mempertahankan struktur porinya, walaupun setelah kalsinasi sampai
500˚C mikropori masih ada dalam sampel ini (Gambar 3.3).
Luas permukaan hidroksida pada zirkonium hidroksida terfosfatisasi
sebelum kalsinasi sangat tinggi. Kedua zirkonia fofat 4 dan 16 hari, ZrO2
-4-500-PO4 dan ZrO2-16 -500-PO4, masing-masing memiliki luas permukaan lebih dari
200 m2/g dan volume pori 0,46 dan 0,54 ml/g. Sebaliknya ZrO2-0-PO4-500, yang
difosfatisasi setelah dikalsinasi menjadi, memiliki luas permukaan dan volume
yang sama dengan bahan pendukung murninya. Distribusi ukuran pori ZrO2-0-500
juga tidak berubah, dari hasil tersebut adanya gugus fosfat tidak menyebabkan
Gambar 3.4 Distribusi ukuran pori ZrO2-0-500-SO4 (□), ZrO2-0-500-PO4 (■)
Zirkonia tersulfatisasi dapat dibentuk dari zirkonium hidroksida yang tidak
didigestasi yang dilanjutkan kalsinasi yaitu ZrO2-0-SO4-500. Keberadaan setelah
dikalsinasi sulfat menghasilkan luas permukaan yang tinggi sebesar 90 m2/g,
dibandingkan terhadap luas permukaan oksida yang tidak tersulfatisasi sebesar
44,1 m2/g. Volume porinya 0,10 ml/g sama dengan ZrO2-0-500. Tetapi, distribusi
ukuran pori menunjukan bahwa pori kecil sangat dominan dalam sampel setelah
dikalsinasi dibandingkan dengan ukuran pori pada ZrO2-0-500. Pori pada zirkonia
tersulfatisasi memiliki diameter pori rata-rata 45 Å.
Keasaman sampel dibandingkan dengan menggunakan
Temperature-Programed desorbtion amonia (TPD). Pengukuran TPD tidak dilakukan pada
sampel ini karena desorpsi amonia hanya akan tercapai sempurna jika mencapai
suhu 500˚C, suhu ini lebih tinggi dibanding dengan suhu yang digunakan untuk
spektroskopi inframerah piridin (Gambar 3.5). Zirkonium hidroksida yang tidak
didigestasi, ZrO2-0-300, menunjukan adanya asam lewis. Bilangan gelombang
antara 1434-1456, 1480-1498 dan 1560-1632 cm-1 menunjukkan adanya ikatan
hidrogen dan ikatan koordinasi dengan piridin (Parry, 1963). Setelah digestasi,
terlihat adanya kenaikan keasaman, ditandai sedikit pergeseran bilangan
gelombang ke arah bilangan gelombang lebih tinggi dan kenaikan absorbansi pada
1490 cm-1, selain itu serapan lemah di 1540 cm-1, menandakan adanya keasaman
Brønsted, pada sampel yang didigestasi. Sifat sisi keasaman tidak dipengaruhi
oleh kalsinasi zirkonia. Kenaikan keasaman dari sampel yang didigestasi juga
terlihat dari TPD amonia (Gambar 3.6). Zirkonia yang tidak didigestasi
memperlihatkan penyerapan yang melebar pada 50-500˚C. penyerapan zirkonia
yang didigestasi hampir sama, tapi suhunya bergeser 20-30˚C lebih tinggi.
Kenaikan keasaman dari sampel yang didigestasi mungkin dapat dijelaskan oleh
adanya silika. Menurut Tanabe et al. (1974) keasaman dihasilkan dari oksida biner
dan juga ketidakseimbangan muatan ketika komponen oksida kecil mengadopsi
matriks oksida (mayor). Berdasarkan model ini, pemasukan silika ke dalam
zirkonia meningkatkan situs asam Lewis. Adanya keasaman Brønsted pada
sampel yang didigestasi mungkin disebabkan oleh keasaman gugus –OH yang
berdampingan dengan ujung ion zirkonium yang tidak berikatan (Chuah et al.,
Gambar 3.5 Spektra IR piridin setelah pengkondisian pada suhu 100˚C (a)ZrO2-0-300, (b) ZrO2-16-300, (c) ZrO2-0-500, (d) ZrO2
-16-500, (e) ZrO2-0-500-PO4 dan (f) ZrO2-16-500-PO4
3.5. Rentang Suhu
Pelepasan amonia dari zirkonia terfosfatisasi, ZrO2-0-500-PO4, lebih
sempit daripada zirkonia yang tidak terfosfatisasi, dengan pelepasan utama pada
100 sampai 450˚C (Gambar 3.6). Oleh karena itu, kedua situs asam lemah dan
kuat hilang ketika proses fosfatisasi dan situs intermediet asam baru akan
terbentuk. Spektroskopi inframerah piridin yang teradsorpsi membuktikan bahwa
adanya serapan pada gelombang 1490 dan 1540 cm-1 disamping serapan
Gambar 3.6 Tampilan TPD amonia dari zirkonia dan zirkonia terfosfatisasi (a) ZrO2-0-500, (b) ZrO2-0-500-PO4, (c) ZrO2-4-500 dan (d) ZrO2
-4-500-PO4
Kedua serapan ini dapat dianggap mewakili situs asam Lewis dan
Brønsted. Spektra inframerah piridin dari zirkonia terfosfatisasi terbentuk oleh
fosfatisasi awal zirkonium hidroksida, yang diikuti dengan kalsinasi, juga
menunjukkan adanya situs asam Lewis dan Brønsted. Gugus hidroksi atau oksida
yang telah ditempeli gugus fosfat, memiliki kekuatan asam yang cukup kuat
(Boyse & Ko, 1996). Spielbauer et al. (1997) telah meneliti zirkonia fosfat
termodifikasi yang dapat meningkatkan protonasi asam lewat sifat zirkonia. Hal
ini ditandai oleh adanya gugus P-OH. Sebagai tambahan, koordinasi pusat
zirkonia tak jenuh dapat memperkuat asam Lewis dibandingkan dengan zirkonia
fosfat bebas. Fosfat dipercaya mengikat permukaan lewat (i) bentuk jembatan
ganda dimana 2 oksigen berikatan dengan 2 ion zirkonium. Dan (ii) bentuk khelat
Sifat asam kuat dari zirkonia tersulfatisasi ditunjukkan pada spectra TPD,
yang terjadi pada rentang suhu 100 sampai 600˚C (Gambar 3.7).
Gambar 3.7 Tampilan TPD amonia dari (a) silika, (b) beta zeolit dan (c) zirkonia tersulfatisasi
Jika kekuatan asam beta zeolit dan silika dibandingkan terhadap zirkonia
tersulfatisasi maka nilainya lebih kecil. Puncak maksimum pelepasan amonia
bergeser ke arah suhu lebih rendah pada sampel ini. Spielbauer et al. (1996) telah
melakukan pengamatan menggunakan spektroskopi FT-IR dengan karbon
monoksida sebagai molekul pengisinya yang dapat membuktikan zirkonia
tersulfatisasi memiliki keasaman Lewis dan Brønsted yang tinggi. Spektroskopi
IR piridin membuktikan adanya situs asam Lewis dan Brønsted sangat kuat pada
beta zeolit, K10, dan Clayzic sedangkan silika hanya memiliki asam Lewis yang
Gambar 3.8 Spektra IR piridin setelah pengkondisian pada suhu 100˚C dari (a) silika, (b) beta zeolit, (c) sirkonia tersulfatisasi, (d) K10 dan (e) Clayzic
3.6. Aktifitas Katalis
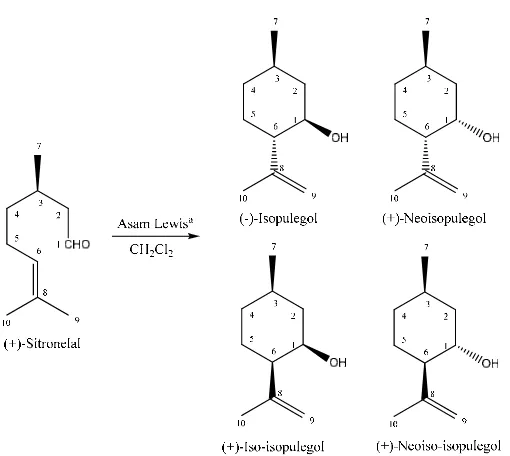
Tabel 2 membandingkan konversi sitronelal dan selektifitas pembentukan
isopulegol dengan menggunakan sampel yang bervariasi setelah 1 jam reaksi.
Kesetimbangan massa terdiri dari 1% reaksi. Perbedaan diastereomer
diidentifikasi dengan menggunakan 1H-NMR. Semua katalis zirkonia memberikan
(±)- isopulegol sebagai produk utama, diikuti dengan (±)-neo-isopulegol,
(±)-iso-isopulegol dan (±)-neoiso-(±)-iso-isopulegol dengan rasio 72:22:5:0,4, setelah
menghitung isopulegol dari bahan awal sitronelal. Dengan (+)-sitronelal sebagai
reaktan, akan menghasilkan produk yang sama. Analisis NMR membuktikan
bahwa (-)-isopulegol merupakan isomer utama, walaupun (+)-iso-isopulegol juga
Perbandingan (-)-isopulegol : isopulegol : (+)-iso-isopulegol :
(+)-neo-isopulegol adalah 68:14:17:1. Produk lainnya adalah hasil isomerisasi, sebagai
produk sampingnya pada beberapa kasus isopulegol eter dapat diidentifikasi.
Produk ini terbentuk dari hasil dehidrasi 2 molekul isopulegol (Fuentes et al.,
1989). Konversi sitronelal menjadi isopulegol dengan zirkonium hidroksida yang
tidak didigestasi, ZrO2-0-300, hanya mencapai 11% setelah 1 jam. Hal sebaliknya
terjadi pada zirkonium hidroksida yang didigestasi 4 dan 16 hari, yang sangat aktif
dengan konversi mencapai 92-94%. Lebih jauh lagi selektifitas zirkonium
hidroksida sangat tinggi, 94-98%, dengan hanya sedikit bagian fraksi yang
mengalami dimerisasi menjadi eter. Zirkonia hasil dari kalsinasi hidroksida yang
tidak didigestasi dan yang didigestasi 4-hari kurang aktif. Bagaimanapun juga,
zirkonia hidroksida yang tidak didigestasi 16 hari, ZrO2-16-500, tetap memiliki
aktifitas dan selektifitas hidroksida yang tinggi, dengan 93% sitronelal
berisomerisasi setelah 1 jam. Hal ini dikarenakan oleh sifat mikropori sampel dan
adanya kombinasi keasaman Lewis dan Brønsted.
Bergabungnya ion fosfat pada zirkonia dapat merubah sifat keasamannya.
Setelah ZrO2-0-300 yang tidak aktif difosfatisasi, tentu saja akan menghasilkan
bahan katalis ZrO2-0-300-PO4, yang aktif untuk reaksi siklisasi, walaupun luas
permukaannya kecil dan tidak memiliki mikropori (Tabel 2.2).
Hal ini membuktikan bahwa mikropori tidak penting untuk siklisasi, akan
tetapi sifat keasaman sampel lebih penting. Pada permukaan zirkonia fosfat, situs
asam lewis kuat juga hadir dengan asam Brønsted. Zirkonia terfosfatisasi dibuat
akan meningkatkan keaktifan dalam pembentukan isopulegol. Setelah 1 jam
reaksi, konversi dari tiga sampel zirkonia fosfat melebihi 95%. Pada katalis yang
digunakan terdapat 0,9% residu organik yang dianalisis dengan termogravimetri.
Tabel 3.2 Aktifitas dan selektifitas katalis terhadap pembentukan isopulegol dalam 1 jam reaksi dalam toluena
Katalis Konversi (%) Selektifitas (%)
ZrO2-0-300 11 94
ZrO2-4-300 92 977
ZrO2-16-300 94 98
ZrO2-0-500 0 0
ZrO2-4-500 7 85
ZrO2-16-500 93 99
ZrO2-0-500-PO4 97 98
ZrO2-4-500-PO4 95 99
ZrO2-16-500-PO4 99 99
ZrO2-0-500-SO4 97 52
H-Beta zeolit 95 84
Montmorillonite 98 19
Clayzic 60 76
Silika gel 60 5 84
Beta zeolit memiliki keaktifan dan selektifitas yang tinggi (84%) untuk
siklisasi sitronelal. Produk sampingnya antara lain dimerisasi menjadi isopulegol
eter, dehidrasi dan cracking. Dari hasil TPD amonia memperlihatkan bahwa
sampel ini keasamannya cenderung lebih rendah dibandingkan dengan zirkonia
tersulfatisasi. Beta zeolit memiliki sistem ikatan silang tiga dimensi yang
memiliki dua sistem ikatan yang saling tegak lurus dengan bagian menyilang 0,76
x 0,64 nm dan yang ketiga 0,55 x 0,55 nm. Mikropori mencegah terjadinya
dimerisasi menjadi isopulegol eter. Hasil analisis NMR mengidentifikasi adanya
isomer (±)-isopulegol:(±)-neo-isopulegol:(±)-iso-isopulegol:(±)-neoiso-isopulegol
yang menunjukkan bahwa ukuran pori hanya mempengaruhi sedikit terhadap
selektifitas isomer yang berbeda.
Zirkonia tersulfatisasi merupakan padatan super asam. Katalis ini
digunakan untuk menentukan bila asam kuat khususnya asam Brønsted lebih
disukai untuk reaksi ini. walaupun konversi 100% dapat dicapai dalam 10 menit,
selektifitas terhadap isopulegol hanya 61%, beberapa produk isopulegol telah
terbentuk dehidrasi (C10H16). Selain itu juga, terjadi eterifikasi isopulegol menjadi
macam-macam isomer eter isopulegol, bersama-sama dengan produk dehidrasi
dan cracking dari eter. Produk ini adalah rangkaian hirokarbon dengan komposisi
C11H22-C15H24. Reaksi ini di katalisis asam kuat yang ada pada zirkonia
tersulfatisasi. Produk meningkat dengan berjalannya waktu akan tetapi selektifitas
isopulegol menurun masing-masing menjadi 52 dan 25% setelah 1 dan 4 jam.
Sama dengan dua katalis resin tersulfonasi, Nafion SAC-13 dan Amberlyst 15,
masing-masing memberikan hasil isopulegol 39 dan 8% setelah 10 menit reaksi
(Gambar 3.9).
Montmorillonite K10 sangat aktif dengan konversi 94% dalam 10 menit.
Tetapi, selektifitas isopulegol hanya 35% dan menurun menjadi 19% setelah 1
jam. sama dengan zirkonia tersulfatisasi dan asam kuat lainnya, selektifitas yang
rendah juga diakibatkan oleh reaksi yang bersaing seperti dehidrasi dan
pembentulan isopulegol eter. Hasil ini dibandingkan dengan Tateiwa et al. (1997)
yang menghasilkan 41% produk siklisasi dalam acetonitril pada 80˚C setelah 24
jam ketika pendukung K10 digunakan. Montomorillonite K10 merupakan
perbandingan 1:2 (Aldridge et al., 1973). Fungsi katalis adalah sebagai asam
Brønsted karena berikatan koordinasi dengan molekul air terhadap setiap kation
pada antar-muka dan sebagai asam Lewis dimana situs asamnya adalah atom
aluminium pada stuktur lempung. Jarak antar molekul K10 cukup luas untuk 2
molekul isopulegol mengalami dimerisasi menjadi eter, hal ini sama dengan kasus
pada bahan mesopori lainnya seperti zirkonium tersulfatisasi.
Gambar 3.9 Rendemen isopulegol pada katalis berbeda setelah 10 menit reaksi kecuali silika (4 jam)
Ketika ZnCl2 diembankan pada K10 (Clayzic), diperoleh selektifitas 76%
terhadap isopulegol dibandingkan dengan K10 walaupun aktivitasnya hanya 60%
setelah 1 jam reaksi. Ketika ZnCl2 diembankan pada lempung, sebagian asam
Silika gel memiliki aktifitas yang rendah untuk siklisasi sitronelal dengan
konversi 5% setelah 1 jam. Hal ini disebabkan oleh tingkat keasaman yang rendah
seperti terlihat dari hasil TPD amonia. Hal ini juga diperlihatkan pada hasil
inframerah piridin, hanya memiliki asam lewis yang lemah.
Siklisasi sitronelal pada zeolit sering dipergunakan untuk memprotonasi
gugus karbonil pada sitronelal oleh bagian asamnya, diikuti oleh penanta-ulangan
intramolekular untuk membentuk karbokation yang lebih stabil dan akhirnya
terjadi deprotonasi membentuk isopulegol. Fuentes et al. (1989) meneliti laju
reaksi yang cepat dan selektifitas tinggi untuk sintesis isopulegol dengan
menggunakan pelarut kloroform. Berdasarkan penelitian tersebut, diusulkan reaksi
dalam kondisi melalui karbokation pada bagian luar zeolit. Ravasio et al. (1997)
menggunakan campuran oksida seperti titania, zirkonia dan
silika-alumina untuk meningkatkan stereoselektifitas produk suatu reaksi siklisasi ketika
adanya asam lewis kuat. Hal yang berbeda ditemukan oleh Fuentes et al.(1989),
tidak ada peningkatan laju reaksi ketika menggunakan kloroform sebagai
pengganti toluena, sebab hal tersebut menghambat pembentukan karbokation.
walaupun sifat situs katalis tidak jelas, peneliti menganjurkan bahwa
kemungkinan mekanisme katalisis sesuai dengan penghambatan kuat ketika
dioksana digunakan sebagai pelarut. Dalam penelitian ini, diteliti sampel yang
memiliki asam Lewis kuat dan asam Brønsted lemah yang menunjukan aktivitas
dan selektifitas yang bagus untuk reaksi siklisasi sitonelal menjadi isopulegol.
Berdasarkan hasil katalisis dan FT-IR piridin, mekanisme reaksinya dapat
Sitronelal akan berkoordiansi dengan ion zirkonium karena memiliki atom
oksigen pada aldehid dan ikatan rangkap yang kaya akan elektron (Gambar 3.10).
Hal ini akan membentuk sitronelal pada keadaan yang lebih stabil yaitu
membentuk cincin tertutup melalui reaksi karbonil-ene (C-C). Pada keadaan
transisi, oksigen akan terprotonasi oleh gugus hidroksil Brønsted bersama dengan
lepasnya hidrogen dari gugus isopropil diikuti oleh menutupnya cincin
membentuk isopulegol. Permukaan zirkonium hidroksida, zirkonia yang
didigestasi dan zirkonia terfosfatisasi mengandung sisi aktif yang baik untuk
siklisasi. Zirkonia yang tidak didigestasi kurang memiliki situs asam Brønsted,
sementara itu situs asam Lewis pada silika lemah, sehingga keduanya merupakan
sampel yang tidak aktif untuk reaksi siklisasi. Keasaman dari beta zeolit dengan
perbandingan Si/Al 13, cocok untuk reaksi siklisasi tanpa dihasilkan produk
samping akibat reaksi yang dikatalisis oleh asam kuat seperti dehidrasi dan
eterifikasi. Katalis asam kuat seperti zirkonia tersulfatisasi, Ambelist atau Nafion
tidak hanya menghasilkan produk siklisasi tetapi juga menghasilkan produk
eterifikasi dan cracking.
Gambar 3.10 Mekanisme reaksi siklisasi sitronelal menjadi isopulegol dengan
34
BAB IV
KESIMPULAN
35
Carbonyl-Ene Reaction and the Intramolecular Cyclisation of Citronellal.
Tetrahedron Lett,
39
, 1997-2000.
Ali, A. A. M., and Zaki, M. I. 1998.
Colloids Surf. A.
139
, 81.
Andrade, C.K.Z., Vercillo, O.E., Rodrigues, J.P. & Silveira, D.P. 2004.
Intramolecular Ene Reactions Catalyzed by NbCl
5, TaCl
5and InCl
3.
J. Braz.
Chem. Soc
.
813-817
V. 15 No. 6.
Arata, K., and Matsuura, C. 1989.
Chem. Lett.
1797.
Aldridge, L. P., McLaughlin, J. R., and Pope, C. G. 1973.
J. Catal.
30
, 409.
Bauer, K., Garbe, D., and Surburg, H., “Ullmann’s Enclyclopedia of Industrial
Chemistry” (W. Gerhertz, Ed.) VCH, Weinheim,
141
. Vol. A11 (1988).
Boyse, R. A., and Ko, E. I. 1996.
Catal. Lett.
38
, 225.
Busca, G., Lorenzelli, V., Galli, P., Ginestra, A. L., and Patrono, P. 1987.
J. Chem.
Soc. Faraday Trans. 1
83
, 853.
Chuah, G. K., and Jaenicke, S. 1997.
Appl. Catal. A.
163
, 261.
Chuah, G. K., Liu, S. H., Jaenicke, S., and Li, J. 2000.
Microporous Mesoporous
Mater.
39
, 381.
Chuah, G. K., Jaenicke, S., and Pong, B. K. 1998.
J. Catal.
175
, 80.
Chuah, G. K., Jaenicke, S., and Xu, T. H. 1999.
Surf. Interface Anal.
28
, 331.
Chuah, G.K., Liu, S.H., Jaenicke, S. & Harrison, L.J. 2001. Cyclisation of Citronellal
to Isopulegol Catalysed by Hydrous Zirconia and Other Solid Acids.
J. of Cat
.
352-359
,
200.
Guidotti, M., Moretti, G., Psaro, R. & Ravasio, N. 2000. One-Pot Conversion of
Citronellal into Isopulegol Epoxide on Mesoporous Titanium Silicate.
Chem.
Com
.
1789-1790
.
Iosif, F., Coman, S., Parvulescu, V., Grange, P., Delsarte, S., De Vos, D. & Jacobs, P.
2004. Ir-Beta zeolite as a heterogeneous catalyst for the one-pot
transformation of citronellal to mentol.
Chem. Com
.
1292-1293
.
Iryani. 2005.
Transformasi Sitronelal dari Minyak Sereh menjadi p-Simena Melalui
Reaksi Siklisasi Aromatisasi dengan Katalis FeCl
3dalam Nahidrida Asetat
.
Jurusan Kimia S1. FMIPA UNNES.
Iwata, T., Yoji, H. & Yoshiki, O. 2002. Process for Producing Isopulegol.
European
Patent Application
. No. EP 1 225 163 A2.
Jansen, J. C., Creyghton, E. J., Njo, S. L., van Koningsveld, and van Bekkum, H.
1997.
Catal. Today
38
, 205 ().
Jensen, B.L., Malkawi, A. & McGowan, V. 2000. Cyclization of the Monoterpene
Citronellal to Isopulegol: A Biomimetic Natural Product Synthesis.
J. Chem.
Educ
. V.77 No.11:
1474
.
Kropp, P. J., Breton, G. W., Craig, S. L., Crawford, S. D., Durland, W. F., Jr., Jones,
J. E., III, and Raleigh, J. S. 1995.
J. Org. Chem.
60
, 4146.
Lenny, S. 2006.
Senyawa Terpenoida dan Steroida
. USU Reporsitory. Medan.
Ko
č
ovský, P., Ahmed, G., Šrogl, J., Malkov, A.V., and Steele, J. 1999.
J. Org.Chem.
64
, 2765.
Mäki-Arvela, P., Kumar, N., Nieminen, V., Sjoholm, R., Salmi, T. & Yu. Murzin, D.
2004. Cyclization of citronellal over zeolites and mesoporous materials for
production of isopulegol.
J. of Cat
.
155-169
,
225.
Moreira, J., and Corrêa, A.G. 2000.
J. Braz. Chem. Soc.
11
, 204.
Nakatani, Y., and Kawashima, K. 1978.
Synthesis
147.
.
Nakano, Y., Iizuka, T., Hattori, H., and Tanabe, K. 1979.
J. Catal.
57
, 1.
Priatmoko. 1990.
Sintesis Mentol dari Sitronelal Hasil Isolasi dari Minyak Sereh
.
Tesis FMIPA UGM. Jogjakarta.
Ravasio, N., Antenori, M., Babudri, F., and Gargano, M. 1997.
Stud. Surf. Sci. Catal.
108
, 625.
Robson, H. 1998.
Microporous Mater.
22
, 551.
Sakai, K., and Oda, O. 1972.
Tetrahedron Lett.
42
, 4375.
Schulte-Elte, K. H., and Ohloff, G. 1967.
Helv. Chim. Acta.
50
, 153.
Shabtai, J., Lazar, R., and Biron, E. 1984.
J. Mol. Catal.
27
, 35.
Spielbauer, D., Mekhermer, G. A. H., Zaki, M. I., and Knözinger, H. 1996.
Catal.
Lett.
40
, 71.
Spielbauer, D., Mekhermer, G. A. H., Riemer, T., Zaki, M. I., and Knözinger, H.
1997.
J. Phys. Chem. B
101
, 4681.
Tanabe, K., Sumiyoshi, T., Shibata, K., Kiyoura, T., and Kitagawa, J. 1974.
Bull.
Chem. Soc. Jpn.
47
, 1064.
Tateiwa, J., Kimura, A., Takasuka, M., and Uemura, S. 1997.
J. Chem. Soc. Perkin
Trans. 1.
2169.
Yadav, G. D., and Nair, J. J. 1998. Novelties of Eclectically engineered Sulfated
Zirconia and Carbon Molecular Sieve Catalyst in Cyclisation of Citronellal to
Isopulegol.
Chem. Commun.
2369-2370
.
Yadav, G. D., and Nair, J. J. 2000.
Langmuir
16
, 4072.
Yuntong, N., Niah, W., Jaenicke, S. & Chuah, G.K. 2007. Synthesis of Menthol from
Citronellal over Bifunctional Ni/Zr-Beta and Zr-beta/Ni-MCM-41 Catalysts,