INTISARI
Manggis (Garcinia mangostana L.) merupakan tanaman yang kaya akan senyawa antioksidan. Ekstrak kulit buah manggis mengandung senyawa golongan xanton yang memiliki beberapa aktivitas farmakologi salah satunya sebagai antioksidan. Sediaan antioksidan banyak digunakan secara topikal sehingga ekstrak kulit buah manggis diformulasikan menjadi sediaan gel. Penelitian ini bertujuan untuk mengetahui pengaruh dan komposisi CMC-Na dan gliserin pada daerah optimum, stabilitas fisik, serta untuk mengetahui aktivitas antioksidan dari sediaan gel tersebut.
Penelitian ini merupakan penelitian eksperimental menggunakan rancangan penelitian desain faktorial dengan dua level. CMC-Na dan gliserin digunakan sebagai faktor dengan level rendah dan level tinggi. Sifat dan stabilitas fisik gel diuji dengan mengamati organoleptis, pH, daya sebar, pembentukan sedimentasi dan viskositas gel secara freeze thaw. Data viskositas dengan rentang 150-250 dPa.s dan daya sebar 19,64-38,5 cm2 dianalisis secara statistik sebagai respon menggunakan Design-Expert® 9.0.6.2 taraf kepercayaan 95% untuk mencari efek dan daerah optimum CMC-Na dan gliserin serta menggunakan RStudio untuk mengetahui stabilitas gel.
Hasil penelitian menunjukkan CMC-Na berefek dominan terhadap viskositas dan daya sebar. Area komposisi optimum untuk CMC-Na dan gliserin diketahui. Gel stabil secara organoleptis, pH, daya sebar, pembentukan sedimentasi dan viskositas secara freeze thaw serta gel memiliki aktivitas antioksidan yang kuat dengan nilai IC50 dalam range 50-100 ppm.
ABSTRACT
Mangosteen (Garcinia mangostana L.) is a plant that is rich in antioxidant compounds. Mangosteen rind extract contains compounds the xanthone which has several pharmacological activity of one of them as an antioxidant. Antioxidant preparations is used on topical so the extract of mangosteen is formulated into gel. The purpose of the research are to determine effect and composition of CMC-Na and Glycerin in optimum area, physical stability and to find out the antioxidant activity of gel.
This research is experimental using factorial design with two factors and two levels. CMC-Na and glycerin is used as factor and each of them in the low and high level. Physical properties and stability of gel were tested by looking at organoleptic, pH, spreadability, viscosity and sedimentation after freeze thaw. Viscosity data between 150-250 dPa.s and spreadability between 19,64-38,5 cm2 that used to determine effect and optimum area of CMC-Na and glycerine were tested by Design-Expert® 9.0.6.2 and physical stability of gel were tested by RStudio with confidence level 95%.
The results showed CMC-Na is a dominant effect to viscosity spreadability. The optimum area composition of CMC-Na and glycerin has been found. Gel is stable in organoleptic, pH, spreadability, viscosity and sedimentation formation after freeze thaw and gel has a strong activity of antioxidant with IC50 in range 50-100 ppm.
FORMULASI GEL ANTIOKSIDAN EKSTRAK KULIT BUAH MANGGIS (Garcinia mangostana L.) DALAM BERBAGAI VARIASI KONSENTRASI
CMC-Na DAN GLISERIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Diajukan oleh:
Lotmi Sabaretnam Barasa
NIM : 128114144
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
i
FORMULASI GEL ANTIOKSIDAN EKSTRAK KULIT BUAH MANGGIS (Garcinia mangostana L.) DALAM BERBAGAI VARIASI KONSENTRASI
CMC-Na DAN GLISERIN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Diajukan oleh:
Lotmi Sabaretnam Barasa
NIM : 128114144
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
iv
HALAMAN PERSEMBAHAN
A d hate er you do, do it heartily, as to the Lord a d ot to e
Knowing that from the Lord you will receive the reward of the inheritance; for you serve the Lord Christ
-Colossians 3:23-24-
Karya ini saya persembahkan untuk
Tuhan Yesus Kristus
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan yang berlaku.
Yogyakarta, 23 Februari 2016
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Lotmi Sabaretnam Barasa
NIM : 128114144
Demi pengembangan ilmu pengetahuan, saya memberikan kepada perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
FORMULASI GEL ANTIOKSIDAN EKSTRAK KULIT BUAH MANGGIS (Garcinia mangostana L.) DALAM BERBAGAI VARIASI KONSENTRASI CMC-Na DAN GLISERIN
berserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lainnya, mengelolanya dalam bentuk pangkalan data, mendistribusikannya secara terbatas, dan mempublikasikannya di internet atau media lainnya tanpa perlu meminta izin atau memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya Dibuat di Yogyakarta
Pada tanggal: 23 Februari 2016 Yang menyatakan
vii
PRAKATA
Puji syukur penulis haturkan kepada Tuhan Yang Maha Esa karena berkat dan kasih-Nya, penulis dapat menyelesaikan skripsi yang berjudul “Formulasi Gel Antioksidan Ekstrak Kulit Buah Manggis (Garcinia mangostana
L.) dalam Berbagai Variasi Konsentrasi CMC-Na dan Gliserin” dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat mendapat gelar sarjana Farmasi (S.Farm.) program studi Farmasi.
Selama proses perkuliahan, penelitian hingga selesainya penyusunan skripsi ini, penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Dengan penuh ucapan syukur, penulis ingin mengucapkan terimakasih kepada: 1. Tuhan Yesus Kristus, untuk berkat yang selalu diberikan dalam hidup
penulis.
2. Keluargaku terkasih, Bunda, Bapak, Kak Titin, Kak Hetty, Kak Liza, Kak Riris dan Kak Anna yang telah memberikan kasih sayang, doa, dukungan dan semangat kepada penulis.
3. Ibu Aris Widyawati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
4. Bapak Dr. Teuku Nanda Saifullah Sulaiman, M.Si., Apt., selaku dosen pembimbing skripsi atas segala dukungan, arahan, semangat dan masukan yang diberikan kepada penulis selama penyusunan skripsi.
viii
6. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen penguji yang telah memberikan waktu, masukan, kritik dan saran kepada penulis.
7. Bapak Jeffry Julianus, M.Si., selaku dosen pembimbing akademik atas pendampingan selama perkuliahan.
8. Segenap dosen Fakultas Farmasi Universitas Sanata Dharma yang telah membagikan ilmu serta pengalaman selama perkuliahan penulis.
9. Pak Musrifin, Mas Agung, Pak Wagiran, Pak Mukminin, Pak Parlan, Pak Kayat, serta laboran-laboran lain atas segala bantuan dan semangat yang diberikan kepada penulis selama penelitian.
10. Risa, Linda dan Vivin selaku rekan satu tim atas kerja sama, dukungan dan suka duka yang dialami bersama selama proses penelitian skripsi.
11. Kakak-kakak yang sudah berbagi pengalaman dan ilmu, Kak Ardha, Kak Ella, Kak Yoestenia, Kak Devina, Kak Sari, Kak Aloy dan Kak Gia.
12. Rosalia Lestari, Benedicta Rah Kalbu, Natalia Putri Arumsari, Yenny Pasaribu, Lusia Jois, Atyk Jelarut dan Lucia Christine, untuk berbagi cerita, penguatan, yang selalu membantu dan mendoakan selama ini.
13. Rekan-rekan skripsi lantai 1, Cindy, Rossa, Agnes, Putri, Agatha, Yudha, Sion, Aan, Tika dan Valent atas semangat, motivasi dan perhatian yang telah diberikan.
14. Semua teman-teman angkatan 2012, khususnya FSM D 2012 dan FST B 2012 atas kebersamaan, canda tawa, kebahagiaan selama perkuliahan.
ix
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan skripsi ini, sehingga penulis mengharapkan adanya kritik dan saran yang membangun dari semua pihak. Semoga skripsi ini dapat berguna untuk seluruh pihak, terutama dalam bidang kefarmasian.
Yogyakarta, 03 Februari 2016
x
DAFTAR ISI
HALAMAN JUDUL……….. i
HALAMAN PERSETUJUAN PEMBIMBING……… ii
HALAMAN PENGESAHAN……… iii
HALAMAN PERSEMBAHAN………. iv
PERNYATAAN KEASLIAN KARYA……… v
PERSETUJUAN PUBLIKASI……….. vi
PRAKATA……….…………. vii
DAFTAR ISI……….. x
DAFTAR TABEL……….. xiv
DAFTAR GAMBAR……….. xv
DAFTAR LAMPIRAN……….. xvi
INTISARI………... xvii
ABSTRACT………. xviii
BAB I. PENDAHULUAN……… 1
A. Latar Belakang……….. 1
B. Rumusan Masalah………. 4
C. Keaslian Penelitian……… 5
D. Manfaat Penelitian……… 6
E. Tujuan Penelitian……….. 6
BAB II. PENELAAHAN PUSTAKA………... 8
A. Tanaman Manggis (Garcinia mangostana L.)………. 8
xi
1. DPPH (1,1-difenil-2-pikrilhidrazil)………... 12
2. Uji Diena Terkonjugasi……….. 13
3. Bilangan Para-anisidin………... 13
4. Penentuan Bilangan Peroksida………... 14
5. Aktivitas Penghambatan Radikal Hidroksil……… 15
6. Metode Reducing Power………... 15
7. Metode Fosfomolibdenum……… 16
8. Metode ABTS Diamonium………... 16
9. Kapasitas Serapan Radikal Oksigen……….. 16
10.Aktivitas Antioksidan dalam Sistem Emulsi Asam Linoleat.. 17
11.Metode CUPRAC………. 17
12.Efek Pembentukan Heksanal……… 18
C. Gel………..……….. 18
D. Desain Faktorial……….... 25
E. Monografi Bahan Pembuat Gel……….... 27
1. CMC-Na………... 27
2. Gliserin……….. 28
3. Metil Paraben……… 29
4. Aquadest………... 30
F. Landasan Teori……….……….... 30
G. Hipotesis………... 32
BAB III. METODE PENELITIAN………... 34
xii
B. Variabel dan Definisi Operasional……….... 34
1. Variabel Penelitian……… 34
1. Verifikasi Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)………. 37
2. Uji Aktivitas Antioksidan Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)... 37
a. Pembuatan Ekstrak Kental……… 37
b. Penyiapan Ekstrak Uji………... 38
c. Pembuatan Larutan DPPH……… 38
d. Penentuan Panjang Gelombang Maksimum………….. 38
e. Penetapan Operating Time……… 38
f. Pengukuran Aktivitas Antioksidan Kulit Buah Manggis………. 39
3. Formulasi Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)……… 39 Manggis (Garcinia mangostana L.)………. 43
xiii
BAB IV. HASIL DAN PEMBAHASAN………. 45
A. Verifikasi Ekstrak Kulit Buah Manggis………. 45
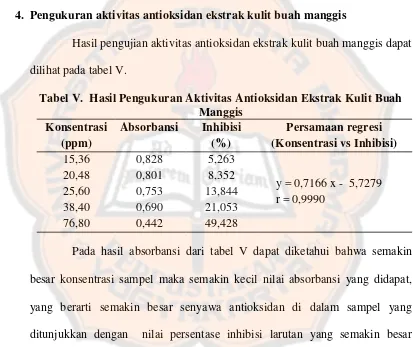
B. Uji Aktivitas Antioksidan Ekstrak Kulit Buah Manggis………….. 45
C. Pengujian Sifat Fisik Gel Ekstrak Kulit Buah Manggis……… 49
1. Uji Organoleptis dan pH………... 49
2. Uji Viskositas……… 51
3. Uji Daya Sebar……….. 55
4. Pengujian Sifat Alir………... 60
5. Optimasi Formula……….. 61
D. Uji Aktivitas Antioksidan Gel Ekstrak Kulit Buah Manggis……… 62
E. Uji Sentrifugasi……….. 64
F. Pengujian Stabilitas Gel Setelah Freeze Thaw Cycle……… 65
1. Uji Organoleptis dan pH………... 65
2. Uji Viskositas……… 66
3. Uji Daya Sebar……….. 68
BAB V. KESIMPULAN DAN SARAN……… 70
A. Kesimpulan………... 70
B. Saran………. 71
DAFTAR PUSTAKA……… 72
LAMPIRAN……….. 77
xiv
DAFTAR TABEL
Tabel I. Rancangan Desain Faktorial dengan 2 Level dan 2 Faktor…… 26 Tabel II. Formula Gel Ekstrak Kulit Buah Manggis………. 39 Tabel III. Hasil Verifikasi Ekstrak Kulit Buah Manggis………. 45 Tabel IV. Data Operating Time Ekstrak Kulit Buah Manggis dengan
DPPH………. 47
Tabel V. Hasil pengukuran Aktivitas Antioksidan Ekstrak Kulit Buah
Manggis………. 48
Tabel VI. Data Pengamatan Organoleptis dan pH Gel Ekstrak Kulit
Buah Manggis………... 50
Tabel VII. Nilai Efek CMC-Na, gliserin, dan Interaksinya terhadap
Viskositas……….. 53
Tabel VIII. Nilai Efek CMC-Na, gliserin, dan Interaksinya terhadap Daya
Sebar……….. 58
Tabel IX. Sifat Alir Gel Ekstrak Kulit Buah Manggis……….. 60 Tabel X. Hasil Validasi Counter Plot Superimposed………... 62 Tabel XI. Data Aktivitas Antioksidan Sediaan Gel Ekstrak Kulit Buah
Manggis………. 63
xv
DAFTAR GAMBAR
Gambar 1. Kandungan Xanton Kulit Buah Manggis………... 10
Gambar 2. Mekanisme Penangkapan Radikal DPPH oleh Antioksidan…. 13
Gambar 3. Struktur Carboxymethylcellulose Sodium………. 27
Gambar 4. Struktur gliserin………. 28
Gambar 5. Struktur Propilen Glikol……… 29
Gambar 6. Struktur Metil Paraben……….. 29
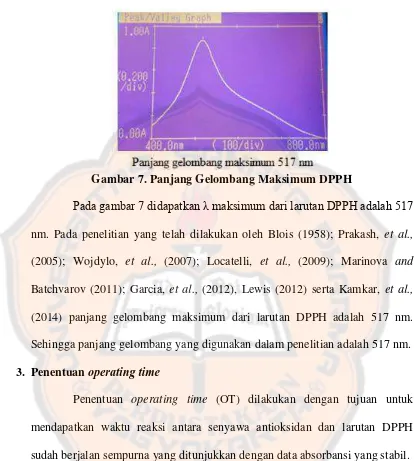
Gambar 7. Panjang Gelombang Maksimum DPPH……….... 47
Gambar 8. Hasil Uji Viskositas Gel Ekstrak Kulit Buah Manggis………. 51
Gambar 9. Counter Plot Respon Viskositas Gel Ekstrak Kulit Buah Manggis………. 53
Gambar 10. Grafik Pengaruh CMC-Na terhadap Viskositas……… 54
Gambar 11. Grafik Pengaruh gliserin terhadap Viskositas………... 55
Gambar 12. Grafik Uji Daya Sebar Gel Ekstrak Kulit Buah Manggis……. 56
Gambar 13. Counter Plot Respon Daya Sebar Gel Ekstrak Kulit Buah manggis………. 57
Gambar 14. Grafik Pengaruh CMC-Na terhadap Daya Sebar……….. 59
Gambar 15. Grafik Pengaruh gliserin terhadap Daya Sebar………. 59
Gambar 16. Counter Plot Superimposed Gel Ekstrak Kulit Buah Manggis………. 61
Gambar 17. Grafik Perubahan Viskositas Gel Ekstrak Kulit Buah Manggis dalam Uji Freeze Thaw Cycle……… 66
xvi
DAFTAR LAMPIRAN
Lampiran 1. Certificate of Analysis (CoA) Dry Extract Mangosteen……. 78 Lampiran 2. Material Safety Data Sheet Dry Extract Mangosteen……… 79 Lampiran 3. Extraction Flow Chart Mangosteen……….. 81 Lampiran 4. Foto Ekstrak Kulit Buah Manggis………. 82 Lampiran 5. Data Sifat Fisik Organoleptis Sediaan Gel Ekstrak Kulit
Buah Manggis……… 83
Lampiran 6. Aktivitas Antioksidan Ekstrak Kulit Buah
Manggis……….. 86
Lampiran 7. Data Pengukuran Viskositas Gel Ekstrak Kulit Buah
Manggis……….. 87
Lampiran 8. Data Pengukuran Daya Sebar Gel Ekstrak Kulit Buah
Manggis……….. 92
Lampiran 9. Data Sifat Alir Sediaan Gel Ekstrak Kulit Buah Manggis…. 97 Lampiran 10. Data Hasil Uji Sentrifugasi Gel Ekstrak Kulit Buah
Manggis……….. 99
Lampiran 11. Hasil Uji Aktivitas Gel Ekstrak Kulit Buah
xvii
INTISARI
Manggis (Garcinia mangostana L.) merupakan tanaman yang kaya akan senyawa antioksidan. Ekstrak kulit buah manggis mengandung senyawa golongan xanton yang memiliki beberapa aktivitas farmakologi salah satunya sebagai antioksidan. Sediaan antioksidan banyak digunakan secara topikal sehingga ekstrak kulit buah manggis diformulasikan menjadi sediaan gel. Penelitian ini bertujuan untuk mengetahui pengaruh dan komposisi CMC-Na dan gliserin pada daerah optimum, stabilitas fisik, serta untuk mengetahui aktivitas antioksidan dari sediaan gel tersebut.
Penelitian ini merupakan penelitian eksperimental menggunakan rancangan penelitian desain faktorial dengan dua level. CMC-Na dan gliserin digunakan sebagai faktor dengan level rendah dan level tinggi. Sifat dan stabilitas fisik gel diuji dengan mengamati organoleptis, pH, daya sebar, pembentukan sedimentasi dan viskositas gel secara freeze thaw. Data viskositas dengan rentang 150-250 dPa.s dan daya sebar 19,64-38,5 cm2 dianalisis secara statistik sebagai respon menggunakan Design-Expert® 9.0.6.2 taraf kepercayaan 95% untuk mencari efek dan daerah optimum CMC-Na dan gliserin serta menggunakan RStudio untuk mengetahui stabilitas gel.
Hasil penelitian menunjukkan CMC-Na berefek dominan terhadap viskositas dan daya sebar. Area komposisi optimum untuk CMC-Na dan gliserin diketahui. Gel stabil secara organoleptis, pH, daya sebar, pembentukan sedimentasi dan viskositas secara freeze thaw serta gel memiliki aktivitas antioksidan yang kuat dengan nilai IC50 dalam range 50-100 ppm.
xviii
ABSTRACT
Mangosteen (Garcinia mangostana L.) is a plant that is rich in antioxidant compounds. Mangosteen rind extract contains compounds the xanthone which has several pharmacological activity of one of them as an antioxidant. Antioxidant preparations is used on topical so the extract of mangosteen is formulated into gel. The purpose of the research are to determine effect and composition of CMC-Na and Glycerin in optimum area, physical stability and to find out the antioxidant activity of gel.
This research is experimental using factorial design with two factors and two levels. CMC-Na and glycerin is used as factor and each of them in the low and high level. Physical properties and stability of gel were tested by looking at organoleptic, pH, spreadability, viscosity and sedimentation after freeze thaw. Viscosity data between 150-250 dPa.s and spreadability between 19,64-38,5 cm2 that used to determine effect and optimum area of CMC-Na and glycerine were tested by Design-Expert® 9.0.6.2 and physical stability of gel were tested by RStudio with confidence level 95%.
The results showed CMC-Na is a dominant effect to viscosity spreadability. The optimum area composition of CMC-Na and glycerin has been found. Gel is stable in organoleptic, pH, spreadability, viscosity and sedimentation formation after freeze thaw and gel has a strong activity of antioxidant with IC50 in range 50-100 ppm.
1 BAB I PENDAHULUAN
A. Latar Belakang
Penuaan kulit bersifat irreversible dimulai pada usia 20 tahun, meskipun tanda-tanda tidak terlihat dalam waktu yang lama. Faktor penuaan kulit dapat berasal dari dalam maupun dari luar tubuh. Beberapa faktor dari luar tubuh yang mempengaruhi penuaan kulit adalah paparan sinar matahari yang dapat menyebabkan kulit rusak, posisi tidur yang buruk, waktu tidur yang tidak mencukupi, merokok, dan lain-lain. Dari semua faktor tersebut, teori radikal bebas merupakan teori yang sering dikaitkan sebagai penyebab penuaan dini. Radikal UV merupakan pemicu yang sangat potensial dalam pembentukan radikal bebas pada kulit (Masaki, 2010).
Radikal bebas adalah suatu molekul yang sangat reaktif karena memiliki elektron yang tidak memiliki pasangan. Pada kulit, radikal bebas yang diproduksi berlebih akan merusak kolagen pada membran sel kulit, sehingga kulit menjadi kehilangan elastisitasnya dan menyebabkan terjadinya keriput. Proses perusakan kulit ditandai oleh kulit menjadi kering, pecah-pecah dan adanya keriput (Winarsi, 2007). Untuk membantu memperbaiki penampilan kulit, dapat dilakukan beberapa cara, antara lain dengan penggunaan senyawa antioksidan. Buah-buahan dan sayuran banyak mengandung senyawa antioksidan seperti karotenoid, flavonoid dan kandungan fenolik lainnya (Masaki, 2010).
satu kandungannya adalah xanton yang memiliki aktivitas antioksidan, antijamur, antimikroba dan potensi sitotoksik (Hyun-Ah, Bao-Ning, Keller, and Dauglas, 2006). Kulit buah manggis mengandung senyawa xanton yang meliputi kudraksanton G, 8-deoksigartanin, garsimangonson B, garsinon D, garsinon E, gartanin, 1-isomangostin, alfa-mangostin, gamma-mangostin, mangostinon, smeathxanthon A dan tovofilin A (Jung, Su, Keller, Metha and Kinghorn, 2006). Banyaknya potensi pemanfaatan serta banyaknya aktivitas farmakologi yang dimiliki membuat ekstrak kulit buah manggis menjadi pilihan dalam pengobatan alternatif dan sangat berpotensi untuk dikembangkan sebagai kemopreventif.
Penggunaan ekstrak kulit buah manggis secara langsung menimbulkan ketidaknyamanan pada saat penggunaan, sehingga perlu dikembangkan menjadi sediaan yang mudah diaplikasikan. Sediaan topikal untuk penggunaan lokal digunakan untuk mengurangi efek samping dan mengatasi efek metabolisme di hati. Sediaan topikal juga dapat dianggap sebagai alternatif yang sebanding dengan sediaan oral (Klinge and Sawyer, 2013). Selain itu, pemanfaatan efek antioksidan pada sediaan yang ditujukan pada kulit, sehingga lebih baik diformulasikan dalam bentuk sediaan kosmetika topikal dibandingkan oral (Draelos and Thaman, 2006).
dan terpenetrasi oleh suatu cairan. Bentuk sediaan gel memiliki beberapa keuntungan diantaranya tidak lengket, gel memiliki aliran tiksotropik dan pseudoplastik yaitu gel berbentuk padat apabila disimpan dan akan segera mencair bila dikocok, konsentrasi bahan pembentuk gel yang dibutuhkan hanya sedikit untuk membentuk massa gel yang baik, viskositas gel tidak mengalami perubahan yang berarti pada suhu penyimpanan (Lieberman, Rieger and Banker, 1989). Gel mempunyai biokompatibilitas yang tinggi sebab mempunyai tegangan permukaan yang rendah dengan cairan biologi dan jaringan sehingga meminimalkan kekuatan adsorbsi protein dan adhesi sel. Gel menstimulasi sifat hidrodinamik dari gel biologikal, sel dan jaringan dengan berbagai cara, serta bersifat lembut/lunak dan elastis sehingga meminimalkan iritasi karena friksi atau mekanik pada jaringan sekitarnya. Selain itu kelebihan lainnya dari gel adalah saat pemakaian gel di kulit setelah kering meninggalkan lapisan film tembus pandang, memiliki daya lekat tinggi yang tidak menyumbat pori sehingga pernapasan kulit tidak terganggu, serta mudah dicuci dengan air dan pelepasan obatnya baik (Lachman, Lieberman and Kanig, 1994).
karena itu dalam formulasi sediaan gel antioksidan ekstrak kulit buah manggis perlu dilakukan optimasi penggunaan CMC-Na dan gliserin agar didapat sediaan gel yang memenuhi persyaratan sifat fisik dan stabilitas gel.
Metode optimasi yang digunakan adalah metode desain faktorial dengan 2 faktor (CMC-Na dan gliserin) dan 2 level (level rendah dan level tinggi). Metode ini digunakan untuk mengetahui faktor antara CMC-Na, gliserin maupun interaksi kedua faktor tersebut. Desain faktorial juga digunakan untuk mengetahui yang paling berpengaruh terhadap sifat fisik dan stabilitas gel. Setelah diketahui faktor yang paling berpengaruh, maka dapat juga diketahui daerah optimum antara komposisi CMC-Na dan gliserin pada gel ekstrak kulit buah manggis.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan sebelumnya, terdapat beberapa masalah yang akan diteliti, yaitu sebagai berikut:
1. Bagaimana pengaruh CMC-Na dan gliserin terhadap sifat fisik gel ekstrak kulit buah manggis?
2. Berapa komposisi CMC-Na dan gliserin pada daerah optimum sehingga dihasilkan gel dengan sifat fisik yang baik?
3. Bagaimana kestabilan gel ekstrak kulit buah manggis setelah diuji sentrifugasi dan freeze thaw cycle?
C. Keaslian Penelitian
Penelitian yang pernah dilakukan berkaitan dengan pemanfaatan ekstrak kulit manggis dalam sediaan kosmetik dan formulasi gel antara lain:
1. Optimasi Gelling Agent CMC-Na dan Humektan Polietilen Glikol 400 dalam Sediaan Gel Antiinflamasi Ekstrak Lidah Buaya (Aloe barbadensis Mill.) dengan Aplikasi Desain Faktorial (Putri, 2014).
Hasil penelitian ini menunjukkan bahwa CMC-Na, PEG-400 dan interaksi keduanya memberikan respon yang signifikan terhadap viskositas dan daya sebar. Tidak ditemukan area komposisi optimum yang diprediksi sebagai formula optimum gel dari gelling agent dan humektan yang memenuhi persyaratan sifat fisik gel dan stabilitas gel.
2. Pengaruh Konsentrasi Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) terhadap Sifat Fisik dan Stabilitas Fisik Sediaan Emulgel (Yoestenia, 2014).
Penelitian ini mengenai optimasi ekstrak kulit buah manggis pada sediaan emulgel.
3. Optimasi Gelling Agent CMC-Na dan Humektan Gliserin dalam Sediaan Gel Anti-Inflamasi Ekstrak Daun Cocor Bebek (Kalanchoe pinnata (Lam.)): Aplikasi Desain Faktorial (Putra, 2015).
Penelitian ini mengenai optimasi CMC-Na dan gliserin pada sediaan topikal ekstrak cocor bebek dengan tinjauan desain faktorial.
dan gliserin sebagai humektan dengan menggunakan desain faktorial belum pernah dilakukan.
D. Manfaat Penelitian 1. Manfaat Teoritis
Penelitian ini diharapkan dapat menambah informasi mengenai penggunaan konsentrasi CMC-Na sebagai gelling agent dan gliserin sebagai humektan dalam gel antioksidan ekstrak kulit buah manggis.
2. Manfaat Praktis
Penelitian ini diharapkan memberikan gambaran mengenai pengaruh peningkatan konsentrasi CMC-Na sebagai gelling agent dan gliserin sebagai humektan terhadap sifat fisik dan stabilitas gel antioksidan ekstrak kulit buah manggis dan juga diharapkan menghasilkan sediaan gel yang aman untuk digunakan dan diterima masyarakat.
E. Tujuan 1. Tujuan Umum
Tujuan umum penelitian ini adalah untuk menghasilkan formula gel antioksidan dari ekstrak kulit buah manggis (Garcinia mangostana L.) yang sesuai dengan persyaratan sifat fisik dan stabilitas fisik yang ditentukan serta dapat diterima masyarakat.
2. Tujuan Khusus
b. Mengetahui komposisi CMC-Na dan gliserin pada daerah optimum sehingga dihasilkan gel ekstrak kulit buah manggis dengan sifat fisik yang diinginkan.
c. Mengetahui kestabilan gel ekstrak kulit buah manggis melalui uji sentrifugasi dan freeze thaw cycle.
8
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Manggis (Garcinia mangostana L.)
Garcinia adalah genus terbesar dari tropis famili Guttiferae yang berisi sekitar 400 spesies pohon poligami atau semak-semak, terdistribusi di Asia tropis, Afrika dan Polinesia (Verheij and Coronel, 1997). Manggis yang memiliki nama latin Garcinia mangostana L. merupakan tanaman yang berasal dari hutan tropis di kawasan Asia Tenggara (Malaysia atau Indonesia). Di Indonesia manggis disebut dengan berbagai macam nama lokal seperti manggu (Jawa Barat), Manggus (Lampung), Manggusto (Sulawesi Utara), Manggista (Sumatera Barat) (Dalimartha, 2003).
Klasifikasi manggis secara taksonomi adalah sebagai berikut: Divisi : Spermatophyta
Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Guttiferales Famili : Guttiferae Genus : Garcinia
bulat-bulat seperti bola, besarnya kira-kira sebesar jeruk garut, berkulit merah tua atau ungu tua. Daging buah manggis berwarna putih, bertekstur halus dan rasanya manis bercampur asam sehingga menimbulkan rasa khas dan segar. Getah manggis berwarna kuning (getah kuning) atau resin ada pada semua jaringan utama tanaman (Cahyono dan Juanda, 2000).
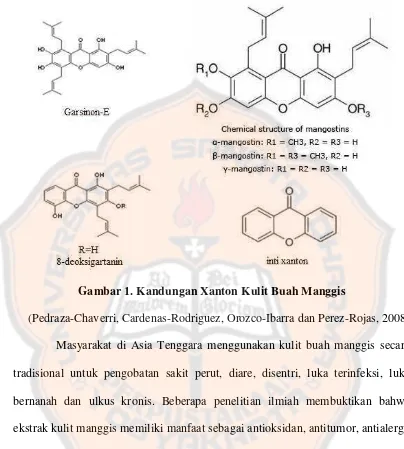
Buah manggis merupakan spesies terbaik dari genus Garcinia dan mengandung gula sakarosa, dekstrosa dan levulosa. Manggis (Garcinia mangostana L.) merupakan salah satu tanaman yang dimanfaatkan sebagai obat tradisional. Kulit manggis mengandung senyawa yang memiliki aktivitas antioksidan. Senyawa tersebut diantaranya xanton, flavonoid dan tanin. Xanton merupakan metabolit sekunder yang ditemukan dalam beberapa tanaman tingkat tinggi termasuk manggis. Xanton dapat diisolasi dari kulit, buah utuh, kulit kayu, dan daun manggis. Golongan xanton yang telah teridentifikasi diantaranya adalah
α-mangostin, -mangostin dan -mangostin, garsinon E, 8-deoksigartanin dan gartanin. Senyawa antioksidan terkuat yang terdapat pada kulit buah manggis adalah senyawa xanton yang merupakan senyawa organik turunan dari difenil-γ -pyron, serta merupakan substansi kimia alami yang dapat digolongkan dalam senyawa jenis fenol atau polyphenolic. Karena itulah xanton dapat digolongkan sebagai senyawa polar. Senyawa ini memiliki rumus molekul C13H8O2, sehingga
memiliki massa molar sebesar 196,19 gram/mol. Dalam persamaan IUPAC, senyawa
Gambar 1. Kandungan Xanton Kulit Buah Manggis
(Pedraza-Chaverri, Cardenas-Rodriguez, Orozco-Ibarra dan Perez-Rojas, 2008) Masyarakat di Asia Tenggara menggunakan kulit buah manggis secara tradisional untuk pengobatan sakit perut, diare, disentri, luka terinfeksi, luka bernanah dan ulkus kronis. Beberapa penelitian ilmiah membuktikan bahwa ekstrak kulit manggis memiliki manfaat sebagai antioksidan, antitumor, antialergi, antiinflamasi, antibakteri, antifungi dan antivirus (Pedraza-Chaverri, Cardenas-Rodriguez, Orozco-Ibarra dan Perez-Rojas, 2008).
B. Antioksidan
Antioksidan adalah senyawa-senyawa yang mampu menghilangkan, membersihkan, menahan pembentukan oksigen reaktif. Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya reaksi oksidasi dengan cara mencegah terbentuknya radikal. Penggunaan senyawa antioksidan semakin meluas, seiring dengan semakin besarnya pemahaman masyarakat tentang peranannya dalam menghambat penyakit generatif seperti penyakit jantung, kanker, serta gejala penuaan. Masalah ini berkaitan dengan kemampuan antioksidan untuk bekerja sebagai inhibitor reaksi oksidasi oleh radikal bebas reaktif (Winarsi, 2007).
Tubuh menghasilkan senyawa antioksidan, tetapi jumlahnya sering kali tidak cukup untuk menetralkan radikal bebas yang masuk ke dalam tubuh. Sebagai contoh tubuh dapat menghasilkan glutathione yang memiliki aktivitas antioksidan sangat kuat, hanya tubuh memerlukan asupan vitamin C sebesar 100mg untuk memicu tubuh menghasilkan gluthathione. Kekurangan antioksidan dalam tubuh perlu dipenuhi dengan asupan antioksidan dari luar (Winarsi, 2007). Antioksidan alami dapat diperoleh dari makanan sehari-hari seperti sayuran, buah-buahan, kacang-kacangan dan tanaman lainnya yang mengandung antioksidan, asam-asam fenolat (seperti asam elagat dan asam kafeat) dan senyawa flavonoid seperti kuersetin, mirisetin, apigenin, luteolin dan kaemferol (Rohdiana, 2001).
Nilai IC50 (Inhibiton Concentration) adalah konsentrasi antioksidan
(ppm) yang mampu menghambat 50% aktivitas radikal bebas. Suatu sampel dikatakan memiliki aktivitas antioksidan bila memiliki nilai IC50 <200 ppm
(Hanani, Mu’nim dan Sekarini, 2005).
Untuk menentukan aktivitas antioksidan secara in-vitro beberapa metode yang dapat dilakukan antara lain:
1. DPPH (1,1-difenil-2-pikrilhidrazil)
berpasangan, maka warna larutan berubah dari ungu menjadi kuning (Gurav, et al., 2007).
Gambar 2. Mekanisme Penangkapan Radikal DPPH oleh Antioksidan (Gurav, et al., 2007) 2. Uji Diena Terkonjugasi
Prinsip uji diena terkonjugasi adalah pembentukan hidroperoksida dari PUFA yang menyebabkan konjugasi struktur pentadin. Hal ini dapat diukur dengan adanya serapan pada panjang gelombang 233-234 nm. Selama oksidasi asam lionelat, ikatan rangkap diubah menjadi ikatan rangkap terkonjugasi yang dapat dikarakterisasi oleh serapan UV pada panjang gelombang 234 nm. Hasil yang terbentuk berupa hidroperoksida yang terdekomposisi sebagai 9-hidroksioktadeka-10, 12-asam dienoat dan 13-hidroksioktadeka-9, 11-asam dienoat yang mempertahankan struktur terkonjugasi dan berperan dalam besarnya absorbansi (Shivaprasad, 2005). 3. Bilangan Para-anisidin
umumnya lebih sensitif terhadap aldehid tak jenuh yang mudah menguap dibandingkan aldehid jenuh dengan sifat yang sama, sehingga uji ini merupakan cara yang cocok untuk menilai adanya oksidasi sekunder. Pengukuran bilangan para-anisidin umumnya digunakan secara bersama dengan pengukuran bilangan peroksida dalam menggambarkan tingkat oksidasi total (Pokor, Yanishlieva and Gordon, 2001).
4. Penentuan Bilangan Peroksida
Bilangan peroksida diukur dalam sampel minyak yang ditambahkan ekstrak tanaman sebanyak 0,1% dengan antioksidan BHT sebagai pembanding sebanyak 0,01% serta blanko diukur tanpa penambahan ekstrak. Sebagian besar ekstrak hidrofilik akan sulit untuk mengalami homogenisasi dengan penentuan bilangan peroksida, sehingga ekstrak terlebih dahulu dilarutkan dalam sejumlah kecil etanol. Bilangan peroksida dihitung menggunakan rumus:
PV = 0,01 x N x 1000/m
Nilai N adalah volume sodium tiosulfat yang digunakan pada titrasi sampel dalam mL dan m adalah massa sampel minyak dalam gram. Sedangkan, rumus untuk menghitung efisiensi antioksidan (EA) adalah:
EA = IPA/IPB
IPA,B adalah periode induksi (waktu dalam hari yang dibutuhkan untuk
5. Aktivitas Penghambatan Radikal Hidroksil
Prinsip dari uji ini adalah pengukuran aktivitas antioksidan dengan mereaksikan antara DMPO (5,5dimetil1pirolinNoksida) dengan radikal -OH secara adisi, dan akan menghasilkan DMPO--OH yang dideteksi menggunakan spektrofotometer ESR. Pengaturan parameternya adalah dengan mengukur medan magnet eksternal 337,5 ± 5 mT pada frekuensi 100 kHz, dengan gelombang mikro 10 mW pada 9,43 GHz. Asam askorbat dan etanol digunakan sebagai kontrol. Perbandingan penghambatan radikal hidroksil ekstrak diukur dengan persamaan:
Tingkat penghambatan = x 100%
Nilai hx,0 adalah reaksi intensitas signal ESR pada masing-masing sampel uji
maupun blanko (Shivaprasad, 2005). 6. Metode Reducing Power
Prinsip dari metode reducing power adalah peningkatan serapan dari reaksi pencampuran berbagai konsentrasi dari ekstrak yang diuji dengan penambahan dapar natrium fosfat dan kalium ferisianida. Peningkatan serapan yang terjadi menunjukkan peningkatan aktivitas antioksidan. Senyawa membentuk kompleks berwarna dengan kalium ferisianida, trikloroasetat dan besi (III) klorida (Miladi and Damak, 2008).
yang berwarna hijau akan mengalami reduksi menjadi Fe2+ yang berwarna kuning. Metode ini menggunakan kompleks digunakan sebagai
pereaksi. Kompleks anion yang berwarna hijau akan berfungsi
sebagai zat pengoksidasi dan mengalami reduksi menjadi yang berwarna kuning (Aiyegoro,2009).
7. Metode Fosfomolibdenum
Fosfomolibdenum adalah metode kuantitatif untuk aktivitas antioksidan total yang dinyatakan sebagai jumlah yang setara asam askorbat. Pengujian menggunakan metode fosfomolibdenum didasarkan pada reduksi dari Mo (V1) menjadi Mo (V) oleh sampel analit, dan selanjutnya pembentukan kompleks warna hijau dari fosfat molybdenum (V) yang mengandung antioksidan pada pH asam (Shivaprasad, 2005).
8. Metode ABTS Diamonium
Garam diamonium ABTS (2,2-azinobis (3-etilbenzotiazolin-6-sulfonikasid) dengan prinsip pengujian dekolorisasi radikal kation yang merupakan metode spektrofotometri dengan panjang gelombang 734 nm, pengujian ini banyak digunakan untuk pengujian aktivitas antioksidan pada berbagai zat. ABTS dihasilkan dengan mengoksidasi larutan kation ABTS•+ dengan kalium persulfat (Re, et al., 1999).
9. Kapasitas Serapan Radikal Oksigen (ORAC)
antioksidan dari makanan, vitamin atau bahan kimia lainnya. Uji ORAC dilakukan dengan menggunakan trolox (analog vitamin E) sebagai standar untuk menentukan trolox ekuivalen (TE). Nilai ORAC kemudian dihitung dari TE dan dinyatakan sebagai satuan ORAC. Semakin tinggi nilai ORAC maka semakin besar aktivitas antioksidan suatu senyawa tersebut. Uji ini berdasarkan pembentukan radikal bebas menggunakan AAPH (2,2-azobis-2-amido propan dihidroklorida) dan pengukuan dari flouoresensi dengan adanya penghambat radikal (Bank, 2002).
10. Aktivitas Antioksidan dalam Sistem Emulsi Asam Linoleat
Tingkat oksidasi akibat pembentukan radikal alkoksi oleh reaksi redoks dengan besi (agen pereduksi) dalam emulsi asam linoelat pada pH fisiologis diukur dengan metode tiosianat. Hasil kromogen merah komplek ferri (III) tiosianat diukur pada panjang gelombang 500 nm (Kosem, et al., 2007). Inhibisi lipid peroksidase (LPI) dalam persen diukur dengan persamaan:
LPI (%) = x 100%
A0 adalah nilai absorbansi dari kontrol (tanpa penambahan ekstrak), A1
adalah nilai absorbansi dari sampel serta A2 adalah nilai absorbansi larutan
tanpa penambahan kalium tiosianat (Kosem, et al., 2007). 11. Metode CUPRAC (Cupric Reducing Antioxidant Capacity)
hasil reaksi redoks dengan mereduksi polifenol yang diukur pada panjang gelombang 450 nm. Spektrum Cu (I) Ne diperoleh dengan mereaksikan asam askorbat dalam berbagai konsentrasi dengan reagen CUPRAC. Kelebihan metode ini adalah pereaksi yang digunakan bekerja dengan cepat, selektif, lebih stabil, mudah didapat dan mudah untuk dilakukan (Apak, et al., 2005). 12. Efek Pembentukan Heksanal
Heksanal dan pentanal adalah 2 jenis aldehid yang merupakan zat volatil utama pada proses oksidasi lipid sekunder. Jumlah heksanal yang dihasilkan berkolerasi dengan adanya dekomposisi asam lemak tak jenuh. Jumlah pentanal yang terbentuk selama oksidasi biasanya secara signifikan lebih rendah dari jumlah heksanal. Hal ini dikarenakan heksanal merupakan hasil oksidasi sekunder, karena itu terjadi peningkatan jumlah secara pesat selama proses oksidasi setelah jeda waktu tertentu (periode induksi). Efisiensi antioksidan (AE) dihitung dengan membagi periode induksi sampel (IP) dengan periode induksi blanko (Ulbert and Roubicek, 1993).
C. Gel
Gel merupakan sistem semi padat terdiri dari suspensi yang dibuat dari partikel anorganik yang kecil atau molekul organik yang besar, dan terpenetrasi oleh suatu cairan (Dirjen POM RI, 1995).
Gel diklasifikasikan menjadi 2 berdasarkan oleh karakteristiknya yaitu gel inorganik dan gel organik. Gel organik memiliki ciri yaitu mengandung polimer sebagai pembentuknya. Selain itu gel juga dibagi menjadi 2 berdasarkan dari sifat pelarutnya, yaitu aqueous gels dan organogels. Aqueous gels yaitu gel dengan pelarutnya merupakan air, sedangkan organogels menggunakan pelarut yang nonaqueous (Zats and Kushla, 2005).
Hidrogel atau aqueous gels adalah sistem gel di mana air bergerak di dalam polimer yang terlarut. Hidrogel memiliki kompatibilitas yang cukup baik terhadap jaringan biologis (Zats and Kushla, 2005). Hidrogel menggambarkan sediaan yang memiliki daya sebar yang baik, serta memiliki sifat hidrofilik karena sebagian besar kandungannya adalah air (85-95%). Bahan dan agen pembentuk gel biasanya merupakan senyawa polimer organik seperti carbopol dan CMC-Na. Setelah saat diaplikasikan, hidrogel memberikan sensasi dingin karena disebabkan oleh evaporasi dari pelarutnya (air). Namun penggunaan hidrogel dalam jangka panjang dapat menyebabkan kulit mengering. Oleh karena itu biasanya ditambahkan humektan dalam formulasinya (Barel, Paye and Malbach, 2001).
Komponen penyusun sediaan gel adalah: 1. Gelling agent
struktur gel (matriks gel) sehingga viskositas gel meningkat (Zatz dan Kushla, 1996).
2. Humectant
Humectant adalah bahan alam produk kosmetik yang ditujukan untuk mencegah hilangnya lembab dari sediaan dan meningkatkan kelembaban lapisan kulit terluar pada saat produk digunakan (Lynde, 2001).
3. Pengawet
Beberapa basis gel resisten terhadap serangan mikroba, tetapi semua sediaan gel mengandung banyak air sehingga membutuhkan pengawet sebagai antimikroba. Pemilihan pengawet untuk sediaan gel harus memperhatikan inkompatibilitasnya dengan gelling agent. Beberapa contoh pengawet yang biasa digunakan pada beberapa gelling agent adalah:
a. Tragakan : metil hidroksi benzoat 0,2 % w/v dengan propil hidroksi benzoat 0,05 % w/v.
b. Na alginat : metil hidroksi benzoat 0,1- 0,2 % w/v, atau klorokresol 0,1 % w/v atau asam benzoat 0,2 % w/v.
c. Pektin : asam benzoat 0,2 % w/v atau metil hidroksi benzoat 0,12 % w/v atau klorokresol 0,1-0,2 % w/v.
d. Starch glyserin : metil hidroksi benzoat 0,1-0,2 % w/v atau asam benzoat 0,2 % w/v.
Pada umumnya pengawet dibutuhkan oleh sediaan yang mengandung air. Biasanya digunakan metilparaben dan propilparaben sebagai pengawet
4. Bahan higroskopis
Penambahan bahan higroskopis biasanya untuk mencegah hilangnya air pada sediaan gel. Contoh bahan higroskopis yang biasa digunakan adalah gliserol, propilenglikol atau sorbitol dengan konsentrasi 10-20% (Lieberman, Rieger and Banker, 1989).
5. Chelating agent
Penambahan chelating agent bertujuan untuk mencegah basis dan zat yang sensitif terhadap logam berat. Contoh chelating agent yang dapat digunakan adalah EDTA (Lieberman, Rieger and Banker, 1989).
Ada banyak faktor yang mempengaruhi pembentukan gel, faktor-faktor ini dapat berdiri sendiri atau berhubungan satu sama lain sehingga memberikan pengaruh yang sangat kompleks. Diantara faktor-faktor tersebut yang paling menonjol adalah konsentrasi basis, suhu, pH,dan adanya ion atau komponen aktif lainnya.
b. Suhu memiliki pengaruh yaitu akan menyebabkan penurunan kekentalan, karena itu kenaikan suhu dapat mengubah sifat aliran yang semula non-Newtonian menjadi non-Newtonian.
c. pH berpengaruh pada bentuk sediaan. Pada umumnya akan membentuk gel dengan baik pada kisaran pH tertentu. Hal ini ditunjukkan oleh terjadinya peningkatan kekentalan dengan meningkatnya pH hingga mencapai titik tertentu dan kemudian akan makin menurun bila pH terus ditingkatkan. d. Pengaruh komponen lainnya, biasanya sifat fungsional beberapa jenis
hidrokoloid dapat dipengaruhi oleh adanya hidrokoloid lain. Pengaruh ini dapat bersifat negatif dalam arti sifat fungsional makin berkurang dengan adanya hidrokoloid lain ataupun bersifat positif karena adanya pengaruh sinergis antar hidrokoloid yang bergabung.
Sifat fisik yang dipengaruhi oleh komposisi bahan gel ekstrak kulit buah manggis antara lain organoleptis, viskositas, daya sebar dan pH.
1. Organoleptis
Uji ini dilakukan untuk melihat fisik emulsi secara visual. Dalam uji ini yang diamati antara lain warna, bau, tekstur dan homogenitas (Muzzafar, Singh and Chauhan, 2013).
2. Viskositas
penyimpanan adalah perubahan profil kekentalan selama 1 bulan (Dwiastuti, 2010).
3. Sifat Alir
Berdasarkan tipe aliran dan deformasinya, bahan dibedakan menjadi 2 golongan yaitu sistem Newtonian dan sistem non-Newtonian. Sistem Newtonian merupakan sistem yang dengan nilai ɳ (viskositas) yang konstan, memiliki kurva linear, serta tidak dipengaruhi oleh shear stress dan shear rate. Sisten non-Newtonian merupakan sistem dengan nilai ɳ yang tidak konstan, memiliki kurva non-linear, dan dipengaruhi oleh berbagai kondisi alir seperti geometri alir, shear rate, dll. Sediaan emulsi, suspensi, disperse dan larutan polimer termasuk dalam tipe non-Newtonian, sedangkan senyawa air, alkohol, gliserin dan larutan sejati masuk dalam tipe Newtonian (Zats and Kushla, 2005).
4. Daya Sebar
Daya sebar adalah kemampuan penyebaran sediaan pada kulit. Daya sebar merupakan karakteristik yang penting karena bertanggung jawab untuk ketepatan transfer dosis atau pelepasan zat aktifnya, dan kemudahan penggunaannya. Faktor yang mempengaruhi daya sebar yaitu rigiditas sediaan, lama penekanan, temperatur tempat aksi, dan viskositas sediaan. Daya sebar berhubungan dengan viskositas, meningkatnya viskositas akan menurunkan daya sebar, dan sebaliknya (Garg, Aggarwal and Singla, 2002). 5. pH
Kulit manusia memiliki pH dalam rentang asam, yaitu antara 4,5-6,5. Apabila suatu sediaan topikal memiliki pH yang terlalu asam akan menyebabkan kulit iritasi, sedangkan apabila pH terlalu basa akan menyebabkan kulit kering (Muzzafar, Singh and Chauhan, 2013).
Uji stabilitas yang dilakukan yaitu centrifugation test dan freeze thaw cycle. Centrifugation test atau uji sentrifugasi merupakan uji mekanik yang bertujuan untuk mengamati adanya pemisahan fase dari sediaan. Sampel diuji sentrifugasi mengunakan sentrifugator dengan kecepatan 3750 rpm selama 5 jam dan diamati pemisahan yang terjadi. Uji ini dapat memprediksi kestabilan sediaan selama penyimpanan 1 tahun akibat dari adanya gaya gravitasi. Freeze thaw test dilakukan dengan menyimpan sediaan pada suhu beku selama 24 jam, kemudian disimpan kembali pada suhu ±25oC selama 24 jam yang merupakan 1 siklus. Uji freeze thaw dilakukan minimal 6 siklus, apabila tidak terjadi perubahan signifikan maka sediaan yang diuji dapat dikatakan stabil (Lawrence and Bing, 2014).
D. Desain Faktorial
Optimasi formula merupakan hal yang penting pada bidang farmasi. Tujuan dilakukan optimasi formula adalah supaya dapat ditemukan formula optimum. Secara umum proses optimasi terdiri dari seri formula dengan konsentrasi bahan yang berbeda. Salah satu cara untuk optimasi formula yaitu menggunakan desain faktorial. Desain faktorial digunakan untuk mencari efek dari berbagai faktor atau kondisi terhadap hasil penelitian. Desain faktorial adalah desain untuk menentukan secara serentak efek dari beberapa faktor dan juga interaksinya. Desain faktorial merupakan aplikasi persamaan regresi yang memberikan model hubungan antara variabel respon dengan satu atau lebih variabel bebas (Bolton and Bon, 2004).
dan B. Ketika faktor A berada pada level tinggi maka desain tersebut disebut dengan formula A, ketika faktor B berada pada level tinggi maka desain tersebut disebut dengan formula B, sedangkan ketika faktor A dan B berada pada level tinggi maka desain tersebut disebut dengan formula AB (Armstrong and James, 1996).
Tabel I. Rancangan Desain Faktorial dengan 2 Level 2 Faktor Formula Faktor A Faktor B Interaksi
A + - +
B _ + -
AB + + -
I - - +
Optimasi campuran dua bahan yang mempunyai dua faktor dengan menggunakan pendekatan desain faktorial memiliki rumus:
Y = b0 + b1 (A) + b2 (B) + b12 (A)(B)
dengan nilai Y merupakan respon yang diamati, A dan B merupakan level faktor dengan b0,b1, b2 dan b12 adalah koefisien yang dapat dihitung dari hasil percobaan
(Kurniawan dan Sulaiman, 2009).
Istilah-istilah pada desain faktorial yang perlu diamati menurut Kurniawan dan Sulaiman (2009) adalah:
a. Faktor, yaitu variabel yang telah ditetapkan pada suatu penelitian yang dapat bersifat kualitatif maupun kuantitatif. Faktor ini harus bisa dinyatakan dalam suatu harga atau nilai.
b. Level, yaitu harga yang ditetapkan untuk faktor.
d. Interaksi, yaitu akibat dari penambahan efek-efek faktor yang dapat bersifat antagonis atau sinergis. Antagonis berarti interaksi memiliki efek yang memperkecil efek faktor sedangkan sinergis berarti interaksi memiliki efek yang memperbesar efek faktor.
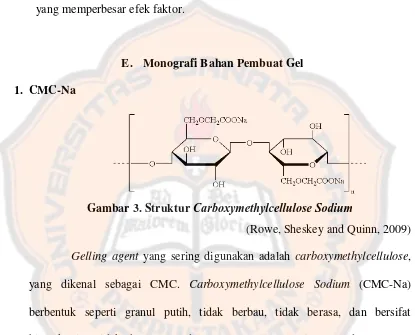
E. Monografi Bahan Pembuat Gel 1. CMC-Na
Gambar 3. Struktur Carboxymethylcellulose Sodium
Sheskey and Quinn, 2009). Dari hasil penelitian Octavia (2009) dengan menggunakan bahan pengikat CMC-Na, gelatin, dan gum arab menunjukkan bahwa dengan menggunakan CMC-Na sebagai bahan pengikat dalam konsentrasi 0,9% menghasilkan sediaan dengan sifat kimia dan organoleptik terbaik.
2. Gliserin
Gliserin berupa cairan jernih, kental, tidak berbau dan bersifat higroskopis. Gliserin dapat digunakan untuk sediaan farmasi termasuk sediaan topikal. Dalam formulasi farmasetika terutama untuk kosmetik, gliserin digunakan sebagai humektan, emollient, juga sebagai bahan tambahan pada aquous maupun non aquous gel, Sebagai humektan konsentrasi ≤30%. Pada sediaan gel, jika hanya digunakan gliserin sebagai humektan, dikhawatirkan gel yang dihasilkan terlalu kental. Maka penelitian ini digunakan kombinasi humektan yaitu propilen glikol dan gliserin agar gel yang dihasilkan baik, yaitu tidak telalu kental dan tidak terlalu encer (Rowe, Sheskey and Quinn, 2009).
Gambar 4. Struktur gliserin
namun tidak larut dalam minyak mineral. Selain sebagai humektan, propilenglikol juga digunakan sebagai stabilisizer, kosolven, plasticizer dan pelarut yang lebih baik dibandingkan dengan gliserin (Rowe, Sheskey and Quinn, 2006).
Gambar 5. Struktur Propilen Glikol
(Rowe, Sheskey and Quinn, 2009) 3. Metil Paraben
Gambar 6. Struktur Metil Paraben
4. Aquadest
Aqudest merupakan cairan jernih, tidak berbau, tidak berwarna, tidak memiliki rasa dan memiliki pH 5-7. Rumus kimia dari aquadest adalah H2O
dengan berat molekul sebesar 18,02 . Aquadest dibuat dengan menyuling air yang memenuhi persyaratan dan tidak mengandung zat tambahan lain. Fungsi dari aquadest adalah sebagai pelarut (Dirjen POM RI, 1995).
F. Landasan Teori
Radikal bebas merupakan salah satu penyebab utama penuaan pada kulit. Salah satu pencegahan dari penuaan kulit yang dapat dilakukan adalah dengan menggunakan senyawa antioksidan. Salah satu tanaman yang memiliki kandungan antioksidan kuat adalah buah manggis (Garcinia mangostana L.) dengan komponen utamanya adalah senyawa golongan xanton yang memiliki aktivitas antioksidan. Xanton merupakan substansi kimia alami yang dapat digolongkan dalam senyawa jenis fenol atau polyphenolic (Pedraza-Chaverri, Cardenas-Rodriguez, Orozco-Ibarra dan Perez-Rojas, 2008). Golongan xanton yang sudah
teridentifikasi antara lain α-mangostin, -mangostin dan garsinon-E dilaporkan memiliki aktivitas farmakologi salah satunya sebagai antioksidan. Oleh karena itu ekstrak kulit buah manggis ditambahkan dalam sediaan gel sebagai zat aktif yang berfungsi sebagai antioksidan pada penelitian ini.
tegangan permukaan yang rendah dengan cairan biologi dan jaringan sehingga meminimalkan kekuatan adsorbsi protein dan adhesi sel. Selain itu kelebihan lainnya dari gel adalah saat pemakaian gel di kulit setelah kering meninggalkan film tembus pandang, daya lekat tinggi yang tidak menyumbat pori sehingga pernapasan pori tidak terganggu, mudah dicuci dengan air dan pelepasan obatnya baik (Lachman, Lieberman and Kanig, 1994).
Konsumen akan tertarik pada sediaan gel ekstrak kulit buah manggis tidak hanya dengan manfaatnya sebagai antioksidan saja, namun sediaan gel tersebut juga harus memiliki sifat fisik tertentu dengan kriteria yang dapat diterima oleh konsumen. Kemampuan gel untuk menyebar (mudah diaplikasikan) dan viskositasnya perlu diperhatikan dalam pembuatan sediaan ini. Viskositas yang cukup berkaitan dengan preparasi, pengemasan, penyimpanan dan aplikasi, sedangkan daya sebar gel berkaitan dengan kemampuan gel untuk menyebar saat diaplikasikan, kenyamanan saat penggunaan dan kemampuan gel dalam pelepasan zat aktifnya (Buchman, 2001).
sediaan gel terlalu banyak maka sediaan tersebut akan terlalu encer dan dapat mempengaruhi daya sebar dari sediaan, dan juga sebaliknya (Loden and Maibach, 2005). Kombinasi antara CMC-Na dan gliserin mampu membentuk gel dengan sifat fisik yang baik dan stabil. Sifat fisik sediaan gel yang diamati meliputi organoleptis, pH, daya sebar dan viskositas. Komposisi CMC-Na dan gliserin optimum yang digunakan sebagai gelling agent dan humektan pada gel ekstrak kulit buah manggis diperoleh dengan menggunakan metode desain faktorial. Desain faktorial dapat menunjukkan hubungan antara variabel bebas yang diteliti untuk menentukan efek dari beberapa faktor dan interaksinya yang berpengaruh secara signifikan. Metode desain faktorial memiliki kelebihan yakni memiliki efisiensi yang maksimum dalam memperkirakan efek masing-masing faktor, maupun efek interaksi antar faktor (Bolton and Bon, 2004). Pengujian aktivitas antioksidan sediaan gel ekstrak kulit buah manggis bertujuan untuk mengetahui kemampuan ekstrak kulit buah manggis dalam bereaksi dengan radikal bebas sebagai antioksidan saat diformulasikan dalam sediaan gel yang dibuat. Pengujian aktivitas antioksidan dilakukan dengan menggunakan DPPH.
G. Hipotesis
1. CMC-Na dan gliserin memiliki pengaruh signifikan terhadap sifat fisik gel ekstrak kulit buah manggis yang meliputi viskositas dan daya sebar.
3. Sediaan gel ekstrak kulit buah manggis secara fisik dapat menjaga kestabilannya dari uji sentrifugasi dan freeze thaw cycle.
34
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis rancangan penelitian yang dilakukan termasuk jenis penelitian eksperimental dengan menggunakan metode desain faktorial untuk membandingkan sifat fisik dan stabilitas fisik sediaan.
B. Variabel dan Definisi Operasional 1. Variabel Penelitian
a. Variabel bebas, dalam penelitian ini adalah variasi konsentrasi CMC-Na sebagai gelling agent dan gliserin sebagai humektan.
b. Variabel tergantung, dalam penelitian ini adalah sifat fisik gel yang meliputi organoleptis, pH, daya sebar dan viskositas serta stabilitas (perubahan viskositas) gel antioksidan kulit buah manggis (Garcinia mangostana L.). c. Variabel pengacau terkendali, dalam penelitian ini adalah kualitas ekstrak
kulit buah manggis, alat dan bahan yang digunakan, lama pengadukan, kecepatan pengadukan, prosedur pembuatan dan pengujian, lama penyimpanan, kondisi penyimpanan serta wadah penyimpanan gel.
2. Definisi Operasional
a. Gel antioksidan ekstrak kulit buah manggis (Garcinia mangostana L.) adalah sediaan semi padat yang mengandung ekstrak kulit buah manggis yang memiliki efek sebagai antioksidan untuk melindungi kulit dari paparan sinar matahari dengan CMC-Na sebagai gelling agent dan gliserin sebagai humektan.
b. Ekstrak kulit buah manggis adalah ekstrak kering hasil dari kulit buah manggis yang diperoleh dari PT. Industri Jamu Borobudur Semarang. c. Antioksidan adalah senyawa-senyawa yang mampu menghilangkan,
membersihkan, menahan pembentukan oksigen reaktif.
d. Radikal bebas adalah atom yang sangat reaktif dan mampu menjadi bagian dari molekul yang berpotensi merusak.
e. Gelling agent adalah bahan yang digunakan untuk membentuk kekentalan atau pembentuk sediaan gel yang membentuk matriks. CMC-Na digunakan sebagai gelling agent dalam penelitian ini.
f. Humektan adalah bahan yang digunakan untuk mencegah lepasnya air dari sediaan serta mengabsorpsi lembab dari lingkungan saat gel diaplikasikan di kulit, sehingga kelembaban kulit dapat dipertahankan. Humektan yang digunakan dalam penelitian ini adalah gliserin.
g. Sifat fisik gel adalah parameter untuk mengetahui kualitas fisik gel yang meliputi organoleptis, pH, daya sebar dan viskositas.
organoleptis, pH, viskositas, daya sebar dan sedimentasi yang terjadi setelah sediaan diuji stabilitasnya menggunakan metode freeze thaw cycle.
i. Daya sebar adalah kemampuan menyebar dari gel ekstrak kulit buah manggis yang diukur menggunakan horizontal double plate selama 1 menit dengan beban 125 gram.
j. Viskositas adalah tingkat kekentalan gel antioksidan ekstrak kulit buah manggis yang diukur menggunakan viscotester. Viskositas gel diketahui dengan mengamati gerakan jarum penunjuk viskositas. Hal ini berkaitan denagn kemampuan gel ekstrak kulit buah manggis untuk dituang dan keluar dari wadah.
k. Sifat alir adalah adalah istilah yang digunakan untuk menggambarkan aliran cairan dan deformasi dari padatan.
l. Formula gel optimum adalah formula gel yang memenuhi standar sediaan semisolid yang ditetapkan meliputi daya sebar 19,64-38,5 cm2, viskositas 150-250 dPa.s dan perubahan viskositas ≤10%.
C. Alat dan Bahan Penelitian 1. Alat Penelitian
2. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah aquadest, ekstrak kulit buah manggis yang diperoleh dari PT. Borobudur Semarang, gliserin (kualitas farmasetis), propilenglikol (kualitas farmasetis), DPPH, CMC-Na (kualitas farmasetis), metil paraben (kualitas farmasetis) serta etanol 96% (teknis).
D. Tata Cara Penelitian
1. Verifikasi Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)
Ekstrak kulit buah manggis yang diperoleh dari PT. Borobudur Industri Jamu Semarang diamati. Verifikasi ekstrak kulit buah manggis yang dilakukan meliputi pengamatan bentuk, warna serta bau dan dibandingkan dengan Certificate of Analysis dari ekstrak kulit buah manggis.
2. Uji Aktivitas Antioksidan Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)
a. Pembuatan Ekstrak Kental
b. Penyiapan Ekstrak Uji
Sebanyak 100,0 mg ekstrak kental kulit buah manggis dilarutkan menggunakan etanol 96% dalam labu ukur 100,0 mL, lalu diaduk hingga homogen untuk membuat larutan stok dengan konsentrasi 1000,0 ppm. Selanjutnya dibuat 5 larutan seri dengan diambil sebanyak 0,3; 0,4; 0,5; 0,75 dan 1,5 mL dari larutan stok, kemudian ditambahkan etanol 96% dalam labu ukur 25,0 mL sehingga diperoleh konsentrasi larutan seri sebesar 12,0; 16,0; 20,0; 30,0 dan 60 ppm.
c. Pembuatan Larutan DPPH
Sebanyak 2,0 mg DPPH dilarutkan dengan menggunakan etanol 96% dalam labu ukur 50,0 mL untuk membuat konsentrasi 40,0 ppm (larutan dilindungi dari cahaya).
d. Penentuan Panjang Gelombang Maksimum
Larutan DPPH 40,0 ppm diambil sebanyak 4,0 mL lalu ditambah dengan etanol 96% sebanyak 2,0 mL, lalu diamati absorbansinya pada panjang gelombang 400-800 nm. Larutan etanol 96% sebanyak 6 mL digunakan sebagai blanko. Panjang gelombang yang memberikan absorbansi tertinggi digunakan sebagai panjang gelombang maksimum. e. Penetapan Operating Time
30 menit). Larutan DPPH dengan konsentrasi 40,0 ppm sebanyak 4,0 mL ditambah dengan etanol 96% sebanyak 2,0 mL digunakan sebagai blanko. f. Pengukuran Aktivitas Antioksidan Kulit Buah Manggis
Larutan uji sebanyak 2,0 mL pada masing-masing konsentrasi seri ditambah dengan 4,0 mL larutan DPPH 40,0 ppm, lalu didiamkan selama OT dan diamati absorbansinya pada panjang gelombang maksimum yang telah didapatkan. Larutan DPPH dengan konsentrasi 40,0 ppm sebanyak 4,0 mL ditambah dengan etanol 96% sebanyak 2,0 mL digunakan sebagai blanko. Selanjutnya dilakukan perhitungan nilai inhibisi ekstrak dari persamaan regresi yang telah didapatkan untuk mendapatkan nilai IC50.
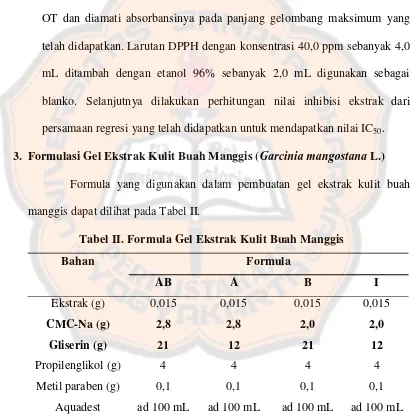
3. Formulasi Gel Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) Formula yang digunakan dalam pembuatan gel ekstrak kulit buah manggis dapat dilihat pada Tabel II.
Tabel II. Formula Gel Ekstrak Kulit Buah Manggis
Bahan Formula
AB A B I
Ekstrak (g) 0,015 0,015 0,015 0,015
CMC-Na (g) 2,8 2,8 2,0 2,0
Gliserin (g) 21 12 21 12
Propilenglikol (g) 4 4 4 4
Metil paraben (g) 0,1 0,1 0,1 0,1
Aquadest ad 100 mL ad 100 mL ad 100 mL ad 100 mL
Pembuatan gel ekstrak kulit buah manggis sebagai berikut:
dengan propilenglikol dan gliserin, diaduk sesaat dan kemudian dicampurkan metil paraben lalu diaduk menggunakan mixer hingga homogen. Setelah itu CMC-Na yang telah dikembangkan ditambahkan ke dalam campuran beserta dengan sisa aquadest lalu kembali diaduk menggunakan mixer dengan skala kecepatan 1 selama ±3 menit. Kemudian pH sediaan dicek menggunakan stik indikator pH universal (pH yang diinginkan dalam rentang 4,8-6,5).
4. Uji Sifat Fisik Gel Antioksidan Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)
a. Uji organoleptis dan pH
Uji organoleptis dilakukan dengan cara mengamati warna, bau dan bentuk dari gel setelah 48 jam gel selesai dibuat. Pengujian pH dilakukan dengan menggunakan pH universal stick dengan cara mengoleskan sedikit gel pada stik pH dan membandingkan warna yang dihasilkan dengan standar. Nilai pH yang diinginkan adalah 4,5-6,5 yaitu pH kulit sehingga kulit tidak teriritasi karena perbedaan pH.
b. Uji daya sebar
Pengujian daya sebar dilakukan setelah 48 jam gel selesai dibuat dan lakukan sebanyak 3 kali replikasi.
c. Uji viskositas
Uji viskositas dilakukan yaitu 48 jam setelah pembuatan gel serta dilakukan sebanyak 3 kali replikasi. Viskositas masing-masing formula gel ditentukan dengan menggunakan alat Viscotester Rion seri VT 04. Gel dimasukkan ke dalam wadah uji, lalu portable viscometer dipasang. Viskositas gel diketahui dengan mengamati gerakan jarum penunjuk viskositas, rotor yang digunakan adalah rotor skala dua.
d. Uji sifat alir gel
5. Uji Stabilitas Gel Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) a. Freeze Thaw Cycle
Uji Freeze Thaw dilakukan dengan cara masing-masing formula disimpan pada suhu -4oC selama 24 jam, lalu kembali disimpan pada suhu ±25oC selama 24 jam (untuk 1 siklus). Penyimpanan dilakukan sebanyak 6 siklus dan setiap akhir siklus dilakukan pengamatan sifat fisik dari setiap formula gel seperti pH, organoleptis, daya sebar dan viskositas.
b. Uji viskositas
Formula AB, A, B dan I diukur viskositasnya menggunakan viscometer VT 04. Gel dimasukkan ke dalam wadah uji kemudian portable viscometer dipasang, dan digunakan rotor 2. Kemudian angka yang ditunjukkan oleh jarum dicatat dan dilakukan pada masing-masing replikasi. Uji viskositas dilakukan yaitu tiap siklus pada freeze thaw cycle.
c. Uji daya sebar
d. Uji pH
Formula AB, A, B dan I diukur nilai pHnya menggunakan kertas indikator pH. Uji pH dilakukan yaitu tiap siklus pada freeze thaw cycle. Pengujian pH dilakukan dengan menggunakan pH universal stick dengan cara mengoleskan sedikit gel pada stik pH dan membandingkan warna yang dihasilkan dengan standar. Nilai pH yang diinginkan adalah 4,5-6,5 yaitu pH kulit sehingga kulit tidak teriritasi karena perbedaan pH.
e. Uji sentrifugasi
Dilakukan uji sentrifugasi terhadap formula AB, A, B dan I setelah 48 jam pembuatan. Tiap formula diuji sentrifugasi dengan cara gel dimasukkan ke dalam tabung sentrifugasi, kemudian dimasukkan ke dalam mesin sentrifugasi dan sistem dijalankan dengan kecepatan 3750 rpm selama 5 jam dan diamati pemisahan yang terjadi pada masing-masing gel tiap formula.
6. Uji Aktivitas Antioksidan Gel Ekstrak Kulit Buah Manggis (Garcinia mangostana L.)
Larutan uji sebanyak 2,0 mL pada masing-masing konsentrasi seri sediaan pada tiap formula ditambah dengan 4,0 mL larutan DPPH 40,0 ppm, lalu didiamkan selama OT dan diamati absorbansinya pada panjang gelombang maksimum yang telah didapatkan. Larutan DPPH dengan konsentrasi 40,0 ppm sebanyak 4,0 mL ditambah dengan etanol 96% sebanyak 2,0 mL digunakan sebagai blanko.
E. Analisis Hasil
Data yang diperoleh pada penelitian ini adalah data aktivitas antioksidan, sifat fisik dan stabilitas fisik sediaan gel ekstrak kulit buah manggis. Data kemudian dianalisis menggunakan software RStudio untuk mengetahui signifikansi perbedaan antara data yang diperoleh.
Data sifat fisik yang diperoleh, dihitung rata-rata dan dicari standar deviasinya. Dari data sifat fisik, viskositas dan daya sebar dianalisis menggunakan Design Expert 9.0.6.2 sehingga didapatkan interaksi dari kedua faktor pada dua level untuk masing-masing respon. Analisis statistik yang digunakan Design Expert 9.0.6.2 adalah uji ANOVA dengan taraf kepercayaan 95%.
45
BAB IV
HASIL DAN PEMBAHASAN
A.Verifikasi Ekstrak Kulit Buah Manggis
Tujuan verifikasi ekstrak kulit buah manggis adalah untuk membuktikan bahwa ekstrak yang digunakan dalam penelitian merupakan benar ekstrak kulit buah manggis. Verifikasi ekstrak kulit buah manggis yang dilakukan meliputi pengamatan bentuk, warna dan bau yang kemudian dibandingkan dengan karakteristik ekstrak yang ada pada Certificate of Analysis (CoA). Ekstrak kulit buah manggis (Garcinia mangostana L.) yang digunakan pada penelitian diperoleh dari PT. Borobudur Industri Jamu Semarang.
Tabel III. Hasil Verifikasi Ekstrak Kulit Buah Manggis Kriteria Hasil Pengamatan Data CoA
Bentuk Serbuk halus Serbuk halus
Warna Coklat Coklat
Bau Bau khas aromatis Bau khas romatis
Hasil pengamatan menunjukkan bentuk, warna dan bau dari ekstrak kulit buah manggis sesuai dengan yang terdapat pada CoA dari PT. Borobudur Industri Jamu. Dari tabel III dapat disimpulkan bahwa ekstrak yang digunakan di dalam penelitian adalah benar ekstrak kulit buah manggis.
B.Uji Aktivitas Antioksidan Ekstrak Kulit Buah Manggis