HASIL INDUKSI MUTASI
ANDINA FABRINI FIRDAUSYA
A24070057
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2012
RINGKASAN
ANDINA FABRINI FIRDAUSYA. Analisis Pertumbuhan, Morfologi, dan Kualitas Tanaman Hias Krisan (Dendranthema grandiflora Tzvelev) Hasil Induksi Mutasi. Dibimbing oleh NURUL KHUMAIDA dan RAHMI YUNIANTI.
Tujuan penelitian ini adalah untuk mempelajari pertumbuhan, morfologi, dan kualitas tanaman hias krisan (Dendranthema grandiflora Tzvelev) hasil induksi mutasi. Penelitian dilaksanakan pada bulan Februari hingga bulan September 2011 di Desa Nongkojajar, Pasuruan, Jawa Timur.
Percobaan menggunakan rancangan kelompok lengkap teracak (RKLT) dengan perlakuan faktor tunggal, yaitu varian hasil induksi mutasi. Varian yang digunakan merupakan hasil induksi mutasi melalui radiasi sinar gamma (0 dan 20 Gy) dan melalui perendaman dalam EMS 0.77% (0, 105, 120 menit). Varian yang digunakan, yaitu PN 0 (kontrol), PN 20, DR 0 (kontrol), DR 20, PA 0 (kontrol), PA 105, PA 120, CDK 0 (kontrol), CDK 105, dan CDK 120.
Penelitian dilaksanakan pada generasi M2V1 dan M2V2. Hasil penelitian menunjukkan bahwa respon pertumbuhan tinggi tanaman dan jumlah ruas batang terhadap induksi mutasi pada generasi M2V1 memiliki pola linier negatif, sedangkan pada generasi M2V2 memiliki pola kuadratik. Pengamatan kualitas bunga pada kedua generasi menunjukkan bahwa terjadi penurunan kualitas bunga pada generasi M2V2 dibandingkan pada generasi M2V1. Meskipun demikian, induksi mutasi tidak mengakibatkan perubahan pada periode kesegaran bunga dalam vas (vase life).
Induksi mutasi melalui perendaman dalam EMS 0.77% menghasilkan lebih banyak variasi dibandingkan induksi melalui radiasi sinar gamma. Beberapa varian hasil induksi mutasi melalui perendaman dalam EMS 0.77% mengalami perubahan morfologi daun, yaitu berbentuk hati dan variegata. Induksi mutasi melalui radiasi sinar gamma hanya menghasilkan daun variegata. Beberapa varian hasil induksi mutasi melalui perendaman dalam EMS 0.77% memiliki bunga pita berbentuk tunggal dengan variasi jarum, dan berbentuk tunggal dengan variasi dayung. Variasi warna bunga pita tujuh varian hasil induksi mutasi yang
dihasilkan diantaranya adalah mimosa, wine red, ruby red, dan rose. Pengamatan terhadap jumlah stomata dan jumlah kloroplas dalam sel penjaga menunjukkan kecenderungan tidak berbeda nyata.
ANALISIS PERTUMBUHAN, MORFOLOGI, DAN KUALITAS TANAMAN HIAS KRISAN (Dendranthema grandiflora Tzvelev)
HASIL INDUKSI MUTASI
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
ANDINA FABRINI FIRDAUSYA A24070057
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR 2012
Judul
:
Nama :
NIM
:
Menyetujui, Dosen Pembimbing Pembimbing I Pembimbing IIDr. Ir. Nurul Khumaida, MSi Dr. Rahmi Yunianti, SP., MSi NIP.19650719 199512 2 001 NIP. 19720617 199702 2 002
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr. NIP. 19611101 198703 1 003
Tanggal Lulus :
ANALISIS PERTUMBUHAN, MORFOLOGI, DAN
KUALITAS TANAMAN HIAS KRISAN (Dendranthema
grandilora Tzvelev) HASIL INDUKSI MUTASI
ANDINA FABRINI FIRDAUSYA
A24070057
RIWAYAT HIDUP
Penulis lahir pada tanggal 19 Februari 1989 di Kabupaten Jember, Propinsi Jawa Timur. Penulis merupakan anak ketiga dari empat bersaudara dari pasangan Bapak Fatkhurrahman dan Ibu Erma Suryani.
Penulis memulai pendidikan formal pada tahun 1995 di SDN Tanjungsari II, Sidoarjo. Penulis melanjutkan pendidikan di SLTPN 2 Taman selama tiga tahun, kemudian dilanjutkan di SMAN 1 Taman selama tiga tahun. Penulis diterima di IPB melalui jalur USMI pada tahun 2007.
Selama menjadi mahasiswa di IPB, penulis mendapat beasiswa dari Perhimpunan Orang Tua Mahasiswa (POM IPB) periode 2007-2008, dan beasiswa dari BRI periode 2008-2010. Penulis aktif pada Himpunan Mahasiswa Islam sebagai pengurus selama 3 tahun dan Dewan Perwakilan Mahasiswa Fakultas Pertanian, IPB selama 1 tahun. Penulis terlibat dalam kepanitiaan Seminar Nasional Perhimpunan Hortikultura Indonesia yang diadakan pada bulan November 2011. Penulis pernah menjadi asisten praktikum Ekologi Pertanian pada tahun 2010. Selain itu, sejak bulan Februari 2012 penulis menjadi asisten peneliti Hibah Tim Peneliti Pasca Sarjana (HTPP).
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah memberikan kekuatan dan hidayah sehingga skripsi yang berjudul “Analisis Pertumbuhan, Morfologi, dan Kualitas Tanaman Hias Krisan (Dendranthema grandiflora Tzvelev) Hasil Induksi Mutasi” dapat diselesaikan dengan baik. Sebagian hasil penelitian telah dipresentasikan pada Seminar Nasional Perhimpunan Hortikultura Indonesia 2011 dengan judul “Analisis Pertumbuhan dan Morfologi Tanaman Hias Krisan (Dendranthema grandiflora Tzvelev) Hasil Induksi Mutasi” dan “Karakterisasi Morfologi Bunga dan Kualitas Bunga Beberapa Varian Krisan (Dendranthema
grandiflora Tzvelev) Hasil Induksi Mutasi”.
Penulis menyampaikan terimakasih dan penghargaan sebesar-besarnya kepada semua pihak yang telah membantu sehingga skripsi ini dapat diselesaikan. Ucapan terimakasih penulis sampaikan kepada:
1. Dr. Ir. Nurul Khumaida, MSi dan Dr. Rahmi Yunianti, SP., MSi selaku dosen pembimbing skripsi yang telah memberikan bimbingan dan pengarahan serta semangat dalam penyusunan skripsi.
2. Dr. Ir. Adiwirman, MSi dan Dr. Ir. Sugiyanta, MSi selaku dosen Pembimbing Akademik yang telah memberikan pengarahan dan bimbingan akademik selama masa perkuliahan.
3. Seluruh staf pengajar dan staf komisi pendidikan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB
4. PT. Primakelola IPB atas bantuan biaya penelitian dan seluruh karyawan PPK-Sampoerna atas waktu dan perhatian yang diberikan.
5. Kedua orang tua, kakak, adik, serta sahabat seperjuangan atas do’a, kasih sayang, motivasi, kepercayaan, dan nasihat yang diberikan.
6. Keluarga besar AGH 44 dan warga Desa Nongkojajar yang telah memberikan bantuan dan ketulusan hati selama penulis melaksanakan penelitian.
Semoga hasil penelitian ini dapat memperkaya ilmu pengetahuan dan bermanfaat bagi kita semua.
Bogor, Februari 2012 Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1 Latar Belakang ... 3 Tujuan ... 3 Hipotesis ... 3 TINJAUAN PUSTAKA ... 4 Morfologi Krisan ... 4
Syarat Tumbuh Krisan ... 4
Perbanyakan Krisan ... 5
Kualitas Bunga Krisan ... 6
Mutasi ... 7
Radiasi ... 9
Ethyl Methane Sulphonate ... 12
Kloroplas ... 13
BAHAN DAN METODE ... 16
Tempat dan Waktu ... 16
Bahan dan Alat ... 16
Metode ... 17
HASIL DAN PEMBAHASAN ... 22
Kondisi Umum Pertanaman ... 22
Pertumbuhan Vegetatif M2V1 ... 23
Pertumbuhan Vegetatif M2V2 ... 28
Karakter Morfologi Daun ... 35
Karakter Morfologi Bunga ... 40
Jumlah Stomata dan Kloroplas ... 47
KESIMPULAN DAN SARAN ... 50
Saran ... 50 DAFTAR PUSTAKA ... 51 LAMPIRAN ... 55
DAFTAR TABEL
No. Halaman
1. Sifat Fisik dan Kimia EMS ... 12
2. Asal Planlet yang Digunakan ... 16
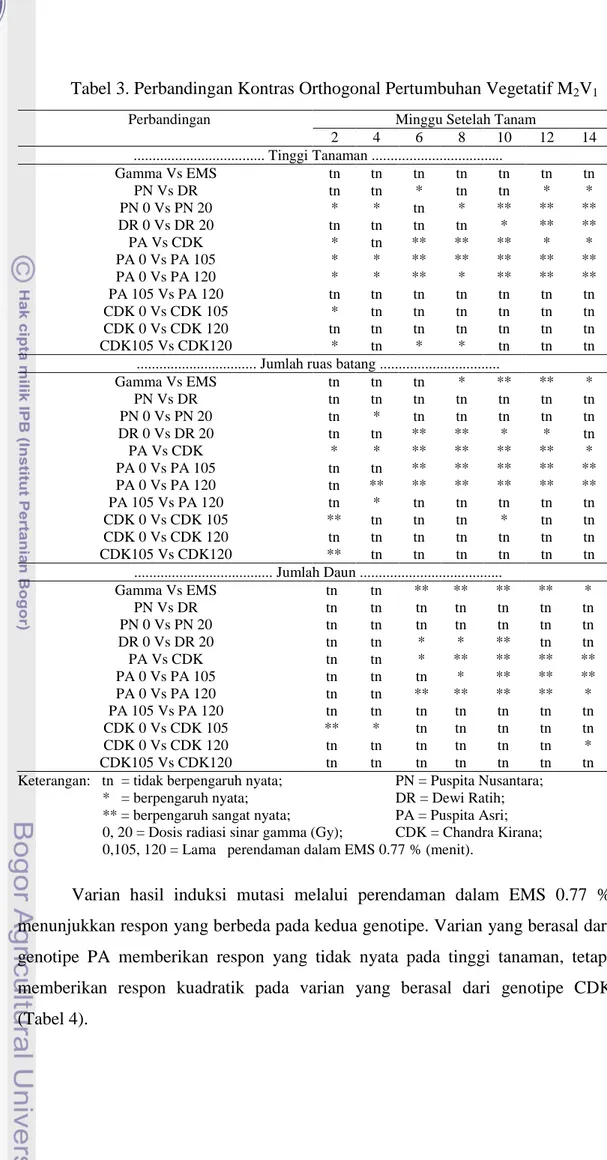
3. Perbandingan Kontras Orthogonal Pertumbuhan Vegetatif M2V1 ... 25
4. Respon Tinggi Tanaman pada Setiap Taraf Lama Perendaman dalam EMS 0.77 % ... 26
5. Respon Jumlah Ruas Batang pada Setiap Taraf Lama Perendaman dalam EMS 0.77 % ... 27
6. Respon Jumlah Daun pada Setiap Taraf Lama Perendaman dalam EMS 0.77 % ... 28
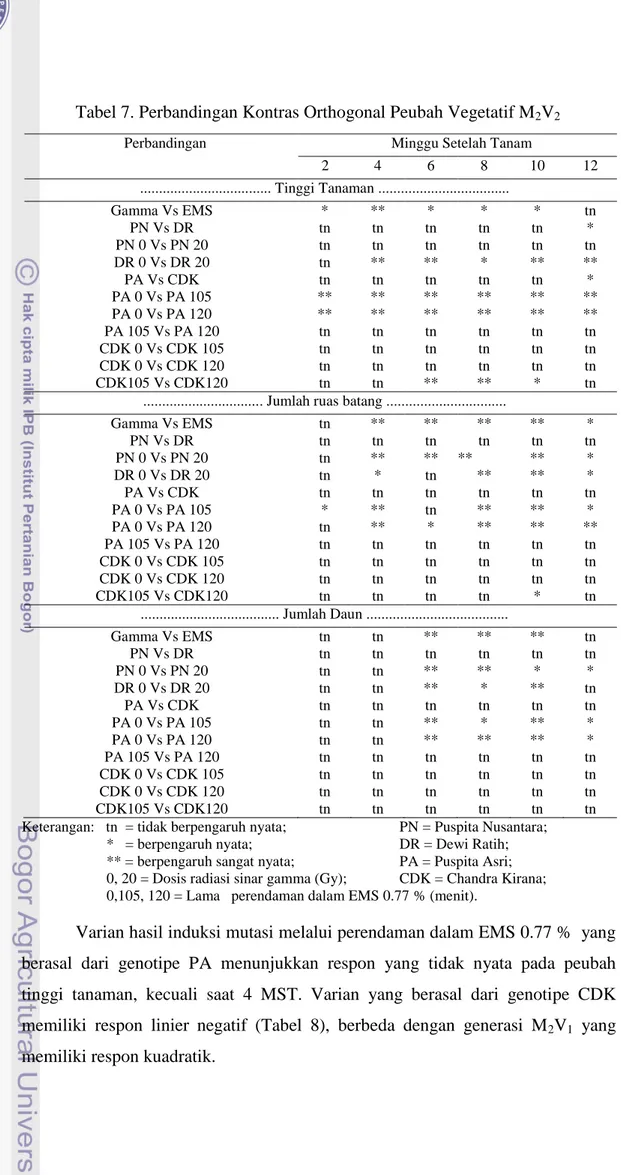
7. Perbandingan Kontras Orthogonal Peubah Vegetatif M2V2 ... 30
8. Respon Tinggi Tanaman pada Setiap Taraf Lama Perendaman dalam EMS 0.77 % ... 31
9. Respon Jumlah Ruas Batang pada Setiap Taraf Lama Perendaman dalam EMS 0.77 % ... 32
10. Respon Jumlah Daun pada Setiap Taraf Lama Perendaman dalam EMS 0.77 % ... 33
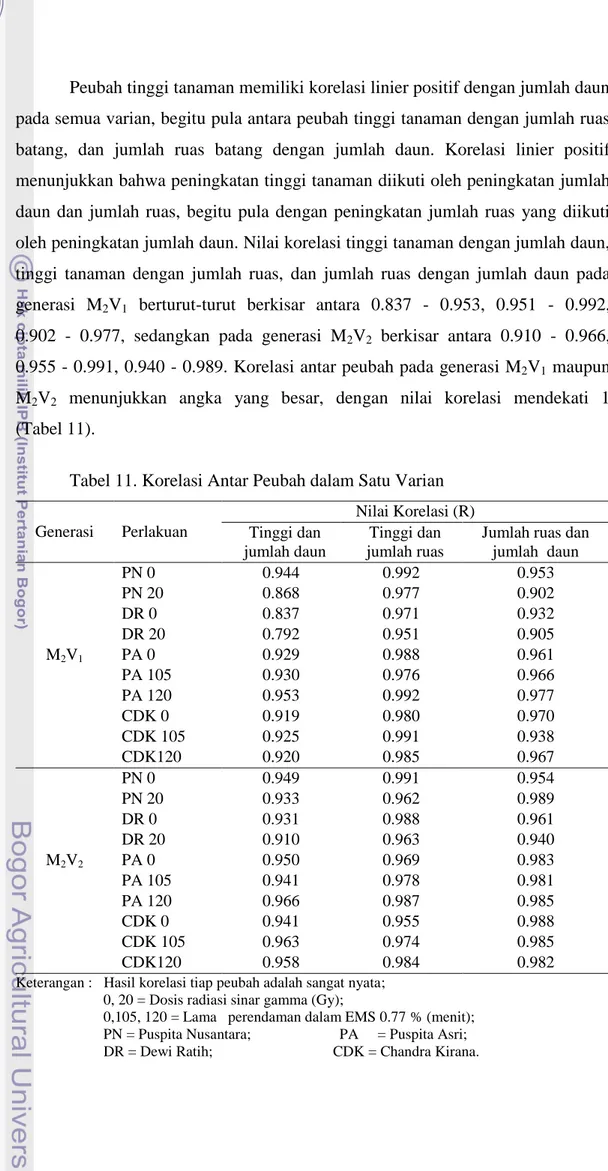
11. Korelasi Antar Peubah dalam Satu Varian …... 34
12. Korelasi Peubah Antar Generasi M2V1 dan M2V2 …... 35
13. Bentuk dan Warna Bunga Akibat Induksi Mutasi …... 42
14. Perbandingan Kontras Orthogonal Saat Panen ………... 43
15. Fenotipe Krisan Hasil Induksi Mutasi (Saat Panen) …... 44
16. Analisis Ragam Gabungan Antara M2V1 dan M2V2 ………... 45
17. Perbandingan Kontras Orthogonal Antara M2V1 dan M2V2 ... 45
18. Umur Berbunga, Respon Time, dan Daya Tahan Bunga dalam Vas (Vase life) ... 46
19. Kontras Orthogonal Umur Berbunga dan Respon Time ... 47
20. Kontras Orthogonal Jumlah Stomata dan Jumlah Kloroplas ... 48
DAFTAR GAMBAR
No. Halaman
1. Spektrum Elektromagnetik ... 10 2. Tahapan Perbanyakan Bibit Krisan Generasi M0 Hingga M2V2 ... 18 3. Hama dan Penyakit Tanaman ... 22 4. Respon Tinggi Tanaman Krisan Genotipe CDK Akibat Induksi
Mutasi melalui Perendaman dalam EMS 0.77 % saat 12 MST ... 26 5. Respon Jumlah Ruas Batang Krisan Genotipe CDK Akibat
Induksi Mutasi melalui Perendaman dalam EMS 0.77 % saat 12 MST ... 27 6. Respon Tinggi Tanaman Krisan CDK Akibat Induksi Mutasi
melalui Perendaman dalam EMS 0.77% saat 12 MST ... 31 7. Respon Jumlah Ruas Batang pada Setiap Taraf Lama Perendaman
dalam EMS 0.77 % ... 32 8. Respon Jumlah Daun pada Setiap Taraf Lama Perendaman dalam
EMS 0.77 % saat 12 MST ... 33 9. Daun Varian Hasil Induksi Mutasi ... 36 10. Morfologi Daun Krisan ... 38 11. Perubahan Warna dan Bentuk Daun Akibat Induksi Mutasi pada
Generasi M2V1 ... 39 12. Daun PA 105 generasi M2V2 ... 39 13. Bunga Krisan Hasil Induksi Mutasi ... 41
DAFTAR LAMPIRAN
No. Halaman
1. Deskripsi Varietas Asal yang Digunakan ... 56
2. Bentuk Bunga Krisan ... 59
3. Bentuk Bunga Pita ... 60
4. Colour Chart untuk Rainforest Flower ... 61
5. Alur Perubahan Warna Bunga Akibat Induksi Mutasi ... 62
6. SNI Bunga Krisan Potong ... 63
7. Rekapitulasi Sidik Ragam Peubah Vegetatif M2V1 ... 64
PENDAHULUAN
Latar Belakang
Tanaman hias sebagai komoditas pertanian yang memiliki nilai ekonomi cukup tinggi, telah diusahakan secara komersial sejak lama. Keindahan dan daya tarik yang dimiliki oleh tanaman hias merupakan alasan mengapa peminatnya cukup besar. Berbagai jenis tanaman hias yang memiliki nilai komersial di Indonesia diantaranya adalah anggrek, krisan, mawar, anyelir, anthurium, gladiol, gerbera, amaryllis, sedap malam, aster, dan melati (Widyawan dan Prahastuti, 1994).
Krisan merupakan salah satu tanaman hias yang penting, baik sebagai bunga potong maupun bunga pot. Produksi tanaman krisan menunjukkan peningkatan setiap tahunnya. Tahun 2010, produksi krisan di Indonesia bahkan merupakan yang tertinggi dibandingkan tanaman hias lainnya. Produksi tanaman ini mencapai 185 232 970 tangkai (Badan Pusat Statistik, 2011). Produksi yang dilakukan merupakan upaya untuk memenuhi permintaan krisan yang cukup besar. Permintaan krisan menduduki urutan tertinggi diantara bunga potong lainnya karena memiliki bentuk mahkota dan warna yang indah, selain itu bunga ini memiliki harga yang cukup murah dibandingkan tanaman hias lain (Widyawan dan Prahastuti, 1994).
Tanaman krisan yang dikembangkan di Indonesia berasal dari varietas lokal dan introduksi. Meskipun demikian, penggunaan varietas lokal kurang berkembang bila dibandingkan dengan varietas introduksi yang memiliki bentuk dan warna lebih beragam. Oleh karena itu, diperlukan upaya perakitan varietas baru yang memiliki bentuk serta warna yang beraneka ragam. Peningkatan keragaman tanaman ini dapat dilakukan dengan hibridisasi ataupun mutasi buatan.
Mutasi merupakan salah satu cara untuk memperluas keragaman genetik tanaman dalam waktu singkat. Induksi mutasi dapat dilakukan dengan menggunakan mutagen fisik ataupun kimia. Salah satu mutagen fisik yang digunakan adalah radiasi sinar gamma, sedangkan mutagen kimia yang dapat digunakan adalah Ethyl Methane Sulphonate (EMS).
Kromosom merupakan pembawa gen yang disusun oleh asam nukleat yang terdiri dari DNA dan RNA. DNA merupakan senyawa polinukleotida yang terdiri dari komponen gula deoksiribosa, basa (purin dan pirimidin), dan fosfat. Basa purin terdiri dari adenin dan guanin, sedangkan pirimidin terdiri dari timin dan sitosin. Radiasi dapat menembus bagian tertentu dari kromosom yang dapat menyebabkan perubahan bahan DNA (Jusuf, 2001). Akibat tidak langsung yang terjadi adalah radiasi menimbulkan perubahan zat kimia tertentu disekitar gen yang menghasilkan perubahan susunan nukleotida (Crowder, 2006).
Susunan nukleotida dalam gen merupakan pengkode bagi protein yang ditentukan dari urutan asam aminonya, karena itu perubahan susunan nukleotida akan menentukan protein yang dihasilkan dan fungsinya (Salisbury and Ross, 1995). Radiasi pengionisasi diketahui menyebabkan mutasi pada gen dalam perbandingan lurus dengan dosis radiasinya (Elrod and Stansfield., 2007). Jumlah radiasi yang sama dengan intensitas tinggi untuk waktu pendek atau intensitas rendah dengan waktu panjang, atau dosis berselang-seling akan menimbulkan jumlah mutasi yang sama (Crowder, 2006).
EMS merupakan mutagen kimia yang digunakan secara luas pada tanaman karena menyebabkan mutasi gen dengan frekuensi tinggi dan penyimpangan kromosom dengan frekuensi rendah. Mutagen kimia EMS memiliki frekuensi mutasi pada mutan M1 dan M2 dari 2 hingga 4 kali lebih tinggi dibandingkan dengan sinar gamma (Filippetti and De Pace, 1986). Selain itu, generasi tanaman yang semakin jauh dari M0 akan menghasilkan lebih banyak mutan. Berdasarkan penelitian Arulbalachandran et al. (2010), pada mutan yang diisolasi dari tanaman black gram (Vigna mungo (L.) Hepper yang telah diberi perlakuan dengan sinar gamma dan EMS pada generasi M4 dihasilkan lebih banyak mutan dibandingkan generasi sebelumnya.
EMS menyebabkan mutasi transisi pada DNA dengan mengubah basa guanin dan timin (GT) menjadi adenin dan timin (AT), serta adenin dan timin (AT) menjadi guanin dan timin (GT). Telah diperoleh pula bukti yang menjelaskan bahwa EMS dapat menyebabkan penyisipan (insersi) atau penghilangan (delesi) pasangan basa serta penghapusan intragenik lebih luas. Pada organisme tingkat tinggi, EMS mampu mematahkan kromosom, meskipun
belum dipahami mekanismenya. Selain itu, ethylasi basa DNA oleh EMS (umumnya pada posisi N-7 dari guanin) secara bertahap menghidrolisis deoxiribosa pada backbone DNA meninggalkan sebuah situs purin (atau mungkin pirimidin) yang stabil dan dapat menyebabkan kerusakan untaian tunggal DNA (Sega, 1984).
Upaya pemberian radiasi sinar gamma telah dilaporkan berhasil merakit keragaman baru tanaman hias. Sebagai contoh, pemberian radiasi pada gerbera dengan dosis rendah (500 rad) secara nyata merangsang terbentuknya tunas, sedangkan radiasi lebih dari 1000 rad menghambat munculnya tunas, akar, dan jumlah akar yang terbentuk pada tunas-tunas in vitro (Prasetyorini, 1991). Selain itu, radiasi sinar gamma pada krisan dapat mengakibatkan perubahan bentuk bunga, warna bunga, kandungan klorofil pada daun, dan antosianin pada bunga (Kendarini, 2006).
Selain pemberian radiasi sinar gamma, perlakuan EMS juga dapat menginduksi mutasi pada beberapa tanaman. Latado et al. (2004) melaporkan bahwa pemberian perlakuan EMS menyebabkan perubahan warna bunga pada tanaman krisan cv. Ingrid yang memiliki petal berwarna dark pink menjadi berwarna pink-salmon, bronze, salmon, dan kuning. Subhash et al. (1997), juga telah menghasilkan tanaman cabai (Capsicum annuum L.) tahan lincomycin setelah diinduksi menggunakan EMS.
Tujuan
Tujuan penelitian ini adalah untuk mempelajari pertumbuhan, morfologi, dan kualitas tanaman hias krisan (Dendranthema grandiflora Tzvelev) hasil induksi mutasi.
Hipotesis
Dari varian yang diuji terdapat satu atau lebih varian krisan yang mengalami perubahan pertumbuhan, morfologi dan kualitas bunga.
TINJAUAN PUSTAKA
Morfologi Krisan
Bunga krisan memiliki banyak varietas atau kultivar. Dewan Standarisasi Nasional (1998) mengelompokkan bunga krisan sebagai berikut:
a. Tunggal : bunga hanya berdiri sendiri pada tangkainya. Piringan dasar bunga lebih sempit daripada lingkar mahkota.
b. Anemone : bunga mirip seperti bunga tunggal, tetapi piringan dasarnya lebih besar dan lebih tebal.
c. Pompon : bunga berbentuk bulat seperti bola, mahkota bunga menyebar ke semua arah dan piringan dasar tidak tampak.
d. Dekoratif : bentuk bunga seperti aster, tidak tampak piringan dasarnya, mahkota bunga bertumpuk rapat, di tengah pendek dan makin ke tepi makin panjang.
e. Bunga besar : bunga hanya berdiri sendiri pada tangkainya, piringan dasar bunga tidak tampak, garis tengah bunga lebih besar dari 10 cm. Bunga krisan besar ini dibagi lagi menjadi empat sub golongan, yaitu:
1. Incurve : ujung mahkota bunga melekuk ke dalam. 2. Kiku : ujung mahkota bunga melekuk ke luar.
3. Spider : mahkota bunga pipih dan panjang seperti kaki laba-laba.
4. Spoon : seperti spider tetapi ujung mahkota bunga agak melebar sehingga berbentuk seperti sendok.
Selain itu, kuntum bunga krisan memiliki karakter masing-masing, yaitu standar dan spray. Krisan standar memiliki satu kuntum bunga berukuran besar tiap tangkai, sedangkan tipe spray memiliki sekitar 10-20 kuntum bunga dengan diameter 2-3 cm.
Syarat Tumbuh Krisan
Krisan tumbuh dengan baik di dataran medium hingga tinggi, yaitu pada kisaran 600-1200 m dpl. Krisan kurang menyukai cahaya matahari dan percikan air hujan langsung serta tanah yang tergenang. Hujan deras atau curah hujan tinggi yang langsung menerpa tanaman krisan dapat menyebabkan tanaman
mudah roboh, rusak, dan menghasilkan bunga dengan kualitas rendah. Oleh karena itu, budidaya krisan di daerah bercurah hujan tinggi dapat dilakukan di dalam bangunan rumah lindung berupa rumah plastik atau rumah kaca. Sifat fisik media tumbuh optimal untuk tanaman krisan, yaitu memiliki kerapatan jenis 0.2-0.8 g/cm (berat kering), total porositas 50-75 %, kandungan udara dalam pori 10-20 %, kandungan garam terlarut 1-1.25 dS/m dan kisaran pH 5.5-6.5 (Balithi, 2008).
Krisan dapat tumbuh pada kisaran suhu harian 17-30 °C. Tanaman krisan membutuhkan kisaran suhu harian 22-28 °C pada siang hari dan tidak melebihi 26 °C pada malam hari untuk pertumbuhan optimal saat fase vegetatif. Suhu juga berpengaruh terhadap kualitas bunga yang dihasilkan. Suhu harian ideal pada fase generatif adalah 16-18 °C. Apabila suhu lebih dari 18 °C, bunga yang dihasilkan cenderung berwarna kusam, pucat, dan memudar (Balithi, 2008).
Kelembaban udara juga berpengaruh terhadap pertumbuhan bunga krisan. Tanaman krisan membutuhkan kelembaban 90-95 % pada awal pertumbuhan untuk pertumbuhan akar. Sedangkan pada tanaman dewasa, pertumbuhan optimal tercapai pada kelembaban udara sekitar 70-85 % (Balithi, 2008).
Perbanyakan Krisan
Perbanyakan krisan dapat dilakukan secara generatif dan vegetatif. Perbanyakan krisan secara generatif jarang dilakukan karena sulit dan bersifat heterozigot sehingga keturunan dari biji tidak sama dengan induknya. Selain itu, perbanyakan secara generatif membutuhkan waktu lama dan penanganan khusus. Perbanyakan krisan secara vegetatif biasanya dilakukan melalui setek pucuk, anakan, dan kultur jaringan. Perbanyakan melalui setek pucuk dapat menghasilkan tunas dalam waktu sekitar tiga bulan, sedangkan perbanyakan melalui kultur jaringan dapat menghemat waktu dan diperoleh bibit dalam jumlah banyak.
Setek pucuk diambil dari pucuk-pucuk batang tanaman induk yang masih muda. Pengambilan setek pertama dari tanaman induk dapat dilakukan setelah tanaman induk mempunyai tujuh daun atau kira-kira berumur 2 minggu setelah tanam. Penyetekan pertama dilakukan dengan menyisakan 4 daun, dari 4 daun ini
diharapkan akan tumbuh minimal 2 tunas yang selanjutnya akan dijadikan bahan setek pada periode berikutnya. Penyetekan kedua dapat dilakukan dengan menyisakan 2 daun yang produktif, sehingga diharapkan dapat tumbuh 2 tunas. Selanjutnya untuk merangsang pertumbuhan akar, bahan setek tersebut diberi perlakuan dengan cara mencelupkan bagian pangkal setek ke dalam hormone perangsang perakaran dengan kedalaman mencelup kira-kira 0.5 cm. Setelah itu bahan setek tersebut dibiarkan sekitar 0.5 jam hingga larutan hormon yang menempel pada pangkal batang mengering (Supari, 1999).
Tanaman induk krisan ditanam seperti cara menanam krisan potong, tetapi dengan jarak tanam lebih besar dan lama penyinaran tambahan lebih lama. Jarak tanam yang digunakan adalah 17 cm x 17 cm. Jarak yang lebih lebar dimaksudkan untuk memberi tempat bagi percabangan tanaman yang banyak setelah tanaman cukup tua, dan penyediaan faktor tumbuh yang banyak agar tanaman dapat memproduksi tunas-tunas dengan baik (Supari,1999). Selain itu, pemupukan juga sedikit berbeda dengan krisan potong. Pemupukan tanaman induk ditekankan untuk merangasang pertumbuhan tunas-tunas baru, sehingga diberikan pupuk nitrogen yang lebih banyak (Supari, 1999).
Tanaman krisan dapat dibudidayakan secara tungal (monokultur), maupun dengan pola tumpang sari (Widyawan dan Prahastuti, 1994). Jarak tanam krisan sangat bervariasi tergantung situasi lokasi penanaman (Soekartawi, 1996). Jarak tanam krisan yang biasa digunakan adalah 10 cm x 10 cm, dan 12.5 cm x 12.5 cm.
Kualitas Bunga Krisan
Kualitas bunga krisan potong segar ditentukan berdasarkan panjang tangkai minimum, diameter tangkai bunga, diameter bunga setengah mekar, jumlah kuntum bunga setengah mekar pertangkai pada tipe spray, kesegaran bunga, benda asing/kotoran, keadaan tangkai bunga, daun pada 2/3 bagian tangkai bunga dengan penanganan pasca panen minimum. Dewan Standarisasi Nasional telah menetapkan Standar Nasional Indonesia untuk bunga krisan potong seperti yang tercantum pada Lampiran 6.
Kriteria yang paling menentukan mutu krisan nasional adalah panjang tangkai bunga. Tanaman krisan yang memiliki panjang tangkai 76 cm akan
memiliki kualitas AA, 70 cm memiliki kualitas A, dan 60 cm memiliki kualitas B. Penurunan kualitas akan mengakibatkan penurunan nilai komersial tanaman tersebut.
Mutasi
Mutasi adalah perubahan pada sekuen DNA. Mutasi dapat terjadi pada genom yang mana saja. Akan tetapi, perubahan-perubahan fenotipik hanya teramati pada organisme jika mutasi terjadi dalam sekuens sebuah gen. Alel-alel mutan memiliki sekuens yang sedikit berbeda dengan alel-alel wild (Elrod and Stansfield, 2007). Mutasi dapat juga didefinisikan sebagai perubahan materi genetik, yang merupakan sumber pokok dari semua keragaman genetik dan bagian dari fenomena alam. Tipe perubahan genetik yang termasuk dalam mutasi terjadi secara acak, maka mungkin saja perubahan tersebut justru meningkatkan kemampuan organisme untuk bertahan hidup, tumbuh dan bereproduksi (Aisyah, 2006).
Induksi mutasi dapat dilakukan dengan beberapa mutagen, yaitu analog basa, mutagen kimia, dan mutagen fisik (Yuwono, 2008). Analog basa adalah senyawa dengan struktur kimia mirip dengan salah satu basa nukleotida sehingga dapat digabungkan dengan molekul DNA dalam proses replikasi. Analog basa dapat menginduksi mutasi karena dapat menyebabkan kesalahan dalam penyisipan nukleotida pada untaian DNA pasangannya. Senyawa ini dapat menyebabkan mutasi transisi. Contoh dari senyawa ini adalah 5-bromourasil (5-BU) dan 2-aminopurin (2-AP) (Yuwono, 2008).
Mutagen kimia yang banyak digunakan oleh pemulia adalah yang berasal dari kelompok alkylating agents. Senyawa ini mengandung satu atau lebih kelompok alkil reaktif yang dapat ditransfer ke molekul lain pada posisi dimana kerapatan elektronnya tinggi. Alkylating agents ini akan bereaksi dengan DNA dengan cara mengalkilasi kelompok fosfat, termasuk basa-basa purin dan pirimidin. Mutagen kimia yang biasa digunakan diantaranya adalah EMS (ethyl methane sulphonate), DES (diethylsulfate), El (ethylenimine), NMUT (N-nitroso-N-methyl urethane), NMU (N-nitro-(N-nitroso-N-methyl urea), NEUT (N-nitrose-N-ethyl urethane) dan NEU (N-nitrose-N-ethyl urea) (Aisyah, 2006).
Mutagen fisik secara khas dibedakan dari tipe radiasinya. Mutagen fisik yang sering digunakan diantaranya adalah sinar-x, sinar gamma, ultraviolet, dan neutron (Aisyah, 2006). Mutagen fisik lainnya adalah partikel alpha dan sinar devteron (Welsh, 1981). Radiasi sinar-x, gamma, dan neutron mengionisasi atom-atom dalam jaringan dengan cara melepaskan elektron-elektron dari atomnya (Aisyah, 2006). Jumlah bahan yang diperlakukan akan mempengaruhi keberhasilan dalam menghasilkan mutan. Oleh karena itu, dalam melakukan pemuliaan mutasi perlu diperhatikan banyaknya bahan yang digunakan agar dapat terjadi variasi-variasi genetika yang banyak (Soetarto dan Darsono, 1972).
Kecepatan mutasi bervariasi sesuai dengan dosis mutagen. Semakin tinggi dosis mutagen, semakin sering terjadi mutasi, pemunculan kromosom-kromosom dan kematian gen yang tidak diharapkan (Welsh, 1981). Dosis radiasi yang tinggi tidak hanya dapat mempengaruhi materi-materi genetik, tetapi juga dapat merusak organisme secara fisiologis. Bahkan radiasi yang tinggi pada tanaman dapat mengurangi frekuensi germinasi, pertumbuhan yang terhambat dan mengurangi kekuatan tanaman (Darussalam, 1972). Dosis yang dianggap efektif adalah yang hanya mengakibatkan kematian 50% dari populasi yang diperlakukan. Dosis ini disebut dosis letal 50% atau LD50 (Welsh, 1981).
Mutasi dapat terjadi pada setiap tahap perkembangan suatu organisme. Apabila terjadi di dalam jaringan somatik, mutasi mengakibatkan pola mosaik pada satu atau beberapa sel. Apabila di dalam jaringan generatif, mutasi dapat dipindahkan kepada keturunannya, tetapi tidak terlihat untuk beberapa generasi. Jaringan tertentu dari suatu organisme lebih sensitif terhadap mutagen daripada jaringan lain. Embrio lebih sensitif daripada jaringan yang sudah tak berkembang. Sel yang aktif tumbuh dan membelah lebih peka terhadap kerusakan daripada sel yang lebih tua (Crowder, 2006).
Sebagian besar mutasi adalah resesif (mutasi maju), tetapi beberapa dapat berbalik (mutasi balik). Mutasi letal menyebabkan kematian pada organisme tersebut. Tipe yang merusak mengganggu aktivitas metabolisme. Sebagian besar mutasi merugikan, tetapi kira-kira 0.01 persen menguntungkan (Crowder, 2006). Sel-sel yang membawa sifat mutasi yang baru cenderung hilang dalam persaingan dengan sel-sel normal (Aisyah, 2006). Mutasi pada sel dapat hilang dengan
matinya individu atau pun karena matinya sel yang termutasi sebelum multiplikasi (Sinha and Sinha, 1982).
Mutasi dapat diklasifikasikan berdasarkan asal, arah, dan tipe sel. Berikut ini merupakan klasifikasi mutasi:
1. Asal
a) Mutasi spontan: mutasi terjadi saat aktivitas selular normal, terutama saat replikasi dan perbaikan DNA.
b) Mutasi terinduksi: mutasi terjadi sebagai akibat perlakuan dengan agen mutagenik atau lingkungan, laju mutasi biasanya lebih tinggi daripada mutasi spontan.
2. Arah
a) Mutasi maju (forward): menciptakan perubahan dari wild type menjadi fenotipe abnormal.
b) Mutasi balik (reverse) atau mundur (back): perubahan sekuens nukleotida kembali menjadi sekuens awalnya.
c) Mutasi supresor: menghasilkan perubahan dari fenotipe abnormal (atau dengan kata lain, termutasi) kembali menjadi wild type.
Supresor intragenik: sebuah mutasi pada gen yang sama dengan yang termutasi pada awalnya, tapi pada situs yang berbeda, sehingga mengembalikan fungsi wild type.
Supresor intergenik: sebuah mutasi pada gen lain yang mengembalikan fungsi wild type
3. Tipe sel
a) Mutasi sel somatik: terjadi pada semua sel tubuh, kecuali sel kelamin, seringkali menghasilkan fenotipe mutan hanya pada satu sektor organisme (mosaik atau kimera), bukan perubahan yang diwariskan.
b) Mutasi lini nutfah (germ line, gametik): terjadi pada sel-sel kelamin, menghasilkan perubahan yang diwariskan (Elrod and Stansfield, 2007).
Radiasi
Radiasi elektromagnetik tersusun atas dua gelombang, yaitu gelombang elektrik dan magnetik. Berikut ini merupakan spektrum elektromagnetik:
Gambar 1. Spektrum Elektromagnetik
(Sumber : McDonald, 2003)
Radiasi adalah istilah yang digunakan untuk berbagai bentuk pancaran energi seperti pancaran cahaya, pancaran panas, pancaran radio dan TV, dan sinar ultra violet. Radiasi energi tinggi biasanya merupakan bentuk-bentuk yang melepaskan tenaga dalam jumlah besar dan kadang-kadang disebut radiasi ionisasi karena ion-ion dihasilkan dalam bahan yang ditembus oleh energi tersebut. Tipe-tipe radiasi adalah sebagai berikut :
1. Sinar x, dari tabung sinar x yang tegangannya relatif rendah, panjang gelombang agak panjang (150 – 0.15 Å), disebut sinar lemah, penting untuk menginduksi perubahan-perubahan genetik.
2. Sinar gamma, dipancarkan dari isotop radioaktif, panjang gelombang lebih pendek dari sinar x, lebih kuat daya tembusnya, dikenal sebagai sinar kuat, penting untuk menginduksi perubahan genetik.
3. Sinar ultra violet, panjang gelombang berbeda-beda (3800 - 150 Å), terletak antara sinar x (150 – 0.15 Å) dan cahaya yang terlihat (7800 – 3800 Å), daya tembus rendah, menyebabkan perangsangan elektron (Crowder, 2006).
Radisi pengionisasi, misalnya sinar x menyebabkan mutasi pada gen dalam perbandingan lurus dengan dosis radiasinya (Elrod and Stansfield, 2007). Jumlah radiasi yang sama dengan intensitas tinggi untuk waktu pendek atau intensitas rendah dengan waktu panjang, atau dosis yang berselang-seling, akan menimbulkan jumlah mutasi yang sama. Tidak ada pengaruh intensitas pada mutasi buatan tetapi pengaruh radiasi bersifat kumulatif. Baik gelombang pendek maupun gelombang panjang mempunyai efektifitas sama pada dosis yang sama
(Crowder, 2006). Frekuensi mutasi dapat ditingkatkan dengan penambahan dosis radiasi, tetapi penggunaan dosis radiasi yang terlalu tinggi dapat menyebabkan tidak berkecambahnya biji-biji (Hartana, 1972).
Radiasi menembus bagian tertentu dari gen yang menyebabkan perubahan bahan DNA. Akibat tidak langsung, yaitu radiasi menimbulkan perubahan zat kimia tertentu disekitar gen yang menghasilkan perubahan susunan nukleotida (Crowder, 2006). Susunan nukleotida dalam gen merupakan pengkode bagi protein yang ditentukan dari urutan asam aminonya. Karena itu perubahan susunan nukleotida akan menentukan protein yang dihasilkan dan fungsinya (Salisbury and Ross, 1995). Perubahan pasangan basa (urutan nukleotida) mengubah struktur dan fungsi protein. Pergeseran dalam pembacaan kode triplet mengubah urutan asam amino dari polipeptida atau mungkin mengakibatkan terhentinya sintesis asam amino (Crowder, 2006).
Kerusakan pada sel akibat radiasi dapat mempengaruhi fungsi jaringan atau organ bila jumlah sel yang mati/rusak dalam jaringan/organ tersebut cukup banyak. Semakin banyak sel yang rusak/mati, semakin parah perubahan fungsi yang terjadi sampai akhirnya organ tersebut kehilangan kemampuan untuk menjalankan fungsinya dengan baik. Perubahan fungsi sel atau kematian dari sejumlah sel menghasilkan suatu efek biologik dari radiasi yang bergantung pada jenis radiasi, dosis, jenis sel, dan lainnya (Alatas, 2010). Biasanya terdapat korelasi antara jumlah DNA, yaitu lebih sedikit DNA akan lebih tahan suatu organisme terhadap radiasi (Crowder, 2006).
Radiasi gamma merupakan yang paling sering digunakan dalam mutasi buatan. Sinar gamma memiliki panjang gelombang yang pendek, yaitu 10 – 0.01 nm dengan sumber utama radiasi adalah isotop Cobalt-60 (60Co). Sinar gamma dikelompokkan ke dalam gelombang elektromagnetik karena tidak mempunyai massa dan muatan listrik. Sinar gamma mempunyai energi radiasi tinggi, yaitu diatas 10 MeV sehingga mempunyai daya penetrasi yang kuat ke dalam jaringan dan mampu mengionisasi atom-atom dari molekul yang dilewatinya (Crowder, 2006).
Ionisasi dari radiasi sinar gamma terjadi menyebar sepanjang jalur ionisasi partikel. Ketika agen ionisasi yang mengandung inti atom (seperti partikel alpha)
terlempar akibat radiasi, ionisasi menjadi lebih rapat terkonsentrasi di daerah terebut. Ionisasi dapat menyebabkan pengelompokan molekul-molekul di sepanjang jalur ion yang tertinggal karena radiasi. Pengelompokan baru ini menyebabkan perubahan kimia yang mengarah pada mutasi gen atau pada kerusakan atau pengaturan kembali kromosom (Aisyah, 2006).
Ethyl Methane Sulphonate
Ethyl Methane Sulphonate merupakan ethyl ester dari asam methanesulphonic (methanesulphonic acid) dan cairan yang tidak berwarna di suhu ruang. Ethyl Methane Sulphonate dapat terlarut pada air dan stabil dibawah suhu dan tekanan normal (Akron, 2009). Ethyl Methane Sulphonate biasanya digunakan dalam percobaan sebagai mutagen dan sebagai bahan untuk penelitian biokimia (Akron 2009, HSBD 2009). Sifat fisik dan kimia EMS dapat dilihat pada Tabel 2.
Tabel 1. Sifat Fisik dan Kimia EMS
Komponen Informasi Berat molekul 124.2a Titik leleh <-25°Cb Tittik didih 213°C to 214°C at 761 mm Hga Log Kow 0.09a Kelarutan air 135 g/L at 25°Cb Tekanan uap 0.328 mm Hg at 25°C Sumber: aHSDB 2009, bChemIDplus 2009
Rumus kimia ethyl methane sulphonate adalah sebagai berikut:
Ethyl Methane Sulphonate (EMS) merupakan agen ethylating yang menyebabkan mutagenik mulai dari virus hingga mamalia. Data genetik yang diperoleh dengan menggunakan mikroorganisme menjelaskan bahwa EMS menyebabkan mutasi transisi dengan mengubah basa guanin dan timin (GT) menjadi adenin dan timin (AT) serta adenin dan timin (AT) menjadi guanin dan timin (GT). Telah diperoleh pula bukti yang menjelaskan bahwa EMS dapat
menyebabkan penyisipan (insersi) atau penghilangan (delesi) pasangan basa serta penghapusan intragenik lebih luas. Pada organisme tingkat tinggi, EMS mampu mematahkan kromosom, meskipun belum dipahami mekanismenya. Sebuah hipotesis yang sering dikutip adalah bahwa etylasi basa DNA oleh EMS (umumnya pada posisi N-7 dari guanin) secara bertahap menghidrolisis deoxiribosa pada backbone DNA meninggalkan sebuah situs purin (atau mungkin pirimidin) yang stabil dan dapat menyebabkan kerusakan untaian tunggal DNA (Sega, 1984).
Penggunan EMS lebih efektif dibandingkan dengan radiasi pengionisasi sinar x. Nauman (1976), menjelaskan bahwa Tradescantia klon 4430 lebih sensitif terhadap EMS 6-7 kali dibandingkan dengan radiasi sinar x untuk menghasilkan mutan. Selain itu, Mallikarjun et al. (2008), melaporkan bahwa regenerasi in vitro melalui kalus dengan perlakuan EMS menciptakan variasi tambahan pada tebu. Kalus yang diberi perlakuan EMS menghasilkan mutagen potensial pada 0.5% untuk interval waktu yang berbeda.
Kloroplas
Kloroplas adalah plastid fotosintesis berwarna hijau yang mengandung klorofil dan responsibel untuk menangkap energi cahaya. Kloroplas umumnya berbentuk bulat hingga oval. Kloroplas lebih besar dibandingkan mitokondria dan memiliki diameter 4-6 µm (McDonald, 2003). Aneka bentuk dan ukuran kloroplas ditemukan pada berbagai tumbuhan. Kloroplas berasal dari proplastid kecil (plastid yang belum dewasa, kecil, dan hampir tak berwarna, dengan sedikit atau tanpa membran dalam). Pada umumnya proplastid berasal hanya dari sel telur yang tak terbuahi, sperma tidak berperan di sini. Proplastid membelah pada saat embrio berkembang, dan berkembang menjadi kloroplas ketika daun dan batang terbentuk. Kloroplas muda juga aktif membelah, khususnya bila organ yang mengandung kloroplas terpajan dengan cahaya, jadi tiap sel daun dewasa sering mengandung beberapa ratus kloroplas (Salisbury and Ross, 1995).
Kloroplas merupakan organel poliploid, yang terdiri dari banyak duplikat DNA kloroplas (plastome) per kloroplas. Sekuen DNA tersedia dari beberapa tanaman yang berbeda mengindikasikan bahwa semua enzim dan protein
esensial untuk replikasi plastid DNA dikodekan pada nuclear genome. Plastid DNA pada umumnya homogeny pada salah satu spesies tanaman. Meskipun demikian, hanya seperti semua sel somatik pada organisme memiliki set nuclear gen yang sama tetapi mungkin mengekspresikan gen ini pada kombinasi yang berbeda. Kloroplas diketahui mengandung semua gen rRNA kloroplas (3-5 gen), sekitar 30 gen tRNA dan sekitar 100 gen pengkode protein, jumlah gen mengestimasikan ukuran genom kloroplas (McDonald, 2003).
Tiap kloroplas dikelilingi oleh sistem satu selimut membran ganda yang mengatur lalu lintas molekul keluar masuk kloroplas. Di dalam kloroplas mengandung bahan amorf, iir-gel, dan kaya enzim yang disebut stroma. Di dalam kloroplas juga dijumpai DNA, RNA, ribosom, dan tentu saja berbagai enzim. Semua molekul ini sebagian besar terdapat di stroma, tempat berlangsungnya transkripsi dan translasi. DNA kloroplas terdapat dalam 50 atau lebih lingkaran jalur-ganda melilit dalam tiap plastid. Berbagai gen plastid menyandi semua molekul RNA-pemindah (sekitar 30), dan molekul RNA-ribosom (empat) yang digunakan oleh plastid untuk translasi (Salisbury and Ross, 1995).
Kloroplas mengandung materi genetik (gen atau DNA) yang juga dapat termutasi. Energi radiasi sinar gamma dapat menyebabkan kerusakan atau mutasi gen pada kloroplas. Mutasi pada gen kloroplas dapat menyebabkan kerusakan gen mutan (defective mutant genes) yang kemudian dapat mengganggu proses fotosintesis pada daun (Agustrial, 2008).
Pengamatan kuantitatif pada karakteristik sel seperti pengukuran sel sering diterapkan untuk mengetahui adanya poliploidi. Materi yang paling sering dilihat adalah sel penjaga dan stomata. Ukuran dan jumlah sel tersebut per area daun menjadi hal yang umum untuk melacak perubahan ploidi (Sybenga, 1992). Menurut Saria et al. (2000), jumlah kloroplas sel penjaga menentukan tingkat ploidi suatu tanaman. Tanaman semangka diploid mempunyai jumlah kloroplas sel penjaga sebanyak 11 – 12, yaitu sekitar dua kali lipat dari tanaman haploidnya yang berjumlah 6 – 7. Pada umumnya, perubahan genetik yang mencakup perubahan tingkat ploidi dipengaruhi oleh adanya pembelahan sel yang tinggi. Perwati (2009), menunjukkan bahwa poliploidi menyebabkan penambahan ukuran sel pada Adiantum raddianum. Selain itu, diketahui bahwa
terdapat kecenderungan penambahan ukuran stomata dan spora seiring meningkatnya derajat ploidi.
Tanaman poliploid mempunyai kromosom yang lebih banyak daripada diploidnya. Sifat umum dari tanaman popliploid adalah tanaman lebih kekar, bagian-bagian tanaman menjadi lebih besar (akar, batang, daun), sel-selnya (sel epidermis) lebih besar, ukuran stomata lebih besar. Selain itu, pada kebanyakan spesies, tangkai dan helai daun menjadi lebih tebal (Suryo, 2007).
BAHAN DAN METODE
Tempat dan Waktu
Perbanyakan planlet krisan dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura, IPB. Aklimatisasi dan budidaya tanaman dilaksanakan di greenhouse petani tanaman hias krisan yang berlokasi di Desa Nongkojajar, Kecamatan Tutur, Kabupaten Pasuruan, Jawa Timur dengan ketinggian 1080 m dpl. Penelitian dilaksanakan mulai bulan Februari hingga September 2011.
Bahan dan Alat
Bahan tanam yang digunakan dalam penelitian ini adalah planlet varian krisan hasil induksi mutasi melalui radiasi sinar gamma (0 dan 20 Gy) dan perendaman dalam EMS 0.77% (0, 105, 120 menit). Asal planlet krisan yang digunakan dalam penelitian dapat dilihat pada Tabel 2.
Tabel 2. Asal Planlet yang Digunakan
No. Genotipe Perlakuan Kode Keterangan
Varianhasil radiasi sinar gamma
1 Puspita Nusantara 0 Gy PN 0 Kontrol
2 Puspita Nusantara 20 Gy PN 20
3 Dewi Ratih 0 Gy DR 0 Kontrol
4 Dewi Ratih 20 Gy DR 20
Varian hasil perendaman dalam EMS 0.77%
5 Puspita Asri 0 menit PA 0 Kontrol
6 Puspita Asri 105 menit PA 105
7 Puspita Asri 120 menit PA 120
8 Chandra Kirana 0 menit CDK 0 Kontrol
9 Chandra Kirana 105 menit CDK 105
10 Chandra Kirana 120 menit CDK 120
Sumber: Maharani (2011) dan Rahmah (2011)
Bahan yang digunakan untuk perbanyakan planlet diantaranya adalah komposisi media Murashige and Skoog (MS 0), alkohol 70 %, alkohol 96 %, spiritus, dan aquades. Bahan yang digunakan dalam budidaya di greenhouse adalah rooton-F, Urea, KCl, SP-36, pupuk kandang, dolomit, arang sekam, fungisida, dan insektisida. Alat yang digunakan dalam perbanyakan planlet
diantaranya adalah autoclave, laminar airflow, dan alat yang dibutuhkan dalam kultur jaringan tanaman. Alat yang digunakan dalam budidaya di greenhouse adalah perlengkapan budidaya tanaman, jaring penegak tanaman, sprayer, mistar, jangka sorong, termometer, hygrometer, dan mikroskop cahaya.
Metode Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian adalah Rancangan Kelompok Lengkap Teracak (RKLT). Perlakuan terdiri dari 7 varian krisan hasil induksi mutasi dan 3 kontrol, setiap perlakuan diulang sebanyak 3 kali sehingga terdapat 30 satuan percobaan. Setiap satuan percobaan terdiri dari 15 tanaman sehingga terdapat 450 tanaman. Penelitian dilakukan pada dua generasi, yaitu generasi M2V1 dan M2V2, sehingga total seluruh tanaman yang digunakan dalam penelitian adalah 900 tanaman.
Model linier rancangan kelompok lengkap teracak adalah: Yij = µ + αi + βj + εij
Keterangan :
Yij = nilai pengamatan perlakuan ke-i dan ulangan ke-j µ = nilai rata-rata umum
αi = pengaruh perlakuan ke-i βj = pengaruh ulangan ke-j
εij = pengaruh galat percobaan dari perlakuan ke-i dan ulangan ke-j i = 1, 2, ...,10 j = 1, 2, 3
Data yang diperoleh dianalisis dengan uji F, apabila perlakuan berpengaruh nyata terhadap peubah, akan dilakukan uji perbandingan kontras orthogonal dan polinomial. Selanjutnya dilakukan uji bartlet untuk melihat kehomogenan ragam antara kedua generasi yang digunakan, apabila berbeda nyata maka dilakukan analisis ragam gabungan.
Pelaksanaan Penelitian
Pelaksanaan penelitian terdiri dari beberapa tahap, yaitu aklimatisasi, penanaman tanaman induk, dan budidaya krisan untuk produksi bunga.
Aklimatisasi Planlet
Botol kultur berisi planlet krisan dikeluarkan dari ruang kultur ke tempat bersuhu ruang untuk penyesuaian dengan lingkungan aklimatisasi. Planlet dipindahkan ke persemaian berisi media arang sekam yang telah disiram dengan fungisida dan bakterisida dengan konsentrasi 2 g/liter. Tanaman disiram dengan menggunakan sprayer 2 kali sehari. Pemeliharaan tanaman hasil aklimatisasi dilakukan di ruang kultur. Setelah berumur 2 minggu, bibit diadaptasikan secara bertahap ke greenhouse. Bibit dipindahkan ke lahan budidaya setelah memiliki 5-7 helai daun dengan ketinggian 7.5 – 10 cm.
Penanaman Tanaman Induk
Bibit krisan yang telah siap untuk dipindahkan ke lahan budidaya ditanam dalam greenhouse sebagai tanaman induk. Tanaman induk merupakan sumber pucuk yang akan digunakan sebagai bibit untuk memproduksi bunga. Tanaman induk dipinching sebanyak tiga kali. Pinching pertama dilakukan agar tanaman induk memproduksi cabang sebagai sumber bibit. Hasil pinching kedua dan ketiga digunakan sebagai bibit generasi M2V1 dan M2V2. Berikut ini merupakan tahapan perbanyakan bibit krisan Generasi M0 hingga M2V2 :
Gambar 2. Tahapan Perbanyakan Bibit Krisan Generasi M0 Hingga M2V2
M 0 M0 M1 M1 M1 M1 M2V1 M2V2 M1 Induksi mutasi Aklimatisasi Dipinching Sub kultur
Budidaya Krisan untuk Produksi Bunga Persiapan lahan budidaya
Tanaman krisan ditanam pada bedengan. Pembentukan bedengan dilakukan dengan menggunakan cangkul. Sebelum bedengan dibentuk, tanah diolah terlebih dahulu sedalam 30 cm. Proses tersebut dilakukan untuk memperbaiki sifat fisik tanah dan membersihkan gulma dari lahan. Setelah itu, tanah dikeringanginkan selama satu minggu. Kemudian tanah diolah menjadi bedengan setinggi 0.25 – 0.3 m dengan lebar 1.2 m memanjang searah rumah kaca. Jarak antar bedengan adalah 0.3 – 0.4 m.
Setelah bedengan terbentuk, tanah diolah ringan dengan mencampurkan 20 ton/ha pupuk kandang, dan pupuk dasar yang terdiri dari 200 kg/ha Urea, 350 kg/ha KCl, dan 300 kg/ha SP-36. Sehari sebelum penanaman, bedengan disiram dengan air hingga kapasitas lapang dan dipasang jaring penegak tanaman. Jaring penegak terbuat dari anyaman tali plastik dengan lubang anyam disesuaikan dengan kerapatan tanaman. Pada awal penanaman, jaring penegak dipasang tepat menyentuh tanah kemudian semakin tinggi tanaman jaring penegak dinaikkan agar tanaman tidak rebah.
Bibit krisan ditanam dengan jarak tanam 10 cm x 10 cm. Lubang tanam dibuat dengan cara ditugal. Bibit krisan ditanam satu persatu pada lubang yang telah disiapkan sedalam 1-2 cm.
Penyinaran
Krisan merupakan tanaman hari pendek yang membutuhkan penambahan cahaya untuk menghambat pembungaan atau pertumbuhan generatif sehingga diperlukan instalasi listrik untuk penambahan lampu dimalam hari. Jarak antar titik lampu yang digunakan adalah 2 x 2.5 m2 dengan ketinggian 1.5 m di atas permukaan bedengan. Penyinaran tambahan dilakukan selama fase vegetatif, yaitu selama 4 jam (pukul 22.00 – 02.00 WIB). Pemberian cahaya tambahan dihentikan setelah tanaman berumur 35 hingga 40 hari, yaitu apabila rata-rata tanaman telah mencapai ketinggian 50-55 cm. Penyinaran dihentikan untuk memacu pertumbuhan generatif (pembungaan).
Pemupukan
Pemupukan lanjutan dilakukan setelah tanaman berumur sekitar 2 minggu. Pupuk yang digunakan diantaranya adalah 1.5 g/m2 Urea dan 6 g/m2 KNO3 yang diaplikasikan melalui siraman atau irigasi. Pemupukan dengan dosis yang sama juga dilakukan pada saat tanaman berumur 4 dan 6 minggu. Pemupukan lanjutan terakhir dilakukan pada saat tanaman berumur 8 minggu dengan menggunakan 1.5 g/m2 Urea, 6 g/m2 KNO3, dan 6 g/m2 SP-36.
Pembuangan tunas utama (knopping)
Knopping adalah pembuangan tunas utama yang tumbuh di tengah atau
tunas yang paling besar. Knopping dilakukan agar diperoleh tanaman krisan dengan jumlah kuntum bunga yang banyak dan ukuran bunga relatif seragam. Pembuangan tunas dilakukan saat tanaman mengeluarkan tunas utama.
Panen
Pemanenan dilakukan saat tanaman berumur 15 MST. Waktu panen yang baik adalah sebelum pukul 07.00 atau setelah pukul 15.00 WIB. Kriteria panen pada krisan tipe spray adalah ketika tiga bunga teratas telah mekar sempurna dan minimal dua bunga telah setengah mekar. Pemanenan dilakukan dengan memotong tangkai bunga dengan sudut kemiringan sekitar 45o untuk memberikan bidang serapan air yang luas sehingga bunga dapat bertahan segar lebih lama.
Setelah panen bunga diletakkan dalam bak yang berisi air dengan kedalaman sekitar 20 cm dari dasar bak. Perendaman dalam bak berisi air bertujuan untuk mempertahankan kesegaran bunga setelah panen. Air di dalam bak diganti setiap tiga hari sekali untuk menghindari serangan bakteri yang dapat mempengaruhi kesegaran bunga. Periode kesegaran bunga diukur hingga tanaman telah layu dengan ciri-ciri 30 % daun telah menguning dan 50 % bunga cakram berubah warna menjadi kecoklatan.
Peubah Pengamatan
Pengamatan dilakukan pada peubah-peubah sebagai berikut:
1. Tinggi tanaman (cm), diukur dari permukaan tanah sampai dengan titik tumbuh.
2. Jumlah ruas batang, diamati dari permukaan tanah sampai dengan titik tumbuh.
3. Jumlah daun, diamati dengan menghitung jumlah daun yang telah membuka sempurna.
4. Diameter bunga (cm).
5. Diameter bunga cakram (cm).
6. Bentuk daun, pada daun yang telah membuka sempurna. 7. Bentuk bunga.
8. Warna bunga, dengan mengamati warna bunga pita dan bunga cakram.
9. Periode kesegaran bunga dalam vas/vase life (hari), yaitu lamanya bunga bertahan dalam keadaan segar bila disimpan dalam vas.
10. Respons time, diamati pada saat hari memasuki hari pendek yaitu saat pemberian cahaya tambahan dihentikan sampai inisiasi bunga.
11. Jumlah stomata, diamati dengan menghitung jumlah stomata dalam bidang pandang.
12. Jumlah kloroplas, diamati dengan menghitung jumlah kloroplas dalam sel penjaga.
Pengamatan jumlah stomata dan jumlah kloroplas dilakukan menggunakan mikroskop cahaya. Sebelum dilakukan pengamatan, preparat dibuat terlebih dahulu. Preparat dibuat dengan cara meletakkan daun pada kaca objektif dan dilekatkan selotip pada bagian bawah atau atas daun. Selanjutnya daun dikerok dengan menggunakan silet hingga tersisa lapisan tipis. Setelah pembuatan preparat selesai, dilakukan pengamatan di bawah mikroskop hingga terlihat stomata dan kloroplas dengan jelas. Perbesaran lensa mikroskop yang digunakan adalah 200 kali dengan luas bidang pandang 0.159 m2.
HASIL DAN PEMBAHASAN
Kondisi Umum Pertanaman
Varian krisan generasi M2V1 dan M2V2 yang ditanam di lahan memiliki daya tumbuh 100%. Hal ini menunjukkan bahwa induksi mutasi tidak mengakibatkan kematian pada varian di kedua generasi yang ditanam. Seperti yang dijelaskan oleh Sihombing (2005), bahwa perlakuan radiasi menyebabkan kerusakan fisiologis pada tanaman generasi M1, tetapi telah menjadi stabil pada tanaman generasi M2 dan M3. Selain itu, kondisi lingkungan cukup mendukung sehingga tidak terjadi kematian pada tanaman. Lokasi penelitian memiliki jenis tanah vulkanik dengan curah hujan rata-rata adalah 1800 mm per tahun (BPS Pasuruan, 2010).
Hama yang menyerang tanaman selama penelitian diantaranya adalah leaf
miner, kutu daun, ulat grayak, belalang, kumbang dan thrips, sedangkan penyakit
yang menyerang adalah karat daun yang disebabkan oleh cendawan Puccinia sp. Serangan hama terbesar adalah leaf miner yang disebabkan oleh Liriomyza trifolii. Hama ini menyerang hampir di semua stadia tanaman. Serangan hama ini meninggalkan bekas seperti terowongan yang panjang akibat larva yang berada di dalam jaringan daun. Pengendalian hama dan penyakit dilakukan secara manual maupun kimia. Pengendalian secara kimia dilakukan melalui penyemprotan pestisida secara teratur sesuai dosis anjuran. Hama dan penyakit yang menyerang tanaman dapat dilihat pada Gambar 3.
Gambar 3. Hama dan Penyakit Tanaman. (a) Ulat Tanah, (b) Ulat Bulu, (c) Kumbang, (d) Leaf Miner, (e) Gejala Serangan Leaf Miner, dan (f) Gejala Serangan Karat Daun.
a f e d c b
Pertumbuhan Vegetatif Tanaman Krisan M2V1
Hasil analisis ragam (Lampiran 7) menunjukkan bahwa varian krisan berpengaruh nyata terhadap peubah tinggi tanaman, jumlah ruas, dan jumlah daun, kecuali pada peubah jumlah daun saat 2 dan 4 MST). Koefisien keragaman pada peubah tinggi tanaman, jumlah ruas batang, dan jumlah daun berturut-turut berkisar antara 11.48 – 16.23 %, 5.67 – 11.55 %, dan 7.91 – 14.52 %.
Perbandingan kontras orthogonal (Tabel 3) menunjukkan bahwa peubah tinggi tanaman antara varian hasil induksi mutasi melalui radiasi sinar gamma tidak berbeda nyata dengan varian hasil induksi mutasi melalui perendaman dalam EMS 0.77 % di semua minggu pengamatan, begitu pula pada peubah jumlah ruas batang saat 2 - 6 MST dan peubah jumlah daun saat 2 - 4 MST. Selanjutnya, peubah jumlah ruas batang berbeda nyata saat 8 dan 14 MST, serta berbeda sangat nyata saat dan 12 MST, sedangkan jumlah daun berbeda sangat nyata saat 6 – 12 MST dan nyata saat 14 MST.
Perbandingan antara kedua genotipe hasil induksi mutasi melalui radiasi sinar gamma (PN dan DR) menunjukkan hasil nyata hanya pada peubah tinggi tanaman saat 6, 12, dan 14 MST, sedangkan di minggu pengamatan lainnya tinggi tanaman tidak berbeda nyata antara kedua genotipe. Begitu pula peubah jumlah ruas batang dan jumlah daun yang menunjukkan hasil tidak nyata pada semua minggu pengamatan. Kedua genotipe tidak berbeda nyata karena keduanya memiliki sifat pertumbuhan tidak berbeda, kecuali pada tinggi tanaman saat 12 dan 14 MST yang berbeda nyata akibat pertumbuhan tinggi DR yang terhambat.
Apabila dibandingkan antara varian hasil induksi mutasi melalui radiasi sinar gamma dalam genotipe yang sama, maka akan didapatkan perbedaan yang nyata. Perbandingan antara PN 0 dan PN 20 berbeda nyata dan sangat nyata kecuali saat 6 MST pada peubah tinggi tanaman, tetapi tidak nyata pada peubah jumlah ruas batang di semua minggu pengamatan kecuali saat 4 MST. Begitu pula pada peubah jumlah daun yang tidak berbeda nyata di semua minggu pengamatan. Hal ini menunjukkan bahwa induksi mutasi mengakibatkan perbedaan pertumbuhan tinggi tanaman tetapi tidak mengakibatkan perubahan pada jumlah ruas batang dan jumlah daun pada krisan genotipe PN. Rosmala (2011) melaporkan bahwa radiasi sinar gamma berpengaruh sangat nyata terhadap tinggi
tanaman handeuleum, semakin bertambahnya dosis radiasi menghasilkan tinggi tanaman yang semakin rendah.
Perbandingan antara DR 0 dan DR 20 menunjukkan bahwa induksi mutasi melalui radiasi sinar gamma mengakibatkan perbedaan pertumbuhan tinggi tanaman, jumlah ruas batang, dan jumlah daun pada kedua varian. Kendarini (2006), melaporkan bahwa penambahan jumlah daun tanaman krisan yang diradiasi sinar gamma tidak linier dengan penambahan dosis radiasi. Krisan kultivar “Puma white” menghasilkan jumlah daun lebih banyak setelah dipapar sinar gamma dosis 15 Gy dibanding tanaman yang dipapar pada dosis 10 Gy, sedangkan jumlah daun pada tanaman yang dipapar dosis 20 Gy kembali menurun. Hal ini sama dengan yang terjadi dalam penelitian, yaitu jumlah daun lebih sedikit pada tanaman yang telah diradiasi dengan sinar gamma 20 Gy (DR 20) dibandingkan dengan kontrol (DR 0). Meskipun dosis radiasi yang digunakan sama, tetapi pengaruhnya antar genotipe PN dan DR berbeda. Hasil tersebut sesuai dengan pernyataan Datta (2001) bahwa antar spesies atau bahkan antar galur dalam satu varietas yang sama memiliki tanggap yang berbeda terhadap perlakuan radiasi.
Selanjutnya apabila dibandingkan antara kedua genotipe hasil induksi mutasi melalui perendaman dalam EMS 0.77 % (PA dan CDK) akan didapatkan hasil nyata dan sangat nyata kecuali saat 4 MST pada peubah tinggi tanaman. Peubah jumlah ruas batang berbeda nyata dan sangat nyata pada semua minggu pengamatan, begitu pula pada peubah jumlah daun kecuali saat 2 dan 4 MST. Selain itu, perbandingan antar varian yang berasal dari genotipe PA menunjukkan kecenderungan berbeda sangat nyata pada peubah tinggi tanaman, jumlah ruas batang, dan jumlah daun. Berbeda dengan varian yang berasal dari genotipe CDK yang menunjukkan kecenderungan tidak berbeda nyata pada ketiga peubah yang diamati. Hal ini menunjukkan bahwa induksi mutasi melalui perendaman dalam EMS 0.77 % mengakibatkan perbedaan pertumbuhan tinggi tanaman, jumlah ruas batang, dan jumlah daun pada krisan genotipe PA, tetapi tidak pada genotipe CDK. Hasil perbandingan secara keseluruhan menunjukkan bahwa induksi mutasi melalui perendaman dalam EMS 0.77 % lebih nyata mempengaruhi pertumbuhan tanaman krisan dibandingkan induksi mutasi melalui radiasi sinar gamma.
Tabel 3. Perbandingan Kontras Orthogonal Pertumbuhan Vegetatif M2V1
Keterangan: tn = tidak berpengaruh nyata; PN = Puspita Nusantara; * = berpengaruh nyata; DR = Dewi Ratih; ** = berpengaruh sangat nyata; PA = Puspita Asri; 0, 20 = Dosis radiasi sinar gamma (Gy); CDK = Chandra Kirana; 0,105, 120 = Lama perendaman dalam EMS 0.77 % (menit).
Varian hasil induksi mutasi melalui perendaman dalam EMS 0.77 % menunjukkan respon yang berbeda pada kedua genotipe. Varian yang berasal dari genotipe PA memberikan respon yang tidak nyata pada tinggi tanaman, tetapi memberikan respon kuadratik pada varian yang berasal dari genotipe CDK (Tabel 4).
Perbandingan Minggu Setelah Tanam
2 4 6 8 10 12 14 ... Tinggi Tanaman ... Gamma Vs EMS tn tn tn tn tn tn tn PN Vs DR tn tn * tn tn * * PN 0 Vs PN 20 * * tn * ** ** ** DR 0 Vs DR 20 tn tn tn tn * ** ** PA Vs CDK * tn ** ** ** * * PA 0 Vs PA 105 * * ** ** ** ** ** PA 0 Vs PA 120 * * ** * ** ** ** PA 105 Vs PA 120 tn tn tn tn tn tn tn CDK 0 Vs CDK 105 * tn tn tn tn tn tn CDK 0 Vs CDK 120 tn tn tn tn tn tn tn CDK105 Vs CDK120 * tn * * tn tn tn
... Jumlah ruas batang ...
Gamma Vs EMS tn tn tn * ** ** * PN Vs DR tn tn tn tn tn tn tn PN 0 Vs PN 20 tn * tn tn tn tn tn DR 0 Vs DR 20 tn tn ** ** * * tn PA Vs CDK * * ** ** ** ** * PA 0 Vs PA 105 tn tn ** ** ** ** ** PA 0 Vs PA 120 tn ** ** ** ** ** ** PA 105 Vs PA 120 tn * tn tn tn tn tn CDK 0 Vs CDK 105 ** tn tn tn * tn tn CDK 0 Vs CDK 120 tn tn tn tn tn tn tn CDK105 Vs CDK120 ** tn tn tn tn tn tn ... Jumlah Daun ... Gamma Vs EMS tn tn ** ** ** ** * PN Vs DR tn tn tn tn tn tn tn PN 0 Vs PN 20 tn tn tn tn tn tn tn DR 0 Vs DR 20 tn tn * * ** tn tn PA Vs CDK tn tn * ** ** ** ** PA 0 Vs PA 105 tn tn tn * ** ** ** PA 0 Vs PA 120 tn tn ** ** ** ** * PA 105 Vs PA 120 tn tn tn tn tn tn tn CDK 0 Vs CDK 105 ** * tn tn tn tn tn CDK 0 Vs CDK 120 tn tn tn tn tn tn * CDK105 Vs CDK120 tn tn tn tn tn tn tn
Keterangan: 0, 105, 120 = berturut-turut adalah lama perendaman dalam EMS 0.77 % (menit); tn = respon tidak nyata; PA = Puspita Asri;
Q* = respon kuadratik nyata; CDK = Chandra Kirana; Q** = respon kuadratik nyata.
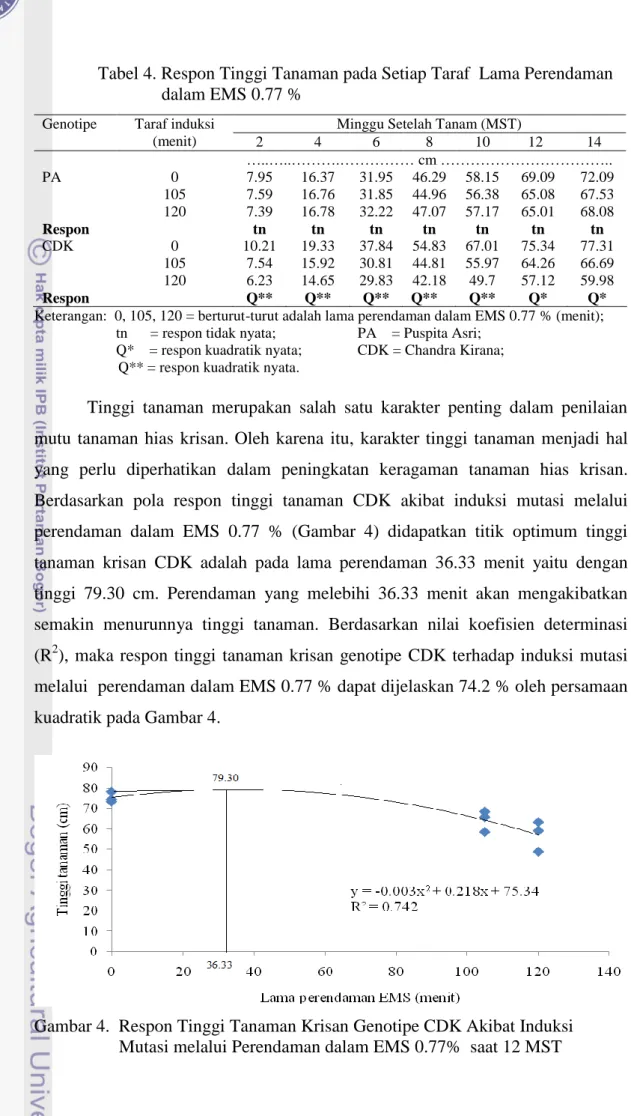
Tinggi tanaman merupakan salah satu karakter penting dalam penilaian mutu tanaman hias krisan. Oleh karena itu, karakter tinggi tanaman menjadi hal yang perlu diperhatikan dalam peningkatan keragaman tanaman hias krisan. Berdasarkan pola respon tinggi tanaman CDK akibat induksi mutasi melalui perendaman dalam EMS 0.77 % (Gambar 4) didapatkan titik optimum tinggi tanaman krisan CDK adalah pada lama perendaman 36.33 menit yaitu dengan tinggi 79.30 cm. Perendaman yang melebihi 36.33 menit akan mengakibatkan semakin menurunnya tinggi tanaman. Berdasarkan nilai koefisien determinasi (R2), maka respon tinggi tanaman krisan genotipe CDK terhadap induksi mutasi melalui perendaman dalam EMS 0.77 % dapat dijelaskan 74.2 % oleh persamaan kuadratik pada Gambar 4.
Gambar 4. Respon Tinggi Tanaman Krisan Genotipe CDK Akibat Induksi Mutasi melalui Perendaman dalam EMS 0.77% saat 12 MST Tabel 4. Respon Tinggi Tanaman pada Setiap Taraf Lama Perendaman
dalam EMS 0.77 %
Genotipe Taraf induksi (menit)
Minggu Setelah Tanam (MST)
2 4 6 8 10 12 14 …..…..……….……… cm ……….. PA 0 7.95 16.37 31.95 46.29 58.15 69.09 72.09 105 7.59 16.76 31.85 44.96 56.38 65.08 67.53 120 7.39 16.78 32.22 47.07 57.17 65.01 68.08 Respon tn tn tn tn tn tn tn CDK 0 10.21 19.33 37.84 54.83 67.01 75.34 77.31 105 7.54 15.92 30.81 44.81 55.97 64.26 66.69 120 6.23 14.65 29.83 42.18 49.7 57.12 59.98 Respon Q** Q** Q** Q** Q** Q* Q*
Varian hasil induksi mutasi melalui perendaman dalam EMS 0.77% menunjukkan respon yang berbeda pada kedua genotipe. Varian yang berasal dari genotipe PA memberikan respon yang tidak nyata pada jumlah ruas batang, tetapi memberikan respon kuadratik pada varian yang berasal dari genotipe CDK kecuali saat 8 dan 14 MST yang memberikan respon tidak nyata (Tabel 5).
Keterangan: 0, 105, 120 = berturut-turut adalah lama perendaman dalam EMS 0.77 % (menit); Q** = respon kuadratik nyata; PA = Puspita Asri;
Q* = respon kuadratik nyata; CDK = Chandra Kirana; tn = tidak berpengaruh nyata.
Titik optimum jumlah ruas batang krisan pada 12 MST didapatkan pada lama perendaman 53.5 menit dengan ruas berjumlah 52.52. Perendaman yang melebihi titik optimum akan memberikan pengaruh semakin menurunnya jumlah ruas tanaman. Berdasarkan nilai koefisien determinasi (R2), maka respon induksi mutasi dengan perendaman EMS 0.77 % terhadap jumlah ruas tanaman krisan genotipe CDK dapat dijelaskan 63.9 % oleh persamaan kuadratik pada Gambar 5.
Gambar 5. Respon Jumlah Ruas Batang Krisan Genotipe CDK Akibat Induksi Mutasi melalui Perendaman dalam EMS 0.77 % saat 12 MST
Tabel 5. Respon Jumlah Ruas Batang pada Setiap Taraf Lama Perendaman dalam EMS 0.77 %
Genotipe Taraf induksi (menit)
Minggu Setelah Tanam (MST)
2 4 6 8 10 12 14 …..…..……….……… ruas ……….. PA 0 9 12 18.53 26.47 34.13 38.87 43.43 105 9.27 13.47 18.73 28.2 38.93 41.87 43.60 120 8.73 12.67 18.33 27.73 35.07 40.53 41.53 Respon tn tn tn tn tn tn tn CDK 0 10.87 13.8 20.6 30.13 43.13 46.8 48.67 105 9.13 12.73 19.67 29.33 38.53 40.53 42.33 120 9.2 12.93 18.07 26.53 31.2 34.93 37.27 Respon Q** Q** Q* tn Q* Q* tn
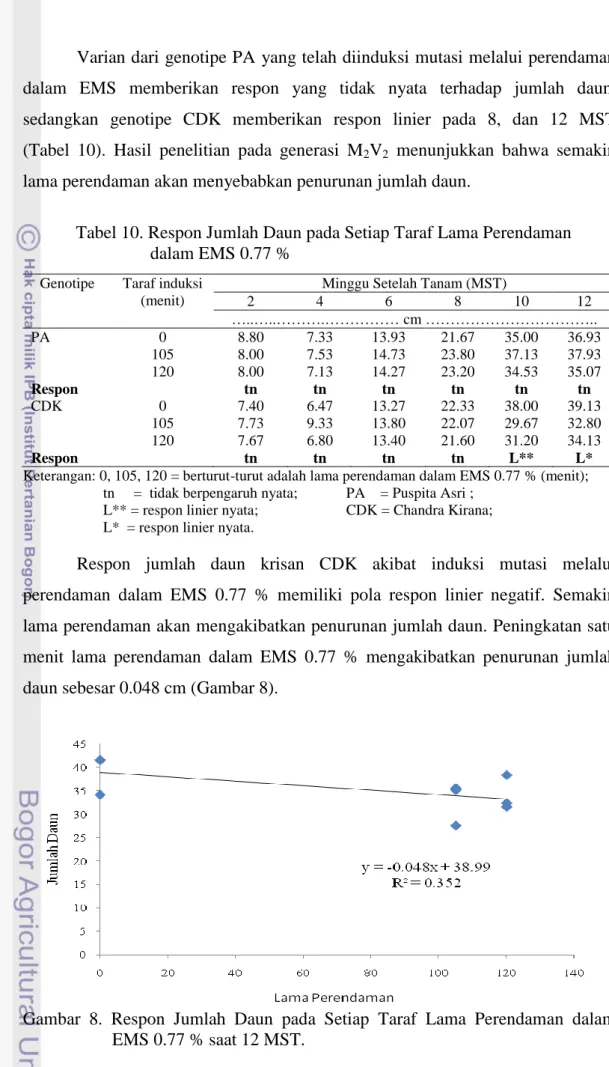
Varian yang berasal dari genotipe PA tidak memberikan respon yang nyata pada peubah jumlah daun. Varian yang berasal dari genotipe CDK memberikan respon kuadratik hanya hingga 4 MST, selanjutnya pada 6-14 MST perendaman dalam EMS 0.77 % menunjukkan respon yang tidak nyata (Tabel 6).
Tabel 6. Respon Jumlah Daun pada Setiap Taraf Lama Perendaman dalam EMS 0.77 %
Genotipe Taraf induksi (menit)
Minggu Setelah Tanam (MST)
2 4 6 8 10 12 14 ……… helai ……… PA 0 8.33 11.8 9 16.2 23.2 26.2 31.27 105 8.60 11.87 10.4 18 26.47 28.8 29.27 120 8 11.13 9.93 18.27 25.53 27.8 29.27 Respon tn tn tn tn tn tn tn CDK 0 9.8 12.73 9.60 18.80 29.20 32.47 32.93 105 8.67 11.93 10.20 19.13 277.53 29.33 37.4 120 7.87 11.53 9.33 17.07 21.67 24.53 26.8 Respon Q* Q* tn tn tn tn tn
Keterangan: Q** = respon kuadratik nyata; PA = Puspita Asri ; Q* = respon kuadratik nyata; CDK = Chandra Kirana; tn = tidak berpengaruh nyata;
0, 105, 120 = berturut-turut adalah lama perendaman dalam EMS 0.77 % (menit).
Pertumbuhan Vegetatif Tanaman Krisan M2V2
Analisis ragam pertumbuhan vegetatif varian krisan M2V2 (Lampiran 8) menunjukkan bahwa varian krisan berpengaruh nyata terhadap peubah tinggi tanaman, jumlah ruas, dan jumlah daun, kecuali pada peubah jumlah ruas batang saat 6 MST dan peubah jumlah daun saat 12 MST yang berpengaruh nyata, serta pada peubah jumlah ruas batang saat 2 MST dan peubah jumlah daun saat 2 dan 4 MST yang tidak berpengaruh nyata. Koefisien keragaman tinggi tanaman, jumlah ruas batang, dan jumlah daun berturut-turut berkisar antara 7.82 – 14.70 %, 6.81 – 16.38 %, dan 7.88 – 25.74 %.
Perbandingan kontras orthogonal (Tabel 7) menunjukkan bahwa varian hasil induksi mutasi melalui radiasi sinar gamma dan perendaman dalam EMS 0.77 % memiliki kecenderungan berbeda sangat nyata pada peubah tinggi tanaman, jumlah ruas batang, dan jumlah daun. Perbandingan antar varian hasil induksi mutasi melalui radiasi sinar gamma (PN dan DR) tidak nyata pada ketiga peubah yang diamati, kecuali pada peubah tinggi tanaman saat 12 MST. Perbandingan antara PN 0 dan PN 20 tidak berbeda nyata pada peubah tinggi
tanaman di semua minggu pengamatan, berbeda sangat nyata pada peubah ruas batang saat 4-12 MST, dan nyata saat 14 MST, begitu pula pada peubah jumlah daun yang berbeda sangat nyata saat 6 dan 8 MST, serta nyata saat 10 dan 12 MST. Begitu pula pada DR 0 dan DR 20, kedua varian ini memiliki kecenderungan berbeda sangat nyata di ketiga peubah yang diamati. Berdasarkan hasil penelitian dapat disimpulkan bahwa pada generasi M2V2, induksi mutasi melalui radiasi sinar gamma mengakibatkan perbedaan tinggi tanaman varian krisan yang berasal dari genotipe DR, serta jumlah ruas batang dan jumlah daun pada genotipe PN dan DR. Sari (2011), melaporkan bahwa dosis radiasi sinar gamma 2 Krad pada tanaman krisan menyebabkan pertumbuhan daun terhambat pada semua kultivar krisan yang telah diradiasi. Hal ini menunjukkan bahwa dosis radiasi sinar gamma yang diberikan terbukti menghambat pertumbuhan daun tanaman krisan.
Perbandingan antara kedua genotipe hasil induksi mutasi melalui perendaman dalam EMS 0.77 % (PA dan CDK) tidak berbeda nyata pada ketiga peubah pengamatan di semua minggu pengamatan, kecuali pada peubah tinggi tanaman saat 12 MST. Kedua genotipe tersebut memiliki pertumbuhan yang hampir sama pada generasi M2V2, bertentangan dengan pertumbuhan saat generasi M2V1 yang berbeda antar kedua genotipe. Perbandingan antar varian yang berasal dari genotipe PA memiliki kecenderungan sangat nyata pada ketiga peubah pengamatan hanya pada perbandingan antara PA 0 dan PA 105, serta PA 0 dan PA 120. Tidak nyata pada perbandingan antara PA 105 dan PA 120. Selanjutnya, perbandingan antar varian yang berasal dari genotipe CDK memiliki kecenderungan tidak berbeda nyata pada ketiga peubah pengamatan.
Pengaruh induksi mutasi melalui perendaman dalam EMS 0.77 % terhadap pertumbuhan krisan genotipe PA generasi M2V2 tidak sebesar pada generasi M2V1. Semakin jauh dari generasi M0 pengaruh induksi mutasi terhadap kerusakan fisiologis tanaman akan semakin berkurang tetapi perubahan yang terjadi akan lebih stabil. Kerusakan fisiologis varian krisan generasi M2V2 tidak sebesar pada generasi M2V1, sehingga induksi mutasi tidak terlalu mempengaruhi pertumbuhan varian krisan generasi M2V2 bila dibandingkan dengan generasi M2V1.
Tabel 7. Perbandingan Kontras Orthogonal Peubah Vegetatif M2V2
Keterangan: tn = tidak berpengaruh nyata; PN = Puspita Nusantara; * = berpengaruh nyata; DR = Dewi Ratih; ** = berpengaruh sangat nyata; PA = Puspita Asri; 0, 20 = Dosis radiasi sinar gamma (Gy); CDK = Chandra Kirana; 0,105, 120 = Lama perendaman dalam EMS 0.77 % (menit).
Varian hasil induksi mutasi melalui perendaman dalam EMS 0.77 % yang berasal dari genotipe PA menunjukkan respon yang tidak nyata pada peubah tinggi tanaman, kecuali saat 4 MST. Varian yang berasal dari genotipe CDK memiliki respon linier negatif (Tabel 8), berbeda dengan generasi M2V1 yang memiliki respon kuadratik.
Perbandingan Minggu Setelah Tanam
2 4 6 8 10 12 ... Tinggi Tanaman ... Gamma Vs EMS * ** * * * tn PN Vs DR tn tn tn tn tn * PN 0 Vs PN 20 tn tn tn tn tn tn DR 0 Vs DR 20 tn ** ** * ** ** PA Vs CDK tn tn tn tn tn * PA 0 Vs PA 105 ** ** ** ** ** ** PA 0 Vs PA 120 ** ** ** ** ** ** PA 105 Vs PA 120 tn tn tn tn tn tn CDK 0 Vs CDK 105 tn tn tn tn tn tn CDK 0 Vs CDK 120 tn tn tn tn tn tn CDK105 Vs CDK120 tn tn ** ** * tn
... Jumlah ruas batang ...
Gamma Vs EMS tn ** ** ** ** * PN Vs DR tn tn tn tn tn tn PN 0 Vs PN 20 tn ** ** ** ** * DR 0 Vs DR 20 tn * tn ** ** * PA Vs CDK tn tn tn tn tn tn PA 0 Vs PA 105 * ** tn ** ** * PA 0 Vs PA 120 tn ** * ** ** ** PA 105 Vs PA 120 tn tn tn tn tn tn CDK 0 Vs CDK 105 tn tn tn tn tn tn CDK 0 Vs CDK 120 tn tn tn tn tn tn CDK105 Vs CDK120 tn tn tn tn * tn ... Jumlah Daun ... Gamma Vs EMS tn tn ** ** ** tn PN Vs DR tn tn tn tn tn tn PN 0 Vs PN 20 tn tn ** ** * * DR 0 Vs DR 20 tn tn ** * ** tn PA Vs CDK tn tn tn tn tn tn PA 0 Vs PA 105 tn tn ** * ** * PA 0 Vs PA 120 tn tn ** ** ** * PA 105 Vs PA 120 tn tn tn tn tn tn CDK 0 Vs CDK 105 tn tn tn tn tn tn CDK 0 Vs CDK 120 tn tn tn tn tn tn CDK105 Vs CDK120 tn tn tn tn tn tn