BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi, maupun sabun. Oleokimia merupakan turunan gliserol dengan asam lemak yang berubah dalam bentuk turunannya yang digunakan baik sebagai surfaktan, deterjen, polimer, aditif, bahan bakar dan sebagainya. Bahan dasar oleokimia seperti gliserol, asam lemak, alkil asam lemak, amina asam lemak dan alkohol asam lemak dapat diperoleh dengan mengubah lipida baik yang berasal dari hewan maupun tumbuhan menjadi gliserol dan turunan asam lemak.
Sumber minyak dan lemak alami dapat berasal dari bahan nabati maupun hewani. Sumber minyak nabati diantaranya adalah minyak kelapa sawit, minyak kacang kedelai, minyak biji bunga matahari, minyak biji wijen, minyak jarak dan sebagainya. Sedangkan minyak dan lemak yang berasal dari hewan yaitu seperti minyak sapi, minyak domba, minyak babi, minyak ikan dan lain-lain. Minyak dan lemak tersebut sangat luas penggunaannya, baik sebagai bahan baku lemak dan minyak yang dapat dikonsumsi maupun sebagai bahan oleokimia (Richtler dan Knault, 1984).
Produk-produk oleokimia adalah berasal dari penggunaan asam lemak dan gliserol. Penggunaan terbesar daripada asam lemak adalah dengan mengubahnya menjadi alkohol asam lemak, amida, garam asam lemak dan juga plastik termasuk nilon (hampir mencapai 40% dari total penggunaannya). Penggunaan terbesar
berikutnya sebesar 30% untuk dijadikan sabun, deterjen, dan kosmetik. Asam lemak juga digunakan sebagai bahan dasar pembuatan resin dan cat sekitar 15%, sisanya digunakan sebagai pembantu dalam industri pembuatan ban, tekstil, kulit kertas, pelumas, lilin. Penggunaan terbesar dari gliserol adalah industri farmasi dan kosmetika serta makanan (Richtler dan Knault, 1984).
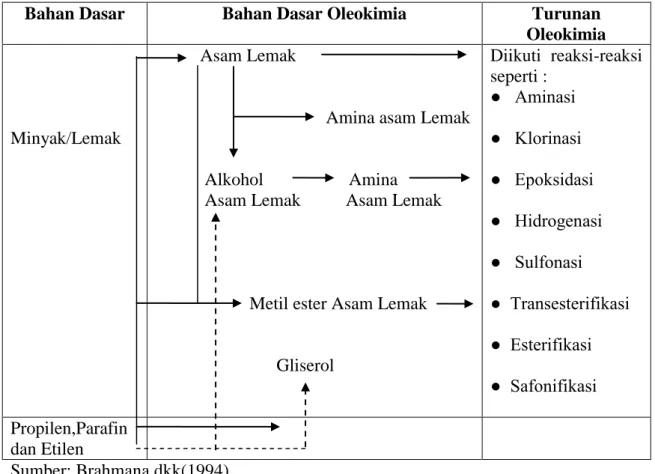
Diagram alir dari oleokimia dapat dilihat pada tabel 2.1. berikut: Tabel 2.1 Diagram Alur Oleokimia
Bahan Dasar Bahan Dasar Oleokimia Turunan
Oleokimia
Minyak/Lemak
Asam Lemak
Amina asam Lemak
Alkohol Amina Asam Lemak Asam Lemak
Metil ester Asam Lemak Gliserol Diikuti reaksi-reaksi seperti : ● Aminasi ● Klorinasi ● Epoksidasi ● Hidrogenasi ● Sulfonasi ● Transesterifikasi ● Esterifikasi ● Safonifikasi Propilen,Parafin dan Etilen Sumber: Brahmana,dkk(1994). ket: : Alami : Sintesis 2.2.Asam Lemak
Asam lemak adalah asam organik yang terdapat sebagai ester trigliserida atau lemak, baik yang berasal dari hewan maupun tumbuhan. Asam lemak adalah asam karboksilat yang mempunyai rantai karbon panjang, dimana R adalah rantai karbon yang jenuh atau tidak jenuh. Makin panjang rantai karbon, makin tinggi titik leburnya.
Asam palmitat dan stearat berupa zat padat pada suhu kamar. Asam oleat mempunyai rantai karbon sangat panjang dengan asam stearat, tetapi suhu kamar, asam oleat berupa zat cair. Disamping itu, semakin banyak jumlah ikatan rangkap semakin rendah titik leburnya (Poedjiadi, 1994).
Asam-asam lemak mempunyai jumlah atom C genap dari C2 sampai C30 dan
dalam bentuk bebas atau ester dengan gliserol. Asam lemak jenuh yang paling banyak ditemukan dalam bahan pangan adalah asam palmitat yaitu 15 sampai 50% dari seluruh asam-asam lemak yang ada.
Sebagian besar minyak nabati berbentuk cair karena mengandung sejumlah asam lemak tidak jenuh, yaitu asam oleat, linoleat, asam linolenat dengan titik cair yang rendah. Lemak hewan pada umumnya berbentuk padat pada suhu kamar karena banyak mengandung asam lemak jenuh, misalnya asam palmitat dan stearat yang mempunyai titik cair lebih tinggi. Secara alamiah asam lemak jenuh yang mengandung atom karbon C1 sampai C8 berwujud cair, sedangkan jika lebih besar dari
C8 akan berwujud padat (Ketaren, 2008).
Walaupun lemak dalam bentuk padat dan minyak dalam bentuk cairan, keduanya mempunyai struktur dasar yang sama. Lemak dan minyak adalah triester dari gliserol, yang dinamakan dengan trigliserida. Trigliserida sederhana jarang ditemukan di alam. Pada umunya lemak atau minyak tidak terdiri dari satu macam trigliserida. Karena alasan ini, komposisi lemak atau minyak biasanya dinyatakan dalam bentuk presentase bermacam-macam yang diperoleh dari hidrolisis (Hart, 2003).
2.3. Asam Oleat
Asam oleat atau asam 9-oktadekanoat adalah salah satu hasil hidrolisis lemak atau minyak tumbuh-tumbuhan. Asam ini berupa diamorf, bentuknya yang stabil mencair pada 16,10C, sedangkan yang meta stabil mencair pada 13,20C. Senyawa ini berupa
zat cair kental, hampir tidak berbau, sukar larut dalam air, tetapi larut dalam alkohol, eter, benzena dan kloroform. Asam oleat mendidih pada suhu 2330C.
H3C - (CH2)7 - CH = CH - (CH2)7 - COOH
Asam Oleat
Asam oleat mempunyai dua bentuk stereoisomer, yaitu bentuk cis dan bentuk trans. Bentuk trans asam oleat dikenal dengan nama asam elaidat.
H - C - (CH2)7 - CH3 H - C - (CH2)7 - COOH
H - C - (CH2)7 - CH3 HOOC - (CH2)7 - C - H
Cis Trans
Pada suhu rendah, akibat pengaruh alkali permanganat, asam oleat akan mengalami oksidasi menjadi asam dihidroksi stearat, sedangkan pada suhu tinggi akan mengalami oksidasi lebih lanjut membentuk asam pelargonat (pelargonic acid) dan asam azelat (azelic acid).
Hidrogenasi katalitik asam oleat akan menghasilkan asam stearat, sedangkan pada brominasi akan menghasilkan asam dibromo stearat. Pada keadaan reaksi ini, hidrogen dan halogen (brom) ditangkap atau diadisi oleh ikatan rangkap asam oleat sehingga ikatan rangkap menjadi ikatan tunggal (Sumardjo, 2006).
H3C - (CH2)7 - CH=CH - (CH2)7 - COOH
Asam Oleat
H3C - (CH2)7 - CH - CH - (CH2)7 - COOH
OH OH Asam Dihidroksi stearat
H3C - (CH2)7 - COOH + HOOC - (CH2)7 - COOH
Asam Pelargonat Asam Azelat
H3C - (CH2)7 - CH - CH - (CH2)7 - COOH H H Asam Stearat H3C - (CH2)7 - CH - CH - (CH2)7 - COOH Br Br H3C - (CH2)7 - CH=CH - (CH2)7 - COOH Asam Oleat hidroge nasi kata litik bromi nasi
Asam oleat komersial mempunyai kecenderungan berubah menjadi berwarna gelap selama dalam pemanasan. Perubahan warna ini disebabkan oleh kandungan minoritas yang terdapat dalam asam oleat yang mengalami oksidasi. Asam oleat komersial dihasilkan dari lemak daging sapi, lemak babi, dan kadang-kadang minyak sayuran yang merupakan pemanfaatan utama dari hasil pertanian (Lin, 1976).
Asam oleat, linoleat dan linolenat biasanya terdapat bersama dengan asam lemak lain seperti laurat, asam miristat, asam palmitat, asam stearat dan asam lemak lainnya. Asam lemak tidak jenuh tersebut dapat diubah ke berbagai bentuk turunannya antara lain dalam bentuk ester asam lemak dengan poliol seperti sorbitol, manitol dan sebagainya untuk surfaktan karena disamping memiliki gugus ester juga memiliki gugus hidroksil sehingga terjadi kesetimbangan antara gugus yang bersifat lipofil dengan gugus yang bersifat hidrofil (Daniel, 2005).
2.4.Senyawa Amida
Suatu amida ialah senyawa yang mempunyai nitrogen trivalent terikat pada satu gugus fungsi kabonil. Suatu amida diberi nama asam karboksilat induknya, dengan mengubah asam…-oat (atau –at) menjadi amida.
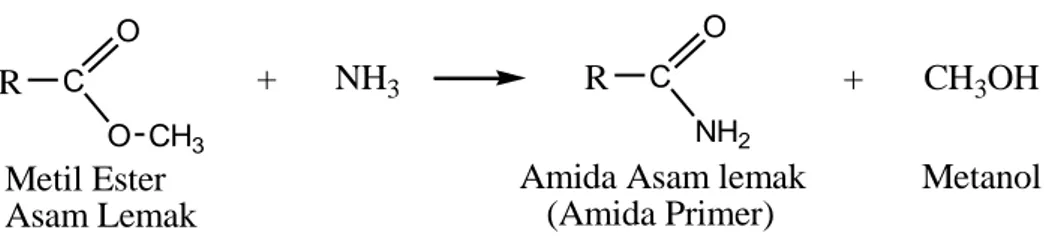
Amida asam lemak pada industri oleokimia dapat dibuat dengan mereaksikan asam lemak atau metil ester asam lemak dengan suatu amina. Amida asam lemak dibuat secara sintesis pada industri oleokimia dalam prosess batch,dimana ammonia dan asam lemak bebas bereaksi pada suhu 2000C dan tekanan345-690 kPa selama 10-12 jam. Dengan proses tersebutlah dibuat amida primer seperti lauramida, stearamida serta lainnya.
Amida primer juga dibuat dengan mereaksikan ammonia dengan metil ester asam lemak. Reaksi ini mengikuti konsep HSAB dimana H+ dari ammonia merupakan
hard-acid yang mudah bereaksi dengan hard base CH3O- untuk membentuk metanol.
Sebaliknya NH2- lebih soft-base dibandingkan dengan H3O- akan terikat dengan
Gambar 2.1. Reaksi pembentukan amida primer
Pembuatan amida sekunder dilakukan dengan mereaksikan asam lemak dengan amina primer seperti alkilamina (Gambar 2.2).
Gambar 2.2. Reaksi pembentukan amida sekunder
Senyawa amina yang digunakan untuk reaksi tersebut antara lain etanol amina dan dietanol amin, yang jika direaksikan dengan asam lemak pada suhu tinggi, 150-2000C akan membentuk suatu amida dan melepaskan air. Reaksi aminasi antara alkil klorida lebih mudah dengan gugus amina dibanding dengan terjadinya reaksi esterifikasi dengan gugus hidroksil. Adanya amina apabila direaksikan dengan ester baru terjadi pada suhu tinggi dan sangat lambat sekali apabila dilakukan pada suhu rendah dengan bantuan katalis basa Lewis NaOMe yang lebih kuat dari trietil amin. Reaksi amidasi antara amina dan ester dengan bantuan katalis NaOMe dapat terjadi pada suhu 100-1200C, sedangkan apabila tidak digunakan katalis maka reaksi baru dapat berjalan pada suhu 150-2500C (Gabriel, 1984).
Etanolamin (NH2-CH2-CH2-OH) merupakan larutan yang tidak berwarna, larut
dalam air dan biasa digunakan dalam pembuatan srubbing hidrogen sulfide (H2S) dan
CO2 yang berasal dari petroleum dan bias juga digunakan sebagai dry cleaning, dalam
pembuatan cat dan dalam bidang farmasi (obat-obatan) (Salleh,dkk, 2001).
R C O O CH3 + NH3 R C O NH2 + CH3OH Metil Ester Asam Lemak
Amida Asam lemak (Amida Primer) Metanol R C O OH + RNH2 150-200 0C R C O HN R + H2O
Amida asam lemak digunakan sebagai bahan pelumas pada proses pembuatan resin, baik sebagai pelumas internal maupun eksternal, amida tersebut berperan mengurangi gaya kohesi dari polimer sehingga meningkatkan aliran polimer pada proses pengolahan (Brahmana, 1994).
Amida berperan untuk mempengaruhi polimer yang melebur agar terlepas dari permukaan wadah logam pengolahan resin. Sebagai pelumas internal, amida berperan untuk mengurangi gaya kohesi dari polimer dan meningkatkan aliran polimer pada proses pengolahannya (Reck, 1984).
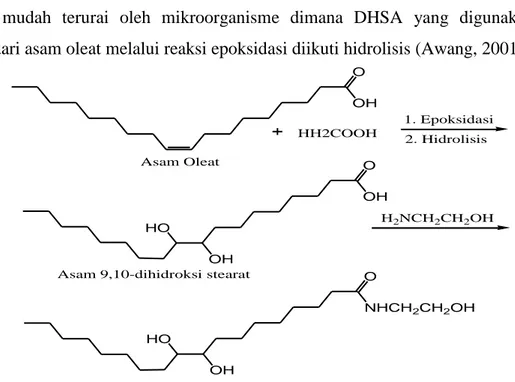
Dalam industri kimia oleo, pembuatan senyawa alkanolamin dari hasil reaksi etanolamin dengan asam 9,10-dihidroksi stearat untuk bahan surfaktan dikembangkan menjadi surfaktan non ionik yakni alkanoamida dari asam dihidroksi stearat (DHSA) yang lebih mudah terurai oleh mikroorganisme dimana DHSA yang digunakan diturunkan dari asam oleat melalui reaksi epoksidasi diikuti hidrolisis (Awang, 2001).
Gambar 2.3 Reaksi pembentukan N-etanol 9,10-dihidroksi stearamida dari asam oleat
O OH O OH OH HO O NHCH2CH2OH OH HO Asam Oleat
Asam 9,10-dihidroksi stearat
N-etanol 9,10-dihidroksi stearamida
HH2COOH
1. Epoksidasi 2. Hidrolisis
2.5. EPOKSIDA
Epoksida (oksirana) ialah eter siklik dengan cincin beranggota tiga yang mengandung satu atom oksigen (Hart,2003). Senyawa oksida pada sintesa organik merupakan zat antara yang potensial dimanfaatkan untuk beragam bentuk senyawa dengan berbagai keperluan sehingga penelitian tentang epoksidasi baik kondisi reaksi, keberlanjutan hasil reaksi maupun manfaat hasil reaksi terus dikembangkan (Wisewan, 1983).
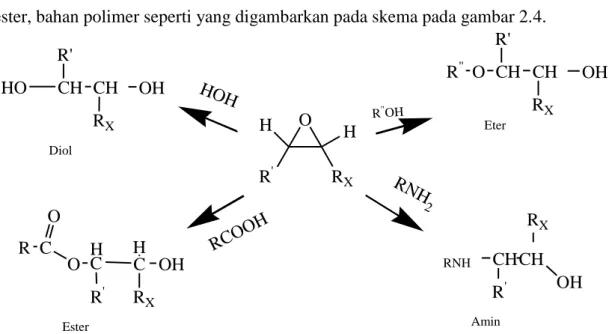
Epoksidasi terhadap ikatan rangkap adalah salah satu modifikasi kimia terhadap berbagai senyawa yang memiliki ikatan π. Berdasarkan pada kereaktifan yang tinggi dari cincin oksiran epoksida dapat dipakai sebagai zat antara untuk menghasilkan berbagai senyawa kimia yakni alkohol, alkanol amin, senyawa karbanil, ester, bahan polimer seperti yang digambarkan pada skema pada gambar 2.4.
Gambar 2.4 Skema pembentukan senyawa hasil transformasi epoksida
Minyak nabati yang memiliki kandungan asam lemak tidak jenuh merupakan sumber menarik untuk diperbaharui dalam menghasilkan produk baru yang berguna tetapi kereaktifannya perlu ditingkatkan melalui penambahan gugus fungsi kedalam molekul asam lemaknya, dengan demikian dengan berbagai reaksi kimia dan biokimia telah dilakukan berbagai cara pengubahan menjadi produk yang lebih berharga. Sejalan dengan reaksi tersebut, epoksida memegang peranan penting karena minyak maupun ester asam lemak yang terepoksidasi dapat digunakan untuk membuat senyawa-senyawa yang berbeda fungsinya dalam industri seperti plastizer, stabilizer,
CH R' CH RX OH O CH R' CH RX OH R" O HC C RX OH C O R R' H RNH CH R' CH RX OH Diol Eter Ester Amin H R' O H RX HOH RCOO H R"OH RNH 2 HO
resin, PVC, polyester, poliuretan, resin epoksi, dan pelapisan permukaan (Charlon dan Chang, 1985).
Anti hidroksilasi dapat dicapai melalui perlakuan dengan H2O2 dan asam
formiat. Dalam hal ini epoksidasi pertama sekali terjadi, diikuti dengan reaksi SN2.
C C + H2O2 C C O C C O H H+ H2O C OH C OH2 -H+ C OH C OH (March, 1992).
Jenis-jenis bahan pereaksi yang digunakan untuk epoksidasi tanpa pemutusan ikatan π yang umum digunakan untuk menghasilkan epoksida adalah senyawa peroksi (peracid). Dalam epoksidasi ini pereaksi dipersiapkan melalui reaksi asam karboksilat dengan peroksida (H202) dengan bantuan katalis asam (Hasibuan, 2000).
Epoksidasi dari minyak dilakukan secara lazim melalui peracid yang dibentuk secara in situ. Peracid yang lebih disukai adalah peracid alifatis yang lebih rendah, yang terutama adalah asam performat. Apabila peracid dibentuk secara in situ, penambahan zat pengompleks yaitu hidrogen peroksida sangat menguntungkan (Jourdan, 1980).
Epoksidasi dari minyak nabati merupakan hal yang penting dan sangat berguna terutama dalam hal sebagai stabilisator dan plastisasi bahan polimer. Berdasarkan pada kereaktifan yang tinggi dari cincin oksiran, epoksida juga dapat dipakai untuk berbagai jenis bahan kimia yaitu alkohol, glikol, alkanolamin, senyawa karbonil, senyawa olefin, dan polimer seperti poliester, poliuretan. Adapun reaksi epoksidasi terhadap gugus olefin pada senyawa alkena dan menghasilkan senyawa diol adalah sebagai berikut:
(Goud, dkk, 2006).
Dalam proses industri, hasil epoksidasi terhadap asam lemak beserta turunannya telah umum digunakan sebagai plastisizer dan stabilizer dalam pembuatan polimer (Lutz,dkk, 1980).
Gugus hidroksi pada senyawa organik dapat meningkatkan sifat hidrofil karena disamping gugus fungsi yang aktif bereaksi dengan berbagai pereaksi untuk menghasilkan senyawa baru juga dapat berinteraksi baik melalui dipol-dipol yang terbentuk maupun melalui ikatan hidrogen dan gugus hidrofil dari senyawa lain. Gugus hidroksil yang tidak terikat memberikan sifat hidrofil sedangkan gugus hidroksil yang terikat baik sebagai ester, eter dapat mengubah senyawa tersebut menjadi sifat lipofil. Adanya sifat hidrofil dan lipofil menyebabkan senyawa poliol banyak digunakan sebagai surfaktan dalam makanan, kosmetik maupun keperluan farmasi seperti obat-obatan (Jung,dkk, 1998).
2.6. SURFAKTAN
Molekul-molekul atau ion-ion yang teradsorpsi pada perbatasan (interfasa) disebut dengan bahan aktif permukaan (surface active agents) atau surfaktan. Surfaktan mempunyai peran penting untuk menurunkan tegangan permukaan bahan yang dikenai (Pavia, 1976). Aktifitas kerja suatu surfaktan disebabkan karena sifat ganda dari molekul tersebut. Molekul surfaktan memiliki bagian polar yang suka akan air dan bagian non polar yang suka lemak/minyak (Lehninger, 1988).
R C O OH + H2O2 R C O O OH + H2O R C O O OH + C H CH H C HC O + R C O OH H+ Peroksida Peracid Epoksida Olefin C OH C OH Asam karboksilat Peracid H C HC O Epoksida H2O
Pada umumnya bagian yang non polar (lipofil) adalah merupakan hidrokarbon rantai panjang, sedangkan bagian yang polar (hidrofilik) adalah suatu ion atau gugus yang kepolarannya tinggi. Berdasarkan gugus hidrofiliknya, surfaktan diklasifikasikan menjadi 4 golongan (Rosen, 1978) yaitu :
1. Surfaktan anionik, adalah surfaktan yang bagian aktifnya memiliki muatan negatif, merupakan kumpulan surfaktan terbesar. Seperti RCOONa+(sabun), danRC6H4SO3
-Na+ (alkilbenzen sulfonat).
2. Surfaktan zwiter ion, yaitu surfaktan yang memiliki muatan positif dan negatif pada bagian aktifnya atau disebut juga surfaktan ampoterik. Contohnya RN+H2CH2COO
-(asam amino rantai panjang).
3. Surfaktan kationik, adalah surfaktan yang mana bagian aktifnya mengandung muatan positif. Misalnya RNH3+Cl- (garam dari amina rantai panjang),
RN(CH3)3+Cl- (amonium klorida kuarterner).
4. Surfaktan non ionik, adalh surfaktan yang mana bagian aktifnya tidak memiliki muatan. Misalnya RCOOCH2CHOHCH2OH (monogliserida dari asam lemak rantai
panjang).
Ada tiga penggunaan surfaktan yaitu sebagai bahan pembasah (wetting agent), bahan pengemulsi (emulsing agent), dan sebagai pelarut (solubilizing agent) (Genaro, 1990).
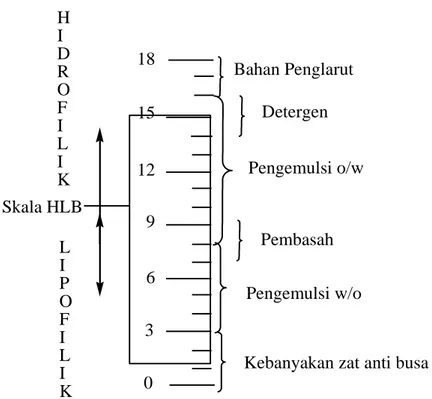
Untuk menentukan kegunaan dari suatu surfaktan maka biasanya terlebih dahulu ditentukan harga HLBnya (Hidrofilic-Lipofilic Balance). Harga HLB dapat ditentukan secara teoritis dan praktek. Harga HLB secara praktek dilakukan dengan menggunakan tensiometer cincin du Nuoy, dimana akan diperoleh harga tegangan permukaan yang setelah diplotkan dengan logaritma konsentrasi akan diperoleh harga konsentrasi kritik misel (CMC). Melalui rumus berikut akan diperoleh harga HLB.
HLB = 7-0,36 ln (Co/Cw) Dimana : Cw = CMC
Secara teori, harga HLB suatu bahan dapat dihitung berdasarkan harga gugus hidrofil, lipofil dan derivatnya yang dapat dilihat dari tabel 2.2 :
Tabel 2.2 Harga HLB untuk Beberapa Gugus Fungsi Gugus Hidrofil Harga HLB
-SO4Na 38,7
-CO2K 21,1
-CO2Na 19,1
-N( amina tersier ) 9,4
Ester ( cicncin sorbitan ) 6,8
Ester ( bebas ) 2,4
-CO2H 2,1
-(OH) ( bebas ) 1,9
-O- 1,3
-OH ( cincin sorbitan ) 0,5
Gugus Lipofil -CH -0,475 -CH2- -0,475 CH3 - -0,475 -CH- -0,475 Gugus turunan -(CH2-CH2-O)- 0,33 -(CH2-CH2-CH2-O)- -0,15 Sumber : (Genaro, 1990)
Berdasarkan harga yang tertera pada tabel diatas dapat ditentukan harga HLB secara teori dengan menggunakan rumus sebagai berikut:
HLB = Σ (gugus hidrofil) - Σ (gugus lipofil) + 7
Untuk senyawa ester asam lemak polihidroksi alkohol nilai HLBnya ditentukan berdasarkan persamaan dibawah ini:
HLB = 20 (1-S/A)
Dimana: S = bilangan penyabunan dari ester A = bilangan asam dari asam lemak
Hubungan antara nilai HLB dengan penggunaaannya sebagai surfaktan dapat dilihat pada gambar 2.5: 15 12 6 3 0 18 Bahan Penglarut Detergen Pengemulsi o/w Pembasah Pengemulsi w/o
Kebanyakan zat anti busa 9 Skala HLB H I D R O F I L I K L I P O F I L I K
Gambar 2.5 Skala Keseimbangan Hydrdofilik Lipofilik (HLB)
Surfaktan digunakan dalam volume besar pada berbagai produk kebutuhan rumah tangga, deterjen dan produk-produk pembersih lainnya. Biasanya setelah digunakan, produk yang mengandung surfaktan tersebut dibuang sebagai limbah yang mana pada akhirnya akan dibebaskan ke permukaan air. Biodegradasi dan mekanisme penguraian lain sangat diperlukan untuk mengurangi jumlah dan konsentrasi surfaktan yang mencapai lingkungan.
Salah satu alternatif untuk mengurangi kerusakan lingkungan yang berhubungan dengan penggunaan surfaktan adalah memperluas penggunaan surfaktan alami. Monogliserida, digliserida dan turunan fosfolipid seperti lesitin termasuk turunan ester asam lemak dengan poliol yang dibuat secara sintetis seperti ester sorbitol, ester glukosa dan lainnya merupakan surfaktan alami. Begitu juga dengan mereaksikan metil ester asam lemak dengan epoksida (Brahmana, 1994).
Akhir-akhir ini sintesa biosurfaktan, yaitu surfaktan yang dihasilkan melalui mediasi dengan katalis biologi makin berkembang. Keuntungan biosurfaktan ini
dengan surfaktan lain adalah : biodegredable, efektif pada temperatur, pH dan salinitas ekstrim, spesifitas tinggi sehingga keharusan untuk melindungi gugus fungsi multi masih berkurang. Surfaktan ini telah banyak dimanfaatkan pada industri, pertanian dan oil recovery yang berfungsi sebagai wetting agent dan industri farmasi dan kosmetika sebagai foaming dan emulsifier (Makkar dan Swaranjits, 1997).
Sabun memperlihatkan sifat-sifatnya terhadap kombinasi dari gugus karboksilat yang bersifat polar dengan rantai hidrokarbon yang nonpolar terhadap molekul yang sama. Dalam larutan berair, sejumlah besar molekul-molekul sabun berkumpul dalam bentuk bola yang dikenal sebagai misel. Ujung karboksilat yang polar dari molekul berada ditepi luar misel karena daya tarik terhadap air (hidrofilik). Ujung hidrokarbon yang nonpolar dari molekul berkumpul bersama pada pusat misel sehingga mengurangi hubungannya terhadap air (hidrofobik) (Pine, 1984).
Setiap molekul sabun memiliki gugus hidrofil dan hidrofob dimana dapat ditulis sebagai RCOONa. Ketika sabun dilarutkan ke dalam air maka akan terionisasi menjadi RCOO-Na+. Bagian yang berperan aktif dalam sifat deterjennya ialah RCOO -dan menghasilkan anion, sehingga sabun dimasukkan ke dalam jenis surfaktan anion.
Fungsi dari sabun ialah untuk menghilangkan kotoran dari permukaan seperti kulit, lantai atau pakaian. Kotoran biasanya campuran bahan berlemak dan partikel padat. Meskipun dapat berupa kotoran tanpa lemak, partikel padat dapat berupa pigmen, kabon, karat besi. Lemak yang dihasilkan dari kulit ataupun sumber lain dapat dihilangkan dari permukaan dengan menggunakan deterjen dengan cara :
a. Mereduksi atau menurunkan tegangan permukaan dari air b. Memindahkan atau mengangkat kotoran
c. Mendispersikan kotoran
Pada saat lemak ikut bersama kotoran lainnya, bagian hidrofob masuk kedalam permukaan daripada lemak tersebut dan bagian hidrofil larut dalam air. Partikel berkarat akan ikut bersama bagian hidrofil dari molekul deterjen dan akan diangkut bersama bagian hidrofob (Parasuram, 1995).
Sabun kalium disebut sabun lunak dan digunakan sebagai sabun bayi. Asam lemak yang digunakan untuk sabun umumnya adalah asam palmitat atau stearat. Dalam industri, sabun tidak dibuat dari asam lemak tetapi langsung dari minyak yang berasal dari tumbuhan. Minyak adalah ester asam lemak tidak jenuh dengan gliserol. Melalui proses hidrogenasi dengan bantuan katalis logam Pt atau Ni, asam lemak tidak jenuh diubah menjadi asam lemak jenuh dan melalui proses penyabunan dengan basa NaOH atau KOH akan terbentuk sabun dan gliserol (Poedjiadi, 1994).