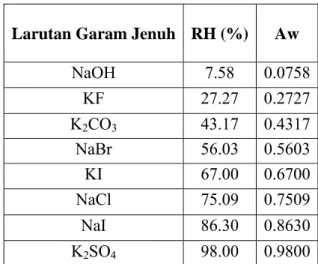
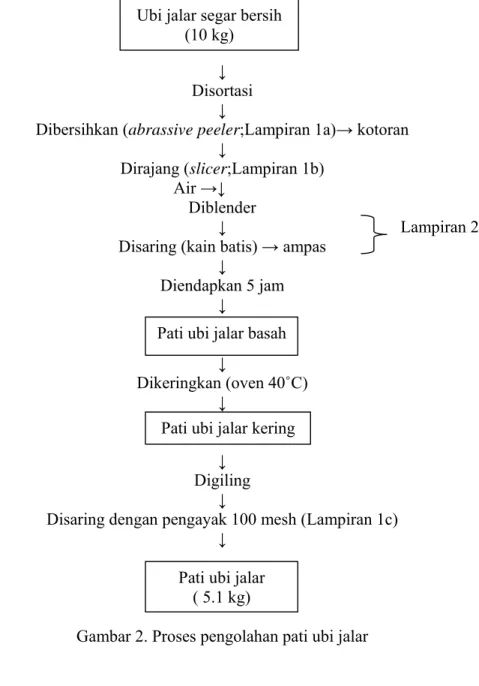
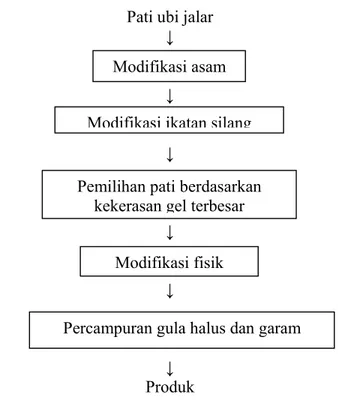
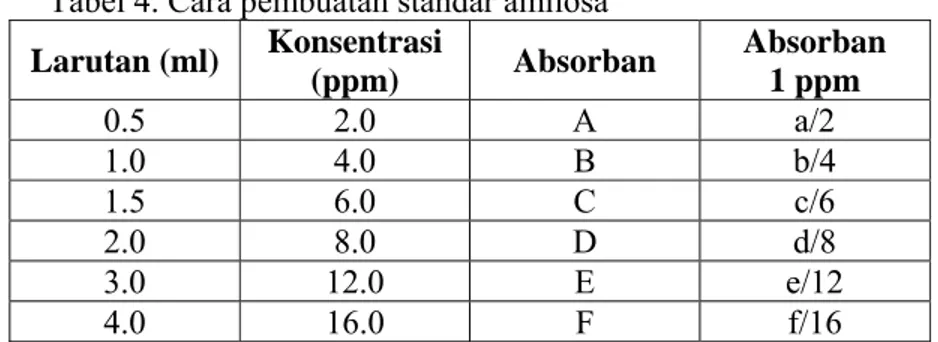
III. METODOLOGI PENELITIAN
Teks penuh
Gambar

Dokumen terkait
Pada stadium tanaman menghasilkan yang mempunyai tajuk tanaman yang lebat, cahaya yang dteruskan sampai ke permukaan tanah lebih sedikit, maka vegetasi gulma yang ada
Kehadiran Netlabel memberi peluang yang besar bagi para musisi karena dapat membantu mereka yang tidak memiliki cukup bujet untuk merilis karya mereka melalui label-label “ offl
-Kurangnya informasi dalam bentuk animasi edukasi mengenai cara yang baik yang dapat dilakukan dalam merawat gigi.. 4.2.1.2 Masalah Yang
At ayon kay Halliday (1978), mas madalas na pinagsasabay ng isang tagapagsalita ang kasanayan niya sa diyalekto sa rehistro isang symbiotic relationship and
Setelah menyelesaikan penelitian, peneliti dapat menyimpulkan bahwa upaya pembentukan keluarga sakinah di Majelis Taklim Padangsidimpuan yaitu meningkatkan
Pada Laporan Akhir ini, penulis mengambil latar belakang penulisan laporan di PT Erlangga Cabang Kayuagung, dengan mengambil pembahasan tentang pengolahan data penjulan
Psikologi agama dan kesehatan mental yang terdiri dari definisi psikologi agama, sejarah dan perkembangan psikologi agama dan objek kajian psikologi agama dan kesehatan
Kasus khusus dari persamaan Bernoulli adalah untuk fluida yang diam (fluida statis). Ketika fluida diam alias tidak bergerak, fluida tersebut tentu saja tidak