LAPORAN PRAKTIKUM
TEKNIK PEMBENIHAN PERIKANAN LAUT
ACARA I
KULTUR PAKAN ALAMI
(Chlorella sp. dan Nannochloropsis sp.)
Oleh :
Nama : Lathifah
NIM : B0A013042
Kelompok : 3
KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGI
PROGRAM STUDI DIII PENGELOLAAN SUMBERDAYA PERIKANAN DAN KELAUTAN
I.
PENDAHULUAN
I.1 Latar BelakangPakan alami adalah sumber pakan yang penting dalam usaha pembenihan ikan, udang, kepiting, dan kerang. Pakan alami merupakan pakan yang sudah tersedia di alam, sedangkan pakan buatan adalah pakan yang dibuat dari beberapa macam bahan yang kemudian diolah menjadi bentuk khusus sesuai dengan yang dikehendaki. Pemberian pakan yang berkualitas akan memperkecil persentase kematian larva. Dalam budidaya teritama dalam usaha pembenihan, pakan merupakan salah satu faktor pembatas. Secara umum pakan terdiri dari pakan alami dan pakan buatan. Pakan alami terbagi atas fitoplankton, zooplankton dan benthos. Salah satu fitoplankton yang banyak digunakan sebagai pakan utama dalam pembenihan ikan air laut adalah Nannochloropsis sp. karena memiliki syarat yang dibutuhkan sebagai pakan larva yaitu mudah dicerna, berukuran kecil, nutrisi tinggi, mudah dibudidayakan, dan cepat berkembang biak.
Indonesia memiliki keanekaragaman hayati yang sangat berlimpah, termasuk didalamnya adalah keanekaragaman hayati mikroalga. Mikroalga adalah tanaman yang paling efisien dalam menangkap dan memanfaatkan energi matahari dan CO2 untuk keperluan fotosintesis. Selain itu, CO2 dimanfaatkan untuk
meningkatkan produktivitas. Di Indonesia sendiri dapat dijumpai ratusan jenis mikroalga. Pada sisi lain, fungsi ekologis mikroalga sangat membantu dalam pencegahan terjadinya pemanasan global. Beberapa jenis mikroalga yang banyak dijumpai pada wilayah perairan serta dibudidayakan antara lain Chlorella vulgaris,
Chlorella sp. dan Nannochloropsis oculata.
Mikroalga merupakan tumbuhan air yang memiliki berbagai potensi yang dapat dikembangkan sebagai sumber pakan, pangan, dan telah dimanfaatkan untuk berbagai macam keperluan mulai dari bidang perikanan sebagai makanan larva ikan, organisme penyaring, industri farmasi, dan makanan suplemen dengan kandungan protein, karbohidrat, lipid, dan berbagai macam mineral. Selain itu, mikroalga juga digunakan dalam pengolahan limbah logam berat sebagai pengikat logam dari badan air dan mengendapkannya pada dasar kolan serta dimanfaatkan sebagai sumber energi alternatif untuk biodiesel.
Praktikum kultur pakan alami ini bertujuan untuk:
1. Mengetahui faktor yang mempengaruhi pertumbuhan fitoplankton. 2. Mengetahui fase-fase kehidupan fitoplankton yang dikultur.
3. Mengetahui cara menghitung kepadatan fitoplankton.
I.3 Manfaat
II.
TINJAUAN PUSTAKA
II.1 Marine phytoplanktonFitoplankton adalah sekelompok dari biota tumbuh-tumbuhan autotrof, mempunyai klorofil dan pigmen lainnya di dalam selnya dan mampu untuk menyerang energi radiasi dan CO2 untuk melakukan fotosintesis. Proses
fotosintesis pada ekosistem air yang dilakukan oleh fitoplankton sebagai produsen merupakan sumber energi utama bagi kelompok organisme air lainnya yang berperan sebagai konsumen. Biota tersebut mampu mensintesis bahan-bahan anorganik untuk dirubah menjadi bahan organik (yang terpenting yaitu karbohidrat) (Zhong, 1989).
Fitoplankton mempunyai peranan yang sangat penting di dalam suatu perairan, selain sebagai dasar dari rantai pakan (primary producer) juga merupakan salah satu parameter tingkat kesuburan suatu perairan. Fitoplankton membentuk sejumlah besar biomassa di laut, kelompok ini hanya diwakili oleh beberapa filum saja. Sebagian besar bersel satu dan mikroskopik, dan mereka termasuk filum Chrysophyta, yakni alga kuning-hijau yang meliputi diatom dan kokolifotor. Selain ini terdapat beberapa jenis alga hijau-biru (Cyanophyta), alga coklat (Phaeophyta) dan satu kelompok besar dari Dinoflagellata (Pyrophyta) (Rimper, 2002).
II.2 Chlorella sp.
Chlorella sp. merupakan alga bersel tunggal dari golongan alga hijau
(Chloropyta) yang telah dimanfaatkan secara komersial karena gizinya yang tinggi (Sriharti dan Carolina, 1995). Chlorella sp. memiliki peranan dalam memenuhi kebutuhan manusia diantaranya sebagai makanan tambahan atau suplemen karena kandungan nutrisinya lengkap (Royan, dkk, 2010). Meningkatnya permintaan akan
Chlorella sp. merupakan peluang dilakukannya peningkatan kultur Chlorella sp.
Chlorella sp. merupakan alga hijau yang diklasifikasikan sebagai berikut:
Phylum : Chlorophyta
Kelas : Chlorophyceae
Ordo : Chlorococcaales
Family : Chlorellaceae
Spesies : Chlorella sp. (Bougis, 1979)
Chlorella sp. merupakan ganggang hijau bersel tunggal (uniseluler) dan
berukuran mikroskopis. Tubuh Chlorella berbentuk bulat seperti bola ataupun bulat telur dan diameter selnya berukuran 3 – 8 mikrometer. Chlorella sp. berwarna hijau dikarenakan selnya mengandung klorofil dalam jumlah yang besar daripada karoten dan xantofil. Sel Chlorella sp. mempunyai protoplasma yang berbentuk cawan tidak mempunyai flagella sehingga tidak dapat bergerak aktif, dinding selnya terdiri dari selulosa dan pektin, tiap-tiap selnya terdapat satu buah inti sel dan satu kloroplas. Protoplasma sel Chlorella diliputi oleh suatu membran yang sangat selektif terhadap apa saja yang memasuki sel (Novitasari et al., 2012).
Menurut Isnansetyo dan Kurniastuty (1995), Chlorella bereproduksi secara aseksual dengan pembelahan sel, tetapi juga dapat dengan pembelaha autospora dari sel induknya. Tiap satu sel induk (parrent cell) akan membelah menjadi 4, 8, atau 16 autospora yang nantinya akan menjadi sel-sel anak (daughter cell) dan melepaskan diri dari induknya (Bold dan Wynne, 1985).
Menurut Kumar dan Singh (1979) proses reproduksi Chlorella dapat dibagi menjadi empat tahap, yaitu tahap pertumbuhan, pemasakan awal, pemasakan akhir, dan pelepasan autospora. Tahap pertama adalah tahap pertumbuhan. Pada tahap ini
sel Chlorella tumbuh membesar dan setelah itu terjadi peningkatan aktivitas sintesa
yang merupakan persiapan awal pembentukan spora. Peningkatan aktivitas sintesa merupakan tahap kedua yaitu pemasakan awal. Setelah tahap pemasakan awal selesai maka dilanjutkan dengan tahap pemasakan akhir atau tahap ketiga. Pada tahap ketiga, autospora mulai terbentuk yang setelah itu disusul tahap keempat. Tahap keempat adalah tahap pelepasan autospora. Pelepasan autospora dimulai dengan dinding sel induk yang akan pecah dan diikui oleh pelepasan autospora yang nantinya akan tumbuh menjadi sel induk muda.
II.3 Nannochloropsis sp.
Nannochloropsis adalah genus ganggang yang terdiri dari sekitar 6 spesies.
dengan baik cahaya atau mikroskop elektron. karakterisasi ini kebanyakan
Nannochloropsis sp. merupakan mikroalga berwarna kehijauan, selnya
berbentuk bola, berukuran kecil dengan diameter 2 – 4 µm, memiliki 2 flagel dengan salah satu flagelnya berambut tipis. Nannochloropsis memiliki kloroplas dan nukleus yang dilapisi membran. Kloroplas memiliki stigma (bintik mata) yang bersifat sensitif terhadap cahaya. Nannochloropsis dapat berfotosintesis karena memiliki klotofil. Ciri khas dari Nannochloropsis sp. adalah memiliki dinding sel yang terbuat dari komponen selulosa (Fachrullah, 2011).
Perkembangbiakan Nannochloropsis sp. terjadi secara aseksual yaitu dengan pembelahan sel atau pemisahan autospora dari sel induknya. Reproduksi sel ini diawali dengan pertumbuhan sel yang membesar. Periode selanjutnya adalah terjadinya peningkatan aktivitas sintesa sebagai bagian dari persiapan pembentukan sel anak, yang merupakan tingkat pemasakan awal. Tahap selanjutnya terbentuknya sel induk muda yang merupakan tingkat pemasakan akhir, yang disusul dengan pelepasan sel anak (Borowitzka, 1988).
Chlorella hidup pada perairan tawar ataupun laut (Lin Wu, et al., 2000). Menurut Bold dan Wynne (1985) berdasarkan habitat hidupnya Chlorella dapat dibedakan menjadi Chlorella air tawar dan Chlorella air laut. Chlorella air tawar dapat mentolerir dengan kadar salinitas hingga 5 ppt, sementara Chlorella air laut dapat mentolerir salinitas antara 33 – 40 ppt. Chlorella tumbuh pada salinitas 25 ppt. Chlorella merupakan mesofilik dan termofilik. Chlorella tumbuh optimum pada suhu 25oC (Richmond, 1986). Chlorella tumbuh baik pada suhu 20oC, tetapi
tumbuh lambat pada suhu 32oC. Tumbuh sangat baik pada suhu antara 25 – 30oC
(Isnansetyo dan Kurniastuty, 1995). pH yang sesuai untuk pertumbuhan Chlorella
berkisar antara 4,5 – 9,3 (Prihantini, et al., 2005).
Nannochloropsis dapat tumbuh pada salinitas 0 – 35 ppt. Salinitas optimum
untuk pertumbuhannya adalah 25 – 35 ppt dengan kisaran suhu optimal yaitu 25 –
30oC. Nannochloropsis sp. dapat tumbuh baik pada kisaran pH 8 – 9,5 dan
intensitas cahaya 100 – 10000 lux (Widianingsih, 2011). Nannochloropsis
membutuhkan beberapa nutrien untuk dapat tumbuh dengan baik. Nutrien tersebut terdiri dari unsur makro dan mikro. Unsur makro terdiri dari N, P, Fe, K, Mg, S, dan Ca sedangkan unsur mikro terdiri dari H2BO3, MnCl3, ZnCl2, CoCl2,
III.
MATERI DAN METODE
III.1 MateriIII.1.1 Alat
Alat yang digunakan dalam praktikum ini adalah botol air mineral 600 ml, aerator, mikroskop, kaca preparat, dan haemocytometer.
III.1.2 Bahan
Bahan yang digunakan adalah inokulum Chlorella sp. dan Nannochloropsis
sp.yang diperoleh dari hatchery marikultur FPIK Unsoed dan media pupuk Walne, Conwy dan Guillard.
Disiapkan botol berukuran 600 ml lengkap dengan aerasi.
Botol diisi dengan air laut steril bersalinitas >30 ppt.
Inokulum dimasukkan ke dalam botol kultur.
Tambahkan pupuk Conwy ke dalam botol kultur.
Acuan pemberian pupuk dengan perbandingan 1 ml : 1 L.
Botol kultur ditempatkan pada kisaran cahaya 2500 – 4000 lux, pengukuran
cahaya menggunakan luxmeter.
Setelah dikultur selama 10 hari, kepadatan fitoplankton dihitung.
Sampel fitoplankton diambil dengan pipet tetes, teteskan ke dalam
haemocytometer sebanyak 1 tetes.
Tempatkan haemocytometer di bawah mikroskop.
Diamati kepadatan fitoplankton pada 4 sudut kotak haemocytometer.
Dicatat hasil yang didapat.
Dimasukkan ke dalam rumus kepadatan :
Kepadatan = K1+K2+K3+K4
4 x 25 x 104
IV.
HASIL DAN PEMBAHASAN
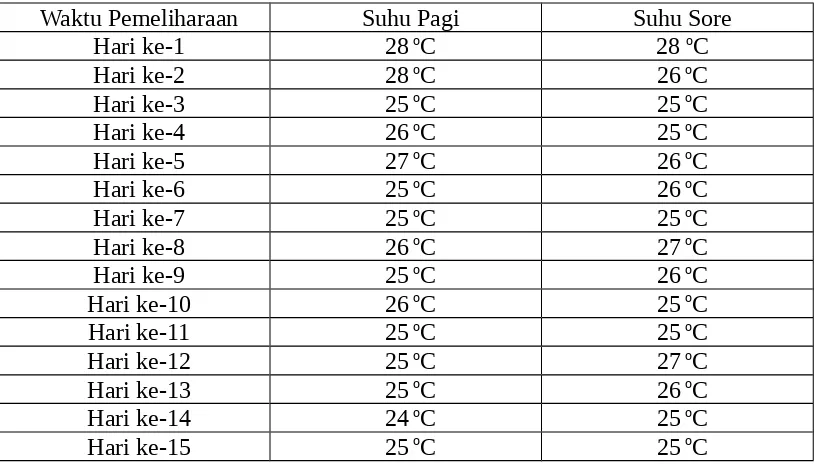
Hari ke-1 12 November 2014 250.000 sel/ml 1.125.000 sel/ml
Hari ke-2 13 November 2014 500.000 sel/ml 1.625.000 sel/ml
Hari ke-3 14 November 2014 1.125.000 sel/ml 1.937.500 sel/ml
Hari ke-4 15 November 2014 1.500.000 sel/ml 3.187.500 sel/ml
Hari ke-5 16 November 2014 1.000.000 sel/ml 3.437.500 sel/ml
Hari ke-6 17 November 2014 1.187.000 sel/ml 3.312.500 sel/ml
Hari ke-7 18 November 2014 2.125.000 sel/ml 3.625.000 sel/ml
Hari ke-8 19 November 2014 1.500.000 sel/ml 3.125.000 sel/ml
Hari ke-9 20 November 2014 2.187000 sel/ml 3.687.500 sel/ml
Hari ke-10 21 November 2014 2.312.000 sel/ml 4.562.000 sel/ml
= 58
Gambar 3. Pupuk Conwy Gambar 4. Inokulum/Bibit
IV.2 Pembahasan
Chlorella sp. merupakan alga bersel tunggan (uniselular), berukuran
mikroskopis, diameter selnya berukuran 2 – 8 mikrometer, berbentuk bulat seperti bola dan bulat telur (Suriawiria, 1987). Sedangkan Nannochloropsis sp. merupakan mikroalga berwarna kehijauan, selnya berbentuk bola, berukuran kecil dengan diameter 2 – 4 µm, memiliki 2 flagel dengan salah satu flagelnya berambut tipis.
Nannochloropsis memiliki kloroplas dan nukleus yang dilapisi membran
(Fachrullah, 2011).
Berdasarkan hasil dari kelompok 3 Teknik Pembenihan Perikanan Laut diketahui jumlah Chlorella sp. pada hari ke-1 yaitu sebanyak 250.000 sel/ml dan jumlah Nannochloropsis sebnayak 1.125.000 sel/ml, tidak terjadi penambahan jumlah sel yang signifikan pada hari pertama, hal ini disebut fase istirahat. Fase istirahat yaitu terjadi sesaat setelah inokulasi plankton dalam media kultur. Fase ini ditandai dengan populasi tidak mengalami perubahan. Fase ini disebut juga fase adaptasi, tidak terjadi fase perubahan, hanya terjadi peningkatan ukuran sel (Umainana, 2012). Kemudian pada hari ke-2 sampai hari ke-4 terjadi kenaikan
Chlorella dengan jumlah rata-rata 500.000 sel/ml dan Nannochloropsis terjadi
kenaikan dengan jumlah rata-rata 352.000 sel/ml. Fase ini disebut fase logaritmik, fase logaritmik adalah fase yang terjadi setelah fase istirahat yang ditandai dengan pembelahan sel-sel baru dan laju pertumbuhan tetap (Umainana, 2012). Namun pada hari ke-5 terjadi penurunan jumlah sel Chlorella menjadi 1.000.000 sel/ml, sedangkan Nannochloropsis terjadi penurunan pada hari ke-6 menjadi 3.312.500 sel/ml, hal ini disebut fase penurunan relatif yaitu fase yang terjadi setelah fase logaritmik. Fase ini disebabkan beberapa faktor antara lain pengendapan partikel nutrien, laju penyediaan CO2 dan O2 yang menurun, perubahan pH media yang
adalah fase akhir dari pola pertumbuhan fitoplankton. Fase kematian ditandai dengan penurunan jumlah/kepadatan plankton. Laju kematian plankton dipengaruhi oleh ketersediaan nutrien, ahaya, temperataur, dan umur plankton itu sendiri (Umainana, 2012). Fase kematian belum terjadi pada kelompok kami, hal ini dikarenakan fase kematian terjadi berkisar hari ke-15 dan seterusnya sedangkan pengamatan yang dilakukan hanya dilakukan sampai hari ke-10.
Faktor-faktor yang mempengaruhi pertumbuhan plankton dibagi menjadi dua kelompok yaitu:
a. Faktor fisika
Cahaya
Ketersediaan cahaya di perairan baik secara kuantitatif maupun kualitatif sangat tergantung pada waktu (harian, musiman, tahunan), tempat (kedalaman, letak geografis), kondisi prevalen di atas permukaan perairan (penutupan awan), atau dalam perairan (absorpsi oleh air dan material-material terlarut, serta penghamburan oleh partikel-partikel tersuspensi). Laju pertumbuhan fitoplankton sangat tergantung pada ketersediaan cahaya di dalam perairan. Laju pertumbuhan maksimum fitoplankton akan mengalami penurunan bila perairan berada pada kondisi ketersediaan cahaya yang rendah.
Suhu
Suhu air dapat mempengaruhi sifat fisika kimia perairan maupun biologi, kenaikan suhu dapat menurunkan kandungan oksigen serta menaikkan daya toksik yang ada dalam suatu perairan. Suhu air mempengaruhi kandungan oksigen terlarut dalam air, semakin tinggi suhu maka semakin kurang kandungan oksigen terlarut. Suhu air mempunyai pengaruh yang besar terhadap proses pertukaran zat atau metabolisme dari makhluk hidup dan suhu juga mempengaruhi pertumbuhan plankton. Perkembangan plankton optimal terjadi dalam kisaran suhu antara 25oC – 30oC.
Kekeruhan/kecerahan
Kekeruhan sangat mempengaruhi perkembangan plankton, apabila kekeruhan tinggi maka cahaya matahari tidak dapat menembus perairan dan menyebabkan fitoplankton tidak dapat melakukan proses fotosintesis.
Pergerakan air
membantu penyebab plankton dari satu tempat ke tempat lainnya dan membantu menyuplai bahan makanan yang dibutuhkan plankton.
b. Faktor kimia
Derajat keasaman (pH)
Derajat keasaman (ph) berpengaruh sangat besar terhadap tumbuh-tumbuhan dan hewan air sehingga sering digunakan sebagai petunjuk untuk menyatakan baik atau tidaknya kondisi air sebagai media hidup. Apabila derajat keasaman tinggi apakah itu asam atau basa menyebabkan proses fisiologis pada plankton terganggu.
Oksigen terlarut
Oksigen terlarut diperlukan oleh tumbuhan air, plankton dan fauna air untuk bernapas serta diperlukan oleh bakteri untuk dekomposisi. Dengan adanya proses dekomposisi yang dilakukan oleh bakteri menyebabkan keadaan unsur hara tetap tersedia di perairan. Hal ini sangat menunjang pertumbuhan air, plankton dan perifiton.
Salinitas
Salinitas berperanan penting dalam kehidupan organisme, misalnya distribusi biota akuatik. Daerah pesisir pantai merupakan perairan dinamis, yang menyebabkan variasi salinitas tidak begitu besar. Organisme yang hidup cenderung mempunyai toleransi terhadap perubahan salinitas sampai dengan 15‰.
Nutrisi
Nutrisi sangat berperan penting untuk pertumbuhan plankton, nutrisi yang paling penting dalam hal ini adalah nitrat (NO3) dan fosfat (PO4).
Fitoplankton mengkonsumsi nitrogen dalam banyak bentuk, seperti nitrogen dari nitrat, ammonia, urea, asam amino. Tetapi fitoplankton lebih cenderung mengkonsumsi nitrat dan ammonia. Nitrat lebih banyak didapati di dasar yang banyak mengandung unsur organik daripada dari air laut, nitrat juga bisa diperoleh dari siklus nitrogen. Nitrogen dari nitrat adalah salah satu unsur penting untuk pertumbuhan blue green alga dan fitoplankton lainnya.
Chlorella termasuk cepat berkembang biak, mengandung gizi yang cukup
disebut Chlorellin yang dapat melawan penyakit-penyakit yang disebabkan oleh bakteri.
Nannochloropsis sp. memiliki kandungan lipid yang cukup tinggi yaitu
antara 31-68% berat kering. Presentase PUFA utama C20:5 3ɷ
pada Nannochloropsis sp. tetap stabil pada kondisi dengan keterbatasan cahaya, akan tetapi pada kondisi dengan intensitas cahaya jenuh kandungan PUFA menurun yang diikuti dengan kenaikan proporsi SFA dan MUFAnya.
Nannochloropsis sp. dapat dimanfaatkan sebagai makanan zooplankton (rotifer,
V.
KESIMPULAN
Dari praktikum yang telah dilakukan, dapat ditarik kesimpulan yaitu:
1. Faktor yang mempengaruhi kehidupan fitoplankton adalah faktor fisika dan kimia. Faktor fisika meliputi chaya, suhu, kekeruhan, dan pergerakan air. Sedangkan faktor kimia meliputi derajat keasaman (pH), salinitas, oksigen terlarut, dan nutrisi.
2. Fase kehidupan fitoplankton dari mulai pemberian benih ke dalam media adalah fase adaptasi/fase istirahat, fase logaritmik, fase penurunan relatif, fase stasioner, dan fase kematian.
3. Cara perhitungan kepadatan fitoplankton menggunakan rumus : Kepadatan = K1+K2+K3+K4
DAFTAR PUSTAKA
Bold, H. C. dan M. J. Wynne. 1978. Introduction to The Algae, Second Edition. Pretice Hall Mc. Engelwood Cliffs. New York.
Bold, H. C. dan M. J. Wynne. 1985. Introduction To The Alga Structure And
Reproduction. Prentice Hall Inc. Engewood. New Jersey.
Borowitzka, M. A. 1988. Algal Growth Media And Sources Of Algal Cultures. In : Borowitzka, M. A & L. J Borowitza (Eds) Microalga Biotechnology. Cambridge University Press: Cambridge. pp. 456-465.
Bougis, P. 1979. Marine Plankton Ecology. American Elsevier Publishing Company. New York.
Chen, J. and H. P. C. Shetty. 1991. Culture Of Marine Feed Organisms. National Inland Institute Kasetsart University Campus. Bangkhen, Bangkok, Thailand.38 P.
Fachrulah, M. R. 2011. Laju Pertumbuhan Mikroalga Penghasil Biofuel Jenis
Chlorela sp. dan Nanochloropsis sp. yang Dikultivasi Mengunakan Air
Limbah Hasil Penambangan Timah di Pulau Bangka. Institut Pertanian
Bogor. Fakultas Perikanan dan Ilmu Kelautan. Bogor. Skripsi. Hal 9.
Hibberd, D. J. 1981. Notes On The Taxonomy And Nomenclature Of The Algal
Classes Eustigmatophyceae And Tribophyceae (Synonym Xanthophyceae).
Journal of the Linnean Society of London, Botany 82: 93-119, 17 figs, 1 table.
Isnansetyo, A. dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan
Zooplankton, Pakan Alam Untuk Pembenihan Organisme Laut. Kanisius.
Yogyakarta.
Kumar, H. D. dan Singh, H. N. 1979. A Texbook On Algae. Mac. Millan Int. College ed. London.
Lin Wu, H., S. H. Ruey, dan P. L. Liang. 2000. Identification of Chlorella spp.
Isolated Using Ribosomal DNA Sequences. Bot. Bull Acad Sin (2001) 42:
115-121.
Novitasari, W., Mahasri, G., dan Masithah, E. D. 2012. Pengaruh Konsentrasi
Pupuk Lemna minor Terhadap Populasi Chlorella sp. Universitas
Airlangga. Surabaya.
Prihantini, N. B., Putri, B., dan Yuniati, R. 2005. Pertumbuhan Chlorella sp.
Dalam Medium Ekstrak Tauge (MET) Dengan Variasi pH Awal. Fakultas
Richmond, A. 1986. CRC Handbook Of Microalgal Mass Culture. CRC Press, Inc. Florida. p. 199-244.
Rimper, J. 2002. Kelimpahan Fitoplankton Dan Kondisi Oseanografi Perairan. IPB. Bogor.
Srihati dan Carolina. 1997. Pengaruh Berbagai Media Terhadap Kualitas Algae
Bersel Tunggal (Scenedesmus sp.). Lembaga Ilmu Pengetahuan Indonesia.
LIPI. Hal 877-882.
Suriawiria, U. 1987. Simbiosis dan Karakteristik Chlorella. Intermedia. Jakarta.
Umainana, M. R., Mubarak, A. S., Masithah, E. D. 2012. Pengaruh Konsentrasi Pupuk Daun Turi Putih (Sesbania grandiflora) Terhadap Populasi
Chlorella sp.. Universitas Airlangga. Surabaya.
Widianingsih, H. R., Endrawati, Y. E., dan Iriani, V. R. 2011. Pengaruh Pengurangan Konsentrasi Nutrien Fosfat dan Nitrat Terhadap Kandungan
Lipid Total Nanochloropsis oculata. Universitas Diponegoro. Semarang.
Jurnal Ilmu Kelautan Maret 201. Vol. 16 (1) 24-29. Hal 24-25.
LAPORAN PRAKTIKUM
TEKNIK PEMBENIHAN PERIKANAN LAUT
ACARA II
PENDEDERAN NENER BANDENG
(Chanos chanos)
Oleh :
Nama : Lathifah
NIM : B0A013042
Kelompok : 3
KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGI
PROGRAM STUDI DIII PENGELOLAAN SUMBERDAYA PERIKANAN DAN KELAUTAN
I.
PENDAHULUAN
I.1 Latar BelakangIndonesia merupakan negara maritim yang mempunyai potensi sumber daya perairan yang besar dilihat dari panjang garis pantai yaitu ± 81.000 km dan luas areal yang dapat digunakan untuk budidaya ikan ±24.530.000 Ha berdasarkan perhitungan sekitar 5 km dari garis pantai ke arah laut. Pengembangan budidaya laut berperan penting untuk pembangunan sektor perikanan dan merupakan salah satu prioritas yang diharapkan menjadi sumber pertumbuhan dari sektor perikanan. Potensi tersebut apabila dimanfaatkan secara optimal akan meningkatkan pendapatan petani nelayan, membuka lapangan pekerjaan, memanfaatkan daerah potensial, meningkatkan produktivitas perikanan, meningkatkan devisa negara, dan membantu menjaga kelestarian sumberdaya hayati.
Ikan bandeng merupakan salah satu ikan konsumsi yang hidup tersebar di perairan Indonesia. Ikan ini termasuk ekonomis penting karena permintaan pasok domestik yang cukup tinggi. Selain itu, ikan bandeng mudah beradaptasi dan bertoleransi tinggi terhadap salinitas, tahan terhadap penyakit, dan tidak bersifat kanibalisme. Di Indonesia, budidaya ikan bandeng di tambak sudah dikenal sejak abad XII, terutama di Pulau Jawa. Perkembangan teknologi budidaya bandeng di Indonesia belum secepat budidaya udang windu, sebagian besar teknologi budidaya bandeng masih tradisional.
Selama ini nener ikan bandeng yang digunakan untuk pembesaran ikan bandeng itu sendiri masih mengandalkan dari alam. Sedangkan produksi nener alam belum mampu untuk mencukupi kebutuhan budidaya bandeng yang terus berkembang. Oleh karena itu, peranan usaha pembenihan bandeng dalam upaya untuk mengatasi kekurangan nener tersebut menjadi sangat penting.
I.2 Tujuan
Praktikum Pendederan Nener Bandeng ini bertujuan untuk:
1. Mengetahui faktor yang mempengaruhi kehidupan ikan bandeng (Chanos
chanos).
I.3 Manfaat
II.
TINJAUAN PUSTAKA
II.1 Nener BandengBandeng banyak dikenal orang sebagai ikan air tawar. Habitat asli ikan bandeng sebenarnya di laut, tetapi ikan ini dapat hidup di air tawar maupun air payau. Ikan bandeng hidup di Samudera Hindia dan menyebranginya sampai Samudra Pasifik, mereka cenderung bergerombol di sekitar pesisir dan pulau-pulau dengan koral. Ikan yang muda dan baru menetas hidup di laur untuk 2 – 3 minggu, lalu berpindah ke rawa-rawa bakau, daerah payau, dan kadangkala danau-danau. Bandeng baru kembali ke laut jika sudah dewasa dan bisa berkembang biak.
Ikan bandeng dalam bahasa latin adalah Chanos chanos dan bahasa Inggris
Milkfish pertama kali ditemukan oleh seseorang yang bernama Forsskal pada tahun
1925 di laut merah. Menurut Sudrajat (2008) klasifikasi ikan bandeng adalah
Ikan bandeng memiliki tubuh yang panjang, ramping, padat, pipih, dan oval menyerupai torpedo. Perbandingan tinggi dengan panjang total sekitar 1 : (4,0 – 5,2). Sementara itu, perbandingan panjang kepala dengan panjang total adalah 1 : (5,2 – 5,5) (Sudrajat, 2008). Ukuran kepala seimbang dengan ukuran tubuhnya, berbentuk lonjong dan tidak bersisik. Bagian depan kepala (mendekati mulut) semakin runcing (Purnomowati, et al., 2007).
diri ketika berenang. Sirip perut terletak pada bagian bawah tubuh dan sirip anus terletak di bagian depan anus. Di bagian paling belakang tubuh ikan bandeng terdapat sirip ekor berukuran paling besar dibandingkan sirip-sirip lain. Pada bagian ujungnya berbentuk runcing, semakin ke pangkal ekor semakin lebar dan membentuk sebuah gunting terbuka. Sirip ekor ini berfungsi sebagai kemudi laju tubuhnya ketika bergerak (Purnomowati, et al., 2007).
Ikan bandeng termasuk jenis ikan eurihalin, sehingga ikan bandeng dapat dijumpai di daerah air tawar, air payau, dan air laut. Selama masa perkembangannya, ikan bandeng menyukai hidup di air payau tau daerah muara sungai. Ketika mencapai usia dewasa, ikan bandeng akan kembali ke laut untuk berkembang biak (Purnomowati, 2007). Pertumbuhan ikan bandeng relatif cepat, yaitu 1,1 – 1,7% bobot badan/hari (Sudrajat, 2008), dan bisa mencapai berat rata-rata 0,60 kg pada usia 5 – 6 bulan jika dipelihara dalam tambak (Murtidjo, 2002).
Ikan bandeng mempunyai kebiasaan makan pada siang hari. Di habitat aslinya ikan bandeng mempunyai kebiasaan mengambil makanan dari lapisan atas dasar laut, berupa tumbuhan mikroskopus seperti plankton, udang, jasad renik, dan tanaman multiseluler lainnya. Makanan ikan bandeng disesuaikan dengan ukuran mulutnya (Purnomowati, et al., 2007). Pada waktu larva, ikan bandeng tergolong karnivora, kemudian pada ukuran fry menjadi omnivora. Pada ukuran juvenil termasuk ke dalam golongan herbivora, dimana pada fase ini juga ikan bandeng sudah bisa makan pakan buatan berupa pellet. Setelah dewasa, ikan bandeng kembali berubah menjadi omnivora lagi karena mengkonsumsi algae, zooplankton, benthos lunak, dan pakan buatan berbentuk pellet (Aslamsyah, 2008).
Pemijahan alami berlangsung dalam kelompok-kelompok kecil yang tersebar di sekitar gosong karang atau perairan yang jernih dan dangkal di sekitar pulau pada bulan Maret, Mei, dan September sampai Januari. Bandeng memijah pada tengah malam sampai menjelang pagi. Sedangkan pemijahan buatan dapat dilakukan melalui rangsangan hormonal. Hormon yang diberikan dapat berbentuk cair atau padat. Hormon bentuk padat diberikan setiap bulan, sedangkan hormon bentuk cair diberikan pada saat induk jantan dan betina sudah matang gonad. Induk bandeng akan memijah setelah 2 – 15 kali implantasi tergantung pada tingkat kematangan gonad. Pemijahan induk betina yang mengandung telur berdiameter lebih dari 750 mikron atau indun jantan yang mengandung sperma tingkat 3 dapat dipercepat dengan menyuntikkan hormon LHR H-a pada dosis 30 – 50 mikron gram/kg berat tubuh atau dengan hormon HC G pada dosis 5.000 – 10.000 IU/kg berat tubuh (Murtidjo, 1989).
II.2 Faktor Fisika Kimia
Parameter fisik dalam kualitas air merupakan parameter yang bersifat fisik, dalam arti dapat dideteksi oleh panca indera manusia yaitu melalui visual, penciuman, peraba, dan perasa. Faktor fisika yang mempengaruhi antara lain:
a. Kecerahan/kekeruhan
Cahaya matahari merupakan sumber energi yang utama bagi kehidupan jasad termasuk kehidupan di perairan karena ikut menentukan produktivitas perairan. Intensitas cahaya matahari merupakan faktor abiotik utama yang sangat menentukan laju produktivitas primer perairan, sebagai dumber energi dalam proses fotosintesis (Irawan, 2009). Tingkat kecerahan yang baik berkisar antara 30 – 65 cm yang mendukung untuk produktivitas organisme akuatik (Suwondo, et al., 2005).
b. Suhu
2009). Kisaran suhu optimal bagi ikan bandeng adalah 28oC – 30oC. Alat yang
digunakan untuk mengukur suhu air adalah termometer (Raswin, 2003). c. Kecepatan arus
Arus air adalah faktor yang mempunyai peranan yang sangat penting bagi perairan letik maupun pada perairan lentik. Hal ini berhubungan dengan penyebaran organisme, gas-gas terlarut dan mineral yang terdapat di dalam air. Kecepatan aliran air akan bervariasi secara vertikal. Arus air pada perairan letik umumnya bersifat tusbulen yaitu arus air yang bergerak ke segala arah sehingga air akan terdistribusi ke seluruh bagian dari perairan (Irawan, 2009). d. Warna air
Menurut Marindro (2002) dalam Irawan (2009), kriteria air tambak yang dapat dijadikan acuan standart dalam pengelolaan kualitas air adalah seperti berikut:
1. Warna air tambak hijau tua yang berarti menunjukkan adanya dominasi Chloropiceae dengan sifat lebih stabil terhadap perubahan lingkungan dan cuaca karena mempunyai waktu moralitas yang relatif panjang. 2. Warna air tampak kecoklatan yang berarti menunjukkan adanya
dominasi Diatom.
3. Warna air tambak hijau kecoklatan yang berarti menunjukkan dominasi yang terjadi merupakan perpaduan antara Chloropiceae dan Diatom. e. Kedalaman
Kedalaman perairan sangat berpengaruh terhadap kualitas air pada lokasi tersebut. Lokasi yang dangkal akan lebih mudah terjadinya pengadukan dasar akibat dari pengaruh gelombang yang pada akhirnya kedalaman perairan lebih dari 3 m dari pengaruh gelombang yang pada akhirnya kedalaman perairan lebih dari dasar jaring. Alat untuk mengukur kedalaman disebut depth sounder
(Setiawan, 2010 dalam Siagian, 2009).
Faktor kimia yang mempengaruhi budidaya perairan adalah sebagai berikut:
a. Salinitas
laut, cukup air tawar dan dapat jauh lebih tinggi karena proses penguapan (Cholik, et al., 1989). Bandeng dapat mentoleransi salinitas sampai pada kisaran 40‰ (Yunus, 1978).
b. Derajat keasaman (pH)
Derajat keasaman (pH) sangat berperan penting dalam kehidupan ikan. Derajat keasaman yang cocock untuk semua jenis ikan berkisar antara 6,7 – 8,6. Ada jenis ikan yang hidup pada daerah rawa yang mempunyai ketahanan untuk tetap bertahan hidup pada kisaran pH yang sangat rendah maupun tinggi yaitu 4 – 9, misalnya ikan sepat siam (Sutanto, 1994). Kisaran pH yang baik untuk kehidupan dan pertumbuhan ikan ataupun udang adalah antara 7 – 8,5 (Cheng,
et al., 2003). c. O2 terlarut (DO)
Oksigen merupakan salah satu faktor pembatas dalam budidaya ikan. Oksigen terlarut itu sendiri adalah jumlah oksigen yang terkandung dalam atmosfer bumi yang larut pada suatu perairan. Oksigen terlarut dianggap sangat penting karena keberadaannya sangat menentukan kelangsungan hidup suatu organisme dan berkaitan dengan parameter lainnya (Boyd, 1988). Pada beberapa jenis ikan mampu bertahan hidup di perairan dengan konsentrasi oksigen 2 ppm, tetapi konsentrasi minimum pada sebagian spesies ikan untuk hidup dengan baik pada oksigen 5 ppm. Pada perairan dengan konsentrasi dibawah 4 ppm ikan masih mampu bertahan hidup, akan tetapi nafsu makannya rendah bahkan tidak ada sama sekali, sehingga pertumbuhannya menjadi terlambat kemudian ikan akan mati dan mengalami stress bila konsentrasi oksigen mencapai titik nol (Susanto, 1986).
d. CO2 terlarut
III.
MATERI DAN METODE
III.1 MateriIII.1.1 Alat
Alat yang digunakan dalam pendederan nener bandeng adalah akuarium, pipet tetes, timbangan, termometer, dan aerator.
III.1.2 Bahan
Bahan yang digunakan dalam praktikum adalah 5 ekor nener bandeng, air laut, dan Spirulina sp.
III.2 Metode
Metode yang digunakan adalah eksperimental laboratoris yaitu pemeliharaan nener bandeng skala laboratorium untuk mengetahui tingkat mortalitas nener bandeng dan suhu yang sesuai untuk pembesaran nener bandeng.
III.3 Pelaksanaan Praktikum
III.3.1 Persiapan pakan alami
Pakan alami nener bandeng berupa Spirulina sp. sehingga perlu dilakukan kultur Spirulina sebagai pakan nener bandeng.
III.3.2 Pembesaran nener bandeng
Akuarium diisi air laut bervolume setengah dari akuarium.
5 buat nener bandeng dimasukkan ke dalam akuarium yang sudah berisi air
laut.
Akuarium diberi aerasi agar tersedia oksigen terkarut di dalam air.
Ikan diberi pakan 2x sehari yaitu pagi dan sore hari. Pada pagi hari ikan diberi
pakan berupa pellet dan sore hari diberi pakan 1 tetes Spirulina sp.
Diamati perkembangannya setiap hari.
Pada hari ke-15 ukur pertambahan berat dan panjangnya. III.3.3 Pengukuran parameter fisika kimia
Parameter yang dilakukan adalah parameter fisika yaitu suhu.
Termometer dimasukkan ke dalam air akuarium untuk mengetahui suhu dalam
air pendederan.
Kemudian dicatat suhu yang ditunjukkan termometer.
Pengukuran suhu dilakukan setiap pagi dan sore hari.
IV.
HASIL DAN PEMBAHASAN
IV.3 HasilTabel 4.1.1 Berat dan panjang bandeng
Ikan ke Berat awal Panjang awal Berat akhir Panjang akhir
IV.4 Pembahasan
Pendederan yaitu pemeliharaan benih ikan selepas dari pembenihan hingga siap dipelihara di kolam-kolam pembesaran ataupun keramba jaring apung. Tahap pendederan sangat penting karena penebaran ikan terlalu kecil dapat menyebabkan tingkat kematian tinggi pada waktu awal pembesaran ikan. Benih ikan dalam tahap pendederak membutuhkan kualitas air yang baik dan pakan yang terkontrol, sehingga pertumbuhan bobot ikan tidak terganggu dikarenakan kurangnya pakan dan buruknya kualitas air (Taufik, 2002).
Ikan bandeng termasuk jenis ikan eurihalin, sehingga ikan bandeng dapat dijumpai di daerah air tawar, air payau, dan air laut. Selama masa perkembangannya, ikan bandeng menyukai hidup di air payau tau daerah muara sungai. Ketika mencapai usia dewasa, ikan bandeng akan kembali ke laut untuk berkembang biak (Purnomowati, 2007). Pertumbuhan ikan bandeng relatif cepat, yaitu 1,1 – 1,7% bobot badan/hari (Sudrajat, 2008), dan bisa mencapai berat rata-rata 0,60 kg pada usia 5 – 6 bulan jika dipelihara dalam tambak (Murtidjo, 2002).
Ikan bandeng mempunyai kebiasaan makan pada siang hari. Di habitat aslinya ikan bandeng mempunyai kebiasaan mengambil makanan dari lapisan atas dasar laut, berupa tumbuhan mikroskopus seperti plankton, udang, jasad renik, dan tanaman multiseluler lainnya. Makanan ikan bandeng disesuaikan dengan ukuran mulutnya (Purnomowati, et al., 2007). Pada waktu larva, ikan bandeng tergolong karnivora, kemudian pada ukuran fry menjadi omnivora. Pada ukuran juvenil termasuk ke dalam golongan herbivora, dimana pada fase ini juga ikan bandeng sudah bisa makan pakan buatan berupa pellet. Setelah dewasa, ikan bandeng kembali berubah menjadi omnivora lagi karena mengkonsumsi algae, zooplankton, benthos lunak, dan pakan buatan berbentuk pellet (Aslamsyah, 2008).
Pada pengujian tingkat mortalitas didapatkan pada hari ke-3 dan ke-5 terjadi kematian pada nener bandeng, adapun penyebab kematian menurut Pulungan et al. (2004) adalah predasi, penyakit, pencemaran, pemusnahan seara fisik oleh mesi atau manusia dan gejala alam yang berpengaruh secara langsung. Sedangkan pengaruh yang tidak langsung adalah dari faktor makanan, kondisi lingkungan yang kurang menyenangkan, beberapa jenis parasit, dan tekanan sosial. Diduga ikan yang mati pada kelompok kami akibat dari kelebihan makanan yang menyebabkan amoniak pada akuarium sehingga ikan mati karena kelebihan kadar amoniak dalam air.
Pemeliharaan dalam tahap pendederan merupakan fase yang penting untuk menghasilkan benih unggul dibesarkan. Jika benih berukuran 100g/ekor hasil pendederan dipindahkan ke kolam pembesaran, maka benih akan memiliki laju pertumbuhan yang cepat (Jangkaru, 1998). Kualitas air merupakan faktor yang sangat penting dalam pemeliharaan ikan, karena akan menentukan hasil yang diperoleh. Kondisi kualitas air juga berperan dalam menekan terjadinya peningkatan perkembangan bakteri patogen dan parasit di dalam media pemeliharaan. Sebagai tempat hidup ikan, kualitas air sangat dipengaruhi oleh faktor-faktor fisika dan kimia air seperti suhu, oksigen terlarut, pH, amonia, nitrit, dan nitrat (Forteath, et al., 1993).
Salah satu parameter fisika air yang sangat penting peranannya dalam kehidupan ikan adalah suhu. Setiap organisme akuatik mempunyai kisaran suhu tertentu dalam pertumbuhannya karena suhu air mempengaruhi nafsu makan ikan dan pertumbuhan badan ikan. Perubahan suhu yang mendadak dapat menyebabkan kematian pada ikan meskipun kondisi lingkungan lainnya optimal. Suhu air dalam tambak pemeliharaan sebaiknya berkisar 27 – 32oC karena ikan-ikan tropis akan
tumbuh baik pada kisaran tersebut (Purnamawati, 2002). Suhu yang didapatkan pada pemeliharaan nener bandeng berkisar 25 – 26oC dikarenakan pemeliharaan
V.
KESIMPULAN
Dari praktikum yang dilakukan dapat disimpulkan bahwa:
1. Kehidupan ikan bandeng dipengaruhi oleh faktor fisika dan kimia perairan yang meliputi kecerahan, suhu, kecepatan arus, warna air, kedalaman, salinitas,derajat keasaman (pH), O2 terlarut (DO), CO2 terlarut.
2. Fase nener pada bandeng merupakan fase kritis dalam budidaya bandeng karena terjadi mortalitas yang tinggi, hasil yang didapatkan kelompok 3 yaitu nener bandeng dengan suhu 25oC tidak sesuai untuk pemeliharaan nener
bandeng karena suhu optimal ikan-ikan tropis adalah 27 – 32oC. Dan pakan
DAFTAR PUSTAKA
Ahmad, T. 1998. Budidaya Bandeng Secara Intensif. Penebar Swadaya. Jakarta.
Aslamyah, S. 2008. Pembelajaran Berbasis SCL pada Mata Kuliah Biokimia
Nutrisi. UNHAS. Makassar.
Boyd, C.E. 1988. Water Quality in Ponds for Aquaculture. Departement of Fisheries And Allied Aquaculture. Alabama Agricultural Experiment
Station. Auburn University. Page 135-161.
Brotowidjoyo. 1995. Pengantar Lingkungan Perairan Dan Budidaya Air. Liberty. Yogyakarta.
Cheng, W., Su-Mei Chen, F. I. Wang, Pei-I Hsu, and C.H. Liu. 2003. Effects of
Temperature, pH, Salinity and AmmoniaOn The Phagocytic And Clearance
Efficiency Of Giant Freshwater Prawn Macrobrachium Rosenbergii To
Lactococcus Garvieae. Aquaculture 219: 111–121 pp.
Cholik F., Artati dan R. Arifudin. 1986. Pengelolaan Kualitas Air Kolam. INFIS Manual seri nomor 26. Dirjen Perikanan. Jakarta. 52 hal.
Forteath N., Wee L., Frith, M. 1993. Water Quality. In : P. Hart and D.O’ Sullivan
(eds.). Recirculation Systems : Design, Contruction and Management.
University of Tasmania at Launceston, Australia, p: 1-21.
Irawan. 2009. Faktor-Faktor Penting Dalam Proses Pembesaran Ikan di Fasilitas
Nursery Dan Pembesaran. Intitut Pertanian Bogor. Bogor.
Jangkaru, Z. 1998. Memacu Pertumbuhan Gurami. Penebar Swadaya. Jakarta.
Murtidjo, B. A. 1989. Tambak Air Payau Budidaya Udang Dan Bandeng. Kanisius. Yogyakarta.
Pulungan. P. C., 2004. Penuntun Praktikum Biologi Perikanan. Laboratorium
Biologi Perikanan Manajemen Sumberdaya Perairan. Fakultas Perikanan
dan Ilmu Kelautan, Universitas Riau. Pekanbaru. 2004.66 hal.
Purnamawati. 2002. Peranan Kualitas Air Terhadap Keberhasilan Budidaya Ikan
di Kolam. Warta Penelitian Perikanan Indonesia. ISSN No. 0852/894.
Volume 8. No. 1. Jakarta.
Purnomowati, I., Hidayati, D., dan Saparinto, C. 2007. Ragam Olahan Bandeng. Kanisius. Yogyakarta.
Ikan Bandeng (Chanos chanos Forsskal). Universitas Hasanuddin. Makassar.
Raswin, M. 2003. Bidang Budidaya Ikan Program Keahlian Budidaya Ikan Air
Payau, Pembesaran Ikan Bandeng. Modul Pengelolaan Air Tambak. Jakarta
: Direktorat Pendidikan Menengah Kejuruan, Direktorat Jenderal Pendidikan Dasar Dan Menengah, Departemen Pendidikan Nasional.
Siagian, C. 2009. Keanekaragaman dan Kelimpahan Ikan serta Keterkaitannya
dengan Kualitas Perairan di Danau Toba Balige Sumatra Utara.
Universitas Sumatera Utara. Medan.
Sudradjat, A. 2008. Budidaya 23 Komoditas Laut Menguntungkan. Penebar Swadaya. Jakarta.
Sutanto 1994. Penginderaan Jauh Jilid 2. Gajah Mada University Press. Yogyakarta.
Suwondo, Y., Fauziah, Syafriyanti, dan S. Wariyanti. 2005. Akumulasi Logam Cuprum (Cu) dan Zincum (Zn) di Perairan Sungai Siak dengan
Menggunakan Bioakumulator Eceng Gondok (Eihhornoa crassipes). Jurnal
Biogenesis. Vol.1 (2): 51-56.
LAPORAN PRAKTIKUM
TEKNIK PEMBENIHAN PERIKANAN LAUT
ACARA III
PEMIJAHAN KERANG DARAH
(Anadara granosa)
Oleh :
Nama : Lathifah
NIM : B0A013042
Kelompok : 3
KEMENTERIAN RISET TEKNOLOGI DAN PENDIDIKAN TINGGI UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGI
PROGRAM STUDI DIII PENGELOLAAN SUMBERDAYA PERIKANAN DAN KELAUTAN
I.
PENDAHULUAN
I.1 Latar BelakangKerang merupakan hewan akuatik yang hidup pada substrat dasar perairan dan ada juga yang menempel pada substrat keras pada badan perairan. Kerang termasuk dalam kelas Pelecypoda dalam kelompok Moluska berdasarkan karakteristik yang dimiliki seperti kaki, insang dan dua keping cangkang (Talman dan Keough, 2001). Kerang hidup pada semua tipe perairan yaitu air tawar, estuari dan perairan laut. Kerang laut terdistribusi dari daerah interdal, perairan laut dangkal dan ada yang mendiami perairan laut (Nurdin, 2009).
Faktor biologi yang meliputi kehidupan kerang laut adalah fitoplankton, zooplankton, zat organik tersuspensi, dan makhluk hidup di lingkungannya (Debenay dan Tack, 1994). Kerang laut mendapatkan makanan dengan feeding
filter menggunakan sifons. Secara ekologi, filtrasi yang dilakukan oleh kerang laut
digunakan untuk menghindari kompetisi makanan sesama spesies (Bachock, et al., 2006).
Beberapa spesies kerang laut memiliki strategi tertentu untuk beradaptasi terhadap lingkungan. Diantaranya kerang yang hidup di substrat dasar akan memiliki kaki dan sifons yang sudah teradaptasi dengan tempat hidupnya. Kaki digunakan untuk bergerak secara horizontal sebagai alat untuk berpindah dan gerakan vertikal untuk menggali substrat (Baron and Jacques, 1992). Sifons kerang yang terdiri dari inhalat dan exhalat sudah teradaptasi dengan kedalaman substrat. Bachok et al. (2006) menemukan kerang Psammotaea elongata menjulurkan ujung sifons sejajar dengan permukaan substrat, sedangkan pada kerang kpah G.
tumidum posisi ujung sifonsnya berada di dalam substrat atau di atas permukaan
substrat.
I.2 Tujuan
Praktikum ini bertujuan agar mahasiswa dapat melakukan pembenihan kerang darah secara terkontrol di laboratorium.
I.3 Manfaat
II.
TINJAUAN PUSTAKA
II.1 Kerang DarahKerang darah (Anadara granosa) merupakan salah satu jenis kerang yang berpotensi ekonomis untuk dikembangkan sebagai sumber protein dan mineral. Kerang darah adalah salah satu biota laut dari kelas Bivalvia, yang hidupnya relatif menetap di dasar perairan (Suprapti, 2008). Kerang darah banyak ditemukan pada substrat yang berlumpur di muara sungai dengan topografi pantai yang landai sampai kedalaman 20 m. Kerang darah bersifat infauna yaitu hidup dengan cara membenamkan diri di bawah permukaan lumpur di perairan dangkal (PKSPL, menggembung, memiliki alur kurang lebih 18 – 20 buah dengan rusuk yang tegas, kedua cangkang equilateral dengan umbo terletak ditengah antara posterior dan anterior. Cangkang A. granosa dapat mencapai ukuran panjang 9 cm, namun biasanya hanya 4 – 6 cm. Kerang darah memijah sepanjang tahun dengan puncaknya terjadi pada bulan Agustus/September. Hewan ini termasuk hewan berumah dua. Kematangan gonad terjadi pada saat kerang darah mencapai ukuran panjang 18 – 20 mm dan berumur kurang dari satu tahun.
(Mzighani, 2005). Kerang darah hidup mengelompok dan umumnya banyak ditemukan pada substrat yang kaya kadar organik. Distribusi kerang tersebut meliputi Australia, Tropical Indo-West Pacific, Red Sea, South China Sea, Vietnam, China, Hong Kong (Xianggang), Thailand, Philippines, New Caledonia, Jepang dan Indonesia yang tersebar di kawasan pesisir pantai. Di Indonesia, daerah penyebaran kerang ini hampir di seluruh pantai Indonesia, hidup di dasar, di daerah pasir berlumpur pada kedalaman sampai dengan 4 meter dan perairan yang relatif tenang. Teknik budidaya kerang darah di Indonesia dimulai dengan pengumpulan benih kerang darah berukuran 4 mm – 10 mm di tempat penyebaran benih alami di tepi pantai yang landai (PKSPL, 2004).
Reproduksi adalah kemampuan individu untuk menghasilkan keturunan sebagai upaya untuk melestarikan jenis atau kelompoknya. Pola reproduksi pada berbeda-beda untuk setiap biota, tergantung pada kondisi lingkungan. Ada biota yang memijah setiap musim atau hanya pada kondisi tertentu setiap tahun (Fujaya 2004). Menurut Broom (1985), kerang darah termasuk dalam tipe biota yang memijah beberapa kali sepanjang tahun. Kerang darah (A. granosa) merupakan kerang yang memiliki alat kelamin terpisah (dioecious). Menurut Quaely (1943) dalam Broom (1985), gonad kerang darah terletak diantara kelenjar pencernaan dan usus. Menurut Franklin (1972), pembedaan jenis kelamin antara kerang darah jantan dan betina cukup sulit dilakukan tanpa pembedahan. Menurut Afiati (2007), gonad kerang darah dapat dibedakan melalui warnanya. Kerang darah betina memiliki warna oranye kemerahan sedangkan gonad kerang darah jantan berwarna putih susu.
II.2 Faktor Fisika Kimia (suhu, pH, salinitas)
Odum (1994) menyatakan suhu ekosistem akuatik dipengaruhi oleh intensitas matahari, ketinggian geografis dan faktor kanopi (penutup vegetasi) dari pepohonan yang tumbuh di sekitarnya. Menurut Sitorus (2008), suhu yang optimal untuk kelangsungan bivalva berkisaran antara 25-31oC. Sedangkan menurut
Brotowidjoyo, et al. (1995) Anadara granosa banyak ditemukan di perairan estuari dengan substrat lumpur dan pasir dengan suhu sekitar 30oC akan merangsang
Hutabarat dan Evans (1985) menyatakan bahwa salinitas di perairan terbuka bisa mencapai 35‰, sedangkan di perairan pantai akan lebih rendah disebabkan terjadinya proses pengenceran, misalnya pengaruh sungai, sehingga salinitas turun. Salinitas menunjukkan jumlah ion-ion terlarut. Perubahan salinitas berpengaruh pada proses difusi dan osmotik. Kerang mengatur osmotik tubuh secara intraseluler (Levinton, 1982).
III.
MATERI DAN METODE
III.1 MateriIII.1.1 Alat
Alat yang digunakan dalam praktikum pemijahan kerang darah adalah akuarium 10 L, akuarium ukuran 80 L, aerator, rak kultur fitoplankton, planktonnet dengan ukuran lebar mata 20, 80, 120, dan 250 µm, mikroskop, selang, ember/nampan, dan gayung.
III.1.2 Bahan
Bahan yang digunakan adalah induk kerang darah ukuran > 3 cm, inokulum fitoplankton (Nannochloropsis sp. dan Chlorella sp.), air laut salinitas 27 – 30 ppt, dan air tawar.
III.2 Metode
Metode yang digunakan adalah eksperimental laboratoris yaitu pemijahan kerang darah yang dilakukan skala laboratoris untuk mengetahui cara pemijahan kerang darah dan pemeliharaan larva secara baik dan terkontrol.
III.3 Pelaksanaan Praktikum
III.3.1 Seleksi dan aklimatisasi induk
Akuarium bervolume 10 – 50 L yang sudah dibersihkan disiapkan, lengkap
dengan aerasi.
Diisi dengan air laut steril bersalinitas 27 – 30 ppt hingga 75% dari volume
total.
Induk kerang darah yang telah dibersihkan dimasukkan, diukur panjang dan
lebar cangkang.
Diberi pakan Nannochloropsis sp. dengan perbandingan 10 ml : 1 L.
Aklimatisasi induk dilakukan selama 24 jam. III.3.2 Pemijahan
Dua buah akuarium ukuran 10 – 60 L disiapkan.
Akuarium diisi dengan air laut bersalinitas 27 – 30 ppt sebanyak 50% dari
volume.
Kerang darah dimasukkan ke dalam akuarium (akuarium 1) dan air dipanaskan
dalam akuarium ke-2 dengan menggunakan heater atau menambahkan air yang direbus, sehingga suhunya meningkat 5 – 7oC dari suhu awal.
Kerang darah diangkat dari akuarium ke-1 untuk di ekspose selama ± 15
menit.
Kerang darah dipindahkan ke dalam akuarium ke-2 yang suhunya telah
dinaikkan.
Ditunggu dan diamati sampai semua induk kerang darah memijah. III.3.3 Pemeliharaan larva
Akuarium yang sudah dibersihkan disiapkan lengkap dengan aerasi.
Telur dipindahkan dari tempat pemijahan dengan menggunakan planktonnet ke
dalam akuarium pemeliharaan larva.
Dilakukan pemberian pakan berupa Nannochloropsis sp. setelah larva kerang
darah berumur 5 – 7 hari.
Pemberian pakan dilakukan secara intensif.
Selanjutnya pengamatan periode kritis pada larva kerang darah, dengan
melakukan pemeliharaan secara terkontrol.
III.3 Waktu dan Tempat
IV.
HASIL DAN PEMBAHASAN
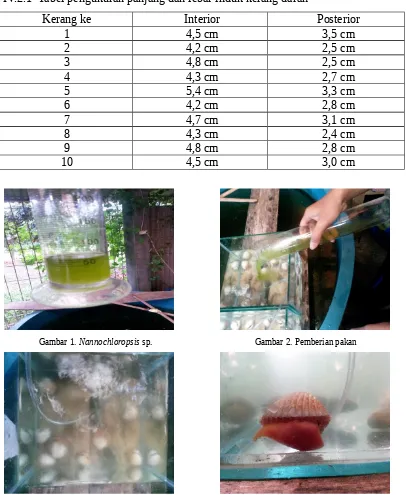
IV.2 HasilIV.2.1 Tabel pengukuran panjang dan lebar induk kerang darah
Kerang ke Interior Posterior
1 4,5 cm 3,5 cm
2 4,2 cm 2,5 cm
3 4,8 cm 2,5 cm
4 4,3 cm 2,7 cm
5 5,4 cm 3,3 cm
6 4,2 cm 2,8 cm
7 4,7 cm 3,1 cm
8 4,3 cm 2,4 cm
9 4,8 cm 2,8 cm
10 4,5 cm 3,0 cm
Gambar 1. Nannochloropsis sp. Gambar 2. Pemberian pakan
Gambar 5. Kerang ketika diekspose Ganbar 6. Akuarium berisi air panas
IV.3 Pembahasan
Anadara granosa sering disebut sebagai kerang darah karena adanya warna
merah kecoklatan dari daging Anadara. Warna ini terjaadi karena adanya haemoglobia dalam darah. Kerang darah adalah salah satu jenis kerang yang memiliki nilai ekonomi yang tinggi dan pada umumnya sebagai sumber makanan laut di wilayah Asia Tenggara dan beberapa wilayah Pasifik (Ulysses, et al., 2009). Menurut Brotowidjoyo, et al. (1995) Anadara granosa banyak ditemukan di perairan estuari dengan substrat lumpur dan pasir dengan suhu sekitar 30oC akan
merangsang Anadara betina untuk bertelur. Parenrengi, et al. (1998) menjelaskan bahwa suhu yang sesuai untuk bivalvia berkisar antara 28oC – 31oC.
Kerang darah termasuk hewan berumah dua (diocis). Kerang darah mulai berkembang biak saat berukuran mencapai 2 cm atau umur kurang dari setahun. Pada masa itulah bibit-bibit muda ini mulai tumbuh. Meski masa pemijahan kerang darah berlangsung sepanjang tahun, masa puncaknya berlangsung antara bulan Agustus – September. Kematangan gonad terjadi pada saat kerang darah mencapai ukuran panjang 18 – 20 mm dan berumur kurang dari satu tahun. Adapun pemijahan mulai terjadi pada ukuran 20 mm. Perkembangbiakan kerang darah dilakukan secara kawin. Umumnya berumah dua dan pembuahannya internal. Telur yang dibuahi sperma akan berkembang manjadi larva glosidium yang terlindung oleh dua buah katup. Ada beberapa jenis yang dari katupnya keluar larva panjang dan hidup sebagai parasit pada hewan lain, misalnya pada ikan.
Dari praktikum yang dilakukan, didapatkan hasil yaitu satu induk kerang darah dari kelompok 3 mengalami kematian. Mortalitas/kematian massal lebih sering terkait dengan perubahan kondisi lingkungan, khususnya salinitas. Kematian kerang ini sering terjadi pada saat hujan yang berkepanjangan yang menyebabkan turunnya salinitas. Kerang akan mati dalam air bersalinitas di bawah 15 ppm. Menurut Idel dan Wibowo (1996) penyebab timbulnya penyakit pada ikan atau biota budidaya adalah padatnya pertumbuhan plankton dan ganggang pirang, kotoran dan sisa pakan yang terlalu banyak, serta masuknya bahan-bahan pencemar ke dalam lingkungan budidaya.
Tinggi dan rendahnya nilai kelulushidupan juga dipengaruhi oleh kondisi suatu perairan atau faktor lainya. Tang, et al. (2009) menyatakan mortalitas atau berkurangnya biomassa (populasi) dapat disebabkan karena dua faktor, yaitu karena faktor alam (natural mortality) dan faktor penangkapan (fishing mortality). Beberapa faktor alam yang menyebabkan kematian/kehilangan adalah karena penyakit, lepas dari areal pemeliharaan, pemangsaan dan faktor perubahan lingkungan, sedangkan faktor penangkapan, jelas karena ditangkap oleh manusia.
Menurut Broom (1985) suhu optimal bagi kehidupan kerang darah
(Anadara granosa) adalah sekitar 25 – 32oC. Kisaran pH air laut optimum bagi
V.
KESIMPULAN
Dari praktikum yang dilakukan, dapat disimpulkan bahwa perkawinan kerang terjadi secara alami yang masa puncaknya berlangsung antara bulan Agustus – September. Cara pemijahan kerang darah yaitu alat kelamin jantan akan mengeluarkan sperma ke air dan akan masuk dalam tubuh hewan betina. Melalui sifon air masuk, sehingga terjadilah pembuahan. Suhu optimal bagi kehidupan kerang darah (Anadara granosa) adalah sekitar 25 – 32oC, kisaran pH air laut
DAFTAR PUSTAKA
Afiati, N. 2007. Hermaphroditsm in Anadara granosa (L.) and Anadara antiquate
(L.) (Bivalvia : Arcidae) from Central Java. Journal of Coastal
Development. 10(3) : 171-179.
Bachok, Z., P. L. Mfilinge and M. Tsuchiya. 2006. Food Sources of Coexisting Suspension-Feeding Bivalves as Indicated by Fatty Acid Biomarkers,
Subjected to the Bivalves Abundance on a Tidal Flat. Journal of
Sustainability Science and Management. 1 : 92-111.
Bardach, J. E., J. H. Ryther and W.O.McLarney. 1972. Aquaculture: The Farming
and Husbandary of Freshwater and Marine Organisms. John Wiley &
Sons. New York.
Baron, J. and C. Jacques. 1992. Effects of Environment Factors on the distribution of the Edible Bivalves Atactodeastriata, Gafrarium tumidum and Anadara
scapha on the Coast of New Caledonia (SW Pacific). Aquatiqa Living
Resour. 5 : 107 – 114.
Barus, T. A. 2004. Pengantar Limnologi Studi Leksono Tentang Ekosistem Air dan
Daratan. USU Press. Medan.
Broom, M. J. 1985. The Biology and Culture of Marine Bivalva Mollusc of the
Genus Anadara. International Centre for Living Aquatic Resources
Management. Manila. 37.
Brotowidjoyo, M. D., Djoko, T. dan Eko, M. 1995. Pengantar Lingkungan
Perairan dan Budi Daya Air. Penerbit Liberty. Yogyakarta. Hlm. 64.
Dance S. P. 1977. The Encyclopedia of Shells. Blanford press. London.
Debenay, J. P., D. Leung Tack, M. Ba and I. Sy. 1994. Environmental Conditions, Growth and Production of Anadara senilis (Linnaeus, 1758) in A Senegal
Lagoon. The Malocological Society of London 113-121.
Franklin, A. 1972. The Cockle and Its Fisheries Laboratory Leaflet (New Series)
No.26. Ministry of agriculture fisheries and food. London.
Fujaya, Y. 2004. Fisiologi Ikan Dasar Pengembangan Teknik Perikanan. Rineka Cipta. Jakarta. 179 p.
Hutabarat, S dan S. M. Evans. 1985. Pengantar Oseonografi. Universitas Indonesia Press. Jakarta. 159 Halaman.
Keputusan Menteri KLH No. 02. 1988. Pedoman Penetapan Baku Mutu
Lingkungan. Sekretariat Menteri KLH. Jakarta. 51.
Levinton, J. S. 1982. Marine Ecology. Prentice Hall, Inc. America. P. 235-269.
Mzighani, S. 2005. Fecundity of Population of Cockles, Anadara antiquate L. 1758 (Bivalvia: Arcidae) from a Sandy/Muddy Beach near Dar es Salaam,
Tanzania, Western Indian Ocean. Journal Marine Science 4(1): 77-84.
Nasution, S. 2009. Jurnal Natur Indonesia “Biomassa Kerang Anadara granosa
pada Perairan Pantai Kabupaten Indragiri Hilir. Fakultas Perikanan dan
Kelautan, Universitas Riau. Pekanbaru.
Odum, E. P. 1994. Dasar-Dasar Ekologi. Penerjemahan: Samingan, T dan B. Srigandono. Gajahmada University Press. Yogyakarta. 697 hal.
PKSPL. 2004. Penelitian dan Pengembangan Budidaya Perikanan (Kerang
darah) di Kabupaten Boalemo, Provinsi Gorontalo [Laporan Penelitian].
Gorontalo: PKSPL.
Romimohtarto, K. 1985. Kualitas Air dalam Budidaya Laut. WBL/05/WP-13 Bandar Lampung.
Sitorus, D. 2008. Keanekaragaman dan Distribusi Bivalva Serta Kaitannya Dengan Faktor Fisika-Kimia di Perairan Pantai Lambu Kabupaten Deli
Serdang. (online).http://www.econtent&do_pdf=1&id 269.
Suprapti N. H. 2008. Kandungan Chromium pada Perairan, Sedimen dan Kerang Darah (Anadara granosa) di Wilayah Pantai Sekitar Muara Sungai
Sayung, Desa Morosari Kabupaten Demak, Jawa Tengah. 10(2) : 53-56
ISSN : 141 -8801.
Talman, S.G. & Keough, M.J., 2001. Impact Of An Exotic Clam, Corbula Gibba, On The Commercial Scallop Pecten Fumatus In Port Phillip Bay, South-East Australia: Evidence Of Resource-Restricted Growth In A Subtidal
Environment. Marine Ecology Progress Series, 221, 135 - 143.
Tang, U. M, P. Rengi, D Erianto, dan Sumarto. 2009. Jurnal Prosiding Seminar Nasional Moluska 2 “Budidaya Kerang (Anadara granosa) Di Bengkalis
Riau”. Institut Pertanian Bogor. Bogor.
Ulysses, M., et al. 2009. Comparative Psp Toxin Accumulation in Bivalves, Paphia