ISOLASI SENYAWA AKTIF FRAKSI N-HEKSANA DARI KULIT BATANG KELOR (Moringa oleifera) DAN UJI EFEKTIVITAS SEBAGAI LARVASIDA
TERHADAP LARVA NYAMUK Aedes aegypti
PROPOSAL PENELITIAN
Oleh
HAMDANI JANORI G1C 014 011
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS MATARAM
BAB I
PENDAHULUAN
1.1 Latar Belakang
Demam Berdarah Dengue (DBD) merupakan salah satu masalah kesehatan yang dialami oleh berbagai negara di seluruh dunia. Sebelum tahun 1970, hanya 9 negara yang mengalami DBD, namun sekarang DBD menjadi penyakit endemik pada lebih dari 100 negara, diantaranya adalah Afrika, Amerika, Mediterania Timur, Asia Tenggara dan Pasifik Barat dimana Asia Tenggara memiliki angka tertinggi kasus DBD dengan jumlah 1,2 juta kasus di tahun 2008 dan dan lebih dari 2,3 juta kasus di tahun 2010 (WHO, 2014). Di Indonesia sendiri kasus DBD semakin bertambah baik dari jumlah penderitanya ataupun luas penyebarannya. Pada tahun 2015, tercatat sebanyak 126.675 penderita DBD di 34 provinsi di Indonesia, dan 1.229 orang diantaranya meninggal dunia. Jumlah tersebut lebih tinggi dibandingkan tahun sebelumnya, yakni sebanyak 100.347 penderita (Kementerian Kesehatan RI, 2016).
Penyakit DBD disebabkan oleh virus dengue yang penyebarannya terjadi melalui gigitan nyamuk Aedes aegypti. Belum ada vaksin yang dapat mencegah seseorang terkena virus dangue tersebut, sehingga cara efektif yang dapat dilakukan untuk menghentikan penyebaran virus tersebut dengan pengendalian melalui pemberantasan jentik nyamuk. Pengendalian dapat dilakukan secara mekanik, biologi, kimia, atau perubahan sifat genetik (Susanna, 1999: 228). Pengendalian yang paling sering dilakukan saat ini adalah pengendalian secara kimia dikarenakan lebih efektif dibandingkan secara mekanik ataupun biologi (Wahyuni, 2010).
mengandung bahan aktif, dimana bahan aktif inilah yang dapat menghambat pertumbuhan ataupun membunuh organisme pengganggu.
Indonesia merupakan negara kepulauan seluas sekitar 9 juta km2 yang terletak
diantara dua benua dan dua samudera dengan jumlah pulau sekitar 17.500 dan panjang garis pantainya sekitar 95.181 km. Dengan kondisi geografis tersebut menyebabkan Indonesia menjadi salah satu negara megabiodiversitas di dunia dan mempunyai keragaman tumbuh-tumbuhan yang sangat besar (Kusmana dan Agus, 2015). Lebih dari 400 jenis tumbuhan telah teridentifikasi bahan kimianya dan 10 ribu diantaranya mengandung metabolit sekunder yang potensial sebagai bahan baku pestisida alami (Saenong, 2016). Pemakaian tumbuhan sebagai pestisida meningkat sejalan dengan berkembangnya kesadaran masyarakat tentang pemikiran kembali ke alam (back to nature). Selain itu, pemakaian tumbuhan sebagai biopestisida tidak akan merusak lingkungan karena residu yang dihasilkan bersifat degradable (Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian, 2012).
Beberapa penelitian telah dilakukan mengenai potensi tumbuhan sebagai larvasida. Salah satunya yaitu penelitian yang dilakukan oleh Boesri dkk (2015), menunjukkan bahwa ekstrak etanol tembakau dengan konsentrasi minimal 1,56%, ekstrak etanol lengkuas dengan konsentrasi minimal 1,56% dan ekstrak etanol serai wangi dengan konsentrasi minimal 1,56% efektif sebagai biolarvasida terhadap larva Aedes aegypty karena mengandung asam lemak, alkaloid, dan flavonoid. Selain itu penelitian yang dilakukan oleh Noshirma, dkk (2016), menunjukkan bahwa ekstrak etanol kunyit putih, cengkeh, jeruk limau, jeruk bali, lidah buaya dan mimba efektif sebagai larvasida karena mengandung minyak atsiri, saponin dan flavonoid.
Anopheles aconitus L karena mengandung senyawa flavonoid, alkaloid, saponin, dan tanin. Selain itu penelitan yang dilkukan oleh Ferreira, dkk (2009), menunjukkan bahwa ekstrak air biji kelor dengan konsentrasi 1260 µg/mL efektif sebagai biolarvasida terhadap larva Aedes aegypti.
Penelitian- penelitian di atas hanya terbatas pada uji aktivitas ekstrak tanpa melakukan isolasi dan screening senyawa-senyawa tertentu yang berfungsi sebagai larvasida. Oleh karena itu penelitian ini bertujuan untuk mengisolasi senyawa aktif pada fraksi n-heksana ekstrak metanol kulit batang tanaman kelor (Moringa oleifera) dan untuk menguji efektivitasnya sebagai larvasida terhadap larva Aedes aegypti. Isolasi senyawa dilakukan sebagaimana lazimnya dalam suatu penelitian bahan alam yaitu tahap ekstraksi, dimana metode ekstraksi yang digunakan adalah sokletasi dengan menggunakan pelarut metanol. Metanol dipilih karena metanol merupakan pelarut yang dapat melarutkan banyak metabolit sekunder (Djamil, 2015). Menurut Sudarma (2014) metanol dapat menarik alkaloid, steroid, saponin dan flavonoid dari tanaman.
untuk analisis kualitatif dan kuantitatif senyawa dalam suatu campuran (Nollet, 2004).
Pada penelitian ini hasil isolasi fraksi n-hexana ektraks metanol akan diuji efektifitas biolarvasidanya terhadap larva Aedes aegypty dengan menggunakan Rancangan Acak Lengkap (RAL) dengan perlakuan yang terdiri dari lima konsentrasi berbeda, satu kontrol positif dan satu kontrol negatif dan dilakukan tiga kali pengulangan.
1.1 Rumusan Masalah
Berdasarkan latar belakang permasalahan, maka rumusan masalah adalah sebagai berikut:
1 Senyawa apa saja yang terdapat pada fraksi n-heksana ekstrak metanol kulit batang kelor (Moringa oleifera) ?
2 Apakah senyawa hasil isolasi fraksi n-heksana ekstrak metanol kulit batang tanaman kelor (Moringa oleifera) efektif sebagai larvasida terhadap larva Aedes aegypty ?
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui senyawa apa saja yang terdapat pada fraksi n-heksana ekstrak metanol kulit batang kelor (Moringa oleifera)
2. Mengetahui apakah senyawa hasil isolasi fraksi n-heksana ekstrak metanol kulit batang tanaman kelor (Moringa oleifera) efektif sebagai larvasida terhadap larva Aedes aegypty
1.3 Manfaat Penelitian
BAB II
Kelor (Moringa oleifer) tumbuh dalam bentuk pohon, berumur panjang (perenial) dengan tinggi 7-12 m. Batang berkayu (lignosus), tegak, berwarna putih kotor, kulit tipis, permukaan kasar. Percabangan simpodial, arah cabang tegak atau miring, cenderung tumbuh lurus dan memanjang. Perbanyakan bisa secara generatif (biji) maupun vegetatif (stek batang). Tumbuh di dataran rendah maupun dataran tinggi sampai di ketinggian ± 1000 m dpl, banyak ditanam sebagai tapal batas atau pagar di halaman rumah atau ladang (Krisnadi, 2015). Tanaman kelor di Indonesia dikenal dalam berbagai macam nama, misalnya : Kelor (Indonesia, Jawa, Sunda, Bali, Lampung), Kerol (Buru), Marangghi (Madura), Moltong (Flores), Kelo (Gorontalo), Keloro (Bugis), Kawano (Sumba), Ongge (Bima), Hau fo (Timor). Menurut sejarahnya, tanaman kelor atau marongghi (Moringa oleifera), berasal dari daerah kawasan Himalaya dan India, kemudian menyebar ke kawasan di sekitarnya sampai ke Benua Afrika dan Asia Barat (Nurcahyati, 2014). Bentuk tanaman kelor dapat dilihat pada Gambar 2.1.
Gambar 2.1 Pohon Kelor
Menurut Krisnadi (2015), klasifikasi tanaman kelor dalam kingdom Plantae adalah sebagai berikut:
Super Divisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Dillenidae
Ordo : Capparales
Family : Moringaceae
Genus : Moringa
Spesies : Moringa oleifera Lam
2.2.1 Morfologi Tanaman Kelor 2.2.1.1 Akar
Akar tunggang, berwarna putih. Kulit akar berasa pedas dan berbau tajam, dari dalam berwarna kuning pucat, bergaris halus tapi terang dan melintang. Tidak keras, bentuk tidak beraturan, permukaan luar kulit agak licin, permukaan kulit dalam agak berserabut, bagian kayu warna cokelat muda, atau krem berserabut, sebagian besar terpisah. Akar tunggung berwarna putih, membesar seperti lobak (Krisnadi, 2015). Akar kelor bermanfaat sebagai antimikroba, mengatasi karang gigi, flu, demam, asma, penguat jantung, anti inflamasi, rematik, bengkak kaki (edema), epilepsi, sakit kepala (Andareto, 2015).
2.2.1.2 Batang
mentah 3,40%; serat 44,74%; abu 5,025%; dan karbohidrat 18,74% (Fagwalawa dkk, 2015).
2.2.1.3 Daun
Daun majemuk, bertangkai panjang, tersusun berseling (alternate), beranak daun gasal (imparipinnatus), helai daun saat muda berwarna hijau muda – setelah dewasa hijau tua, bentuk helai daun bulat telur, panjang 1-2 cm, lebar 1-2 cm, tipis lemas, ujung dan pangkal daun tumpul (obtusus), tepi rata, susunan pertulangan menyirip (pinnate), permukaan atas dan bawah halus (Krisnadi, 2015). Daun kelor mengandung zat besi lebih tinggi daripada sayuran lainnya yaitu sebesar 17,2 mg/100 g (Yameogo dkk, 2011). Selain itu, daun kelor juga mengandung berbagai macam asam amino, antara lain asam amino yang berbentuk asam aspartat, asam glutamat, alanin, valin, leusin, isoleusin, histidin, lisin, arginin, venilalanin, triptopan, sistein, dan methionin (Simbolan dkk, 2007). Kandungan fenol dalam daun segar sebesar 3,4% sedangkan pada daun kelor yang telah diekstrak sebesar 1,6% (Folid dkk, 2007)
2.2.1.4 Bunga
Bunga muncul di ketiak daun, bertangkai panjang, kelopak berwarna putih agak krem, menebar aroma khas. Bunganya berwarna putih kekuning-kuningan terkumpul dalam pucuk lembaga di bagian ketiak dan tudung pelepah berwarna hijau. Memiliki 5 kelopak yang mengelilingi 5 benang sari dan 5 staminodia. Bunga kelor keluar sepanjang tahun dengan aroma bau semerbak (Krisnadi, 2015).
2.2.1.5 Buah atau Polong
2.2 Metabolit Sekunder
Metabolit sekunder adalah senyawa organik yang dihasilkan tumbuhan yang tidak memiliki fungsi langsung pada fotosintesis, pertumbuhan atau respirasi, transport solut, translokasi, sintesis protein, asimilasi nutrien, diferensiasi, pembentukan karbohidrat, protein dan lipid. Metabolit sekunder yang seringkali hanya dijumpai pada satu spesies atau sekelompok spesies berbeda dari metabolit primer yang dijumpai hampir disemua kingdom tumbuhan (Mastuti, 2016). Metabolit sekunder yang sudah dapat diketahui fungsinya dalam biologi antara lain tanin, alkaloid, terpenoid dan flavonoid (Robinson, 1995).
2.2.1 Alkaloid
Alkaloid adalah senyawa bahan alam yang mempunyai atom nitrogen yang bersifat basa pada strukturnya. Nama alkaloid diturunkan dari kata alkaline yang mendiskripsikan berbagai nitrogen yang bersifat basa. Alkaloid dihasilkan oleh berbagai mahluk hidup antara lain bakteri, jamur, tumbuhan, dan binatang (Sudarma, 2014). Alkaloid sering kali bersifat racun bagi manusia dan banyak dari alkaloid yang memiliki aktivitas fisiologi yang menonjol sehingga banyak dimanfaatkan dalam bidang pengobatan. Umumnya alkaloid ini berbentuk kristal (Harborne, 1996).
O H
CH3
O CH3 O
C H3
N
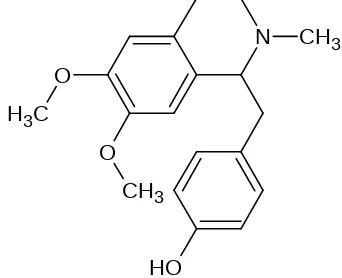
Gambar 2.2 Struktur Senyawa Armepavina (Yanti, 2014)
makanan dari tempat hidupnya (Yunita dkk, 2009). Senyawa bioaktif tersebut akan terakumulasi di dalam tubuh larva dan akan berperan sebagai racun. Racun akan terdistribusi ke seluruh sel-sel tubuh melalui sistem peredaran darah atau haemolimfa (Ningsih dkk, 2013). Dari penelitan yang dilakukan oleh Yanti (2014), terhadap ekstrak daun sirsak hutan yang diduga senyawa alkaloid yang terdapat merupakan senyawa armepavina dari hasil analisis dengan LC-MS, spektrofotometer UV-Vis dan FTIR. Struktur senyawa armepavina dapat dilihat pada Gambar 2.2
2.2.2 Saponin
Saponin adalah glykosida yang steroidnya terdiri dari 27 karbon atau triterpen 30 karbon dan banyak terdapat pada tumbuhan. Dijumpai pada berbagai bagian tumbuhan seperti daun, batang akar, bunga, buah. Saponin dikarekterisasi dari rasa pahit dan kemampuannya untuk melakukan hemolisa pada sel darah merah. Saponin larut dalam air membentuk buih seperti buih sabun, hal ini disebabkan karena saponin mempunyai amphiphilik (Sudarma, 2014). Saponin bersifat sebagai natural detergent yang dapat merusak membran sel biologis yang tersusun atas fosfolipid dan kolesterol (Idowu dkk, 2015). Salah satu struktur senyawa saponin dapat dilihat pada Gambar 2.3
Gambar 2.3 Struktur Senyawa Saponin (Wibowo, 2012)
Terpenoid adalah senyawa yang tersusun dari kerangka isopren (C5), yakni rantai
beranggota lima karbon bercabang (branching) metil pada karbon nomor dua atau kelipatannya. Senyawa-senyawa seskuiterpen, asam ursolat yang terdapat pada berbagai tanaman dan bersifat sebgai penghambat kanker dan menurunkan gula darah, asam betulinat yang terkandung dalam berbagai tanaman termasuk buah kayu putih yang bersifat antidiabetes, azadikratin dari biji mimba (Azadirachta indica) sebagai pestisida, berbagai macam parfum dan aroma kebanyakan adalah senyawa-senyawa terpenoid (Saifudin, 2014). Terpena memiliki struktur dasar (C5H8)n dimana
n adalah jumlah unit isoprena. Hal ini dikenal dengan nama isoprena rule atau C5 rule (Sudarma, 2014). Sturuktur isoprena dapat dilihat pada Gambar 2.4
CH3
C H2
CH3
Gambar 2.4 Struktur Senyawa Terpenoid
Dari penelitian yang dilakukan oleh Inoue dkk. (2004), bahwa aktivitas terpena dengan rantai panjang dapat merusak dinding sel. Aktivitas dari terpena tidak hanya ditentukan dari panjang gugus alkil yang terikat pada rantai induk tetapi juga dari gugus fungsi yang terikat dan ikatan rangkap pada sturkturnya.
2.2.4 Steroid
Steroid adalah lipid terpenoid yang dicirikan dengan empat ring karbon yang menyatu satu sama lain (“ four fised ring”) yang setiap ringnya tersusun dengan pola 6-6-6-5. Pola ring tersebut sering disimbolkan dengan huruf A,B,C,D. Steroid kaya akan gugus fungsi yang terikat pada ring-ring tersebut. Ratusan steroid yang memiliki peranan penting ditemukan pada tumbuhan, hewan, manusia, dan jamur (Sudarma, 2014). Struktur dasar steroid dapat dilihat pada Gambar 2.5
Gambar 2.5 Struktur Senyawa Steroid
Menurut Cowan (1999), mekanisme penghambatan bakteri oleh senyawa steroid diduga dengan cara merusak membran sel bakteri. Steroid dapat meningkatkan permeabilitas membran sel sehingga akan terjadi kebocoran sel yang diikuti dengan keluarnya materi intraseluler. Dari penelitian yang dilakukan oleh Novadiana dkk. (2014), bahwa senyawa steroid hasil isolasi dari fraksi kloroform ekstrak etanol diperoleh nilai LC50 sebesar 96,4096 ppm yang membuktikan bahwa steroid yang
diisolasi bersifat toksik terhadap larva udang.
2.2.5 Flavonoid
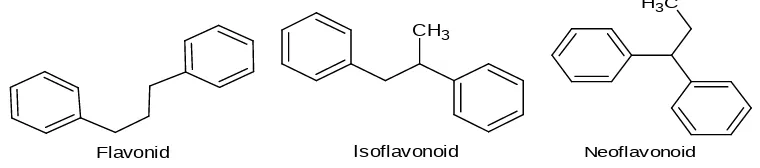
Flavonoid merupakan senyawa fenolik terbesar yang ditemukan di alam. Senyawa ini memiliki kerangka dasar yang terdiri dari 15 atom karbon, dimana dua cincin benzena (C6) terikat pada satu rantai propan (C3) sehingga membentuk suatu
susunan C6-C3-C6. Susunan ini dapat menghasilkan tiga jenis struktur, yakni
1,3-diarilpropan atau flavonoid, 1,2-1,3-diarilpropan atau isoflavonoid, dan 1,1-1,3-diarilpropan atau neoflavonoid (Achmad, 1986).
Flavonid
CH3
Isoflavonoid
C H3
Neoflavonoid
Gambar 2.6 Struktur Senyawa Flavonoid
Menurut Leone dkk (2015), flavonoid mampu menghambat enzim tripsin yang berada di mid-gut larva nyamuk dan akan menyebabkan larva kekurangan nutrisi serta perkembangannya terhambat.
2.3 Metode Isolasi
2.3.1 Ekstraksi kulit batang kelor yang pernah dilakukan
Ekstraksi adalah proses pemisahan suatu bahan alam dari campurannya, biasanya dengan menggunakan pelarut. Tujuan ekstraksi adalah untuk menarik semua senyawa organik atau komponen kimia yang terdapat dalam sampel dengan pelarut tertentu. Ekstraksi ini didasarkan pada perpindahan massa komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut (Sudarma, 2014).
Pemilihan pelarut dalam mengekstraksi senyawa bahan alam merupakan hal yang sangat penting karena dengan pelarut yang tepat akan mendapatkan hasil yang ekstraksi yang maksimal. Metabolit sekunder yang terdapat pada makhluk hidup mempunyai kelarutan yang berbeda-beda artinya mempunyai tingkat kepolaran yang berbeda beda. Tahapan ekstraksi untuk senyawa yang tidak diketahui sifatnya dimulai dari pelarut non polar kemudian dilanjutkan dengan pelarut polar. Tahapan ekstraksi tersebut tidak dapat dibalik artinya tidak bisa dimulai dengan pelarut polar karena pelarut polar tidak bersifat selektif sehingga senyawa non polar atau medium polar mungkin juga dapat terekstrak dengan pelarut polar, selain itu kelarutan tidak saja dipengaruhi oleh polaritas namun juga dipengaruhi oleh volume pelarutnya (Sudarma, 2014).
Ada beberapa metode ekstraksi sampel bahan alam antara lain maserasi, infusdasi, digesti, perkolasi dan soxletasi (Atun, 2014).
sel, maka larutan yang terpekat didesak keluar. Peristiwa tersebut terjadi secara berulang sehingga terjadi keseimbangan konsentrasi antara larutan di luar dan di dalam sel. Filtrat yang diperoleh dari proses tersebut diuapkan dengan alat penguap putar vakum (rotary evaporator) hingga menghasilkan ekstrak pekat (Kristanti, 2008). Keuntungan utama metode ekstraksi maserasi yaitu, prosedur dan peralatan yang digunakan sederhana, tidak dilakukan pemanasan sehingga bahan alam tidak menjadi terurai. Ekstraksi dingin memungkinkan banyak senyawa yang dapat terekstraks, meskipun beberapa senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar (Heinrich, 2004).
b. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru dan sempurna yang umumnya dilakukan pada temperatur ruangan. Prinsip perkolasi adalah dengan menempatkan serbuk simplisia pada suatu bejana silinder, yang bagian bawahnya diberi sekat berpori. Proses terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya, terus menerus sampai diperoleh ekstrak yang jumlahnya dua kali lebih banyak dari sampel awal yang diekstrak (Departemen Kesehatan Republik Indonesia, 2000).
d. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendinginan balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai tiga kali sehingga dapat termasuk ektraksi sempurna
Beberapa penelitian tentang ektraksi kulit batang kelor telah dilakukan. Penelitian yang dilakukan oleh Kumbhare (2012) menunjukkan bahwa ekstraksi senyawa fenolik dilakukan menggunakan tiga pelarut yang berbeda yaitu petroleum eter, kloroform dan metanol dengan menggunakan metode sokletasi. Diperoleh hasil terbesar terdapat pada ekstrak metanol sebesar 16,63 %, ekstrak kloroform 3,6% dan ekstrak petroleum eter sebesar 0,89%. Hasil penelitian yang dilakukan oleh Ikalinus dkk. (2015) menunjukkan bahwa ekstraksi kulit batang kelor dengan menggunakan metode maserasi dan pelarut metanol mengandung senyawa steroid, flavonoid, alkaloid, fenol, dan tanin.
2.3.2 Fraksinasi
Fraksinasi adalah proses pemisahan dan pemurnian untuk mendapatkan kandungan senyawa tertentu (Departemen Kesehatan Republik Indonesia, 2000). Jumlah dan senyawa yang dapat dipisahkan menjadi fraksi berbeda-beda tergantung pada kandungan senyawa di setiap tumbuhan.
2.4 Uji Fitokimia Kulit Batang Kelor
Uji fitokimia merupakan uji kualitatif untuk mengetahui senyawa aktif yang terkandung dalam tanaman. Prinsip dasarnya adanya reaksi pengujian warna dengan suatu reaksi warna (Kristanti, 2008). Uji fitokimia yang sering digunakan antara lain uji saponin, tanin, flavonoid, alkaloid, terpenoid, triterpenoid, dan steroid. Pengujian ini termasuk langkah awal yang penting dalam penelitian mengenai tumbuhan obat atau pencarian senyawa aktif baru dari bahan alam yang dapat menjadi prekusor bagi sintesis obat-obat baru (Iskandar dan Susilawati, 2012).
Beberapa penelitian uji fitokimia ekstrak kulit batang kelor telah dilakukan. Penelitan yang dilakukan oleh Rafshanjani dkk. (2014) di dapatkan bahwa ekstrak metanol kulit batang kelor mengandung alkaloid, glikosida, flavonoid, steroid, karbahidrat, tanin dan saponin. Penelitian yang dilakukan oleh Ikalinus dkk. (2015), menunjukkan bahwa pada kulit batang kelor mengandung senyawa aktif golongan steroid, flavonoid, alkaloid, fenol dan tanin.
2.5 Karakterisasi Kulit Batang Kelor dengan Menggunakan GC-MS
Berdasarkan penelitian yang dilakukan oleh Balamurugan dkk. (2015) untuk mengetahui senyawa yang terkandung dalam batang kelor melalui metode GC-MS dengan menggunakan pelarut metanol dan didapatkan hasil karakterisasi diantaranya isooctanol, 4-nonene,3 methyl, 1,14-tertadecanediol, dibutyl phthalate, heptanoic acid,2-ethyl, 1-hepten-4-ol, 4-dodecanol, squalene.
2.6 Nyamuk Aedes aegypti
Aedes aegypti tersebar diseluruh negara tropis dan subtropis di Asia Tenggara. Ia tersebar pada garis lintang 40º utara dan 40º selatan, distribusi nyamuk ini terbatas pada ketinggian 1000-1500 meter dari permukaan air laut (WHO, 2011). Nyamuk Aedes aegypti sendiri lebih banyak tersebar didaerah perkotaan dengan penyebaran telur pada penampungan air, gelas dan bak mandi (Hendra, 2007).
2.6.1 Taksonomi
Menurut Ananya (2009), klasifikasi nyamuk Aedes aegypti dalam kingdom Animalia adalah sebagai berikut:
Filum : Atyhropoda
Kelas : Insecta
Ordo : Diptera
Family : Culicidae
Genus : Aedes
Spesies : Aedes aegypti L.
2.6.2 Morfologi
Telur Aedes aegypti berbentuk lonjong, panjangnya ± 0,6 mm dan beratnya 0,0113 mg. Pada waktu diletakkan telur berwarna putih, 15 menit kemudian telur berubah menjadi abu-abu dan setelah 40 menit menjadi hitam. Pada dindingnya terdapat garis-garis menyerupai kawat kasa atau sarang tawon (Sungkar, 2005).
belum begitu jelas, dan corong pernapasan belum menghitam. Larva instar II bertambah besar, ukuran 2,5-3,9 mm, duri di dada belum jelas dan corong pernapasan sudah berwarna hitam. Larva instar III berukuran 4-5 mm, duri-duri pada dada sudah mulai jelas dan corong pernapasan berwarna coklat kehitaman. Larva instar IV telah lengkap struktur anatominya dan tubuh dapat dibagi menjadi bagian kepala (caput), dada (thorax), dan perut (abdoment). Larva instar IV mempunyai tanda khas yaitu pelana yang terbuka pada segmen anal, sepasang bulu siphon dan gigi sisir yang berduri lateral pada segmen abdomen ke tujuh (Sunkar, 2005).
Pupa nyamuk Aedes aegypti bentuk tubuhnya bengkok, dengan bagian kepala-dada lebih besar bila dibandingkan dengan bagian perutnya, sehingga tampak seperti tanda baca “koma”. Pada bagian punggung dada terdapat alat bernafas seperti terompet. Pada ruas perut ke delapan terdapat sepasang alat pengayuh yang berguna untuk berenang. Alat pengayuh tersebut berjumbai panjang pada tuas ke delapan (Hendra, 2007).
Nyamuk Aedes aegypti berukuran kecil, berwarna hitam dengan bintik- bintik putih ditubuhnya dan cincin putih dibagian kakinya. Bagian tubuh terdiri atas kepala, thorax dan abdomen. Tanda khas Aedes aegypti berupa gambaran lyre form pada bagian dorsal thorax. Sayap berukuran 2,5-3 mm, bersisik hitam, mempunyai vena yang permukaannya ditumbuhi sisik-sisik sayap yang letaknya mengikuti vena. Pada pinggir sayap terdapat sederet rambut yang disebut fringe (Sunkar, 2005).
2.6.3 Habitat
tertarik untuk meletakkan telurnya pada TPA berwarna gelap, paling menyukai warna hitam, terbuka lebar, dan terutama yang terletak di tempat- tempat terlindung sinar matahari langsung (Hendra, 2007).
Nyamuk Aedes aegypti hidup domestik, lebih menyukai tinggal di dalam rumah daripada luar rumah. Kebiasaan istirahat lebih banyak di dalam rumah pada benda-benda yang bergantung, berwarna gelap dan di tempat-tempat lain yang terlindung (Hendra, 2007).
2.6.4 Siklus hidup
Telur nyamuk Aedes aegypti di dalam air dengan suhu 20-40º C akan menetas menjadi larva dalam waktu 1-2 hari. Kecepatan pertumbuhan dan perkembangan larva dipengaruhi oleh beberapa faktor, yaitu temperatur, tempat, keadaan air dan kandungan zat makanan yang ada di dalam tempat perindukan. Pada kondisi optimum, larva berkembang menjadi pupa dalam waktu 4-9 hari, kemudian pupa menjadi nyamuk dewasa dalam waktu 2-3 hari. Jadi pertumbuhan dan perkembangan telur, larva, pupa sampai dewasa memerlukan waktu kurang lebih 7-14 hari (Hendra, 2007).
BAB III
METODOLOGI PENELITIAN 3.1 Jenis Penelitian
analisis senyawa kulit batang kelor dengan menggunakan instrumen GC-MS dan isolat yang didapat diuji efektivitasnya sebagai larvasida terhadap Aedes aegypti.
3.2 Waktu dan Tempat Penelitian
Penelitian ini bertempat di Laboratorium Kimia Dasar dan Laboratorium Biologi Dasar, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Mataram yang dimulai dari bulan November 2017.
3.3 Persiapan Penelitian 3.3.1 Alat-alat penelitian
Alat-alat yang digunakan dalam penelitian ini adalah blender laboratory, alat-alat gelas pada umumnya, tabung reaski, chamber, corong pisah, botol vial, corong kaca, oven, timbangan analitik, rotary evaporator, set alat sokletasi, set alat kromatografi kolom vakum cair (KVC), set alat kromatografi kolom gravitasi (KKG), spektrofotometri GC-MS, pinset, saringan teh.
3.3.2. Bahan-bahan penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah kulit batang kelor kering, metanol, n-heksana, DCM, asam asetat glasial, etil asetat, aquades, pereaksi meyer, logam Mg (magnesium), larutan yodium, larutan HCl 2M, larutan H2SO4
pekat, asetat anhidrat, larutan HCl pekat, larutan HNO3 pekat, silika gel GF60, plat
KLT, temefos , larva Aedes aegypti, kertas saring, alat-alat tulis, kertas label, gunting, aluminium foil.
3.4 Pelaksanaan Penelitian
3.4.1 Preparasi sampel
Sampel berupa kulit batang kelor sebanyak 1 kg yang diperoleh di wilayah Taliwang, Sumbawa Barat. Sampel diambil dari kulit batang kelor kemudian dibersihkan dari pengotornya. Sampel selanjutnya dicuci dengan air mengalir. Kemudian dikeringanginkan selama 7 hari dan di oven selama 2 hari. Sampel kemudian diblender untuk memperkecil ukuran dan memperluas permukaan (bidang sentuh). Dilakukan juga preparasi pelarut yang digunakan yaitu n-heksana dan metanol dengan cara distilasi, dimana distilasi pelarut n-heksana dilakukan pada suhu penguapan konstan 68 ºC dan pelarut metanol pada suhu penguapan konstan 70 ºC.
3.4.2 Analisis kadar air
Sampel kering yang telah dipreparasi, dianalisis kandungan airnya dengan analisis gravimetri metode penguapan. Langkah awal yaitu dipanaskan cawan pada suhu 105º C selama ± 15 menit untuk menghilangkan kadar airnya, lalu didinginkan di dalam desikator selama 10 menit. Kemudian cawan ditimbang dan diulangi perlakuan sampai diperoleh berat yang konstan. Sampel ditimbang sebanyak 5 gram dan dipanaskan dalam oven pada suhu 105º C selama 1 jam untuk menguapkan air yang ada pada sampel. Setelah itu, didinginkan sampel kering dalam desikator selama ± 15 menit dan ditimbang kembali. Perlakuan ini dilakukan sampai tercapainya berat konstan. Kadar air dihitung dengan menggunakan rumus berikut :
w=(b−c)
(b−a)x100 (3.1)
Keterangan:
w = kadar air (%)
a = berat konstan cawan kosong
b = berat cawan + sampel sebelum dikeringkan
Diharapkan kadar air tidak melebihi 10 % untuk menghindari tumbuhnya mikroba dan jamur yang dapat merusak senyawa aktif di dalam sampel.
3.4.3 Ekstraksi kulit batang kelor
Ekstraksi kulit batang kelor dilakukan dengan menggunakan metode sokletasi. Alat sokletasi dipasang, kemudian serbuk kulit batang kelor 100 gram dibungkus dengan kertas saring, diikat dengan benang, kemudian dimasukkan dalam alat soklet. Sokletasi dilakukan sampai tetesan siklus tidak berwarna lagi. Ekstraksi dilakukan menggunakan pelarut metanol dan dilakukan pada suhu 70º C. Ekstraksi dilakukan sampai pelarut yang menguap sudah tidak berwarna lagi. Ekstrak yang diperoleh kemudian dievaporasi menggunakan rotary evaporator sehingga diperoleh ekstrak kental metanol. Ekstrak kental metanol yang diperoleh selanjutnya ditimbang beratnya.
3.4.4 Fraksinasi ekstrak metanol kulit batang kelor
Fraksinasi ekstrak kental metanol kulit batang kelor dilakukan dengan ekstraksi cair-cair menggunakan corong pisah. Fraksinasi dilakukan dengan mensuspensi ekstrak metanol kulit batang kelor dengan menggunakan dengan tingkat kepolaran yang berbeda. Pelarut yang digunakan adalah pelarut etil asetat dan n-heksana. Kemudian ekstrak metanol diekstraksi berurutan menggunakan n-heksana dan etil asetat. Setiap fraksi kemudian dievaporasi untuk mendapatkan ekstrak kentalnya. Ekstrak kental masing-masing fraksi yang diperoleh selanjutnya ditimbang. Selanjutnya dilakukan uji fitokimia terhadap ekstrak yang diperoleh.
Tabung reaksi yang bersih disiapkan untuk uji fitokimia. Pada tiap-tiap tabung ditambahkan 1 mL ekstrak kental. Selanjutnya ditambahkan 2-3 tetes reagen Mayer. Hasil positif alkaloid apabila terbentuk endapan putih atau kekuning-kuningan.
3.4.5.2 Uji saponin
Ekstrak kental diambil sebanyak 1 mL, dimasukkan ke dalam tabung reaksi, ditambahkan air sebanyak 1 mL (1:1) dan dikocok selama 1 menit, apabila menimbulkan busa dan dapat bertahan selama 10 menit, maka ekstrak positif mengandung saponin.
3.4.5.3 Uji steroid/terpenoid
Ekstrak kental diambil sebanyak 1 mL, dimasukkan dalam tabung reaksi, dilarutkan dalam 0,5 mL kloroform dan ditambah dengan 0,5 mL asam asetat anhidrat. Campuran ini selanjutnya ditambah dengan 1-2 mL H2SO4 pekat melalui
dinding tabung. Jika hasil yang diperoleh berupa cincin kecoklatan atau violet pada perbatasan dua pelarut maka ekstrak tersebut menunjukkan adanya terpenoid, sedangkan jika hasil yang diperoleh terbentuk warna hijau kebiruan maka ekstrak tersebut menunjukkan adanya steroid.
3.4.5.4 Uji flavonoid
Tabung reaksi sebanyak empat buah disiapkan untuk diuji. Pada tiap tabung reaski ditambahkan 2 mL ekstrak kental. NaOH encer sebanyak 1 mL ffditambahkan ke dalam tabung I, tabung II ditambahkan dengan 1 mL natrium asetat (CH3COO- Na+),
tabung III ditambahkan logam Mg dan 4-5 tetes HCl pekat dan 1 mL H2SO4 pekat
ditambahkan ke dalam tabung IV. Perubahan warna merah atau kuning menunjukkan positif flavonoid.
Sebelum dilakukan pemisahan, fraksi n-hexana dianalisis menggunakan metode kromatografi lapis tipis (KLT). Tujuannya adalah untuk melihat pola pemisahan senyawa-senyawa yang ada di dalamnya. Disiapkan peralatan yang diperlukan seperti chamber dan plat KLT. Pada plat KLT dibuat garis sebagai batas atas dan batas bawah dengan jarak masing-masing 1 cm dari pinggirnya. Sebelum sampel ditotolkan terlebih dahulu dibuat larutan pengembangnya (eluen). Eluen dibuat dengan pelarut tunggal atau campuran pelarut dengan perbandingan tertentu, kemudian eluen dijenuhkan beberapa saat di dalam chamber. Sampel selanjutnya ditotolkan pada garis batas bawah plat KLT, kemudian saat eluen mencapai garis batas atas, plat KLT diangkat, ditunggu hingga kering atau sambil digoyangkan, kemudian untuk mendeteksi senyawa flavonoid maka plat KLT dianalisis dibawah lampu UV pada panjang gelombang 365 nm.
3.4.7 Kromatografi kolom vakum cair (KVC)
Fraksi n-heksana difraksinasi dengan menggunakan kromatografi kolom vakum dengan fase diam berupa silika gel GF60 dan fase gerak berupa berupa pelarut organik
kolom untuk melindungi kolom. Kolom juga dijaga untuk tidak kering, maka di atas lapisan pasir harus selalu ada selapis fase gerak.
Sampel selanjutnya dimasukkan ke dalam, dimana sebelumnya telah diimpregnasi terlebih dahulu dengan menambahkan silika gel. Eluen yang sesuai selanjutnya ditambahkan ke dalam kolom. Hasil pemisahan ditampung dan diberi nomor, kemudian penggantian fase gerak dilakukan ketika eluen yang dimasukkan sebelumnya telah habis digunakan untuk mengaliri kolom. Semua fraksi yang diperoleh kemudian diuji dengan menggunakan KLT untuk melihat pola pemisahannya. Fraksi-fraksi yang memiliki pola pemisahan yang ditandai dengan nilai Rf yang sama digabungkan menjadi satu untuk selanjutnya dilakukan
kromatografi kolom gravitasi (KKG).
3.4.8 Kromatografi kolom gravitasi (KKG)
Persiapan untuk kromatografi kolom gravitasi ini dilakukan seperti metode sebelumnya yaitu metode basah, dimana cara basa lebih mudah untuk mendapatkan packing yang memberikan pemisahan yang baik. Proses pemisahan dilakukan seperti proses sebelumnya. Kemudian dilakukan pemisahan sampai diperoleh beberapa fraksi. Fraksi-fraksi yang dihasilkan dari kromatografi kolom tekan ini selanjutnya di KLT. Fraksi-fraksi yang memiliki kesamaan noda dan nilai Rf digabungkan menjadi
F1, F2, F3 dan seterusnya. Fraksi yang memiliki pemisahan yang paling baik
selanjutnya dianalisis dengan menggunakan instrumen GC-MS.
3.4.9 Instrumentasi Gas Chromatography-Mass Spectrometry (GC-MS)
3.5 Uji Efektifitas Larvasida 3.5.1 Sampel
3.5.1.1 Kriteria inklusi
Larva Aedes aegypti
Larva Aedes aegypti instar 3
Larva hidup
Larva yang bergerak aktif
3.5.1.2 Kriteria eksklusi
Bukan larva Aedes aegypti
Bukan larva Aedes aegypti instar 3
Larva mati
3.5.1.3 Besar sampel
Jumlah larva yang digunakan adalah 10 ekor untuk setiap larutan larutan uji dengan konsentrasi yang telah ditentukan. Adapun konsentrasi pada uji ini berjumlah lima konsetrasi berbeda, satu kontrol positif dan satu kontrol negatif kemudian dilakukan pengulangan sebanyak tiga kali. Sehingga jumlah sampel total yang dibutuhkan adalah 210 larva Aedes aegypti
3.6.1 Variabel Penelitian 3.6.1.1 Variabel bebas
Variabel bebas atau independent variable pada penelitian ini adalah isolat dari kulit batang kelor dan larva Aedes aegypti.
Variabel terikat atau dependent variable pada penelitian ini adalah Letal Conceration 50 (LC50).
3.6.3 Cara Kerja
3.6.3.1 Pembuatan larutan a. Larutan uji
Larutan uji dibuat dengan melarutkan isolat dengan n-heksana murni dengan cara menimbang isolat sebanyak 25 gram dalam 50 mL pelarut (larutan induk 500 ppm). Kemudian dilakukan pengenceran dengan konsentrasi 250 ppm, 125 ppm, 62,5 ppm dan 31,25 ppm.
b. Pembuatan larutan temefos 1%(kontrol positif)
Ditimbang 0,5 g bubuk temefos. Dilarutkan dalam aquades steril. Kemudian larutan yang telah homogen dipindahkan ke dalam labu takar 50 mL. Kemudian ditambahkan aquades sampai tanda batas.
c. Pembuatan larutan kontrol negatif
Larutan kontrol negatif adalah aquades.
3.6.3.2 Uji larvasida a. Uji eksplorasi
Uji eksplorasi digunakan guna mengetahui konsentrasi dari larutan yang menyebabkan kematian sebanyak 50% pada larva yang digunakan dalam penelitian. Kriteria mati pada larva yaitu jika larva tidak bergerak dan tidak bereaksi jika disentuh.
Larva yang sudah sesuai untuk digunakan dimasukkan ke dalam gelas
plastik.
Larva yang sudah berada di gelas plastik disaring menggunakan saringan
teh, kemudian dimasukkan kedalam larutan uji.
Kemudian dilakukan pengamatan setelah 24 jam.
b. Uji utama
Dibuat larutan induk untuk uji utama, dimana larutan induk yang
digunakan adalah larutan dengan konsentrasi terendah yang dapat membunuh 100% larva.
Larutan diencerkan setengah dari konsentrasi awal sehingga didapat lima
variasi konsentrasi yang berbeda.
Hasi pengenceran dimasukkan kedalam gelas plastik.
Larva yang sudah sesuai untuk digunakan dimasukkan ke dalam gelas
plastik.
Larva yang sudah berada di gelas plastik disaring menggunakan saringan
teh, kemudian dimasukkan kedalam larutan uji.
Kemudian dilakukan pengamtan setiap 12 jam sekali.
3.6.8 Analisis dan Interpretasi Data
a. Uji Normalitas
Uji ini dilakukan untuk mengetahui nilai sebaran data pada sebuah kelompok data, apakah sebaran data telah terdistribusi normal atau tidak. Jika data yang ditemukan normal, maka dapat dilakukan uji One-Way Annova.
b. Uji Homogenitas
Uji ini dilakukan untuk mengetahui nilai kesamaan data pada sebuah kelompok data, apakah sebaran data telah terdistribusi normal atau tidak. Jika data yang ditemukan normal, maka dapat dilakukan uji One-Way Annova.
c. Uji One-Way Annova
Uji ini dilakukan untuk mengetahui perbedaan jumlah kematian larva pada setiap konsentrasi. Namun, syarat dilakukan uji ini adalah data yang terdistribusi normal.
d. Analisis Probit
DAFTAR PUSTAKA
Andareto, Obi, 2015, Apotik Herbal di Sekitar Anda (Solusi Pengobatan 1001 Penyakit Secara Alami dan Sehat Tanpa Efek Samping), Jakarta, Pustaka Ilmu Semesta.
Atun, Sri, 2014, Metode Isolasi dan Identifikasi Struktur Senyawa Organik Bahan Alam Senyawa Alam Metabolit Sekunder Teori, Konsep, dan Teknik Pemurnian, Jurnal Konservasi Cagar Budaya Borobudur, Vol 8, No. 2, hal 53-61.
Avriani, B.E.J, 2017, Isolasi Senyawa Antibakteri dari Ekstrak Metanol Daun Asam Jawa (Tamarindus Indica L.), Skripsi, Mataram, Universitas Mataram.
Bargah, R. K, dan Chinmoyee, D., 2010, Isolation of Flavonoid Glycoside from Moringa pterygosperma, Oriental Journal of Chemistry, Vol 26, No. 3, hal 1203-1205.
Boesri, Hasan. Bambang, H., Sri, W.H., Tri, S., 2015, Uji Toksisitas Beberapa Ekstrak Tanaman terhadap Larva Aedes aegypti Vektor Demam Berdarah Dengue, Vektora, Vol7, No. 1, hal 29-38.
Bonang, G., 1992, Mikrobiologi untuk Profesi Kesehatan Edisi 16, Jakarta, Buku Kedokteran EGC.
Brooks, G.F, Butel J.S, Carroll, K.C., 2007, Medical Microbiology 24th Ed, USA, Mc Graw Hill.
Chairunnisa, Firda. Alima dan Ana, Medawati, 2014, Pengaruh Daya Antibakteri Obat Kumur Ekstrak Etanol Daun Ciplukan (Physalis angulata) terhadap Bakteri Streptococcus mutans In Vitro, Yogyakarta, Deepublish.
Departeman KesehatanRI, 2000, Parameter Standar Umum Ekstrak Obat, Jakarta, Diktorat Jendral POM-Depkes RI.
Djamil, Ratna dan Cathrina, Yenni, 2015, Isolasi dan Identifikasi Senyawa Flavonoid dalam Fraksi n-Butanol Daun Dewa (Gynura pseudochina (L.)DC) secara Spektrofotometri UV-Cahaya Tampak. Jurnal Ilmu Kefarmasian Indonesia, Vol 12, No. 1, hal 93-98.
Ferreira, P.M.P., Ana, F.U.C., Davi,F.F., Nara, G.C., Vania, M.M.M., Maria, G.R.Q., Alice, M.C.M., Joaquim, G.M.N., 2009, Larvicidal Activity of the Water Extract of Moringa oleifera Seeds Against Aedes aegypti and Its Toxicity upon Laboratory Animals, Anais da Academia Brasileira de Ciencias, Vol 2, No. 81, hal 207-216.
Forssten, S.D., Marika, B., Arthur, C.O., 2010, Streptococcus mutans,Caries and Simulation Models. Journal Nutrient, Vol 5, No. 2, hal 290-298.
Greenwood, 1995, Antibiotic Susceptibility (Sensitivity) test, Antimicrobial and Chemotherapy, USA, Mc Graw Hill Company.
Idowu, Kehinde, Oseni, Abass, O., 2015, Compositional Investigation of Phytochemical and Antioxidant Properties of Various part of Moringa oleifera Plant, Jurnal Basic Appl Sci, Vol 2, No. 2, hal 2059-3058.
Grotewold, Erich, 2006, The Science of Flavonoids, Ohio, Springer.
Kementerian Kesehatan RI., 2016, Infodatin Pusat Data dan Informasi Kementerian Kesehatan RI Situasi DBD di Indonesia, Kementerian Kesehatan RI, Jakarta.
Kusmana, Cecep dan Agus Hikmat., 2015, Keanekaragaman Hayati Flora di Indonesia, Jurnal Pengelolaan Sumberdaya Alam dan Lingkungan, Vol 5, No.2, hal 187-198.
Krisnadi, A. D., 2015 , Kelor Super Nutrisi, Blora, LSM-MEPELING.
Kristianti, A.N., Aminah, N.S., Tanjung, M., dan Kurniadi, B., 2008, Buku Ajar Fitokimia, Surabaya, Unair Press.
Leone, A., Spada, A., Battezzati, A., Schiralddi, A., Bertoli, S., 2015, Cultivation, Genetic, Ethnopharmacology, Phytochemistry and Pharmacology of Moringa oleifera Leaves, International Journal Mol Sci, No. 16, hal 12791-12835.
Markham, K. R., 1998, Cara Mengidentifikasi Flavonoid, Bandung, ITB.
Markham, K. R, dan Oyvind, M. A., 2006, Flavonoids Chemistry, Biochemistry and Applications, USA, CRC Press.
Maung, Yuzana, Sutartina, S.H., dan Lukman, A., 2016, Efek Ekstrak Daun Kelor (Moringa oleifera) terhadap Mortalitas Larva Anopheles aconitus L.,Surakarta, Universitas Sebelas Maret.
Muntasiroh, Q. A., 2010, Isolasi dan Identifikasi Komponen Kimia Fraksi Teraktif Buah Merah (Pandanus conoideus lam.) Hasil Uji Toksisitas secara Brine Shrimp Lethality Test, Skripsi, Surakarta, Universitas Sebelas Maret.
Ningsih, U.T., Yuliani, Haryono,T., 2013, Pengaruh Filtrat Umbi Gandung, Daun Sirsak dan Herba Anting-anting terhadap mortalitas larva Spodeptera litura, Jurnal LenteraBio, Vol 2, No. 1, hal 33-36.
Nollet, L.M.L., 2004, Handbook of Food Analysis Second Edition Revised and Expanded, New York, Marcel Dekker Inc, hal 1211-1245.
Saenong, M.S., 2016, Tumbuhan Indonesia Potensial sebagai Insektisida Nabati untuk Mengendalikan Hama Kumbang Bubuk Jagung (Sitophilus spp.), Jurnal Litbang Pertanian, Vol. 35, No. 3, hal 131-142.
Sastrohamdjoyo Hardjono., 2002, Kromatografi, Yogyakarta, Liberty.
Saifudin, Azis, Senyawa Alam Metabolit Sekunder Teori, Konsep, dan Teknik Pemurnian, Yogyakarta, Deepublish.
Sudarma, I.M., 2014, Kimia Bahan Alam, Mataram, Universitas Mataram.
Sungkar,S., 2005, Bionomik Aedes aegypti, Vektor Demam Berdarah Dengue. Majalah Kedokteran Indonesia,Vol.55, No. 4, hal 384-389.
Yunita, A.E., Suprapti, N.H., Hidayat, J.W., 2009, Pengaruh Ekstrak Daun Teklan (Eupatorium riparium) terhadap Mortalitas dan Perkembangan Larva Aedes aegypti, Jurnal BIOMA, Vol 11, No. 1, hal 11-17.
Whiley, R. A, dan Belghton, D., 2013, Streptococci and Oral Stretococci. Bite-Sized Tutorial.