DETEKSI ANTIBODI ANTI- E
scherichia coli
K99
DI DALAM SERUM INDUK SAPI FRIESIAN HOLSTEIN BUNTING
POST VAKSINASI E.
coli
DENGAN TEKNIK ELISA
ITA KRISSANTI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2008
1
ABSTRAK
ITA KRISSANTI. B04104022. Deteksi Antibodi Anti-Eschercia coli K99 di dalam Serum Induk Sapi Friesian Holstein Bunting Post Vaksinasi E. coli dengan Teknik ELISA. Dibimbing oleh SRI MURTINI dan ANITA ESFANDIARI.
Penelitian ini bertujuan untuk mengetahui respon terbentuknya antibodi anti-Escherichia coli K99 pada induk sapi Friesian Holstein (FH) bunting yang divaksinasi dengan vaksin E. coli polivalen inaktif. Empat ekor induk sapi bunting tua kering kandang digunakan dalam penelitian sebagai kelompok sapi dalam menentukan nilai batas positif dan negatif (background). Dua ekor diantaranya kemudian digunakan sebagai hewan coba. Satu ekor divaksinasi tiga kali dengan dosis 5 ml/ekor secara intramuskular pada 8, 6, dan 4 minggu sebelum perkiraan partus. Satu ekor lainnya tidak divaksin sebagai kontrol serum negatif. Selanjutnya serum sampel dikumpulkan sebelum vaksinasi dan setiap minggu setelah vaksinasi hingga induk sapi partus. Respon antibodi anti-E. coli K99 dalam serum diperiksa menggunakan teknik Enzyme-linked Immunosorbent Assay (ELISA) dengan metode tidak langsung. Hasil penelitian menunjukkan bahwa antibodi anti-E. coli K99 di dalam serum sapi yang divaksin mulai terdeteksi satu minggu setelah vaksinasi pertama dan bertahan sampai dengan 5 minggu post vaksinasi pertama. Dari hasil penelitian ini dapat disimpulkan bahwa antibodi spesifik terhadap E. coli K99 pada induk sapi FH bunting dapat diinduksi dengan pemberian vaksin E. coli sebanyak tiga kali dengan interval waktu vaksinasi masing-masing 2 minggu.
2
ABSTRACT
ITA KRISSANTI. B04104022. Detection of Anti-Escherchia coli K99 Antibody in the Serum of Pregnant Friesian Holstein Cattle in Post Vaccination of E. coli with ELISA Technique. Under direction of SRI MURTINI and ANITA ESFANDIARI.
This research was conducted to find out the immune response of pregnant Friesian Holstein (FH) cows which were vaccinated with inactive E. coli polyvalent vaccines. Four pregnant diary cows were used to determine the cut off value (background). Two cows were used for experimental study, one animal was vaccinated three times at 8, 6, and 4 weeks before calving, other was unvaccinated as control. The vaccination applied by intra muscular injection at dosages level of 5 ml. Serum samples were collected before vaccination and every week after vaccination until calving. The anti-E. coli K99 antibody responses was detected by indirect enzyme-linked immunosorbent assay (ELISA). The result showed that the anti-E. coli K99 antibody in the serum of the vaccinated cow was detected one week after the first vaccination and lasted until the fifth week post vaccination. From this experiment, it can be concluded that specific antibody against E. coli K99 in a pregnant FH cattle can be induced using the vaccine of E. coli as many as three times with two weeks interval.
3
DETEKSI ANTIBODI ANTI- E
scherichia coli
K99
DI DALAM SERUM INDUK SAPI FRIESIAN HOLSTEIN BUNTING
POST VAKSINASI E.
coli
DENGAN TEKNIK ELISA
ITA KRISSANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2008
4
Judul Skripsi : Deteksi Antibodi Anti-Eschericia coli K99 di dalam Serum Induk Sapi Friesian Holstein Bunting Post Vaksinasi E. coli dengan Teknik ELISA
Nama : Ita Krissanti NIM : B04104022
Disetujui
Dr. Drh. Sri Murtini, MSi Dr. Drh. Anita Esfandiari, MSi
Pembimbing I Pembimbing II
Diketahui
Dr. Nastiti Kusumorini Wakil Dekan FKH IPB
5
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tulisan ini adalah hasil penelitian pada paruh waktu terakhir masa pendidikan di Fakultas Kedokteran Hewan IPB.
Terima kasih penulis sampaikan kepada Dr. Sri Murtini dan Dr. Anita Esfandiari atas bimbingannya. Penulis merasa sangat dibantu atas saran, kritik, diskusi, bimbingan laboratorik dan penulisan serta penyusunan skripsi ini. Ungkapan terima kasih juga disampaikan kepada Dr. Abadi Sutisna selaku pembimbing akademik yang telah memberikan arahan dan memperkaya wawasan penulis selama masa kuliah.
Penghargaan penulis sampaikan kepada Dr. Rochman Naim yang membukakan jalan dan memberi kesempatan bagi penulis untuk mendalami minat dalam bidang mikrobiologi. Disamping itu terima kasih penulis sampaikan kepada Dr. Eko Sugeng Pribadi, Drh. Rahmat Hidayat, MSi., dan Drh. Usamah Affif, MSc. yang telah mendukung dan memberi kepercayaan bagi penulis. Penulis tidak akan bisa melupakan bantuan dan dukungan dari beliau semua. Selanjutnya penulis menyampaikan terima kasih kepada Bapak Agus Sumantri dari Laboratorium Bakteriologi yang telah banyak memberi informasi dan saran. Ucapan terima kasih juga ditujukan kepada seluruh staf bagian Imunologi, bagian Patologi Klinik, dan bagian Mikrobiologi FKH IPB yang telah membantu selama proses penelitian.
Terima kasih penulis sampaikan kepada tim satu penelitian (Noviyanti, Siti, Annisa, Hasan, Faisal, dan Tresna) yang selalu membantu dan berbagi suka duka selama penelitian. Penulis menyampaikan terima kasih kepada Fitriawati, Lili, Debby, dan semua sahabat yang selalu hangat memberikan dorongan, inspirasi, keberanian, serta semangat. Terima kasih penulis sampaikan juga kepada rekan-rekan asteroidea 41 yang telah bersama-sama melewati berbagai pengalaman selama empat tahun.
Kepada kedua orang tua, kakak, dan keluarga tercinta, penulis menyampaikan terima kasih atas doa, semangat, dorongan, dan pengorbanan yang senantiasa diberikan kepada penulis agar tangguh menjalani cita-cita. Semoga skripsi ini dapat bermanfaat bagi para pembaca yang menggunakannya.
6
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 21 Juni 1986, sebagai putri kedua dari keluarga Drs. H. E. Sunarman dan Yanti Yulianti. Penulis menempuh pendidikan di SD Negeri Brawijaya 2 Kota Sukabumi tahun 1992-1998, dan SLTP Negeri 1 Kota Sukabumi tahun 1998-2001. Pada tahun 2004 penulis lulus dari SMA Negeri 3 Kota Sukabumi kemudian diterima di Fakultas Kedokteran Hewan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan, penulis mengikuti organisasi Forum Ilmiah Mahasiswa FKH IPB, Himpunan Profesi Satwa Liar FKH IPB, dan Ikatan Mahasiswa Kedokteran Hewan Indonesia. Penulis juga menjadi asisten mata kuliah Mikrobiologi Medis I tahun akademik 2006/2007 dan 2007/2008.
DAFTAR ISI
Halaman
DAFTAR TABEL . . . viii
DAFTAR GAMBAR. . . ix PENDAHULUAN. . . 1 Latar Belakang. . . 1 Tujuan . . . 2 Manfaat . . . 2 Hipotesis . . . 2 TINJAUAN PUSTAKA. . . 3 Escherichia coli . . . 3 Kekebalan Humoral . . . 5 Vaksinasi . . . 6
Sapi Friesian Holstein (FH) . . . 7
Teknik Enzyme-Linked Immunosorbent Assay (ELISA). . . 9
BAHAN DAN METODE. . . 10
Waktu dan Tempat Penelitian . . . 10
Hewan Percobaan . . . 10
Bahan dan Alat. . . 10
Metode Penelitian . . . 10
Pemeliharaan Hewan Percobaan. . . 10
Vaksinasi. . . 11
Pengambilan dan Penyimpanan Serum . . . 11
Pemeriksaan ELISA . . . 11
Analisis Hasil ELISA . . . 12
HASIL DAN PEMBAHASAN . . . 14
SIMPULAN DAN SARAN . . . 20
Simpulan . . . 20
Saran . . . 20
DAFTAR PUSTAKA . . . 21
8
DAFTAR TABEL
Halaman
1 Data biologis sapi . . . 8
2 Rumus perhitungan nilai absorbansi. . . 12
3 Nilai absorbansi kelompok sapi background. . . 15
9
DAFTAR GAMBAR
Halaman 1 Beberapa morfologi mikroskopis Escherichia coli (E. coli ) . . . 3 2 Induk sapi perah betina jenis Friesian Holstein. . . 7 3 Hasil ELISA. Warna biru yang semakin tua menandakan nilai
absorbansi yang semakin besar . . . 14 4 Respon antibodi (IgG) terhadap E. coli K99 dalam serum sapi yang
PENDAHULUAN
Latar Belakang
Penyakit diare yang disebabkan oleh bakteri Escherichia coli merupakan masalah kesehatan dunia yang masih sering terjadi dan dapat menyerang setiap saat. Bakteri E. coli dapat menyerang unggas dan mamalia, termasuk manusia (Gross dan Barnes 1997). Bakteri ini telah tersebar di seluruh dunia dan termasuk salah satu mikroorganisme penyebab food borne diseases, water borne diseases bahkan air borne diseases (Shakespeare 2002; Andriani 2005; Murdiati & Sendow 2006). Habitat kehidupan alami bakteri E. coli adalah di dalam saluran pencernaan manusia dan hewan (bakteri enterik). Oleh karena itu pada kondisi sanitasi dan higienitas yang buruk, bakteri ini dapat mencemari air, tanah maupun bahan pangan.
E. coli merupakan penyebab penyakit kolibasilosis pada sapi terutama periode neonatal. Bakteri ini biasanya menjangkiti anak sapi yang berumur dibawah 14 hari, dan banyak kasus terjadi pada umur kurang dari 1 minggu (Seddon 1967). Menurut Supar (1986), agen kausatif utama diare neonatal dan penyebab kematian anak sapi yang sering ditemukan di lapangan adalah E. coli enterotoksigenik (ETEC) yang mempunyai antigen perlekatan K99, F41 atau K99 F41 sebagai faktor virulensinya. Penyakit infeksius yang disebabkan oleh ETEC pada anak sapi ditandai dengan diare profus dan feses berwarna putih kekuning-kuningan, dehidrasi serta jika parah dapat diakhiri dengan kematian anak sapi yang rentan (Supar et al. 1998).
Dampak kerugian ekonomi akibat kematian anak sapi tersebut sangat besar dan sangat berarti bagi petani kecil. Dalam Utomo et al. (2006), kematian anak sapi pada tingkat peternak di Indonesia umumnya masih cukup tinggi yaitu berkisar antara 7-27%. Sementara Supar (2001) melaporkan bahwa prevalensi diare anak sapi perah 20-31%, dan kematian karena diare berkisar 19-24% per tahun. Dalam penelitian lapangan tahun 1992/1993 seperti yang dilaporkan oleh Supar (1996), pada peternakan sapi perah di Kabupaten Bogor, Sukabumi dan Bandung, kasus diare mencapai 15,8-19,6%, sedangkan kematian anak sapi perah sampai umur 2 bulan pada peternakan responden di daerah tersebut berkisar antara 7-16% dan pada peternakan intensif di Sukabumi Selatan mencapai 56,2%. Supar et al. (1993) juga melaporkan bahwa kerugian lain yang
2
timbul karena penyakit ini adalah meningkatnya biaya perawatan dan pengobatan, serta penurunan berat badan.
Infeksi E. coli dapat dikurangi diantaranya melalui tindakan sanitasi, penggunaan antibiotik dan vaksinasi. Penggunaan antibiotik terus-menerus dapat menimbulkan resistensi. Adanya multipel resistensi ETEC terhadap antibiotika yang sering dipakai di peternakan dilaporkan oleh Supar et al. (1990), sehingga upaya pencegahan timbulnya infeksi E. coli dengan jalan vaksinasi merupakan alternatif pengendalian yang cukup aman dan efektif. Menurut Soeripto (2002), vaksinasi merupakan salah satu upaya untuk mencegah penyakit, dan upaya yang efektif untuk menghindarkan diri dari residu antibakteri dan resistensi bakteri. Penelitan yang dilakukan Supar et al. (1998) menyatakan bahwa penggunaan vaksin ETEC terhadap induk sapi pada tingkat akhir kebuntingan dapat menurunkan kematian pedet dari rata-rata 13% per bulan menjadi 0,7% per bulan pada sebuah peternakan intensif di Sukabumi.
Induk sapi bunting yang divaksin dengan E. coli diharapkan dapat membentuk antibodi yang dapat dipindahkan melalui kolostrum kepada anaknya sebagai pemberi kekebalan pasif. Selama ini respon induk bunting yang divaksinasi belum banyak diamati karena dikhawatirkan vaksinasi pada hewan bunting akan membahayakan keselamatan induk dan fetus. Oleh sebab itu penting untuk mengetahui respon hewan bunting yang divaksin.
Tujuan
Penelitian ini bertujuan untuk mendeteksi adanya antibodi anti-E. coli K99 dengan metode Enzyme-linked Immunosorbent Assay (ELISA) di dalam serum induk sapi Friesian Holstein bunting yang divaksinasi dengan vaksin E. coli.
Manfaat
Penelitian ini diharapkan dapat memberikan informasi apakah pemberian vaksinasi E. coli pada induk sapi Friesian Holstein dapat membentuk antibodi spesifik terhadap E. coli K99 di dalam serum yang akan menjadi sumber antibodi dalam kolostrum untuk imunisasi pasif anak sapi terhadap diare neonatal.
Hipotesis
Induk sapi Friesian Holstein bunting yang divaksinasi dengan vaksin E. coli akan membentuk antibodi spesifik terhadap E. coli K99 di dalam darah.
3
TINJAUAN PUSTAKA
Escherichia coli
E. coli merupakan salah satu jenis bakteri yang secara normal hidup dalam saluran pencernaan baik manusia maupun hewan yang sehat. Klasifikasi E. coli dalam Todar (2008) adalah sebagai berikut:
kingdom : Bacteria filum : Proteobacteria
kelas : Gamma Proteobacteria ordo : Enterobacteriales
famili : Enterobacteriaceae genus : Escherichia
spesies : Escherichia coli
Gambar 1 Beberapa morfologi mikroskopis Escherichia coli (E. coli ). (Sumber: Source molecular 2008)
Nama bakteri E. coli diambil dari nama seorang bakteriolog yang berasal dari Jerman yaitu Theodor Von Escherich, yang berhasil melakukan isolasi bakteri ini pertama kali pada tahun 1885. E. coli berbentuk batang pendek (kokobasil), berukuran 0,5-1,0 x 1,0-4,0 mikron dan tidak berspora. Selain itu E.coli memiliki sifat Gram negatif, tidak tahan asam, serta fakultatif anaerob.
4
Strain E. coli yang patogen dapat menimbulkan diare enterik dan dikelompokkan dalam 6 kategori yaitu: enterotoxigenic (ETEC), enterohemorrhagic (EHEC), enteroinvasive (EIEC), enteropathogenic (EPEC), enteroaggregative (EAEC) dan diffuse-adherent (DAEC). E. coli menjadi patogen karena memiliki faktor virulensi berupa antigen kapsul, pili, fimbriae, enterotoksin, hemolisin, kolisin dan aerobaktin atau sideropor (Gross & Barnes 1997; Carter & Wise 2004).
Kelompok E. coli enterotoksigenik (ETEC) menjadi agen penting penyebab diare akut pada hewan muda dan anak-anak. Perlekatan sel enterosit usus kecil oleh fimbriae merupakan langkah pertama ETEC patogen untuk menimbulkan diare. Fimbriae adalah struktur permukaan bakteri berupa protein polimer yang berbentuk seperti serabut yang sangat halus. Adhesin fimbriae pada ETEC babi dan sapi dinamakan K88 dan K99 (Orskov & Orskov 1983). Terdapat empat adhesin fimbriae ETEC yang dikenal pada ternak neonatal yaitu K88(F4), K99(F5), P987(F6), dan F41 (Cox & Houvenagel 1993).
Bakteri ETEC K99 menghasilkan enterotoksin yang tahan panas. Diare yang muncul akibat aktivitas enterotoksin pada ETEC pada prinsipnya bekerja sebagai antiabsorbtif karena bekerja menghalangi transpor Na+ dan Cl- dari lumen ke dalam sel epitel usus yang kemudian terjadi peningkatan sekresi cairan isotonis. Enterotoksin juga merusak motilitas usus yang merupakan faktor untuk memfasilitasi keberadaan ETEC di dalam lumen usus. Faktor penting pada inang dalam infeksi ETEC adalah umur, pH lambung, dan kehadiran antibodi spesifik terhadap permukaan antigen ETEC (Todar 2008).
Infeksi ETEC K99 sering menyebabkan diare akut dan kematian anak sapi neonatal pada hari-hari minggu pertama kelahirannya (Supar 1996). Bakteri ini dapat masuk melalui tali pusar atau mulut. Infeksi pada tali pusar sering kali menyebabkan septikemia. Dalam keadaan parah terjadi radang pada persendian sehingga anak sapi sulit untuk berdiri. Tanda khusus penyakit ialah berak berwarna putih kekuningan yang cair seperti pasta dengan bau yang busuk sehingga penyakit ini dikenal dengan nama white scours diseases. Diagnosa penyakit dapat ditentukan secara klinis dan pemeriksaan laboratorium (Seddon 1967; Syarief & Sumoprastowo 1985).
5
Kekebalan Humoral
Respon kebal dalam tubuh terdiri atas kekebalan humoral dan kekebalan yang berperantara sel (seluler). Kekebalan humoral melibatkan interaksi antara sel B (limfosit B) dengan antigen yang disertai proses proliferasi dan diferensiasi sel limfosit B menjadi sel plasma yang memproduksi antibodi. Saat terpapar suatu antigen atau protein asing, tubuh hewan akan melakukan respon kebal humoral dengan menghasilkan antibodi yang bereaksi spesifik terhadap antigen tersebut. Molekul antibodi yang ditemukan oleh Paul Ehrlich pada periode 1888-1897 merupakan molekul protein yang dihasilkan oleh sel limfosit B sebagai respon terhadap adanya antigen di dalam tubuh (Kreier & Mortensen 1990). Antibodi tersebut berfungsi sebagai molekul efektor dalam respon kekebalan humoral dengan berikatan dengan antigen untuk kemudian menetralisasi atau memfasilitasi eliminasinya (Kuby 2004).
Sel B (limfosit B) dihasilkan oleh sumsum tulang dan bersirkulasi di dalam sirkulasi darah, cairan limfe ataupun tersimpan di berbagai organ limfoid. Interaksi antara sel B dengan antigen akan menyebabkan aktivasi, proliferasi dan diferensiasi sel B tersebut. Mekanisme ini terjadi saat antigen berikatan dengan molekul membran pada sel B. Setelah antigen diproses, sel B akan memaparkan peptida-peptida antigen yang berikatan dengan Major Histocompatibility Complex (MHC) kelas II pada membran sel. Sel T-helper yang spesifik terhadap kompleks antigen-MHC kemudian berikatan dan mensekresikan sitokin atau interleukin. Sitokin selanjutnya akan menstimulasi proses pembelahan dan diferensiasi sel B. Sel B yang teraktivasi akan berproliferasi dan berdiferensiasi menjadi sel memori dan sel plasma yang mensekresikan antibodi (Kuby 2004).
Molekul antibodi atau imunoglobulin dibedakan ke dalam lima kelas yaitu IgM, IgG, IgA, IgE, dan IgD, berdasarkan ukuran molekul, waktu paruhnya di dalam plasma, kandungan karbohidrat, dan aktivitas biologisnya. Antibodi utama yang paling berlimpah dalam sirkulasi adalah imunglobulin gamma (IgG). Molekul IgG disintesa pada bagian akhir dari respon imun primer dan merupakan antibodi utama yang disintesa selama respon imun sekunder (Kuby 2004).
Antibodi sebagai zat kebal yang mencegah infeksi mikroorganisme patogen mempunyai banyak manfaat dan digunakan secara luas dalam reagen diagnostik untuk mendeteksi dan mengukur bahan biologis. Antibodi dapat digunakan untuk memurnikan bahan biologis. Antibodi juga dapat digunakan untuk pengobatan penyakit baik pada manusia maupun pada hewan.
6
Pengukuran antibodi serum terhadap bakteri tertentu (serologi bakteri) digunakan secara luas untuk memantau prosedur vaksinasi, untuk mempelajari patogenisitas penyakit, dan yang paling penting sebagai wahana diagnosa penyakit (Spencer 1995).
Vaksinasi
Vaksinasi adalah pemberian vaksin ke dalam tubuh seseorang untuk memberikan kekebalan terhadap suatu penyakit (Kreier & Mortensen 1990). Seperti halnya vaksin virus, vaksin bakteri terdiri dari dua bentuk yaitu vaksin aktif dan vaksin inaktif. Vaksin aktif ada dua macam, yaitu bakteri yang patogenisitasnya telah dilemahkan melalui pasase di laboratorium dan yang dilemahkan dengan cara memutasikan sifat virulensinya. Vaksin inaktif juga terdiri dari dua macam yaitu vaksin yang terdiri atas seluruh sel dan yang terdiri atas fragmen sel saja yang sering disebut dengan vaksin sub unit. Hasil vaksinasi sangat bervariasi tergantung dari jenis vaksinnya. Vaksin aktif akan memberikan perlindungan yang lebih lama dibanding vaksin inaktif, tetapi penggunaan vaksin inaktif dalam waktu panjang akan lebih aman dibanding vaksin aktif (Soeripto 2002).
Secara teknis vaksin harus memenuhi kriteria dapat memberikan perlindungan semaksimal mungkin terhadap ternak yang divaksin dan terhadap fetus melalui maternal immunity, tidak menimbulkan sakit jika diaplikasikan dan cara pemberiannya tidak berulang-ulang agar dapat menghemat waktu, tenaga dan biaya, serta tidak menimbulkan stres berulang pada ternak (Soeripto 2002).
Pencegahan dan pengendalian penyakit melalui vaksinasi akan memberikan dampak yang lebih baik daripada dengan kemoterapi, karena tidak akan meninggalkan residu antibakteri pada produk ternak dan tidak menyebabkan resistensi bakteri (Soeripto 2002). Saat ini vaksin E. coli dengan isolat bakteri lokal merupakan salah satu vaksin inaktif yang sudah beredar dan tersedia di Indonesia untuk pencegahan kolibasilosis pada ternak sapi, babi, dan unggas (Dirkeswan 2000).
7
Sapi Friesian Holstein (FH)
Taksonomi sapi perah sebagai hewan domestik dalam Dale et al. (1984) adalah sebagai berikut:
kingdom : Animalia filum : Chordata kelas : Mamalia ordo : Artiodactyla subordo : Ruminansia famili : Bovidae genus : Bos
spesies : Bos taurus
Ternak sapi perah sangat penting secara ekonomis sebagai sumber daya penghasil susu. Sapi perah yang dipelihara di Indonesia pada umumnya adalah jenis Friesian Holstein (FH) atau dikenal juga dengan nama Fries Holland. Sapi FH termasuk keturunan dari Bos taurus dan merupakan bangsa sapi asli eropa yang berasal dari provinsi Friesland di Belanda. Sapi ini memiliki karakteristik fisik warna rambut yang khas yaitu warna belang hitam putih. Selain itu jenis sapi FH sangat terkenal dengan kemampuannya berproduksi susu paling tinggi di dunia (Siregar 1995). Menurut USDA (2004), kemampuan produksi sapi FH dapat mencapai 23.382 pon atau 10606 Kg susu tiap laktasi dengan kadar lemak 3,7%.
Gambar 2 Induk sapi perah betina jenis Friesian Holstein. (Sumber: Britannica 2008)
8
Sapi memiliki konsentrasi IgG 88% atau 25 mg/ml dari total imunoglobulin di dalam serum (Larson 1992 dalam Barrington et al. 2001). Induk sapi bunting yang terpapar oleh antigen dan vaksinasi akan mengakibatkan diproduksinya molekul antibodi (IgG) yang akan ditransfer dari darah induk menuju kolostrum di kelenjar ambing (Butler 1983). Menurut Brandon et al. (1971), transfer IgG pada sapi dimulai beberapa minggu sebelum partus dan berhenti tiba-tiba segera sebelum partus. Pada periode ini, IgG ditransfer ke dalam sekresi kelenjar ambing hingga mencapai 500 g/minggu.
Pemindahan kekebalan pasif dari induk sapi kepada anaknya melalui kolostrum yang mengandung IgG diperlukan untuk perlindungan hewan baru lahir terhadap penyakit septisemik. Bila terjadi kegagalan pemindahan imunoglobulin, maka anak sapi akan memiliki kadar imunoglobulin yang rendah atau tidak cukup dalam serumnya sehingga mempunyai resiko yang besar untuk mendapat koliseptisemi, pneumoni, dan infeksi lainnya (Tizard 2000).
Sapi jarang digunakan di lembaga penelitian sebagai hewan coba. Beberapa keterbatasan penggunaan hewan ini adalah ukuran hewan yang besar serta biaya pemeliharaan, perawatan, dan penyediaan fasilitas yang mahal. Penggunaan untuk penelitian harus memperhatikan pemeliharaan sesuai dengan kondisi umum yang berlaku untuk studi sapi(Smith & Mangkoewidjojo 1988).
Tabel 1. Data biologis sapi.
Lama bunting : 280 hari (275-283 hari)
Berat dewasa : 300-680 Kg betina, 350-1000 Kg jantan Berat lahir : 22-50 Kg
Jumlah anak : 1, kadang-kadang 2
Suhu (rektal) : 38.0 oC - 39.0 oC (rata-rata 38.6 oC ) Pernapasan : 27-40/menit
Denyut jantung : 40-58/menit
Tekanan darah : 121-166 sistol; 18-120 diastol Konsumsi energi : kira-kira 15 kal/Kg/hari
Imunitas pasif : hanya melalui usus, dari kolostrum
9
Teknik Enzyme-linked Immunosorbent Assay (ELISA)
Enzyme-linked Immunosorbent Assay (ELISA) pertama kali diperkenalkan oleh Engvall dan Perlmann pada tahun 1971 (Kreier & Mortensen 1990). Prinsip ELISA adalah mengukur langsung interaksi antara antigen dan antibodi sehingga termasuk dalam uji pengikatan primer (Tizard 2000). Pada ELISA, ligan mengikat antibodi atau antigen yang akan dideteksi oleh antibodi yang telah dikonjugasi dengan enzim. Enzim akan menginduksi perubahan warna dari substratnya dan kemudian diukur oleh spektrofotometer (reader) secara otomatis. Substrat yang digunakan harus dipilih yang cocok dengan enzim yang digunakan untuk mengkonjugasi. Kromogen yang terdapat dalam substrat merupakan indikator warna terjadinya reaksi enzim dengan substrat. Tingkat perubahan warna sebagai indikator reaksi enzim dengan substrat tersebut merupakan penanda konsentrasi antigen/antibodi yang diukur (Murtini 2004).
Sejak diperkenalkan pada tahun 1971, ELISA telah mengalami banyak perkembangan. ELISA merupakan salah satu uji serologis yang saat ini banyak dimanfaatkan untuk berbagai tujuan. Dalam diagnosis penyakit infeksi, ELISA dapat digunakan untuk mendeteksi adanya antigen (bakteri, virus, parasit atau jamur) atau antibodi. Demikian pula pada penyakit non infeksi, ELISA dapat digunakan untuk evaluasi program vaksinasi, memonitor hormon, obat-obatan, antibiotika, toksin, pestisida, komponen serum, protein onkofetal, sitokin ataupun penyakit-penyakit autoimun (Suwarno 2003).
Beberapa kelebihan ELISA adalah sangat sensitif dan tidak berbahaya sebab tidak menggunakan bahan radioaktif. Teknik ELISA telah dikembangkan dengan menggunakan berbagai macam antigen yang mempunyai sensitivitas dan spesifisitas yang berbeda. ELISA dapat digunakan untuk membantu menetapkan diagnosis secara cepat. Teknik ini sangat baik untuk menguji sampel dalam jumlah besar sehingga lebih murah. Penggunaan ELISA yang tepat akan menghasilkan pengujian yang sensitif, spesifik, prediktif, dan praktis untuk sampel yang banyak. Keandalan pengujian tersebut sangat baik untuk penelitian epidemiologi (Suwarno 2003).
10
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan April 2007 sampai dengan bulan Juli 2008. Tempat penelitian di kandang Ruminansia Besar dan Laboratorium Terpadu,Departemen Ilmu Penyakit Hewan dan Kesmavet, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Hewan Percobaan
Hewan percobaan yang digunakan adalah empat ekor induk sapi perah jenis Friesian Holstein (FH) lokal dari daerah Boyolali yang sedang dalam masa kering kandang (umur kebuntingan lebih dari enam bulan).
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah: imunomodulator (Inmunair® 17.5, Calier), vaksin E.coli polivalen inaktif dari Balai Besar Penelitian Veteriner (BALITVET), antigen E. coli K99 dari BALITVET, Larutan buffer karbonat bikarbonat pH 9,6, Larutan phosphate buffer saline (PBS), Larutan 0,05% phosphate buffer saline Tween-20 (PBST), Larutan PBS Skim 5%, konjugat rabbit anti-bovine IgG peroxidase (Cat. No. A-5295, Sigma Chemical Co.), substrat ABTS (2,2’-azino-di [3-ethyl-benzithiazoline sulfonate]).
Alat-alat yang digunakan adalah: disposable syringe, tabung gelas, lemari pendingin, sentrifus (Kokusan tipe H-26 F), freezer, penangas air, tabung mikro, pipet mikro, cawan polysterene 96 sumuran (Nunc), aluminium foil, inkubator, dan alat pembaca mikro-ELISA.
Metode Penelitian
- Pemeliharaan Hewan Percobaan
Empat ekor induk sapi bunting dipelihara sejak masa kering kandang (umur kebuntingan lebih dari enam bulan) sampai partus. Keempat ekor sapi tersebut digunakan sebagai kelompok sapi background. Dua ekor diantaranya kemudian digunakan sebagai hewan coba yaitu yang diberi vaksin dan tidak diberi vaksin (kontrol). Imunomodulator diberikan kepada keempat ekor sapi secara peroral dengan dosis 1 mg/kg bobot badan setiap hari selama 3 hari
11
sebelum dilakukan vaksinasi. Kemudian dilakukan koleksi sampel darah sebelum vaksinasi dan setiap minggu setelah vaksinasi. Selama percobaan berlangsung, sapi diberi pakan 2 kali sehari pagi dan sore dengan pakan hijauan, konsentrat yang dicampur dengan ampas tahu dan pemberian air secara ad libitum. Semua sapi dipelihara pada kandang individual di Kandang Ruminansia Besar, Fakultas Kedokteran Hewan IPB.
- Vaksinasi
Pada penelitian ini digunakan vaksin E. coli polivalen yang berisi antigen O157 dan O9, 101, enterotoksigenik E. coli K99 & F41 dengan K99 & F41 inaktif yang diemulsikan dalam alhidrogel. Vaksinasi dilakukan terhadap satu ekor induk sapi sebanyak tiga kali vaksinasi yaitu pada 8, 6, dan 4 minggu sebelum induk sapi diperkirakan partus. Vaksinasi diberikan secara intramuskular dengan dosis 5 ml/ekor. Satu ekor sapi lainnya tidak diberi vaksin sebagai hewan kontrol. Sampel darah diambil sebelum vaksinasi dan setiap minggu setelah vaksinasi sampai induk partus.
- Pengambilan dan Penyimpanan Serum
Sampel darah sebanyak 5-6 ml diambil melalui vena jugularis menggunakan disposable syringe lalu dimasukkan dalam tabung gelas tanpa antikoagulan. Sampel darah yang didapat lalu diinkubasi pada suhu 27oC (suhu kamar) selama 30 menit sampai keluar cairan bening (serum). Sampel selanjutnya dimasukkan ke dalam lemari pendingin dengan suhu 4oC. Kemudian
serum dipisahkan melalui sentrifugasi selama 5 menit dengan kecepatan 1500 rpm (Kokusan tipe H-26 F). Serum selanjutnya dimasukkan ke dalam tabung mikro. Sampel serum tersebut kemudian disimpan dalam freezer dengan suhu -20oC sampai analisis dilakukan. Setelah itu serum yang sudah dikoleksi, diinaktivasi dalam penangas air bersuhu 56oC selama 30 menit, lalu didinginkan dan siap digunakan untuk pemeriksaan ELISA. Sebelum diperiksa serum diencerkan 1:200 dalam PBS.
- Pemeriksaan ELISA
Deteksi keberadaan antibodi terhadap E. coli K99 pada sampel serum yang dikoleksi, diuji dengan metode indirect ELISA menurut Supar (1986).
12
Antigen K99 diencerkan dengan larutan buffer karbonat bikarbonat pH 9,6 dengan perbandingan 1:5000. Sumuran-sumuran cawan ELISA kemudian dilapisi dengan antigen tersebut sebanyak 100 µl/sumur (coating) menggunakan pipet mikro. Selanjutnya cawan ditutup dan dibungkus dengan aluminium foil, lalu diinkubasi semalam pada suhu 4oC.
Setelah inkubasi, sumuran-sumuran cawan ELISA dicuci dengan 0,05% PBST sebanyak tiga kali. Kemudian dimasukkan 100 µl PBS Skim 5% ke dalam sumuran-sumuran cawan ELISA (blocking). Cawan dibungkus seperti sebelumnya dan diinkubasi dalam suhu 37oC selama 1 jam. Cawan ELISA
selanjutnya dicuci kembali tiga kali seperti prosedur di atas.
Selanjutnya sumur cawan no.1 dan 2 dari baris A diisi dengan 100 µl PBS sebagai kontrol negatif. Sumuran no.1 dan 2 dari baris B sampai E diisi dengan 100 µl serum sapi yang tidak terpapar E. coli (background) untuk menentukan nilai cut off. Sedangkan sumuran lainnya masing-masing diisi dengan 100 µl serum yang akan diuji. Setiap sampel serum diperiksa dua kali (duplo). Cawan ELISA diinkubasi lagi dalam suhu 37oC selama satu jam lalu dilakukan pencucian seperti di atas.
Sebanyak 100 µl suspensi konjugat rabbit anti-bovine IgG peroxidase konsentrasi 1:10000 dimasukkan ke dalam setiap sumur sebelum diinkubasi pada suhu 37oC selama satu jam. Kemudian cawan ELISA dicuci lagi 3 kali dengan PBST dan sebanyak 100 µl substrat ABTS dimasukkan ke dalam setiap sumur. Cawan ELISA kemudian diinkubasikan dalam ruangan gelap pada suhu 37oC selama 30 menit sampai ada perubahan warna. Hasil reaksi diukur dengan alat pembaca ELISA pada panjang gelombang 405 nm berupa angka pembacaan kerapatan optik (optical density) dalam bentuk nilai absorbansi.
- Analisis Hasil ELISA
Nilai absorbansi dari optical density akan sesuai dengan konsentrasi antibodi dalam sampel. Untuk menentukan nilai ELISA serum yang diuji dipakai cara berikut: nilai absorbansi serum yang diuji dikurangi nilai absorbansi rata-rata PBS.
Tabel 2 Rumus perhitungan nilai absorbansi.
13
Analisis hasil diamati secara metode deskriptif dengan menggunakan tabel dan grafik yang menyajikan nilai absorbansi sesungguhnya dari setiap sampel serum yang diperiksa maupun nilai rataannya.
14
HASIL DAN PEMBAHASAN
Keberadaan antibodi sebagai respon vaksinasi dapat dideteksi dengan pengujian ELISA yang diekspresikan dalam nilai absorbansi. Nilai absorbansi yang diperoleh merupakan nilai kuantitas dan sebanding dengan konsentrasi antibodi yang terdapat di dalam serum.
Gambar 3 Hasil ELISA. Warna biru yang semakin tua menandakan nilai absorbansi yang semakin besar.
Hasil uji ELISA terhadap PBS dan background menunjukan bahwa nilai rata-rata absorbansi PBS sebagai background negatif cukup rendah yaitu 0,066. Pengujian PBS merupakan blanko yang digunakan untuk mengurangi semua absorbansi yang diperoleh.
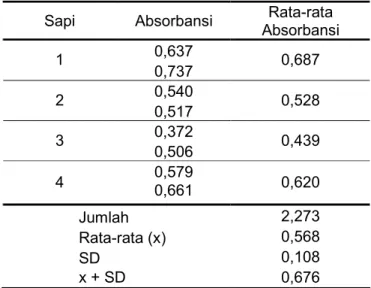
Nilai cut off ELISA sebagai titik batas nilai negatif dan positif adanya antibodi anti-E. coli K99 ditentukan dengan cara menghitung nilai rata-rata absorbansi yang diperoleh dari sampel keempat sapi normal (kelompok background). Standar deviasi ditambahkan pada penghitungan nilai rata-rata tersebut untuk menentukan nilai positif. Pada Tabel 3 dapat dilihat nilai absorbansi kelompok sapi background.
Dari jumlah nilai rata-rata sebesar 0,568 dengan standar deviasi 0,108 pada kelompok sapi background (Tabel 3) diperoleh nilai cut off sebesar 0,676. Interpretasi positif adanya antibodi anti-E. coli K99 ditentukan bila nilai absorbansi > 0,676 dan negatif apabila nilai absorbansi < 0,676.
15
Tabel 3 Nilai absorbansi kelompok sapi background
Sapi Absorbansi Rata-rata Absorbansi 0,637 1 0,737 0,687 0,540 2 0,517 0,528 0,372 3 0,506 0,439 0,579 4 0,661 0,620 Jumlah 2,273 Rata-rata (x) 0,568 SD 0,108 x + SD 0,676
Hasil pemeriksaan ELISA terhadap serum yang duji dapat dilihat pada tabel berikut.
Tabel 4 Hasil ELISA serum sapi
Sapi Kontrol Sapi yang divaksin Minggu ke-
Absorbansi Interpretasi Absorbansi Interpretasi
0# 0,295 _ 0,625 * _ 1 0,204 _ 0,846 + 2 0,297 _ 0,967 ** + 3 0,171 _ 1,022 + 4 0,382 _ 0,857 *** + 5 0,406 _ 0,780 + 6 0,305 _ 0,610 _ 7 0,583 _ 0,593 _ 8 0,506P _ 0,546 _ 9 0,599 P _ #
Minggu sebelum vaksinasi, P
partus,
* vaksinasi pertama, ** vaksinasi kedua, *** vaksinasi ketiga,
- : negatif jika nilai absorbansi < 0,676, + : positif jika nilai absorbansi > 0,676.
Waktu partus antara induk sapi kontrol dengan induk sapi yang divaksin berbeda dengan selisih waktu 5 hari. Induk sapi kontrol lebih dahulu partus yaitu pada 8 minggu 1 hari setelah vaksinasi pertama. Sedangkan induk sapi yang divaksin partus pada 8 minggu 6 hari setelah vaksinasi pertama. Perbandingan
16
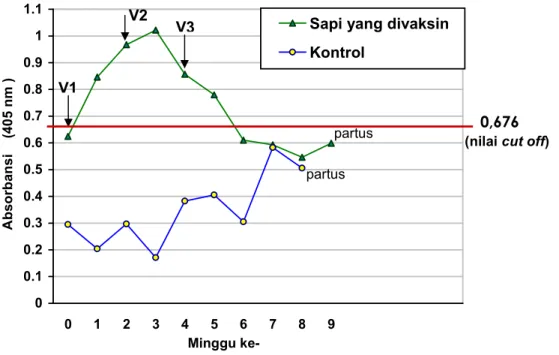
respon antibodi antara sapi perlakuan yang diberi vaksin E. coli dengan sapi kontrol yang tidak divaksin ditunjukkan pada Gambar 4.
Gambar 4 Respon antibodi (IgG) terhadap E. coli K99 dalam serum sapi yang dideteksi dengan ELISA
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 1.1 0 1 2 3 4 5 6 7 8 9 Minggu ke-A b s o rb a n s i ( 4 0 5 n m )
Sapi yang divaksin Kontrol
Gambar 4 menunjukkan bahwa sapi yang diberi vaksin E. coli memberikan respon yang baik terhadap vaksinasi. Reaksi positif pembentukan antibodi anti-E. coli K99 mulai terdeteksi pada minggu ke-1 yaitu satu minggu setelah pemberian vaksin yang pertama. Hasil positif adanya antibodi tetap terlihat pada minggu berikutnya yaitu minggu ke-2, 3, 4, dan 5. Gambaran grafik menunjukan adanya kenaikan nilai absorbansi yang terus meningkat dari minggu ke-0 (absorbansi=0,625) dan mencapai puncaknya pada minggu ke-3 (absorbansi=1,022) yaitu seminggu setelah pemberian vaksinasi kedua. Nilai absorbansi kemudian menjadi turun pada minggu ke-4 (absorbansi=0,857) dan minggu-minggu berikutnya sampai saat partus.
Sapi kontrol yang tidak diberikan vaksinasi E. coli memperlihatkan gambaran negatif terdapatnya antibodi anti-E. coli K99. Hal ini terlihat dari nilai absorbansi sapi kontrol pra dan pasca vaksinasi berkisar pada nilai yang rendah dibandingkan sapi yang divaksinasi dan berada di bawah nilai cut off.
V1 V2 V3 0,676 partus partus
17
Vaksin adalah bahan antigenik yang digunakan untuk menghasilkan kekebalan aktif terhadap suatu penyakit sehingga dapat mencegah atau mengurangi pengaruh infeksi oleh mikroorganisme patogen. Pada sapi yang divaksin, penyuntikan vaksin E. coli polivalen yang mengandung antigen O157 dan O9, 101 dan enterotoksigenik E. coli K99 & F41, akan menstimulasi sejumlah limfosit yang spesifik terhadap masing-masing antigen determinan dari molekul tersebut. Vaksin yang berisi antigen ini digunakan untuk menggertak antibodi spesifik anti-E. coli K99 sebagai respon humoral.
Sel-sel limfosit dalam sistem imun yang bereaksi spesifik dengan antigen mikroba diantaranya yaitu limfosit B. Sel limfosit B mengidentifikasi antigen ketika antibodi permukaan melekat pada antigen asing. Kemudian pengeluaran sitokin atau interleukin oleh sel T helper yang berinteraksi dengan Major Histocompatibility Complex (MHC) II akan menginduksi sel B. Sel B yang aktif lalu akan berproliferasi serta berdiferensiasi menjadi sel B memori dan sel plasma dewasa yang menghasilkan antibodi (Kresno 2001; Kuby 2004).
Bila pemaparan antigen terjadi untuk kedua kalinya (booster), maka terjadilah respon imun sekunder yang melibatkan peranan sel B memori. Sel B memori ini akan segera mengingat dan membelah dengan cepat serta menghasilkan antibodi dalam kadar yang tinggi pada saat terinduksi kembali oleh antigen yang sama yang pernah masuk sebelumnya pada respon primer (Tizard 2000). Dengan fase lag yang pendek kadar imunoglobulin G (IgG) akan meningkat pesat dan lebih tinggi dibandingkan dengan imunoglobulin M (IgM) serta berlangsung lebih lama (Kresno 2001). Hal ini terlihat setelah sapi menerima vaksinasi yang kedua, hewan tersebut membentuk level antibodi sirkulasi (IgG) yang tinggi. Molekul IgG disintesa pada bagian akhir dari respon imun primer dan merupakan antibodi utama yang disintesa selama respon imun sekunder (Kuby 2004). Konsentrasi antibodi yang dihasilkan oleh hewan yang divaksin akan menurun secara perlahan sehingga untuk mempertahankan level antibodi dalam darah tetap tinggi diperlukan vaksinasi ulang atau yang dikenal dengan istilah booster. Menurut Smith (1995), injeksi booster selalu dibutuhkan untuk mendapatkan serum dengan titer antibodi paling tinggi.
Respon antibodi yang dapat dilihat pada uji ELISA menunjukkan kenaikan angka absorbansi dari sebelum vaksinasi, vaksinasi ke-1 dan vaksinasi ke-2. Sedangkan vaksinasi ulangan ke-3 tidak dapat lagi meningkatkan titer antibodi. Hal ini ditunjukkan dengan menurunnya nilai absorbansi hingga saat partus.
18
Penurunan titer tersebut dapat terjadi karena pada minggu ke-4 post vaksinasi sudah mulai terjadi proses perpindahan antibodi dari serum ke dalam kolostrum. Adanya transpor selektif antibodi ke dalam kolostrum akan mengurangi konsentrasi antibodi yang terdapat dalam serum. Molekul IgG yang terdiri dari subkelas IgG1, IgG2, IgG3, dan IgG4 akan ditranspor melalui plasenta dan menyediakan imunitas humoral pasif bagi bayi manusia yang baru lahir (Kreier dan Mortensen 1990). Pada sapi yang memiliki tipe plasenta eptheliochorial atau syndesmochorial, tidak terjadi transfer antibodi maternal secara transplasental (Outteridge 1985; Tizard 2000; Toelihere 2006). Transfer antibodi dari induk sapi terjadi secara transmammary yaitu antibodi akan diangkut menuju kelenjar mamari dan disekresikan dalam kolostrum sebelum partus melalui mekanisme transpor khusus (Barrington et al. 2001). Menurut Tizard (2000), transfer imunoglobulin dari aliran darah induk mamalia ke dalam kolostrum yang terjadi pada beberapa minggu terakhir masa kebuntingan dipengaruhi oleh hormon estrogen dan progesteron. Smith et al. (1971) melaporkan bahwa pengaruh estrogen dan progesteron terhadap transfer imunoglobulin dimulai pada 4-6 minggu terakhir masa kebuntingan.
Respon humoral terhadap E. coli K99 menghasilkan antibodi yang akan menetralisir enterotoksin dari bakteri dan mencegah penempelan organisme tersebut pada permukaan mukosa. Konsentrasi antibodi yang terbentuk dipengaruhi oleh sifat dan lamanya antigen berada dalam tubuh (Tizard 2000). Smith (1995) melaporkan bahwa faktor-faktor yang berpengaruh dalam pembentukan antibodi adalah imunogenisitas, pemberian adjuvan, spesies hewan, rute aplikasi, dan dosis. Konsentrasi antibodi dalam serum induk sapi juga dipengaruhi oleh umur induk. Induk sapi yang lebih tua umurnya (laktasi ke-5 atau lebih) mempunyai konsentrasi antibodi (IgG1) yang lebih tinggi dibandingkan sapi yang masih muda (Oyeniyi et al. 1978). Pada sapi kontrol yang tidak dilakukan penyuntikan vaksin E. coli tidak menyebabkan terbentuknya antibodi terhadap E. coli K99. Hal ini membuktikan bahwa tanpa adanya introduksi antigen tidak akan terjadi pembentukan antibodi dalam tubuh.
Dalam upaya pengendalian penyakit diare neonatal yang disebabkan oleh ETEC, pengobatan dini terhadap penyakit ini sangat penting. Salah satu bentuk pengendalian adalah pemberian imunisasi pasif pada anak sapi melalui kolostrum induk sapi. Hal itu dapat terwujud bila tersedia antibodi yang spesifik terhadap faktor-faktor virulensi yang dimiliki ETEC. Pada penelitian ini vaksin
19
E. coli polivalen yang berisi antigen enterotoksigenik E. coli K99 & F41 inaktif dapat menginduksi terbentuknya respon antibodi anti-E. coli K99 dalam serum. Terdapatnya antibodi dalam serum dengan jumlah yang tinggi dapat menjadi sumber antibodi maternal yang diperlukan dalam pembentukan kolostrum pada masa akhir kebuntingan (Butler 1983). Dalam Snodgrass et al. (1982), pemeriksaan antibodi terhadap antigen E. coli K99 dalam serum dan kolostrum menunjukan peningkatan yang signifikan pada kelompok induk sapi yang diinjeksi vaksin kombinasi ETEC K99 dengan rotavirus. Anak babi yang diberikan kolostrum sapi yang mengandung antibodi anti-ETEC terbukti tahan terhadap infeksi E. coli karena antibodi kolostrum tesebut dapat mencegah perlekatan (adhesi) bakteri pada intestin (Ohashi 1994; Barman 2001).
Penggunaan ELISA sangat sensitif dan efisien untuk mengukur tanggap kebal humoral setelah vaksinasi. Hasil uji ELISA menunjukan bahwa vaksin menimbulkan respon yang baik. Vaksin E. coli yang digunakan mampu menginduksi respon kekebalan humoral yang dapat dibedakan dengan nyata pada sapi yang divaksin dibanding kontrol. Namun demikian, belum dapat dipastikan terdapatnya antibodi anti-E. coli K99 di dalam serum juga disertai dengan adanya antibodi spesifik tersebut di dalam kolostrum yang akan bersifat protektif terhadap infeksi E. coli K99. Data yang diperoleh dari penelitian ini dapat menjadi tambahan bukti mengenai kemampuan vaksin E. coli polivalen dalam menginduksi respon kebal terhadap E. coli K99.
20
SIMPULAN DAN SARAN
Simpulan
Dari hasil pengujian ELISA dapat disimpulkan bahwa antibodi spesifik terhadap E. coli K99 pada induk sapi bunting dapat diinduksi dengan pemberian vaksin E. coli polivalen inaktif sebanyak tiga kali pada 8, 6, dan 4 minggu sebelum induk sapi diperkirakan partus. Antibodi terhadap E. coli K99 dapat terdeteksi pada satu minggu setelah vaksinasi pertama dan bertahan di dalam darah sampai dengan 5 minggu setelah vaksinasi pertama.
Saran
- Melalui vaksinasi induk sapi bunting diharapkan terjadi transfer antibodi maternal melalui kolostrum kepada anak sapi, sehingga perlu dilakukan penelitian tentang deteksi antibodi (IgG) anti-E. coli K99 di dalam kolostrum.
- Penggunaan hewan coba yang lebih banyak akan lebih baik dalam pengamatan respon vaksinasi untuk meminimalisasi adanya variasi individu yang mempengaruhi respon kebal yang terbentuk.
21
DAFTAR PUSTAKA
Andriani. 2005. Escherichia coli O157 H:7 sebagai Penyebab Penyakit Zoonosis. Di dalam: Iip Priadi dan Muladi, editor. Prosiding Lokakarya Nasional Penyakit Zoonosis; Bogor, 15 September 2005. Bogor: Pusat Penelitian dan Pengembangan Peternakan. Hlm 173-177.
Barrington GM, McFadden TB, Huyler MT, Besser TE. 2001. Regulation of colostrogenesis in cattle. Livestock Prod Sci 70:95-04.
http://www.elsevier.com/locate/livprodsci [19 Jun 2008].
Barman NN, Sarma DK, Neog BN. 2001. Elimination of enterotoxigenic Escherichia coli in experimentally infected piglets by passive immunization with bovine colostral antibodies. Vet Arski Arhiv 71:381-387.
Brandon MR, Watson DL, Lascelles AK. 1971. The mechanism of transfer of immunoglobulin into mammary secretion of cows. Aust J Exp Biol Med Sci 49:613.
Britannica. 2008. Friesian Holstein. www.britannica.com/ebc/art-10565/Holstein/Fri.html [20 Mei 2008].
Butler JE. 1983. Bovine immunoglobulins: an augmented review. Vet Immunol Immunopathol 4:43-152.
Carter GR, Wise DJ. 2004. Essential of Veterinary Bacteriology and Mycology. Ed ke-6. Iowa: Blackwell Publishing.
Cox E, Houvenaghel A. 1993. Comparison of the in vitro adhesion of K88, K99, F41 and P987 positive Escherichia coli to intestinal vili of 4 to 5 week old pigs [abstrak]. Vet Microbiol 34:7-18.
http://www.ncbi.nlm.nih.gov/pubmed/8447080.htm [30 Jul 2008].
Dale LB, Tillman PC, Niemi SM. 1984. Ungulates as Laboratory Animals. Di dalam: Fox JG, Cohen BJ, Loew FM, editor. Laboratory Animal Medicine. California: Academic Pr.
[Dirkeswan] Direktorat Kesehatan Hewan. 2000. Indeks Obat Hewan Indonesia. Jakarta: Dirkeswan, Dirjen Peternakan, ASOHI.
Gross WB, HJ Barnes. 1997. Colibacilosis in Diseases of Poultry. Ed ke-10. Calnek et al., editor. USA:Iowa Univ Pr.
Kreier JP, Mortensen RF. 1990. Infection, Resistance, and Immunity. New York: Harper & Row.
Kresno SB. 2001. Imunologi: Diagnostik dan Prosedur Laboratorium. Ed ke-4. Jakarta: Fakultas Kedokteran Universitas Indonesia.
Kuby J. 2004. Immunology. Ed ke-10. New York : WH Freeman.
Larson BL. 1992. Immunoglobulins of The Mammary Secretion. Di dalam: Fox PF, editor. Advances Dairy Chemistry 1: Proteins. Ames: Iowa State Univ Pr.
Murdiati TB, Sendow I. 2006. Zoonosis yang ditularkan melalui pangan. Wartazoa 16:14-20.
22
Murtini S. 2004. Tata Cara Pengambilan, Pengiriman, dan Pemeriksaan Hewan dan Bahan Asal Hewan di Laboratorium. Di dalam: Workshop Penyakit-penyakit Eksotik dan Penyaki-Penyakit-penyakit Penting pada Hewan Bagi Petugas Dokter Hewan; Bogor, 12-15 Januari 2004. Bogor: FKH IPB dan Badan Karantina Deptan.
Ohashi S. 1994. Studies on bovine enterotoxigenic Escherichia coli bacterins containing K99 antigens. Tohoku J Vet Clin. 17:65-75.
Orskov I, Orskov F. 1983. Serology of Escherichia coli fimbrae [abstrak]. Prog Allergy 33: 80-105.http://www.ncbi.nlm.nih.gov/pubmed/8447080.htm [30 Jul 2008].
Outteridge PM. 1985. Veterinary Immunology. Sydney: Academic Pr.
Oyeniyi O, Hunter AG. 1978. Colostral constituens including immunoglobulins in the first three milking postpartum. J Dairy Sci 61:44-48.
Seddon HR. 1967. Diseases of domestic animals in Australia Part 5. Bacterial Diseases. Sydney: Service Publications (Vet. Hygiene). Hlm. 48-54. Shakespeare M. 2002. Zoonoses. USA: Pharmaceutical Pr.
Siregar S. 1995. Sapi perah, jenis, teknik dan pemeliharaan, dan analisa usaha. Jakarta: Penebar Swadaya.
Smith KL, Muir LA, Ferguson LC, Conrad HR. 1971. Selective transport of IgG1 into the mammary gland: Role of estrogen and progesterons. Symposium: Bovine Immune System. J Dairy Sci 54:1886-1894.
Smith JB, Mangkoewidjojo S. 1988. Pemeliharaan, Pembiakan, dan Penggunaan Hewan Percobaan di Daerah Tropis. Jakarta: UI Pr.
Smith JR. 1995. Produksi Serum Hiperimun. Di dalam: Artama WT, penerjemah; Burgess GW, editor. Teknologi ELISA dalam Diagnosis dan Penelitian. Yogyakarta: Gadjah Mada Univ Pr. Hlm 15-32.
Snodgrass DR, Nagy LK, Sherwood D, Campbell I. 1982. Passive immunity in calf diarrhea: Vaccination with K99 antigen of enterotoxigenic Escherichia coli and rotavirus. Infect Immun 37:586-591. http://iai.asm.org [1 Jul 2008].
Soeripto. 2002. Pendekatan Konsep Kesehatan Hewan Melalui Vaksinasi. Jurnal Litbang Pertanian 21:48-55.
Source Molecular. 2008. Escherichia coli. www.source molecular.com/pig.htm [21 Jun 2008].
Spencer TL. 1995. ELISA dan Serologi Bakteri. Di dalam: Artama WT, penerjemah; Burgess GW, editor. Teknologi ELISA dalam Diagnosis dan Penelitian. Yogyakarta: Gadjah Mada Univ Pr. Hlm 15-32.
Supar. 1986. Penggunaan Metode Enzyme-linked Immunosorbent Assay (ELISA) untuk deteksi antigen pili K99, K88 pada Escherichia coli dari Anak Sapi dan Anak Babi Diare. Penyakit Hewan 17:159-168.
Supar. Hirst RG, Patten BE. 1990. Antimicrobial drug resistance in enterotoxigenic Escherichia coli K88, K99, F41 and 987P isolated from piglets in Indonesia. Penyakit Hewan 22:13-19.
23
Supar, Arifin Z, Kurniasih N, Djaenuri, Ramli G. 1993. Studi Epidemiologi dan Dampak Ekonomi Kolibasilosis pada Sapi Perah. Laporan Penelitian Tahun Anggaran 1992/1993. Balai Penelitian Veteriner.
Supar. 1996. Studi kolibasilosis pada anak sapi perah dan deteksi Escherichia coli K99, F41 dan K99F41. Di dalam: Prosiding Temu Ilmiah Nasional Bidang Veteriner. Maret 1996. Hlm 148-155.
Supar, Kusmiyati, Poerwadikarta MB. 1998. Aplikasi Vaksin Enterotoksigenik Escherichia coli (ETEC) K99, F41 Polivalen pada Induk Sapi Perah Bunting dalam Upaya Pengendalian Kolibasilosis dan Kematian Pedet Neonatal. JITV 3:27-33.
Supar. 2001. Pemberdayaan Plasma Nutfah Mikroba Veteriner dalam pengembangan Peternakan: Harapan Vaksin Escherichia coli Enterotoksigenik, Enteropatogenik dan Verotoksigenik Isolat Lokal untuk Pengendalian Kolibasilosis Neonatal pada Anak Babi dan Sapi. Wartazoa 11:36-43.
Suwarno. 2003. Prinsip Dasar, Optimalisasi dan Interpretasi Hasil Uji ELISA. Surabaya: Lab Virologi dan Immunologi FKH Unair.
Syarief MZ, Sumoprastowo RM. 1984. Ternak Perah. Jakarta: CV Yasaguna. Tizard IR. 2000. Veterinery Immunology; an Introduction. Ed ke-6. Pennsylvania:
WB Saunders.
Todar K. 2008. Todar’s Online Texbook of Bacteriology. www.textbookof
bacteriology.net /e.coli.html [ 29 Jul 2008].
Toelihere MR. 2006. Ilmu Kebidanan pada Ternak Sapi dan Kerbau. Jakarta: UI Pr.
Utomo B, Prawirodigdo S, Sarjana, Sudjatmogo. 2006. Performan Pedet Sapi Perah dengan Perlakuan Induk Saat Masa Akhir. Di dalam: Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner 2006. Bogor: Pusat Penelitian dan Pengembangan Peternakan. Hlm 76-81.
[USDA] United States Department of Agriculture. 2004. Animal Improvement Programs Laboratory Means (lbs) for Calculating PTA% for the May 2004 Run. http://www.aipl.arsusda.gov/dynamic/summary/current/yld_mean. htm [21 Mei 2008].
24
25
Lampiran 1 Jadwal pengambilan darah yang digunakan untuk uji ELISA Pengambilan darah Sapi kontrol Sapi yang divaksin
I (Minggu 0) 8 minggu pre partum Pre-vaksinasi II (Minggu ke-1) 7 minggu pre partum Satu minggu pasca
vaksinasi pertama II (Minggu ke-2) 6 minggu pre partum Boosting pertama III (Minggu ke-3) 5 minggu pre partum Satu minggu pasca
vaksinasi kedua IV (Minggu ke-4) 4 minggu pre partum Boosting kedua V (Minggu ke-5) 3 minggu pre partum Satu minggu pasca
vaksinasi ketiga VI (Minggu ke-6) 2 minggu pre partum Dua minggu pasca
vaksinasi ketiga VII (Minggu ke-7) 1 minggu pre partum Tiga minggu pasca
vaksinasi ketiga VIII (Minggu ke-8) partus Empat minggu pasca
vaksinasi ketiga
0 1 2 3 4 5 6 7 8 ... partus minggu
Keterangan:
: Vaksinasi E. coli : Koleksi sampel darah untuk ELISA