MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei-Agustus 2011 di RPH Kota Pekanbaru. Analisis sampel dilakukan di Laboratorium Pasca Panen Fakultas Pertanian dan Peternakan UIN SUSKA Riau, Laboratorium Mikrobiologi dan Laboratorium Kimia UPT Pengujian dan Sertifikasi Mutu Barang Disperindag Provinsi Riau serta Laboratorium PT Saraswanti Indo Genetech-Bogor.
Materi Penelitian
Bahan yang digunakan dalam penelitian ini adalah daging sapi (otot bagian Longissimus dorsi et lumbarum dan Bicef femoris), hati dan ginjal sapi yang dipotong di RPH kota Pekanbaru. Adapun bahan untuk analisis mikrobiologi adalah plate count agar (PCA), buffered pepton water (BPW) 0.1%, brilliant
green lactose bile agar (BGLBB), lauryl sulfate tryptose broth (LSTB), eschericia coli broth (ECB), Levine eosine methylene blue agar (L-EMBA), methyl red-voges proskauer (MR-VP), kalium cyanide broth (KCB), simmons citrate agar (SCA), reagen kovac, reagen voges-proskauer (VP), baird-parker agar (BPA), egg yolk tellurite emultion, brain heart infusion broth (BHIB), triple sugar agar (TSA), coagulase rabbit plasma dengan ethylene diamine tetra acetate (EDTA). Bahan untuk uji residu pestisida antara lain aseton/asetonitril,
heksana, H2SO4dan NHO3.
Alat yang digunakan dalam penelitian ini adalah cawan petri, pipet serologis, tabung reaksi dan penutupnya, tabung durham, gelas ukur, beaker glass,
labu erlenmeyer, botol medium, inkubator, stomacher, colony counter, penangas
air, tube mixer, timbangan, clean banch, gunting, pinset, plastik steril, timbangan, rak tabung, gelas preparat, jarum inokulum diameter 3 mm, mortar, rotary
evaporator, pH-meter, photographic colour standard, carver press,planimeter,
kromatograf gas dan atomic absorbance spechtrofotometry (AAS).
Metode Penelitian Metode Pengambilan Sampel
Pengambilan sampel dilakukan secara acak sederhana (simple random
Kota Pekanbaru. Sebanyak lima pemilik ternak yang melaksanakan pemotongan di RPH diambil sebagai sampel. Masing-masing dari pemilik ternak diambil tiga ekor ternaknya untuk dianalisis keamanan daging meliputi kualitas fisik (pH, warna dan persentase air bebas), cemaran mikroba (TPC, E.coli. Coliform dan
Salmonella), cemaran residu kimia (residu logam berat dan residu pestisida).
Sampel yang digunakan untuk analisis kualitas fisik dan cemaran mikroba pada daging berupa jaringan otot Bicep femoris (BF) dan Longissimus dorsi et
lumbarum (LD), sedangkan sampel yang digunakan untuk analisis residu logam
berat (Pb, Cd dan Hg) dan residu pestisida (golongan organofosfat) adalah otot bagian Bicep femoris (BF), hati dan ginjal. Masing-masing sampel diambil sebanyak 250 gram. Pengambilan sampel dilakukan pada pagi hari sekitar pukul 01.00-06.00 WIB. Sampel yang telah diperoleh harus dibawa ke laboratorium untuk diuji pada hari yang sama. Selama pengambilan sampel daging sapi ditempatkan dalam plastik steril dan dimasukkan kedalam cool box yang telah diberi es batu.
Rancangan Percobaan
Rancangan yang digunakan untuk mengevaluasi penerapan SSOP, GSP, SJH, kualitas fisik, cemaran mikroba, residu logam berat dan residu pestisida adalah secara deskriptif yang bertujuan untuk membuat gambaran secara sistematis serta hubungan yang diselidiki (Nazir 2005). Penentuan jumlah sampel yang diperlukan diambil secara acak dengan cara menghitung sampel berdasarkan rumus (Levy & Lemeshow 1999):
Keterangan :
n = Jumlah sampel yang diperlukan
N = Jumlah pemilik ternak yang dipotong di RPH e = Nilai error sebesar 30%
z = 1,96 dengan a = 0,05
Py = Peluang jawaban 50% karena ada 2 pilihan jawaban, yaitu ya (1) dan tidak (0)
Peubah yang Diukur
Peubah yang diamati pada penelitian ini adalah evaluasi penerapan sanitasi (standard sanitation operational procedure/SSOP), sistem pemotongan (good
slaughtering practices/GSP) dan sistem jaminan halal (SJH) serta penilaian
kualitas fisik daging (warna, persentase air bebas dan pH), uji mikrobiologis (TPC, E. coli, Coliform dan Salmonella), residu logam berat (Pb, Cd dan Hg) dan serta residu pestisida golongan organofosfat.
1. Evaluasi Penilaian SSOP, GSP dan SJH serta penilaian NKV di RPH Kota Pekanbaru
Evaluasi penilain terhadap penerapan SSOP, GSP dan SJH diidentifikasi dengan kuisioner penilaian yang mencakup parameter penilaian pelaksanaan SSOP, GSP dan SJH di RPH yang sebelumnya telah diberi pembobotan berdasarkan titik kritis pada tiap-tiap parameter penilaian.Indikator penilaian terdiri atas dua pilihan yaitu pilihan “ya” dan “tidak”. Penilaian “ya” digunakanuntuk setiap parameter yang terlaksana sesuai prosedur, sedangkan penilaian “tidak” untuk parameter-parameter yang belum atau tidak terlaksana sesuai prosedur. Penilaian SSOP di RPH mengacu pada Peraturan Menteri Pertanian (2010) dan SNI 01-6159-1999, evaluasi GSP mengacu pada SK Menteri Pertanian Nomor 431/Kpts/TN.310/7/1992 tentang syarat dan tata cara penyembelihan ternak serta penanganan daging. Penilaian SJH mengacu pada LPPOM-MUI (2011) tentang pedoman pengelolaan rumah potong hewan halal, sedangkan penilaian NKV mengacu pada Departeman Pertanian (2006) tentang pedoman nomor kontrol veteriner unit usaha pangan asal hewan.
Setiap penilaian nomor kontrol veteriner (NKV) yang diidentifikasi berfungsi untuk mengetahui jumlah penyimpangan, baik penyimpangan minor (MN), mayor (MY), serius (SR), kritis (KT) dan tanpa penyimpangan (OK) dalam menerapkan GSP dan SJH di RPH. Menurut Ditjen PPHP (2009), penyimpangan minor merupakan penyimpangan yang kurang serius dan tidak menyebabkan resiko terhadap kualitas keamanan produk. Penyimpangan mayor merupakan tingkat penyimpangan yang dapat menyebabkan resiko terhadap kualitas keamanan produk, sedangkan penyimpangan serius dapat menyebabkan resiko terhadap kualitas keamanan produk dan segera ditindaklanjuti serta penyimpangan kritis merupakan tingkat penyimpangan yang sangat serius dan dapat menyebabkan resiko terhadap keamanan produk dan harus segera ditindaklanjuti.
2. Penentuan Sifat Fisik Daging Sapi
Warna Daging Sapi (SNI 3932:2008). Warna daging diukur dengan menggunakan standar warna daging berdasarkan SNI 3932:2008. Skor warna daging ditentukan dengan photoghrapic colour standard. Skor warna tersebut memiliki skala angka 1-9 dimana semakin besar skor warna daging dinyatakan semakin gelap. Standar warna daging mulai dari merah muda sampai merah tua (Lampiran 4). Cara mengukur warna daging yaitu dengan mencocokkan warna daging dengan standar warna daging, namun sebelumnya sampel daging disayat terlebih dahulu.
Daya Mengikat Air (Metode Hamm 1975 disitir Soeparno 2005). Penentuan daya mengikat air menggunakan daging sebanyak 0.3 g yang selanjutnya diletakkan di atas kertas saring jenis Whatman 41 dengan diameter 9 cm diantara dua lempeng besi. Sampel kemudian diberi tekanan sebesar 35 kg/cm2 selama 5 menit. Setelah daerah yang tertutup sampel menjadi rata serta luas daerah basah di sekitarnya diukur dan diberi tanda untuk memudahkan pengenalan. Area basah diperoleh dengan mengurangkan area yang tertutup daging dari area total yang meliputi pula area basah pada kertas saring. Luas daerah yang tertutup sampel dihitung dengan planimeter. Daya mengikat air dapat dihitung dengan rumus:
Keterangan:
Area basah : luas penyerapan air pada kertas saring setelah diberi tekanan selama 5 manit.
% H2O : mgH2O x 100%
300
DMA : dikonversikan pada 0.3 g dan kadar air bahan
Nilai pH Daging (AOAC 1995). Pengukuran pH daging menggunakan pH meter dengan cara mengambil daging sebanyak 5g yang dihaluskan dan dimasukkan kedalam beaker glass yang selanjutnya diencerkan dengan aquades sebanyak 50 ml, kemudian dihomogenkan selama satu menit. Sebelum pH daging diukur, pH meter terlebih dahulu dikalibrasi dengan buffer pH 4 dan buffer pH 7. Setelah dikalibrasi pengukuran derajat keasaman daging dilakukan dengan menempatkan elektroda pada sampel sehingga nilai pH dapat tertera pada layar.
H2O = Area Basah (cm2)_
3. Penentuan Cemaran Mikroba pada Daging
Penghitungan Total Plate Count (TPC) (SNI 2897:2008). Penghitungan TPC menggunakan metode cawan tuang (pour plate). Sampel daging ditimbang sebanyak 25 g, kemudian dimasukkan kedalam plastik steril yang telah berisi 225 ml larutan BPW 0.1% steril, kemudian dihomogenkan dengan stomacher selama 1–2 menit. Larutan yang terbentuk merupakan pengenceran 10-1. Suspensi 10-1 sebanyak1 ml dipindahkan ke dalam 9 ml larutan BPW dengan pipet steril untuk mendapatkan pengenceran 10-2. Selanjutnya buat pengenceran 10-3, 10-4, 10-5 dan seterusnya dengan cara yang sama.
Selanjutnya dimasukkan 1 ml suspensi dari setiap pengenceran ke dalam cawan petri secara duplo. Cawan petri ditambah 15-20 ml PCA yang sudah didinginkan hingga temperatur 45°C ± 1°C pada masing-masing cawan yang sudah berisi suspensi. Supaya larutan contoh dan media PCA tercampur seluruhnya, maka dilakukan homogenisasi dengan memutar cawan membentuk angka delapan dan didiamkan sampai menjadi padat. Selanjutnya diinkubasi pada temperatur 34-36 °C selama 24-48 jam dengan posisi cawan petri terbalik. Penghitungan jumlah koloni dilakukan pada setiap pengenceran kecuali pada cawan petri yang berisi koloni menyebar (spreader colonies) dengan cara memilih cawan yang berisi jumlah koloni 25 sampai 250 koloni yang tumbuh di media dihitung sebagai sebagai total mikroba.
Uji Coliform (SNI 2897:2008). Prinsip penghitungan jumlah Coliform adalah berdasarkan metode most probable number (MPN) yang terdiri atas uji presumtif (penduga) dan uji konfirmasi (peneguhan) menggunakan media cair dalam tabung reaksi dan dilakukan berdasarkan jumlah tabung positif. Pengamatan tabung positif dapat dilihat dengan timbulnya gas di dalam tabung
durham.
Pengujian diawali dengan penyiapan sampel sebanyak 25 gsecara aseptik kemudian dimasukkan kedalam plastik steril yang telah berisi 225 ml larutan BPW 0.1% steril, lalu dihomogenkan dengan stomacher selama 1-2 menit. Larutan yang terbentuk merupakan pengenceran 10-1. Uji pendugaan dilakukan dengan pemindahan 1 ml larutan pengencer 10-1 tersebut dengan pipet steril
kedalam larutan 9 ml larutan BPW 1% untuk mendapatkan pengenceran 10-2. Selanjutnya dengan cara yang sama dibuat pengenceran 10-3. Pipet masing-masing 1 ml dari setiap pengenceran ke dalam 3 seri tabung LSTB yang berisi tabung
durham. Selanjutnya diinkubasi pada temperatur 35 °C selama 24-48 jam. Diperhatikan adanya gas yang terbentuk di dalam tabung durham. Hasil uji dinyatakan positif apabila terbentuk gas.
Uji peneguhan harus selalu disertai dengan menggunakan kontrol positif. Pengujian dilakukan dengan memindahkan biakan positif dari hasil uji pendugaan positif dengan menggunakan jarum inokulasi dari setiap tabung LSTB ke dalam tabung ECB yang berisi tabung durham. Selanjutnya ECB diinkubasikan pada temperatur 45.5 °C selama 24±2 jam dan bila hasilnya negatif diinkubasikan kembali selama 48±2 jam. Perhatikan adanya gas yang terbentuk di dalam tabung durham. Hasil uji dinyatakan positif apabila terbentuk gas. Selanjutnya gunakan tabel most probable number (MPN) untuk menentukan nilai MPN berdasarkan jumlah tabung BGLBB yang positif sebagai jumlah Coliform per mililiter atau per gram.
Uji Salmonella sp (SNI 2897:2008). Pengujian jumlah Salmonella sp mengunakan media selektif melalui empat tahapan yaitu pra pengayaan
(pre-enrichment), pengayaan (enrichment) kemudian dilanjutkan dengan uji seleksi
dan uji biokimia. Tahap pra-pengayaan dilakukan dengan mempersiapkan sampel daging ditimbang sebanyak 25 g kemudian dimasukkan kedalam wadah steril yang telah berisi 225 ml larutan LB steril, kemudian dihomogenkan dengan stomacher selama 1-2 menit. Suspensi dipindahkan ke dalam labu erlenmeyer atau wadah steril kemudian diinkubasi pada suhu 35 °C selama 24±2 jam.
Tahapan uji pengayaan dengan cara mengaduk perlahan biakan pra-pengayaan, kemudian diambil dan dipindahkan masing-masing 1 ml ke dalam media 10 ml TTB, 10 ml RV dan 10 ml SCB. Medium TTB, RV dan SCB diinkubasikan pada temperatur 35 °C selama 24±2 jam. Tahap seleksi dilakukan melalui pengambilan 1 ose dari masing-masing media pengayaan dan diinokulasikan pada media HE, XLD dan BSA, kemudian diinkubasikan pada temperatur 35 °C selama 24±2 jam. Media BSA yang belum jelas dapat diinkubasi lagi selama 24±2 jam. Koloni Salmonella diamati pada media HE yang terlihat
berwarna hijau kebiruan dengan atau tanpa titik hitam (H2S). pada media XLD
koloni terlihat merah muda dengan atau tanpa titik megkilat atau terlihat hampir seluruh koloni hitam, sedangkan pada media BSA koloni terlihat keabu-abuan atau kehitaman, kadang metalik, media disekitar koloni berwarna coklat dan semakin lama waktu inkubasi akan berubah menjadi hitam.
Tahapan selanjutnya dilakukan identifikasi dengan pengambilan koloni dengan menduga dari ketiga media tersebut. Inokulasi dilakukan dengan media agar miring TSIA dan LIA dengan cara menusuk kedasar media agar, selanjutnya digores pada masing-masing media agar miring. Inkubasi dilakukan pada pada temperatur 35 °C selama 24±2 jam. Pengamatan koloni spesifik Salmonella dengan hasil reaksi seperti tercantum pada Tabel 7.
Tabel 7 Hasil uji Salmonella sp pada TSA dan LIA Media Agar miring
(Slant) Dasar Agar (Bottom) H2S Gas TSIA Alkalin/K (merah) Asam/ A (kuning) Positif (hitam) Negatif/ positif LIA Alkalin/K (ungu) Alkalin/K
(ungu)
Positif (hitam)
Negatif/ positif
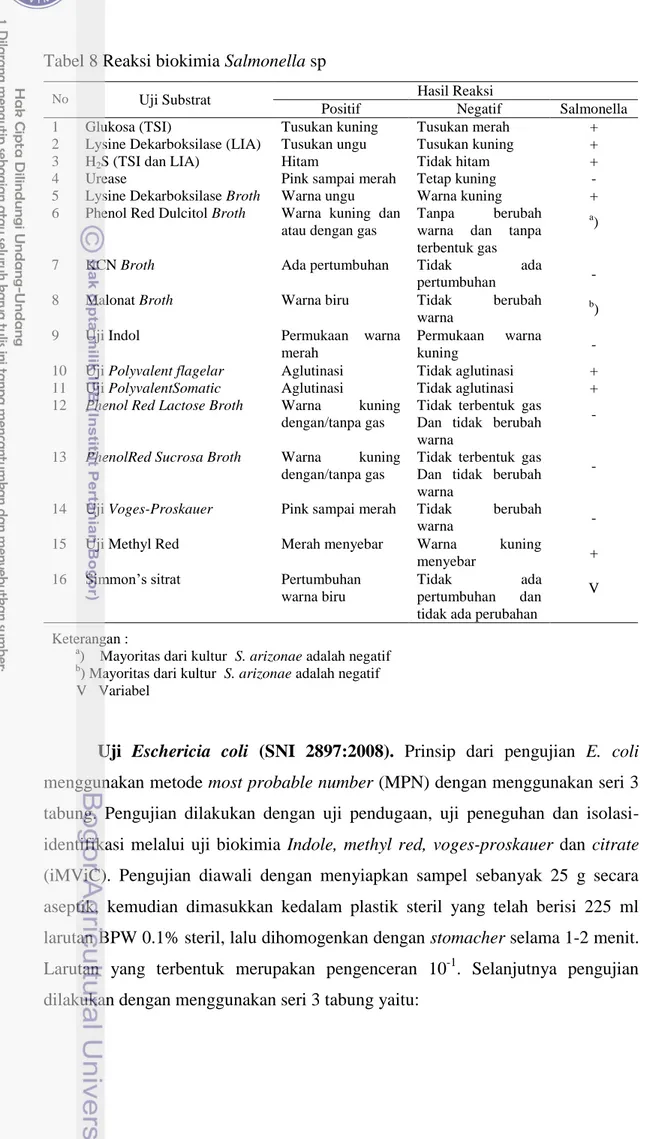
Selanjutnya dilakukan uji biokimia untuk Salmonella sp dengan melakukan uji urease, uji indol, uij MR-VP dan uji sitrat. Pengujian urease negatif ditunjukkan dengan tidak adanya perubahan warna, uji indol negatif dengan terbentuknya cincin kuning, uji VP negatif tidak terjadi perubahan warna pada media, uji MR positif adanya difusi warna merah dalam media dan uji sitrat positif adanya pertumbuhan diikuti perubahan warna dari hijau menjadi biru. Interprestasi hasil reaksi biokimia Salmonella sp ditunjukkan pada Tabel 8.
Tabel 8 Reaksi biokimia Salmonella sp
No Uji Substrat Hasil Reaksi
Positif Negatif Salmonella
1 Glukosa (TSI) Tusukan kuning Tusukan merah +
2 Lysine Dekarboksilase (LIA) Tusukan ungu Tusukan kuning +
3 H2S (TSI dan LIA) Hitam Tidak hitam +
4 Urease Pink sampai merah Tetap kuning -
5 Lysine Dekarboksilase Broth Warna ungu Warna kuning +
6 Phenol Red Dulcitol Broth Warna kuning dan
atau dengan gas
Tanpa berubah
warna dan tanpa terbentuk gas
a)
7 KCN Broth Ada pertumbuhan Tidak ada
pertumbuhan -
8 Malonat Broth Warna biru Tidak berubah
warna
b)
9 Uji Indol Permukaan warna
merah
Permukaan warna
kuning -
10 Uji Polyvalent flagelar Aglutinasi Tidak aglutinasi +
11 Uji PolyvalentSomatic Aglutinasi Tidak aglutinasi +
12 Phenol Red Lactose Broth Warna kuning
dengan/tanpa gas
Tidak terbentuk gas Dan tidak berubah warna
-
13 PhenolRed Sucrosa Broth Warna kuning
dengan/tanpa gas
Tidak terbentuk gas Dan tidak berubah warna
-
14 Uji Voges-Proskauer Pink sampai merah Tidak berubah
warna -
15 Uji Methyl Red Merah menyebar Warna kuning
menyebar +
16 Simmon’s sitrat Pertumbuhan
warna biru
Tidak ada
pertumbuhan dan
tidak ada perubahan
V
Keterangan :
a) Mayoritas dari kultur S. arizonae adalah negatif
b) Mayoritas dari kultur S. arizonae adalah negatif
V Variabel
Uji Eschericia coli (SNI 2897:2008). Prinsip dari pengujian E. coli menggunakan metode most probable number (MPN) dengan menggunakan seri 3 tabung. Pengujian dilakukan dengan uji pendugaan, uji peneguhan dan isolasi-identifikasi melalui uji biokimia Indole, methyl red, voges-proskauer dan citrate (iMViC). Pengujian diawali dengan menyiapkan sampel sebanyak 25 g secara aseptik, kemudian dimasukkan kedalam plastik steril yang telah berisi 225 ml larutan BPW 0.1% steril, lalu dihomogenkan dengan stomacher selama 1-2 menit. Larutan yang terbentuk merupakan pengenceran 10-1. Selanjutnya pengujian dilakukan dengan menggunakan seri 3 tabung yaitu:
1. Uji pendugaan
Uji pendugaan dilakukan dengan memindahkan 1 ml larutan pengencer 10-1 tersebut dengan menggunakan pipet steril kedalam larutan 9 ml larutan BPW 1% untuk mendapatkan pengenceran 10-2. Dengan cara yang sama dibuat pengenceran 10-3. Pipet masing-masing 1 ml dari setiap pengenceran ke dalam 3 seri tabung LSTB yang berisi tabung durham. Inkubasi dilakukan pada temperatur 35 °C selama 24-48 jam dan diperhatikan adanya gas yang terbentuk di dalam tabung durham. Hasil uji dinyatakan positif apabila terbentuk gas.
2. Uji peneguhan (konfirmasi)
Uji peneguhan harus selalu disertai dengan penggunaan kontrol positif. Pengujian dilakukan melalui pemindahan biakan positif dari hasil uji pendugaan positif dengan menggunakan jarum inokulasi dari setiap tabung LSTB ke dalam tabung ECB yang berisi tabung durham. Selanjutnya ECB diinkubasikan pada temperatur 45.5 °C selama 24±2 jam dan bila hasilnya negatif inkubasikan kembali selama 48±2 jam dan diperhatikan adanya gas yang terbentuk di dalam tabung durham. Hasil uji dinyatakan positif apabila terbentuk gas.
3. Uji isolasi-identifikasi
Uji isolasi dan identifikasi dilakukan dengan pembuatan goresan pada media L-EMBA atau VRBA dari tabung ECB yang positif, inkubasi pada temperatur 35 °C selama 18-24 jam. Koloni yang diduga E. coli adalah yang memiliki diameter 2 mm sampai 3 mm, warna hitam atau gelap pada bagian pusat
koloni, dengan atau tanpa metalik kehijauan yang mengkilat pada media L-EMBA. Selanjutnya koloni yang diduga dari masing-masing media L-EMBA
diambil dengan menggunakan jarum ose dan dipindahkan ke PCA miring. PCA miring diinkubasi pada temperatur 35 °C selama 18-24 jam untuk uji biokimia.
Uji indol dilakukan melalui inokulasi koloni dari tabung OCA pada TB dan diinkubasikan pada temperatur 35 °C selama 24±2 jam selanjutnya tambahkan 0.2-0.3 ml reagen Kovac. Hasil reaksi positif ditandai dengan adanya bentuk cincin merah pada lapisan atas media sedangkan hasil negatif ditandai dengan terbentuknya cincin berwarna kuning.
Uji Voges-Proskauer (VP) dilakukan dengan pengambilan biakan dari media PCA, lalu diinokulasikan kedalam tabung yang berisi 10 ml media MR-VP dan diinokulasikan pada temperatur 35 °C selama 48±2 jam. Inokulan dipindahkan sebanyak 5 ml MR-VP ke tabung rekasi dan ditambahkan 0.6 ml larutan
α-naphthol dan 0.2 ml KOH 40%, kemudian homogenkan. Hasil reaksi positif
ditandai dengan adanya warna merah muda eosin dalam waktu 2 jam.
Uji Methyl Red (MR) diambil dari media PCA lalu diinokulasikan ke dalam tabung yang berisi 10 ml media MR-VP dan inkubasikan pada temperatur 35 °C selama 48 ± 2 jam. Selanjutnya ditambahkan 2-5 tetes indikator MR pada tabung. Hasil uji positif ditandai dengan adanya warna merah dan hasil reaksi negatif ditandai adanya warna kuning.
Uji citrate dilakukan dengan inokulasi koloni dari media Agar miring PCA ke dalam media KCB dan inkubasikan pada temperatur 35 ᴼC selama 96 jam. Hasil uji positif ditandai dengan terbentuknya kekeruhan pada media. Klasifikasi
E. coli adalah apabila reaksi iMViC dengan pola + + - - atau - + - - (Tabel 9),
membentuk gas di EC broth setelah diinkubasi selama 48±2 jam dan pada pewarnaan Gram menunjukkan Gram negatif, tidak berspora dan berbentuk bola atau kokus. Dihitung MPN untuk E.coli per gram contoh dengan menggunakan tabel MPN berdasarkan jumlah seri tabung yang positif pada tabung EC broth. Tabel 9 Hasil rekasi indole, Methyl red, Voges-proskauer, citrate (iMViC)
terhadap E.coli
Tipe Organisme Indol MR VP Citrat
E. coli spesifik + + - -
E. coli non spesifik - + - -
Typical intermediate N/A + - +
Atypical intermediate - + - +
Typical Enterobacter aerogenes - - + +
4. Penentuan Cemaran Residu Kimia pada Daging
Penentuan Cemaran Logam Berat Pb, Cd dan Hg (SNI 01-2896-1998). Prinsip dari analisis ini adalah mengukur mineral, seperti kalium, besi, phospor dan logam berat seperti timbal, tembaga dan kadmium dengan persiapan sampel dengan cara-cara pengabuan basah. Selanjutnya dianalisis mineral dan logam beratnya menggunakan atomic absorbance spechtrofotometry (AAS). Setiap sampel ditimbang 5-10 g dan dimasukkan kedalam erlenmeyer 125 ml kemudian ditambahkan 10 ml H2SO4 dan 10 ml NHO3, selanjutnya dipanaskan secara
perlahan-lahan sampai larutan berwarna gelap. Sampel ditambahkan kembali NHO3 dan dipanaskan 5-10 menit sampai larutan menjadi tidak gelap lagi.
Sebanyak 10 ml aquades ditambahkan dan dipanaskan sampai berasap. Larutan didiamkan sampai dingin, kemudian ditambahkan 5 ml aquades dan dididihkan sampai berasap. Selanjutnya larutan didinginkan dan diencerkan kemudian dimasukkan kedalam labu erlenmeyer.
Kandungan mineral dan cemaran logam berat pada produk daging segar dianalisis dengan menggunakan AAS. Sebelum dilakukan analisis terlebih dahulu dibuat larutan blanko yang berisi semua pereaksi untuk mengetahui kadar mineral dan cemaran logam berat yaitu H2SO4 pekat dan NHO3 pekat. Sampel dibaca
absorbansinya dengan AAS pada gelombang 235.4 nm untuk timbal; 248.3 nm untuk tembaga; 228.8 nm untuk kadmium; 766.5 nm untuk kalium; 248.3 nm untuk besi dan 213.6 nm untuk phospor.
Uji Residu Pestisida (Komisi Pestisida 1997). Pengujian residu pestisida yang dilakukan pada penelitian ini adalah hanya untuk melihat pestisida yang berasal dari golongan organofosfat yang terdiri dari diazinon, fenitrotion, metidation, malation, chlorpirifos, paration dan profenofos. Analisis dilakukan dengan menggunakan gas kromatrografi dengan detektor FPD (flame photometric
detector). Penentuan residu pestisida dilakukan dengan cara sebagai berikut :
1. Proses ekstraksi
a. Daging tanpa lemak yang telah dicincang ditimbang sebanyak 25 g selanjutnya dimasukkan dalam mortar dan ditambahkan 45 g natrium sulfat, dicampur hingga diperoleh serbuk kering
b. Serbuk kering dipindah kedalam blender, dan ditambah 13 ml aseton, 125 ml asetonitril, 5 g Celite 545 dan 10 g Calflo E.
c. Serbuk kering dilumatkan selama 2-3 menit, kemudian disaring dengan corong Buchner dengan menggunakan tekanan secukupnya untuk mencegah penyumbatan.
d. Penyaringan diulangi dengan menggunakan kertas saring dan diukur volumenya. Dihitung berat contoh analitik yang sepadan dengan volume. e. Sebagian hasil penyaringan dipekatkan beberapa ml dengan rotary
evaporator pada suhu tangas air 45°C.
f. Residu dipindahkan secara kuantitatif kedalam tabung kimia dengan aseton, dan diuapkan sampai kering dengan mengalirkan gas nitrogen secara perlahan-lahan pada suhu kamar.
2. Pra-perlakuan dan penetapan residu
a. Residu dilarutkan dalam 2.0 ml heksana yang telah dijenuhkan dengan asetonitril, ditambahkan 2.0 ml asetonitril yang telah dijenuhkan dengan heksana.
b. Sampel dikocok dengan kuat selama 2 menit, hingga kedua fase terpisah c. Lapisan bagian bawah (fase asetonitril) selanjutnya digunakan untuk
penetapan secara kromatrografi gas
d. Penetapan residu dilakukan dengan menyuntikkan 2–2.5 μl fase asetonitril kedalam kromatrograf gas.
Kadar residu pestisida dapat ditentukan berdasarkan hasil rekaman yang tercatat dalam kertas kromatrografi yaitu berupa kromatrogram. Cara membaca hasil kromatrogram yaitu dengan melihat jarak dan tinggi peak (puncak) yang dihasilkan dalam kromatrogram dan membandingkan dengan jarak dan peak (puncak) pada pestisida standar. Penentuan konsentrasi residu dihitung dengan menggunakan rumus yang sesuai dengan Komisi Pestisida Departemen Pertanian (1997) sebagai berikut :
Keterangan : TS = Tinggi Sampel (mm) T std = Tinggi Standar (mm) FP = Faktor Pengenceran (10 ml) BS = Berat Sampel (g) Analisis Data
Data hasil uji laboratorium dianalisis secara statistik dengan pengujian nilai rata-rata, kemudian tiap nilai pengujian dibandingkan dengan SNI tentang kualitas fisik, cemaran mikrobiologis, residu logam berat dan residu pestisida pada daging. Hasil evaluasi penilaian SSOP, GSP, SJH dan NKV di rumah potong hewan (RPH) Kota Pekanbaru dianalisis secara deskriptif dan dibandingkan dengan studi literatur yang mendukung.