ISOLASI BAKTERI DAN UJI AKTIVITAS KITINASE TERMOFILIK KASAR DARI SUMBER AIR PANAS TINGGI RAJA, SIMALUNGUN
SUMATERA UTARA
TESIS
O l e h
ICHE MARINA DEWI 067030011/BIO
SEKOLAH PASCASARJANA UNIVERSITAS SUMATERA UTARA
MEDAN 2008
ISOLASI BAKTERI DAN UJI AKTIVITAS KITINASE TERMOFILIK KASAR DARI SUMBER AIR PANAS TINGGI RAJA, SIMALUNGUN
SUMATERA UTARA
TESIS
Untuk Memperoleh Gelar Magister Sains (M.Si) dalam Program Studi Biologi
pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
ICHE MARINA DEWI 067030011/BIO
SEKOLAH PASCASARJANA UNIVERSITAS SUMATERA UTARA
MEDAN 2008
Judul Tesis : ISOLASI BAKTERI DAN UJI AKTIVITAS KITINASE TERMOFILIK KASAR DARI SUMBER AIR PANAS TINGGI RAJA, SIMALUNGUN SUMATERA UTARA
Nama Mahasiswa : Iche Marina Dewi Nomor Pokok : 067030011
Program Studi : Biologi
Menyetujui Komisi Pembimbing
(Dr. Dwi Suryanto, M.Sc.) (Prof. Dr. Erman Munir, M.Sc.)
Ketua Anggota
Ketua Program Studi, Direktur,
(Dr. Dwi Suryanto, M.Sc.) (Prof. Dr. Ir. T. Chairun Nisa B, M.Sc.)
Telah diuji pada
Tanggal : 26 September 2008
PANITIA PENGUJI TESIS
Ketua : Dr.Dwi Suryanto, M.Sc.
Anggota : 1. Prof. Dr. Erman Munir, M.Sc 2. Dr. Delvian, SP.MP
ABSTRAK
Isolasi dan pengujian kitinase kasar bakteri termofilik penghasil kitinase telah dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi, FMIPA USU dari Bulan Februari 2008 sampai dengan Juni 2008. Tujuan penelitian ini adalah untuk mengisolasi dan mengetahui suhu optimum aktifitas kitinase bakteri yang diisolasi dari sumber air panas Tinggi Raja. Lima isolat (TR1, TR2, TR3, TR4, TR5) telah diseleksi untuk pemeriksaan lebih lanjut. TR 4 dan TR 5 menunjukkan suhu optimum dari aktifitas kitinase adalah 60oC dengan melepaskan 0.042 µmol/ml dan 0.030 µmol/ml N-asetilglukosamin,berturut-turut, kemudian TR 2 dan TR 3 menunjukan suhu optimum 65oC dengan melepaskan 0.025 µmol/ml dan 0,019 µmol/ml N-asetilglukosamin. Aktifitas kitinase TR1 belum dapat ditetapkan, sebab pada suhu 70oC aktifitas masih
meningkat.
ABSTRACT
An isolation and examination of crude chitinase of thermofilic bacteria were carried out in Laboratory of Microbiology, Departement of Biologi, FMIPA, USU from Februari to June 2008. The objective of the study was to isolated and to know the optimum temperature of the chitinase activity of bacterial isolates from Tinggi Raja hot spring. Five isolates (TR1, TR2, TR3, TR4, TR5) were selected for futher study. TR4 and TR5 showed optimum temperature of chitinase activity at 60oC by releasing 0.042 µmol/ml and 0.030 µmol/ml N-acetylglucosamine, respectively, while TR2 and TR3 showed optimum temperature at 65oC by releasing 0.025 µmol/ml and 0,019 µmol/ml
N-acetylglucosamine, respectively. However, chitinase activity of TR1 have not been determinate yet since by of 70oC the activity was still increase .
UCAPAN TERIMA KASIH
Puji dan syukur saya panjatkan kepada Allah SWT, yang telah memberikan berkat berlimpah, kesempatan dan kesehatan kepada saya sehingga saya dapat menyelesaikan tesis yang berjudul, “Isolasi Bakteri dan Uji Aktivitas Kitinase Termofilik Kasar Dari Sumber Air Panas Tinggi Raja, Simalungun Sumatera Utara. Tesis ini ditulis untuk memenuhi syarat mendapatkan gelar Magister Sains di Program Studi S2 Biologi pada Sekolah Pascasarjana Universitas Sumatera Utara Medan.
Dalam penulisan tesis ini, saya banyak mendapat bantuan moril maupun materil, bimbingan petunjuk, saran-saran serta nasehat yang besar nilainya dalam penyelesaian tesis ini. Untuk itu perkenankan saya terlebih dahulu mengucapkan terima kasih banyak yang sedalam-dalamnya kepada :
Ketua Komisi Pembimbing Dr.Dwi Suryanto, M.Sc, yang telah banyak membimbing dan memberi saran serta dorongan dengankesabaran selama saya menyusun usulan penelitian, menjalani penelitian sampai penyelesaian tesis ini.
Pembimbing 2, Prof. Dr. Erman Munir, M.Sc yang telah meluangkan waktu, membimbing dan mengarahkan penulis dalam penyelesaian tesis ini.
Dosen Penguji Dr. Delvian, SP.MP dan Dr. Ir. Eddy Batara Mulya Siregar, MS yang telah bersedia dengan sabar membantu saya dalam penyempurnaan tesis ini.
Secara khusus saya persembahkan pada yang tercinta Ir. Sunawardi, M.Si (suami), ananda Syifa Marini Thurfah dan ananda Ahmad Fauzan Syauqhi tiada kata yang setara untuk mengutarakan terima kasih dan penghargaan yang setinggi-tingginya atas dukungan, cinta, kasih sayang, pengertian, pengorbanan dan kesabaran yang diberikan kepada saya.
Segenap pihak yang telah membantu dan memberikan dukungan moril. Atas segala jerih payah serta bantuan yang telah saya terima, kiranya Allah SWT berkenan membalasnya.
Akhir kata saya menyadari sepenuhnya bahwa isi tesis ini masih memiliki kekurangan-kekurangan, maka saya mengharapkan kritik dan saran dari pembaca agar tesis ini dapat lebih baik. Saya berharap semoga tesis ini dapat bermanfaat.
Medan, 26 September 2008
Penulis
RIWAYAT HIDUP
Iche Marina Dewi, lahir pada tanggal 7 Maret 1976 di Serui–Irian Jaya, merupakan anak ke dua dari Bapak Djamidan dengan Ibu Sri Sukasih. Latar belakang pendidikan dan pengalaman yang pernah didapat adalah :
1. SD Inpres Serui, Irian Jaya : lulus 1987
2. SMPN 2 Banda Aceh : lulus 1990
3. SMAN 2 Banda Aceh : lulus1993
4. Sarjana S1 Fakultas MIPA/ Biologi Unsyiah : lulus 1998
5. Guru SMAN 2 Kutacane : 2000-sekarang
DAFTAR ISI
Halaman
ABSTRAK……….. i
ABSTRACT ………... ii
UCAPAN TERIMA KASIH …….……….... iii
RIWAYAT HIDUP ………..………. v
DAFTAR ISI ………....……… vi
DAFTAR TABEL ……….………. viii
DAFTAR GAMBAR……….………. ix DAFTAR LAMPIRAN ……….………. x BAB I. PENDAHULUAN ……… 1 1.1. Latar Belakang ………. 1 1.2. Tujuan Penelitian ………. 4 1.3. Rumusan Masalah ………... 4 1.4. Hipotesis ……….. 4 1.5. Manfaat Penelitian……….... 5
BAB II. TINJAUAN PUSTAKA ……….……… 6
2.1. Mikroorganisme Termofilik ………... 6
2.2. Kitin ……….. 8
2.3. Kitinase ………. 9
2.4. Biosintesis Enzim Kitinase pada Mikroorganisme ……….. 12
2.5. Klasifikasi Enzim Kitinase ……… 12
2.6. Metode Pemekatan Cairan Enzim dan Pengukuran Aktifitas Kitinase ……….. 14
2.7. Kegunaan Enzim Kitinase ………. 16
2.9. Deskripsi daerah sumber Air Panas Tinggi Raja,
Sumatera Utara ………... 18
BAB III. METODOLOGI PENELITIAN……… 20
3.1. Waktu Dan Tempat Penelitian ……… 20
3.2. Alat Dan Bahan ……….. 20
3.3. Pengambilan Sampel Air Panas ………. 21
3.4. Preparasi Koloidal Kitin ………. 21
3.5. Preparasi Larutan Buffer Fosfat ………. 22
3.6. Pembuatan Larutan Mc Farland ……….... 22
3.7. Isolasi dan Seleksi Bakteri Kitinase ……….. 22
3.8. Karakterisasi Morfologi Dan Biokimia Bakteri Kitinase ….. 23
3.9. Ekstrak Kitinase Kasar ……….. 23
3.10. Pengukuran Aktifitas Kitinase Kasar Berdasarkan Pengaruh Suhu ……….. 24
3.11. Analisis Data ………. 26
BAB IV. HASIL DAN PEMBAHASAN ……… 28
4.1. Isolasi dan Seleksi Bakteri Kitinase Termofilik ……… 28
4.2. Karakterisasi Morfologi Dan Biokimia Bakteri Kitinase …. 31 4.3. Pengaruh Suhu Terhadap Aktivitas Kitinase Kasar ………. 35
BAB V. KESIMPULAN DAN SARAN ………... 43
5.1. Kesimpulan……… 43
5.2. Saran ……… 43
DAFTAR TABEL
Nomor Judul Halaman
1. Struktur tabel sidik ragam ……… 26
2. Karakteristik morfologi bakteri kitinolitik termofilik asal Tinggi Raja 31 3. Karakterisasi sifat biokimia isolat kitinolitik termofilik ….…………. 33
DAFTAR GAMBAR
Nomor Judul Halaman
1. Unit kitin ……… 8
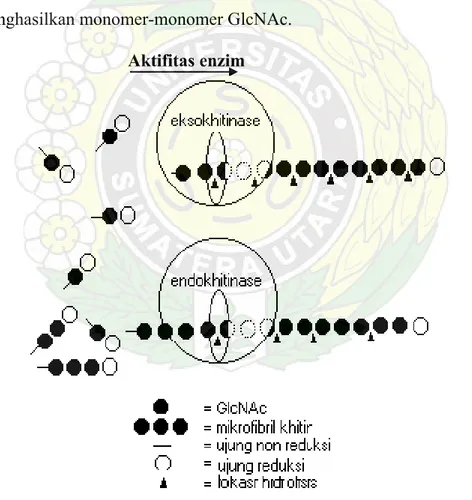
2. Mekanisme kerja enzim eksokitinase dan endokitinase ……… 14
3. Beberapa isolat dengan zona bening (a) di sekitar koloni bakteri (b) pada hari ketiga ……… 29 4. Diameter zona bening bakteri kitinolitik termofilik dalam uji nisbi …. 30 5. Pewarnaan gram bakteri kitinolitik termofilik (perbesaran 16 X 100)... 33 6. Rataan aktivitas kitinase kasar (µgr/ml) pada berbagai suhu …..……... 37 7. Pengaruh suhu terhadap kitinase total bakteri termofil Tinggi Raja ….. 38
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Preparasi koloidal kitin ……… 49
2. Isolasi bakteri ……….. 50
3. Penyiapan biakkan murni bakteri kitinolitik………. 51
4. Karakterisasi sifat morfologi dan biokimia isolat ..……….. 52
5. Isolasi enzim kitinase kasar ………... 53
6. Penentuan aktifitas kitinase dengan variasi suhu ……… 54
7. Pembuatan kurva standar N-asetil Glukosamin……… 55
8. Peta lokasi sumber isolat ………. 56
9. Pengamatan uji biokimia sederhana ……… 57
10. Data penentuan kurva standar GlcNAc dengan menggunakan spektrofotometer λ = 538 nm ... 58
11. Daftar sidik ragam & uji duncan 5 isolat bakteri kitinase termofilik Tinggi Raja ……….. 60
BAB I PENDAHULUAN
1.1. Latar Belakang
Indonesia merupakan negara yang kaya sumber air panas sebagai media bagi pertumbuhan bakteri termofilik yang dikenal memproduksi enzim yang bernilai ekonomi. Namun sampai saat ini bakteri dari sumber air panas belum banyak dieksplorasi. Salah satu tempat di Indonesia yang memiliki beberapa sumber mata air panas, antara lain daerah panas bumi Tinggi Raja, di Desa Tinggi Raja, Kecamatan Silau Kahean, Kabupaten Simalungun, Sumatera Utara. Manifestasi sumber air panas tersebut sampai saat ini hanya dimanfaatkan untuk obyek pariwisata pemandian air panas yang itupun pemanfaatannya belum optimal (Sundoro, 2006). Beberapa penelitian juga sudah diarahkan untuk pengelolaan energi pembangkit listrik tenaga air tetapi belum dapat diaplikasikan.
Sumber mata air panas ini diduga memiliki potensi bakteri termofil yang belum dieksplorasi sebelumnya. Bakteri termofil merupakan bakteri dengan kemampuan bertahan hidup pada kondisi panas sampai dengan kondisi ekstrim panas, bahkan bakteri termofil ada yang mampu bertahan hidup pada suhu 250oC (Vieille & Zeikus, 2001).Bakteri sebagai salah satu mikroorganisme yang berperan sebagai penghasil enzim yang paling banyak digunakan dibanding tanaman dan hewan. Sebagai sumber enzim, bakteri dianggap lebih menguntungkan karena pertumbuhannya cepat,
dapat tumbuh pada subtrat yang relatif murah, kondisi pertumbuhan dan rekayasa genetik dapat diatur serta mampu menghasilkan enzim yang ekstrim seperti pada suhu tinggi sangat menguntungkan dibidang industri dan penelitian ilmiah (Lestari, 2000).
Pada tahun-tahun belakangan ini, enzim termostabil dari ekstrim termofil menjadi sangat penting karena sifat termostabilitas intrinsik dan resistensinya terhadap perubahan faktor-faktor fisik dan kimia. Enzim termostabil sangat penting dalam aplikasi bioteknologi dan industri, seperti dalam teknik-teknik biologi molekuler untuk kegunaan penelitian dan diagnostik (enzim yang memproses DNA dan RNA) dan kemampuan enzim mengubah tepung, makanan, pengelolaan sampah, sintesis organik, pembuatan kertas dan industri kulit. Hingga saat ini, lebih dari 70 genus dan 140 spesies termofil telah diisolasi dari berbagai lingkungan termis (George, 2001).
Untuk lebih memanfaatan bakteri termofilik strain lokal, dilakukan studi terhadap enzim termostabil bakteri ini. Beberapa enzim yang telah diteliti antara lain selulase, amilase, protease, kreatinase, xylanase, kitinase dan lain–lain. Penelitian tentang enzim kitinase telah dilakukan, baik uji potensi enzim bakteri kitinolitiknya hingga cara mempelajari gen yang menyandi enzim yang terlibat dalam proses–proses kimiawi khususnya. Kitinase juga dihasilkan oleh jamur, tumbuhan tingkat tinggi, serangga, udang, kepiting, cumi-cumi dan artropoda lainnya (Rahayu, 2000).
Di alam, polimer kedua terbanyak setelah selulosa adalah kitin. Indonesia sangat berpotensi menghasilkan kitin dan produk turunannya. Limbah cangkang rajungan di Cirebon saja berkisar 10 ton perhari yang berasal dari sekurangnya 20 industri kecil
(Lestari, 2000). Turunan kitin tersebut masih menjadi limbah yang dibuang dan menimbulkan masalah lingkungan. Pada hewan, kitin dikonversi menjadi monomer atau oligomernya dengan menggunakan enzim kitinase. Kitin juga merupakan sumber karbon dan nitrogen yang dimanfaatkan oleh bakteri kitinase (Poernomo, 2004).
Kitinase merupakan enzim ekstraseluler yang berperan dalam pemecahan kitin. Secara umum kitinase diklasifikasikan atas endokitinase, eksokitinase dan β-1,4-N-asetilglukosaminidase. Endokitinase adalah enzim yamg memotong acak ikatan β-1,4 bagian internal mikrofibril kitin dengan produk akhir yang bersifat mudah larut yaitu berupa N-asetilglukosamin dengan berat molekul rendah seperti kitotetraose. Eksokitinase merupakan enzim yang mengkatalisis secara aktif pembebasan unit–unit diasetil kitobiose tanpa pembentukan unit–unit monosakarida dan oligosakarida disebut eksokitinase, sedangkan β-1,4-N-asetilglukosaminidase merupakan kitinase yang bekerja pada pemutusan diasetilkitobiose, kitotriose, kitotetraose dan menghasilkan monomer GlcNAc (Harman et al, 1993).
Kemampuannya menghidrolisis kitin pada suhu tinggi merupakan hal yang menarik dalam pengisolasian bakteri kitinase termofilik. Produk hidrolisis berupa derivat kitin banyak dimanfaatkan untuk keperluan medis, farmakologi, industri, pertanian, pakan ternak, kapsul obat dan obat-obatan seperti obat anti tumor dan anti kanker, juga sebagai agen pengendalian hama dan penyakit tanaman yang merupakan hal yang tergolong baru dalam ilmu pengetahuan.
1.2. Tujuan Penelitian
Penelitian bertujuan untuk :
a. Mendapatkan bakteri kitinolitik termofilik, memperoleh isolat murni dan mengidentifikasi bakteri kitinolitik yang ditemukan
b. Mengetahui suhu dan aktifitas kitinase optimum bakteri kitinolitik termofil dari sumber air panas Tinggi Raja
c. Mengetahui pengaruh suhu terhadap aktifitas enzim kitinase termofil
1.3. Rumusan Masalah
Penelitian dibatasi pada masalah-masalah yang berhubungan dengan penelitian ini saja, yaitu
a. Ada tidaknya bakteri kitinolitik termofilik di sumber air panas Tinggi Raja
b. Apakah bakteri yang ditemukan tersebut memiliki suhu optimum dalam proses produksi enzim kitinolitik termofil,
c. Berapakah suhu optimum aktifitas kitinase termofilik kasar asal Tinggi Raja
1.4. Hipotesis
Terdapat beberapa isolat bakteri kitinolitik termofilik Tinggi Raja yang memiliki aktifitas kitinase pada suhu optimum yang berbeda.
1.5. Manfaat Penelitian
Penelitian ini bermanfaat untuk memperkaya informasi mengenai sumber daya alam yang memiliki potensi bakteri kitinolitik (bioprospecting chitinase) dan memberi kontribusi bagi penelitian lebih lanjut dalam pemanfaatan enzim kitinase bakteri kitinolitik termofilik dari sumber air panas Tinggi Raja.
BAB II
TINJAUAN PUSTAKA
2.1. Mikroorganisme Termofilik
Berdasarkan suhu optimum pertumbuhan, mikroorganisme secara umum dibedakan atas psikrofil, mesofil, termofil, ekstrim termofil dan ultra termofil. Psikrofil hidup pada kisaran suhu -3-20oC, mesofil pada suhu 13–45oC dan termofil antara 45– 65oC bahkan ada yang memiliki kemampuan hidup pada suhu ekstrim termofil yakni antara 65–85oC dan hipertermofil pada suhu di atas 85oC (Rudiger, 1994). Bakteri yang mampu hidup pada kisaran suhu di atas 110oC disebut bakteri ultratermofil (Sharmili & Ramasay, 2003).
Termofilik didefinisikan sebagai organisme yang hidup pada suhu di atas 45oC. Organisme ini telah memunculkan pengetahuan baru selama beberapa tahun belakangan. Minat para ilmuwan terhadap organisme termofil semakin tinggi terutama dipicu dengan adanya penemuan bakteri-bakteri yang dapat hidup pada suhu titik didih air atau bahkan lebih tinggi (Lestari, 2000).
Termofil sangat menarik untuk dikaji baik dari sudut pandang ilmu dasar maupun terapan. Bidang penelitian dasar yang berkaitan yaitu biologi molekuler, genetika, biokimia, evolusi, taksonomi, ekologi dan asal usul kehidupan. Berdasarkan sudut pandang terapan atau bioteknologi, termofil merupakan sumber enzim-enzim yang unik dengan sifat spesifik, terutama yang tahan terhadap suhu tinggi. Contoh, penerapan
enzim termostabil yang telah dilakukan dalam bidang industri antara lain sebagai agen aktif dalam fermentasi bersuhu tinggi, proses penggolahan limbah dan proses pelarutan mineral (Lestari, 2000).
Pemakaian enzim termostabil disamping tahan terhadap denaturasi panas, juga dapat meminimalkan resiko kontaminan dan dapat menggeser reaksi ke arah pembentukan produk (Rudiger, 1994). Penggunaan enzim termostabil dalam bioteknologi telah dapat menurunkan biaya operasi, disamping dapat meningkatkan kecepatan reaksi-reaksi biokimianya (Aguilar et al., 1998).
Menurut Edwar (1991) dan Madigan (1997), mikroorganisme termofilik dapat diisolasi dari berbagai sumber, termasuk sumber air panas baik yang terdapat di darat maupun di laut, tanah yang selalu terkena sinar matahari, bahan yang mengalami fermentasi seperti kompos dan instalasi air panas. Bakteri termofil merupakan bakteri dengan kemampuan bertahan hidup pada kondisi panas sampai ekstrim panas, pada beberapa litelatur bahkan disebutkan ada yang mampu bertahan hidup pada suhu 250oC (Vieille & Zeikus, 2001).
Di Sumatera Utara kekayaan alam berupa sumber air panas terdapat di beberapa daerah. Pada kondisi hutan, dimana daun-daunan gugur, biji-bijian, rerumputan, serbuk sari dan bangkai serangga merupakan sumber bahan organik yang dapat dimanfaatkan oleh mikroorganisme yang terdapat di dalam sumber air panas tersebut. Hal ini memberikan peluang besar bagi mikroorganisme termofilik penghasil enzim hidrolitik ekstraselluler seperti protease, manase, amilase, kitinase dan xilanase pada sumber air
panas tersebut. Salah satu enzim termostabil yang banyak digunakan dalam bidang bioteknologi adalah enzim DNA polymerase yang biasa digunakan dalam proses PCR.
2.2. Kitin
Kitin merupakan polimer N-asetilglukosamin yang cukup banyak ditemukan dalam dinding sel jamur dan eksoskeleton dari serangga dan krustasea (Cohen-Kupiec & Chet, 1998). Kitin (C6H9O4. NHCOCH3)n merupakan zat padat yang larut dalam
asam-asam mineral pekat, tetapi tidak larut dalam air, pelarut organik, alkali pekat, dan asam mineral lemah. Dengan adanya ikatan hidrogen yang sangat kuat pada rantai kitin, membuat kitin tidak dapat larut dalam air dan membentuk fibril.
Kitin dapat larut dalam fluoroalkohol dan asam mineral pekat. Koloidal kitin merupakan kitin yang banyak digunakan sebagai substrat dalam medium fermentasi (Haran et al., 1995). Satu unit kitin dapat dilihat pada gambar berikut.
Berdasarkan pola penyusun rantai polimer, kitin fibril terbagi atas α-kitin, β-kitin, γ-kitin (Cabib, 1987). Pada α-kitin, rantai-rantai polimer yang berdekatan tersusun secara antiparalel. Bentuk ini banyak ditemukan pada jamur dan arthropoda. Jenis β-kitin mempunyai rantai polimer yang tersusun paralel, sedangkan γ-β-kitin fibrilnya masing-masing tersusun dari tiga rantai, dua rantainya tersusun paralel dan rantai ketiga antiparalel (Cabib, 1987).
Sumber kitin bermacam-macam, namun secara komersial kitin dieksplorasi dari cangkang udang-udangan dan Crustacea. Sebanyak 50–60% dari limbah udang, dihasilkan 25% kitin dari 32% berat kering limbah tersebut (Meidina et al., 2005) Kitin terdapat melimpah di tanah dengan struktur dan karakteristik yang unik. Banyak hewan dan mikroorganisme (seperti jamur, dan alga) memberikan kontribusi terbanyak atas ketersedian kitin di dalam tanah.
2.3. Kitinase
Secara umum enzim sering digunakan dalam proses produksi. Enzim yang digunakan pada umumnya berasal/diisolasi dari bakteri. Penggunaan enzim dalam proses produksi dapat meningkatkan efisiensi yang kemudian meningkatkan jumlah produksi. Bidang bioteknologi industri mengembangkan teknologi dan bioproses dengan segala ilmu pendukungnya, seperti mikrobiologi, rekayasa genetika, biokimia atau ilmu pendukung lainnya.Bioproses, yang di dalamnya meliputi bidang produksi
antara lain antibiotika, asam amino, pengendalian limbah, ataupun enzim (Poernomo, 2004).
Enzim adalah kelompok protein yang berperan penting dalam aktifitas biologi. Enzim berfungsi sebagai katalisator di dalam sel dan sifatnya sangat khas. Dalam jumlah yang kecil, enzim dapat mengatur reaksi tertentu sehingga dalam keadaan normal tidak terjadi penyimpangan hasil reaksi. Karena enzim mengkatalisator reaksi-reaksi di dalam sistem biologis, maka enzim disebut sebagai biokatalisator (Murray, 2003).
Di bidang industri, enzim yang digunakan sebagian besar diisolasi dari mikroorganisme. Pemilihan mikroorganisme sebagai sumber enzim mempunyai beberapa keuntungan bila dibandingkan dengan yang diisolasi dari tanaman maupun dari hewan. Antara lain adalah sel mikroorganisme relatif lebih mudah ditumbuhkan, kecepatan pertumbuhan relatif lebih cepat, skala produksi sel lebih mudah ditingkatkan bila dikehendaki produksi yang lebih besar, biaya produksinya relatif rendah, kondisi selama produksi tidak tergantung oleh adanya pergantian musim dan waktu yang dibutuhkan dalam proses produksi lebih pendek (Poernomo & Purwanto, 2003).
Enzim kitinase mampu mendegradasi kitin. Kitinase banyak dihasilkan oleh berbagai organisme seperti bakteri, fungi, tumbuhan tingkat tinggi, dan hewan. Organisme ini biasanya memiliki beragam gen kitinase yang ekspresinya diinduksi oleh ekstraseluler kitin dan derivatnya. Pada hewan, kitinase digunakan untuk mengkonversi kitin menjadi monomer atau oligomernya. Kitinase juga dimanfaatkan oleh bakteri
untuk asimilasi kitin sebagai sumber karbon dan nitrogen (Tsujibo et al., 1999). Sejumlah besar organisma memiliki enzim yang mampu menurunkan kitin fibril dan dikenal secara kolektif sebagai kitinase (Inbar & Chet, 1991).
Kitinase menjadi perhatian yang besar, terutama karena peranannya dalam morfogenesis jamur dan parasitisme. Pemanfaatan enzim ini telah banyak dilakukan dalam aplikasi pengendalian hayati (Sahai & Manocha, 1993). Kitinase yang dihasilkan mikroorganisme memiliki berat molekul berkisar antara 20.000–120.000 KDA. Pada bakteri, berat molekul antara 60.000–110.000 KDA, sedangkan pada aktinomisetes yaitu 30.000 atau lebih rendah (Wang et al, 1997).
Bakteri kitinolitik merupakan bakteri yang kompeten memproduksi enzim kitinase dan memanfaatkan kitinase untuk asimilasi kitin sebagai sumber karbon dan nitrogen (Wu et al, 2001). Genus bakteri yang sudah banyak dilaporkan menghasilkan kitinase antara lain Aeromonas, Alteromonas, Chromobacterium, Enterobacter,
Ewingella, Pseudoalteromonas, Pseudomonas, Serratia, Vibrio (Chernin et al, 1998).
Beberapa spesies yang telah dipelajari antara lain Aeromonas sp, Bacillus cereus, B.
licheniformis (Pleban et al, 1997), Clostridium sp, Enterobacter liquefaciens, Flavobacterium indolthecium, Klebsiella sp, Micrococcus colpogenes, Pseudomonas
sp, Serratia marcencens, Vibrio parahaemaluticus, V. alginolyticus, Bacillus dan
Pyrococcus (Gao et al, 2003)
Di Indonesia, sejumlah bakteri yang mempunyai aktifitas enzim kitinase telah diisolasi dari berbagai sumber air panas di daerah Tompasso, Manado. Dari 45 isolat
yang didapat, Bacillus licheniformis MB-2 menunjukkan indeks kitinolitik yang terbesar (Jayanti, 2002). Enzim kitosanase yang dihasilkan dari isolat MB-2 telah pula dimurnikan dan dikarakterisasi (Chasanah, 2004).
2.4. Biosintesis Enzim Kitinase Pada Mikroorganisme
Pengaturan biosintesis enzim kitinase melalui sistem represor-induser. Kitin dan produk hasil degradasinya (oligomer/monomer) berperan sebagai induser (Sahai & Manocha, 1993). Glukosamin dapat menginduksi kitinase karena pada kitosan (kitin yang mengalami deasetilasi) masih terdapat sekitar 10–20% residu asetil (Sahai & Manocha, 1993).
Pengaturan sintesis kitinase dipengaruhi juga oleh produk akhir (katabolit) berupa GlcNAc dan glukosa. Kitin yang dipreparasi dengan hidrolisis parsial dengan HCl 10 N akan menghasilkan koloidal kitin yang mampu menginduksi kitinase kompleks seperti N-asetilglukosaminidase, endokitinase dan kitobiosidase pada Aeromonas caviae (Inbar & Chet, 1991), Enterobacter agglomerans (Chernin et al., 1995) dan Trichoderma
harzianum (Haran et al., 1995).
Kemampuan menginduksi sintesis kitinase dipengaruhi kemampuan sel mikroorganisme untuk mengenal struktur fisik kitin seperti susunan rantai. Beberapa mikroorganisme memproduksi protein seperti lektin yang mengikat secara khusus kristal α-kitin. Sel juga dapat mengenal derajat deasetilasi dari jumlah glukosamin dan GlcNAc relatif yang dibebaskan selama degradasi kitin.
2.5. Klasifikasi enzim kitinase
Kitinase poli 1,4–β(2 asetamido–2–deoksi–D–glukosaminide) glikanohidrolase adalah enzim yang menghidrolisis ikatan β-1,4-asetamido–2 deoksi-D-glikosida dari kitin dan kitodekstrin (Bielka et al., 1984). Mekanisme proses hidrolisis tersebut tergantung dari tipe-tipe kitinase dan kemampuan mengkatalisis dengan produk akhir yang berbeda.
Polimer N-asetilglukosamin yang cukup banyak ditemukan dalam dinding sel jamur dan eksoskeleton dari serangga dan krustasea, dimana kesamaan rangkaian peptida telah digunakan untuk mengelompokkan kitinase ke dalam lima kelas. Kelas I, II, dan IV terdiri dari kitinase yang bersumber dari tanaman dan secara struktural tidak berhubungan dengan kelas III dan V. Kitinase kelas III diperoleh terutama dari tumbuhan dan jamur, sedangkan kelas V mewakili sebagian besar bakteri kitinase (Cohen-Kupiec & Chet, 1998).
Sistim tata nama dan penggolongan enzim kitinase masih banyak menimbulkan kerancuan. Harman et al., (1993) membagi kitinase dalam tiga tipe yaitu:
a. Eksokitinase (belum memiliki nomor entry dalam Enzyme Nomenclature)
dinamakan juga kitobiosidase atau kitin–1,4-β-khitobiosidase, yaitu enzim yang mengkatalisis secara aktif pembebasan unit diasetilkitobiose tanpa ada unit-unit monosakarida atau oligosakarida yang dibentuk (Gambar 2). Pemotongan hanya terjadi pada ujung non reduksi mikrofibril kitin dan tidak secara acak.
b. Endokitinase (EC. 3.2.1.14) yaitu enzim yang memotong secara acak ikatan β -
1,4 bagian internal mikrofibril kitin (Gambar 2). Produk akhir yang terbentuk berupa oligomer pendek N-asetilglukosamin (GlcNAc) yang mempunyai berat molekul rendah seperti kitotetraose, kitotriose dengan didominasi oleh diasetilkitobiose. Produk yang dihasilkan bersifat mudah larut.
c. β -1,4–N asetilglukosamidase (EC. 3.2.1.30) adalah suatu enzim kitinolitik yang bekerja pada pemutusan diasetilkitobiose, kitotriose dan kitotetraose dengan menghasilkan monomer-monomer GlcNAc.
Aktifitas enzim
Gambar 2. Mekanisme kerja enzim eksokitinase dan endokitinase (Sahai & Manocha, 1993)
2.6. Metode pemekatan cairan enzim dan pengukuran aktifitas kitinase
Enzim yang berada pada cairan kultur belum 100% terdiri atas protein enzim yang diinginkan, sehingga perlu pemurnian untuk memisahkannya dari senyawa-senyawa lain. Tahap awal dalam pemurnian enzim adalah pemekatan medium kultivasi. Pemekatan dapat dilakukan dengan beberapa cara yaitu ultrafiltrasi, liofiliasi dan mengendapkan protein dengan ammonium sulfat, aseton, etanol, atau polietilen glikol (PEG) (Scopes, 1994). Pemekatan enzim kitinase dari Streptomyces dengan ammonium sulfat pada kejenuhan 70% dan etanol dingin, dapat meningkatkan kemurnian enzim berturut-turut 5 dan 3,5 kali dibanding enzim kasarnya (Lloyd et al., 1965). Sementara itu Singh et al.,(1999) menyatakan bahwa protein kitinase dari Streptomyces sp. 385 yang dipekatkan dengan polietilen glikol (PEG), kemurniannya meningkat sebanyak 11,9 kali dibanding enzim kasarnya.
Pengendapan protein dengan ammonium sulfat adalah cara yang paling banyak digunakan. Hal ini disebabkan karena ammonium sulfat mudah didapatkan, harganya relatif murah, bersifat menstabilkan enzim serta dapat mencegah aktifitas enzim proteolitik. Garam ammonium sulfat konsentrasi 2-3 M dapat menstabilkan enzim selama beberapa tahun. Kelemahannya adalah tidak dapat mengendapkan seluruh protein yang telah larut dan bila mengandung logam dapat merusak enzim (Scopes, 1994).
Pengukuran aktifitas kitinase dalam memecah kitin dapat dilakukan dengan beberapa cara seperti yang disebutkan Jeaniaux (1966) dan Cabib (1987) yaitu :
a. Berdasarkan pengurangan substrat.
1). Metode turbidimetri (nepelometri) yaitu mengukur variasi turbiditas (kekeruhan) suspensi koloidal kitin selama kitinolisis. Pengukuran ini hanya cocok untuk enzim dengan aktifitas tinggi tapi bersifat cepat dan akurat. Misalnya pengukuran aktifitas enzim endokitinase.
2). Metode viskosimetri yaitu pengukuran aktifitas enzim kitinase terhadap derivat kitin yakni kitosan, glikol kitin atau karboksimetilkitin yang ditandai dengan terjadinya pengurangan viskositas substrat.
b. Berdasarkan pembentukan produk akhir yaitu GlcNAc (Metode Reissig, 1955). Yaitu pengukuran secara kolorimetrik produk akhir berupa GlcNAc yang dibebaskan dari kitin dengan p-dimetilaminobenzaldehida. µmol GlcNAc yang dibebaskan selama 1 jam dalam kondisi yang ditetapkan dianggap sebagai satu unit aktifitas kitinase
c. Spectrometer Assay
Yaitu proses yang menggunakan subtrat dari kromogen 3,4, dinitrofenil tetra N-asetilkitotetraose.
d. Radiometer Assay.
Pengukuran produk diuji dengan menentukan radioaktifitasnya setelah penghilangan kitin yang belum dipecah dengan cara penyaringan atau disentrifugasi.
Pengujian ini untuk mengetahui sensitifitas enzim kitinase dengan menggunakan subtrat yang berlabel 14C atau 3H.
2.7 Kegunaan enzim kitinase
Enzim kitinase berperanan penting dalam kontrol fungi patogen tanaman secara mikoparasitisme. Kemampuan beberapa spesies sebagai mikroorganisme biokontrol yang sangat efektif untuk menghambat pertumbuhan fungi patogen tanaman dikaitkan dengan kemampuannya menghasilkan enzim kitinase (Paulitz & Belanger, 2001). Kitinase yang diproduksi mikroorganisme dapat menghidrolisis struktur kitin, senyawa utama penyusun dinding sel tabung kecambah spora dan miselia, sehingga jamur tidak mampu menginfeksi tanaman(Priyatno et al., 2000).
Kitinase mendapat perhatian yang besar, terutama karena peranan mereka dalam morfogenesis jamur dan parasitisme. Kepentingan enzim ini dalam banyak aplikasi kontrol biologi juga telah didokumentasikan (Sahai & Manocha, 1993). Salah satu contoh penyakit sasaran yang potensial dikendalikan dengan mikroorganisme kitinolitik adalan penyakit karat daun kedelai yang disebabkan jamur Phakopsora pachyrhizi Syd (Priyatno et al., 2000).
Kemampuan bakteri untuk memproduksi kitinase sangat bervariasi, mungkin disebabkan perbedaan kecil pada gen yang mengkodenya (Tronsmo & Harman, 1993). Variasi ini tidak saja terlihat dari jumlah aktifitas kitinase total yang diproduksi setiap speciesnya, tetapi juga pada jenis kitinase yang dihasilkan. Semua enzim yang dapat
mendegradasi kitin, disebut kitinase total atau kitinase non-spesifik (Nugroho et al., 2003).
2.8 Faktor-faktor yang Mempengaruhi Aktifitas Enzim
Enzim mampu mempercepat reaksi kimia paling sedikit 1 juta kali lebih cepat dari reaksi yang tidak dikatalis. Laju reaksi yang dikatalis enzim lebih cepat dari katalis lain. Dalam sintesis enzim, parameter lingkungan sangat mempengaruhi (Darwis & Sunarti, 1992). Aktifitas suatu enzim dipengaruhi oleh beberapa faktor, yaitu pH, konsentrasi subtrat dan enzim, suhu dan adanya aktivator atau inhibitor (Lehninger, 1998).
pH berpengaruh karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi pH. Hal ini menyebabkan daerah katalitik dan konformasi enzim jadi berubah. Perubahan pH juga menjadi penyebab denaturasi protein dan megakibatkan hilangnya aktifitas enzim. Untuk mempelajari enzim, terlebih dahulu harus dicari pH optimum dengan menggunakan buffer yang sesuai (Girindra, 1993).
Pengaruh suhu terlihat pada reaksi-reaksi kimia, karenanya reaksi yang dikatalisis enzim peka terhadap suhu. Hal ini disebabkan karena enzim merupakan struktur protein pula yang akan mengalami denaturasi jika suhunya dinaikan dan menyebabkan menurunnya daya kerja enzim.
Girindra (1993) menyebutkan bahwa kecepatan enzim bereaksi dipengaruhi pada konsentrasi enzim yang berperan sebagai katalisator. Suatu reaksi yang dikatalis oleh
enzim terlebih dahulu terbentuk komplek enzim subtrat (ES), yang kemudian terurai menjadi enzim dan produknya.
Aktifitas enzim sendiri diperbesar dengan adanya aktifator yang mengaktifkan enzim. Aktifator tersebut dapat berupa logam dan non logam yang merupakan zat-zat non spesifik yang menggiatkan proses enzimatis. Umumnya aktivator ini merupakan bahan yang tahan panas dan berberat molekul relatif rendah (Baldwin, 1973).
2.9. Deskripsi Daerah Sumber air Panas Tinggi Raja, Sumatera Utara
Tinggi Raja merupakan objek pariwisata cagar alam dan sumber air panas/belerang. Sampai sekarang ini pengelolaannya masih ditangani oleh Balai Konservasi Sumber Daya Alam (BKSDA) Kadis Kehutanan Propinsi Sumatera Utara (Khairul, 2007).
Sumber air panas berada pada satu bukit kapur sekitar setengah hektar. Ada tiga bukit, masing-masing di arah selatan, timur dan barat. Ketiganya dihubungkan dengan retakan yang seolah membelah bukit. Retakan inilah tempat luapan air panas, dengan lebar yang beragam mulai 10– 60 cm, tinggi cipratan air rata-rata 30 cm – 1 m (Khairul, 2007).
Sumber air panas Tinggi Raja kecamatan Silau Kahean, Kabupaten Simalungun terletak dalam suatu lokasi cagar alam (CA) dengan luas 176 ha di desa Tinggi Raja. Berjarak 80 Km dari Pematang Siantar dan 116 km dari Desa Tinggi Raja. Peta lokasi pengambilan sumber isolat dapat dilihat pada Lampiran 8.
Secara geografis Tinggi Raja terletak di antara 3º 08’ s.d 3º 09’ lintang Utara dan 98º 46’ 30˝ s.d 98º 48’ 30˝ bujur timur. Berdasarkan letak pada ketinggian di atas permukaan laut (dpl) maka Cagar Alam Tinggi Raja terletak pada ketinggian sampai dengan 450 m dpl. Cagar Alam ini terletak di antara desa Dolok Merawa dan dusun Bahoan (BKSDA Sumatera Utara, 2003).
Tanah di kawasan Cagar Alam Tinggi Raja sebagian besar termasuk ke dalam struktur tanah laterit berkapur dengan humus yang tipis (terutama pada kawasan yang dekat dengan endapan kapur), pH tanah 6,5– >7. Keadaan iklim menurut klasifikasi Scmith dan Ferguson, dikelompokkan ke dalam iklim tipe A yaitu dengan curah hujan berkisar antara 2500–3500 mm per tahun, dengan suhu rata-rata saat ini antara 24-30ºC (BKSDA Sumatera Utara, 2003)
BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan tempat Penelitian
Sampel air yang diduga mengandung bakteri termofilik diambil dari sumber air panas Tinggi Raja, di Desa Tinggi Raja, Kecamatan Silau Kahean, Kabupaten Simalungun, Sumatera Utara. Isolasi, identifikasi sederhana dan pengujian bakteri dilakukan di laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Pelaksanaan kegiatan penelitian dilakukan dari Februari sampai Juli 2008.
3.2. Alat dan Bahan
Bahan yang dipergunakan dalam penelitian ini adalah air dari sumber air panas Tinggi Raja sebagai sumber pengambilan isolat. Media koloidal kitin yang dipreparasi dengan HCl 10 N. Media Garam Minimum Kitin tersusun atas MgSO4.7H2O 0,5 gram,
MnCl2 0,001 gram, KH2PO4 0,3 gram, K2HPO4 0,7 gram, FeSO4.7H2O 0,01 gram,
ZnSO4 0,001 gram dipreparasi dalam 1000 ml aquadest steril (Atlas, 1990). Tepung
agar-agar, indikator pH, bahan pewarnaan bakteri (kristal violet, iodin, aseton alkohol dan safranin). Untuk uji biokimia menggunakan media SIM, TSIA, SA, SCA, 2H202,
Peralatan yang dibutuhkan yaitu cawan petri, tabung reaksi, ose, hoki stik, kapas, alumunium foil, label, lampu Bunsen, voter, inkubator, otoklaf, botol sampel, botol erlenmeyer, pipet, propipet, kuvet, termometer, pH meter merek Hanna, GPS 60 merek Garmin, termos, sentrifus merek IEC Minimax, jangka sorong, shaker water bath merek Jilabo, mikroskop, spektrofotometer merek Shimadzu 1240
3.3. Pengambilan Sampel Air Panas
Sampel air sebagai sumber isolat diambil dan disimpan dalam botol sampel yang telah disterilkan. Isolasi bakteri dilakukan di laboratorium. Suhu dan pH air diukur pada saat pengambilan sampel air, juga pengukuran koordinat tempat pengambilan sampel airdengan menggunakan Geography Posisioning System (GPS).
3.4. Preparasi Koloidal Kitin
Koloidal kitin diperoleh dengan cara pembuatan koloidal kitin menurut metode Arnold dan Solomon (1986). Dalam metode ini digunakan 20 gram kitin diperoleh dari Laboratorium Penelitian FMIPA-USU. Kitin dihaluskan dan dilarutkan dalam 400 ml asam klorida, lalu didiamkan 24 jam pada suhu 4oC, kemudian disaring dengan glass wool dan diambil filtratnya. Filtrat ditambah 200 ml aquades dingin dan 10 N natrium hidroksida sampai pH 7, disentrifus pada kecepatan 6000 rpm selama 20 menit hingga berbentuk pelet. Pelet diresuspensi aquades, disentrifus 15 menit dan disimpan pada suhu 4oC (Rochima, 2006). Preparasi koloidal kitin disajikan dalam diagram alur pada Lampiran 1.
3.5. Preparasi Larutan Buffer Fosfat
Larutan buffer fosfat terdiri atas KH2PO4 (Y) dan K2HPO4 (X). Untuk pH yang
diinginkan yaitu 7,0 maka X gram yang dibutuhkan 8,6722 gram/L dan Y gram yang dibutuhkan 0,0218 gram/L. Larutan X dan Y diencerkan sampai 200 ml (Sudarmadji & Bambang, 1984).
3.6. Pembuatan Larutan Mc Farland
Untuk pembuatan larutan Mc Farland, bahan-bahan yang digunakan yaitu BaCl2
(1,175% 10/v. BaCl2.2H2O) dan H2SO4 (1% v/v). Komposisi larutan Mc Farland
ádalah 0,05 ml 0,048 M BaCl2 (1,175% 10/v. BaCl2.2H2O) pada 99,5 ml dari 0,35 N
H2SO4 (1% v/v) (Lorian, 1980).
3.7. Isolasi Dan Seleksi Bakteri kitinase
Sebanyak 1 ml air dari sumber air panas diinokulasikan ke dalam 10 ml media kitin padat dengan komposisi koloidal kitin ditambahkan garam minimum, tepung agar dan aquadest sesuai formulasi. Kultur tersebut disimpan dalam inkubator pada suhu termofil, 60oC. Kultur bakteri yang hidup dan membentuk zona halo diambil. Zona halo di sekitar koloni membuktikan bahwa bakteri tersebut adalah bakteri kitinase yang mampu mendegradasikan kitin (Rahayu, 2000).
Bakteri kitinase tersebut dibiakkan kembali pada media agar garam minimum kitin berikutnya agar diperoleh biakan murni. Isolat murni di inkubasi pada suhu 60oC
selama 1-5 hari. Zona halo diukur dengan menggunakan jangka sorong berdasarkan penampakan nilai hidrolisisnya. Alur kerja dipaparkan pada Lampiran 2 dan 3.
3.8. Karakterisasi Morfologi dan Biokimia Bakteri Kitinase
Isolat kemudian diseleksi lagi berdasarkan Indeks Kitinolitik (IK) yaitu perbandingan diameter halo dengan diameter koloni untuk memperoleh isolat yang potensial. Isolat yang telah diseleksi kemudian diidentifikasi secara morfologi untuk mengetahui bentuk sel, jenis gram bakteri, motilitas, spora, sifat aerob/anaerob (Rahayu, 2000).
Pengamatan motilitas dengan menggunakan medium semi padat Sulfide Indol
Motility (SIM), untuk mengamati sifat pewarnaan gram digunakan safranin, iodin,
aseton alkohol dan kristal violet. Uji biokimia meliputi uji sitrat (Simmons Citrate
Agar), uji katalase menggunakan larutan 3% H2O2, uji karbohidrat dengan media Triple Sugar Indol Agar, uji amilase dengan media Starch Agar dan uji oksidase dengan
menggunakan Bactident oxidase. Lampiran 4, memperlihatkan alur kerja karekterisasi morfologi dan biokimia bakteri kitinolitik.
3.9. Ekstrak Kitinase Kasar
Pembuatan kultur awal bakteri (starter) yaitu dengan menggunakan isolat bakteri kitinolitik sebanyak 108 sel/ml yang disuspensikan pada larutan fisiologis 0,85%
NaCl dan ditumbuhkan dalam 100 ml medium MGMC cair dengan pH 7 dan diinkubasi di atas water bath shaker merek Julabo dengan goncangan 120 rpm pada suhu ruang
selama 24 jam. Masing-masing starter (5% starter) dari bakteri kitinolitik ditumbuhkan dalam 100 ml medium MGMK cair dengan pH 7. Kultur diinkubasi di atas whater bath shaker dengan goncangan 120 rpm selama 72 jam pada suhu 60oC.
Enzim dipanen dengan cara sentrifugasi dengan menggunakan sentrifuse merek IEC Minimax. Medium kultivasi berkecepatan 6000 rpm selama 20 menit pada suhu ruang. Endapan yang terbentuk dibuang sedangkan supernatan yang diperoleh merupakan kitinase kasar, kemudian langsung diujikan. Alur kerja isolasi kitinase kasar dapat dilihat pada Lampiran 5.
3.10. Pengukuran Aktivitas Kitinase Kasar berdasarkan Pengaruh Suhu
Kitinase kasar dari masing-masing isolat dipipet sebanyak 3 ml dan ditambahkan subtrat kitin (1% koloidal kitin (b/v) dalam 50 mM buffer fosfat, pH 7) dengan volume yang sama dan diinkubasi pada suhu yang berbeda yaitu 50oC, 55oC, 60oC, 65oC dan
70oC selama 30 menit. Kisaran suhu yang digunakan dalam penelitian ini sesuai dengan pendapat Brock (1986) yang mengemukakan bahwa kecepatan tumbuh maksimal dari beberapa bakteri termofilik berkisar pada suhu optimal 55-70oC. Semua kultivasi dilakukan tiga ulangan. Reaksi dihentikan dengan cara terapi dingin 4oC selama 15 menit dan kemudian disentrifugasi pada kecepatan 6000 rpm selama 20 menit.
Campuran yang didinginkan, diambil supernatannya dan dimasukkan ke dalam tabung reaksi steril sebanyak 0,5 ml. Supernatan ditambahkan 0,1 ml larutan Na2B4O7
0,8 M dan dipanaskan selama 3 menit. Campuran didinginkan dan ditambahkan 3 ml larutan B (10 ml p-dimetilaminobenzaldehid 1% dalam asam asetat glasial + 10 ml HCl 1,25%). Campuran divortek dan diukur serapannya pada panjang gelombang 538 nm
(Wijaya, 2002). Densitas optik (OD538) diukur dengan menggunakan
spektrofotometer merk Shimadzu 1240.
Aktivitas kitinase dihitung berdasarkan selisih antara kadar N-asetil glukosamin (GlcNAc) yang dibebaskan pada perlakuan dengan kadar GlcNAc yang terdapat dalam kitinase kasar yang tidak diperlakukan (kontrol). GlcNAc yang dihasilkan dianalisis secara kolorimetri dengan metode Reissig (1955) dalam Jeanoux (1966). Satu unit aktivitas kitinase didefinisikan sebagai jumlah enzim yang membebaskan sebanyak 1 µmol GlcNAc/jam pada kondisi tertentu (Sing et al, 1999). Alur kerja penentuan kadar (GlcNAc) pada sampel dapat dilihat pada Lampiran 6.
Aktifitas kitinase dihitung berdasarkan N-asetilglukosamin yang terbentuk dari hidrolisis kitin seperti pada persamaan berikut :
A = [N – AGA] x 1000 x 2 x t BM N - AGA
Dimana :
A = aktivitas
[N-AGA] = konsentrasi N-asetilglokosamin
[BM N-AGA]= Berat Molekul N-Asetilglukosamin
Satu unit (U) aktivitas enzim setara dengan 1 µmol N-asetilglokosamin yang dihasilkan selama satuan inkubasi (Wijaya, 2002).
3.11. Analisis Data
Data berupa hasil pengamatan morfologi dan biokimia dipaparkan secara deskriftif, sedangkan hasil berupa data kuantitatif pengaruh suhu dilakukan perhitungan statistik analisa varian dilanjutkan dengan uji Duncan (Hanafiah, 1993). Mengingat semua media dan kondisi lingkungan serta perlakuan terhadap kitinase kasar dikondisikan sama kecuali perlakuan suhu aktivitas enzim, maka dilakukan perhitungan dalam Rancangan Acak Lengkap Tunggal. Perlakuan suhu terhadap kitinase kasar adalah rentang suhu termofil antara 50–70oC sebanyak 3 kali ulangan. Parameter yang diukur adalah konsentrasi GlcNAc (µg/ml) terhadap berbagai kondisi suhu.
Data hasil penelitian dihitung dalam struktur tabel sidik ragam yang disajikan sebagai berikut :
Tabel 1. Struktur tabel sidik ragam
Ftabel
Sumber keragaman
Derajat bebas
Jumlah kuadrat Kuadrat tengah Fhitung 0.05 0.01 Perlakuan Galat p-1 P(n-1) ∑( ∑ Yij )2/n-FK JKt - JKp JKPerl/dbPerl JKG / dbG KTP / KTG Tabel F α(0.05) Tabel F α (0.01) Total P(n-1) JKtotal
Pengujian hipotesis dilanjutkan bila nilai Fhitung > Ftabel maka hipotesis nol ditolak yang
GlcNAc (µg/ml), dialanjutkan dengan uji Duncan Multiple Range Test (DMRT) untuk melihat jarak antar perlakuan suhu (Hanafiah, 1993).
BAB IV
HASIL DAN PEMBAHASAN
4.1. Isolasi Dan Seleksi Bakteri kitinase Termofilik
Isolasi bakteri dilakukan dengan metode agar sebar pada media agar garam minimum kitin pH 7,0 (pH rata-rata di lokasi sumber air panas Tinggi Raja). Dengan teknik biakan murni diperoleh 32 isolat tunggal bakteri kitinase dari Tinggi Raja. Masing-masing isolat tunggal diinokulasikan kembali pada media selektif kitin untuk mengamati dan mengukur zona hidrolitik yang terbentuk. Zona hidrolitik diamati pada hari keempat dengan diameter rata-rata 9–49 mm.
Seluruh tahap inkubasi pada proses isolasi dan seleksi dilakukan pada suhu tinggi (65oC). Suhu tinggi dimaksudkan agar bakteri kitinolitik yang terseleksi merupakan bakteri penghasil kitinase yang memiliki aktivitas optimum dan stabilitas tinggi pada suhu tinggi.
Untuk mengetahui produksi kitinasenya dapat dilihat dari warna medium menjadi lebih transparan (terbentuknya zona halo) di sekeliling koloni bakteri. Zona bening/halo dapat dilihat pada Gambar 3. Warna medium transparan disebabkan oleh enzim kitinase yang dikeluarkan ke dalam medium merupakan metabolit yang tidak berwarna (membentuk zona bening di sekitar koloni bakteri). Kitinase merupakan enzim ekstraseluler yang dihasilkan bakteri kitinolitik yang berperan penting dalam menghidrolisis kitin (Tsujibo et al., 1999). Enzim ekstraseluler adalah enzim yang
dihasilkan di dalam sel, tetapi dikeluarkan ke dalam medium tumbuhnya (Wijaya, 2002). a b TR 1 TR 2 TR 4 TR 5 TR 3
Gambar 3. Beberapa isolat dengan zona bening(a) di sekitar koloni bakteri(b) pada hari ketiga
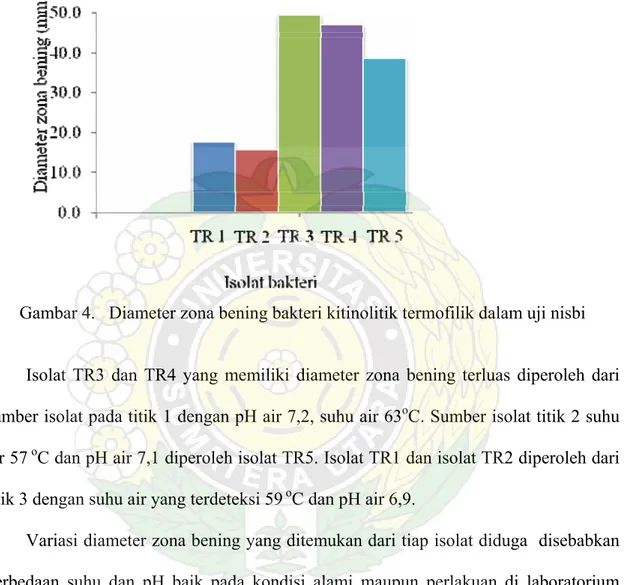
Lima isolat yang memiliki zona bening terlebar adalah isolat TR1 diameter zona bening 17,60 mm, isolat TR2 diameter zona bening 15,53 mm, TR3 diameter zona bening 49,44 mm, TR4 diameter zona bening 46,94 mm dan isolat TR5 diameter zona bening 38,65 mm. Besar kecilnya zona bening sangat tergantung pada kemampuan bakteri untuk memproduksi kitinase yang sangat bervariasi. Perbedaan tersebut mungkin disebabkan perbedaan kecil pada gen yang mengkodenya (Tronsmo & Harman, 1993).
Gambaran lebar diameter zona bening dapat dilihat pada Gambar 4 berikut :
Gambar 4. Diameter zona bening bakteri kitinolitik termofilik dalam uji nisbi Isolat TR3 dan TR4 yang memiliki diameter zona bening terluas diperoleh dari sumber isolat pada titik 1 dengan pH air 7,2, suhu air 63oC. Sumber isolat titik 2 suhu
air 57 oC dan pH air 7,1 diperoleh isolat TR5. Isolat TR1 dan isolat TR2 diperoleh dari titik 3 dengan suhu air yang terdeteksi 59 oC dan pH air 6,9.
Variasi diameter zona bening yang ditemukan dari tiap isolat diduga disebabkan perbedaan suhu dan pH baik pada kondisi alami maupun perlakuan di laboratorium selama penelitian berlangsung. Seperti dikemukakan Lehninger (1998), bahwa aktivitas suatu enzim dipengaruhi oleh beberapa faktor, yaitu pH, konsentrasi subtrat dan enzim, suhu dan adanya aktivator atau inhibitor.
Berdasarkan data observasi yang memberikan informasi hasil pengukuran pH air yang diperoleh dari sumber air panas berkisar antara 6,9-7,2 atau rata-rata pH 7, maka perlakuan pengaruh pH tidak dilakukan mengingat kisaran pH dari ketiga tempat pengambilan sumber isolat berada pada pH normal dengan hasil aktifitas kitinase kasar sudah maksimal.
4.2. Karakterisasi Morfologi dan Biokimia Bakteri Kitinase
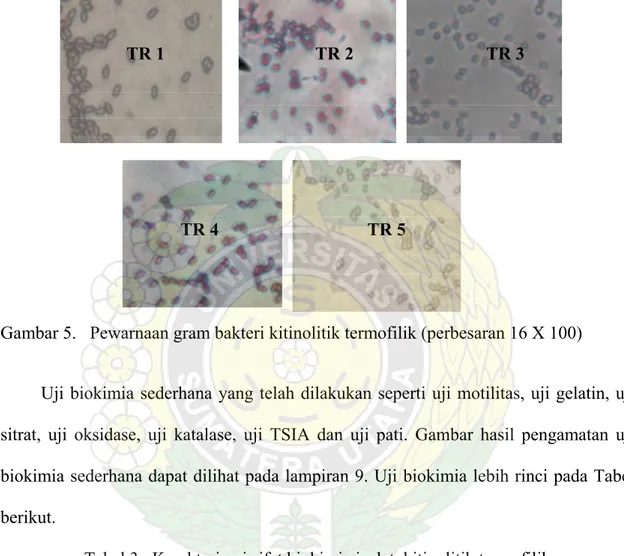
Menurut Lay (1994), koloni yang tumbuh di atas lempengan agar, perlu diperhatikan warna, sifat tembus cahaya, pinggiran (tepi), sifat permukaan (elevasi) dan bentuknya. Hal ini memungkinkan diperoleh ciri-ciri morfologi koloni bakteri. Tahap penting yang juga harus dilakukan dalam pencirian dan pengidentifikasian bakteri adalah proses pewarnaan gram yang merupakan proses pewarnaan diferensial.
Hasil pengamatan morfologi koloni dan morfologi bakteri dapat dilihat dalam Tabel 1 berikut.
Tabel 2. Karakteristik morfologi bakteri kitinolitik termofilik asal Tinggi Raja
Morfologi Koloni Morfologi Bakteri
Kode
Isolat Warna Bentuk Tepi Elevasi Bentuk Penataan warna gram
TR 1 TR 2 TR 3 TR 4 TR 5 putih putih krem putih krem bulat bulat bulat bulat bulat gelombang rata rata gelombang rata tinggi cembung cembung cembung cembung bulat batang bulat batang bulat diplo strepto diplo strepto strepto ungu merah ungu merah merah + - + - -
Dari warna koloni, 2 isolat yaitu TR3 dan TR5 berwarna krem sedang TR1, TR2, dan TR4 koloni berwarna putih. Bentuk koloni umumnya sirkuler, koloni TR1 dan TR4 bertepi gelombang sedang yang lain rata. Permukaan koloni umumnya cembung kecuali TR1.
Setelah proses pewarnaan dapat dilihat morfologi bakteri. Bentuk bervariasi antara kokus dengan basil dan penataan bakteri bervariasi antara diplo dengan strepto. TR1 dan TR3 memiliki persamaan bentuk, penataan, warna dan sifat gram yaitu bentuk diplococus, warna ungu dan sifat gram positif. TR2 dan TR4 juga memiliki persamaan, bentuk dan penataan bakteri streptobasil dengan warna bakteri merah menunjukkan uji gram negatif.
Menurut Lay (1994), bakteri gram positif pada pewarnaan gram berwarna ungu disebabkan kompleks zat warna kristal violet-yodium tetap dipertahankan meskipun diberi larutan pemucat aseton alkohol. Sedangkan gram negatif berwarna merah sebab kompleks tersebut larut pada saat pemberian aseton alkohol dan mengambil warna merah safranin.
Perbedaan warna menunjukkan perbedaan struktur dinding sel bakteri. Umumnya bakteri gram negatif memiliki dinding sel dengan kandungan lipida yang tinggi, sehingga lipida larut oleh aseton alkohol. Sedangkan bakteri gram positif memiliki struktur dinding sel berkomposisi peptidoglikan yang membentuk persenyawaan kompleks kristal violet-yodium ribonukleat dan tidak larut dalam aseton alkohol. Hasil pewarnaan bakteri dapat dilihat pada Gambar 5 berikut
TR 1 TR 2 TR 3 TR 4 TR 5
Gambar 5. Pewarnaan gram bakteri kitinolitik termofilik (perbesaran 16 X 100)
Uji biokimia sederhana yang telah dilakukan seperti uji motilitas, uji gelatin, uji sitrat, uji oksidase, uji katalase, uji TSIA dan uji pati. Gambar hasil pengamatan uji biokimia sederhana dapat dilihat pada lampiran 9. Uji biokimia lebih rinci pada Tabel berikut.
Tabel 3. Karakterisasi sifat biokimia isolat kitinolitik termofilik
Isolat TSIA SA Gelatin SIM SCA Katalase Oksidase
TR 1 TR 2 TR 3 TR 4 TR 5 M - K M - M M - K M - K M - K + + + + + - + - + - + + + + + - - + - - + - - + + + + + + +
Keterangan : Merah (M) Starch agar (SA)
Kuning (K) Triple sugar iron agar (TSIA)
Reaksi yang terlihat pada TSIA menurut Lay (1994) adalah bila slant (basa) berwarna merah dan butt (asam) berwarna kuning artinya bakteri tersebut mampu memfermentasikan glukosa, dapat diamati pada isolat TR1, TR3, TR4 dan TR5. TR2, slant dan butt berwarna merah yang berarti tidak mampu memfermentasikan ketiga jenis gula (glukosa, laktosa atau sukrosa).
Pada uji pati semua isolat memberikan hasil yang positif dengan adanya zona bening di sekitar koloni yang telah diinkubasi selama 24 jam ketika ditetesi dengan beberapa tetes larutan lugol pada permukaan koloni. Hal ini menandakan bahwa isolat tersebut mampu menghidrolisis pati. Pada uji gelatin hanya isolat TR2 dan TR4 menunjukkan hasil yang positif dengan mencairnya media gelatin yang ditumbuhi mikroorganisme setelah dimasukkan ke dalam kulkas selama 30 menit. Motilitas diamati dengan menggunakan médium semi padat SIM. Hasil uji menunjukkan bahwa 5 isolat bersifat motil yang ditandai dengan jejak pergerakan bakteri di dalam medium. Hasil uji sitrat yang ditandai dengan perubahan media dari hijau menjadi biru, mengindikasikan hanya isolat TR3 yang mampu menggunakan Na sitrat sebagai satu-satunya sumber karbon. Dari uji katalase dengan penambahan larutan 3% H2O2
mengindikasikan bahwa isolat TR2 dan TR3 tidak memiliki enzim katalase yang ditandai dengan tidak terbentuknya gelembung udara disekitar koloni tapi pada isolat TR1, TR4 dan TR5 uji bersifat katalase positif.
Semua isolat menunjukkan uji positif untuk oksidase. Uji positif oksidase ditandai dengan perubahan warna koloni menjadi hitam saat ditetesi dengan reagen dimetil-p-fenillendiamin dalam waktu 30 menit. Menurut Lay (1994), perubahan warna disebabkan oksidase sitokrom mengoksidasikan larutan reagen. Reagen yang dioksidasekan berwarna hitam, hal ini tidak terjadi bila terjadi reaksi reduksi.
Uji katalase dilakukan untuk membuktikan adanya enzim katalase yang berfungsi dalam penguraian H2O2 yang bersifat racun. Pada uji gelatin dapat diketahui
kemampuam mikroorganisme dalam menghidrolisis gelatin. Uji positif gelatinase ditandai dengan medium gelatin yang tetap cair setelah dimasukkan ke dalam lemari pendingin selama 30 menit, sedangkan uji positif sitrat ditandai dengan berubahnya medium dari warna hijau menjadi biru karena terjadi penghilangan asam dan peningkatan pH media.
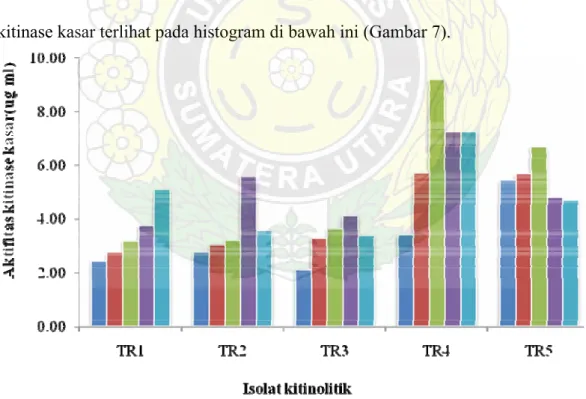
4.3. Pengaruh Suhu Terhadap Aktivitas Kitinase Kasar
Pengujian pengaruh suhu terhadap aktifitas kitinase kasar dilakukan pada lima isolat yang telah dikarakterisasikan. Uji ini dilakukan dengan menggunakan medium kitin cair untuk mengetahui kemampuan kelima isolat dalam merombak kitin secara kuantitatif. Data hasil pengamatan tertera pada Tabel 3 berikut.
Tabel 4. Aktifitas kitinase kasar pada suhu berbeda.
Notasi No. Isolatkode Suhu( oC)
Rata-rata Konsentrasi GlcNAc (µg/ml) Rata-rata Konsentrasi GlcNAc (Unit) 0,05 1 TR 1 50 2.4314 0.011 d 55 2.7753 0.013 Cd 60 3.1742 0.014 C 65 3.7363 0.017 B 70 5.1025 0.023 A 2 TR 2 50 2.7807 0.013 -55 3.0498 0.014 -60 3.1943 0.014 -65 5.5827 0.025 -70 3.5710 0.016 -3 TR 3 50 2.0862 0.009 B 55 3.2731 0.015 Ab 60 3.6277 0.016 A 65 4.1190 0.019 A 70 3.3976 0.015 A 4 TR 4 50 3.4063 0.015 C 55 5.7275 0.026 Bc 60 9.1871 0.042 A 65 7.2493 0.033 Ab 70 7.2578 0.033 Ab 5 TR 5 50 5.4462 0.025 B 55 5.6882 0.026 B 60 6.6861 0.030 A 65 4.8114 0.022 C 70 4.7158 0.021 D
Keterangan : Notasi berdasarkan hasil uji Duncan, angka-angka yang diikuti oleh huruf dan pada kolom yang sama artinya tidak berbeda nyata
Aktifitas kitinase dihitung berdasarkan N-asetilglukosamin yang terbentuk dari hidrolisis kitin. Satu unit aktivitas kitinase didefinisikan sebagai jumlah enzim yang membebaskan sebanyak 1µmol GlcNAc/jam pada kondisi tertentu (Sing et al, 1999).
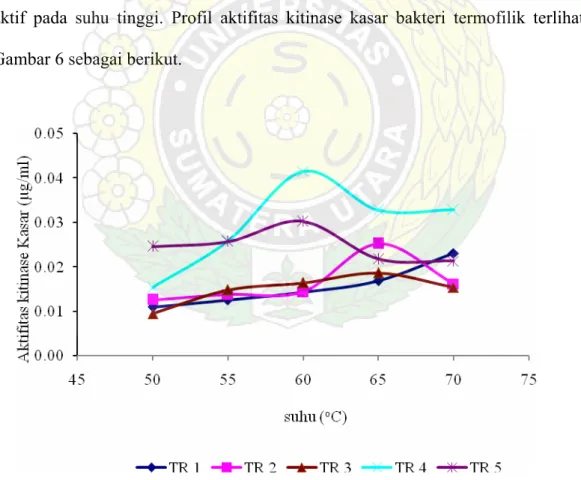
Aktifitas kitinase kasar akan semakin meningkat seiring dengan kenaikan suhu sampai ke tingkat optimal, setelah itu menurun. Penurunan aktifitas kitinase diduga karena enzim mengalami denaturasi sehingga kehilangan sebagian aktifitasnya. Hasil pengukuran aktifitas kitinase kasar bakteri termofilik asal Tinggi Raja menunjukkan suhu optimal masing-masing spesies.
Suhu optimum aktifitas kitinase TR1 belum dapat ditetapkan sebab sampai suhu tertinggi yang diujikan (suhu 70oC) aktifitasnya masih meningkat. Walaupun demikian, dari data dapat diketahui bahwa kitinolitik yang dihasilkan TR1 adalah kitinolitik yang aktif pada suhu tinggi. Profil aktifitas kitinase kasar bakteri termofilik terlihat pada Gambar 6 sebagai berikut.
TR2 menunjukkan aktifitas yang tinggi pada suhu 65oC dan aktifitas menurun pada suhu 70oC. Seperti halnya TR2, aktifitas kitinase TR3 juga menunjukkan suhu
optimum 65oC namun berbeda pada aktifitas kitinase kasar yang dihasilkan. TR4 dan TR5 menunjukkan suhu optimum aktifitas kitinase kasar yakni 60oC untuk kemudian aktifitas kitinase menurun pada suhu 70 oC
Menurut Rochima (2006), meningkatnya suhu menyebabkan energi kinetik enzim semakin tinggi. Akibatnya, gerakan vibrasi, translasi dan rotasi enzim dengan subtrat akan meningkat sehingga peluang keduanya bereaksi bertambah besar. Pemanasan pada suhu 55-70 oC menyebabkan protein labil akan terdenaturasi. Untuk lebih jelas, aktifitas kitinase kasar terlihat pada histogram di bawah ini (Gambar 7).
Dari hasil pengamatan ditemukan adanya perbedaan nilai aktifitas berdasarkan besarnya zona bening yang terbentuk dengan kemampuan menghasilkan enzim. TR3 yang memiliki zona bening terbesar ternyata memiliki kemampuan menghasilkan enzim kasar yang tak sebanding, sebaliknya isolat TR1 memiliki zona bening yang relatif kecil jika dibandingkan dengan isolat TR3, tetapi memiliki enzim yang tinggi pada suhu diatas 70oC. Pada suhu tersebut TR1 masih menunjukkan peningkatan nilai aktifitas kitinase totalnya. Diduga zona bening yang terbentuk pada saat itu kecil disebabkan karena kondisi suhu yang diinginkan isolat TR1 tidak optimum. Pada uji nisbi yang dilakukan menunjukkan fase pertumbuhan TR1 memiliki fase lag yang panjang sebelum sampai ke fase log. Hal ini terlihat pada pengukuran hari ke tujuh TR1 menunjukkan diameter zona bening dan koloni terus melebar, pada TR3 menunjukkan diameter zona bening dan koloni yang sama dengan hari ketiga (tetap).Seperti yang dilaporkan Yurnaliza (2001), beberapa faktor seperti perbedaan jenis mikroorganisme, kecepatan pertumbuhan setiap isolat pada medium padat dan cair, jumlah inokulum yang diberikan pada kedua medium, dan tipe enzim kitinase yang dihasilkan, diduga menjadi penyebab tidak berkorelasinya nilai aktivitas hidrolisis secara kualitatif dengan nilai aktivitas enzim secara kuantitatif.
Kehadiran enzim kitinolitik pada medium pertumbuhan dapat dilihat dari reaksi pelepasan GlcNAc dari koloidal kitin. Jeuniaux (1966), melaporkan kitinase mampu
menghidrolisis kitin menjadi kitobiose dan kitotriose, serta asetiglukosamin bebas juga dapat dihasilkan terutama ketika substrat dalam bentuk koloidal kitin.
Kemampuan bakteri untuk memproduksi kitinase sangat bervariasi, mungkin disebabkan perbedaan kecil pada gen yang mengkodenya (Tronsmo & Harman, 1993). Nilai aktifitas unit enzim µmol/ml diperoleh dari konsentrasi kitinase kasar µg/ml berbanding terbalik dengan berat molekul N-asetil glukosamin dalam satuan waktu inkubasi.
Setiap spesies memiliki variasi terhadap perlakuan suhu yang berimplikasi terhadap diproduksi dan disekresikannya enzim ke dalam medium. Beda sangat nyata dicatat sebagai rentang suhu optimum bakteri termofilik dalam menghasilkan kitinase kasar yang ditandai dengan besar aktifitas kitinase kasar yang terdeteksi oleh spektrofotometer.
Hasil uji statistik sidik ragam yang digunakan untuk setiap isolat menunjukkan bahwa untuk TR1 suhu memberikan pengaruh nyata pada α = 5%. Aktifitas pada suhu 70oC berbeda nyata terhadap suhu 50oC, 55oC, 60oC, dan 65oC, sedangkan aktifitas pada suhu 50 oC dan 55 oC berbeda tidak nyata. Hasil uji sidik ragam pada isolat TR 2 tidak memberikan pengaruh terhadap perlakuan suhu.
Pada TR 3 aktifitas kitinase pada suhu 65oC berbeda nyata terhadap suhu 50oC tetapi berbeda tidak nyata terhadap suhu 60oC ,70oC dan 55oC. Aktifitas kitinase pada
suhu 60oC berbeda nyata terhadap suhu 50oC, tapi berbeda tidak nyata terhadap aktifitas kitinase pada suhu 70oC dan 55oC. Aktifitas kitinase pada suhu 70oC berbeda
nyata dengan suhu 50oC tapi berbeda tidak nyata terhadap aktifitas kitinase pada suhu 55oC.
Pada TR4 aktifitas kitinase pada suhu 60oC, berbeda nyata dengan aktifitas kitinase pada suhu 50 oC, tetapi berbeda tidak nyata terhadap aktifitas kitinase pada 65oC dan 70oC. Aktifitas kitinase pada suhu 70oC berbeda nyata terhadap perlakuan suhu 50oC tetapi tidak nyata terhadap aktifitas kitinase pada suhu 65oC.
Pada TR5 aktifitas kitinase pada suhu 60oC berbeda nyata terhadap perlakuan suhu 70oC, 65oC, 55oC dan 50oC. Aktifitas kitinase pada suhu 55oC berbeda nyata terhadap suhu 70oC, 65oC dan 60oC tetapi berbeda tidak nyata dengan aktifitas kitinase pada suhu 50oC. Aktifitas kitinase pada suhu 50oC berbeda nyata dengan aktifitas kitinase pada suhu 65oC. Perhitungan sidik ragam dapat dilihat pada lampiran 11.
Hasil pengukuran aktifitas enzim pada berbagai suhu memperlihatkan beberapa puncak aktifitas enzim kasar, kecuali isolat TR1 yang masih menunjukkan peningkatan kadar konsentrasi N-asetil glukosamin walaupun telah berada pada suhu 70oC . Hal ini
jelas terlihat pada hasil uji jarak Duncan, pada rentang 60oC-70oC setiap isolat menunjukkan hasil beda sangat nyata yang identik dengan rentang suhu optimum untuk aktifitas U/ml kitinase kasar.
Variasi aktifitas kitinase kasar tersebut selain dipengaruh oleh temperatur juga dipengaruhi oleh jenis dan komposisi media, fase pertumbuhan bakteri itu sendiri, kemampuan bakteri dan koloninya dalam mengekstraksi enzim kasar. Variasi ini tidak saja terlihat dari jumlah aktivitas kitinase total yang diproduksi setiap speciesnya, tetapi
juga pada jenis kitinase yang dihasilkan. Semua enzim yang dapat mendegradasi kitin, disebut kitinase total atau kitinase non-spesifik (Nugroho et al., 2003).
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan beberapa hal sebagai berikut :
a. Dari 32 isolat yang berasal dari sumber air panas Tinggi Raja diperoleh 5 isolat bakteri termofilik penghasil kitinase yang memiliki zona bening terbesar.
b. Kelima isolat memiliki karakteristik biokimia dan morfologi yang berbeda. c. Isolat TR3 menghasilkan zona bening terbesar 49,44mm.
d. Isolat TR1 menunjukkan aktifitas kitinase tertinggi dan masih terus meningkat pada suhu 70oC.
5.2. Saran
Berdasarkan hasil penelitian terhadap bakteri kitinolitik termofil dari Tinggi Raja maka perlu dilakukan penelitian lanjutan, sehingga dapat ditetapkan waktu pemanenan, pH dan faktor fisik lain yang memungkinkan diperolehnya kondisi optimal agar kitinase termofil dapat maksimal diproduksi.
Isolat TR1 agar ditindaklanjuti dalam penelitian berikutnya, sebab kemampuan memproduksi kitinase kasar yang tahan terhadap suhu panas dalam penelitian ini belum terdeteksi secara tuntas.
DAFTAR PUSTAKA
Aguilar, C.F.I. Sanderson, M. Moracci, M. Claramella, R. Nucci, M. Rossi & L.H. Pearl. 1998. Crystal Structure Hyperthermophilic Archeon Sulfolobus
solfatoricus as a Key Factor In Thermostability, Mol. Biol, 271:789-802
Arnold, L.D. & Solomon, N.A. 1986. Manual Industrial Microbiology, American Society for Microbiology, Washington D.C.
Atlas, R.M. 1990. Handbook of Media for Enviromental Microbiologi, University Of Louisville CRC Perss, Boca Roton, New York.
Baldwin, E. 1973. Dynamyc Aspects of Biochemistry, Cambridge : University Perss. Bielka, H. H.B.F. Dixon, P. Karlson, C. Liebeeg, N. Sharon, F. J. Van Lenten, S.
F.Velix, J. F. G. Vliegenhart & E. C. Webb. 1984. Enzyme Nomenclature.Academic Press, Inc. New york.
BKSDA Sumatera Utara. 2003. Rencana Pengelolaan Cagar Alam Dolok Tinggi Raja Kabupaten Simalungun, Balai Konservasi Sumber Daya Alam, Sumatera Utara : 447-465
BKSDA Sumatera Utara. 2003. Laporan Evaluasi Fungsi Kawasan Cagar Alam Dolok Tinggi Raja Kabupaten Simalungun Tahun 2003 Balai Konservasi Sumber Daya Alam Sumatera Utara :18-19
Brock,T.D. 1986. Thermophiles: General, Moleculer & Applied Microbiology, University of Wisconsin – Madison, USA.
Cabib, E. 1987. The Synthesis & Degradation of Chitin. Dalam A. Meister (Ed) Advances in Enzymology. An Interscience Publication John Willey & Sons Inc. New York. 59 : 59-101
Chasanah, E.2004. Characterization of chitosanase of Bacillus licheniformis MB-2 from Manado hot spring water. J. Mikrobiol. Institut Pertanian Bogor.
Chernin, L.S. Michael, K.W. Jacquelyn, M. T. Shoshan, H. Barrie, W.B. Cheat, W & Gordon, S.A. B, Stewart. 1998. Chitinolytic Activity in Chromobacterium
Cohen-Kupiec R & Chet, I. 1998. The Molecular Biology of Chitin Digestion, Curr. Opinion Biothecnol. 93: 331-334
Darwis, A.A. & Sunarti, T.C.1992. Teknologi Mikrobial, Institut Pertanian Bogor. Edward, C. 1990. Thermophiles, Microbiology of Extreme Environtments. Alden Perss,
oxford.
Gao, J. M.W. Bauer, K.R. Shockley, M.A. Pysz, & R.M. Kelly. 2003. Growth of Hiperthermophilic Archaeon Pyrococcus furiosus on Chitin Involves Two Family 18 Chitinases. Appl. Environ. Microbiol. 69: 319-3128
George, G. 2001. Bergey’s Manual of systematic bacteriology. Springer–verling, New York, USA. Vol. 1
Girindra, A.1993. Biokimia I, Cetakan 3, Jakarta, Gramedia, 100-101
Haran, S. & Chet, I. 1995. New Components of the Chitinolytic System of
Thrichoderma harzianum, Mycol Rev. 94 : 441-446
Harman, G.E. Hayes, C.K. Lorito, M. Broadway, R.M. Di Pietro, A. Peterbauer, C. & Tronsmo A.1993. Chitinolytic Enzymes of Trichoderma harzianum: Purification of Chitobiosidase & Endochitinase. Phytopathology. 83: 313-318 Hanafiah, K.A. 1993. Rancangan Percobaan: Teori dan Aplikasi, F.P. Universitas
Sriwijaya Palembang, PT RajaGrafindo Persada, Jakarta, 68
Inbar, J. & I. Chet. 1991. Evidence That Chitinase Produced by Aeromonas caviae is Involved in The Biological Control of Soil-Borne. Plant Pathogens by The Bacterium Soil Biol. Biochem. 23: 973-978
Indrajaya, W. F.M. Akhmaloka. 2003. Isolation & Identification of Thermophilic Microorganism from Wayang Crater, J. Mikrobiol. 8: 53-56
Jayanti, J.F.L. 2002. Thermostable Chitinase & Chitin Deacetylase From Manado Isolates. Skripsi Sarjana Jurusan Teknologi Pangan dan Gizi. Institut Pertanian Bogor.
Jeaniaux, C. 1966. Chitinases, Dalam E, F. Neufeld & V. Ginburg (Eds.) Complex Carbohydrates. Methods in Enzymology. Academic Press, New York. 8: 644-650
Khairul. 2007. Tinggi Raja Salju di tengah Air Panas, <http://Khairulid.blogspot.com> (13 Maret 2005)
Lay, B.W. 1994. Analisa Mikroba di Laboratorium. Edisi 1. Cetakan 1. Jakarta: PT Raja Grafindo Persada. 99-100 p.
Lehninger, A.L. 1997. Dasar-Dasar Biokimia, alih Bahasa Maggy Thenawijaya, Jilid 1, Jakarta, Erlangga. 235-274
Lestari, P. 2000. Eksplorasi Enzim Termostabil dari Mikroba Termofil, fakultas Biologi, Univ. Jendral Sudirman, Purwokerto. J. Hayati. l7: 21-25
Lloyd, A. B., R. L. Noveroske & J. L. Lockwood. 1965. Lysis of Fungal Mycelium by
Streptomyces spp. and Their Chitinase Systems. Phytopathology. 55: 871–875.
Lorian,V, N.D. 1980. Antibiotic In Laboratory Medicine. Williams & Wilkins. Baltimore. London.
Madigan, M.T. 1997, Extremophiles Scientific American. 82-87
Meidina, Sugyono, Jenie, B.S.L. Suhartono, M.T. 2005. AktifitasAntibakteri Oligomer Kitin yang Diproduksi Menggunakan Kitin Dari Isolat B. licheniformis MB-2, Departemen Teknologi Pangan dan Gizi, Institut Pertanian Bogor, Bogor.288-293
Murray, R.K.,Granner, D.K., Rodwell, V.W., 2003, Biokimia, Jakarta , EGC. 70-102 Muzzarelli, R.A. A. 1985. Chitin, Dalam G. O. Aspinal (Ed.) The polysaccharides.
Academic Press Inc., New York. 3:41-7450
Nugroho, T.T. Ginting, C. Ali, M. Dahliaty, A. Wahyuningsih, Devi, S. & Sukmarisa, Y. 2003 Isolasi dan Karakterisasi Sebagian Kitinase Trichoderma viride, J. Natur Indonesia. 5:101-106
Paulitz, T.C. & Belanger, R.R. 2001. Biological Control In Greenhouse Systems Annu. Rev. Phytopathol. 39: 123-133
Priyatno, T.P. Sudjono, M.S. Y. Chaerani, Suryadi, & Sudjadi, M. 2000. Tehnik Produksi Dan Formulasi Bakteri Kitinolitik Untuk Pengendalian Penyakit Karat Kedelai. J. Natur Indonesia. 5: 229-235