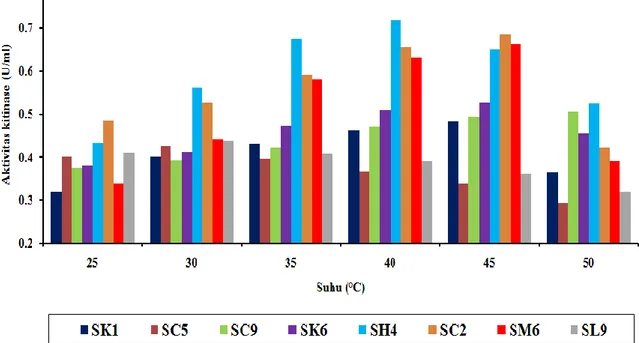
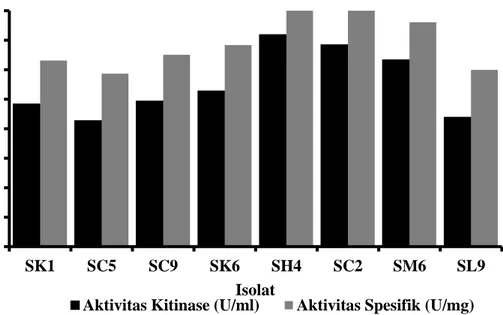
ISOLASI BAKTERI KITINOLITIK DARI SALURAN PENCERNAAN BEBERAPA HEWAN PEMAKAN SERANGGA
DAN KARAKTERISASI KITINASE KASAR
SKRIPSI
DAVID BARITA U. SIADARI 120805084
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DAVID BARITA U. SIADARI 120805084
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2017
PERSETUJUAN
Judul : Isolasi Bakteri Kitinolitik dari Saluran Pencernaan : Beberapa Hewan Pemakan Serangga dan
: Karakterisasi Kitinase Kasar
Kategori : Skripsi
Nama : David Barita U. Siadari
Nomor Induk Mahasiswa : 120805084
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, April 2017
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dr. It Jamilah, M.Sc. Prof. Dr. Dwi Suryanto, M.Sc.
NIP. 196404281999032002 NIP. 196404091994031003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
ISOLASI BAKTERI KITINOLITIK DARI SALURAN PENCERNAAN BEBERAPA HEWAN PEMAKAN SERANGGA
DAN KARAKTERISASI KITINASE KASAR
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2017
David Barita U. Siadari 120805084
PENGHARGAAN
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas kasih dan anugerahNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Isolasi Bakteri Kitinolitik dari Saluran Pencernaan Beberapa Hewan Pemakan Serangga dan Karakterisasi Kitinase Kasar”. Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Terimakasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc. selaku dosen pembimbing 1 dan Ibu Dr. It Jamilah, M.Sc. selaku dosen pembimbing 2 yang telah memberi bimbingan dan banyak masukan selama pelaksanaan penelitian dan penyusunan skripsi ini. Ucapan terimakasih juga penulis ucapkan kepada Ibu Dra. Nunuk Priyani, M.Sc. dan Bapak Drs. Nursal, M.Si. selaku dosen penguji yang telah memberi banyak masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Ucapan terimakasih juga penulis sampaikan kepada Ibu Dr. Saleha Hannum, M.Si. selaku Ketua Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Bang Endra Raswin dan Ibu Roslina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Ucapan terimakasih terbesar, penulis sampaikan kepada almarhumah Ibunda tercinta, Tiawan Purba, yang telah memberikan doa, dukungan, semangat, kesabaran, perhatian, pengorbanan dan kasih sayang yang begitu besar kepada penulis, dan juga kepada Almarhum Ayahanda J. Siadari yang telah memberikan dukungan. Penulis juga mengucapkan terima kasih kepada kakak Dameria Siadari, Asima Siadari yang selalu memberikan doa, semangat, pengorbanan dan kasih sayang dan, mengingatkan untuk selalu bersyukur dan mengandalkan Tuhan Yesus dalam setiap rencana. Terimakasih juga penulis ucapkan abang Pauli Rikardo dan Pio bestua Siadari yang selalu memberi dukungan dan mengajarkan penulis untuk selalu bertanggung jawab. Skripsi ini penulis hadiahkan kepada almarhumah Ibunda, penulis berjanji selalu menjadi pribadi yang membanggakan.
Terimakasih kepada keluarga penulis terkhusus keluarga besar Siadari yang telah memberi doa dan dukungannya.
Ucapan terimakasih penulis kepada Andrew Sinaga, Maretta Silaban, Tryas Johana, Freddy, Rita, Samuel, Aditya, Bobby, Gagah, Nolo, Agustono, Yolanda, Villa, Melva, Mei, Venna, Rina, Evi, Ester, Henda, Naomi, Ihsan, Deby, Firda, Dwi febrina, Ilham, Bobby Panggabean, Ilham, Evan, Yudi dan teman- teman AOC 2012 yang tidak bisa disebutkan satu persatu yang telah memberikan bantuan dan indahnya sebuah persahabatan serta saling memberi semangat kepada penulis. Terimakasih penulis ucapkan kepada rekan-rekan Asisten Laboratorium Pengelolaan Sumber Daya Alam dan Lingkungan tahun 2015-2017. Terimakasih
telah memberi bantuan kepada penulis.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. Semoga Tuhan Yang Maha Pengasih membalas semua kebaikan dan ketulusan kita. Amin.
Medan, April 2017
Penulis
ISOLASI BAKTERI KITINOLITIK DARI SALURAN PENCERNAAN BEBERAPA HEWAN PEMAKAN SERANGGA
DAN KARAKTERISASI KITINASE KASAR
ABSTRAK
Amfibi dan reptil kecil memperoleh makanan dengan memakan serangga kecil seperti nyamuk. Saluran pencernaan hewan merupakan habitat alami bagi bakteri, seperti bakteri kitinolitik. Oleh karena itu, hewan ini dapat menjadi sumber bakteri kitinolitik penghasil kitinase potensial. Penelitian ini bertujuan untuk memperoleh isolat bakteri kitinolitik dan mengetahui aktivitas enzim kitinase kasarnya. Bakteri kitinolitik diisolasi dari saluran pencernaan beberapa hewan pemakan serangga seperti katak; Hylarana hosii; Hylarana kampeni; Fejervarya limnocharis;
Fejervarya cancrivora, bunglon (Calotes versicolor) serta kadal (Mabouya multifasciata) yang diperoleh dari daerah Sibolangit, Deli Serdang, Sumatera Utara. Sebanyak 49 isolat diperoleh dengan mengisolasi bakteri pada media garam minimum kitin yang mengandung 0,025 % ekstrak khamir. Delapan isolat yang memiliki nilai IK terbaik diuji aktivitas dan dikarakterisasi enzim kitinasenya.
Dua isolat diantaranya memiliki indeks kitinolitik (IK) paling tinggi yaitu isolat SH4 yang berasal dari katak H. hosii dan isolat SC2 yang berasal dari bunglon C.
versicolor masing-masing sebesar 2,63 dan 2,47. Hasil uji menunjukkan isolat SC2 dan SH4 memiliki unit aktivitas kitinase dan aktivitas spesifik paling tinggi.
Isolat SC2 memiliki unit aktivitas kitinase dan aktivitas spesifik paling tinggi masing-masing sebesar 0,684 U/ml dan 0,811 U/mg. Aktivitas kitinase SC2 memiliki aktivitas optimum pada pH = 6 dan suhu optimum 45 oC. Sedangkan, isolate SH4 memiliki unit aktivitas dan aktivitas spesifik kitinase masing-masing sebesar 0,719 U/ml dan 0,838 U/mg. Enzim kitinase isolat SH4 memiliki aktvitas optimum pada pH = 8 dan suhu optimum 40 oC.
Kata kunci: bakteri kitinolitik, bunglon, katak, kitinase, saluran pencernaan
ABSTRACT
Amphibians and small reptiles obtained their food by catching small insects such as mosquitoes. Therefore, Amphibian and reptile gastrointestinals were the natural habitat for bacteria such as chitinolytic bacteria, as a good source of potential chitinase-producing bacteria. The purpose of this study was to obtain chitinolytic bacterial isolates and to examine the chitinase activity from amphibians and reptiles. Chitinolytic bacteria were isolated from the grastrointestinal tract of several insectivorous animals such as frogs; Hylarana hosii; Hylarana kampeni;
Fejervarya limnocharis; Fejervarya cancrivora, lizards (Mabouya multifasciata) and chameleons (Calotes versicolor) collected from Sibolangit, Deli Serdang, North Sumatra. Bacteria were isolated on chitin minimum salt medium added with 0.025% yeast extract. Eight isolates with relatively high chitinolytic index were tested and characterized for their chitinase activities.. It was observed that SH4 of frog (H. hosii) and SC2 of chameleon (C. versicolor) showed to have high chitinolytic index of 2.63 and 2.47, respectively. SH4 and SC2 isolate showed to have chitinase activity of 0,719 U/ml and 0,684 U/ml, respectively. SH4 and SC2 isolate show to have specific activity of 0.838 U/mg and 0,811 U/mg, respectively. Chitinase of SH4 isolate has optimum activity at pH = 8 with the optimum temperature of 40 oC, whereas SC2 has optimum activity at pH = 6 with optimum temperature of 45 oC.
Keyword: Chitinolytic bacteria, Chameleon, Chitinase, Frog, Gastrointestinal tract
DAFTAR ISI
Halaman PERSETUJUAN
PERNYATAAN
i ii
PENGHARGAAN iii
ABSTRAK v
ABSTRACT vi
DAFTAR ISI vii
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 4
BAB 2 TINJAUAN PUSTAKA
2.1 Bakteri Kitinolitik 5
2.2 Enzim Kitinase dan Karakteristiknya 6
2.3 Peranan Enzim Kitinase 7
2.4 Kitin 8
2.5 Amfibi 9
BAB 3 METODE PENELITIAN
3.1. Waktu dan Tempat 10
3.2. Isolasi dan Skrining Bakteri Kitinolitik dari Saluran
Pencernaan 10
3.3. Karakterisasi Morfologi Bakteri Kitinolitik 11 3.4. Pengukuran Pertumbuhan Bakteri Kitinolitik 11
3.5. Produksi Enzim Kitinase 11
3.6. Pengukuran Aktivitas Enzim Kitinase 12
3.7. Pengaruh pH dan Suhu terhadap Aktivitas Enzim
Kitinase 12
3.8. Analisis Kadar Protein 13
BAB 4 HASIL DAN PEMBAHASAN
4.1. Hasil Isolasi dan Karakteristik Bakteri kitinnolitik dari Saluran Pencernaan Hewan Pemakan Serangga
14 4.2. Hasil Penapisan Bakteri kitinnolitik dari Saluran
Pencernaan Hewan Pemakan Serangga
16
Isolat Terpilih
4.5. Pengaruh pH Terhadap Aktivitas Kitinase Isolat Terpilih
22 4.6. Pengaruh Suhu Terhadap Aktivitas Kitinase Isolat
Terpilih
23 4.7. Uji Aktivitas Total dan Aktivitas Spesifik Kitinase 24 BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 26
5.2. Saran 26
DAFTAR PUSTAKA 27
LAMPIRAN 34
DAFTAR TABEL
Nomor Judul Halaman
1 Karakteristik morfologi koloni bakteri kitinolitik dari saluran pencernaan bunglon (Calotes versicolor) dan kadal (Mabouya multifasciata).
14
2 Karakteristik morfologi koloni bakteri kitinolitik dari saluran pencernaan katak (Fejervarya
cancrivora), (Fejervarya limnocharis), (Hylarana hossi), dan (Hylarana kampeni).
15
3 Nilai indeks kitinolitik bakteri dari saluran
pencernaan bunglon (Calotes versicolor) dan kadal (Mabouya multifasciata)
16
4 Nilai indeks kitinolitik bakteri dari saluran pencernaan katak (Fejervarya limnocharis), (Fejervarya cancrivora), (Hylarana hosii) dan (Hylarana kampeni).
18
5 Karakteristik biokimia sel dan pewarnaan bakteri kitinolitik dari saluran pencernaan hewan pemakan serangga.
19
6 Pertumbuhan sel bakteri dan aktivitas kitinase isolat terpilih
21
Nomor Judul Halaman
1 Struktur Kimia Kitin 9
2 Pengaruh pH terhadap aktivitas kitinase bakteri
kitinolitik yang berasal dari saluran pencernaan hewan pemakan serangga.
22
3 Pengaruh suhu terhadap aktivitas kitinase bakteri kitinolitik yang berasal dari saluran pencernaan hewan pemakan serangga.
23
4 Unit aktivitas kitinase dan aktivitas spesifik kitinase dari 8 isolat bakteri kitinolitik terpilih dari saluran
pencernaan hewan pemakan serangga
25
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Alur kerja penelitian 34
2 Pembuatan koloidal kitin dengan cara hidrolisis parsial 35 3 Komposisi medium mgmk padat dan cara pembuatannya 36 4 Komposisi medium mgmk cair dan cara pembuatannya 36 5 Pembuatan kurva standar n-acetiglukosamin (glcnac) 37
6 Pembuatan larutan schales 38
7 Metode penetuan kadar protein 38
8 Uji aktivitas kitinase modifikasi spindler 39
9 Komposisi dan pembuatan reagen bradford 40
10 Rumus perhitungan 41
BAB 1 PENDAHULUAN
1.1.Latar Belakang
Perairan di Indonesia merupakan sumber cangkang hewan laut krustasea yang mengandung kitin berlimpah, dengan kadar kitin yang cukup tinggi yaitu berkisar 20-60 %. Indonesia menghasilkan limbah yang mengandung kitin sekitar 131.600 ton pertahun (Departemen Kelautan dan Perikanan RI, 2014). Limbah kitin beberapa diantaranya berasal dari sisa hasil olahan organisme krustasea. Limbah tersebut misalnya cangkang dari Rajungan (Rochima, 2007) dan cangkang udang.
Keberadaan limbah tersebut dapat menggangu dan menimbulkan masalah lingkungan jika tidak ditanggulangi (Herdyastuti, 2009). Selain itu saat ini semua produk kitin dan turunannya masih merupakan produk yang mahal di pasar dunia, yaitu senilai U$ 10.000/ton (Sanford, 2003).
Berbagai upaya dilakukan untuk mengurangi penumpukan limbah - limbah yang mengandung kitin. Salah satu upaya yang dilakukan ialah dengan memanfaatkan dan mengolah limbah yang mengandung kitin. Pengolahan itu dapat dilakukan melalui proses kimiawi maupun enzimatis. Proses enzimatis melibatkan kitinase dalam degradasi kitin, dapat menghasilkan produk-produk turunan kitin seperti kitin-oligosakarida. Teknik ini relatif lebih baik dibanding secara kimiawi, karena mudah dikendalikan, ramah lingkungan (biocompatible), terurai secara biologis (biodegradable), lebih murah, serta dapat membentuk oligomer atau polimer yang diinginkan (Haliza & Suhartono, 2012).
Kitinase memiliki banyak manfaat diantaranya sebagai bioinsektisida dan biofungsida dalam pengendalian hama tanaman (Omoya & Akinyosoye., 2011) serta digunakan untuk pengolahan limbah kitin pada industri pembekuan udang dan kepiting (Harman & Tronsmo, 1993). Hasil enzimatis kitinase menghasilkan produk-produk yang berguna. Produknya seperti kitin, kitosan dan turunan lainnya serta kitin juga merupakan komponen struktural utama dari dinding sel jamur, kerangka luar insekta dan cangkang krustasea (Patil et al., 2000). Kitin dan turunannya banyak digunakan sebagai bahan dasar yang diperlukan secara luas di
2
berbagai bidang industri seperti industri kertas, industri pangan, farmasi, ,kesehatan, pertanian, dan biokimia (Dahiya et al., 2006).
Karakterisasi kitinase telah banyak diteliti, diantaranya: aktivitas kitinase dari Bacillus sp. BG-11 optimum pada pH 8,5 dan suhu 50 oC (Bushan, 2000).
Mukherjee & Sen (2006), melaporkan aktivitas optimum kitinase Streptomyces venezuelae pada pH 7,5 dan suhu 40 oC. Penelitian lainnya, aktivitas kitinase Nocardia sp. optimum pada pH 9 dan suhu 45 oC (Bansode & Bajekal, 2006), serta aktivitas optimum kitinase Aeromonas schubertii sebesar 0,85 U/mL pada pH 4,8 (Guo et al., 2004).
Berbagai sumber isolat bakteri telah banyak yang dilaporkan memiliki aktivitas kitinolitik. Berbagai macam sumber isolat bakteri itu diantaranya, dari sumber air panas (Lestari, 2000), tanah (Khan & Khan, 2011), sumber limbah organik (Giyanto et al., 2009), dari cairan tumbuhan Nephentes (Bhore et al., 2013) tanaman kopi (Vega et al., 2005), rizosfer tanaman cabai (Mubarik et al., 2010). Sumber lain bakteri kitinolitik potensial berasal dari hewan invertebrata yang diisolasi dari eksoskeleton Crustaceae (Anuradha & Revathi, 2013).
Amfibi dan reptil kecil seperti Katak Hylarana, Mabouya dan Calotes merupakan organisme darat yang memenuhi kebutuhan makannya dengan memangsa serangga kecil seperti nyamuk (Main, 1968). Nyamuk merupakan organisme yang komposisi eksoskeletonya mengadung kitin. Kenyataan tersebut mengindikasikan adanya subtrat kitin yang dapat menjadi sumber makanan dari eksokskelton serangga bagi bakteri kitinolitik dari saluran pencernaan hewan pemakan serangga tersebut. Pryor (2008), melaporkan bahwa terdapat keberadaan bakteri yang berasal dari saluran pencernaan katak kolam Rana catesbeiana.
Penelitian tersebut memunculkan kemungkinan adanya sumber isolat baru yang potensial salah satunya bakteri kitinolitik dari saluran pencernaan beberapa hewan pemakan serangga seperti katak Hylarana hosii, Hylarana kampeni, Fejervarya limnocharis, Fejervarya cancrivora, kadal Mabouya multifasciata dan Calotes versicolor. Untuk itu perlu dilakukan penelitian mengenai bakteri kitinolitik dari Saluran pencernaan hewan pemakan serangga dari kelompok amphibi dan reptil tersebut di atas serta potensi enzimatis kitinasenya.
1.2. Permasalahan
Peningkatan pertumbuhan industri hasil laut menyebabkan peningkatan volume limbah sisa olahan yang mengandung kitin berupa, kulit udang dan cangkang kepiting. Penumpukan dapat menimbulkan pencemaran lingkungan jika tidak ditangani secara serius. Pengolahan limbah kitin saat ini yang efektif adalah melalui proses enzimatis menggunakan enzim kitinase. Ketersediaan enzim kitinase untuk industri masih kurang. Mikroorganisme penghasil kitinase yang potensial sangat dibutuhkan oleh industri pengolahan kitin. Eksplorasi sumber – sumber bakteri kitinolitik telah banyak dipelajari potensinya dalam menghasilkan kitinase dan diduga terdapat bakteri kitinolitik yang mempunyai kemampuan dalam menghidrolisis senyawa kitin yang berasal dari saluran pencernaan hewan pemakan serangga seperti, Mabouya multifasciata, Calotes versicolor, Hylarana hosii, Hylarana kampeni, Fejervarya limnocharis, Fejervarya cancrivora. Namun belum diketahui potensi kitinasenya, untuk itu perlu dilakukan karakterisasi enzimnya dalam rentang tertentu serta diuji kemampuan enzim kitinase kasarnya secara in vitro di laboratorium.
1.3. Tujuan Penelitian
Tujuan dari penelitian ini ialah:
a. Mengisolasi bakteri kitinolitik dari saluran pencernaan hewan pemakan serangga Mabouya multifasciata, Calotes versicolor, Hylarana hosii, Hylarana kampeni, Fejervarya limnocharis, Fejervarya cancrivora dengan metode Pryor (2008).
b. Menganalisis karakteristik enzim kitinase seperti suhu dan pH optimum enzim kitinase ekstrak kasar dari bakteri kitinolitik yang berasal dari saluran pencernaan hewan pemakan serangga.
4
1.4. Manfaat Penelitian
Penelitian ini diharapkan memperoleh isolat bakteri kitinolitik sebagai sumber kitinase yang potensial dan sebagai informasi kepada peneliti lain mengenai karakteristik kitinase dari bakteri kitinolitik yang berasal dari saluran pencernaan hewan pemakan serangga yaitu Mabouya multifasciata, Calotes versicolor, Hylarana hosii, Hylarana kampeni, Fejervarya limnocharis, Fejervarya cancrivora juga sebagai acuan untuk penelitian selanjutnya mengenai potensi aplikasinya baik secara in vitro maupun in vivo di lapangan di kemudian hari.
BAB 2
TINJAUAN PUSTAKA
2.1. Bakteri Kitinolitik
Bakteri kitinolitik adalah bakteri yang memiliki aktivitas kitinolitik, yang dapat menghasilkan enzim kitinase yang mampu mendegradasi kitin menjadi derivatnya yaitu N-asetil-glukosamin (Patil et al., 2000). Kitin merupakan senyawa yang sulit larut, ukuran , susunan molekul yang kompleks dan keragaman komposisinya, kitin didegradasi tidak di dalam sel melainkan mikrooganisme yang menhasilkan enzim untuk menghidrolisis kitin. Mikrooganisme kitinolitik memproduksi kitinase dalam jumlah yang lebih banyak daripada hewan dan tumbuhan (Matsumoto, 2006). Bakteri kitinolitik dapat diperoleh dari berbagai sumber diantaranya dari tumbuhan yaitu dari filosfer Coffea arabica (Vega et al., 2005), tanah (Khan & Khan, 2011), limbah udang (Herdyastuti et al., 2009), cangkang kepiting lingkungan air seperti air laut dan danau (Donderski dan Brzezinska, 2001), cangkang Crustaceae (Anuradha & Revathi, 2013). Eksoskeleton serangga (Yong et al., 2005). Penelitian lokal melaporkan keberadaan bakteri kitinolitik dari sumber lain, sumber tanah Bangka (Suryanto et al., 2014), rizosfer dan filosfer tanaman sawi putih (Brassicaceae) (Bungsu et al, 2014), rizosfer tanaman karet (Situmeang, 2014).
Beberapa jenis bakteri yang telah banyak dilaporkan mampu menghasilkan enzim kitinase adalah Streptomyces RKt5 (Yurnaliza et al., 2011), Enterobacter agglomerans (Chernin et al., 1995), Enterobacter (BK 15) (Indarwan, 2011), Pseudomonas sp, Pantoea dispersa, Enterobacter amnigenus (Gohel et al., 2006), Bacillus papandayan (Rochima, 2006), Bacillus cereus (Anindyaputri, 2010), B.
thuringiensis, B. licheniformis (Gomma, 2012), Bacillus (BK 17) (Indarwan, 2011), Arthrobacter (Okazaki et al., 1999), Lysinibacillus fusiformis (Singh et al., 2012), Pseudomonas fluorescens (Nandakumar et al., 2007), P. putida (Saranya
& Thayumanavan, 2013), Serratia marcescens (Horn et al., 2006), Paenibacillus elgii (Das et al., 2010), Vibrio harveyi (Svitil et al., 1997). V. aestuarianus, Flavobacterium odoratus, Shewenella putrefaciens, Exiguobacterium (Anuradha
6
& Revathi, 2013), dan Stenotrophomonas maltophilia (Zhang et al., 2001; Hamid et al., 2013). Selain bakteri, jamur juga telah dilaporkan dapat menghasilkan enzim kitinase diantaranya: Colleotricum (Tokuyasu et al., 1996), Trichoderma Nugroho et al., 2003), Aspergillus terreus (Ghanem et al.,2010), Coniothyrium minitans (Haggag & Hasan, 2013).
2.2. Enzim Kitinase dan Karakteristiknya
Enzim adalah biomolekul berupa protein berbentuk bulat (globular), yang terdiri atas satu rantai polipeptida atau lebih dari satu rantai polipeptida (Wirahadikusumah, 1989). Enzim berfungsi sebagai katalis atau senyawa yang dapat mempercepat proses reaksi tanpa habis bereaksi. Dengan adanya enzim, molekul awal yang disebut substrat akan dipercepat perubahannya menjadi molekul lain yang disebut produk (Grisham et al., 1999). Keunggulan enzim sebagai biokatalisator antara lain memiliki spesifitas tinggi, mempercepat reaksi kimia tanpa pembentukkan produk samping, produktivitas tinggi dan dapat menghasilkan produk akhir yang tidak terkontaminasi sehingga mengurangi biaya purifikasi dan efek kerusakan lingkungan (Chaplin and Bucke, 1990).
Kitinase merupakan enzim ekstraseluler yang dihasilkan oleh bakteri kitinolitik yang berperan penting dalam menghidrolisis kitin. Kitinase dapat menghidrolisis kitin secara acak pada ikatan glikosidiknya (Nasran et al., 2003).
Degradasi kitin secara enzimatis oleh kitinase berlangsung secara bertahap.
Awalnya polimer kitin dipecah menjadi oligomer kitin (umumnya berupa dimer) dan selanjutnya diuraikan menjadi monomer N-asetil-glukosamin oleh N- asetilglukosaminidase (Purwani et al., 2002).
Kitinase dihasilkan oleh mikroba, tanaman dan hewan termasuk manusia dengan fungsi yang bervariasi sesuai dengan sumbernya. Beberapa mikroba yang diketahui berpotensi sebagai penghasil kitinase adalah Enterobacter, Streptomyces, Aspergillus, Penicillium, Trichoderma (Omumasaba et al., 2001).
Bakteri mengeluarkan kitinase sebagai sarana memperoleh nutrisi dan agen parasit (Gooday, 1990). Kitin didegradasi oleh kitinase secara enzimatik melalui dua cara, Endokitinase (EC 3.2.1.14) mengubah polimer menjadi oligomer yang secara berkelanjutan didegradasi menjadi monomer oleh eksokitinase-kitobase (β
yang dapat mendegradasi kitin disebut sebagai kitinase total atau kitinase non spesifik yang terdiri dari:
1. Eksokitinase atau kitobiosidase, mengkatalis pembebasan unit dimmer kitobiosa (β-1,4-N-asetil-glukosamin).
2. Endokitinase (EC. 3.2.1.14) enzim yang mendegradasi kitin secara acak dari dalam menghasilkan oligomer-oligomer pendek N-asetil-glukosamin.
3. N-asetilglukosaminidase (EC. 3.2.1.30) bekerja karena ada pemutusan diasetilkitobioasa menghasilkan GlcNAc (Harman & Tronsmo, 1993).
Endokitinase memotong rantai kitin dari dalam menghasilkan oligomer kitin yaitu diasetilkitibiosa sebagai hasil utama, lalu didegradasi oleh N- asetilglukosaminidase menjadi monomer GlcNac yang kemudian mengalami deasetilasi menjadi glukosamin. Bentuk monosakarida dan disakarida ini akan diserap kedalam sel mikroorganisme dan berfungsi sebagai sumber karbon dan nitrogen. Lintasan alternatif degradasi kitin adalah dengan melibatkan deasetilase kitin menjadi kitosan. Enzim kitosanase menghidrolisis ikatan glikosida β-(1,4) pada kitosan menghasilkan diasetilkibiosa (kitobiosa) yang dihidrolisis oleh β-N- asetilglukosaminidase menjadi glukosamin (Gooday, 1990).
Hasil enzimatis hidrolisis kitin menjadi glukosamin itu juga berbeda-beda karakteristiknya pada setiap enzim kitinase yang berasal dari bakteri dengan perbedaan habitat tempat hidupnya. Karakteristik enzim kitinase telah banyak diteliti. Beberapa diantaranya aktivitas spesifik kitinase V. fluvialis dengan waktu inkubasi 120 menit sebesar 0,0141 U/mL, optimum pada pH 7,5 dan suhu 45 oC (Harini & Martiningrum, 2006). Aktivitas Kitinase Trichoderma viride TNJ63 optimum pada pH 5.5 dan suhu 30 oC (Nugroho et al., 2003). Aktivitas enzim kitinase dari isolat ICBB232 sebesar 2,085 U/mL serta optimum pada pH 6 dan suhu 50 oC (Pujiyanto, 2001). Maimunah (2013), melaporkan aktivitas enzim kitinase Bacillus Sp. BK 17 optimum pada pH 6 suhu 35 oC sebesar 0,075 U/mL.
2.3. Peranan Enzim Kitinase
Peranan kitinase sangat luas di berbagai bidang. Dalam bidang kesehatan, ekstrak kasar kitinase yang diproduksi oleh Myrothecium verrucaria dapat mematikan larva nyamuk dengan cara merusak struktur eksoskeleton Aedes aegypty (Gooday,
8
1990). Fungsi lain digunakan dalam penguraian bertingkat untuk menghasilkan kitosan yang sangat berguna sebagai bahan dasar dalam pembuatan membran dialisa darah (Toharisman, 2007). Pada bidang pertanian, kitinase berfungsi sebagai agen biokontrol pertanian potensi pemanfaatan isolat kitinolitik sebagai agen pengendali hayati tanaman (Suryanto & Munir, 2006) dan terhadap hama serangga dan fungi patogen yang memiliki komponen kitin pada dinding sel.
Enzim kitinase ini juga berperan dalam proses pembunuhan larva Haemonchus contortus dengan cara mendegradasi dan melisiskan dinding kulit larva cacing (Ahmad, 2007). Pengendalian penyakit hawar daun pada tanaman Sawit yang disebabkan oleh jamur Curvularia affinis dan Colletotrichum gloeosporioides dengan menggunakan Bacillus thuringiensis (Asril et al., 2014). Dalam bidang peternakan budidaya ikan, enzim kitinase digunakan dalam menghidrolisis tepung cangkang udang sebagai pakan bagi benih ikan patin (Hapsari, 2013).
Monomer dari kitin yaitu N-aseti-glukosamin dapat dimanfaatkan dalam bidang farmasi, diantaranya dapat digunakan sebagai obat untuk mengontrol kadar gula dalam darah, sebagai suplemen, anti inflamasi dan sebagainya. Untuk kosmetik, senyawa gula ini dapat membantu mengurangi hilangnya hiperpigmentasi karena N-asetil-D glukosamin dapat membantu mengurangi aktivitas enzim tirosinase yang berperan dalam produksi melanin (Haliza &
Suhartono, 2012). Dalam bidang Industri, mikroorganisme penghasil kitinase berpotensi besar untuk mendegradasi limbah yang mengandung kitin dengan merubahnya menjadi produk yang berguna seperti protein sel tunggal (Muharni, 2009), sebagai penjernih jus, produksi senyawa perisa, pengawet anti mikroba (Shahidi et al., 1999). Kitinase juga memainkan peranan yang penting dalam proses fisiologi dan ekologi (Saito et al., 1998).
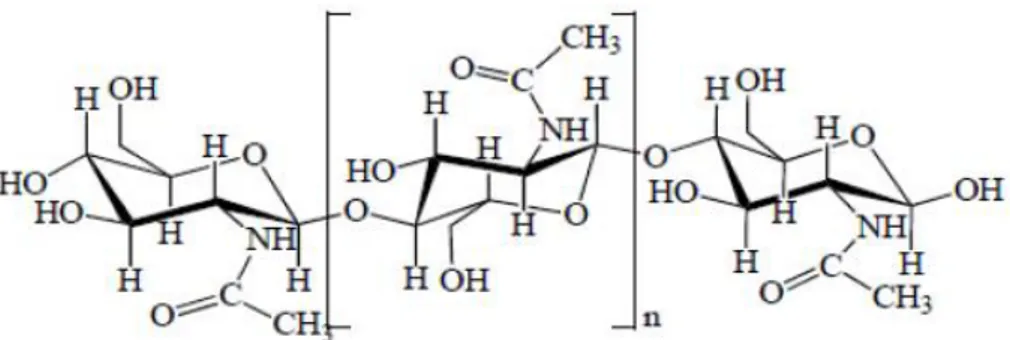
2.4. Kitin
Kitin adalah polisakarida yang tersusun atas residu β-1.4-N-acetilglukosamin (GlcNAc) yang berikatan dengan ikatan hidrogen. Kelimpahan kitin di alam berada diurutan kedua setelah selulosa dan terdistribusi secara luas di lingkungan seperti kutikula insekta, cangkang crustacea, nematoda dan dinding sel cendawan
tidak bercabang. Tiap rantai polimer pada umumnya terdiri atas 2000 hingga 5000 unit (Sanjaya dan Yuanita, 2007). Struktur kitin mirip dengan selulosa, tetapi pada kitin gugus hidroksil yang terikat pada atom C-2 digantikan oleh gugus setamina (-NHCOCH3) (Dutta et al, 2004).
Gambar 1. Struktur Kimia Kitin (Aranaz et al, 2009)
2.5. Amfibi
Amfibi adalah kelompok terkecil di antara vertebrata, dengan jumlah hanya 3.000 spesies.Amfibi dijumpai di seluruh dunia kecuali di kutub. Mereka menempati sejumlah habitat yang berbeda-beda seperti hutan hujan, kolam, dan danau.
Mereka juga ada di daerah berumput di lereng pegunungan tinggi, bahkan juga di gurun. Meskipun amfibi dewasa dapat bertahan hidup selama periode kemarau panjang, umumnya mereka membutuhkan tempat-tempat lembab seperti sungai dan kolam. Di wilayah hutan hujan tropis yang lembab, banyak katak dapat bertahan hidup tanpa memiliki sumber air tetap. Sebagai hewan yang berdarah dingin, amfibi tidak aktif dalam kondisi dingin. Pada kondisi ini mereka melakukan hibernasi, biasanya dalam lumpur di dasar kolam. Amfibi merupakan hewan nocturnal (Brotowidjoyo, 1994).
Umumnya kodok dewasa adalah predator yang memakan bermacam- macam invertebrata kecil terutama serangga dan keong (Main, 1968). Di dalam mulut terdapat gerigi kecil di sepanjang rahang atas, dan ada gigi vomerin pada langit-langit mulut. Lidah berotot dan bercabang dua pada ujungnya, dan bertaut pada bagian anterior mulut. Saluran pencernaan mulai dari esophagus (berdinding lurus dan besar) langsung bersatu dengan lambung. Lambung memanjang dan berkelok ke samping kiri dan berotot. Usus terdiri dari intestinum yang kecil, panjang, dan berkelok-kelok (Duellman & Trueb, 1986).
10
BAB 3
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2015 sampai dengan selesai di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Serta lokasi pengambilan sampel di Bumi Perkemahan Sibolangit.
3.2. Isolasi dan Skrining Bakteri Kitinolitik dari Saluran Percernaan
Sampel Mabouya multifasciata, Calotes versicolor, Hylarana hosii, Hylarana kampeni, Fejervaria Limnocharis, Fejervaria cancrivora dibedah dengan dissecting set yang telah steril. Saluran pencernaan dipotong lalu dimasukkan ke dalam larutan garam fisiologis yang telah steril (Pryor, 2008). Sampel diberi pegenceran hingga seri 10-6 lalu diinokulasikan 0.1 mL ke dalam media garam minimum kitin (MGMK) agar dengan komposisi larutan garam (KH2PO4, K2HPO4, MgSO4.7H2O, feSO4.7H2O, ZnSO4, MnCl2), koloidal kitin, agar-agar, yeast extract 0,025 % dengan metode cawan sebar menggunakan hockey stick (Suryanto dan Munir, 2006). Isolat diinkubasi pada suhu 28-30 oC selama 1-5 hari. Isolat bakteri kitinolitik ditandai dengan terbentuknya zona bening di sekitar koloni lalu setiap koloni disubkultur sampai diperoleh isolat murni.
Indeks Kitinolitik diukur dengan cara, sebanyak 10 µl suspensi bakteri kitinolitik (OD600 ≈ 0,5) dalam larutan NaCl 0,9 % diteteskan ke kertas cakram dan diinokulasikan di tengah MGMK agar. Biakan diinkubasi selama 7 hari.
Indeks kitinolitik diperoleh berdasarkan perbandingan diameter zona bening di sekitar koloni dengan diameter koloni. Isolat yang memiliki indeks kitinolitik lebih tinggi ditetapkan sebagai isolat terpilih untuk produksi enzim uji aktivitas enzim.
3.3. Karakterisasi Morfologi Bakteri Kitinolitik
Isolat murni yang memiliki kemampuan kitinolitik dikarakterisasi berdasarkan morfologi koloni, sifat Gram dan sifat biokimia. Karakterisasi morfologi yang diamati secara makroskopis adalah meliputi bentuk, tepi, elevasi, dan warna koloni. Karakteristik yang diamati secara mikroskopis meliputi sifat Gram dan bentuk sel. Sifat biokimia metabolisme sel bakteri yang diamati mencakup uji hidrolisis pati dengan media Starch Agar (SA), uji gelatin dengan media nutrien gelatin, uji motilitas dengan media Sulfide Indole Motility (SIM), uji sitrat dengan media Simmon’s Citrate Agar (SCA), uji katalase dengan menggunakan larutan 3% H2O2, dan uji sulfida dengan media Triple Sugar Iron Agar (TSIA). Untuk uji sitrat, uji gelatin, uji pati, uji motilitas dan uji sulfida biakan terlebih dahulu diinkubasi selama 24 jam pada suhu 37 oC.
3.4. Pengukuran Pertumbuhan Bakteri Kitinolitik dan Aktivitas Kitinase Sebanyak 250 μL kultur bakteri (10-8) diinokulasikan ke dalam labu Erlenmeyer 25 mL MGMK cair dan diinkubasi pada suhu 37 oC dalam keadaan bergoncang (120 rpm) selama 24 jam. 10 % kultur cair dari perbanyakan diinokulasikan ke dalam 7 erlenmeyer yang berisi 100 ml MGMK cair.
Pengamatan pertumbuhan dilakukan setiap 24 jam sekali selama 7 hari dengan menghitung Angka Lempeng Total (ALT) pada media MGMK agar (Suryanto dan Munir, 2006). Aktivitas kitinase diukur menggunakan metode Spindler (1997) setiap sekali 24 jam.
3.5. Produksi Enzim Kitinase
Sebanyak 250 μL kultur bakteri (10-8) diinokulasikan ke dalam MGMK cair yang mengandung yeast dengan pH 7 dan diinkubasi pada suhu 27 oC dan kecepatan 120 rpm selama 24 jam. Sebanyak 2,5 ml kultur isolat diinokulasikan ke dalam 100 ml MGMK cair. Kultur isolat disentrifugasi pada kecepatan 10000 rpm selama 10 menit pada suhu 4 oC. Supernatan yang diperoleh diuji aktivitas kitinasenya (Maimunah, 2013). Aktivitas kitinase dan kadar protein diukur pada hari ke-6.
12
3.6. Pengukuran Aktivitas Enzim Kitinase
Pengukuran aktivitas enzim Kitinase secara kuantitatif ditentukan dengan metode Spindler (1997). Pengujian diawali dengan penyiapan kurva standar N- asetilglukosamin (GlcNAc). Pada beberapa konsentrasi (0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 dan 200 ppm) dalam akuades. Masing-masing konsentrasi tertentu ditambahkan dengan akuades, GlcNAc dan pereaksi Schales (0,5 g K3(FnCn)6) dalam 0,5 M sodium karbonat). Larutan dihomogenkan kemudian dipanaskan pada suhu 100 oC selama 10 menit untuk menghentikan reaksi. Larutan didinginkan dan diukur nilai absorbansinya pada panjang gelombang 420 nm.
Kurva standar dibuat dengan menghubungkan konsentrasi standar terhadap absorbansi terkoreksi.
Pengujian enzim dilakukan dengan mencampur 150 μL sampel enzim, 150 μL penyangga fosfat pH 7, dan 300 μL koloidal kitin 0,3 %. Campuran dihomogenakan selanjutnya diinkubasi pada suhu 37 oC selama 30 menit.
Campuran enzim disentrifugasi 10000 rpm selama 5 menit pada suhu 4 oC dan supernatan yang dihasilkan diambil sebanyak 300 μL dimasukkan ke dalam tabung reaksi, kemudian ditambah dengan 700 μL akuades dan 1000 μL pereaksi Schales (Imoto & Yagashita, 1971). Blanko dibuat dengan mencampurkan 1000 μL akuades dengan 1000 μL pereaksi schales kemudian dihomogenkan.
Campuran langsung didihkan pada suhu 100 oC selama 10 menit. Campuran reaksi didinginkan untuk selanjutnya diukur absorbansinya pada panjang gelombang 420 nm. Aktivitas diukur berdasarkan persamaan garis linear yang diperoleh pada perhitungan kurva standar N-asetil-D-glukosamin (Spindler, 1997).
3.7. Pengaruh pH dan Suhu terhadap Aktivitas Enzim Kitinase
Pengaruh pH terhadap aktivitas kitinase diuji dengan cara mereaksikan 100 μL enzim dengan 300 μL substrat koloidal kitin 0,3 % pada suhu 37 oC selama 30 menit pada berbagai kondisi pH larutan penyangga 3 sampai 8 masing-masing 200 μL. Penyangga pH 8 dibuat dari penyangga Tris-Hcl. Konsentrasi penyangga yang digunakan adalah 0,2 M. Aktivitas enzim kitinase ditentukan dengan
Pengaruh suhu terhadap aktivitas kitinase diuji dengan cara mereaksikan 100 μL enzim, 300 μL substrat koloidal kitin 0,3 % dan 150 μL 0,2 M penyangga yang sesuai. Pada suhu uji 20 - 50 oC (interval 5 oC) selama 30 menit. Aktivitas enzim kitinase ditentukan dengan menggunakan metode Spindler (1997).
3.8. Analisis Kadar Protein
Pengukuran konsentrasi protein diawali dengan membuat kurva standar dari bovine serum albumin (BSA). Deret konsentrasi yang dibuat terdiri atas 0, 20, 40, 60, 80, dan 100 ppm. Larutan standar dibuat dengan menimbang 0,01 g BSA (bovine serum albumin) yang kemudian dilarutkan dengan 10 ml akuades steril sehingga diperoleh larutan stok BSA dengan konsentrasi 1000 ppm. Larutan stok dengan konsentrasi 1000 ppm diencerkan menjadi konsentrasi 0, 20, 40, 60, 80, dan 100 ppm. Kemudian dilakukan pengukuran terhadap standar protein dengan menambahkan 500 µL seri larutan standar dengan 750 µL reagen Bradford. Kemudian larutan diguncang menggunakan vortex dan diinkubasi pada suhu ruang selama 10-60 menit. Pengukuran absorbansi dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 595 nm. Blanko yang digunakan adalah aquades sebanyak 500 µL yang ditambah dengan reagen Bradford sebanyak 750 µL.
Pengukuran konsentrasi protein pada sampel dilakukan dengan cara, 500 μl enzim kitinase ekstrak kasar dipipet dan dicampur dengan 750 μl reagen Bradford kemudian diguncang menggunakan vortex. Nilai absorbansi campuran tersebut diukur pada panjang gelombang 595 nm sebnyak dua kali. Hasil absorbansi yang diperoleh dikonversikan pada persamaan garis dari kurva standar BSA yang telah dibuat sehingga diperoleh kandungan protein enzim kitinase. Setelah konsentrasi protein ditentukan, maka aktivitas spesifik enzim dapat ditentukan (Bradford, 1976). Reagen Bradford dibuat dari 100 mg Coomassie Brilliant Blue G-250, 25 ml etanol 95%, 100 ml 85% (b/v) asam fosfat, dan NaOH 1M. Campuran uji dihomogenkan dengan vorteks dan diinkubasi selama 30 menit pada suhu ruangan. Nilai absorbansi diukur pada panjang gelombang 595 nm.
14
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi dan Karakteristik Bakteri Kitinolitik dari Saluran Pencernaan Hewan Pemakan Serangga
Isolasi bakteri kitinolitik dilakukan menggunakan metode Pryor (2008), dengan cara mengambil organ saluran pencernaannya dan bakteri ditumbuhkan di medium selektif MGMK agar. Isolat bakteri kitinolitik yang diperoleh sebanyak 49 isolat dari 4 spesies katak dan 2 spesies reptil kecil. Hasil isolasi diperoleh 37 isolat yang memiliki koloni berbentuk bulat (circular) dan 12 isolat berbentuk tidak beraturan (irregular), dimana 34 koloni bertepi bulat penuh (entire), 8 koloni bertepi bergelombang (undulate), 7 koloni bertepi berombak (lobate) dan 1 koloni memiliki tepi mengeriting (curled), dengan elevasi koloni berbentuk rata (flat), terangkat (raised) dan cembung (convex). Warna koloni bervariasi dari putih, putih susu, putih kekuningan, putih jingga (Tabel 1 dan 2).
Tabel 1. Karakteristik morfologi koloni bakteri kitinolitik dari saluran pencernaan bunglon (Calotes versicolor) dan kadal (Mabouya multifasciata).
No Isolat Morfologi Koloni
Bentuk Tepi Elevasi Warna
Calotes versicolor.
1. SC1 Circular Undulate Flat Putih
2. SC2 Circular Lobate Flat Putih
3. SC3 Circular Undulate Raised Putih kekuningan
4. SC4 Irregular Undulate Raised Putih kekuningan
5. SC5 Irregular Lobate Flat Putih
6. SC6 Circular Undulate Flat Putih kekuningan
7. SC7 Irregular Undulate Flat Putih susu
8. SC8 Circular Undulate Flat Putih susu
9. SC9 Circular Entire Raised Putih susu
10. SC10 Circular Undulate Flat Putih
Mabouya multifasciata.
11. SM1 Circular Undulate Flat Putih
12. SM2 Circular Undulate Flat Putih kekuningan
13. SM3 Circular Lobate Flat Putih
14. SM4 Irregular Undulate Convex Putih
15. SM5 Circular Undulate Raised Putih
16. SM6 Circular Undulate Raised Putih kekuningan
17. SM7 Circular Undulate Flat Putih
Tabel 2. Karakteristik morfologi koloni bakteri kitinolitik dari saluran pencernaan katak (Fejervarya cancrivora), (Fejervarya limnocharis), (Hylarana hossi), dan (Hylarana kampeni).
No Isolat Morfologi Koloni
Bentuk Tepi Elevasi Warna
Fejervarya cancrivora
1. SF1 Circular Entire Convex Putih jingga
2. SF2 Circular Entire Convex Putih
3. SF3 Iregular Undulate Raised Putih kekuningan
4. SF4 Iregular Lobate Raised Putih susu
5. SF5 Circular Undulate Flat Putih
6. SF6 Circular Undulate Flat Putih susu
7. SF7 Circular Undulate Convex Putih susu
Fejervarya limnocharis
8. SL1 Iregular Undulate Raised Putih
9. SL2 Circular Entire Flat Putih
10. SL3 Iregular Curled Raised Putih susu
11. SL4 Circular Undulate Flat Putih
12. SL5 Circular Undulate Flat Putih
13. SL6- Iregular Undulate Raised Putih susu
14. SL7 Circular Undulate Flat Putih
15. SL8 Circular Undulate Flat Putih
16. SL9 Iregular Undulate Flat Putih
17. SL10 Circular Lobate Flat Putih susu
Hylarana hosii
18. SH1 Circular Entire Flat Putih
19. SH2 Circular Undulate Flat Putih
20. SH3 Circular Undulate Flat Putih
21. SH4 Circular Undulate Raised Putih
22. SH5 Circular Undulate Raised Putih
23. SH6 Circular Entire Raised Putih
24. SH7 Iregular Undulate Flat Putih susu
25. SH8 Iregular Lobate Flat Putih
Hylarana kampeni
26. SK1 Circular Undulate Flat Putih
27. SK2 Circular Undulate Flat Putih susu
28. SK3 Circular Entire Flat Putih susu
29. SK4 Iregular Undulate Convex Putih
30. SK5 Circular Undulate Flat Putih
31. SK6 Circular Undulate Flat Putih susu
32. SK7 Irregular Lobate Flat Putih
Perbedaan karakteristik koloni bakteri yang diperoleh bisa disebabkan karena berasal dari sumber isolat yang berbeda-beda yang memiliki pigmen intraseluler yang juga berbeda. Menurut Leboffe dan Pierce (2011), Perbedaan warna pada koloni bakteri disebabkan oleh perbedaan pigmen intraseluler yang dihasilkan oleh bakteri yang berasal dari sumber berbeda. Pigmen bakteri dapat diklasifikasikan atas karotenoid, antosianin, melanin, tripirilmethenes dan phenazin.
16
4.2. Hasil Penapisan Bakteri Kitinolitik dari Saluran Pencernaan Hewan Pemakan Serangga.
Berdasarkan pengukuran indeks kitinolitik didapatkan 15 isolat bakteri dengan nilai IK tertinggi yaitu pada isolat SC1, SC2, SC5, SC7, SC8, SC9, SM1, SM6, SH3, SH4, SK1, SK6, SL3, SL8 dan SL9. Indeks kitinolitik tertinggi diperoleh oleh isolat SH4 dengan indeks sebesar 2, 63 dan nilai IK terendah pada isolat SF5 sebesar 0,92. Isolat bakteri kitinolitik SH4 yang memiliki nilai IK tertinggi mengindikasikan bahwa bakteri SH4 memiliki kemampuan kitinolitik yang sangat besar dengan produksi enzim yang tinggi juga diikuti dengan aktivitas enzim yang tinggi.
Tabel 3. Nilai indeks kitinolitik bakteri dari saluran pencernaan bunglon (Calotes versicolor) dan kadal (Mabouya multifasciata)
No Sumber dan Kode Isolat Indeks Kitinolitik (IK)
Calotes versicolor.
1. SC1 1,90
2. SC2 2,47
3. SC3 1,37
4. SC4 1,73
5. SC5 2,10
6. SC6 1,60
7. SC7 2,01
8. SC8 1,94
9. SC9 2,28
10. SC10 1,30
Mabouya multifasciata
1. SM1 1,90
2. SM2 1,04
3. SM3 1,62
4. SM4 1,62
5. SM5 1,48
6. SM6 2,46
7. SM7 1,25
Tabel 4. Nilai indeks kitinolitik bakteri dari saluran pencernaan katak (Fejervarya limnocharis), (Fejervarya cancrivora), (Hylarana hosii) dan (Hylarana kampeni).
No Sumber dan Kode Isolat Indeks Kitinolitik
A. Fejervarya limnocharis
1. SL1 2,11
2. SL2 1,33
3. SL3 1,98
4. SL4 1,44
5. SL5 1,21
6. SL6 1,52
7. SL7 2,01
8. SL8 2,05
9. SL9 2,14
10. SL10 1,01
B. Fejervarya cancrivora
1. SF1 1,03
2. SF2 1,77
3. SF3 1,53
4. SF4 1,40
5. SF5 0,92
6. SF6 1,28
7. SF7 1,06
C. Hylarana hosii
1. SH1 1,01
2. SH2 1,57
3. SH3 2,03
4. SH4 2,63
5. SH5 1,30
6. SH6 1,01
7. SH7 1,57
8. SH8 1,0
D. Hylarana kampeni
1. SK1 2,25
2. SK2 1,60
3. SK3 1,01
4. SK4 1,97
5. SK5 1,50
6. SK6 2,36
7. SK7 1,0
18
Pisano et al., (1992), menyatakan bahwa terdapat korelasi yang tinggi antara aktivitas kitinolitik yang besar dengan produksi enzim yang tinggi dari mikroorganisme kitinolitik actinomycetes yang berasal dari laut. Pernyataan hampir serupa juga dikemukakan Haggag dan Abdallh (2012), yang melaporkan bahwa bakteri Streptomyces hygroscopicus yang memiliki indeks kitinolitik tinggi berupa munculnya zona bening yang luas juga selalu diikuti dengan produksi dan aktivitas kitinase yang juga tinggi.
Zona bening yang dihasilkan oleh setiap isolat bakteri kitinolitik sangat beragam. Penelitian Soeka dan Sulistiani (2011) melaporkan, bahwa bakteri kitinolitik Stenotrophomonas yang berasal dari Gunung Bromo menghasilkan zona bening dengan nilai IK sebesar 2. Apriani (2008) juga melaporkan, bahwa bakteri kitinolitik isolat C15 dari limbah kulit udang memiliki nilai IK sebesar 1, 73.
4.3. Karakteristik Biokimia Sel dan Pewarnaan Gram Bakteri Kitinolitik dari Saluran Pencernaan Hewan Pemakan Serangga
Limabelas isolat bakteri dengan nilai IK tertinggi telah dikarakterisasi biokimia sel dan pewarnaan Gramnya. Hasil karakterisasi biokimia dan pewarnaan Gram dapat dilihat pada tabel 5.
Berdasarkan data di atas diperoleh karakteristik biokimia sel bakteri yaitu uji hidrolisis pati terdapat 4 isolat positif, 11 isolat negatif. Uji patogenitas 3 isolat positif yaitu SH4, SK6, dan SC9 , serta 12 isolat negatif. Uji sitrat terdapat 1 isolat negatif yaitu SH3 dan 14 isolat positif. Uji fermentasi gula dan sulfida diperoleh 8 isolat hanya mampu menfermentasi 1 zat gula saja dan 7 isolat mampu menfermentasi 3 zat gula sekaligus yaitu SC2, SC7, SC8, SC9, SH3, SL9, SM1 dan 11 isolat menghasilkan endapan hitam, 4 isolat tidak menghasilkan endapan hitam yaitu SC8, SH4, SL3, SM6 serta 4 isolat menyebabkan keretakan pada media yaitu SC7, SC9, SL8, SL9. Uji motilitas diperoleh hasil 11 isolat positif motil dan 4 isolat negatif atau amotil yaitu SC1, SC8, SM6, SH3. Uji katalase diperoleh hasil 13 isolat negatif dan 2 isolat positif yaitu isolat SC8 dan SK6.
Tabel 5. Karakteristik biokimia sel dan pewarnaan bakteri kitinolitik dari saluran pencernaan hewan pemakan serangga.
No Isolat
Uji Biokimia
Morfologi sel
Hidrolisa Pati Hidrolisa Gelatin Sitrat
Hidrogen Sulfida &
Fermentasi Gula
Motilitas Katalase
Glukosa Sukrosa Laktosa Endapan Hitam Keretakan Media
Gram Penataan
1. SC1 - - + + - - + - - - Negatif Streptococcus
2. SC2 - - + + + + + - + - Negatif Monococcus
3. SC5 + - + + - - + - + - Negatif Monococcus
4. SC7 - - + + + + + + + - Negatif Monococcus
5. SC8 - - + + + + - - - - Negatif Diplococcus
6. SC9 + - + + + + + + + - Negatif Diplococcus
7. SM1 - - + + + + + - + - Negatif Monococcus
8. SM6 + - + + - - - - - - Negatif Monococcus
9. SH3 - - + + + + + - - - Negatif Monococcus
10. SH4 - + + + - - - - + - Negatif Diplococcus
11. SK1 - - + + - - + - + - Negatif Diplococcus
12. SK6 + + + + - - + - + + Negatif Streptococcus
13. SL3 - - - + - - - - + - Negatif Diplococcus
14. SL8 - - + + - - + + + + Negatif Diplococcus
15. SL9 - + + + + + + + + - Negatif Streptococcus
Keterangan: + = Hasil Uji Positif - = Hasil Uji Negatif
Hasil yang diperoleh tersebut bisa saja disebabkan karena semua isolat memilki jenis bakteri yang berbeda-beda dengan karakteristik metabolisme sel yang berbeda. Perbedaan karakteristik metabolisme sel tersebut itulah yang bisa menyebabkan perbedaan dari masing-masing jenis bakteri.
Berdasarkan data di atas didapatkan bahwa 15 isolat bakteri memiliki karakteristik gram negatif yang memiliki komposisi dinding sel dengan membran luar yang tersusun atas lipid yang bersifat non polar dan sedikit peptidoglikan.
Semua sel bakteri memiliki bentuk bulat (coccus) dengan penaatan sel yang berbeda-beda yaitu 6 isolat diplococcus, 6 isolat monococcus, dan 3 isolat streptococcus. Limabelas isolat bakteri kitinolitik berwarna merah pada warna selnya setelah diberi pewarnaan Gram (Tabel 5). Perbedaan karakteristik tersebut dapat disebabkan karena semua isolat berasal dari sumber hewan yang berbeda- beda yang memiliki pola kebiasaan yang berbeda. Menurut Madigan et al (2015) menyatakan bahwa, komposisi dinding sel bakteri gram negatif yang mengandung banyak lipid (non polar) menyebabkan ketika telah diberi pewarna crystal violet dan dibilas dengan larutan aseton alkohol yang merupakan pelarut non polar maka
20
kompleks membran lipid-crystal violet akan terbilas karena lapisan kompleks itu terlarut beserta larutan aseton alkohol. Penelitian lain melaporkan karakteristik sel bakteri yang berbeda-beda, beberapa berbentuk seperti streptobasil dengan jenis gram positif (Anindyaputri, 2010), berbentuk koma (vibrio) dengan jenis gram negatif, berbentuk monobasil dengan jenis gram negatif (Flavobacterium) (Anuradha dan Revathi, 2013).
4.4. Pengukuran Pertumbuhan Sel Bakteri dan Aktivitas Kitinase Isolat Terpilih
Delapan isolat dengan nilai IK tertinggi diukur pertumbuhan sel dan aktivitas kitinase selama 7 hari (Gambar 1). Berdasarkan data dibawah, diperoleh 8 isolat bakteri kitinolitik mampu tumbuh pada media MGMK cair. Pertumbuhan semua isolat memiliki pola pertumbuhan yang cenderung sama yaitu mulai meningkat setelah 2 hari waktu inkubasi. Pertumbuhan semua sel bakteri cenderung terus meningkat hingga 6 hari waktu inkubasi, dengan tingkat pertumbuhan tertinggi pada akhir fase log yang ditemukan pada hari ke-6 . Pertumbuhan sel semua isolat bakteri kitinolitik mengalami penurunan setelah 7 hari inkubasi. Produksi kitinase dari isolat ini mulai terlihat pada hari ke-2 inkubasi dan cenderung meningkat hingga hari ke-6. Aktivitas kitinase tertinggi ditemukan pada 6 hari waktu inkubasi dan setelah 6 hari inkubasi, aktivitas kitinase tersebut mengalami penurunan pada semua isolat bakteri (Tabel 6).
Penurunan pertumbuhan sel terjadi setelah memasuki fase kematian pada hari ke-7 kemungkinan bisa disebabkan karena waktu dari fase stasioner yang sangat singkat sehingga pola fase stasioner tidak terlihat (Tabel 6). Aktivitas kitinase tertinggi juga berada pada akhir fase log yang ditemukan pada hari ke-6 atau sama dengan jumlah sel yang dihasilkan pada waktu yang sama. Hasil tersebut membuktikan bahwa pertumbuhan sel yang tinggi bisa saja menghasilkan aktivitas kitinase tertinggi.
Tabel 6. Pertumbuhan sel bakteri dan aktivitas kitinase isolat terpilih.
No
Jumlah Sel (log CFU) dan Aktivitas Kitinase
(U/ml)
Hari
1 2 3 4 5 6 7
1. Jumlah sel SC2 4.8 6.9 9.2 11.2 12.5 14.6 13.2
Aktivitas kitinase SC2 0.195 0.265 0.530 0.561 0.594 0.650 0.365 2. Jumlah sel SC5 4.06 6.13 9.22 10.38 13.23 15.02 13.8
Aktivitas kitinase SC5 0.126 0.186 0.294 0.334 0.378 0.396 0.202 3. Jumlah sel SC9 5.11 5.81 9.58 10.73 13.08 14.74 13.12 Aktivitas kitinase SC9 0.092 0.280 0.408 0.438 0.466 0.485 0.313 4. Jumlah sel SM6 5.27 6.25 9.35 11.02 12.47 14.77 13.44 Aktivitas kitinase SM6 0.157 0.286 0.462 0.544 0.576 0.624 0.328 5. Jumlah sel SH4 5.38 7.00 9.31 11.14 12.45 15.06 13.89 Aktivitas kitinase SH4 0.188 0.288 0.555 0.594 0.605 0.668 0.354 6. Jumlah sel SK1 5.59 7.14 9.35 11.26 13.50 15.08 13.89 Aktivitas kitinase SK1 0.147 0.246 0.363 0.392 0.407 0.450 0.271 7. Jumlah sel SK6 5.47 5.87 9.28 11.11 13.38 15.04 13.83 Aktivitas kitinase SK6 0.125 0.256 0.384 0.419 0.483 0.506 0.308 8. Jumlah sel SL9 5.30 6.01 9.51 10.85 13.46 15.30 14.08 Aktivitas kitinase SL9 0.125 0.256 0.384 0.419 0.483 0.506 0.308
Penelitian lain mengenai kurva pertumbuhan bakteri kitinolitik mendapatkan hasil yang berbeda-beda. Asril et al (2014) menyatakan bahwa, aktivitas spesifik kitinase dari bakteri Bacillus thuringiensis SAHA mulai terlihat diantara akhir fase log dan awal fase stasioner ketika jumlah sel cenderung menurun. Hal ini disebabkan oleh menurunnya nutrisi pada media, sehingga kitinase disekresikan dalam jumlah yang tinggi. Hao et al (2012) melaporkan, bahwa aktivitas kitinase dari bakteri kitinolitik Chitinolyticbacter meiyuanensis SYBC-H1 cenderung meningkat setelah 2 hari inkubasi, dan aktivitas tertinggi setelah hari ke-5 inkubasi, kemudian akan cenderung menurun setelah mencapai waktu 7 hari inkubasi.
22
4.5. Pengaruh pH Terhadap Aktivitas Kitinase Isolat Terpilih
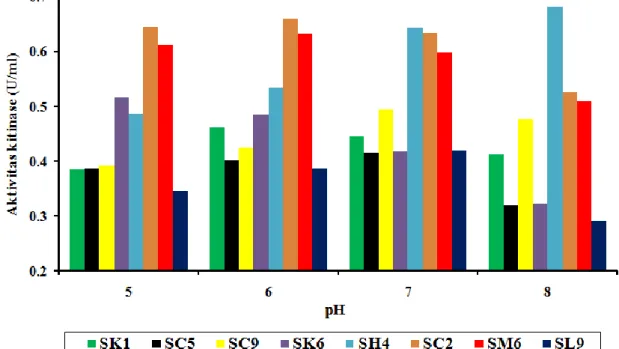
Pengujian pengaruh pH terhadap aktivitas kitinase dilakukan pada 8 isolat dengan nilai IK tertinggi. Semua isolat memiliki aktivitas maksimum pada pH optimum yang berbeda-beda. Isolat SK1 memilki aktivitas kitinase optimum pada pH 6, SH4 optimum pada pH 8, SC5 optimum pada pH 7, SC2 optimum pada pH 6, SC9 optimum pada pH 7, SM6 optimum pada pH 6, SK6 optimum pada pH 5, dan SL9 aktivitas opimumnya pada pH 7. Hasil pengukuran menunjukkan isolat SH4 memiliki aktivitas kitinase optimum tertinggi diantara 7 isolat lain, terdapat pada pH 8 sebesar 0,682 U/mL (Gambar 2). Hasil ini bisa disebabkan karena masing- masing enzim kitinase dihasilkan dari jenis bakteri yang berbeda dengan kemampuan enzim yang berbeda pula akibat struktur dan pola aktivitas enzim yang unik.
Gambar 2. Pengaruh pH terhadap aktivitas kitinase bakteri kitinolitik yang berasal dari saluran pencernaan hewan pemakan serangga.
Asril et al (2014)., melaporkan karakteristik kitinase yang berbeda yaitu aktivitas kitinase dari Bacillus thuringiensis SAHA optimum di kondisi netral pada pH 7 sebesar 0,721 U/mL. Penelitian lainnya menyatakan hasil yang berbeda yaitu aktivitas kitinase dari bakteri Flavobacterium sp. memiliki aktivitas