Pendahuluan
Di dalam tanah, bakteri menghasilkan eksopolisakarida untuk melindungi
sel dari kekeringan atau menempel pada suatu substrat untuk memenuhi
kebutuhan nutrisinya. Eksopolisakarida bakteri banyak dijumpai di sekeliling struktur luar sel serta berhubungan erat dengan bentuk kapsul sel bakteri atau yang diekskresikan ke medium pertumbuhan dalam bentuk slime. Eksopolisakarida merupakan polimer dengan bobot molekul tinggi yang tersusun dari monosakarida dan beberapa bahan non karbohidrat seperti asetat, piruvat, suksinat, dan fosfat. Struktur dan komposisi eksopolisakarida yang dihasilkan oleh bakteri tergantung pada beberapa faktor lingkungan seperti medium, sumber karbon dan nitrogen, sistem fisiologi bakteri (aerobik atau anaerobik), dan kondisi fermentasi (pH, temperatur, konsentrasi oksigen). Pada umumnya eksopolisakarida dapat diperoleh secara optimum pada pH 7, temperatur 30-370
Beberapa bakteri penghasil eksopolisakarida yang telah dilaporkan antara lain Pseudomonas aeruginosa, Erwinia, Ralstonia, dan Azotobacter vinelandii (Saile et al. 1997). Burdman et al. (2000) mengatakan bahwa Azospirillum
brasilense menghasilkan eksopolisakarida dalam bentuk arabinosa yang
berkorelasi dengan tingkat kemampuannya membentuk agregat. Produksi
polisakarida dilakukan dengan cara menumbuhkan A. brasilense di dalam medium
yang mengandung pewarna fluorescent yang dapat berikatan dengan β-1,4 dan
β-1,3 glukan. Sementara itu Samet et al. (2004) melaporkan eksopolisakarida dihasilkan oleh strain tipe liar maupun mutan dari A. brasilense. Di dalam medium fruktosa sintetik, strain tipe liar menghasilkan EPS yang kaya akan glukosa selama fase pertumbuhan eksponensial dan EPS yang kaya akan arabinosa selama fase pertumbuhan stasioner dan fase kematian. Hasil penelitian
tersebut juga mengindikasikan bahwa EPS yang mengandung arabinosa
memegang peranan penting dalam agregasi sel. Di lain pihak, rata-rata produksi EPS oleh Vibrio harveyi strain VB23 lebih tinggi selama masa pertumbuhan C dengan menggunakan sukrosa atau glukosa sebagai sumber karbon (Sutherland 2001b; Duta et al. 2004; Bueno & Garcia-Cruz 2006).
eksponensial akhir jika dibandingkan dengan masa pertumbuhan stasioner (Bramhachari & Dubey 2006). Berdasarkan hasil penelitian yang dilakukan oleh Emtiazi et al. (2004), diketahui bahwa 1% sukrosa merupakan sumber karbon terbaik untuk produksi eksopolisakarida dari Azotobacter strain AC2. Kondisi optimum yang diperlukan untuk sintesis eksopolisakarida dari Halomonas
ventosae dan H. anticariensis adalah di dalam medium dengan konsentrasi garam
laut 7.5%, temperatur 32o
Burkholderia tropica menghasilkan sejumlah besar eksopolisakarida di
dalam medium pertumbuhan sintetik yang mengandung manitol dan glutamat sebagai sumber karbon dan nitrogen (Serrato et al. 2006). Pseudomonas sp. UBF 2 menghasilkan polisakarida sebanyak 8.6 g/l di dalam medium sintetik yang mengandung 2% (b/v) glukosa (El-Tayeb & Khodair 2007). Bradyrhizobium
japonicum USDA 110 menghasilkan eksopolisakarida dalam bentuk kapsul dan
bentuk terlarut yang jumlahnya bervariasi tergantung pada sumber karbon. Dilaporkan bahwa produksi tertinggi eksopolisarida bakteri tersebut diperoleh dari sumber karbon pentosa, asam organik, gula asam, dan poliols (alkohol gula, seperti sorbitol) serta hasil yang sedikit lebih rendah di dalam heksosa dan asam amino.
C, pengadukan atau aerasi 100 rpm dan menggunakan 1% glukosa sebagai sumber karbon (Mata et al. 2006).
Hasil penelitian Tully (1988) terhadap Bradyrhizobium japonicum USDA 110 yang ditumbuhkan dalam medium dengan sumber karbon hidroaromatik (asam sikimat, asam quinat, asam adipat), L-arabinose, dan glukosa menunjukkan bahwa produksi eksopolisakarida yang dihasilkan oleh bakteri tersebut paling baik di dalam asam adipat, sedangkan masa pembelahan sel tercepat di dalam asam kuinat dan sikimat, masing-masing tujuh dan tiga belas jam. Berdasarkan hasil penelitian tersebut disimpulkan bahwa produksi eksopolisakarida tidak berkorelasi terhadap laju pertumbuhan.
Sifat tanah yang dipengaruhi oleh polisakarida meliputi : (i) kapasitas pertukaran kation (kontribusi dari gugus COOH asam uronik), (ii) retensi anion
(terjadi pada gugus NH2), dan aktivitas biologi (sumber energi bagi
mikroorganisme tanah). Sementara itu, kemantapan agregat yang dipengaruhi oleh polisakarida berhubungan dengan viskositas, berat molekul, dan jumlah
polisakarida yang dapat diadsorpsi. Adsorpsi polisakarida oleh liat tergantung pada konformasi dan konfigurasi molekul, khususnya ikatan β-glikosidik. Ikatan
ini memberikan konformasi untuk hubungan tertutup atau terdekat antara polisakarida dan permukaan liat. Penelitian mengenai peran polisakarida di dalam
tanah terutama difokuskan pada fungsinya sebagai bahan perekat untuk memantapkan agregat tanah (Oades 1989).
Sejumlah bakteri mengekskresikan polisakarida ke dalam lingkungannya atau tetap berada di permukaan sel bakteri sebagai kapsul polisakarida. Jumlah dan komposisi eksopolisakarida ini bervariasi antar genus dan spesies dan dalam beberapa kasus juga tergantung pada kondisi lingkungan di sekitarnya (Laus et al. 2005). Bakteri Gram negatif menghasilkan beberapa jenis eksopolisakarida penting yang dapat digunakan untuk menetapkan hubungan antara
mikroorganisme dengan tanaman dan hewan. Rhizobacteria penambat N2 non
simbiotik dari genus Azospirillum banyak dijumpai di daerah sekitar perakaran dan memberikan pengaruh yang menguntungkan terhadap pertumbuhan dan produktivitas beberapa tanaman pertanian dan perkebunan penting lainnya (Okon & Labandera-Gonzalez 1994; Ahmad et al., 2005; Akbari et al., 2007). Bakteri
penambat N2
Polisakarida yang terdapat pada permukaan sel bakteri secara umum terdapat dalam dua bentuk yaitu lipopolisakarida dan eksopolisakarida (Weiner et
al. 1995). Lipopolisakarida mengikat permukaan sel melalui penempelan dengan
lipid, sementara eksopolisakarida (EPS) berasosiasi dengan permukaan sel sebagai sebuah kapsul. EPS memiliki heterogenisitas dalam strukturnya, mulai dari struktur sederhana, ikatan α 1-4, berupa rantai glukosa tidak bercabang yang disebut dekstran sampai dengan struktur yang kompleks dengan ikatan bercabang atau substitusi heteropolisakarida yang tersusun dari sub unit berulang oligosakarida yang disebut dengan xantan dan asam kolanik. EPS dapat juga disubstitusi, umumnya ikatan ester dan N dengan piruvat, asetat, format, sulfat, fosfat dan gugus lainnya. Menurut Sutherland (1997) sejumlah bakteri dapat
non simbiotik seperti Azospirillum, Klebsiella dan Azotobacter diketahui memiliki kemampuan untuk meningkatkan agregasi dan flokulasi tanah. Kemampuan tersebut sangat dipengaruhi oleh penyebaran dan ketahanan hidup mikroorganisme ini di dalam tanah.
mensintesis polisakarida dalam bentuk alginat. Telah banyak penelitian mengenai eksopolisakarida tersebut yang dihasilkan oleh Azotobacter vinelandii,
Pseudomonas aeruginosa, P. fluorescens, dan P. putida. Sementara itu Wang et al. (2007) melaporkan bahwa eksopolisakarida larut air yang diperoleh dari P. agglomerans strain KFS-9 asal isolasi dari hutan mangrove mengandung
protein yang berikatan dengan polisakarida. Eksopolisakarida ini tersusun atas arabinosa, glukosa, galaktosa, dan asam glukoronik dengan perbandingan molar 1.0:2.2:2.8:0.9. Sementara itu, komposisi monosakarida yang berasal dari eksopolisakarida asam bakteri B. tropica terdiri atas Glc, Rha, Glc A dengan perbandingan molar 1:2:2 (Serrato et al. 2006). Komponen utama dari fraksi karbohidrat eksopolisakarida H. ventosae adalah glukosa, manosa, dan galaktosa
(molar ratio 1.75: 4:1) untuk strain A112T dan 1.25:4.1 untuk strain A116.
Eksopolisakarida dari spesies bakteri tersebut juga mengandung sejumlah kecil xilosa, arabinosa, dan asam galakturonat. Sedangkan eksopolisakarida yang dihasilkan oleh H. anticariensis mengandung glukosa, manosa dan asam galakturonat dengan molar ratio 1:3:2.5 untuk strain FP35T
Beberapa spesies bakteri dapat menghasilkan sejumlah eksopolisakarida yang berbeda struktur kimianya. Sebagai contoh lebih dari 70 eksopolisakarida yang berbeda ditemukan pada Escherichia coli. Sebaliknya spesies lainnya hanya menghasilkan eksopolisakarida dalam jumlah yang terbatas atau hanya satu jenis saja. Karakterisasi polisakarida bakteri dalam suatu larutan umumnya sulit untuk dilakukan karena memiliki heterogenisitas kimia yang cukup tinggi, ikatan multiganda, berat molar yang tinggi, distribusi berat molar yang luas dan viskositas tinggi. Polimer berantai panjang dan pendek disintesis walaupun pada umumnya terdapat satu berat molekul polimer yang paling dominan (Weiner et al. 1995). Hasil penelitian yang dilakukan oleh Iqbal et al. (2002) menunjukkan bahwa eksopolisakarida bakteri mengandung gugus hidroksil, karboksil, dan N. Selain itu pula Becker et al. (2002) juga mengemukakan bahwa bakteri
Sinorhizobium meliloti menghasilkan eksopolisakarida suksinoglikan yang
bersifat masam. Eksopolisakarida ini tersusun atas unit berulang oktasakarida yang mengandung satu galaktosa dan tujuh residu gula yang saling berikatan dan
dan 1:2.5:2.2 untuk strain FP36 dan sedikit xilosa dan ramnosa (Mata et al. 2006).
dihubungkan oleh β-1-3, β-1-4 dan β-1-6 glikosidik. Struktur unit berulang dapat mengandung gugus asetil, pirufat, dan suksinil. Penelitian dengan metode spektra Infra Red (IR) untuk mengkarakterisasi struktur eksopolisakarida Pseudomonas dilakukan oleh Emnova et al. (2006). Dari hasil penelitian ini diketahui bahwa ada penyerapan pita secara spesifik untuk gugus hidroksil (-OH) dan eter (-C-O) namun tidak terlihat pada gugus karboksil (-COOH) dan -COOR. Oleh karena itu, eksopolisakarida dari genus tersebut diduga sebagai polimer levan. Adanya gugus sulfur (-C-S atau –S-S) di dalam rantai eksopolisakarida Pseudomonas memberikan suatu peluang bahwa bakteri atau eksopolisakarida dari bakteri tersebut dapat digunakan sebagai obyek pengembangan bioteknologi pertanian dan farmasi.
Tujuan
Penelitian ini dimaksudkan untuk menetapkan: (i) jenis dan tingkat konsentrasi sumber karbon optimum untuk produksi eksopolisakarida dari
B. cenocepacia strain KTG dan (ii) gugus fungsional yang terdapat pada
eksopolisakarida B. cenocepacia strain KTG.
Bahan dan Metode Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Mikroba dan Bioproses, Balai Penelitian Bioteknologi Perkebunan, Pusat Penelitian dan Pengembangan Teknologi Mineral dan Batubara, Bandung untuk kegiatan scanning electron
microscope (SEM) dan Laboratorium Bio-Farmaka, Institut Pertanian Bogor
untuk penetapan eksopolisakarida dengan fourier-transformed infrared
spectroscopy (FTIR). Penelitian dilaksanakan pada bulan Juni-November 2009.
Produksi Eksopolisakarida
Optimasi produksi eksopolisakarida B. cenocepacia strain KTG ditetapkan
berdasarkan metode yang dikemukakan oleh Emtiazi et al. (2004).
B. cenocepacia strain KTG ditumbuhkan pada temperatur 280C di atas mesin pengocok dengan kecepatan 200 rpm selama 72 jam. Medium uji yang digunakan
untuk menetapkan optimasi produksi eksopolisakarida adalah 50 ml medium cair ATCC no. 14 dengan enam sumber dan tiga tingkat konsentrasi karbon. Sumber karbon yang digunakan masing-masing terdiri atas: (i) sukrosa, (ii) glukosa, (iii)
4-hydroxyphenyl acetic acid (4-HAA), (iv) manitol, (v) glutamat, dan (vi) laktosa
(Moreno et al. 1999; Serrato et al. 2006). Sementara itu, tingkat konsentrasi karbon yang digunakan masing-masing: 1, 2, dan 3% (b/v).
Pengamatan Morfologi Eksopolisakarida Bakteri dengan Menggunakan Scanning Electron Microscope (SEM)
Pemurnian eksopolisakarida untuk pengamatan morfologi dengan menggunakan SEM dilakukan dengan memanen eksopolisakarida B. cenocepacia strain KTG dari medium cair ATCC no.14 dengan cara sentrifugasi 14 000 g selama 30 menit untuk memisahkan sel dan supernatan. Eksopolisakarida yang terdapat dalam supernatan selanjutnya dipanen dengan menambahkan aseton (1 bagian supernatan : 3 bagian aseton) dan disentrifugasi kembali 14 000 g selama 30 menit. Selanjutnya endapan yang terbentuk dicuci dengan 70% etanol dan dilarutkan kembali dengan akuades. Eksopolisakarida ini dimurnikan kembali dengan setil-trimetil-amonium bromida [1:1, (Merck 2342)]. Ditambah dengan etanol di dalam larutan 10% NaCl. Selanjutnya dicuci kembali dengan akuades dan dikeringkan (El-Tayeb & Khodair 2007).
Karakterisasi Gugus Fungsional Eksopolisakarida B. cenocepacia Strain KTG
Karakterisasi gugus fungsional eksopolisakarida B. cenocepacia strain KTG dilakukan dengan fourier transform infrared (FTIR). Pellet yang digunakan untuk analisis infra red diperoleh dengan cara menghaluskan 2 mg eksopolisakarida yang sudah dicampur dengan 200 mg KBr kering, selanjutnya campuran ditekan sampai membentuk lingkaran tipis dengan diameter 16 mm. Spektrum FTIR ditetapkan dan dibaca dengan alat Bruker Tensor 27 (Bruker SA, Wissembourg,
France) pada bilangan gelombang 4000–400 cm−1. Pembacaan spektrum yang
Hasil
Produksi Eksopolisakarida
Hasil penelitian ini menunjukkan bahwa sumber karbon terbaik bagi
B. cenocepacia strain KTG adalah sukrosa dan 4-hydroxyphenyl acetic acid.
Dengan sumber karbon sukrosa konsentrasi 2% (b/v) dihasilkan bobot kering
eksopolisakarida rata-rata 5.03 mg/ml. Sedangkan sumber karbon
4-hydroxyphenyl acetic acid dengan konsentrasi 3% (b/v) menghasilkan bobot kering eksopolisakarida rata-rata 6.9 mg/ml (Tabel 6).
Tabel 6 Bobot kering eksopolisakarida yang dihasilkan B. cenocepacia strain KTG di dalam medium ATCC no.14 dengan enam jenis sumber karbon konsentrasi 1, 2, dan 3% (b/v) selama 72 jam inkubasi
Sumber karbon
Konsentrasi (% b/v)
Bobot kering eksopolisakarida (mg/ml) Sukrosa 1 2 3 0.89 fg 5.03 b *) 1.15 ef Glukosa 1 2 3 0.35 i 0.25 i 0.45 hi 4-HAA 1 2 3 0.90 fg 2.75 c 6.90 a Laktosa 1 2 3 0.70 gh 1.25 e 1.25 e Manitol 1 2 3 0.25 i 1.60 d 0.90 fg Glutamat 1 2 3 0.16 i 0.16 i 0.31 i Koefisien keragaman (%) 10.7 *)
Angka dalam kolom yang sama yang diikuti dengan huruf yang sama tidak berbeda nyata menurut uji jarak ganda Duncan (P>0.05).
Pengamatan Morfologi Eksopolisakarida Bakteri dengan Menggunakan Scanning Electron Microscope (SEM)
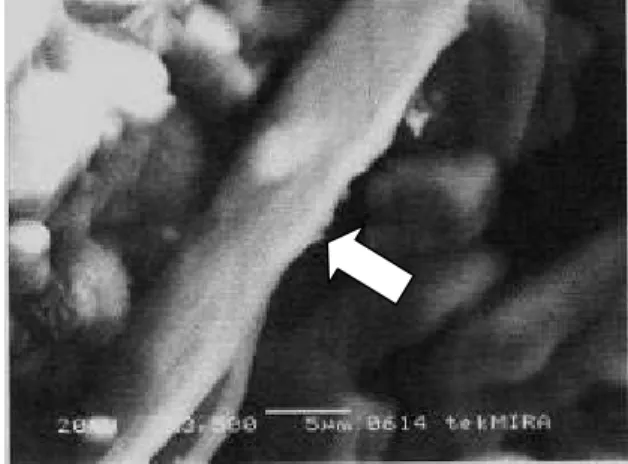
Berdasarkan pengamatan morfologi yang diperoleh dari hasil scanning diketahui bahwa eksopolisakarida yang dihasilkan oleh B. cenocepacia strain KTG berbentuk seperti serat, berwarna putih, dan sebagian lagi terdiri atas lembaran-lembaran berjonjot dengan ukuran yang lebih pendek (Gambar 3).
Gambar 3 Scanning electron microscope eksopolisakarida B. cenocepacia strain KTG (tanda panah, perbesaran 3500x).
Karakterisasi Gugus Fungsional Eksopolisakarida B. cenocepacia Strain KTG
Eksopolisakarida yang dihasilkan oleh tiga bakteri potensial yang ditumbuhkan dalam medium ATCC no. 14 dengan sumber karbon sukrosa memiliki dominasi gugus fungsional utama atas dasar kekuatan pita absorpsi pada bilangan gelombang 3406-3366 cm-1, 2929-2927 cm-1, 1633-1630 cm-1, dan
1058-1052 cm-1. Kisaran absorpsi tersebut masing-masing menandakan gugus
-O-H (hidroksil); C-H, CH3 (alifatik); -C=O (karbonil); dan C-C, C-OH, C-O-C
(ikatan glikosidik). Hal yang membedakan pita spektrum FTIR B. cenocepacia strain KTG dengan dua isolat lainnya adalah terdapat absorpsi lemah pada
2365 cm-1 yang menandakan ada ikatan OH dalam rangkaian polimer ini
(Tabel 7). Dengan penggunaan sumber karbon yang berbeda di dalam medium pertumbuhan B. cenocepacia strain KTG, maka kekuatan pita absorpsi pada pembacaan bilangan gelombang FTIR akan berbeda pula (Gambar 4).
Tabel 7 Penetapan gugus fungsional B. cenocepacia strain KTG dan dua bakteri potensial penghasil eksopolisakarida lainnya.
Spesies/Kode bakteri Bilangan gelombang (cm-1 Gugus fungsional ) B. cenocepacia strain KTG (3.3) 3406 2927 2365 1630 1058 -OH dan N-H C-H, CH3 -OH -C=O -C-O-C (glikosidik) Rhizobium tropici (2.6) 3390 2929 1633 1052 -OH dan N-H C-H, CH Stenotrophomonas maltophilia (5.5) 3 -C=O -C-O-C (glikosidik) 3366 2929 1601 1052 -OH dan N-H C-H, CH3
C=O rantai terbuka -C-O-C (glikosidik)
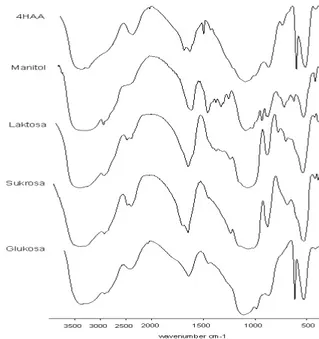
Gambar 4 Spektrum infra red gugus fungsional utama eksopolisakarida B.
cenocepacia strain KTG yang ditumbuhkan dalam medium ATCC
no. 14 dengan sumber karbon glukosa, sukrosa, laktosa, manitol, dan 4-hydroxyphenyl acetic acid.
Keterangan gambar : Jenis karbon Bilangan gelombang (cm-1) Gugus fungsional 4-HAA 3397 2409 1650.9 1447 1135 -O-H dan N-H -OH -C=O -C-H -C-C, C-OH, C-O-C Manitol 3276 2933.6 1615.7 1457 1377 1253 -O-H dan N-H -C-H -C=C dan COO -CC-H --COOH 3 Aromatik C-O Laktosa 3397.8 2425.3-2482 1648.8 1378 1072-883 -O-H dan N-H -OH -C=O -COOH -O-CH Sukrosa 3 3383 2926.3 2427.7 1649.2 1456 1115-992.9 -OH -CH, CH -OH 3 -C=O -CC-H C-C, C-OH, C-O-C 3 Glukosa 3395.9 2924.8 2479-2402 1651.9 1541 1454 1239.7 -OH -CH, CH -OH 3 -C=O -N-H, C=N -C-H C-O, C-OH
Namun demikian, secara umum dapat dikatakan bahwa eksopolisakarida yang dihasilkan B. cenocepacia strain KTG di dalam medium ATCC no. 14 dengan sumber karbon yang berbeda memiliki dominasi gugus fungsional utama
atas dasar kekuatan pita absorpsi pada bilangan gelombang 3397-3383 cm-1,
2933-2924 cm-1, 1651-1648 cm-1, dan 1115-1068 cm-1. Kisaran absorpsi tersebut
masing-masing menandakan gugus O-H (hidroksil); C-H, CH3 (alifatik); C=O
Karakterisasi gugus fungsional eksopolisakarida melalui analisis FTIR juga dilakukan terhadap B. cenocepacia strain KTG yang ditumbuhkan di dalam medium ATCC no.14 dengan penambahan FPR, FPS, dan FPT. Hasil analisis disajikan secara lengkap dalam Tabel 8.
Tabel 8 Penetapan gugus fungsional eksopolisakarida B. cenocepacia strain KTG yang ditumbuhkan dalam medium ATCC no. 14 yang mengandung FPR, FPS, dan FPT
Fraksi pasir Bilangan gelombang
(cm-1 Gugus fungsional ) FPR 3396 2939 1638 1403 1128 -OH C-H C=O COO- C-C, C-OH, C-O-C antisimetrik FPS 3403 2935 1636 1400 1126 O-H dan N-H C-H C=O COO- C-C, C-OH, C-O-C antisimetrik FPT 3400 2937 1637 1406 1126 O-H dan N-H C-H C=O COO- C-C, C-OH, C-O-C antisimetrik
Berdasarkan hasil yang disajikan pada Tabel 8 diketahui bahwa eksopolisakarida B. cenocepacia strain KTG yang ditumbuhkan dalam medium ATCC no.14 dengan penambahan FPS dan FPT memiliki kesamaan dalam hal bilangan gelombang yang dihasilkan. Apabila eksopolisakarida B. cenocepacia strain KTG yang dihasilkan dalam FPS dan FPT dibandingkan dengan yang dihasilkan dalam FPR, perbedaan dalam FPR terdapat pada bilangan gelombang 3396 cm-1 yang menandakan ikatan OH dan N-H.
Pembahasan
Pada umumnya bakteri penghasil eksopolisakarida akan tumbuh baik di dalam medium dengan sumber karbon yang mudah dioksidasi. Dengan menggunakan sukrosa dan 4-hydroxy-phenyl acetic acid, B. cenocepacia strain KTG menghasilkan bobot kering eksopolisakarida yang lebih tinggi jika dibandingkan dengan penggunaan glukosa, laktosa, manitol, dan glutamat di dalam medium ATCC no. 14. Diperkirakan bahwa B. cenocepacia strain KTG lebih mudah memetabolismekan sukrosa dan 4-hydroxy-phenyl acetic acid dibandingkan dengan penggunaan empat sumber karbon lain yang diujikan dalam penelitian ini. Kemudahan dalam menggunakan sukrosa dan 4-hydroxy-phenyl
acetic acid sebagai sumber energi ini memungkinkan untuk pertumbuhan dan
pembentukan biomassa sel B. cenocepacia strain KTG secara optimal.
Bobot eksopolisakarida yang dihasilkan B. cenocepacia strain KTG ini juga lebih tinggi dibandingkan dengan yang diperoleh oleh Moreno et al. (1999) dari
Azotobacter vinelandii dengan menggunakan sukrosa dan 4-hydroxy-phenyl acetic acid yaitu 1.2 mg/ml. Hasil penelitian ini mendukung penelitian yang telah
dilakukan bahwa sukrosa merupakan sumber karbon terbaik untuk produksi eksopolisakarida dari Azotobacter strain AC2 (Emtiazi et al. 2004) dan
Pseudomonas diminuta (Santi et al. 2008).
Beberapa bakteri mengeksresikan eksopolisakarida di sekitar lingkungan pertumbuhannya. Jumlah dan komposisi eksopolisakarida ini sangat bervariasi tergantung pada genus dan spesies bakteri. Dalam beberapa kasus tergantung pula pada kondisi lingkungan pertumbuhan bakteri yang bersangkutan. Bakteri sangat membutuhkan energi untuk menghasilkan eksopolisakarida. Oleh karena itu, adanya sumber karbon di dalam media tumbuh selain dapat berfungsi sebagai komponen pembentukan sel dapat pula berfungsi sebagai sumber energi yang diperlukan untuk sintesis dan ekskresi eksopolisakarida.
Morfologi eksopolisakarida pada tampilan scanning electron microscope (SEM) menggambarkan bahwa eksopolisakarida bakteri bersifat hidrat dengan 99% berat basah terdiri atas air. Sutherland (2001b); Chenu & Stotzky (2002); dan Moppert et al. (2009) menyatakan bahwa eksopolisakarida bakteri memiliki sifat anionik yang memungkinkan untuk mengikat kation. Selanjutnya Emnova et al.
(2006) menyatakan bahwa adsorpsi polisakarida oleh liat tergantung pada konformasi dan konfigurasi molekul, khususnya ikatan β-glikosidik. Ikatan ini memberikan konformasi untuk hubungan terdekat antara eksopolisakarida dan permukaan liat.
Berdasarkan analisis FTIR diketahui bahwa gugus fungsional utama eksopolisakarida yang dihasilkan oleh B. cenocepacia strain KTG terdiri atas –OH, -CH, -C=C, dan C-O-C. Gugus fungsional tersebut ada yang bersifat polar (hidrofilik) dan ada pula yang bersifat nonpolar (hidrofobik). Puncak 3406 cm-1 mengindikasikan keberadaan ikatan hidrogen gugus OH dan OH bebas. Gugus tersebut pembawa sifat hidrofilik pada eksopolisakarida. Selain itu sifat hidrofilik juga dibawa oleh gugus C-H, C-H3 pada puncak 2927 cm-1, absorbsi lemah pada
puncak 2365 cm-1 yang menandakan ada hidrogen dalam bentuk ikatan -OH di
dalam rangkaian eksopolisakarida ini dan –C=O (karbonil) pada puncak
1630 cm-1. Puncak 1058 cm-1 yang terdapat di antara bilangan gelombang 1170-950 cm-1
Menurut Chenu & Stotzky (2002), interaksi antara bakteri dan partikel tanah dikelompokkan dalam mekanisme secara biologi, fisik dan fisik-kimia. Interaksi secara biologi terjadi melalui pertumbuhan dan perbanyakan sel serta ekskresi senyawa organik seperti enzim dan biopolimer lainnya. Sementara interaksi secara fisik berhubungan dengan geometri dan kohesi matrik tanah seperti distribusi ukuran pori, retensi air, kemantapan agregat, dan sifat mekanik tanah. Oleh karena itu interaksi secara fisik sangat tergantung pada ukuran, bentuk, penyusunan dari partikel-partikel tanah. Interaksi secara fisik kimia terjadi dalam
larutan tanah yang meliputi penyerapan, pelarutan, hidrolisis, oksidasi, dan kondisi pH tanah. Karakteristik permukaan partikel tanah yang menentukan dalam interaksi secara fisik-kimia dapat ditinjau dari area permukaan, muatan elektrostatis, dan gugus fungsional. Dapat disimpulkan bahwa secara keseluruhan, interaksi bakteri dan lingkungan tanah terjadi secara simultan yang melibatkan proses biologi, fisik, dan fisik-kimia.
menandakan ikatan glikosidik. Ikatan ini memberikan konformasi untuk hubungan terdekat antara eksopolisakarida dan permukaan liat.
Dalam hal agregasi tanah, khususnya untuk tanah tekstur berpasir, maka
pembentukan mikroagregat. Pembentukan mikroagregat dapat mengoptimalkan jumlah air yang tersedia bagi tanaman. Lebih lanjut Gryze et al. (2006) menyatakan bahwa pada awal proses dekomposisi, senyawa organik yang mudah terdekomposisi akan membentuk senyawa hidrofilik yang berperan dalam meningkatkan kemantapan agregat tanah melalui pengikatan inter partikel.
Kesimpulan
Burkholderia cenocepacia strain KTG menggunakan sukrosa dan 4-Hydroxy-phenyl acetic acid (4-HAA) lebih optimal untuk menghasilkan
eksopolisakarida di dalam medium pertumbuhan ATCC no. 14 dibandingkan dengan penggunaan glukosa, laktosa, manitol, dan glutamat.
Eksopolisakarida B. cenocepacia strain KTG memiliki pola yang konsisten dalam hal karakter gugus fungsional di dalam medium pertumbuhan dengan beberapa sumber karbon dan agregat tanah dengan fraksi pasir yang berbeda.
Dominasi gugus fungsional utama atas dasar kekuatan pita absorpsi pada eksopolisakarida B. cenocepacia strain KTG yang ditumbuhkan pada sumber karbon sukrosa, glukosa, manitol, laktosa, dan 4-HAA menandakan gugus O-H (hidroksil), -C-H, C-H3 (alifatik), -C=O (karbonil), dan C-C, C-OH, C-O-C
(penciri ikatan glikosidik). Pada medium ATCC no.14 yang masing-masing ditambah bahan tanah steril FPR, FPS, dan FPT, eksopolisakarida B. cenocepacia strain KTG memiliki gugus fungsional dominan yang bersifat hidrofilik; -OH, -CH, -CH3, dan –C=O serta konfigurasi ikatan α dan β. Karakteristik gugus
fungsional yang terdapat dalam eksopolisakarida tersebut memungkinkan untuk perekatan dengan permukaan partikel tanah.