2 Tinjauan Pustaka
2.1 Nitrogen Amonia
Nitrogen merupakan nutrien dasar untuk semua bentuk kehidupan, bahkan perubahan yang sangat kecil dari kadar nitrogen yang tersedia di alam dapat mempengaruhi tingkat kehidupan mikroorganisme, tumbuhan dan hewan.4
Pada air dan air limbah, bentuk-bentuk nitrogen yang sangat menarik perhatian yaitu nitrat, nitrit, amonia, dan nitrogen organik. Semua bentuk nitrogen ini, begitu juga gas nitrogen (N2), dapat dipertukarkan secara biokimia dan merupakan komponen dari siklus nitrogen.5
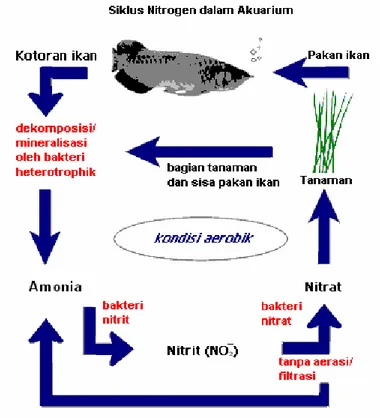
Siklus nitrogen di lingkungan hidrosfer dapat diilustrasikan sebagai Gambar 2.1 berikut.
Gambar 2.1 Siklus nitrogen di lingkungan hidrosfer
Nitrogen organik didefinisikan sebagai nitrogen yang terikat dengan karbon, yang mempunyai bilangan oksidasi negatif tiga. Nitrogen organik dan amonia dapat ditentukan
secara bersama-sama dan disebut sebagai nitrogen kjeldahl.Yang termasuk nitrogen organik antara lain protein dan peptida, asam nukleat dan urea. Konsentrasi nitrogen organik bervariasi dari 100 µg L-1 di beberapa danau hingga lebih dari 20 mg L-1 pada limbah
mentah.5
Total nitrogen teroksidasi merupakan penjumlahan nitrogen nitrat dan nitrit. Nitrat biasanya terdapat dalam skala renik pada permukaan air tetapi dapat mencapai skala yang tinggi pada air tanah. Pada jumlah yang berlebihan, nitrat berkontribusi terhadap penyakit yang dikenal sebagai metemoglobinemia pada bayi. Dengan batas 10 mg nitrat sebagai nitrogen L-1 telah ditetapkan pada air minum untuk mencegah penyakit ini. Nitrat merupakan nutrien yang penting untuk autotrof yang berfotosintesis dan telah dikenal sebagai nutrien pembatas-pertumbuhan (growth-limiting nutrient).5
Nitrit merupakan nitrogen dengan bilangan oksidasi di antara nitrat dan nitrogen organik. Nitrit dapat masuk ke dalam sistem persediaan air karena kegunaannya sebagai inhibitor korosi pada industri pemrosesan air. Nitrit merupakan agen etiologik yang sebenarnya dari metemoglobinemia. Asam nitrit, yang dibentuk dari nitrit dalam larutan asam, dapat bereaksi dengan amina sekunder (RR’NH) membentuk nitrosamin (RR’N-NO), yang diketahui karsinogen.5
Amonia terbentuk secara alami pada air permukaan dan air limbah. Konsentrasinya rendah pada air tanah karena amonia teradsorbsi ke partikel tanah dan tidak segera dilepaskan dari tanah. Amonia diproduksi dari deaminasi senyawa yang mengandung nitrogen organik dan dari hidrolisis urea. Konsentrasi amonia dalam air bervariasi dari 10 µg nitrogen amonia L-1 pada air permukaan dan air tanah hingga lebih dari 30 mg L-1 pada air limbah.5
Oleh karena itu, untuk mempermudah pembahasan kita tentang nitrogen, dapat dinyatakan bahwa nitrogen organik ditulis sebagai N organik, nitrogen nitrat sebagai N-NO3-, nitrogen
nitrit sebagai N-NO2-, dan nitrogen amonia sebagai N-NH3.5
Amonia merupakan produk akhir utama dari dekomposisi protein pada ikan dan organisme air lainnya. Sumber utama senyawa nitrogen pada pembudidayaan ikan berasal dari makanan yang mengandung protein. Oleh karena itu, kecepatan penghasilan amonia oleh ikan sebanding dengan kecepatan pemberian makanan untuk ikan. Amonia dieksresikan terutama melalui insang, dan dalam urin dan feces. Amonia juga dihasilkan selama dekomposisi zat organik, seperti sisa makanan, oleh bakteri.6
Penentuan amonia dalam air dilakukan dengan mengukur ammoniacal nitrogen yaitu penjumlahan NH3 dan NH4+. Dalam air, terdapat amonia (tak terionisasi) yang beracun
(NH3) dan ion amonium (terionisasi) yang relatif tidak beracun (NH4+). Nitrogen amonia
akan berada sepenuhnya sebagai NH4+ pada pH air yang ada di alam. Bentuk amonia dan ion
amonium dapat berubah satu sama lain dengan mudah, dengan perbandingan amonia terhadap amonium yang sangat bergantung pada pH dan suhu. Amonium terdapat paling banyak ketika pH di bawah 8,75, dan amonia terdapat paling banyak ketika pH di atas 9,75. Total amonia nitrogen (TAN) merupakan penjumlahan dari konsentrasi amonium dan amonia.4
Pada analisis air, kegunaan mengetahui konsentrasi TAN selain untuk memahami biogeokimia nitrogen pada ekosistem air4,7, juga mempunyai gambaran menyeluruh tentang
lingkungan yang merupakan akibat dari aktivitas manusia dan polutan atau mengetahui tingkat eutrofikasi. Selain itu, konsentrasi TAN digunakan sebagai parameter kualitas air.4
2.2 Toksisitas Nitrogen Amonia
Jika pada ikan terdapat amonia secara kronis atau berlangsung lama dengan konsentrasi 0,01 mg L-1, dapat mengakibatkan kelainan pertumbuhan pada ikan seperti kerusakan pada insang dan ginjal, penurunan pertumbuhan, kerentanan terhadap penyakit, gagal berfungsinya otak, dan penurunan dalam kemampuan mengikat oksigen. Sedangkan toksisitas jangka pendek dari amonia dapat mengakibatkan kematian pada ikan atau sindrom akuarium baru, dalam beberapa hari, mulai dari konsentrasi 0,1 mg L-1.6,8
2.3 Reaksi Berthelot
Reaksi pembentukan senyawa indotimol biru, pertama kali dijelaskan oleh Berthelot pada 1859, sudah sangat lazim digunakan untuk penentuan nitrogen amonia secara spektrofotometri.
Reaksi Berthelot adalah reaksi amonia dengan hipoklorit yang menghasilkan monokloramin, yang kemudian bereaksi dengan timol, pada suasana basa, menghasilkan indotimol biru.9
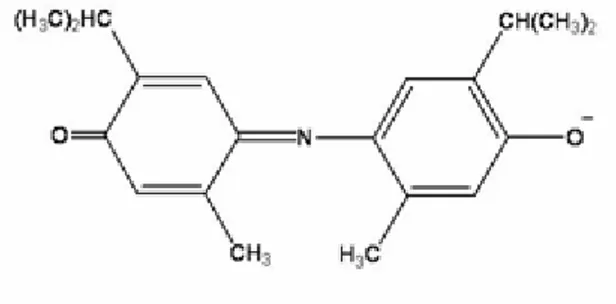
Struktur senyawa indotimol biru yang terbentuk seperti terlihat pada Gambar 2.2 berikut.
Gambar 2.2 Struktur senyawa indotimol biru
Senyawa indotimol biru yang terbentuk mempunyai serapan maksimum di daerah sinar tampak pada panjang gelombang 672 nm dengan intensitas yang cukup baik. Oleh karena itu dapat digunakan sebagai pereaksi untuk analisis nitrogen amonia secara spektrofotometri.
2.4 Metode Analisis untuk Nitrogen Amonia
Penentuan amonia, khususnya pada konsentrasi rendah, memerlukan reaksi kimia untuk mengubah analit menjadi senyawa turunannya sehingga dapat dianalisis secara kolorimetri.7 Dua metode kolorimetri yang sesuai untuk analisis air yaitu metode Nessler dan fenat. Kedua metode ini akan dijelaskan kemudian. Reaksi menggunakan reagen tipe indofenol (metode fenat) merupakan cara yang masih banyak digunakan.7
2.4.1 Metode Nessler
Pada tahun 1856 J. Nessler pertama kali mengusulkan larutan basa merkuri (II) iodida dalam kalium iodida (K2HgI4) sebagai pereaksi untuk penentuan amonia secara kolorimetri.10,11
Sejak itu, berbagai modifikasi dari reagen yang digunakan telah dilakukan. Ketika pereaksi Nessler direaksikan dengan larutan amonium, amonia bereaksi dengan pereaksi tetapi tidak seketika membentuk hasil yang berwarna jingga-coklat, tetapi terflokulasi dengan lama. Hasil yang berwarna jingga-coklat ini mempunyai rumus NH2Hg2I3 (Nichols dan Willets,
1934).11 Akan tetapi metode ini mempunyai kelemahan di antaranya menggunakan logam
berat sebagai pereaksi dan hanya bereaksi dengan amonium (NH4+).
2.4.2 Metode Fenat
Pembentukan warna dari reaksi amonia dengan fenol dan hipoklorit, pertama kali dijelaskan oleh Berthelot pada 1859, merupakan dasar dari metode indofenol. Metode ini telah diteliti
lebih luas, dan berbagai modifikasi dari prosedur ini telah diusulkan. Russell menggunakan ion mangan (II) untuk mempercepat reaksi, sedangkan peneliti lain menggunakan natrium nitroprusida sebagai katalis. Akan tetapi, ada juga beberapa metode indofenol yang tidak menggunakan katalis. Pada beberapa prosedur, kloramin-T digunakan menggantikan hipoklorit. Timol telah digunakan sebagai pengganti fenol.10
Weatherburn, setelah meneliti faktor-faktor yang mempengaruhi kebolehulangan warna indofenol, menganjurkan penggunaan pereaksi fenol, natrium nitroprusida dan hipoklorit seperti yang dahulu digunakan oleh Chaney dan Marbach.
2.4.3 Metode Indotimol
Pada metode indotimol digunakan timol sebagai pengganti fenol, natrium nitroprusida sebagai katalis dan hipoklorit. Pengukuran serapan indotimol biru dilakukan pada panjang gelombang 672 nm.
Selain metode spektrofotometri yang telah disebutkan di atas, nitrogen amonia dapat juga dianalisis dengan metode kromatografi penukar ion atau dengan metode elektrometri menggunakan elektroda selektif ion.
2.5 Prakonsentrasi menggunakan silika-C
18Prakonsentrasi merupakan suatu teknik untuk memekatkan analit sehingga konsentrasinya naik agar dapat diukur secara kuantitatif oleh alat ukur.
Ekstraksi fasa-padat merupakan teknik prakonsentrasi yang memiliki kelebihan dibandingkan ekstraksi cair-cair, seperti penggunaan pelarut yang lebih sedikit, waktu ekstraksi untuk preparasi analit yang lebih cepat dan potensial untuk otomatisasi.12,13
Silika-C18 adalah salah satu jenis material yang dapat digunakan pada teknik ekstraksi
fasa-padat. Silika-C18 bersifat nonpolar (fasa terbalik), berbentuk butiran halus berwarna putih,
dengan ukuran pori 60 Ǻ dan stabil pada kebanyakan pelarut organik. Silika-C18 tidak
menunjukkan gejala pengembangan ataupun penyusutan.12 Unsur renik dapat tertahan pada
Struktur silika-C18 dapat dilihat pada Gambar 2.3 berikut ini.
Gambar 2.3 Struktur silika-C18
Ketika silika-C18 yang bersifat hidrofobik digunakan, reagen pasangan ion direaksikan ke
larutan analit, yang bersifat ionik, terlebih dahulu. Reagen pasangan ion ini memiliki bagian hidrofobik dan bagian ionik. Bagian hidrofobik dari reagen pasangan ion akan berinteraksi dengan silika-C18 yang hidrofobik, sedangkan bagian ionik dari reagen pasangan ion akan
membentuk pasangan ion dengan analit.13
2.6 Analisis Injeksi Alir (Flow Injection Analysis / FIA)
Analisis injeksi alir (Flow Injection Analysis) merupakan metode analitik berdasarkan penginjeksian sampel ke suatu aliran yang tidak bersegmen. Aliran tersebut menuju ke suatu detektor atau sensor untuk direkam sebagai sinyal analitik yang kontinu.14
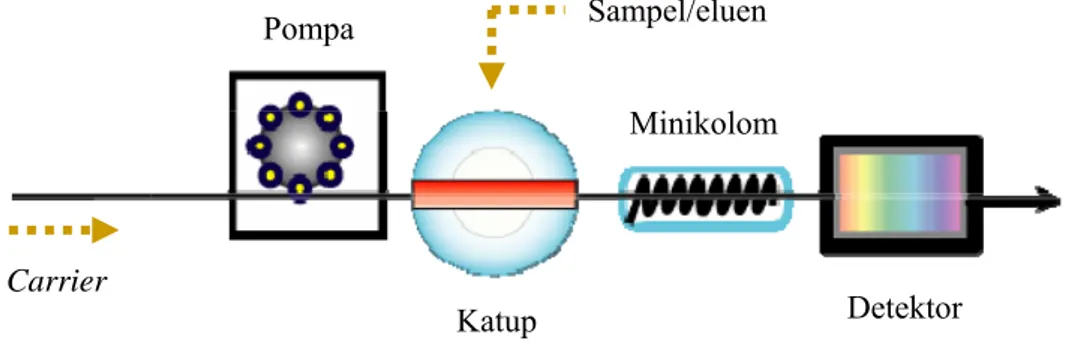
Analisis injeksi alir merupakan metode yang ideal untuk otomatisasi analisis sampel dalam bentuk larutan. Teknik prakonsentrasi yang dikombinasikan dengan metode FIA memiliki keunggulan dibandingkan dengan proses prakonsentrasi biasa. Teknik prakonsentrasi yang dikombinasikan dengan metode FIA berlangsung dalam saluran dan reaktor tertutup sehingga dapat menghindari proses analisis dari kesalahan yang mungkin terjadi akibat pergantian alat, ataupun kontaminasi. Selain itu, pengukuran dengan sistem FIA memerlukan jumlah analit dan reagen yang lebih sedikit, dan menghasilkan presisi yang lebih baik dibandingkan dengan metode analisis biasa.14 Gambar 2.4 memperlihatkan rangkaian sistem
FIA yang digunakan.
Minikolom Pompa Carrier Katup Sampel/eluen Detektor
Pompa peristaltik dalam sistem FIA digunakan untuk mendorong cairan (sampel, reagen maupun carrier) melalui pipa penyalur menuju pipa pencampur, dengan kecepatan alir yang stabil. Kecepatan alir dari pompa dapat diatur dan divariasikan.
Sistem katup 8 jalur digunakan untuk memasukkan sampel maupun eluen dengan volume tertentu ke dalam aliran carrier. Sistem katup ini digunakan untuk mencegah adanya faktor pengganggu dalam sistem zona sampel seperti udara yang kadang-kadang dapat memberikan sinyal pada rekorder.
Jenis detektor yang dipilih disesuaikan dengan karakteristik analit. Pengukuran analit yang memiliki serapan di daerah sinar tampak atau UV dapat menggunakan detektor berupa spektrofotometer UV-Vis. Instrumentasi lain dapat dipergunakan sebagai detektor, disesuaikan dengan kebutuhan, ketersediaan alat, dan tentunya tujuan analisis. Detektor dapat pula dikombinasikan dengan rekorder sehingga sinyal yang dihasilkan instrumen dapat direkam secara digital.
2.7 Kinerja Analitik
Untuk mengevaluasi layak tidaknya suatu metode analisis, beberapa besaran kinerja seperti presisi, linieritas, kepekaan dan limit deteksi harus memberikan nilai yang memenuhi persyaratan tertentu.
2.7.1 Presisi
Presisi menggambarkan kebolehulangan dari pengukuran, yaitu kedekatan antara nilai data yang satu dengan nilai data yang lain, yang diperoleh dengan kondisi pengukuran yang sama. Presisi pengukuran dapat ditentukan dengan melakukan pengukuran berulang. Presisi biasanya dinyatakan sebagai standar deviasi, atau koefisien variansi.12
2.7.2 Linieritas
Linieritas pengukuran suatu metode analitik adalah kemampuan untuk memberikan transformasi matematika yang bagus dan proporsional antara konsentrasi analit dalam sampel dengan daerah konsentrasi yang diberikan. Biasanya linieritas dievaluasi secara grafik, yaitu dengan plot antara tinggi puncak atau luas puncak analit sebagai fungsi dari konsentrasi analit, yang biasa disebut kurva kalibrasi.12 Rentang dinamik pengukuran
diperoleh dari daerah linier pengukuran. Semakin besar nilai rentang dinamik pengukuran maka menandakan kinerja analitiknya semakin bagus.
2.7.3 Kepekaan
Besaran ini menunjukkan seberapa besar konsentrasi analit harus diubah agar diperoleh perubahan sinyal analitik yang kuantitatif.
2.7.4 Limit deteksi
Limit deteksi dapat diartikan konsentrasi minimum analit yang masih terdeteksi secara kuantitatif oleh alat ukur.12 Limit deteksi dapat dihitung melalui perbandingan sinyal analit
(S) terhadap sinyal blanko (N). Nilai S/N = 3 umumnya dipakai sebagai patokan besaran limit deteksi. Nilai sinyal blanko merupakan nilai rata-rata dari pengukuran berulang blanko sebanyak minimal 10 kali.