INTISARI
Diltiazem termasuk zat penghambat kanal kalsium dan merupakan obat yang digunakan untuk terapi hipertensi dan angina pektoris. Uji kualitas sediaan racikan pulveres perlu dilakukan untuk menjamin mutu dan keamanan produk. Penelitian ini bertujuan untuk mengetahui kualitas sediaan racikan pulveres dengan zat aktif diltiazem pada rumah sakit X terkait keragaman bobot, keseragaman kandungan, dan kadar air.
Penelitian ini bersifat non eksperimental deskriptif. Keragaman bobot pulveres diuji dengan menimbang isi pulveres pada tiap bungkus menggunakan neraca analitik. Uji keseragaman kandungan dilakukan dengan menetapkan kadar tiap bungkus pulveres menggunakan metode kromatografi cair kinerja tinggi (KCKT) dengan fase gerak metanol : air (80:20) pada pH 4 ± 0,5. Uji kadar air dilakukan dengan menghitung nilai persen moisture content menggunakan moisture analyzer pada suhu 120˚C selama 90 detik.
Hasil penelitian menunjukkan bahwa pulveres dengan zat aktif diltiazem yang diracik di rumah sakit X memiliki bobot dan kandungan yang tidak seragam, namun telah memenuhi kriteria kadar air yang disyaratkan. Terdapat 14 dari 30 sampel pulveres yang memiliki bobot di luar rentang yang disyaratkan dan memiliki nilai koefisien variasi untuk tiga kali pengambilan sampel sebesar 19,92%; 11,11%; dan 12,04%. Uji keseragaman kandungan menunjukkan bahwa terdapat enam dari sembilan sampel pulveres yang memiliki kandungan di luar rentang yang disyaratkan.
ABSTRACT
Diltiazem is a calcium channel inhibitor and used to treat hypertension and angina pectoris. The quality test of pulveres require to ensure quality and safety of the product. The aim of this research were to determine the quality of pulveres dosage forms with diltiazem as active ingredient in X hospital related to weight variation, content uniformity, and dryness.
This research was non-experimental descriptive. Variation weight of pulveres was tested by weighing the content of each units by analytical balance. Content uniformity test was analyzed by determine content of each units using High Performance Liquid Chromatography (HPLC) with mobile phase methanol : water (80:20) at pH 4 ± 0,5. Dry parameter was tested by calculating the precent moisture content using moisture analyzer on temperature 120˚C for 90 seconds.
This result showed that pulveres in X hospital were not have weight uniformity and content uniformity, but fulfilled moisture content criteria. There were 14 of 30 units out of weight range and has coefficient variation (CV) value for three times sampling were 19,92%; 11,11%; and 12,04%. Content uniformity test showed that six of nine units pulveres did not meet the requirements content range criteria.
UJI KUALITAS SEDIAAN RACIKAN PULVERES DENGAN ZAT AKTIF
DILTIAZEM PADA RUMAH SAKIT X
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Wirna Niki Suprobo
NIM : 118114183
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
UJI KUALITAS SEDIAAN RACIKAN PULVERES DENGAN ZAT AKTIF
DILTIAZEM PADA RUMAH SAKIT X
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Wirna Niki Suprobo
NIM : 118114183
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iv
Halaman Persembahan
vii
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
segala berkat, rahmat, dan karunia-Nya yang begitu besar kepada penulis,
sehingga penulis dapat menyelesaikan skripsi yang berjudul “Uji Kualitas Sediaan
Racikan Pulveres dengan Zat Aktif Diltiazem pada Rumah Sakit X” sebagai salah
satu syarat memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi
Universitas Sanata Dharma.
Penulis menyadari bahwa dalam penyusunan skripsi ini tidak lepas dari
bantuan, kritik, saran dan bimbingan dari banyak pihak. Penulis mengucapkan
terimakasih yang sebesar-besarnya kepada:
1. Seluruh staff Instalasi Farmasi Rumah Sakit X yang telah bersedia
bekerjasama dalam melakukan penelitian ini.
2. P.T. Rama Emerald Multi Sukses yang telah bersedia memberikan
working standard diltiazem yang digunakan dalam skripsi ini.
3. Ibu Dr. Sri Hartati Yuliani, M.Si., Apt. selaku dosen pembimbing utama
yang dengan penuh kesabaran memberikan bimbingan, masukan,
pengarahan, dukungan, semangat, kritik, serta saran selama penelitian
maupun penyusunan skripsi.
4. Bapak Florentinus Dika Octa Riswanto, M.Sc. selaku dosen pembimbing
pendamping yang dengan penuh kesabaran memberikan masukan,
pengarahan, dukungan, semangat, kritik, serta saran selama penelitian
viii
5. Ibu Beti Pudyastuti, M.Sc., Apt. selaku dosen penguji yang telah
memberikan bimbingan, saran, dan kritik yang membangun skripsi ini.
6. Ibu Dita Maria Virginia, S. Farm., Apt., M.Sc. selaku dosen penguji yang
telah memberikan bimbingan, saran, dan kritik yang membangun skripsi
ini.
7. Mas Bimo, Pak Mus, Mas Agung, Pak Ketul, dan Mas Darto selaku
karyawan dan staff laboratorium Fakultas Farmasi Universitas Sanata
Dharma yang telah membantu penulis dalam pengerjaan penelitian di
laboratorium.
8. Seluruh Dosen dan Karyawan Fakultas Farmasi Universitas Sanata
Dharma yang telah memberikan ilmu, bimbingan, pengarahan,
pengalaman, dan masukan selama perkuliahan.
9. Bapak dan Ibu tercinta yang tidak pernah berhenti memberikan doa,
dukungan, dan semangat dalam hidupku.
10.Adik-adikku, yang tidak pernah berhenti mendoakan, memberi semangat,
serta memberikan keceriaan dalam hidupku.
11.Satrio sebagai teman, sahabat, dan rekan kerja dalam penelitian skripsi ini.
Terima kasih atas kerjasama, kesabaran, kepercayaan, keceriaan,
semangat, dan kebersamaannya selama ini.
12.Tante, Mita, Imo, Mba Get, Devina, dan Risda sebagai sahabat dan teman
sepermainan yang selalu memberi canda, semangat, kritik, dan saran yang
ix
13.Teman-teman angkatan 2011 yang bersama-sama berjuang dan mengisi
sebagian cerita hidupku, terimakasih atas kebersamaan, keceriaan, dan
bantuannya selama perkuliahan.
14.Semua pihak yang tidak dapat disebutkan satu persatu, atas segala
bantuan, semangat, dan doa yang diberikan kepada penulis dari awal
penelitian hingga diselesaikannya penulisan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penelitian dan
penulisan skripsi ini karena keterbatasan wawasan dan kemampuan. Penulis
dengan senang hati menerima kritik dan saran baik dari semua pihak dan berharap
semoga skripsi ini dapat bermanfaat bagi pembaca, masyarakat, dan majunya ilmu
pengetahuan farmasi.
Yogyakarta, 29 Mei 2015
x
DAFTAR ISI
HALAMAN JUDUL ... i
PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
HALAMAN PERSETUJUAN PUBLIKASI ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
INTISARI ... xvi
ABSTRACT ... xvii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
1. Rumusan masalah ... 3
2. Keaslian penelitian ... 4
3. Manfaat penelitian ... 4
B. Tujuan Penelitian ... 5
BAB II. PENELAAHAN PUSTAKA... 6
xi
B. Diltiazem ... 7
C. Uji Keragaman Bobot ... 7
D. Uji Keseragaman Kandungan ... 8
E. Uji Kadar Air ... 9
F. Kromatografi Cair Kinerja Tinggi ... 10
G. Validasi Metode Analisis ... 14
H. Keterangan Empiris ... 17
BAB III. METODOLOGI PENELITIAN ... 19
A. Jenis dan Rancangan Penelitian ... 19
B. Variabel Penelitian dan Definisi Operasional ... 19
C. Alat Penelitian ... 21
D. Bahan Penelitian ... 21
E. Tata Cara Penelitian ... 22
F. Analisis Hasil ... 27
BAB IV. HASIL DAN PEMBAHASAN ... 30
A. Uji Keragaman Bobot ... 30
B. Uji Keseragaman Kandungan ... 32
C. Uji Kadar Air dalam Sampel Pulveres ... 47
BAB V. KESIMPULAN DAN SARAN ... 50
A. Kesimpulan ... 50
B. Saran ... 50
DAFTAR PUSTAKA ... 51
xii
xiii
DAFTAR TABEL
Tabel I. Kriteria rentang persen recovery yang diperbolehkan ... 16
Tabel II. Kriteria persen RSD yang diperbolehkan ... 17
Tabel III. Hasil uji keragaman bobot pulveres ... 31
Tabel IV. Data kurva baku diltiazem ... 38
Tabel V. Nilai resolusi peak diltiazem dalam matriks sampel ... 39
Tabel VI. Nilai KV presisi intraday dan interday ... 42
Tabel VII. Nilai persen recovery intraday dan interday ... 43
Tabel VIII.Uji keseragaman kandungan ... 45
xiv
DAFTAR GAMBAR
Gambar 1. Struktur diltiazem ... 7
Gambar 2. Skema instrumen KCKT ... 11
Gambar 3. Diagram pengambilan sampel ... 23
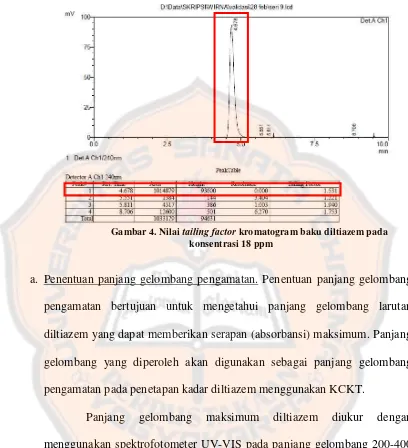
Gambar 4. Nilai tailing factor kromatogram baku diltiazem ... 35
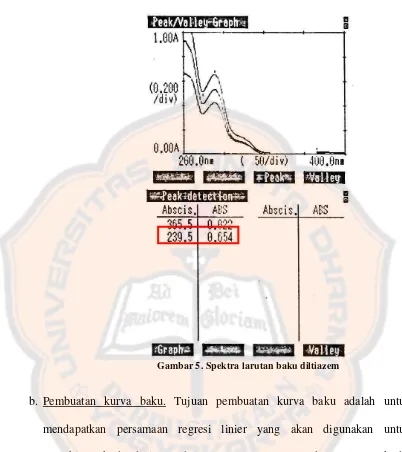
Gambar 5. Spektra larutan baku diltiazem ... 37
Gambar 6. Nilai resolusi peak diltiazem dalam matriks sampel ... 40
xv
DAFTAR LAMPIRAN
Lampiran 1. Certificate of Analysis (CoA) diltiazem ... 54
Lampiran 2. Surat izin penelitian dan pengambilan data ... 55
Lampiran 3. Resep sediaan racikan pulveres ... 56
Lampiran 4. Data penimbangan bobot pulveres ... 57
Lampiran 5. Data penimbangan baku diltiazem ... 58
Lampiran 6. Kromatogram baku diltiazem ... 59
Lampiran 7. Data kurva baku diltiazem ... 61
Lampiran 8. Kurva baku diltiazem ... 61
Lampiran 9. Kromatogram sampel pulveres dengan zat aktif diltiazem 62
Lampiran 10. Data perolehan nilai KV presisi intraday dan interday ... 63
Lampiran 11. Contoh perhitungan nilai koefisien variasi ... 64
Lampiran 12. Data perolehan nilai recovery intraday dan interday ... 65
Lampiran 13. Contoh perhitungan nilai persen recovery ... 65
Lampiran 14. Tabel uji keseragaman kandungan ... 66
xvi
INTISARI
Diltiazem termasuk zat penghambat kanal kalsium dan merupakan obat yang digunakan untuk terapi hipertensi dan angina pektoris. Uji kualitas sediaan racikan pulveres perlu dilakukan untuk menjamin mutu dan keamanan produk. Penelitian ini bertujuan untuk mengetahui kualitas sediaan racikan pulveres dengan zat aktif diltiazem pada rumah sakit X terkait keragaman bobot, keseragaman kandungan, dan kadar air.
Penelitian ini bersifat non eksperimental deskriptif. Keragaman bobot pulveres diuji dengan menimbang isi pulveres pada tiap bungkus menggunakan neraca analitik. Uji keseragaman kandungan dilakukan dengan menetapkan kadar tiap bungkus pulveres menggunakan metode kromatografi cair kinerja tinggi (KCKT) dengan fase gerak metanol : air (80:20) pada pH 4 ± 0,5. Uji kadar air dilakukan dengan menghitung nilai persen moisture content menggunakan moisture analyzer pada suhu 120˚C selama 90 detik.
Hasil penelitian menunjukkan bahwa pulveres dengan zat aktif diltiazem yang diracik di rumah sakit X memiliki bobot dan kandungan yang tidak seragam, namun telah memenuhi kriteria kadar air yang disyaratkan. Terdapat 14 dari 30 sampel pulveres yang memiliki bobot di luar rentang yang disyaratkan dan memiliki nilai koefisien variasi untuk tiga kali pengambilan sampel sebesar 19,92%; 11,11%; dan 12,04%. Uji keseragaman kandungan menunjukkan bahwa terdapat enam dari sembilan sampel pulveres yang memiliki kandungan di luar rentang yang disyaratkan.
xvii
ABSTRACT
Diltiazem is a calcium channel inhibitor and used to treat hypertension and angina pectoris. The quality test of pulveres require to ensure quality and safety of the product. The aim of this research were to determine the quality of pulveres dosage forms with diltiazem as active ingredient in X hospital related to weight variation, content uniformity, and dryness.
This research was non-experimental descriptive. Variation weight of pulveres was tested by weighing the content of each units by analytical balance. Content uniformity test was analyzed by determine content of each units using High Performance Liquid Chromatography (HPLC) with mobile phase methanol : water (80:20) at pH 4 ± 0,5. Dry parameter was tested by calculating the precent moisture content using moisture analyzer on temperature 120˚C for 90 seconds.
This result showed that pulveres in X hospital were not have weight uniformity and content uniformity, but fulfilled moisture content criteria. There were 14 of 30 units out of weight range and has coefficient variation (CV) value for three times sampling were 19,92%; 11,11%; and 12,04%. Content uniformity test showed that six of nine units pulveres did not meet the requirements content range criteria.
1
BAB I PENDAHULUAN
A.Latar Belakang
Obat racikan masih sering diresepkan oleh dokter kepada apoteker dalam
usaha pelayanan kesehatan terutama pada pasien anak dan lanjut usia. Pembuatan
obat racikan dimaksudkan untuk memudahkan dalam menyesuaikan antara dosis
dengan berat badan secara tepat dan dapat dikombinasikan dengan obat lain sesuai
dengan kebutuhan pasien (Wiedyaningsih, 2013). Obat racikan yang sering
digunakan dalam instalasi farmasi baik di rumah sakit atau puskesmas adalah obat
racikan dalam bentuk sediaan cair dan padat. Menurut Wiedyaningsih (2013),
obat racikan dalam bentuk sediaan padat yang sering digunakan adalah pulveres
(serbuk/serbuk dalam kapsul).
Pulveres adalah serbuk yang dibagi dalam bobot yang lebih kurang sama,
dibungkus dengan kertas perkamen atau bahan pengemas lain yang cocok
(Syamsuni, 2006). Secara umum, kelebihan dari sediaan pulveres adalah sesuai
untuk pasien yang mengalami kesulitan dalam menelan bentuk sediaan padat
kompak (tablet atau kapsul), bentuknya lebih stabil jika dibandingkan dengan
bentuk sediaan cair, serta memiliki kecepatan disolusi yang lebih cepat
dibandingkan dengan bentuk sediaan tablet atau kapsul sehingga absorpsinya
menjadi lebih cepat (Aulton, 2002). Selain beberapa kelebihan yang dimiliki,
pulveres memiliki beberapa kekurangan yang dapat menurunkan kualitas sediaan,
perkamen dilakukan secara visual atau tidak ditimbang satu per satu, efektifitas
obat dapat berkurang karena sebagian obat menempel pada mortir-stamper atau
blender saat proses peracikan sehingga jumlah obat yang diberikan kepada pasien
juga berkurang, proses pencampuran yang tidak sesuai dengan Good
Compounding Practice, serta tingkat higienisitas yang cenderung lebih rendah
daripada obat produksi pabrik (Wiedyaningsih, 2013).
Menurut Syamsuni (2006), sediaan racikan pulveres memiliki kualitas
yang baik apabila memenuhi syarat yaitu kering, halus, homogen, seragam dalam
bobot, dan seragam dalam zat yang terkandung. Sediaan racikan yang berkualitas
akan berdampak pada keamanan pasien di mana keamanan pasien merupakan
fokus utama yang sedang menjadi perhatian WHO (Patramurti dan Ismiyati,
2010). Kualitas obat racikan akan lebih baik apabila diracik oleh apoteker atau
tenaga peracik yang telah terlatih dan terdidik. Selain itu, fasilitas pendukung
seperti alat yang digunakan dalam meracik obat juga menjadi salah satu faktor
meningkatnya kualitas obat racikan.
Sedikitnya jumlah tenaga apoteker sebagai peracik resep dibandingkan
dengan jumlah pasien yang menebus resep membuat suatu instalasi farmasi
menggunakan tenaga kerja non apoteker untuk membantu pekerjaan mereka
dalam proses peracikan resep (Dewi dan Wiedyaningtyas, 2012). Selain itu, waktu
peracikan yang sedikit membuat apoteker hanya mempertimbangkan kualitas
sediaan yang terlihat tanpa mempertimbangkan parameter kualitas sediaan lain
seperti keragaman bobot dan keseragaman kandungan zat aktifnya. Proses
tidak sesuai dapat membahayakan kesehatan pasien dan dapat memberikan efek
yang tidak diinginkan pada pasien (Swastiningsih, 2013).
Menurut penelitian yang dilakukan oleh Juniarta (2015), obat racikan
yang paling sering diresepkan di rumah sakit X adalah obat racikan pulveres
dengan zat aktif diltiazem dan klobazam. Instalasi farmasi rumah sakit X
mengkombinasikan diltiazem dengan klobazam untuk terapi pada pasien lanjut
usia dengan gangguan sistem kardiovaskular. Diltiazem termasuk zat penghambat
kanal kalsium dan digunakan untuk terapi hipertensi dan angina pektoris dengan
mekanisme menghambat secara tidak selektif saluaran kalsium (Ca+) tipe L di
pembuluh darah dan jantung (Katzung, Masters, dan Trevor, 2012).
Besarnya pengaruh kualitas sediaan racikan pulveres terhadap keamanan
pasien merupakan salah satu alasan pentingnya dilakukan kontrol kualitas
terhadap sediaan yang dibuat, sehingga penelitian terkait kualitas sediaan racikan
pulveres yang meliputi uji keragaman bobot, uji keseragaman kandungan, dan uji
kadar air perlu dilakukan. Penelitian ini diharapkan dapat memberikan informasi
tentang kualitas sediaan racikan pulveres dengan zat aktif diltiazem yang diracik
di rumah sakit X serta diharapkan dapat memberikan kontribusi terhadap
meningkatnya kualitas peracikan dan hasil racikan pulveres di rumah sakit X.
1. Rumusan masalah
Apakah sediaan racikan pulveres dengan zat aktif diltiazem yang
diracik di rumah sakit X telah memenuhi syarat pulveres yang berkualitas
2. Keaslian penelitian
Penelitian tentang uji keseragaman kandungan zat aktif sediaan
racikan pulveres pernah dilakukan oleh Ismiyati (2008) dengan judul penelitian
“Uji Keseragaman Kandungan Zat Aktif Pulveres Parasetamol dan
Fenobarbital serta Pulveres Ketotifen dan Siproheptadin HCL Rumah Sakit X” dan pernah dilakukan oleh Patramurti dan Ismiyati (2010) dengan judul
penelitian “Safety Assessment Resep Racikan Pasien Anak Mengandung Parasetamol dan Fenobarbital: Tinjauan Keseragaman Kandungan Zat Aktif”.
Sejauh penelusuran pustaka yang peneliti lakukan, penelitian tentang
uji kualitas sediaan racikan pulveres dengan zat aktif diltiazem pada rumah
sakit X yang mencakup uji keragaman bobot, uji keseragaman kandungan, dan
uji kadar air belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat teoritis. Hasil penelitian ini diharapkan dapat bermanfaat bagi
pengembangan ilmu pengetahuan khususnya ilmu kefarmasian mengenai
pentingnya uji kualitas sediaan racikan pulveres serta diharapkan dapat
memberikan kontribusi terhadap meningkatnya kualitas sediaan racikan
pulveres di rumah sakit X.
b. Manfaat praktis. Penelitian ini diharapkan dapat memberikan informasi
mengenai kualitas sediaan racikan pulveres dengan zat aktif diltiazem pada
rumah sakit X terkait keragaman bobot, keseragaman kandungan, dan kadar
B.Tujuan Penelitian 1. Tujuan umum
Menentukan kualitas sediaan racikan pulveres dengan zat aktif
diltiazem yang diracik di rumah sakit X.
2. Tujuan khusus
Mengetahui kualitas sediaan racikan pulveres dengan zat aktif
diltiazem pada rumah sakit X terkait keragaman bobot, keseragaman
6
BAB II
PENELAAHAN PUSTAKA
A.Sediaan Pulveres
Pulveres adalah serbuk yang dibagi dalam bobot yang kurang lebih sama
dan dibungkus dengan kertas perkamen atau bahan pengemas lain yang cocok
(Syamsuni, 2006). Sediaan racikan pulveres yang dibagi tanpa penimbangan
pembagiannya dilakukan paling banyak hanya 20 bungkus untuk menjamin
pembagian yang sama. Apabila lebih dari 20 bungkus, maka serbuk dibagi dalam
beberapa bagian dengan cara penimbangan dan tiap bagian paling banyak menjadi
20 bungkus (Anief, 2000). Sediaan racikan pulveres memiliki kualitas yang baik
apabila memenuhi persyaratan yaitu kering, halus, homogen, seragam dalam
bobot, dan seragam dalam zat yang terkandung (Syamsuni, 2006).
Keuntungan bentuk sediaan pulveres antara lain lebih stabil
dibandingkan dengan bentuk sediaan cair, sesuai digunakan dalam peracikan dosis
besar, dan memiliki kecepatan disolusi yang lebih cepat dibandingkan tablet atau
kapsul, sehingga absorbsinya lebih cepat. Selain beberapa keuntungan, pulveres
juga memiliki beberapa kerugian, yaitu rasa tidak enak atau pahit yang tidak bisa
ditutupi dan tidak sesuai digunakan pada penghantaran obat yang dapat
terinaktivasi di dalam cairan lambung atau dapat merusak dinding lambung
B.Diltiazem
Diltiazem (gambar 1) merupakan zat penghambat kanal kalsium yang
digunakan untuk terapi hipertensi dan semua bentuk angina pektoris dengan
mekanisme menghambat secara tidak selektif pada saluaran kalsium (Ca+) tipe L
di pembuluh darah dan jantung. Efek yang ditimbulkan adalah menurunnya
resistensi vaskular, kecepatan jantung, dan kekuatan jantung yang menyebabkan
penurunan kebutuhan oksigen (O2) (Katzung dkk., 2012).
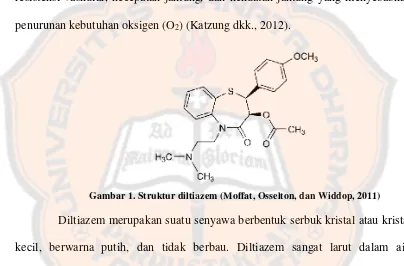
Gambar 1. Struktur diltiazem (Moffat, Osselton, dan Widdop, 2011)
Diltiazem merupakan suatu senyawa berbentuk serbuk kristal atau kristal
kecil, berwarna putih, dan tidak berbau. Diltiazem sangat larut dalam air,
kloroform, diklorometan, asam format, dan metanol, namun tidak larut dalam eter.
Diltiazem memiliki titik lebur pada 207,5ºC sampai dengan 212,0ºC (Moffat dkk.,
2011). Diltiazem memiliki panjang gelombang maksimum pada 240 nm, sehingga
dapat dieteksi menggunakan detektor UV (Sultana, Arayne, Shafi, dan Siddiqui,
2009).
C.Uji Keragaman Bobot
Keseragaman sediaan dosis tunggal dapat ditunjukkan melalui penentuan
2011). Farmakope Indonesia IV (1995) menyatakan bahwa persyaratan
keragaman bobot dapat diterapkan pada produk yang mengandung zat aktif 50 mg
atau lebih yang merupakan 50% atau lebih dari bobot suatu sediaan dan dapat
diterapkan pada sediaan padat (termasuk sediaan padat steril) tanpa mengandung
zat aktif atau inaktif yang ditambahkan. Uji keragaman bobot merupakan
indikator yang paling sederhana dari isi sediaan yang homogen (Podczeck dan
Jones, 2004). Uji keragaman bobot dilakukan sebagai tahap awal identifikasi
untuk mengetahui keseragaman kandungan dari sampel pulveres (Darmawan,
2012). Bobot pulveres yang bervariasi dapat berpengaruh pada keseragaman
kandungan (Ismiyati, 2008). Penyimpangan bobot masing-masing bungkus
pulveres terhadap yang lain adalah tidak boleh lebih dari 10% (Anief, 2000).
D.Uji Keseragaman Kandungan
Keseragaman kandungan merupakan pengukuran variasi kandungan zat
aktif dari satu unit dengan unit yang lain. Faktor-faktor seperti berat jenis
(density), ukuran partikel, dan bentuk partikel mungkin dapat berpengaruh pada
keseragaman sediaan. Keseragaman penting untuk menjamin kesesuaian tiap unit
sediaan berdasarkan literatur tentang penerimaan kriteria keseragaman
kandungan. Prosedur pengujian keseragaman kandungan biasanya menggunakan
metode KCKT (Huynh-Ba, 2009). Farmakope Indonesia IV (1995) menyatakan
bahwa persyaratan keseragaman kandungan dapat diterapkan apabila kandungan
zat aktif terdapat dalam jumlah kecil yaitu kurang dari 50 mg atau kurang dari
Masing-masing sediaan harus memiliki kandungan zat aktif dalam
kisaran yang sempit sesuai dengan persyaratan untuk zat aktif tetentu di sekitar
label klaim (Felton 2012). Menurut Farmakope Indonesia IV (1995), tablet
diltiazem mengandung diltiazem hidroklorida (C22H26N2O6SHCl) tidak kurang
dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
E.Uji Kadar Air
Penggunaan eksipien dalam sediaan obat padat dapat mempengaruhi
stabilitas sediaan obat terutama dapat meningkatkan nilai kadar air dalam obat
(Mahato dan Narang, 2012). Nilai kadar air dalam tablet yang mengandung
magnesium stearat dan serbuk selulosa tidak boleh lebih dari 5% (Yoshioka dan
Stella, 2002). Magnesium stearat adalah eksipien yang paling sering digunakan
dalam formulasi tablet dan digunakan sebagai zat pelicin (Troy, 2006). Eksipien
lain yang sering digunakan dalam formulasi tablet adalah selulosa (Aulton dan
Taylor, 2013).
Peningkatan nilai kadar air (kelembaban) dapat mempengaruhi stabilitas
bahan aktif yang terkandung dalam sediaan obat, sehingga kadar air merupakan
parameter utama dalam uji stabilitas padatan. Pengujian kadar air dapat dilakukan
menggunakan dua metode, yaitu metode Loss on Drying dan Karl Fischer
Titration (Huynh-Ba, 2009).
Metode Loss on Drying digunakan ketika bahan atau sampel yang akan
diuji memiliki jumlah yang berlimpah dan tidak terurai atau melebur pada suhu
110˚C. Metode ini sering digunakan untuk pengujian kadar air pada tablet, zat
titrimetri atau sering disebut metode Karl Fischer Titration didasarkan pada reaksi
secara kuantitatif air dengan larutan anhidrat belerang dioksida dan iodin dengan
adanya dapar yang bereaksi dengan ion hidrogen (Huynh-Ba, 2009).
F. Kromatografi Cair Kinerja Tinggi (KCKT) 1. Definisi
Kromatografi Cair Kinerja Tinggi (KCKT) atau biasa disebut dengan
HPLC (High Performance Liquid Chromatography) merupakan teknik
pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa
tertentu dalam suatu sampel pada sejumlah bidang, antara lain farmasi
lingkungan, bioteknologi, polimer, dan industri-industri makanan. KCKT
merupakan metode yang tidak destruktif dan dapat digunakan baik untuk
analisis kualitatif maupun kuantitatif (Gandjar dan Rohman, 2007). Tujuan
analisis menggunakan KCKT adalah memisahkan analit dari komponen lain
dalam matriks sampel dan mendapatkan kuantifikasi yang akurat untuk setiap
analit (Ahuja dan Dong, 2005).
Sistem KCKT akan membawa sampel masuk ke dalam kolom oleh
fase gerak. Proses pemisahan komponen dalam sampel terjadi karena adanya
interaksi yang berbeda antara komponen dalam sampel dengan fase gerak dan
fase diam yang berada di dalam kolom (Harvey, 2000). Salah satu metode
pemisahan dari KCKT yang biasanya menjadi pilihan pertama untuk
pemisahan dua senyawa dalam matriks sampel adalah sistem KCKT fase
terbalik di mana pada sistem ini fase diam yang digunakan memiliki sifat
digunakan adalah C8 atau C18, sedangkan fase gerak yang sering digunakan
dalam sistem ini adalah campuran air dengan asetonitril (ACN) atau metanol
(MeOH). Dibandingkan dengan KCKT lain (fase normal, penukar ion, dan
lainnya), kromatografi fase terbalik biasanya lebih mudah, tahan, dan dapat
digunakan secara luas. Kolom yang digunakan pada kromatografi fase terbalik
juga lebih efisien dan reprodusibel (Snyder, Kirkland, dan Dolan, 2010).
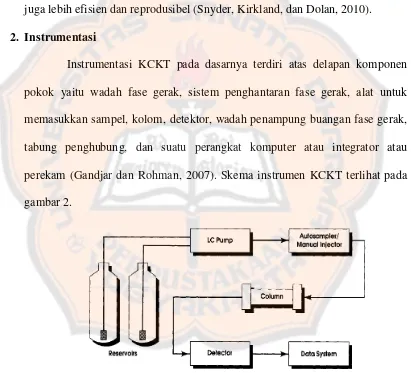
2. Instrumentasi
Instrumentasi KCKT pada dasarnya terdiri atas delapan komponen
pokok yaitu wadah fase gerak, sistem penghantaran fase gerak, alat untuk
memasukkan sampel, kolom, detektor, wadah penampung buangan fase gerak,
tabung penghubung, dan suatu perangkat komputer atau integrator atau
[image:31.595.103.514.249.622.2]perekam (Gandjar dan Rohman, 2007). Skema instrumen KCKT terlihat pada
gambar 2.
Gambar 2. Skema instrumen KCKT (Ahuja danDong, 2005)
a. Wadah fase gerak. Wadah fase gerak harus bersih dan lembam (inert).
Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai
wadah fase gerak. Sebelum digunakan, fase gerak harus di-degassing
akan berkumpul menjadi komponen lain terutama di pompa dan detektor
sehingga akan mengacaukan hasil analisis. Fase gerak juga harus disaring
terlebih dahulu untuk menghindari adanya partikel-partikel kecil. Partikel
kecil ini dapat terkumpul dalam kolom atau dalam tabung yang sempit,
sehingga dapat mengakibatkan kekosongan pada kolom atau tabung tersebut
(Gandjar dan Rohman, 2007).
b. Pompa. Pompa yang digunakan dalam KCKT harus inert terhadap fase
gerak yang digunakan dan sebaiknya mampu memberikan tekanan sampai
5000 psi serta mampu mengalirkan fase gerak dengan kecepatan 3
mL/menit. Bahan yang sering digunakan untuk pompa adalah gelas, baja
tahan karat, teflon, dan batu nilam. Tujuan penggunaan pompa adalah untuk
menjamin proses penghantaran fase gerak berlangsung secara tepat,
reprodusibel, konstan, dan bebas dari gangguan (Gandjar dan Rohman,
2007).
c. Tempat penyuntikan sampel (injector). Sampel-sampel cair dan larutan
disuntikkan secara langsung ke dalam fase gerak yang mengalir dibawah
tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari
tembaga tahan karat dan katup teflon yang dilengkapi dengan keluk sampel
(sample loop) internal atau eksternal. Proses penyuntikan dilakukan dengan
memutar katup sehingga fase gerak mengalir melewati keluk sampel dan
mengalir sampai ke kolom. Kelebihan sampel akan dikeluarkan ke wadah
pembuangan (Gandjar dan Rohman, 2007). Seiring perkembangan jaman,
Sistem ini memudahkan pengguna KCKT untuk mengatur volume yang
akan diinjeksikan berdasarkan program yang ada. Sampel dimasukkan ke
dalam vial, kemudian diletakkan pada rak autosamplers (Kazakevich dan
LoBrutto, 2007).
d. Kolom. Ada dua jenis kolom pada KCKT, yaitu kolom konvensional dan
kolom mikrobor. Kolom pada KCKT biasanya berisi fase diam berupa silika
yang dimodifikasi secara kimiawi, silika yang tidak dimodifikasi atau
polimer-polimer stiren, dan divinil benzene. Oktadesil silika (ODS atau C18)
merupakan fase diam yang paling banyak digunakan karena mampu
memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang,
maupun tinggi (Gandjar dan Rohman, 2007). Proses pemisahan antar
komponen dalam sampel terjadi pada kolom KCKT. Pemisahan terjadi
berdasarkan interaksi antara komponen dalam sampel dengan fase gerak dan
fase diam. Komponen sampel yang bersifat polar akan terelusi lebih dahulu
dan komponen dalam sampel yang bersifat nonpolar akan terelusi lebih lama
dari kolom KCKT fase terbalik. Hal ini disebabkan interaksi antara
komponen polar dalam sampel dengan fase diam lemah sehingga lebih
terbawa fase gerak, sedangkan interaksi antara komponen nonpolar dalam
sampel dengan fase diam lebih kuat sehingga lebih sukar terbawa fase gerak
(Snyder dkk., 2010).
e. Detektor. Detektor yang paling banyak digunakan untuk analisis di bidang
farmasi adalah detektor ultraviolet-visibel (UV-Vis) karena kebanyakan
(Gandjar dan Rohman, 2007). Idealnya suatu detektor yang digunakan
dalam sistem KCKT harus mempunyai karakteristik sebagai berikut:
mempunyai respon terhadap solut yang cepat dan reprodusibel, mempunyai
sensitifitas yang tinggi (mampu mendeteksi solut pada kadar yang sangat
kecil), stabil dalam pengoperasiannya, mempunyai sel volume yang kecil
sehingga mampu meminimalkan pelebaran pita, sinyal yang dihasilkan
berbanding lurus dengan konsentrasi solut pada kisaran yang luas, dan tidak
peka terhadap perubahan suhu dan kecepatan alir fase gerak (Gandjar dan
Rohman, 2007).
f. Data sistem. Alat pengumpul data seperti komputer, integrator, atau
rekorder dihubungkan dengan detektor. Alat ini akan mengukur sinyal
elektronik yang dihasilkan oleh detektor lalu mem-plotkannya sebagai suatu
kromatogram yang selanjutnya dapat dievaluasi oleh seorang analis
(pengguna) (Gandjar dan Rohman, 2007).
G.Validasi Metode Analisis
Validasi metode analisis menurut United States Pharmacopeia (USP)
dilakukan untuk menjamin bahwa metode analisis tersebut akurat, spesifik,
reprodusibel, dan tahan pada kisaran analit yang akan dianalisis.
Parameter-parameter validasi tersebut adalah:
1. Selektivitas
Selektivitas adalah kemampuan suatu metode analisis untuk mengukur
zat tertentu yang diinginkan secara cermat dan seksama dengan adanya
membagi selektivitas menjadi dua kategori, yakni uji identifikasi dan uji
kemurnian atau pengukuran kadar. Selektivitas pada uji identifikasi
ditunjukkan dengan kemampuan suatu metode analisis untuk membedakan
antar senyawa yang memiliki struktur molekul yang hampir sama, sedangkan
untuk uji kemurnian dan tujuan pengukuran kadar, selektivitas ditunjukkan
oleh daya pisah dari dua senyawa yang berdekatan (Gandjar dan Rohman,
2007). Selektivitas suatu metode analisis untuk penetapan kadar dapat
diketahui dari nilai resolusinya (Rs). Menurut Snyder dkk. (2010), nilai
resolusi yang dianjurkan adalah lebih dari atau sama dengan dua.
2. Linieritas
Linieritas merupakan kemampuan suatu metode untuk memperoleh
hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit
pada kisaran yang diberikan (Gandjar dan Rohman, 2007). Linieritas dapat
dilihat dengan dua cara, yaitu secara evaluasi langsung pada garis persamaan
kurva baku dan secara statistika menggunakan regresi linier (Ermer dan Miller,
2005). Linieritas dinyatakan dalam koefisien korelasi (r). Suatu metode analisis
dikatakan linier apabila memenuhi persyaratan nilai r ≥ 0,99 (Chan, Lam, Lee,
dan Zhang , 2004).
3. Akurasi
Akurasi merupakan suatu prosedur analisis yang digunakan untuk
melihat ketelitian suatu metode analisis atau kesesuaian antara nilai yang
diperoleh dari hasil analisis dengan nilai sebenarnya (Ermer dan Miller, 2005).
recovery). Akurasi dapat ditentukan dengan dua cara yaitu metode simulasi
(spiked-placebo method) atau metode penambahan baku (standard addition
method) (Harmita, 2004). Suatu metode memiliki akurasi yang baik apabila
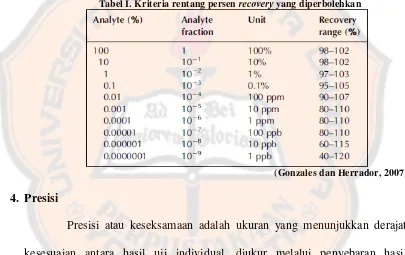
memiliki nilai persen recovery dalam rentang 80-110% untuk kadar analit 1-10
ppm (Gonzales dan Herador, 2007). Kriteria rentang persen recovery yang
[image:36.595.103.508.281.536.2]diperbolehkan untuk penetapan akurasi ditunjukkan pada tabel I.
Tabel I. Kriteria rentang persen recovery yang diperbolehkan
(Gonzales dan Herrador, 2007)
4. Presisi
Presisi atau keseksamaan adalah ukuran yang menunjukkan derajat
kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil
individual dari rata-rata jika prosedur diterapkan secara berulang pada
sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004). Presisi
dinyatakan dalam koefisien variasi (KV) atau simpangan baku relatif (RSD).
Menurut Gonzales dan Herrador (2007), suatu metode memiliki presisi yang
Tabel II. Kriteria persen RSD yang diperbolehkan
(Gonzales dan Herrador, 2007)
H. Keterangan Empiris
Pulveres dengan zat aktif diltiazem digunakan oleh rumah sakit X untuk
pasien lanjut usia dengan gangguan sistem kardiovaskular. Pulveres memiliki
kualitas yang baik apabila memenuhi syarat kering, halus, homogen, seragam
dalam bobot, dan seragam dalam kandungan zat aktif. Proses peracikan pulveres
yang tidak sesuai dengan prosedur dapat menurunkan kualitas sediaan pulveres
yang dibuat. Penurunan kualitas dapat berupa bobot dan kandungan zat aktif
dalam pulveres yang tidak seragam.
Diltiazem memiliki panjang gelombang pada daerah UV yaitu pada
panjang gelombang 240 nm dan melebur pada suhu 207,5-212,0ºC. Uji
keragaman bobot dilakukan sebagai tahap awal identifikasi keseragaman
kandungan dengan menimbang isi pulveres satu persatu. Uji keseragaman
kandungan dilakukan dengan menggunakan metode KCKT fase terbalik dengan
detektor UV-Vis dan uji kadar air dilakukan dengan metode Loss on Drying
Penelitian ini bersifat non eksperimental deskriptif dan diharapkan dapat
memberikan informasi tentang kualitas sediaan racikan pulveres dengan zat aktif
diltiazem pada rumah sakit X terkait keragaman bobot, keseragaman kandungan,
19
BAB III
METODOLOGI PENELITIAN
A.Jenis dan Rancangan Penelitian
Penelitian yang berjudul “UJi Kualitas Sediaan Racikan Pulveres dengan
Zat Aktif Diltiazem Pada Rumah Sakit X” termasuk jenis penelitian non eksperimental dengan rancangan penelitian deskriptif. Jenis penelitian non
eksperimental karena dalam penelitian ini subjek penelitian tidak diberi perlakuan.
Rancangan penelitian bersifat deskriptif karena peneliti hanya mendeskripsikan
keadaan yang ada.
B.Variabel dan Definisi Operasional 1. Variabel penelitian
a. Sediaan racikan pulveres dengan zat aktif diltiazem yang diracik di rumah
sakit X.
b. Kualitas sediaan racikan terkait keragaman bobot, keseragaman kandungan,
dan kadar air.
c. Variabel yang dikendalikan dalam penelitian ini adalah:
1) Kemurnian pelarut dan fase gerak, digunakan pelarut grade for liquid
chromatography.
2) Perbedaan spesifikasi alat yang digunakan selama penelitian, digunakan
alat dan instrumen yang sama selama penelitian.
d. Variabel yang tidak dikendalikan dalam penelitian ini adalah peracik yang
2. Definisi operasional
a. Sediaan racikan pulveres yang digunakan sebagai sampel merupakan
sediaan racikan pulveres yang diracik di rumah sakit X yang mengandung
diltiazem dan klobazam sebagai zat aktif dan bahan lain sebagai bahan
pengisinya.
b. Parameter kualitas sediaan racikan pulveres yang diuji meliputi: keragaman
bobot, keseragaman kandungan, dan kadar air.
c. Keragaman bobot sediaan racikan pulveres ditentukan dengan menghitung
nilai KV. Sediaan racikan pulveres dikatakan memiliki bobot yang seragam
apabila nilai KV ≤ 10% dan seluruh sampel pulveres yang diuji berada
dalam rentang 90% hingga 110% dari yang tertera pada etiket.
d. Uji keseragaman kandungan dilakukan menggunakan metode KCKT fase
terbalik dengan kolom C18 dan fase gerak metanol : air (80:20) dengan pH
diatur 4 ± 0,5 menggunakan asam asetat glasial. Pelarut yang digunakan
memiliki komposisi yang sama dengan komposisi fase gerak. Pengujian
keseragaman kandungan terbatas pada satu senyawa aktif yaitu diltiazem.
e. Sediaan racikan pulveres dikatakan seragam dalam kandungan apabila
seluruh sampel pulveres yang diuji terletak dalam rentang 90,0% hingga
110,0% dari yang tertera pada resep.
f. Uji kadar air dilakukan dengan menghitung nilai persen moisture content
sediaan racikan pulveres sebelum dan setelah penyimpanan. Penyimpanan
yang memenuhi persyaratan apabila nilai persen moisture content kurang
dari 5%.
C.Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer
merek Shimadzu tipe UVmini-1240, seperangkat alat KCKT merek Shimadzu
LC-2010HT No. C21255111004 LP yang terdiri dari: detektor UV-Vis, kolom
oktadesilan (C18) merek phenomenex No. 00G-4252-E0 dengan panjang 250 x 4,6
mm, injektor jenis auto sampler, dan seperangkat komputer merek Hp.
Ultrasonikator merek Retsch tipe T460, pompa vakum merek Gast model
DOA-P504-BN, moisture analyzer merek Kem tipe MLS 50-3C, membrane filter holder
merek Whatman (kapasitas 300 mL) Cat. No. 1960-004, kertas saring, Whatman
0,45 µm, organic solvent membrane filter merek Whatman (ukuran pori 0,5µm,
diameter 47 mm), inorganic solvent membrane filter merek Whatman (ukuran
pori 0,45 µm, diameter 47 mm), penyaring Millipore, neraca analitik merek Ohaus
tipe PAJ1003 kepekaan 0,1 mg (maksimal 120 gram, minimal 0,001 gram),
mikropipet ukuran 20-200 µL dan ukuran 100-1000 µL merek Socorex, mortir,
stamper, dan seperangkat alat-alat gelas yang lazim digunakan di laboratorium
analisis.
D.Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah baku diltiazem
kualitas working standard (P.T. Rama Emerald Multi Sukses) dengan kadar
99,53%, metanol grade for liquid chromatography (E. Merck), aquabidestilata
Dharma), asam asetat glasial p.a (E. Merck), dan sediaan racikan pulveres dengan
zat aktif diltiazem yang diracik di rumah sakit X.
E.Tata Cara Penelitian 1. Pemilihan dan pengambilan sampel
Sampel yang digunakan dalam penelitian ini adalah sediaan racikan
pulveres yang diracik di rumah sakit X dengan resep sebagai berikut:
R/ Farmabes 1 tab 30 mg
Clobazam ½ tab 5 mg
Mfla. Pulv. d.t.d. no X
S.1 d.d 1
Berdasarkan pada resep diketahui bahwa sampel yang digunakan
dalam penelitian ini merupakan sediaan racikan pulveres yang mengandung
campuran diltiazem (Farmabes®) dan klobazam masing-masing satu dan
setengah tablet untuk tiap bungkus pulveres. Tablet diltiazem yang digunakan
bermerek Farmabes® dengan dosis sebesar 30 mg dan memiliki bobot 143,4
mg/tablet, sedangkan klobazam yang digunakan adalah obat generik dengan
dosis 10 mg dan bobot sebesar 124,6 mg/tablet.
Peracikan pulveres dilakukan di instalasi farmasi rumah sakit X pada
pagi hari dengan proses penggerusan dan pencampuran dilakukan sekali
banyak. Pengambilan sampel dilakukan siang hari pada hari yang sama dengan
peracikan pulveres. Pengambilan sampel dilakukan sebanyak tiga kali dalam
waktu yang berbeda dan setiap pengambilan didapatkan 10 bungkus pulveres.
dahulu, kemudian dari 10 bungkus pulveres diambil tiga bungkus secara
random untuk dilakukan pengujian terhadap keseragaman kandungan dan
enam bungkus secara random untuk dilakukan pengujian kadar air. Total
sampel pulveres yang digunakan selama penelitian ini adalah 30 bungkus.
Diagram pengambilan sampel dalam penelitian ini ditunjukkan pada gambar 3.
Gambar 3. Diagram pengambilan sampel
2. Uji keragaman bobot
Sepuluh bungkus pulveres ditimbang satu persatu menggunakan
neraca analitik. Proses penimbangan dilakukan dengan menimbang terlebih
dahulu isi pulveres dengan bungkusnya, kemudian isi pulveres dikeluarkan dan
bungkus pulveres ditimbang kembali. Bobot pulveres tiap bungkus didapatkan
dari hasil selisih antara nilai bobot pulveres dan bungkusnya dengan bobot
bungkus pulveres.
3. Uji keseragaman kandungan
a. Verifikasi metode kromatografi cair kinerja tinggi (KCKT).
1) Pembuatan fase gerak dan pelarut. Fase gerak dan pelarut yang
digunakan dalam penelitian ini adalah campuran metanol dan
aquabidestilata dengan perbandingan 80:20 dan pH diatur hingga 4 ± 0,5
10 bungkus 3 bungkus 6 bungkus Uji keragaman bobot Uji keseragaman kandungan
Uji kadar air
Rand
om
3 kali
3 kali
menggunakan asam asetat glasial (100%). Masing-masing larutan
disaring menggunakan kertas saring whatman dengan bantuan pompa
vakum. Larutan dicampur dan dimasukkan kedalam wadah fase gerak,
pencampuran dilakukan di luar sistem KCKT. Sebelum digunakan, fase
gerak di-degassing terlebih dahulu selama 15 menit.
2) Pembuatan larutan baku diltiazem.
a) Pembuatan larutan stok diltiazem 2000 µg/mL. Baku diltiazem
ditimbang seksama lebih kurang 100,0 mg, kemudian dilarutkan
dengan pelarut. Larutan tersebut dimasukkan ke dalam labu ukur 50
mL dan ditambahkan pelarut hingga tanda, sehingga diperoleh larutan
stok dengan konsentrasi 2000 µg/mL.
b) Pembuatan larutan intermediet diltiazem 1000 µg/mL. Larutan stok
diltiazem 2000 µg/mL diambil 5 mL dan dimasukkan kedalam labu
ukur 10 mL. Larutan tersebut diencerkan dengan pelarut hingga tanda,
sehingga diperoleh larutan intermediet dengan konsentrasi 1000
µg/mL.
c) Pembuatan seri larutan baku diltiazem. Larutan intermediet 1000
µg/mL diambil 20, 40, 60, 80, 100, 120, 140, 160, 180, dan 200 µL
dan dimasukkan ke dalam labu ukur 10 mL. Larutan tersebut
diencerkan dengan pelarut hingga tanda, sehingga diperoleh seri
larutan baku diltiazem dengan konsentrasi 2, 4, 6, 8, 10, 12, 14, 16,
3) Penentuan panjang gelombang pengamatan. Tiga seri larutan baku
konsentrasi 12, 14, dan 16 µg/mL diambil kemudian dilakukan scanning
menggunakan spektrofotometer UV pada panjang gelombang 200-400
nm. Diperoleh panjang gelombang dengan absorbansi maksimum yang
akan digunakan sebagai panjang gelombang pengamatan pada penetapan
kadar menggunakan KCKT.
4) Preparasi sampel. Satu bungkus pulveres digerus dan dihomogenkan
menggunakan mortir dan stamper. Sampel yang telah dihomogenkan
ditimbang seksama lebih kurang 50,0 mg, kemudian dilarutkan dengan
pelarut. Larutan tersebut dimasukkan ke dalam labu ukur 25 mL dan
ditambahkan pelarut sampai tanda. Sebanyak 5 mL larutan diambil dan
dimasukkan ke dalam labu ukur 10 mL, kemudian diencerkan dengan
pelarut hingga tanda. Larutan tersebut diambil 500 µL dan dimasukkan
ke dalam labu ukur 10 mL, kemudian diencerkan dengan pelarut hingga
tanda. Larutan disaring dengan millipore dan dimasukkan ke dalam vial
KCKT, kemudian di-degassing selama 5 menit.
b. Validasi metode analisis.
1) Penentuan resolusi sampel. Sebanyak 10 µL larutan sampel yang telah
disaring dan di-degassing diinjeksikan pada sistem KCKT fase terbalik
yang telah dioptimasi. Nilai Rs dihitung sebagai penentu parameter
validasi selektivitas.
2) Pembuatan kurva baku dan penentuan linieritas. Masing-masing seri
menggunakan ultrasonicator selama 5 menit. Sebanyak 10 µL dari
masing-masing larutan diinjeksikan pada sistem KCKT fase terbalik
yang telah dioptimasi. Kurva regresi linear dibuat untuk menyatakan
hubungan antara konsentrasi seri larutan baku diltiazem dengan nilai
AUC yang diperoleh, kemudian ditentukan persamaan garis regresi linier
serta nilai koefisien korelasinya (r).
3) Penentuan persen perolehan kembali (persen recovery) dan penentuan
nilai koefisien variasi (KV). Satu bungkus pulveres digerus dan
dihomogenkan menggunakan mortir dan stamper. Sampel yang telah
dihomogenkan ditimbang seksama lebih kurang 50,0 mg, penimbangan
dilakukan sebanyak empat kali. Masing-masing sampel dilarutkan
dengan pelarut dan dimasukkan ke dalam labu ukur 25 mL, kemudian
ditambahkan pelarut sampai tanda. Masing-masing larutan diambil 5 mL
dan dimasukkan ke dalam labu ukur 10 mL, kemudian diencerkan
dengan pelarut hingga tanda. Masing-masing larutan dimasukkan ke
dalam labu ukur 10,0 mL dan diberi label a, b, c, dan d. Larutan a
diencerkan dengan pelarut hingga tanda sehingga diperoleh larutan
sampel tanpa adisi. Larutan b, c, dan d ditambahkan baku diltiazem
masing-masing sebanyak 40, 60, dan 80 µL, kemudian masing-masing
diencerkan dengan pelarut hingga tanda sehingga diperoleh larutan
sampel adisi 4, 6, dan 8 µg/mL. Replikasi dilakukan sebanyak tiga kali.
Kedua macam sampel ini digunakan untuk memperoleh nilai persen
c. Penetapan kadar dan uji keseragaman kandungan. Sebanyak 10 µL
larutan sampel yang telah disaring dan di-degassing, diinjeksikan pada
sistem KCKT fase terbalik yang telah dioptimasi. Replikasi dilakukan
sebanyak tiga kali untuk setiap bungkus pulveres. Pengujian dilakukan
terhadap sembilan bungkus pulveres dengan zat aktif diltiazem dan
klobazam yang diambil di rumah sakit X dengan waktu pengambilan
yang berbeda.
4. Uji kadar air
Uji kadar air dilakukan terhadap enam bungkus pulveres untuk setiap
waktu pengambilan dengan menggunakan moisture analyzer. Tiga serbuk
pulveres yang baru diambil masing-masing digerus dalam mortir dan stamper
kemudian dimasukkan ke dalam alat sebanyak lebih kurang 100,0 mg. Suhu
alat diatur pada 120˚C dan waktu pengeringan diatur selama 90 detik. Nilai
persen moisture content yang ditampilkan pada alat dicatat sebagai kadar air
sebelum penyimpanan. Penyimpanan dilakukan selama 10 hari pada suhu
ruangan, kemudian pengujian yang sama dilakukan terhadap tiga bungkus sisa
dan dicatat sebagai kadar air setelah penyimpanan.
F. Analisis Hasil 1. Uji keragaman bobot
Keragaman bobot pulveres ditentukan dari nilai koefisien variasi (KV).
Sediaan racikan pulveres dikatakan memiliki bobot yang seragam apabila nilai
KV ≤ 10% dan seluruh sampel pulveres yang diuji memiliki bobot dalam
2. Validasi metode analisis
Validasi metode analisis yang digunakan dalam penetapan kadar
diltiazem pada penelitian ini dapat ditentukan berdasarkan parameter berikut:
a. Selektivitas. Selektivitas ditentukan dengan menghitung nilai resolusi antara
dua peak yang saling berdekatan dari kromatogram larutan sampel. Menurut
Snyder dkk. (2010), nilai resolusi yang baik adalah ≥ 2. Nilai resolusi dapat dihitung menggunakan rumus:
Rs = ... (1)
Keterangan: Rs = resolusi
tR1 = waktu retensi puncak kedua
tR2 = waktu retensi puncak pertama
Wb2 = lebar puncak kedua
Wb1 = lebar puncak pertama
b. Linieritas. Linieritas dinyatakan dengan nilai koefisien korelasi (r) yang
menunjukkan korelasi antara konsetrasi seri baku diltiazem dengan Area
Under Curve (AUC). Menurut Chan dkk. (2004), suatu metode memiliki
linieritas yang baik apabila nilai r ≥ 0,99.
c. Akurasi. Akurasi metode analisis dinyatakan dalam nilai persen perolehan
kembali (persen recovery). Suatu metode dikatakan memiliki akurasi yang
baik jika nilai persen recovery terletak pada rentang 80-120% untuk kadar
analit ≤ 10 ppm (Gonzales dan Herrador, 2007). Rumus perhitungan nilai
persen recovery adalah:
d. Presisi. Presisi dinyatakan dengan simpangan baku relatif (RSD) atau
koefisien variasi (KV). Suatu metode dikatakan memiliki presisi yang baik
apabila nilai KV ≤ 11,3 untuk kadar analit 10 ppm (Gonzales dan Herrador 2007). Nilai KV dapat dihitung menggunakan rumus:
KV = × 100% ... (3)
Keterangan: s = standar deviasi
= konsentrasi rata-rata sampel
3. Uji keseragaman kandungan
Hasil yang diperoleh berupa nilai Area Under Curve (AUC). Kadar
diltiazem dalam sampel pulveres ditentukan dengan memasukkan nilai AUC
yang diperoleh ke dalam persamaan kurva baku. Keseragaman kandungan
ditentukan menggunakan aturan yang tertera pada Farmakope Indonesia IV
(1995), untuk senyawa diltiazem tidak boleh kurang dari 90,0% dan tidak
boleh lebih dari 110,0% dari yang tertera pada etiket. Apabila terdapat satu
sampel yang berada di luar rentang maka seluruh sampel pulveres yang diuji
dianggap tidak seragam.
4. Uji kadar air
Parameter yang diperoleh dari uji kadar air adalah nilai persen
moisture content. Nilai persen moisture content menunjukkan nilai kadar air
dalam sampel pulveres. Pengujian dilakukan sebelum dan setelah penyimpanan
30
BAB IV
HASIL DAN PEMBAHASAN
Uji kualitas sediaan racikan pulveres dengan zat aktif diltiazem pada
rumah sakit X dapat dilakukan dengan melakukan pengujian pada tiga parameter
kualitas sediaan racikan pulveres yaitu seragam dalam bobot, seragam dalam
kandungan zat aktif, dan kering. Pengambilan sampel dilakukan secara acak
(random) sehingga setiap unit populasi mempunyai kesempatan yang sama untuk
diambil sebagai sampel. Cara random merupakan usaha untuk mendapatkan
sampel yang representative karena adanya bias pemilihan dapat diperkecil sekecil
mungkin (Harinaldi, 2005).
A.Uji Keragaman Bobot
Tujuan dilakukan uji keragaman bobot adalah untuk melihat salah satu
parameter kualitas pulveres yaitu seragam dalam bobot. Uji keragaman bobot
merupakan salah satu metode yang dapat digunakan untuk mengetahui
keseragaman sediaan dan dapat digunakan sebagai tahap awal identifikasi untuk
mengetahui keseragaman kandungan dari sampel pulveres. Pengujian ini
dilakukan pada seluruh bungkus pulveres yang dijadikan sampel. Bobot pulveres
diperoleh dari selisih antara nilai bobot pulveres total dengan bobot bungkusnya.
Perhitungan nilai KV digunakan untuk mengetahui besar keragaman bobot
pulveres tiap bungkus. Menurut Anief (2000), nilai KV atau penyimpangan bobot
antar bungkus pulveres tidak boleh lebih besar dari 10%. Hasil uji keragaman
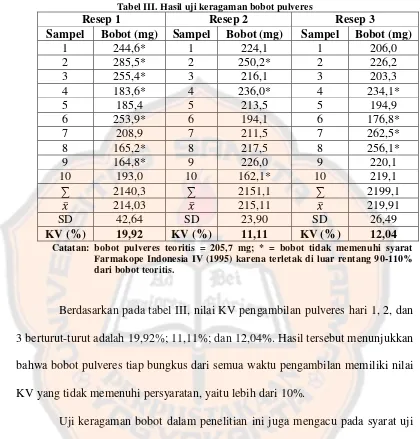
Tabel III. Hasil uji keragaman bobot pulveres
Resep 1 Resep 2 Resep 3
Sampel Bobot (mg) Sampel Bobot (mg) Sampel Bobot (mg)
1 244,6* 1 224,1 1 206,0 2 285,5* 2 250,2* 2 226,2 3 255,4* 3 216,1 3 203,3 4 183,6* 4 236,0* 4 234,1* 5 185,4 5 213,5 5 194,9 6 253,9* 6 194,1 6 176,8* 7 208,9 7 211,5 7 262,5* 8 165,2* 8 217,5 8 256,1* 9 164,8* 9 226,0 9 220,1 10 193,0 10 162,1* 10 219,1
∑ 2140,3 ∑ 2151,1 ∑ 2199,1 214,03 215,11 219,91 SD 42,64 SD 23,90 SD 26,49
KV (%) 19,92 KV (%) 11,11 KV (%) 12,04
Catatan: bobot pulveres teoritis = 205,7 mg; * = bobot tidak memenuhi syarat Farmakope Indonesia IV (1995) karena terletak di luar rentang 90-110% dari bobot teoritis.
Berdasarkan pada tabel III, nilai KV pengambilan pulveres hari 1, 2, dan
3 berturut-turut adalah 19,92%; 11,11%; dan 12,04%. Hasil tersebut menunjukkan
bahwa bobot pulveres tiap bungkus dari semua waktu pengambilan memiliki nilai
KV yang tidak memenuhi persyaratan, yaitu lebih dari 10%.
Uji keragaman bobot dalam penelitian ini juga mengacu pada syarat uji
keseragaman kandungan untuk zat aktif diltiazem pada Farmakope Indonesia IV
(1995) yaitu tidak boleh kurang dari 90% dan tidak lebih dari 110% dari jumlah
yang tertera pada etiket atau jumlah yang sebenarnya. Bobot pulveres sebenarnya
adalah 205,7 mg yang diperoleh dari hasil penimbangan bobot satu tablet
Farmabes® (143,4 mg) dan setengah tablet klobazam (62,3 mg) yang digunakan
rumah sakit X untuk membuat sediaan racikan pulveres. Rentang bobot yang
Hasil pengujian menunjukkan bahwa pulveres yang diambil pada hari 1,
2, dan 3 berturut-turut terdapat tujuh, tiga, dan empat bungkus pulveres yang
terletak di luar rentang yang telah ditetapkan. Berdasarkan pada pengujian
terhadap keragaman bobot dapat disimpulkan bahwa pulveres dengan zat aktif
diltiazem yang diracik di rumah sakit X memiliki bobot yang tidak seragam.
B.Uji Keseragaman Kandungan
Uji keseragaman kandungan dilakukan dengan menggunakan metode
KCKT fase terbalik di mana fase diam yang digunakan (C18) lebih non polar
dibandingkan dengan fase gerak yang digunakan. Tujuan dilakukan pengujian ini
adalah untuk melihat salah satu parameter kualitas pulveres yaitu seragam dalam
kandungan zat aktif. Farmakope Indonesia IV (1995) menyatakan bahwa
persyaratan keseragaman kandungan dapat diterapkan apabila kandungan zat aktif
terdapat dalam jumlah kecil yaitu kurang dari 50 mg atau kurang dari 50% bobot
sediaan.
Pulveres yang dijadikan sampel dalam penelitian ini terdiri dari dua
komponen zat aktif yaitu diltiazem dan klobazam dengan dosis masing-masing 30
mg dan 5 mg (dibawah 50 mg), sehingga uji keseragaman kandungan perlu
dilakukan untuk melihat kualitas sediaan pulveres tersebut. Uji keseragaman
kandungan dalam penelitian ini hanya dilakukan pada satu komponen zat aktif
saja yaitu diltiazem. Menurut Juniarta (2015), diltiazem merupakan obat yang
paling sering digunakan di rumah sakit X untuk terapi pada pasien dengan
1. Verifikasi sistem KCKT
Penelitian ini mengacu pada penelitian yang dilakukan oleh Sultana
dkk. (2009) mengenai analisis senyawa campuran diltiazem dengan obat
Non-Steroidal Anti-Inflammatory (NSAID) dalam sediaan obat dan serum manusia
dengan metode KCKT yang mencakup optimasi dan validasi metode. Tahap
optimasi diperoleh suatu metode yang cocok digunakan untuk pemisahan dan
uji kuantitatif senyawa diltiazem baik dalam produk farmasi maupun dalam
serum manusia, sedangkan pada tahap validasi, metode ini memiliki linieritas,
akurasi, presisi, serta selektivitas yang baik. Parameter linieritas ditunjukkan
dengan nilai r = 0,9998, akurasi ditunjukkan dengan nilai persen perolehan
kembali sebesar 99,9-100,3%, presisi ditunjukkan dengan nilai RSD ≤ 2, dan selektivitas ditunjukkan dengan nilai resolusi sebesar 5,55.
Sistem KCKT yang digunakan dalam penelitian Sultana (2009)
tersebut adalah:
Instrumen : Shimadzu LC-10 AT VP pump
Kolom : Hiber RT 250-4,6 Purospher Star RP-18
Fase gerak : Metanol-air 80:20 (v/v) pH diatur 3,1±0,01 menggunakan
asam fosfat (85%)
Kecepatan alir : 0.5 mL/menit
Detektor : UV pada 240 nm
Sistem kromatografi yang digunakan adalah sistem kromatografi fase
terbalik sehingga fase gerak yang digunakan lebih polar dibandingkan dengan
Penelitian tersebut menggunakan campuran fase gerak dengan pH dijaga
hingga 3,1 ± 0,01 dengan alasan pada pH yang terlalu basa akan menghasilkan
peak yang mengekor (tailing peak).
pH dan larutan asam yang digunakan untuk mengatur pH dalam
penelitian ini berbeda dengan penelitian yang dilakukan oleh Sultana (2009).
pH yang digunakan dalam penelitian ini adalah 4 ± 0,5 karena kolom C18 yang
digunakan memiliki kapasitas pH berkisar antara tiga sampai delapan sehingga
bertujuan menjaga kondisi kolom (C18) agar tidak rusak. Larutan yang
digunakan untuk mengatur pH pada fase gerak adalah asam asetat glasial yang
merupakan asam lemah dibandingkan dengan asam fosfat. Larutan asam
memiliki sifat korosif, penggunakan larutan asam yang terlalu kuat (asam
fosfat) ditakutkan akan melarutkan partikel-partikel silika yang menempel pada
kolom. Peak diltiazem pada pH 4 ± 0,5 yang diperoleh memiliki nilai tailing
factor yang sudah dapat diterima untuk analisis secara kuantitatif. Menurut
Snyder dkk. (2010), nilai tailing factor suatu peak dalam pemisahan secara
rutin untuk semua peak adalah < 2. Gambar 4 menunjukkan waktu retensi peak
larutan baku diltiazem yang muncul pada menit ke-4,678 dan nilai tailing
Gambar 4. Nilai tailing factor kromatogram baku diltiazem pada konsentrasi 18 ppm
a. Penentuan panjang gelombang pengamatan. Penentuan panjang gelombang
pengamatan bertujuan untuk mengetahui panjang gelombang larutan
diltiazem yang dapat memberikan serapan (absorbansi) maksimum. Panjang
gelombang yang diperoleh akan digunakan sebagai panjang gelombang
pengamatan pada penetapan kadar diltiazem menggunakan KCKT.
Panjang gelombang maksimum diltiazem diukur dengan
menggunakan spektrofotometer UV-VIS pada panjang gelombang 200-400
nm dan menggunakan tiga seri larutan baku dengan konsentrasi yang
berbeda. Tujuan pengukuran pada tiga konsentrasi yang berbeda adalah
untuk mendapatkan hasil yang representatif terhadap semua seri larutan
baku. Konsentrasi yang digunakan dalam penentuan panjang gelombang
pengamatan adalah 6, 8, dan 10 µg/mL. Ketiga seri baku tersebut di-scan
satu diagram dan dapat diamati apakah ketiga seri baku tersebut memiliki
panjang gelombang yang sama atau tidak. Panjang gelombang yang didapat
dibandingkan dengan literatur. Menurut Chan dkk. (2004), pengukuran
panjang gelombang maksimum dikatakan memenuhi syarat apabila tepat
atau dalam batas ± 1 nm dari panjang gelombang teoritis pada rentang
panjang gelombang UV.
Secara teoritis panjang gelombang maksimum diltiazem adalah 240
nm dalam pelarut campuran metanol-air (Sultana dkk., 2009). Berdasarkan
percobaan, data hasil pengukuran panjang gelombang diltiazem adalah
239,5 nm. Hasil panjang gelombang tersebut menyimpang 0,5 nm dari
panjang gelombang teoritis (240 nm), sehingga dapat dikatakan bahwa
senyawa tersebut merupakan diltiazem. Panjang gelombang yang digunakan
dalam penetapan kadar diltiazem dengan KCKT adalah panjang gelombang
teoritis yaitu 240 nm. Pergeseran panjang gelombang maksimum tersebut
dapat disebabkan kondisi penelitian, serta spesifikasi dari alat dan bahan
yang digunakan berbeda. Spektra hasil pengukuran panjang gelombang
Gambar 5. Spektra larutan baku diltiazem
b. Pembuatan kurva baku. Tujuan pembuatan kurva baku adalah untuk
mendapatkan persamaan regresi linier yang akan digunakan untuk
menghitung kadar diltiazem dalam penetapan recovery dan penetapan kadar
sampel. Persamaan kurva baku diperoleh dari korelasi antara konsentrasi
seri larutan baku diltiazem dengan luas area di bawah peak (AUC) di mana
dengan meningkatnya konsentrasi maka akan meningkatkan nilai AUC.
Kurva baku dibuat dengan menggunakan 10 seri konsentrasi
diltiazem, yaitu 2, 4, 6, 8, 10, 12, 14, 16, 18, dan 20 µg/mL. Pemilihan
rentang kurva baku didasarkan pada rentang konsentrasi terendah sampai
nilai linieritas yang baik, dinyatakan dalam koefisien korelasi (r). Menurut
Chan dkk. (2004), suatu metode dikatakan memiliki linieritas yang baik
apabila nilai koefisien korelasi (r) ≥ 0,99. Data persamaan kuva baku
[image:58.595.98.505.224.570.2]diltiazem yang diperoleh disajikan pada tabel IV.
Tabel IV. Data kurva baku diltiazem
Konsentrasi seri baku
(µg/ml)
AUC
2 129426 4 430764 6 394044 8 470933 10 556663 12 684428 14 811360 16 861513 18 1014879 20 1163895
A 22277
B 55410
R 0,997
Persamaan kurva baku
y = 55410x + 22277
Berdasarkan tabel IV persamaan kurva baku diltiazem yang
diperoleh adalah y = 55410x-22277 dengan nilai koefisien korelasi (r)
sebesar 0,997 dan telah memenuhi persyaratan yaitu r ≥ 0,99 sehingga
persamaan tersebut dapat digunakan untuk menghitung kadar diltiazem.
2. Validasi metode analisis
Tujuan dilakukan validasi metode analisis menurut United States
Pharmacopeia (USP) adalah untuk menjamin bahwa metode analisis tersebut
dianalisis. Parameter-parameter validasi yang digunakan dalam penelitian ini
adalah akurasi, presisi, selektivitas, dan linieritas.
a. Selektivitas. Selektivitas merupakan kemampuan suatu metode analisis
untuk dapat memisahkan senyawa analit secara tepat dan spesifik dari
senyawa-senyawa lain yang ada dalam sampel. Parameter selektivitas
adalah resolusi (Rs). Resolusi merupakan jarak antara dua peak yang saling
berdekatan. Menurut Snyder dkk. (2010), suatu metode analisis dikatakan
[image:59.595.98.511.268.524.2]memiliki selektivitas yang baik apabila memiliki nilai resolusi ≥ 2. Nilai resolusi peak diltiazem dalam matriks sampel ditunjukkan pada tabel V dan
gambar 6.
Tabel V. Data nilai resolusi peak diltiazem dalam matriks sampel
Tabel V menunjukkan rata-rata nilai resolusi peak diltiazem dalam
sampel dari tiga kali replikasi adalah sebesar 3,164 dan nilai resolusi
tersebut telah memenuhi persyaratan (Rs ≥ 2). Hal ini menunjukkan bahwa
metode KCKT yang digunakan memiliki selektivitas yang baik.
Sampel Replikasi
Replikasi 1 3,149 Replikasi 2 3,170 Replikasi 3 3,174
Gambar 6. Nilai resolusi peak diltiazem dalam matriks sampel
Gambar 6 menunjukkan resolusi peak diltiazem dalam sampel
adalah sebesar 3,149 dan menunjukkan bahwa peak larutan sampel
diltiazem memiliki waktu retensi pada menit ke-4,631 sama dengan peak
baku (gambar 4), sehingga dapat dikatakan bahwa senyawa yang terkandung
dalam pulveres tersebut adalah diltiazem.
b. Linieritas. Linieritas merupakan suatu metode validasi yang menunjukkan
korelasi atau hubungan antara kosentrasi analit dengan respon yang
dihasilkan. Linieritas suatu metode ditunjukkan dengan nilai koefisien
korelasi (r). Suatu metode dikatakan memiliki linieritas yang baik apabila
nilai r ≥ 0,99 (Chan dkk., 2004). Berdasarkan pembuatan kurva baku, nilai
koefisien korelasi (r) yang diperoleh adalah 0,997 dan telah memenuhi
baik untuk digunakan dalam penetapan kadar diltiazem. Peak larutan baku
[image:61.595.99.506.173.601.2]diltiazem ditunjukkan pada waktu retensi 4,696 menit (gambar 7).
Gambar 7. Kromatogram baku diltiazem pada konsentrasi 12 ppm
c. Presisi. Presisi merupakan ukuran yang menunjukkan kedekatan nilai data
yang satu dengan