i
FORMULASI SEDIAAN HIDROGEL SCARLESS WOUND DENGAN ZAT AKTIF PIROXICAM SEBAGAI ANTIINFLAMASI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Lalitya Adhiati Kanya NIM: 138114003
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
FORMULASI SEDIAAN HIDROGEL SCARLESS WOUND DENGAN ZAT AKTIF PIROXICAM SEBAGAI ANTIINFLAMASI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Lalitya Adhiati Kanya NIM: 138114003
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
vii ABSTRAK
Parut luka terjadi pada proses inflamasi, karena pembentukan kolagen dalam jumlah yang tidak sesuai yang diakibatkan oleh sekresi COX-2. Untuk mengatasi masalah parut luka dibuat gel scarless wound dengan zat aktif piroxicam untuk menghambat COX-2. Tujuan dari penelitian ini adalah mengetahui kadar gelling agent carbopol efektif sehingga dihasilkan formulasi sediaan hidrogel scarless wound dengan zat aktif piroxicam yang stabil dengan pelepasan obat yang baik serta dapat menyembuhkan luka tanpa meninggalkan parut luka. Metode yang dilakukan untuk melihat kestabilan sediaan adalah data viskositas dan daya sebar dengan sebaran data normal dan homogen diuji ANOVA taraf kepercayaan 95% serta sebaran data yang tidak normal atau tidak homogen diuji kruskal wallis dengan software R 3.2.4. Formula optimum didapat dari data disolusi obat yaitu dengan menghitung persen kadar obat yang terdisolusi pada waktu tertentu. Semua gel stabil secara fisik dan formula yang optimum adalah formula dengan konsentrasi carbopol 1% (formula 1), diaplikasikan kepada luka eksisi tikus setiap 12 jam, didapat % wound closure nya, dan kulit diuji histopatologi. Menurut % wound closure dan histopatologi, formula dengan konsentrasi carbopol 1% terbukti dapat menyembuhkan luka.
Kata kunci: COX 2, hidrogel, piroxicam, scarless wound healing
ABSTRACT
Scar occurs in the inflammatory process because of formation of collagen in an incorrect amount caused by the secretion of COX-2. To overcome the problem of scar, scarless wound gel with active ingredient piroxicam is made to inhibit COX-2. The purpose of this study was to determine the effective concentration of gelling agent carbopol resulted stable hydrogel scarless wound with an active ingredient piroxicam with the greatest drug release that can heal wounds without leaving a scar. The methods performed to see the stability of hydrogel is viscosity and the spreadability. The normal and homogeneous data distribution is tested with ANOVA 95% and if data distribution were not normal or not homogenous, Kruskal Wallis test is used with the software R 3.2.4. The optimum formula was from the drug dissolution data to calculate the amount of drug dissolved at a given time. All hydrogels are physically stable and the optimum formula is a formula with 1% carbopol concentration (formula 1). The optimum formula was applied to the rats’ wounds every 12 hours. From % wound closure and histopathology test, formula 1 is proven to heal wounds with good quality.
viii
HALAMAN PERSEMBAHAN
Saya persembahkan skripsi ini untuk Tuhan YME yang
selalu menuntun saya menapaki jalan kehidupan,
bapak, ibu, serta adik yang terus mendoakan dan
memberikan kasih sayang pada saya,
teman-teman terkasih yang memberikan
ix PRAKATA
Puji syukur penulis panjatkan kepada Tuhan YME atas segala anugrah dan rahmat yang telah diberikan sehingga skripsi yang berjudul “Formulasi Sediaan Hidrogel Scarless Wound dengan Zat Aktif Piroxicam Sebagai Antiinflamasi” dapat dikerjakan dengan baik dan lancar.
Penulis menyadari bahwa penyusunan skripsi ini tidak terlepas dari campur tangan berbagai pihak. Kesempatan ini penulis gunakan untuk mengungkapkan rasa terima kasih kepada:
1. Tuhan yang Maha Esa, Maha Pengasih, serta Maha Penyayang yang telah memberikan rahmat dan kuasanya atas penyusunan skripsi ini;
2. Ibu Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma;
3. Bapak Enade Perdana Istyastono, Ph.D., Apt., selaku dosen pembimbing yang selalu memberikan saran, memotivasi, dan bersabar selama penelitian dan penyusunan skripsi;
4. Ibu Dr. Sri Hartati Yuliani, Apt., yang telah mendukung dan memberi banyak panduan serta saran dalam penyusunan skripsi ini;
5. Ibu Wahyuning Setyani, M. Sc., Apt., selaku dosen penguji yang telah memberikan saran dan masukan yang sangat berarti pada penyusunan skripsi ini;
6. Bapak Yohanes Ratijo, yang telah banyak bersabar dalam mendampingi penelitian, selalu mendukung, memotivasi, dan meluangkan waktu, tempat, dan tenaga yang ekstra dalam penelitian ini;
7. Ibu Agustina Setiawati, M.Sc., Apt. dan Ibu Dr. Dewi Setyaningsih, M.Sc.,Apt., selaku kepala laboratorium yang telah memberikan ijin penelitian; 8. Pak Agung, Pak Musrifin, Pak Mukmin, dan Pak Wagiran, selaku laboran laboratorium Fakultas Farmasi yang telah mengijinkan penulis untuk melaksanakan penelitian di laboratorium;
x
10. Penelitian ini sebagian didanai oleh DP2M DIKTI berdasarkan kontrak Surat Perjanjian Pelaksanaan Hibah No.010/HB/LIT/III/2016 tanggal 15 Maret 2016;
11. Keluarga tercinta, orang tua penulis, Bapak Hari Prabowo, Ibu Sandra Daya Laksmi, Adik Dwitiya Ken Saraswati dan keluarga besar penulis yang selalu memberikan doa, pertolongan, motivasi demi kelancaran studi dan penyusunan naskah skripsi;
12. Kenny dan Dhuta yang sama-sama merasakan suka duka dari awal sampai akhir penelitian hingga penulisan naskah skripsi ini;
13. Teman-teman seperjuangan lain, Hesti, Nilla, Ivana, Dipta, Ryan, Elwy, Fidel yang telah membantu dan mau bekerjasama dalam penelitian;
14. Teman-teman terdekat penulis: T e m a n t e r d e k a t F S T 2 0 1 3 : Maria, Aven, M o n i t a , d a n Indri; Teman terdekat FSM A 2013: Tiara, Sekar, Oline, Herna, Atika, dan Enggar; Teman semasa sekolah: Cathrin, Lia, Dewi, Bunga, Dinda, Ayesha, dan Budi yang memberikan keceriaan serta semangat selama penulisan skripsi ini;
15. Teman-teman FST 2013, FSM A 2013, dan seluruh angkatan 2013; 16. Serta semua pihak yang tidak dapat penulis sebutkan satu per satu.
Penulis menyadari bahwa skripsi ini masih memiliki banyak kekurangan sehingga penulis berharap kritik dan saran dari semua pihak. Akhir kata, penulis berharap semoga tugas akhir ini dapat bermanfaat bagi semua pihak terutama di bidang ilmu farmasi.
Yogyakarta, 16 Januari 2017
xi
Pembuatan gel scarless wound healing ... 6
Uji sterilitas... 7
Uji sifat fisis...7
Uji stabilitas...10
Perlakuan terhadap hewan uji ... 10
Kecepatan penyembuhan luka ... 11
Uji histopatologi ... 12
KESIMPULAN ... 14
UCAPAN TERIMA KASIH ... 14
DAFTAR PUSTAKA ... 14
LAMPIRAN ... 16
xii
DAFTAR TABEL
xiii
DAFTAR GAMBAR
Gambar 1. Struktur Piroxicam ... 2
Gambar 2. Hasil Uji Sterilitas ... 7
Gambar 3. Grafik Pelepasan Obat...9
xiv
DAFTAR LAMPIRAN
Lampiran 1. Proposal Penelitian ... 16
Lampiran 2. Ethical Clearance Penelitian ... 29
Lampiran 3. Certificate of Analysis Piroxicam ... 30
Lampiran 4. Data Sifat Fisis Hidrogel ... 31
Lampiran 5. Kurva baku piroxicam dan data uji pelepasan obat... 32
Lampiran 6. Data hasil uji stabilitas ... 35
Lampiran 7. Data %Wound Closure dan Kecepatan Penyembuhan... 42
Lampiran 8. Hasil Uji Histopatologi... 44
1
FORMULASI SEDIAAN HIDROGEL SCARLESS WOUND DENGAN ZAT AKTIF PIROXICAM SEBAGAI ANTIINFLAMASI FORMULATION OF HYDROGEL PIROXICAM SCARLESS WOUND
HEALING AS ANTI-INFLAMMATORY DRUG Lalitya Adhiati Kanya
Fakultas Farmasi
Universitas Sanata Dharma, Kampus III Paingan, Maguwoharjo, Depok, Sleman, Yogyakarta, Indonesia 55282
Telp. (0274) 883037, Fax. (0274) 886529 [email protected]
ABSTRAK
Parut luka terjadi pada proses inflamasi, karena pembentukan kolagen dalam jumlah yang tidak sesuai yang diakibatkan oleh sekresi COX-2. Untuk mengatasi masalah parut luka dibuat gel scarless wound dengan zat aktif piroxicam untuk menghambat COX-2. Tujuan dari penelitian ini adalah mengetahui kadar gelling agent carbopol efektif sehingga dihasilkan formulasi sediaan hidrogel scarless wound dengan zat aktif piroxicam yang stabil dengan pelepasan obat yang baik serta dapat menyembuhkan luka tanpa meninggalkan parut luka. Metode yang dilakukan untuk melihat kestabilan sediaan adalah data viskositas dan daya sebar dengan sebaran data normal dan homogen diuji ANOVA taraf kepercayaan 95% serta sebaran data yang tidak normal atau tidak homogen diuji kruskal wallis dengan software R 3.2.4. Formula optimum didapat dari data disolusi obat yaitu dengan menghitung persen kadar obat yang terdisolusi pada waktu tertentu. Semua gel stabil secara fisik dan formula yang optimum adalah formula dengan konsentrasi carbopol 1% (formula 1), diaplikasikan kepada luka eksisi tikus setiap 12 jam, didapat % wound closure nya, dan kulit diuji histopatologi. Menurut % wound closure dan histopatologi, formula dengan konsentrasi carbopol 1% terbukti dapat menyembuhkan luka.
Kata kunci: COX 2, hidrogel, piroxicam, scarless wound healing ABSTRACT
Scar occurs in the inflammatory process because of formation of collagen in an incorrect amount caused by the secretion of COX-2. To overcome the problem of scar, scarless wound gel with active ingredient piroxicam is made to inhibit COX-2. The purpose of this study was to determine the effective concentration of gelling agent carbopol resulted stable hydrogel scarless wound with an active ingredient piroxicam with the greatest drug release that can heal wounds without leaving a scar. The methods performed to see the stability of hydrogel is viscosity and the spreadability. The normal and homogeneous data distribution is tested with ANOVA 95% and if data distribution were not normal or not homogenous, Kruskal Wallis test is used with the software R 3.2.4. The optimum formula was from the drug dissolution data to calculate the amount of drug dissolved at a given time. All hydrogels are physically stable and the optimum formula is a formula with 1% carbopol concentration (formula 1). The optimum formula was applied to the rats’ wounds every 12 hours. From % wound closure and histopathology test, formula 1 is proven to heal wounds with good quality.
2 PENDAHULUAN
Parut luka terbentuk pada saat pematangan luka karena kolagen tak bisa menghasilkan kulit yang sama seperti sebelum luka (Enoch dan Leaper, 2008).
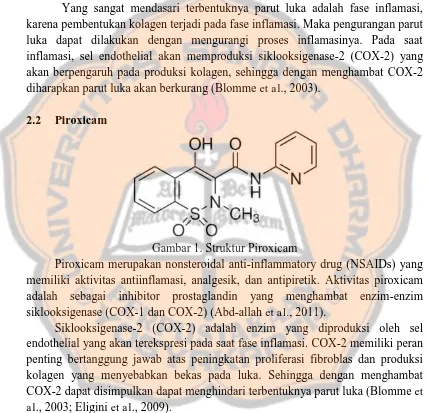
Gambar 1. Struktur Piroxicam
Piroxicam merupakan nonsteroidal anti-inflammatory drug (NSAIDs) non selektif yang memiliki aktivitas antiinflamasi, analgesik, dan antipiretik (Abd-allah et al., 2011). Menurunnya jumlah COX-1 berpengaruh pada menurunnya produksi prostaglandin yang akan memicu penutupan luka dari tepi luka dan mengurangi jaringan granulasi (Lee et al., 2003). COX-2 bertanggung jawab atas peningkatan proliferasi fibroblas dan produksi kolagen yang jika berlebih menyebabkan parut luka (Blomme et al., 2003), sehingga dengan diberi piroxicam yang merupakan inhibitor non selektif diharapkan dapat menghindari terbentuknya parut luka (Eligini et al., 2009). Karakteristik wound dressing yang ideal adalah melindungi dari bakteri, mengontrol penguapan air serta difusi oksigen dan karbondioksida, mengabsorpsi eksudat luka, dan ini merupakan ciri dari hidrogel (Sun, 2011).
Pada penelitian ini dilakukan variasi konsentrasi carbopol terhadap hidrogel yang akan dilihat seberapa banyak pengaruhnya terhadap pelepasan obat. Carbopol merupakan gelling agent yang akan berpengaruh pada viskositas, karena jika viskositas sediaan semakin tinggi maka zat aktif dalam sediaan akan semakin sulit dilepaskan (Anggraeni et al., 2012). Carbopol memiliki sifat dalam mengontrol pelepasan obat dengan fungsi sebagai pengikat sehingga penambahan carbopol diduga dapat berpengaruh dalam pelepasan obat (Rowe et al., 2009).
3 METODE PENELITIAN
Jenis penelitian yang digunakan adalah eksperimental murni.Bahan yang digunakan dalam penelitian ini adalah piroxicam (Kalbe Farma) sebagai zat aktif pada sediaan hidrogel, piroxicam (Kalbe Farma), piroxicam working standar (Dexa Medica), etanol 96% (Aldrich) yang digunakan sebagai kosolven, kalium sorbat (Brataco) dan asam borat (Brataco) yang digunakan sebagai pengawet pada basis gel, carbopol (Brataco); CMC-Na (Brataco); dan Ca-alginat (Brataco) yang digunakan sebagai gelling agent, gliserol (Aldrich) digunakan sebagai humektan, trietanolamin (Brataco) digunakan sebagai peningkat pH, akuades (Tirta Amarta) digunakan sebagai pelarut, etanol 70% (Aldrich) digunakan untuk sterilisasi ruangan, Nutrien Agar (Oxoid) digunakan sebagai media uji sterilisasi, ketamin 10% digunakan sebagai anestesi dan euthanasia tikus, krim depilatori (Reckitt Benckiser) digunakan sebagai pencukur bulu tikus, formalin 10% (Aldrich) digunakan untuk mengawetkan jaringan, membrane filter GVWP 02500 0.22μm (millipore) digunakan saat uji disolusi.
Alat yang digunakan meliputi gelas beker, hotplate magnetic stirrer (Cenco), batang pengaduk, pipet ukur, timbangan analitik (Ohaus), kabinet LAF, ose, labu ukur, tabung sentrifugasi, tabung reaksi, bunsen, cawan petri, mortir, stamper, spuit injeksi, pinset, gunting, skalpel, biopsy punch, gelas ukur, kaca objek, pipet tetes, kaca bundar, mikroskop (Olympus), serta Franz diffusion cell (Logan VT-300).
4 Pembuatan sediaan hidrogel scarless wound
Tabel I. Formula Gel Scarless Wound
Hidrogel yang sudah dibuat kemudian disterilisasi menggunakan autoklaf pada suhu 121ºC selama 30 menit. Setelah itu secara aseptis dicampur dengan piroxicam yang dilarutkan etanol dilakukan di dalam LAF.
Uji sterilitas
Uji sterilitas dilakukan dengan menggoreskan hidrogel yang dihasilkan ke media Nutrient Agar pada cawan petri menggunakan jarum ose secara zig zag pada LAF. Tiap petri kemudian dibungkus plastic wrap dan diinkubasi terbalik selama 24 jam.
Pengamatan organoleptis
Pengamatan dilakukan setelah 48 jam pembuatan gel selesai dengan mengamati bentuk, warna, dan bau sediaan gel.
Uji pH
Uji pH dilakukan 48 jam setelah pembuatan gel dengan mengambil sejumlah sediaan gel dengan batang pengaduk dan dioleskan pada pH universal, kemudian dilihat warna pH stick dan disesuaikan dengan pengemasan.
Uji homogenitas
Sediaan gel secukupnya diletakkan pada object glass dan ditutup dengan object glass lainnya.
Uji viskositas
5
dijalankan menggunakan alat rheosys dengan sistem cone and plate. Uji daya sebar
Uji dilakukan 48 jam setelah pembuatan gel. Gel ditimbang 0,5 gram diletakkan di tengah kaca bulat berskala. Kaca bulat lain dengan pemberat 125 g diletakkan di atas gel dan didiamkan 1 menit, lalu dilihat diameter penyebarannya. Uji pelepasan obat
Dilakukan uji disolusi gel menggunakan cell diffusion model. 0,05mL gel dimasukkan ke dalam franz diffusion cell, digunakan membran selulosa dengan medium disolusi buffer fosfat pH 7,4, dan dijaga jangan sampai ada gelembung. Sampel dari uji disolusi diambil pada menit ke 15, 30, 45, 60, 75, 90, 120, 180, 240, 300, 360. Tiap sampel diambil, diberi buffer fosfat dengan volume yang setara untuk menjaga volume tetap konstan. Banyaknya obat yang terlepas dideterminasi secara spektrofotometri pada panjang gelombang 354 nm (Masthanamma, 2015). Uji stabilitas gel scarless wound dengan zat aktif piroxicam
Setiap formula disimpan pada suhu 4ºC selama 24 jam, kemudian disimpan pada suhu 25ºC selama 24 jam. Dilakukan penyimpanan sampai 6 siklus dan setiap akhir siklus dilakukan pengamatan uji viskositas, pH, daya sebar (Thanasukarn, et al., 2004).
Uji scarless wound
6
Uji histopatologi-Pengecatan Hematoxylin-Eosin (HE)
Sampel berupa jaringan kulit dari perlakuan diambil dan dilakukan pengecatan dengan hematoxylin eosin, dilihat di bawah mikroskop untuk melihat perubahan histopatologi. Uji hematoxylin-eosin dilakukan oleh Laboratorium Patologi Anatomi Universitas Gadjah Mada.
Tata Cara Analisis Analisis kuantitatif
Data viskositas dan daya sebar dengan sebaran data normal dan homogen diuji ANOVA taraf kepercayaan 95% dengan software R 3.2.4. Nilai p-value < 0,05 menunjukan ada perbedaan signifikan yang kemudian diuji lanjut dengan TukeyHSD. Jika data tidak normal atau tidak homogen, pengujian menggunakan Kruskall Wallis.
Kadar obat yang lepas dari uji disolusi, absorbansi yang didapat dimasukkan ke dalam persamaan kurva baku. Dari kurva baku didapat banyaknya obat yang lepas dari sediaan, lalu dihitung pelepasan obat dengan persamaan:
Drug release (%) = jumlah obat pada aseptor
jumlah obat awal pada donor x 100%
Pengukuran efek penyembuhan luka pada tikus dihitung dengan persamaan: Wound closure (%) = area luka pada hari ke 0-area luka pada hari ke n
area luka pada hari ke 0 x 100%
Pengukuran luas parut luka dengan persamaan: Scar Index(µm) = luas area scar µm
2
rata-rata ketebalan kulit µm x 100%
Analisis kualitatif
Pengamatan uji histopatologi dengan membandingkan hasil secara mikroskopis antara struktur kulit dari penyembuhan luka eksisi dengan struktur kulit normal pada tikus.
HASIL DAN PEMBAHASAN
Pembuatan gel scarless wound healing
7
dibersihkan etanol dan disinari UV selama 24 jam. Basis gel disterilisasi dengan autoklaf pada suhu 121ºC dengan tekanan 1 atm selama 15 menit, yang dengan kondisi ini dapat mematikan mikroorganisme dengan adanya degradasi asam nukleat dan denaturasi enzim (Aulton, 2013). Zat aktif dilarutkan dalam etanol lalu dicampur ke dalam basis yang sudah disterilisasi, pencampuran dilakukan pada LAF secara aseptis. Penambahan zat aktif secara aseptis bukan sterilisasi terminal agar zat aktif tidak terdegradasi karena adanya panas sterilisasi.
Uji Sterilitas
Uji sterilitas dilakukan untuk mengetahui apakah sediaan yang sudah dibuat dapat mempertahankan sterilitasnya atau tidak. Sediaan harus steril karena diaplikasikan pada kulit terbuka yang sangat rentan untuk infeksi. Hasil menunjukkan bahwa semua hidrogel dapat mempertahankan sterilitasnya, dapat dilihat dari tidak adanya mikroba pada hasil uji.
(a) (b)
(b) (d)
Gambar 2. Hasil Uji Sterilitas: Basis (a); FI (b); FII (c); FIII (d) Uji Sifat Fisis
8
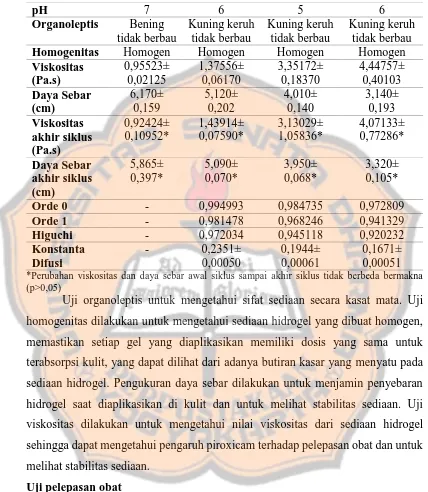
Tabel II. Hasil Uji Sifat Fisis dan Kinetika Pelepasan Obat
Sediaan Basis Formula 1 Formula 2 Formula 3 Homogenitas Homogen Homogen Homogen Homogen Viskositas *Perubahan viskositas dan daya sebar awal siklus sampai akhir siklus tidak berbeda bermakna (p>0,05)
Uji organoleptis untuk mengetahui sifat sediaan secara kasat mata. Uji homogenitas dilakukan untuk mengetahui sediaan hidrogel yang dibuat homogen, memastikan setiap gel yang diaplikasikan memiliki dosis yang sama untuk terabsorpsi kulit, yang dapat dilihat dari adanya butiran kasar yang menyatu pada sediaan hidrogel. Pengukuran daya sebar dilakukan untuk menjamin penyebaran hidrogel saat diaplikasikan di kulit dan untuk melihat stabilitas sediaan. Uji viskositas dilakukan untuk mengetahui nilai viskositas dari sediaan hidrogel sehingga dapat mengetahui pengaruh piroxicam terhadap pelepasan obat dan untuk melihat stabilitas sediaan.
Uji pelepasan obat
9
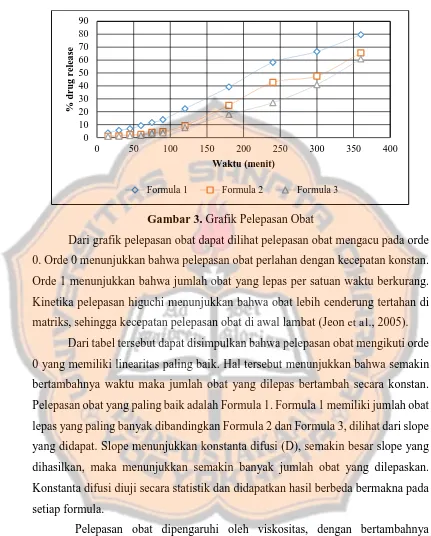
Gambar 3. Grafik Pelepasan Obat
Dari grafik pelepasan obat dapat dilihat pelepasan obat mengacu pada orde 0. Orde 0 menunjukkan bahwa pelepasan obat perlahan dengan kecepatan konstan. Orde 1 menunjukkan bahwa jumlah obat yang lepas per satuan waktu berkurang. Kinetika pelepasan higuchi menunjukkan bahwa obat lebih cenderung tertahan di matriks, sehingga kecepatan pelepasan obat di awal lambat (Jeon et al., 2005).
Dari tabel tersebut dapat disimpulkan bahwa pelepasan obat mengikuti orde 0 yang memiliki linearitas paling baik. Hal tersebut menunjukkan bahwa semakin bertambahnya waktu maka jumlah obat yang dilepas bertambah secara konstan. Pelepasan obat yang paling baik adalah Formula 1. Formula 1 memiliki jumlah obat lepas yang paling banyak dibandingkan Formula 2 dan Formula 3, dilihat dari slope yang didapat. Slope menunjukkan konstanta difusi (D), semakin besar slope yang dihasilkan, maka menunjukkan semakin banyak jumlah obat yang dilepaskan. Konstanta difusi diuji secara statistik dan didapatkan hasil berbeda bermakna pada setiap formula.
Pelepasan obat dipengaruhi oleh viskositas, dengan bertambahnya viskositas maka jumlah obat yang dilepas dalam satuan waktu tertentu akan semakin sedikit. Rumus konstanta difusi adalah:
D = kT
10
K adalah konstanta boltzman, T adalah temperature absolut, � adalah viskositas, r adalah jari-jari solute yang sperish (Avramov, 2009). Dengan meningkatnya viskositas maka dapat disimpulkan akan menurunkan kecepatan pelepasan obat karena akan menahan zat aktif dalam sediaan (Anggraeni et al., 2012). Hal ini sesuai, bahwa formula 1 yang memiliki viskositas paling rendah melepaskan konsentrasi obat paling besar, diikuti dengan formula 2 yang memiliki viskositas lebih besar, pelepasan obat lebih kecil, lalu formula 3 yang memiliki viskositas paling besar memiliki pelepasan obat dalam jumlah paling kecil.
Uji Stabilitas
Uji stabilitas dilakukan dengan menyimpan sediaan hidrogel pada suhu 4ºC selama 24 jam, kemudian disimpan pada suhu 25ºC selama 24 jam sampai 6 siklus. Viskositas serta daya sebar diamati pada setiap siklus. Pada setiap siklus dilakukan uji statistik untuk melihat adanya perbedaan rata-rata viskositas dan daya sebar antar siklusnya. Menurut data uji statistik didapatkan hasil bahwa sediaan stabil, dari siklus 0 sampai siklus 6 tidak berbeda bermakna atau p>0,05. Disimpulkan bahwa sediaan stabil terhadap perubahan suhu ekstrim (Arieta, 2009).
Perlakuan Terhadap Hewan Uji
Tikus yang digunakan memiliki kriteria sebagai berikut: Tikus spesies Rattus norvegicus dengan galur Wistar, usia 2 bulan, bobot berkisar antara 150-180 g. Usia dan berat badan dikontrol dengan baik agar meminimalisir variabel pengacau tak terkendali pada tikus. Berat badan dengan deviasi 30 g agar tidak menyebabkan perbedaan ketebalan kulit yang signifikan yang dapat memengaruhi kecepatan penyembuhan luka dan menyebabkan hasil penelitian menjadi bias.
Pencukuran dilakukan dengan menggunting bulu tikus sampai tipis lalu diberikan krim depilatori. Bulu tikus harus tipis sebelum diaplikasikan krim depilatori karena jika bulu masih tebal krim depilatori tidak bisa sampai ke kulit. Tikus yang sudah dicukur didiamkan selama 48 jam agar dipastikan tidak ada krim depilatori yang tersisa pada kulit sehingga tidak mempengaruhi penyembuhan pada kulit.
11
saling bertumpang tindih. Luka tidak diberikan di dekat leher agar tidak terpengaruh dengan gerakan, karena leher banyak bergerak saat beraktivitas, dan luka tidak diberikan terlalu jauh di dekat ekor agar meminimalisir tikus dapat menjilat gel hingga terhapus. Pemberian gel dilakukan segera setelah tikus diberi luka eksisi dan kemudian setiap 12 jam berikutnya hingga luka sembuh.
Setelah luka menutup sempurna atau %wound closure mencapai 100% untuk tiap luka pada tikus, dilakukan pengambilan kulit tikus. Tikus kemudian dieutanasia dan kulit punggung tikus diambil, kemudian sampel kulit disimpan dalam pot berisi formalin 10% untuk selanjutnya dibuat preparat dengan pengecatan Hematoxylin-Eosin dan diamati di bawah mikroskop.
Kecepatan Penyembuhan Luka
Lama luka mencapai % wound closure hingga 100% pada tikus adalah 10-12 hari. Data yang diambil untuk analisis statistik adalah data hari % wound closure mencapai 100%, yaitu saat luka sudah menutup sepenuhnya, data ditunjukkan pada tabel III.
12 Uji Histopatologi
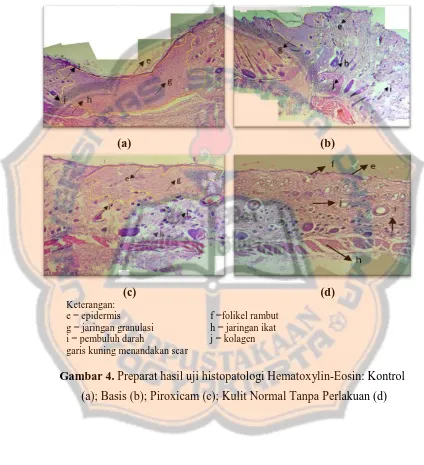
Uji histopatologi ini dilakukan untuk melihat struktur kulit secara mikroskopis dan dilakukan jika kulit sudah menutup sempurna. Hasil histopatologi ditunjukkan pada gambar 3.
(a) (b)
(c) (d) Keterangan:
e = epidermis f =folikel rambut g = jaringan granulasi h = jaringan ikat i = pembuluh darah j = kolagen garis kuning menandakan scar
13
Tabel III. Hasil Pengamatan Histopatologi Scar index Hari
14 KESIMPULAN DAN SARAN
Formula optimum adalah formula 1 yang mengandung carbopol 1%. Formula 1 memiliki jumlah pelepasan obat yang paling besar dan terbukti mampu menyembuhkan luka dan mengurangi bekas luka.
Saran untuk penelitian selanjutnya adalah untuk menguji formula optimum secara in vivo.
UCAPAN TERIMA KASIH
Terima kasih ditujukan kepada PT. Dexa Medica atas sumbangan working standar piroxicam, serta Grant penelitian dari DP2M DIKTI.
DAFTAR PUSTAKA
Abd-allah, F.I., et al., 2011. Evaluation of The Antiinflammatory and Analgesic Effects of Piroxicam Loaded Microemulsion in Topical Formulations. International Journal of Pharmacy and Pharmaceutical Sciences, Cairo, 66-70.
Abd-allah, F.I., Dawaba, H.M. & Ahmed, A.M.S., 2010. Loaded Microemulsions In Topical Formulations. 4(4), 267–275.
Anggraeni. Y., Hendradi. E. & Purwanti. T., 2012. Diklofenak Dalam Sistem Niosom Dengan Basis Gel . 1(1),1–15.
Arieta, A.G., 2009. Analytical Considerations. WHO
Avramov, I., 2009. Relationship Between Diffusion, Selfdiffusion, and Viscosity. Bulgarian Academy of Science.
Blomme. E.A.G., et al., 2003. Selective Cyclooxigenase-2 Inhibition Does Not Affect The Healing of Cutaneous Full-Thickness Incisional Wounds in SKH-1 Mice. British Journal of Dermatology, 14, 211–223.
Divadi. A., 2015. Pembuatan dan Uji Aktivitas Sediaan Gel Scarless Wound dengan Esktrak Binahong dan Zat Aktif Piroxicam. Universitas Sanata Dharma. Yogyakarta.
Eligini, S., et al., 2009. Cyclooxigenase-2 Mediates Hydrogen Peroxide-Induced Wound Repair in Human Endothelial Cells. Elsevier, Amsterdam, 1428-1436.
Enoch, S., and Leaper, D.J., 2007. Basic Science of Wound Healing. Elsevier, Amsterdam, 31-37.
Jeon, O., Kang, S.W., Lim, H.W., Chung, J.H., Kim, B.S., 2005. Long Term and Zero Order Release of Basic Fibroblast Growth Factor krom Heparin-Conjugated Poly(L-lactide-co-glycolide) Nanospheres and Fibrin Gel. Biomaterial, 27, 1598-1607.
Lee, J.L., Mukhtar, H., Bickers, D.R., Kopelovich, L., Athar, M., 2003. Cyclooxygenases in the skin: pharmacological and toxicological implications. Toxicology and Applied Pharmacology, 192: 294-306.
15
solubilization technique. International journal of biological and pharmaceutical research, Pradesh, 6(4), 273-278.
Rowe, R.C., et al., 2009. Handbook of Pharmaceutical Excipients. 6th ed..
Pharmaceutical Press, London, 465-469.
Sun, G., et al., 2011. Dextran hydrogel scaffolds enhance angiogenic responses and promote complete skin regeneration during burn wound healing. Proceedings of the National Academy of Sciences, 108(52), 20976–20981.
16
Dewasa ini banyak sekali orang yang memperhatikan penampilan, terutama pada bagian yang tampak, seperti kulit. Kulit yang kita harapkan adalah kulit yang halus, tanpa parut luka. Parut luka terbentuk karena adanya proses penyembuhan luka. Secara umum proses penyembuhan luka terjadi dalam 3 tahap yaitu inflamasi, proliferasi, dan remodelling (Beldon, 2010). Penyembuhan luka yang tidak sempurna dapat menyebabkan parut luka yang terbentuk pada saat fase inflamasi. Pada akhir fase inflamasi terbentuk kolagen, elastin, dan produksi matriks ekstraselular oleh fibroblast yang berperan dalam penutupan luka. Pada saat pematangan luka, kolagen akan semakin meningkat, namun serat kolagen ini tidak dapat menghasilkan kulit yang sama dengan sebelum terjadi luka (Enoch dan Leaper, 2008).
Piroxicam merupakan nonsteroidal anti-inflammatory drug (NSAIDs) yang memiliki aktivitas antiinflamasi, analgesik, dan antipiretik. Mekanisme kerja piroxicam adalah sebagai inhibitor prostaglandin yang menghambat enzim-enzim siklooksigenase (COX-1 dan COX-2) (Abd-allah et al., 2011). Siklooksigenase-2 (COX-2) adalah enzim yang diproduksi oleh sel endothelial yang akan terekspresi pada saat fase inflamasi (Eligini et al., 2009). COX-2 yang memiliki peran penting bertanggung jawab atas peningkatan proliferasi fibroblas dan produksi kolagen yang menyebabkan bekas pada luka (Blomme et al., 2003). Sehingga dengan menghambat COX-2 diharapkan dapat menghindari terbentuknya parut luka (Blomme et al., 2003; Eligini et al., 2009).
Sediaan yang akan dibuat adalah sediaan gel. Gel merupakan sistem semipadat yang terdiri dari suspensi yang dibuat dari partikel anorganik yang kecil atau molekul organik yang besar, terpenetrasi oleh satu cairan (Depkes RI, 2014). Digunakan hidrogel yaitu gel dengan bahan pembawa dari air. Karakteristik hidrogel sebagai sediaan scarless wound adalah semipermeabel, non aderen, serta semi transparan dengan polimer hidrofilik. Karakteristik wound dressing yang ideal adalah dapat melindungi dari bakteri, mengontrol penguapan air, oksigen dan karbondioksida dapat berdifusi, mengabsorpsi eksudat luka (Sun, 2011). Wound dressing yang baik juga harus bersifat non adherent, memfasilitasi autolytic debridement atau pembersihan luka, mudah menempel pada kulit namun tidak sulit dicuci, serta tentunya ekonomis. Hidrogel sendiri sudah dianggap
17
autolytic debridement, serta bersifat semipermeabel sehingga memungkinkan oksigen dan karbondioksida berdifusi, tetapi hidrogel membutuhkan pengolesan ulang serta dapat menjadi media pertumbuhan bakteri (Okan et al., 2007).
Pada penelitian ini dilakukan variasi konsentrasi carbopol. Pada variasi carbopol ini akan dilihat seberapa banyak pengaruhnya terhadap pelepasan obat. Carbopol merupakan gelling agent yang akan berpengaruh pada viskositas, karena jika viskositas sediaan semakin tinggi maka zat aktif dalam sediaan akan semakin sulit dilepaskan (Anggraeni et al., 2012). Selain sebagai gelling agent carbopol memiliki sifat dalam mengontrol pelepasan obat karena dapat berfungsi sebagai pengikat sehingga penambahan carbopol diduga dapat berpengaruh dalam pelepasan obat (Rowe et al., 2009).
1.2 Rumusan Masalah
Berapa kadar gelling agent carbopol yang efektif sehingga dihasilkan formulasi sediaan hidrogel scarless wound dengan zat aktif piroxicam dengan pelepasan obat yang baik serta dapat menyembuhkan luka tanpa meninggalkan parut luka?
1.3 Tujuan
Mengetahui kadar gelling agent carbopol efektif sehingga dihasilkan formulasi sediaan hidrogel scarless wound dengan zat aktif piroxicam dengan pelepasan obat yang baik serta dapat menyembuhkan luka tanpa meninggalkan parut luka.
1.4 Urgensi Penelitian
Penelitian ini berguna untuk mengembangkan dan menentukan kadar gelling agent carbopol yang menghasilkan sediaan hidrogel piroxicam dengan pelepasan obat yang baik dan dapat mempercepat proses penyembuhan luka tanpa meninggalkan parut luka.
1.5 Kontribusi Penelitian
Penelitian ini diharapkan dapat bermanfaat bagi pengembangan ilmu pengetahuan khususnya dalam bidang kefarmasian berkaitan dengan formulasi sediaan hidrogel scarless wound dengan zat aktif piroxicam dalam proses penyembuhan luka tanpa meninggalkan parut luka, sehingga dapat pula dijadikan sumber acuan yang dapat digunakan untuk penelitian selanjutnya.
1.6 Luaran yang Diharapkan
Kadar gelling agent efektif pada sediaan hidrogel scarless wound dengan zat aktif piroxicam dengan pelepasan obat yang baik dan memiliki aktivitas penyembuhan luka tanpa meninggalkan parut luka
1.7 Manfaat Penelitian
18
19 BAB II
TINJAUAN PUSTAKA 2.1 Luka
2.1.1 Penyembuhan luka
Luka adalah perusakan pada kulit yang akan merubah struktur dan fungsi dari jaringan yang normal. Luka dapat terjadi karena adanya operasi, sayatan, dan tusukan (Ariani, et al., 2013). Luka harus disembuhkan agar struktur kulit dapat kembali seperti semula dan berfungsi seperti sedia kala (Enoch dan Leaper, 2008). Penyembuhan luka terdiri dari 3 tahap. Tahap pertama adalah fase inflamasi, lalu tahap kedua adalah proliferasi atau fase pembentukan jaringan, dan fase ketiga atau fase terakhir adalah fase remodelling yang berarti penyusunan ulang jaringan (Beldon, 2010). Pada saat luka terjadi, hal pertama adalah mengeluarkan darah. Histamin akan dilepaskan dari sel mast dan akan meningkatkan vasodilatasi dan meningkatkan permeabilitas vaskular, untuk memfasilitasi terjadinya fase inflamasi di sekitar luka (Harper et al. 2014).
Pada fase inflamasi terjadi selama 1-2 hari terjadi aktivasi interleukin dan sinyal transforming growth factor-b (TGF-b), sehingga akan merangsang neutrofil. Neutrofil akan menghancurkan serpihan luka dan bakteri, serta mengeluarkan zat-zat asing yang tidak dibutuhkan hingga luka menjadi steril (Enoch dan Leaper, 2007; Harper et al. 2014). Fase kedua adalah fase proliferasi. Fase ini terjadi pada hari ketiga sampai minggu kedua. Pada fase ini terjadi pembentukan jaringan (Enoch dan Leaper, 2007). Terjadi angiogenesis atau pembentukan pembuluh darah baru sehingga pembuluh darah akan permeabel dan siap untuk memfasilitasi granulasi jaringan. Setelah itu terjadi migrasi fibroblas sehingga dapat diproduksi fibronectin dan kolagen, lalu akan terjadi epitelisasi sehingga luka mengencang atau terjadi atraksi luka (Harper et al. 2014). Fase ketiga adalah fase remodelling. Pada fase ini terjadi penyusunan ulang jaringan dan pematangan jaringan (Enoch dan Leaper, 2007). Fase ini dapat terjadi sampai 2 tahun setelah luka terjadi. Pada fase ini luka akan sembuh tetapi tidak akan sama seperti sebelum luka terjadi. Pada saat luka mematang, bekas luka akan berubah warna dari kemerahan menjadi merah keabuan seiring berjalannya waktu (Harper et al. 2014).
2.1.2 Parut Luka
20
ekstraselular oleh fibroblast yang akan berperan dalam penutupan luka. Selanjutnya terjadi fase proliferasi. Pada fase proliferasi, proliferasi sel epitel berlanjut, sehingga dapat menyebabkan penebalan lapisan epidermal, yang menyebabkan hipertrofi, penebalan pada bekas luka atau yang biasa disebut keloid. Setelah itu terjadi pematangan luka dan kolagen akan semakin meningkat. Namun, serat kolagen ini tidak dapat menghasilkan kulit yang sama dengan sebelum terjadi luka (Enoch dan Leaper, 2008).
Yang sangat mendasari terbentuknya parut luka adalah fase inflamasi, karena pembentukan kolagen terjadi pada fase inflamasi. Maka pengurangan parut luka dapat dilakukan dengan mengurangi proses inflamasinya. Pada saat inflamasi, sel endothelial akan memproduksi siklooksigenase-2 (COX-2) yang akan berpengaruh pada produksi kolagen, sehingga dengan menghambat COX-2 diharapkan parut luka akan berkurang (Blomme et al., 2003).
2.2 Piroxicam
Gambar 1. Struktur Piroxicam
Piroxicam merupakan nonsteroidal anti-inflammatory drug (NSAIDs) yang memiliki aktivitas antiinflamasi, analgesik, dan antipiretik. Aktivitas piroxicam adalah sebagai inhibitor prostaglandin yang menghambat enzim-enzim siklooksigenase (COX-1 dan COX-2) (Abd-allah et al., 2011).
Siklooksigenase-2 (COX-2) adalah enzim yang diproduksi oleh sel endothelial yang akan terekspresi pada saat fase inflamasi. COX-2 memiliki peran penting bertanggung jawab atas peningkatan proliferasi fibroblas dan produksi kolagen yang menyebabkan bekas pada luka. Sehingga dengan menghambat COX-2 dapat disimpulkan dapat menghindari terbentuknya parut luka (Blomme et al., 2003; Eligini et al., 2009).
2.3 Hidrogel 2.3.1 Definisi
21
mengontrol penguapan air, oksigen dan karbondioksida dapat berdifusi, mengabsorpsi eksudat luka (Sun, 2011). Wound dressing yang baik juga harus bersifat non adherent, memfasilitasi autolytic debridement atau pembersihan luka, mudah menempel pada kulit namun tidak sulit dicuci, serta tentunya ekonomis.
Hidrogel sendiri sudah dianggap sebagai “ideal wound dressing” (Boateng, 2008). Hidrogel dapat digunakan sebagai scarless wound, memberi efek dingin pada kulit, semipermeabel sehingga dapat memfasilitasi difusi dari oksigen dan karbondioksida, serta memfasilitasi autolytic debridement, tetapi hidrogel membutuhkan pengolesan ulang setelah beberapa saat dipakai karena mudah tercuci. Selain itu hidrogel juga ada potensi untuk dapat menjadi media pertumbuhan bakteri (Okan et al., 2007).
Gel merupakan sistem semipadat yang terdiri dari suspensi yang dibuat dari partikel anorganik yang kecil atau molekul organik yang besar, terpenetrasi oleh satu cairan. Sedangkan hidrogel sendiri adalah gel, tetapi dengan pembawa air (Depkes RI, 2014). Untuk zat aktif piroxicam dapat digunakan hidrogel (Depkes RI, 2014).
2.3.2 Komponen Gel
Gambar 2. Struktur Carbopol (Rowe et al., 2009).
Carbopol merupakan kelompok acrylic polymer cross-linked dengan poly alkenyl ether. Nama lain carbopol adalah acitamer, acrylic Acid pilymer, carbomer, carboxyvinyl polymer. Carbopol berperan besar dalam menambah viskositas dan sebagai suspending agent dalam gel, krim, dan salep. Carbopol juga memiliki sifat sebagai buffering agent (Liu et al., 2008). Selain sebagai gelling agent carbopol memiliki sifat dalam mengontrol pelepasan obat karena dapat berfungsi sebagai binder sehingga penambahan carbopol diduga dapat berpengaruh dalam pelepasan obat (Rowe et al., 2009). Carbopol merupakan gelling agent yang akan berpengaruh pada penambahan viskositas, karena jika viskositas sediaan semakin tinggi maka zat aktif dalam sediaan akan semakin sulit dilepaskan (Anggraeni et al., 2012).
22
Carbopol bersifat asam dan sebelum digunakan dinetralkan dengan penambahan basa triethanolamine (TEA).
2.4 Landasan Teori
Pada proses penyembuhan luka terjadi 3 tahap yaitu tahap inflamasi, proliferasi, dan remodelling. Parut luka terjadi pada proses inflamasi, terjadi pembentukan kolagen. Pembentukan kolagen pada fase inflamasi ini diakibatkan oleh sekresi COX-2. Maka untuk menghambat COX-2 digunakan piroxicam yang merupakan NSAIDs antiinflamasi, antipiretik, dan analgesik yang akan menghambat enzim COX-2 sehingga menghambat sintesis prostaglandin. Akan dibuat gel scarless wound dengan zat aktif piroxicam dengan variasi gelling agent carbopol. Penelitian ini bertujuan untuk melihat formulasi sediaan gel scarless wound terbaik yang stabil dengan pelepasan zat aktif piroxicam yang baik. Carbopol sebagai gelling agent akan berpengaruh pada viskositas hidrogel. Semakin besar viskositas pada gel maka akan berpengaruh pada pelepasan obat karena viskositas yang tinggi akan membuat zat aktif sulit dilepaskan sehingga dengan melakukan variasi carbopol diharapkan akan didapatkan sediaan yang stabil serta dapat memiliki profil pelepasan obat yang baik.
2.5 Hipotesis
23 BAB III
METODE PENELITIAN 3.1 Jenis dan Rancangan Penelitian
Penelitian yang berjudul “Formulasi sediaan hidrogel scarless wound
dengan zat aktif piroxicam” ini termasuk eksperimental murni.
3.2 Variabel Penelitian dan Definisi Operasional 3.2.1 Variabel Tergantung
Variabel tergantung pada penelitian ini adalah viskositas, daya sebar, pH, homogenitas, stabilitas gel, dan pelepasan zat aktif.
3.2.2 Variabel Bebas
Variabel bebas pada penelitian ini adalah variasi kadar gelling agent carbopol serta penambahan piroxicam 5% ke dalam sediaan gel penyembuh luka. 3.2.3 Variabel Pengacau
a. Variabel pengacau terkendali. Variabel pengacau terkendali pada penelitian ini adalah tempat penyimpanan, cara penyimpanan gel, wadah gel, kecepatan dan cara pembuatan gel, berat badan tikus, galur tikus, jenis kelamin tikus, dan asupan gizi tikus.
b. Variabel pengacau tak terkendali. Variabel pengacau tak terkendali pada penelitian ini adalah suhu ruangan, kelembaban ruangan, kondisi patologis hewan uji (tikus).
3.2.4 Definisi Operasional
a. Formulasi sediaan. Formulasi hidrogel dengan variasi kadar gelling agent carbopol
b. Basis hidrogel. Menggunakan basis carbopol, CMC-Na, Ca-alginate dengan pelarut akuades.
c. Gelling agent. Bahan pembentuk gel dengan carbopol, serta gelling agent lain yaitu CMC-Na dan Ca-alginate.
d. Formula optimum. Formula gel dengan standar sediaan semisolid sesuai syarat (daya sebar 5-7 cm dan viskositas 200-300 dPa.s), serta dapat melepas zat aktif dengan maksimal.
e. Sifat fisik gel. Parameter acuan yang digunakan adalah organoleptis, pH, homogenitas, viskositas, dan daya sebar gel.
f. Stabilitas gel. Parameter untuk mengetahui stabilitas gel scarless wound meliputi viskositas dan persen sineresis setelah sediaan gel melewati siklus freeze thaw.
24
h. Uji disolusi. Uji disolusi adalahsuatu metode in vitro yang digunakan untuk mengetahui pelepasan obat dari bentuk sediaan gel.
i. Uji Hispatologi. Suatu pengamatan kulit tikus menggunakan mikroskop cahaya dengan adanya bantuan zat pewarna tertentu.
3.3 Bahan Penelitian
Piroxicam, kalium sorbat, asam borat, carbopol 940, CMC-Na, Ca-alginat, gliserin, TEA, akuades, etanol 96% (Labora), etanol 70%, Nutrien Agar (Oxoid), kloroform teknis, ketamine, krim depilatori, kapas, formalin 10%, larutan Harris Hematoxylin, larutan acid alcohol, larutan ammonium, larutan stok Eosin alcohol 1%, larutan working Eosin.
3.4 Alat Penelitian
Beaker glass, kabinet LAF, pipet tetes, plastic wrap, kaca bundar, object glass, corong, alumuniumfoil, ose, spuit injeksi, pinset, gunting, blade, scalpel, plat besi, mikroskop cahaya, mantle heater, stirrer, magnetic stirrer, labu ukur, pompa vakum, batang pengaduk, corong buchner, sentrifuge, sentrifuge tube, viskometer, mortir, stamper, sudip, thermometer, biopsy punch.
3.5 Tata Cara Penelitian
3.5.1 Sterilisasi ruangan
Ruangan dibersihkan terlebih dahulu dengan menggunakan etanol 70% dan didiamkan selama 24 jam sebelum pembuatan gel scarless wound, dalam hal
25
ini termasuk setiap sudut dan lantai ruangan. Saat didiamkan 24 jam sebelum pembuatan gel, lampu UV pada LAF dan ruangannya dinyalakan selama 24 jam. 3.5.2 Sterilisasi tube
Plastik filling gel dibiarkan dibawah sinar UV pada LAF selama 24 jam bersamaan dengan tube yang akan dipakai yang sudah dicuci dengan etanol 70% bersamaan dengan proses sterilisasi ruangan.
3.5.3 Pembuatan gel scarless wound
Tabel I. Formula gel scarless wound acuan (Divadi, 2015) Formula Jumlah (g)
Tabel II. Formula gel scarless wound
26
disterilisasi menggunakan autoklaf pada suhu 121ºC selama 30 menit. Setelah itu dicampur dengan piroxicam yang dilakukan di dalam LAF.
3.5.4 Uji sifat fisik gel scarless wound dengan zat aktif piroxicam a. Pengamatan organoleptis
Pengamatan dilakukan setelah 48 pembuatan gel selesai dengan mengamati bentuk, warna, dan bau sediaan gel.
b. Uji pH
Uji pH dilakukan 48 jam setelah pembuatan gel dengan mengambil sejumlah sediaan gel dengan batang pengaduk dan dioleskan pada pH universal, kemudian dilihat warna pH stik dan disesuaikan dengan pengemasan. pH yang diharapkan adalah 4,5-6,5 (Tranggono dan Latifah, 2007).
c. Uji homogenitas
Sediaan gel secukupnya diletakkan pada object glass dan ditutup dengan object glass lainnya.
d. Uji viskositas
Digunakan alat Rheosys yang menggunakan cone and plate. Diambil gel sedikit dan ditaruh pada plate, Pengujian viskositas dilakukan sebanyak 5 replikasi, dilakukan 48 jam setelah pembuatan gel. Respon yang diinginkan adalah 200-300 dPa.s (Garg et al., 2002).
e. Uji daya sebar
Uji dilakukan 48 jam setelah pembuatan gel. Gel ditimbang 0,5 gram diletakkan di tengah kaca bulat berskala. Kaca bulat lain dengan pemberat 125 g diletakkan di atas gel dan didiamkan 1 menit, lalu dilihat diameter penyebarannya. Pengujian daya sebar dilakukan sebanyak 5 replikasi. Respon yang dikehendaki adalah diameter penyebaran 5-7cm (Garg et al., 2002).
f. Uji sterilitas
27
diambil 1 ose gel dan digoreskan secara zigzag pada permukaan media NA. Tiap tahap dilakukan di dalam LAF. Cawan petri dibungkus dengan plastic wrap dan diberi label, diinkubasi terbalik dalam LAF tanpa nyala bunsen 24 jam dan dilakukan pengamatan setelahnya (Divadi, 2015). g. Uji disolusi
Dilakukan uji disolusi gel menggunakan cell diffusion model. 2 gram gel dimasukkan ke dalam franz diffusion cell, di dalamnya terdapat membran selofan poros yang sebelumnya direndam air suling 100ºC selama 5 menit. Keadaan dijaga jangan sampai ada gelembung. Uji dilakukan dengan 300 mL buffer fosfat pH 7,4 dengan kecepatan 120 rpm. 2 mL sampel dari uji disolusi diambil dengan interval tiap 15 menit selama 90 menit. Tiap sampel diambil, diberi buffer fosfat dengan volume yang setara untuk menjaga volume tetap konstan. Banyaknya obat yang terlepas dideterminasi secara spektrofotometri pada panjang gelombang 350 nm (Abd-allah et al., 2010)
3.5.5 Uji stabilitas gel scarless wound dengan zat aktif piroxicam a. Uji sineresis
Uji dilakukan setelah 48 jam setelah pembuatan gel untuk melihat pemisahan fase pada sediaan. Sampel uji dimasukkan ke dalam tabung sentrifugal dan disentrifugasi selama 5 jam dengan kecepatan 3750 rpm dan setiap 1 jam diamati ada tidaknya pemisahan fase. Uji ini untuk prediksi kestabilan sediaan selama penyimpanan satu tahun akibat pengaruh gravitasi (Elya et al., 2013).
b. Siklus freeze-thaw
Setiap formula disimpan pada suhu 4ºC selama 24 jam, kemudian disimpan pada suhu 25ºC selama 24 jam. Dilakukan penyimpanan sampai 6 siklus dan setiap akhir siklus dilakukan pengamatan uji viskositas, pH, daya sebar (Thanasukarn, et al., 2004).
3.5.6 Uji scarless wound
Tiga ekor tikus ditimbang dan dicukur. Pada punggung tikus diberi krim depilatory dan didiamkan 5 menit, dibilas dengan kapas basah sampai kulit tampak, lalu dibiarkan selama 48 jam. Tikus diberi anestesi ketamine melalui injeksi i.m. pada paha dan ditunggu hingga tikus tertidur. Kulit punggung tikus dibasahi dengan etanol 70% dan dilakukan luka eksisi dengan biopsy punch. Gel scarless wound sebanyak 0,1 mL dioleskan pada luka tiap 12 jam hingga luka sembuh. Tikus dieutanasia dengan inhalasi kloroform teknis, kemudian kulit punggung diambil dengan ukuran 2x2 cm dan disimpan dalam pot berisi formalin 10% (Divadi, 2015; DiPietro, 2003).
28
Dilakukan pengecatan yang diawali dengan trimming atau pemotongan jaringan menggunakan scalpel. Lalu dilakukan dehidrasi, dikeluarkan air dari jaringan menggunakan reagen pembersih. Setelah itu dilakukan penetrasi parafin ke dalam jaringan atau impregnasi. Jaringan diletakkan di sebuah balok kayu (embedding), jaringan dipotong dengan pisau mikrotom (cutting), dan pengecatan (staining) mrnggunakan xylol, alkohol absolut, akuades, harris hematoxylin, acid alkohol, eosin, dan alkohol 96%. Terakhir dilakukan penutupan dengan object glass dengan cover glass (mounting) dan hasil histopatologinya diamati pada mikroskop cahaya (Olympus tipe BH-2, Olympus Corp., Jepang) (Jones, 2014).
3.6 Tata Cara Analisis 3.6.1 Analisis kuantitatif
Data yang diperoleh pada penelitian ini adalah data sifat fisik, stabilitas fisik, dan aktivitas pengurangan parut luka sediaan scarless wound dengan zat aktif piroxicam. Untuk mengetahui signifikansi data yang diperoleh adalah dengan analisis statistik data menggunakan software R 3.2.3. Data sifat fisik viskositas dan daya sebar dihitung rata-rata serta standar deviasi dianalisis menggunakan uji ANOVA dengan taraf kepercayaan 95%.
Data viskositas dan daya sebar dengan sebaran data normal dan homogen diuji ANOVA taraf kepercayaan 95% dengan software R 3.2.3. Nilai p-value < 0,05 menunjukan ada perbedaan signifikan yang kemudian diuji lanjut dengan TukeyHSD. Jika data tidak normal atau tidak homogen, pengujian menggunakan Kruskall Wallis.
Kadar obat yang lepas dari uji disolusi, absorbansi yang didapat dimasukkan ke dalam persamaan kurva baku. Dari kurva baku didapat banyaknya obat yang lepas dari sediaan.
Pengukuran efek penyembuhan luka pada tikus dihitung dengan persamaan: Wound closure (%) = ar a u a pa a ar 0−ar a u a pa a ar n
ar a u a pa a ar 0 x 100% 3.6.2 Analisis kualitatif
31 Lampiran 4. Data hasil uji sifat fisis Hasil Uji Sterilitas
(a) (b)
(c) (d)
Hasil Uji Sterilitas: Basis (a); FI (b); FII (c); FIII (d) Data Hasil Uji Viskositas
Sediaan Basis FI FII FIII
Replikasi 1 0,92556 1,40065 3.45437 4,42362 Replikasi 2 0,95468 1,36061 3,40067 4,52475 Replikasi 3 0,94504 1,31849 3,28567 4,42780 Replikasi 4 0,97723 1,32825 3,54774 3,86701 Replikasi 5 0,97362 1,46978 3,07017 4,99467 Rata-rata 0,95523 1,37556 3,35172 4,44757 SD 0,02125 0,06170 0,18370 0,40103 Data Hasil Uji Daya Sebar
Sediaan Basis FI FII FIII
Replikasi 1 6,375 5,050 3,925 3,400 Replikasi 2 6,250 4,900 3,850 2,875 Replikasi 3 6,175 5,400 3,975 3,075 Replikasi 4 6,100 5,000 4,200 3,125 Replikasi 5 5,950 5,250 4,100 3,225 Rata-rata 6,170 5,120 4,010 3,140
32
Lampiran 5. Kurva baku piroxicam dan data uji pelepasan obat Kurva baku piroxicam
Correlation coefficient (r) 0,9987
33 Data uji pelepasan obat
Formula I Formula II Formula III Waktu % Drug Release % Drug Release % Drug Release
15 3,623683994 0,96563593 0,930858212
30 5,639862783 1,384618364 1,149122839
45 6,84036758 2,289778528 1,432058466
60 9,229664934 2,38859514 1,597777904
75 11,65577219 4,03290356 3,529824042
90 13,89364699 4,645566553 3,687459606
120 22,25953408 9,235400537 7,66553452
180 39,20045544 24,94724181 17,95226553
240 58,19729355 42,66110764 26,97184912
300 66,56318064 47,60193823 41,03779171
360 79,69762338 65,50750828 60,92412434
Koefisien difusi Uji normalitas
34 Uji Homogenitas dan Anova
35 Lampiran 6. Data hasil uji stabilitas
1. Pergeseran Daya Sebar selama ke-6 freeze thaw cycle Formula/
Rata-rata ± SD 6,170±0,159 5,120±0,202 4,010±0,140 3,140±0,193
Siklus 1 6,200 5,125 4,000 3,325
6,225 4,875 4,100 3,125
5,975 5,000 4,125 3,475
5,900 5,025 4,025 3,250
6,000 5,075 4,200 3,375
Rata-rata ± SD 6,060±0,144 5,020±0,094 4,090±0,080 3,310±0,132
Siklus 2 5,200 5,350 3,875 3,250
5,950 5,050 4,050 3,025
5,700 5,125 4,100 3,075
5,925 5,150 4,025 3,125
6,150 5,225 4,075 3,175
Rata-rata ± SD 5,785±0,364 5,180±0,114 4,025±0,088 3,130±0,087
Siklus 3 5,950 4,950 3,975 3,200
6,100 5,075 3,625 3,075
6,325 5,800 4,075 3,025
6,200 5,125 4,325 3,300
6,225 5,125 4,550 3,425
Rata-rata ± SD 6,160±0,142 5,215±0,335 4,110±0,352 3,205±0,163
Siklus 4 6,000 5,500 4,050 3,375
6,025 5,375 4,125 3,300
5,975 5,400 4,100 3,300
6,075 5,325 4,075 3,325
6,050 4,875 4,150 3,325
Rata-rata ± SD 6,025±0,040 5,295±0,243 4,100±0,040 3,325±0,031
Siklus 5 5,975 5,150 4,025 3,100
5,800 5,150 4,075 3,125
6,050 5,125 3,950 3,150
5,075 5,050 3,900 3,250
6,150 5,125 3,850 3,350
36 Uji Normalitas
*p-value > 0,05 menunjukkan data terdistribusi normal, Uji Homogenitas
Rata-rata ± SD 5,865±0,397 5,090±0,070 3,950±0,068 3,320±0,105
37
*p-value > 0,05 menunjukkan varians data homogen dan dilanjutkan dengan Uji ANOVA, varians data yang tidak homogen dilanjutkan dengan Uji Kruskal Wallis,
Uji Kruskal Wallis
*p-value > 0,05 menunjukkan data tidak berbeda secara signifikan, Uji ANOVA
*p-value > 0,05 menunjukkan data tidak berbeda secara signifikan, Formula p-value*
Basis 0,1557
FI 0,2742
FII 0,1305
38
2. Pergeseran Viskositas selama ke-6 freeze thaw cycle Formula/
0,95468 1,36061 3,40067 4,52475
0,94504 1,31849 3,28567 4,42780
0,97723 1,32825 3,54774 3,86701
0,97362 1,46978 3,07017 4,99467
Rata-rata ± SD 0,95523±
1,06900 1,26949 2,67180 3,21077
0,98132 1,48465 4,47415 4,04804
1,43401 2,00423 4,00936 5,67666
0,91459 1,34385 2,03314 5,78309
Rata-rata ± SD 1,00298±
0,89623 1,25781 3,54677 4,43993
1,34881 1,27493 3,39517 4,27953
0,85967 1,46738 3,70207 5,09045
Rata-rata ± SD 1,00686±
1,07283 1,09880 3,63166 4,74887
1,28693 1,50240 3,47372 4,76383
1,12249 1,79168 3,52430 4,08325
0,97588 1,45287 3,10570 4,39814
Rata-rata ± SD 1,18053±
0,95332 1,02164 2,95694 4,11146
1,12777 1,64060 3,48256 4,25075
0,96443 1,45365 2,93154 4,24160
0,81247 1,57599 3,08797 4,42667
Rata-rata ± SD 0,93723±
0,95156 1,41657 1,78990 3,15054
0,98562 1,30673 2,75361 6,25269
0,99043 1,50556 4,55937 4,25024
0,90861 1,39095 2,21455 4,33413
39 Uji Normalitas
*p-value > 0,05 menunjukkan data terdistribusi normal, Uji Homogenitas
1,03786 1,41302 4,00365 3,11855
0,83555 1,38413 4,43460 4,63016
0,78545 1,57302 2,05089 4,29132
1,00821 1,40977 2,93354 3,41477
40 FIII 0,002767
*p-value > 0,05 menunjukkan varians data homogen dan dilanjutkan dengan Uji ANOVA, varians data yang tidak homogen dilanjutkan dengan Uji Kruskal Wallis,
Uji Kruskal Wallis
*p-value > 0,05 menunjukkan data tidak berbeda secara signifikan,
41 (b)
Grafik stabilitas viskositas selama freeze thaw cycle (a); Grafik stabilitas daya sebar selama freeze thaw cycle (b)
0.000 1.000 2.000 3.000 4.000 5.000 6.000 7.000
0 1 2 3 4 5 6
Day
a
Seb
ar
(
cm
)
Siklus
Perubahan Daya Sebar
Basis
F1
F2
42
Lampiran 7. Data %Wound Closure dan Kecepatan Penyembuhan % Wound Closure
Kecepatan Penyembuhan
Kontrol Basis Piroxicam
Tikus 7 11 10 10
Tikus 8 10 11 10
Tikus 9 12 11 11
Uji Normalitas
43 Uji Homogenitas
*p-value > 0,05 menunjukkan varians data homogen, Uji ANOVA
*p-value > 0,05 menunjukkan data tidak berbeda secara signifikan
Data Scar Index Tebal 1 (µm)
Tebal 2 (µm)
Tebal 3 (µm)
Tebal 4 (µm)
Rata-rata (µm)
Luas jaringan granulasi
(µm2)
scar index
44 Lampiran 8. Hasil Uji Histopatologi
(a) (b)
(c) (d) Keterangan:
e = epidermis f =folikel rambut g = jaringan granulasi h = jaringan ikat i = pembuluh darah j = kolagen garis kuning menandakan scar
Gambar.Preparat hasil uji histopatologi Hematoxylin-Eosin: Kontrol (a); Basis (b); Piroxicam (c); Kulit Normal Tanpa Perlakuan (d)
Scar Index(µm) = luas area scar µm
2
rata-rata ketebalan kulit µm x 100%
45
Lampiran 9. Foto dokumentasi kegiatan penelitian
Orientasi Sediaan
Formulasi Sediaan hidrogel scarless wound healing piroxicam
Sediaan hidrogel scarless wound healing piroxicam: A. Basis; B. FI; C. FII; D. FIII
46
Uji Viskositas Uji Sterilitas
Uji Homogenitas
Uji Daya Sebar
47
Pot berisi sampel kulit punggung tikus dalam formalin 10%, siap diuji histopatologi histopatologi
Kandang tikus
Tikus diberi perlakuan luka punggung
48
BIOGRAFI PENULIS