SEJARAH SENYAWA KOORDINASI
Kimia tentang senyawA-senyawa kompleks,relative belum lama. Senyawa kompleks
yang mula-mula didapatkan agaknya biru Prusia : KCN, Fe (CN)2, Fe ( CN)3. Senyawa ini
didatkan oleh pembuat zat pembuat zat warna Diesbach di Berlin pada awal abad 18. Sejak itu
banyak dibuat senyawa-senyawa kompleks,seperti K4[Fe (CN)6] pada tahun 1753,
Kobalammines pada tahun 1798, [ Fe (CO)5] pada tahun 1891, Ftalosianin pada tahun
1926,Siklopentadienil pada tahun 1951.
Awal dari kimia koordinasi biasanya dianggap sejak diketemukannya heksamminekobal
(III) klorida, CoCl3.6NH3 oleh Tassaert pada tahun 1798. Dia mendapatkan, bila larutan Co (III)
klorida ditambah larutan NH3 dan dibiarkan semalam,akan terbentuk Kristal-kristal CoCl3.6NH3
yang berwarna orange. Dia dan ahli lain tidak dapat menjelaskan,apa sebabnya dua senyawa diatas yang masing-masing sudah jenuh valensinya dapat saling berikatan membentuk senyawa yang baru. Jawaban tentang hal ini baru diketemukan kira-kira seratus tahun kemudian. Sejak itu memang telah banyak senyawa-senyawa sejenis dibuat dan diselidiki, beberapa teori telah diajukan, namun teori-teori ini tidak dapat menjelaskan hasil-hasil percobaan.
Pembuatan dari kompleks-kompleks logam biasanya dilakukan dengan mereaksikan garam-garam dengan molekul-molekul atau ion-ion tertentu.penelitian- penelitian pertama selalu memakai amoniak dan zat yang terjadi disebut Logamammine. Kemudian ternyata, bahwa anion-anion seperti CN-, NO
2-, NCS- dan Cl- juga membentuk kompleks dengan logam-logam.
Kompleks-kompleks berikut diberi nama sesuai dengan penemunya.
Kompleks Nama Rumus sekarang
Fenny pada tahun 1851-1852 memberi nama senyawa-senyawa kompleks berdasarkan warnanya. Hal ini berdasarkan kenyataan bahwa kloroammine dari kobal (III) dan krom (III) dengan jumlah amoniak sama, mempunyai warna hamper sama. Namun demikian hal ini kemudian tidak menjadi dasar lagi, seperti terlihat pada Ir Cl3.6 H2O yang diberi nama
Baik kompleks klorammine kobal (III) ataupun krom (III). Kecuali warnanya berbeda. Reaktivitas dari klor yang ada juga berbeda. Penambahan larutaunar perak nitrat kepada larutan yang baru dibuat dari CoCl2.6 NH3 ternyata dapat mengendapkan ketiga ion Cl- yang ada. Untuk
senyawa CoCl3.5 NH3 ternyata hanya dapat diendapkan dua pertiganya,ion Cl- ketiga baru
diendapkan pada saat yang lama. Hasil-hasil Percobaan ini terdapat pada table II
TABEL I
NAMA SENYAWA BERDASARKAN WARNA
Kompleks Warna Nama Rumus sekarang
CoCl3. 6 NH3 Kuninng Luteokobltik klorida [Co (NH3 )6] Cl3
CoCl3. 5 NH3 ungu Purpureokobaltik klorida [Co (NH3 )5Cl] Cl2
CoCl3.4 NH3 Hijau Praseokabaltik klorida Trans-[Co (NH 3) 4Cl2 ] Cl
CoCl3. 3 NH3 Violet Violeokobaltik klorida Cis- [ Co (NH 3) Cl 2] Cl
CoCl3.5 NH3
H2O
Merah Roseokobaltik klorida [Co (NH 3) 5H2 O] Cl 3
IrCl3. 6 NH3 Putih Luteoiridium klorida [Ir (NH 3)6 ] Cl3
Dari percoban di atas dapat diambil kesimpulan bahwa ketiga Cl dalam CoCl3. 6 NH3.
Dari Ir Cl3. 3 NH3 mempunyai kedudukan sama, sedang dalam CoCl3. 5 NH3 dan CoCl3. 4.NH3
ada dua jenis klor. Atom klor yang pertama dalam garam-garam dan mudah diendapkan dengan perak nitrat, sedang atom klor yang kedua sangat kuat diikat hingga tidak diendapkan.
TABEL II
JUMLAH Cl- YANG DIENDAPKAN SEBAGAI AgCl
Kompleks Jumlah Cl terendap Rumus sekarang
Co Cl3 .6 NH3 3 [Co (NH3 ) 6] 3+ .3 Cl
-Co Cl3 .5 NH3 2 [Co (NH3 ) 5 Cl ]2+ .3 Cl
-Co Cl3 .4 NH3 1 [Co (NH 3)4 Cl ]+ .3 Cl
TABEL III
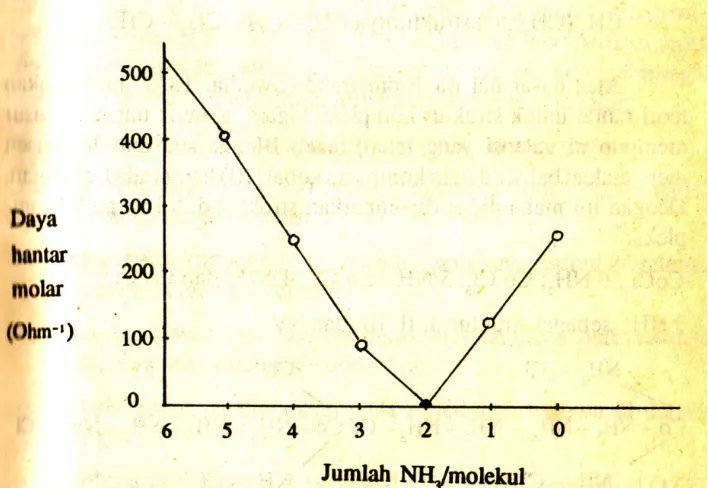
DAYA HANTAR MOLAR KOMPLEKS PLATINA (IV)
Kompleks Daya hantar molar
(ohm-1) Jumlah ion Rumus sekarang
Pt Cl 4.6 NH3 523 5 [Pt(NH3)6]4+.4 Cl
-Pt Cl 4.5 NH3 404 4 [Pt(NH3)5 Cl]3+.4 Cl
-Pt Cl 4.4 NH3 229 3 [Pt(NH3)4 Cl2]2+.2 Cl
-Pt Cl 4.3 NH3 97 2 [Pt(NH3)3 Cl3]+.Cl
-Pt Cl 4.2 NH3 0 1 [Pt(NH3)6]4+.4 Cl
-Pt Cl 4. NH3. KCl 109 2 K+. [Pt(NH3)Cl5]
-Pt Cl 4.2 KCL 256 3 2 K+. [PtCl6]
2-Percobaan lain yang dapat dipakai untuk menetapkan jumlah ion dalam senyawa kompleks ialah percobaan daya hantar listrik dalam larutan.
Daya hantar listrik berbanding. den lurus dengan jumlah ion dalam larutan. Dengan membandingkan daya hantar listrik seperti dalam table III,dapat ditentukan jumlah ion yang ada dalam senyawa kompleks.
Bila hasil-hasil dalam table III di atas digambarkan dalam grafik,diperoleh gambar seperti pada gambar I
CoCl3.4 NH3 ada dua jenis, hijau dan violet,keduanya mempunyai sifat fisika dan kimia yang
berbeda. PtCl2. 2 NH3 juga ada dua jenis,yaitu bentuk ά dan β yang keduanya berbeda kelarutan
dan jenis sifat kimianya.
Teori-teori tentang senyawa kompleks harus dapat menerangkan kenyataan-kenyataan di atas. Sebeum adanya teori-teori modern tentang senyawa kompleks telah ada beberapa teori. Dari teori-teori ini teori Werner telah dapat bertahan selama beberapa puluh tahun.
Teori rantai Blomstrand – Jorgensen
Dalam tahun 1850 – 1870 timbul persoalan tentang struktur dari senyawa-senyawa kompleks. Pada saat itu ahli-ahli kimia organic mendapatkan bahwa atom karbon selalu mempunyai valensi empat dan senyawa-senyawa organik mempunyai struktur rantai.
CH3(CH2)3 Cl strukturnya CH3 – CH2 – CH2 – CH2 – Cl
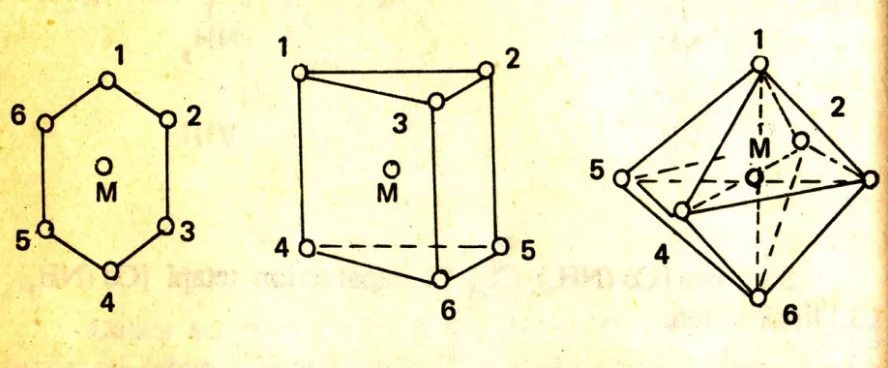
Atas dasar hal ini Blomstrand (Swedia, 1869 mengajukan teori rantai untuk struktur kompleks logam. Karena tiap-tiap unsur mempunyai valensi yang tetap, maka Blomstrand dan Jorgensen mengatakan bahwa dalam kompleks kobal (III) hanya ada tiga ikatan. Dengan ini maka dapat digambarkan struktur dari kompleks-kompleks :
CoCl3 .6NH3; CoCl3.4NH3, dan CoCl3.3NH3 sebagai struktur I, II, III dan IV.
berhasil membuat senyawa IV. Namun demikian dia dapat membuat senyawa IrCl3.3NH3 yang tidak menghantar aliran listrik dan tidak memberikan endapan dengan larutan perak nitrat.
Teori koordinasi Werner
Alfred Werner yang kemudian menjadi Professor Kimia di Zurich dan mendapat hadiah Nobel pada tahun 1913, telah bekerja lebih kurang 30 tahun (1891 - 1920) untuk menyelidiki senyawa kompleks. Pada tahun 1891 – 1893 ia memberikan teori tentang senyawa-senyawa kompleks, yang sekarang terkenal sebagai teori koordinasi. Tiga postulat terpenting dari teorinya ialah :
a. Kebanyakan unsur mempunyai dua jenis valensi, yaitu :
(1) valensi primer (---), yang sekarang disebut elektrovalensi atau bilangan oksidasi.
(2) valensi sekunder (_____), yang sekarang disebut kovalensi atau bilangan koordinasi.
b. Tiap-tiap unsur berkehendak untuk menjenuhkan baik valensi primernya atau valensi sekundernya.
c. Valensi sekunder diarahkan pada kedudukan tertentu di dalam ruang.
Menurut Werner, seri pertama dari kobal (III) ammine CoCl3.6NH3 mempunyai struktur V dan rumusnya dituliskan sebagai : [Co(NH3)6]Cl3. Valensi primer atau bilangan oksidasi dari
kobal (III) adalah 3 dan ini dijenuhkan oleh tiga jenis ion Cl-. Valensi sekunder atau bilangan
koordinasi kobal (III) adalah 6. Bilangan koordinasi adalah jumlah atom atau molekul yang
terikat langsung pada atom logam.
Amoniak yang diikat dengan valensi sekunder disebut ligand. Jadi ligand adalah molekul
atau ion yang diikat secara langsung oleh logam, dikatakan ligand-ligand ini ada dalam daerah
Dalam senyawa CoCl3.6NH3, atau [Co(NH3)6] Cl3, yang berfungsi sebagai ligand adalah NH3 sedang Cl ada di luar daerah koordinasi. Dalam larutan zat ini terion menjadi empat ion dan tiga
ion Cl- yang ada mudah diendapkan dengan larutan perak nitrat (Arrhenius).
[Co (NH3)6] Cl3 [Co(NH3)6]3+ + 3Cl
-Dalam senyawa CoCl3.5NH3, jumlah amoniak hanya ada 5 buah, hingga satu atom klor mempunyai dua fungsi, yaitu ikut menjenuhkan valensi sekunder dan primer. Hal ini dalam struktur VI dinyatakan dengan dua garis ikatan - - - -. Atom klor ini ada dalam daerah --koordinasi, hingga rumusnya dituliskan sebagai [Co(NH3)5 Cl]Cl2. Ionisasi zat ini menghasilkan tiga ion:
[Co(NH3)5Cl]Cl2 [Co(NH3)5Cl]2+ + 2Cl
-Dua senyawa dalam seri di atas mempunyai rumus : [Co(NH3)4 Cl2] Cl dan [Co(NH3)3 Cl3] yang strukturnya digambarkan sebagai VII dan VIII.
Senyawa [Co(NH3)4 Cl2] Cl dapat terion, tetapi [Co (NH3)3 Cl3] tidak terion :
[Co (NH3)4 Cl2 ] Cl [Co (NH3)4 Cl2]+ + Cl
-[Co (NH3)3 Cl3 ] X
Setelah diketemukan senyawa-senyawa jenis [MIII (NH3)3 Cl3] yang ternyata tidak terion
dalam larutan, maka teori-teori tentang rummus di atas benar. Teori rantai untuk rumus [Co (NH3)3 Cl] yang dinyatakan sebagai rumus IV ternyata salah, sebab disini ada kemungkinan satu klor terion.