i
Skripsi
Untuk memenuhi sebagian persyaratan
mencapai derajat sarjana S-1
Andika Munandar
09630025
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SUNAN KALIJAGA
YOGYAKARTA
vii
Jadilah ilmuwan atau peneliti yang “sehat” lahir dan batin
(Utoro Yahya)
“Do the best”
(Arryanto Yateman)
“Ada tiga tipe pekerja yaitu Bekerja dengan cerdas, bekerja dengan keras dan
bekerja dengan malas”
viii
Bapak, Ibu, Alm. mamah, kakak laki-laki dan perempuan, serta
adik laki-laki dan perempuan
dengan doa dan dukungannya
Dan untuk almamater tercinta
Program Studi Kimia
Fakultas Sains Dan Teknologi
Universitas Islam Negeri Sunan Kalijaga Yogyakarta
ix
Puji dan syukur penulis panjatkan kepada Allah SWT karena dengan
rahmat-Nyalah penulis dapat menyelesaikan Tugas Akhir dengan judul “Adsorpsi Logam Pb dan Fe Dengan Zeolit Alam Teraktivasi Asam Sulfat” sebagai syarat menyelesaikan studi Strata-1 dengan baik. Shalawat dan salam selalu
tercurah kepada Nabi Agung Muhammad SAW, keluarga serta para sahabat yang
selalu menjadi suri tauladan bagi umatnya.
Dalam penulisan skripsi ini, penulis menyadari bahwa penyelesaian
penelitian dan penulisan Tugas Akhir ini tidak lepas dari bantuan dan dukungan
dari banyak pihak. Terima kasih penulis sampaikan kepada :
1. Bapak Albert, Alm mamah Naimah, ibu azwita, bang ihsan, kakak cici, aditya
dan andini dengan semua doa dan dukungan.
2. Bapak Wahyudi Wibowo yang telah memberikan bahan dan
masukan-masukan tentang penelitian.
3. Prof. Drs. H. Akh. Minhaji, MA. Ph.D., selaku Dekan Fakultas Sains dan
Teknologi Universitas Islam Negeri Sunan Kalijaga.
4. Bapak Khamidinal, M.Si dan Didik Krisdiyanto, M.Sc., selaku Dosen
Pembimbing skripsi yang telah memberikan kritik dan masukan yang tiada
lelah.
5. Ibu Esti Wahyu Widowati, M.Si, M.Biotech., selaku Kepala Program Studi
x
7. Pak wijaya, pak indra dan mba isni untuk masukan, dukungan dan nasihat
untuk menyelesaikan skripsi.
8. Siwi Hanjanattri yang selalu ada untuk menemani. Terima kasih atas
kebersamaannya.
9. Sahabat terbaik, teman-teman kimia 2009 yang memberi banyak masukan
dan semangat.
10. Anak kost dwima yang selalu bantu memberikan hiburan jangan lupa futsal
dan pes-nya.
11. Buat iradio jogja yang selalu menemanin ketika menulis dan membacakan
requestan lagu
Penulis menyadari bahwa Tugas akhir ini masih memiliki banyak
kekurangan dan masih jauh dari kesempurnaan. Oleh karena itu, penulis sangat
terbuka terhadap kritik dan saran yang membangun dari semua pihak. Semoga
Tugas Akhir ini bermanfaat bagi semua pihak yang membacanya.
Yogyakarta, 21 Maret 2014
xi
xii
C. Bahan... 22
D. Prosedur Penelitian... 22
1. Preparasi Zeolit Alam ... 22
2. Pembuatan larutan induk asam sulfat ... 23
3. Pengaktifan Zeolit Alam Menggunakan Asam Sulfat ... 23
xiii
Gambar 4.2 Spektra FTIR zeolit alam dan zeolit alam teraktivasi asam ... 30
xiv
Tabel 4.2 Interpretasi FTIR zeolit alam dan zeolit alam teraktivasi ... 31
Tabel 4.3 Interpretasi SAA terhadap zeolit alam dan zeolit teraktivasi asam ... 33
Table 4.4 Distribusi pori zeolit alam dan zeolit alam teraktivasi asam ... 34
Tabel 4.5 Isoterm adsorpsi logam Pb dari zeolit alam dan zeolit teraktivasi ... 35
Tabel 4.6 Isoterm adsorpsi logam Fe dari zeolit alam dan zeolit teraktivasi ... 36
Tabel 4.7 Adsorpsi multikomponen logam Pb dan Fe dengan zeolit alam ... 37
Tabel 4.8 Adsorpsi multikomponen logam Pb dan Fe dengan zeolit teraktivasi .. 38
Tabel 4.9 Kinetika adsorpsi logam Pb ... 39
xv
Lampiran 3 : Isoterm adsorpsi logam Fe... 55
Lampiran 4 : Waktu kontak logam Pb dan Fe dengan zeolit alam dan zeolit
teraktivasi ... 60
Lampiran 5 : Kinetika adsorpsi logam logam Pb dengan zeolit alam... 61
Lampiran 6 : Kinetika adsorpsi logam Fe dengan zeolit alam ... 64
Lampiran 7 : Kinetika adsorpsi logam Pb dengan zeolit alam teraktivasi asam ... 66
xvi Andika Munandar
09630014
======================================================
Logam Pb dan Fe merupakan limbah yang dapat mencemari lingkungan, kedua logam tersebut banyak terdapat pada limbah accu sehingga untuk menghilangkan kedua logam dapat menggunakan adsorpsi dengan materi adsorben yang berpori seperti zeolit. Penelitian ini bertujuan untuk mengetahui karakter, kapasitas adsorpsi, dan kinetika adsorpsi dari zeolit alam dan zeolit teraktivasi asam sebagai adsorben yang mengadsorp kedua logam.
Zeolit alam diayak untuk mendapatkan ukuran yang sama. Zeolit alam yang telah diayak diaktivasi menggunakan asam sulfat. Zeolit alam dan zeolit teraktivasi asam kemudian dikarakterisasi dengan XRD, FTIR dan SAA. Zeolit kemudian digunakan sebagai adsorben untuk menjerap logam Pb dan Fe dengan variasi konsterasi satu logam, konsterasi dua logam bersama dan waktu pengadukan. Larutan sampel yang telah diadsorp kemudian dianalisis konsentrasi akhir dengan AAS.
Zeolit teraktivasi asam merupakan jenis modernit. Proses aktivasi menyebabkan terjadinya dealuminasi terlihat dari bertambahnya Si/Al pada zeolit teraktivasi asam dan menyebabkan bertambahnya luas permukaan zeolit. Tipe isoterm yang digunakan isoterm langmuir untuk masing masing logam Pb dan Fe, untuk isoterm kedua logam menggunakan kompetisi isoterm langmuir yang menghasilkan persamaan di bawah ini untuk masing-masing adsorben, sedangkan kinetika adsorpsi masing masing logam Pb dan Fe yang diadosrpsi zeolit alam dan zeolit alam teraktivasi asam menunjukkan pseudo orde dua yang menguatkan isoterm langmuir.
Kata kunci : zeolit, accu zuur, logam Pb, logam Fe, adsorpsi, dealuminasi,
BAB I
PENDAHULUAN
A. Latar Belakang
Pencemaran lingkungan oleh industri yang berupa limbah baik berupa zat
organik ataupun logam berat menjadi suatu permasalahan yang sangat penting
yang mana diperlukan penanganan yang tepat serta ramah lingkungan baik limbah
tersebut akan digunakan kembali untuk produksi ataupun yang akan dibuang ke
lingkungan karena sudah tidak dapat digunakan kembali, limbah – limbah yang
masuk dalam kategori logam berat digunakan oleh beberapa industri baik berupa
industri rumah tangga ataupun industri besar. Limbah logam berat sangat
berbahaya yang mana dapat mengubah keadaan air secara perlahan- lahan
disebabkan logam berat dapat menjadi suatu zat padat yang dapat tersuspensi
dalam air, selain itu limbah logam berat bersifat terakumulatif sehingga akan
selalu bertambah dan dapat mengurangnya kadar air bersih yang dapat dikonsumsi
oleh makhluk hidup. Apabila air tersebut tetap digunakan untuk keperluan
sehari-hari seperti diminum ataupun untuk kegunaan yang lain maka kadar logam berat
yang mencemari lingkungan akan terakumulasi dalam tubuh makhluk hidup
ataupun merusak eksosistem pada lingkungan sehingga dapat menyebabkan
penyakit ketika telah melebihi ambang batas kadar ditentukan (Islam, 2007).
Limbah logam berat seperti kadmium(Cd), timbal(Pb), besi(Fe), perak
(Ag), seng/zink(Zn), kromiun(Cr), tembaga(Cu), raksa(Hg), kobalt(Co), dan
sesium(Se). Potensi yang disebabkan oleh logam berat ini bermacam-macam jenis
diterima oleh tubuh makhluk hidup, yaitu ; timbal (Pb) dapat menyebabkan
gangguan ginjal dan keguguran pada ibu hamil serta timbal memiliki sifat
karsinogenik, dan besi (Fe) dapat memberikan bekas karat pada pakaian yang
dicuci dengan air yang memiliki kadar besi yang tinggi serta bahaya lain yang
disebabkan oleh lingkungan tercemar dari logam berat yang tidak dikelola dengan
baik sehingga melebihi ambang batas yang ditentukan oleh pemerintah (Rukaesih,
2004).
Penanganan logam berat dapat menggunakan beberapa proses yang
didapatkan melalui tiga cara yaitu fisika, biologi, atau kimia yang mana
penanganan logam berat ini bisa menggunakan satu cara, dua cara, ataupun tiga
cara pada waktu yang berdekatan. Namun demikian perlu diketahui teknik yang
terdapat dari tiga cara ini supaya dapat menggunakan cara yang tepat serta
mendapatkan hasil yang maksimal sehingga dapat mengurangi pencemaran serta
dapat mengurangi biaya atau menambahkan pemasukan dalam untuk penanganan
limbah yang berupa logam berat. Beberapa proses yang digolongkan oleh tiga
cara tersebut ialah dimulai dari biologi yang menggunakan makhluk hidup seperti
bakteri atau tumbuhan yang dapat menyerap logam berat ataupun mengubah
logam berat tersebut menjadi tidak berbahaya, secara fisika bisa berupa filtrasi
dan adsorpsi, dan cara yang terakhir ialah kimia dimana cara kimia ada beberapa
macam metode , yaitu : netralisasi asam basa, koagulasi dan flokuasi, pertukaran
ion, elektrodialisis, disinfektan, khlorinasi, ozonisasi, khlorin oksida, pemindahan
ammonia, dan adsorpsi. Oleh karena terdapat persamaan pada kimia dan fisika
adsorpsi yaitu pada permukaan adsorben (fisisorpsi) atau gugus aktif (kemisorpsi)
dari adsorben agar dapat menyerap adsorbat pada limbah cair (Suharto, 2011).
Metode adsorpsi memiliki beberapa keuntungan dibandingkan metode
lainnya yang telah disebutkan diatas, yaitu dapat menyerap logam berat pada
limbah cair atupun perairan, memiliki sifat selektif yang tinggi sehingga akan
terjadi kompetisi pada penyerapan logam berat oleh adsorben, adsorben yang
digunakan dapat berupa adsorben alam ataupun adsorben sintesis. Adsorben alam
bisa berupa zeolit, bentonit, kitosan dan ada beberapa yang lain dengan terdapat
suatu luas permukaan dan terdapat pori – pori yang berguna sebagai penahan
molekul yang sesuai dengan ukuran permukaan pada senyawa tersebut ataupun
terdapat gugus aktif yang berguna sebagai penyerap dan penahan molekul dengan
cara mengikat melalui gugus aktif tersebut, sedangkan adsorben sintesis bisa
berasal dari bahan alami yang di sintesis dengan bahan kimia lainnya atau berasal
dari campuran antara bahan kimia satu dengan bahan kimia yang lain.
Adsorben yang bisa berasal dari alam dan sintesis salah satu berupa zeolit,
yang mana zeolit ini merupakan hasil dari batuan alami yang zeolit memiliki
gugus aktif berupa silika alumina (SiO2.Al2O3) dan memiliki luas permukaan
tertentu sehingga dapat mengadsorp baik melalui gugus aktif ataupun luas
permukaan yang telah di aktivasi ataupun di aktivasi dan dimodifikasi dengan
senyawa lain untuk meningkatkan kemampuan adsorpsi yang di miliki zeolit.
Aktivasi yang dilakukan untuk zeolit melalui dua cara yaitu aktivasi secara fisika
ataupun kimia yang mana aktivasi fisika berupa hidrotermal dan ayakan yang
diaktivasi asam ataupun basa sedangkan untuk modifikasi dapat berupa
penambahan senyawa lain bisa bersifat senyawa organik ataupun anorganik,
aktivasi zeolit dengan asam atau basa memiliki tujuan tertentu berupa jika
diaktivasi asam maka akan terjadi dealuminasi dan dekatonisasi yang mana hal ini
akan menghilangkan ataupun mengurangi gugus alumina serta senyawa anorganik
yang menutup pori pada zeolit sehingga menghasilkan luas permukaan yang besar
dan jumlah pori yang lebih banyak sehingga dapat melakukan adsorpsi lebih
besar, sedangkan untuk aktivasi menggunakan basa digunakan untuk menambah
jumlah kation tertentu pada zeolit alam yang sebelumnya sudah terdapat kation
ataupun memang ditambahkan untuk meningkatkan kemampuan adsorpsi sebagai
pemanfaatan yang lain ( Jing, 2007).
Oleh karena zeolit dapat melakukan adsorpsi pada logam berat dengan
cara diaktivasi dengan asam bertujuan mengurangi ataupun menghilangkan
kation, anion, dan senyawa organik yang terdapat pada zeolit, sedangkan logam
berat yang dijadikan sebagai limbah yaitu timbal dan besi hal ini disebabkan
perusahaan listrik untuk kendaraan bermesin memiliki sumber listrik seperti aki
(accumulator) yang mana terdapat limbah padat dan limbah cair yang menjadikan
masalah bagi lingkungan ataupun yang disebabkan terdapat padatan tersuspensi
pada limbah cair yang mana menjadi awal permasalahan ketika limbah tersebut di
buang ke lingkungan dan digunakan kembali. Sehingga dilakukanlah penelitian
tentang “studi pengaruh Fe dan Pb terhadap kapasitas adsorpsi dengan aktivasi
B. Batasan Masalah
1. Zeolit yang digunakan berasal dari daerah klaten
2. Asam yang digunakan berupa asam sulfat (H2SO4) dengan konsentrasi
0,5 M.
3. Karakterisasi yang digunakan difraksi sinar-x (XRD) untuk menguji
kristalinitas, gugus fungsi zeolit dengan Fourier transformation infra
red (FTIR), dan luas permukaan serta porositas menggunakan surface
area analyzer (SAA)
4. Logam yang digunakan berupa logam Fe dan Pb.
5. Variasi hanya di waktu kesetimbagan dan konsentrasi.
6. Isoterm yang digunakan isoterm Langmuir dan isoterm Freundlich
C. Rumusan Masalah
1. Bagaimana karakter dari zeolit alam sebelum dan sesudah diaktivasi
asam ?
2. Bagaimana pengaruh logam lain terhadap kapasitas adsorpsi pada
zeolit alam ?
3. Bagaimana persamaan isoterm adsorpsi yang dihasilkan dari dua
logam ?
D. Tujuan Penelitian
1. Mengetahui karakter dari zeolit alam sebelum dan sesudah diaktivasi
2. Mengetahui pengaruh logam lain terhadap kapasitas adsorpsi pada
zeolit alam.
3. Mengetahui persamaan isoterm adsorpsi yang dihasilkan dari dua
logam.
E. Manfaat Penelitian
1. Mengetahui zeolit alam yang terdapat di Indonesia khusus jawa tengah
2. Menjadi rujukan dalam penanganan terhadap logam Fe dan Pb
3. Memberikan pengetahuan tentang kapasitas adsorpsi zeolit alam untuk
limbah yang multikomponen khusus limbah Fe dan Pb dengan
BAB II
TINJAUAN PUSTAKA DAN LANDASAN TEORI A. Tinjauan Pustaka
Amun (2004) Kesetimbangan Adsorpsi Optiomal Campuran Biner Cd (II)
dan Cr (III) dengan Zeolit Alam Terimpregnasi 2-merkaptobenzotiazol, jurnal ini
menunjukkan bahwa zeolit alam dapat dimodifikasi dengan senyawa lain yang
sebelum modifikasi dilakukan dealuminasi menggunakan asam mineral yaitu
asam sulfat, sehingga menjadikan asam sulfat sebagai aktivan yang digunakan
pada penelitian dikarenakan membuat perbandingan Si lebih besar terhadap Al.
Dyah (2009) Adsorpsi Multi Logam Ag(I), Pb(II), Cr(III), Cu(II) dan
NI(II) pada Hibrida Etilendiamino-Silika dari Abu Sekam Padi, menunjukkan
silika yang dihasilkan dari abu sekam padi sangat tinggi sehingga apabila zeolit
teraktivasi oleh asam dan menghasilkan perbandingan antara harga Si lebih besar
dibandingkan Al yang diakibatkan Al2O3 ikut larut ketika diaktivasi asam. Selain
dari kadar Si yang cukup besar jurnal ini menunjukkan bahwa adsorpsi walaupun
memiliki selektivitas yang tinggi tetapi dapat mengadsorb beberapa komponen
yang berbeda dari logam yang menjadi pencemar dari lingkungan.
Noor (2010) Adsorpsi Fe dan Mn dalam limbah cair dengan zeolit alam,
menunjukkan potensi zeolit alam yang terdapat di Indonesia yang jumlah masih
banyak terdapat di alam, memiliki umur yang panjang untuk zeolit, dan memiliki
selektivitas yang tinggi dalam mengadsorb logam – logam berat tanpa
dimodifikasi. Karena faktor selektivitas yang tinggi maka penelitian tentang
Fe dan Mn dengan bilangan oksidasi yang sama dan adsorpsi melalui tahapan satu
komponen dilanjutkan dengan tahapan multikomponen dengan metode Batch.
Atik (2012) Studi Adsorpsi Logam Pb (II) dan Cd(II) Pada Asam Humat
Dalam Medium Air, menunjukkan tentang dua variasi teori adsorpsi yaitu tentang
kinetika adsorpsi yang menggunakan variasi waktu kontak dan isoterm adsorpsi
menggunakan variasi konsentrasi logam terhadap asam humat yang menunjukkan
isoterm Langmuir yang digunakan pada penelitian.
Penelitian diatas menjadi acuan untuk penelitian yang akan dilakukan
yaitu adsorpsi logam Pb dan Fe dengan bilangan oksidasi yang sama melalui cara
multikomponen menggunakan zeolit alam dan zeolit alam yang diaktivasi dengan
asam sulfat.
B. Dasar Teori 1. Zeolit
Zeolit merupakan suatu mineral yang ditemukan oleh Freherr Alex
Cronsted yang berasal dari Swedia yang merupakan seorang mineralogi, zeolit
pertama kali ditemukan pada tahun 1755 dalam bentuk berupa padatan kristal
mikroporus yang berarti kristal berpori. Zeolit berasal dari bahasa Yunani zhein
yang berarti mendidih dan lithos yang berarti batuan, dikarenakan oleh temuan
Cronsted berupa uap yang dihasilkan dari batuan tersebut ketika dipanaskan.
Zeolit yang berpori ini memiliki struktur dasar berupa silika alumina dan
berbentuk tetrahedral (TO4) yang merupakan unit bangun primer yang dijembatani
merupakan dari kation, harga x bisa 2 atau lebih, n valensi kation, a dan b valensi
dari alumina dan silika serta c valensi dari air (Wang, 2007).
Zeolit memiliki lebih dari 150 tipe dengan berbagai macam jenis kation
penyusun struktur zeolit dengan cara saling mengikat dengan silika alumina, jenis
zeolit ditentukan dari rasio Si/Al dengan rasio yang rendah memiliki
perbandingan Si/Al 1-1,5, rasio yang sedang memiliki perbandingan Si/Al 2-5,
dan rasio yang tingi memiliki perbandingan Si/Al 10-100 atau lebih. Zeolit yang
berasal dari alam memiliki banyak kation, zeolit alam yang merupakan batuan
alami memiliki pengotor berupa senyawa organik atau senyawa anorganik yang
membuat kemampuan adsorpsi lemah dan zeolit alam memiliki alumina dengan
struktur okathedral yang merupakan sifat quarsa sehingga zeolit alam perlu
dihilangkan pengotornya (Ulfah, 2006).
Zeolit alam yang banyak pengotor dapat dihilangkan dengan dua cara
yaitu secara fisik dan kimia, secara fisik zeolit alam akan dipanaskan dengan suhu
tinggi yang berguna untuk menghilangkan atau mengurangi kadar senyawa
organik atau anorganik yang dapat menguap ketika dipanaskan dan secara kimia
zeolit alam bisa dengan diasamkan atau dibasakan untuk menghilangkan senyawa
organik dan senyawa anorganik yang menyebabkan peningkatan kritaslinitas dan
luas permukaan (Ulfah, 2006).
Zeolit memiliki beberapa sifat yang berasal dari struktur zeolit yang
tetrahedral (TO4) serta berpori, sifat yang terdapat pada zeolit ialah
menghilangkan air (dehidrasi), katalisator, menyerap senyawa kimia (adsorben),
melakukan pertukaran kation yang menjadikan zeolit sebagai adsorben yang baik
untuk melakukan adsorpsi (Ulfah, 2006).
2. Dealuminasi atau dekationisasi
Dealuminasi merupakan penghilangan atau pengurangan gugus alumina
yang asimetris dengan struktur oktahedral sehingga kandungan aluminium pada
zeolit menjadi optimal yang mengakibatkan zeolit mampu stabil pada suhu tinggi,
selain penghilang gugus alumina dealuminasi dapat menjadi pengontrol aktivitas
keasaman serta selektifitas pada zeolit yang diperlihatkan dari reaksi dealuminasi
pada zeolit yaitu
SiO2- + H2O SiOH + OH- (1)
(Trisunaryanti, 1996). Dekationisasi ialah penghilangan ataupun pengurangan
senyawa – senyawa yang memiliki sifat kation berupa logam yang terdapat pada
zeolit alam.
3. Adsorpsi
Adsorpsi merupakan suatu metode penanganan limbah khususnya limbah
dengan ukuran partikel tertentu ataupun memiliki gugus aktif yang dapat
ditangkap secara kimia, oleh karena itu terdapat dua macam teknik adsorpsi yaitu
berupa fisisorpsi dan kemisorpsi yang mana pada fisisorpsi menggunakan ukuran
partikel yang tidak dapat lewat pada suatu permukaan adsorben (gaya ) sedangkan
kemisorpsi merupakan penyerapan suatu senyawa yang berupa kation ataupun
anion dengan gugus aktif sebagai penyerapan ( Atkins, 1990).
Metode adsorpsi memiliki suatu kapasitas yang merupakan kemampuan
diperlihatkan dari perubahan konsentrasi, massa dari adsorben ataupun yang lain
sehingga menyebabkan pengaruh terhadap kation ataupun anion yang terdapat
dalam limbah tersebut, hal ini dikarenakan setiap kation ataupun anion yang
diserap oleh adsorben akan terjadi kompetisi yang terlebih dahulu diadsorp
(Atkins, 1990).
4. Adsorpsi Isoterm
Adsorpsi isoterm merupakan adsorpsi dengan keadaan suhu yang konstan.
Adsorpsi yang terjadi dalam keadaan kesetimbangan baik laju adsorpsi dan
desorpsi relatif sama
r adsoprsi = r desoprsi (2)
hal ini dikarenakan kesetimbangan adsorpsi digambarkan dengan persamaan
isoterm. Terdapat beberapa parameter untuk menunjukkan sifat permukaan dan
afinitas dari adsorben baik pada kondisi suhu dan pH tetap, hal ini yang menjadi
alasan dilakukan beberapa penelitian yang bertujuan untuk menyelidiki isoterm
dari adsorpsi ion logam berat dengan dihubungkan terhadap pH, jumlah adsorben,
konsentrasi sekutu, waktu kontak serta suhu. Terdapat beberapa jenis persamaan
isoterm adsorpsi yang sering digunakan secara luas, yaitu :
a. Isoterm Langmuir
Isoterm Langmuir merupakan isoterm yang paling sederhana dengan
asumsi bahwa setiap pori bersifat ekuivalen sehingga partikel terikat di tempat
tersebut. Namun hal tersebut tidak bergantung pada partikel yang menempati
tempat yang saling berdekatan. Selain asumsi diatas ada asumsi yang lain berupa
pada lapisan tunggal (monolayer), panas adsorpsi tidak tergantung pada
penutupan permukaan, semua bagian dan permukaann bersifat homogen, dan
jumlah tertentu gugus aktif adsorben yang membentuk ikatan kovalen atau ion.
Isoterm Langmuir memiliki persamaan yang digunakan sebagai dasar
mengetahui keadaan setimbang dari proses adsorpsi dan desorpsi yang dihasilkan
pada sistem cair-padat (Do. Duong D, 1998). Yaitu :
r adsorpsi = r desorpsi (3)
Qe =
(4)
Persamaan diatas dapat digunakan untuk kurva garis linear yang
menghubungkan antara Ce/Qe dengan Ce, maka
(5)
Keterangan :
Qe : jumlah adsorbat terserap/berat adsorbat pada
kesetimbangan (mg/g)
Qm : kapasistas penyerap maksimum pada permukaan/berat
padatan (mg/g)
K : konstanta kesetimbangan (L/mg)
Ce : konsentrasi pada kesetimbangan (mg/L)
Jika diasumsikan dalam persamaan garis linear sehingga Ce/Qe itu sebagai sumbu
Y dan Ce sebagai sumbu X, maka persamaan diatas dapat dituliskan dengan
(Sutarti, 1994).
Jika percobaan dilakukan dengan variasi konsentrasi Pb dan Fe terhadap
waktu kontak dan konsentrasi awal, maka akan diperoleh Ce, Qm, dan Qe
sehingga didapatkan harga kesetimbangan dengan hubungan antara Qe dan Ce
pada berbagai suhu, dan kesetimbangan untuk multikomponen dengan
menggunakan model kompetitif Langmuir seperti persamaan (Do.Duong D, 1998)
∑
(7)
Keterangan :
Qe : jumlah adsorbat terserap/berat adsorbat pada
kesetimbangan (mg/g)
Qm : kapasistas penyerap maksimum pada permukaan/berat
padatan (mg/g)
Ce : konsentrasi pada kesetimbangan (mg/L)
K : harga Sum of Squared Error minimum
i : logam awal
k : logam pembanding
SSE =∑ ( Qe,hitung– Qe,data)2 (8)
persentase kesalahan relatif rata – rata untuk N berdasarkan persamaan di bawah
ini dengan menggunakan i sebagai komponen
∑ – (9) Selain menggunakan model isoterm Langmuir yang multi komponen perlu
diketahui harga α yaitu tingkat daya pemisah yang dapat dihitung dari persamaan
α=
Isoterm Freundlich merupakan isoterm yang memiliki asumsi yang
berbeda dengan isoterm Langmuir dan asumsi isoterm Freundlich ialah terbentuk
beberapa lapisan (multilayer) dari molekul - molekul adsorbat pada permukaan
adsorben, bagian gugus aktif pada permukaan adsorben bersifat heterogen, dan
hanya melibatkan gaya sehingga adsorbat dapat bergerak dari satu bagian
permukaan ke bagian permukaan lain dari adsorbe (Atkins, 1990). Isoterm
Freundlich terdapat persamaan empiris untuk menentukan kesetimbangan
adsorbat ketika terjadinya proses adsorpsi, yaitu :
Qe = KfCe1/n (11)
Kf dan n merupakan suatu konstanta maka harga konstanta dari Kf dan n
didapatkan dari persamaan logaritmik yang sesuai dengan persamaan (Kundari,
2008).
Log Qe = log Kf + Log Ce (12)
5. Kinetika adsorpsi
Kinetika adsorpsi merupakan bagian dari adsorpsi yang membahas tentang
laju adsorpsi dari suatu adsorben terhadap adsorbat sehingga kinetika adsorpsi
memiliki beberapa persamaan untuk menentukan konstanta laju dari adsorpsi dari
adsorben (Fatimah, 2013), beberapa persamaan kinetika adsorpsi seperti
digunakan untuk adsorpsi logam ialah pseudo yang memiliki dua jenis pseudo
yaitu pseudo orde satu dan pseudo orde dua yang mana persamaan pseudo orde
satu mengikuti persamaan Lagergren yaitu
(13)
persamaan di atas diintegrasikan maka akan menjadi persamaan di bawah ini
∫ (14) hasil integral dari persamaan di atas menghasilkan persamaan di bawah ini
ln (Qe-Qt) = ln Qe – k t (15)
persamaan di atas ketika dijadikan persamaan linear maka ln (Qe-Qt) versus t
sehingga akan didapatkan nilai k dan Qe dari persamaan linear ( Lagergren,
1989). Selain pseudo orde satu masih ada orde dua yang mengikuti persamaan Ho
yang ada di bawah ini
(16)
persamaan di atas diintegrasikan maka menjadi persamaan di bawah ini
∫ (17) Hasil integral dari persamaan di atas menghasilkan persamaan di bawah ini
(18)
persamaan di atas ketika dijadikan persamaan linear maka
versus t sehingga
akan didapatkan nilai k dan Qe dari persamaan linear ( Ho, 2000).
6. Pengaruh kation atau anion
Pengaruh kation atau anion saat terjadi adsorpsi sangat penting disebabkan
dikarenakan kation atau anion memiliki bilangan oskidasi yang berbeda dan
pengaruh kapasitas pertukaran kation yang terdapat zeolit (Nurimaniwathy, 2004).
Oleh karena keadaan limbah yang tidak hanya terdiri satu kation atau anion
melainkan terdapat beberapa macam kation ataupun anion lain yang akan terjadi
kompetisi dalam penyerapan oleh adsorben (Raya, 1998).
7. Logam Pb
Timbal mempunyai berat atom 207,21 mol/gram, berat jenis 11,34 gram/L,
bersifat lunak serta berwarna biru atau silver abu - abu dengan kilau logam, nomor
atom 82 mempunyai titik leleh 327,4ºC dan titik didih 1.620ºC (Fardiaz, 1995).
Timbal termasuk logam berat ”trace metals” karena mempunyai berat jenis lebih
dari lima kali berat jenis air (Darmono, 2001). Senyawa Pb yang masuk ke dalam
tubuh melalui makanan dan akan mengendap pada jaringan tubuh, dan yang lain
akan terbuang bersama bahan sisa metabolisme.
Timbal adalah unsur yang ditemukan di dalam batu - batuan, tanah,
tumbuhan dan hewan. Timbal 95% bersifat anorganik dan umumnya dalam
bentuk garam anorganik yang kurang larut dalam air. Selebihnya berbentuk
timbal organik. Timbal organik ditemukan dalam bentuk senyawa Tetra Ethyl
Lead (TEL) dan Tetra Methyl Lead (TML), jenis senyawa ini hampir tidak larut
dalam air, namun dapat dengan mudah larut dalam pelarut organik misal dalam
lipid. Waktu keberadaan timbal dipengaruhi oleh beberapa faktor seperti arus
angin dan curah hujan. Timbal tidak mengalami penguapan namun dapat
ditemukan di udara sebagai partikel. Karena timbal merupakan unsur yang tidak
Timbal banyak dimanfaatkan oleh kehidupan manusia seperti sebagai
bahan pembuat baterai, amunisi, produk logam (logam lembaran, solder, dan
pipa), perlengkapan medis (penangkal radiasi dan alat bedah), cat, keramik,
peralatan kegiatan ilmiah/praktek (papan sirkuit / CB untuk komputer) untuk
campuran minyak bahan - bahan untuk meningkatkan nilai oktan.
Konsentrasi timbal di lingkungan tergantung pada tingkat aktivitas
manusia, misal di daerah industri, di jalan raya, dan tempat pembuangan sampah.
Karena timbal banyak ditemukan pada lingkungan maka timbal dapat memasuki
tubuh melalui udara, air minum, makanan dan tanah pertanian.
8. Logam Fe
Besi mempunyai berat atom sebesar 55,84 mol/gram dengan berat jenis
7,86 gram / L bersifat padatan yang keras berwarna abu-abu, dan memiliki nomor
atom sebesar 26 serta mempunyai titik leleh 1538 oC dan titik didih sebesar 1861
o
C (Fardiaz, 1995). Besi termasuk logam berat dan memiliki berat jenis lebih dari
berat jenis air (Darmono, 2001), sifat kimia senyawa Fe dalam perairan yang
terdapat di lingkungan akan menyebabkan bekas karat pada pakaian, porselin dan
alat – alat rumah tangga serta akan menimbulkan rasa yang tidak enak pada air
minum dengan konsentrasi kurang lebih 0,31 mg/L dan akan memberikan warna
kuning pada air tanah jika terdapat jumlah besi pada tanah sangat banyak. Selain
hal tersebut masih ada sifat redoks, pembentukan kompleks, metabolisme oleh
mikroorganisme (Rukaesih, 2004).
Besi memiliki dua bilangan oksidasi yaitu besi (II) dan besi (III) yang
dikarenakan mikroorganisme yang menghasilkan keadaan reduksi dalam air tanah.
Keadaan besi (II) ketika di tanah memiliki konsentrasi sekitar 1,0-10 mg/L namun
demikian konsentrasi besi (II) bisa sampai 50mg/L pada air tanah tertentu,
keadaan tidak terdapat oksigen atmosfer pada air tanah yang mengandung besi (II)
akan terlihat jernih namun setelah mengalami oksidasi oleh oksigen yang berasal
dari atmofser maka mengubah ion ferro menjadi ion ferri sehingga membuat air
menjadi keruh yang dapat lihat reaksi di bawah ini ( Achmad Rukaesih, 2004).
4 Fe2+ + O2 + H2O 4 Fe(OH)3 + 8 H+ (19)
Reaksi di atas merupakan pembentukkan besi (III) oksida terhidrat yang
tidak larut dalam air, selain disebabkan oleh oksidasi oksigen atmosfer yang
dapat membentuk ion ferri bisa terjadi karena pH rendah yang diakibatkan oleh
limbah tambang asam. Oleh karena keadaan pH yang rendah maka oksidasi ion
ferro menjadi ion ferri di katalis oleh bakteri besi yaitu Thiobacillus ferroxidants,
Thiobacillus thiooxidants, dan Thiobacillus ferrooxidants (Achmad Rukaesih,
2004).
9. Difraksi sinar-X
Difraksi sinar-X (XRD) dalam pengertian ilmu kimia ialah teknik analitik
yang sesuai untuk menguji Kristalit atau non kristalit, seperti keramik, logam,
material elektronik, materi geologi, organik, dan polimer. Dimana materi tersebut
bisa berupa serbuk. Kristal tunggal, film tipis dengan banyak lapisan (multilayer
thin film), lembaran, serat fiber, atau materi yang tidak beraturan (Settle, 1997).
Analisis difraksi sinar-x untuk zeolit ialah mengidentifikasikan zeolit
kristal, analisis difraksi sinar-x (XRD) didasarkan pada daya pantul cahaya yang
mengenai kristal sehingga menghasilkan dua cara yang berguna untuk mengetahui
kisi kristal dan jarak lapisan atom atau ion penyusun serta mengetahui sudut
kristal. Kedua cara tersebut ialah persamaan bragg untuk mengetahui jarak lapisan
atom atau ion penyusun serta mengetahui sudut kristal dan indeks miller untuk
mengetahui kisi kristal (Richardson, 1989).
Selain analisis kualitatif terdapat analisis kuantitatif pada difraksi sinar-x
(XRD) dengan cara membandingkan intensitas puncak difraksi antara satu jenis
zeolit dengan zeolit yang lain dengan intensitas dinyatakan sebagai I/I1 (Wong-ng
et.al, 2001: 1020).
10.Fourier Transmission Infra Red
Fourier Transmission Infra Red merupakan metode dari spekroskopi infra
merah dengan bilangan gelombang dari 4000 - 0 cm-1, spektorskopi infra merah
mendeteksi perubahan molekul-molekul diatomik yang berupa perubahan vibrasi
rotasi. Vibrasi rotasi infra merah tengah terdapat batas minimal yaitu pada
bilangan gelombang 1300 - 33 cm-1 (Sunardi, 2005).
Vibrasi rotasi infra merah untuk zeolit memiliki dua jenis vibrasi yaitu
vibrasi internal yang menunjukkan tetrahedral SiO4 dan AlO4 sebagai unit
pembangun primer dari kerangka zeolit dan vibrasi eksternal yang menunjukkan
ikatan-ikatan eksternal pada tetrahedral serta sensitif pada topologi zeolit
(Flanigen, 1971).
Bilangan gelombang dari infra merah menunjukkan rentangan tertentu
cm-1) yang menjadi acuan bila terjadi aktivasi dengan asam yang ditunjukkan
dengan bilangan gelombang yang lebih besar dari zeolit sebelum diaktivasi asam
(Breck, 1974:425).
11.Surface Area Analyzer
Surface Area Analyzer memiliki beberapa metode dengan salah satu
berupa Gases Surface Analyzer yang metode ini menggunakan gas untuk
menganalisis luas permukaan suatu material berpori dengan teknik adsorpsi
desorpsi dengan adsorbat berupa gas yang bersifat inert seperti nitrogen atau
helium dan adsorben berupa material berpori yaitu zeolit dikatakan sebagai
adsorpi fisika (fisisorpsi) yang hanya terjadi interaksi antara molekul adsorben
dengan adsorbat. Surface Area Analyzer akan didapatkan beberapa data-data yang
bisa diubah dalam berbagai hal mulai dari bentuk material berpori seperti
monolayer atau multilayer dan jenis material berpori seperti mikropori, mesopori,
dan makropori ( Yateman, 2009).
Data Gases Area Analyzer untuk menganalisis material berpori seperti
zeolit umumnya yaitu BET yang menghasilkan data berupa luas permukaan, rerata
pori, dan total pori yang berguna untuk mengetahui kemampuan adsorpsi dari
material berpori yang mendapatkan perlakuan sehingga mengalami penambahan
luas permukaan meningkatkan kemampuan adsorspis (Rina, 2012).
12.Atomic Adsorbtion Spectorscopy
Spektroskopi serapan atom ialah metode analisis yang didasarkan pada
penyerapan cahaya pada panjang gelombang tertentu oleh suatu detector yang
spektroskopi serapan atom menggunakan lampu katoda berongga yang memiliki
emisi cahaya yang akan menghasilkan panjang gelombang tertentu untuk setiap
unsur logam. Spektroskopi serapan atom dapat digunakan dua macam analisis
yaitu analisis kualitatif dan kuantitatif dengan cara berkas cahaya yang di absorbsi
dengan jumlah tertentu akan sebanding dengan atom-atom keadaan dasar
(Underwood, 1989), spektroskopi serapan atom sama dengan spektroskopi yang
lain yaitu diperlukan panjang gelombang maksimal tertentu untuk setiap atom
yang akan di analisis seperti Logam Pb memiliki panjang gelombang sebesar 217
nm dan logam Fe memiliki panjang gelombang sebesar 248 nm (khopkar, 1990).
C. Hipotesa
1. Zeolit alam yang diaktivasi asam akan mengalami peningkatan
kristalinitas zeolit dari karakterisasi difraksi sinar-x, dealuminasi
ditunjukkan oleh karakterisasi Fourier Transformation infra red, dan
penambahan luas permukaan ditunjukkan dengan Surface Area Analyzer.
2. Logam Pb dan Fe yang diadsorp oleh zeolit alam dan zeolit alam
teraktivasi asam akan mengalami keadaan setimbang yang mengikuti
isoterm Langmuir.
3. Waktu kontak antara logam Pb dan Fe dengan zeolit alam dan zeolit
BAB III
METODE PENELITIAN A.Waktu dan Tempat Penelitian
Penelitian dilakukan pada tanggal 11 April – 11 Juni 2013 bertempat pada
Laboratorium Penelitian dan Pengujian Terpadu Universitas Gajah Mada.
B.Alat
Peralatan yang digunakan dalam penelitian ini adalah hotplate, cawan
petri, magnetit stirer dan alat gelas lainnya. Untuk karakterisasi zeolit alam yang
akan digunakan maka dianalisis dengan X-Ray Diffraction (XRD), Fourier
Transformation InfraRed (FTIR), Surface Area Analyzer (SAA), dan kemampuan
adsorpsi logam oleh zeolit menggunakan Atomic Adsorption Spectroscopy (AAS).
C.Bahan
Bahan yang dibutuhkan untuk penelitian ini adalah zeolit alam Klaten
(dibeli dari toko progo mulyo). Serta bahan lainnya berupa asam sulfat (H2SO4)
p.a sebagai bahan untuk aktivasi zeolit, aquades, timbal dua nitrat (Pb(NO3)2), dan
besi dua sulfat (FeSO4.12H2O).
D.Prosedur Penelitian 1. Preparasi zeolit alam
Zeolit alam yang telah dihaluskan direndam dalam akuades sambil diaduk
dengan magnetit stirer selama 1 jam pada suhu kamar, kemudian disaring dan
dikeringkan dengan oven 120oC selama 24 jam sehingga tidak lengket pada
spatula ketika diambil dengan spatula. Zeolit alam yang telah kering dianalisis
2. Pembuatan larutan induk H2SO4 (0,5M)
Sebanyak 13,9 mL H2SO4 pekat dipipet dan diencerkan dengan akuades
dalam labu ukur 500 mL hingga tanda batas.
3. Pengaktifan kimia menggunakan asam sulfat (H2SO4)
Serbuk zeolit sebanyak 50 gram dimasukkan dalam gelas beker 500 mL
ditambahkan asam sulfat (H2SO4) dengan konsentrasi 0,5 M. Selanjutnya diaduk
menggunakan magnetik stirer selama 120 menit. Kemudian dicuci dengan
akuades dan dikeringkan dalam oven selama 24 jam kemudian didinginkan hingga
suhu kamar menggunakan desikator. Zeolit yang telah teraktivasi selanjutnya di
lakukan karakterisasi akhir menggunakan XRD, FTIR dan SAA.
4. Variasi Waktu Kontak
Larutan sampel yang berisi komponen tunggal dari Fe dan Pb dengan
konsentrasi 12 dan 10 ppm dibuat kemudian diambil 25 mL untuk dimasukan ke
dalam 8 buah tabung reaksi ukuran 50 mL dan dilakukan adsorpsi dengan zeolit 1
gram. Proses adsorpsi dilakukan dengan variasi waktu yaitu: 15 menit, 30 menit,
45 menit, 60 menit, dan 75 menit, 90 menit, 105 menit, 120 menit. Selanjutnya
dilakukan analisis dengan Atomic Adsorption Spectroscopy (AAS).
5. Variasi konsentrasi
Berdasarkan hasil waktu kontak untuk logam Pb sebesar 120 menit dan 60
menit untuk logam Fe maka dilakukan penelitian dengan variasi konsentrasi
limbah pada komponen Fe dan Pb dengan simulasi dari larutan induk yang
diencerkan sehingga konsetrasi 10 ppm, 30 ppm, 50 ppm, 70 ppm, dan 90 ppm,
dan dimasukan dalam tabung reaksi 50 mL kemudian dimasukkan 1 gram zeolit
pada masing – masing tabung reaksi kemudian tabung reaksi pada suhu kamar.
Setelah mencapai waktu kesetimbangan logam Pb selama 120 menit dan Fe
selama 60 menit, kemudian larutan diambil filtrat dan dianalisis dengan Atomic
Adsorption Spectroscopy (AAS).
6. Adsorpsi dua komponen
Adsorpsi dua komponen masing – masing larutan Fe dan Pb di ambil 25
mL dan dimasukan dalam ke dalam tabung reaksi 50 mL dan masing – masing
ditambahkan 1 gram zeolit lalu tabung reaksi diaduk menggunakan shaker pada
suhu ruangan. Setelah larutan diaduk menggunaka shaker diambil filtrat dan
BAB IV
HASIL DAN PEMBAHASAN A. Karakterisasi Zeolit
1. Karakterisasi Zeolit menggunakan Difraksi sinar-X (XRD)
Zeolit alam yang akan digunakan untuk mengadsorps dilakukan aktivasi
menggunakan asam sulfat dengan konsentrasi 0,5 M, yang bertujuan untuk
meningkatkan kemampuan adsorpsi sehingga bisa diasumsikan bahwa zeolit alam
yang diaktivasi akan memiliki luas permukaan yang lebih luas. Zeolit alam dan
zeolit alam teraktivasi dikarakterisasi oleh tiga macam alat karakterisasi seperti
difraksi sinar-X (XRD), Fourier Transformattion Infra Red (FTIR), Surface Area
Analyzer (SAA), dan untuk menganalisis kemampuan adsorpsi dari zeolit ialah
menggunakan Atomic Adsorption Spectroscopy (AAS). Karakterisasi pertama
menggunakan difraksi sinar-X (XRD) yang menunjukkan macam – macam kristal
dari zeolit yang berbeda – beda yang dihasilkan dari reaksi batuan alami zeolit
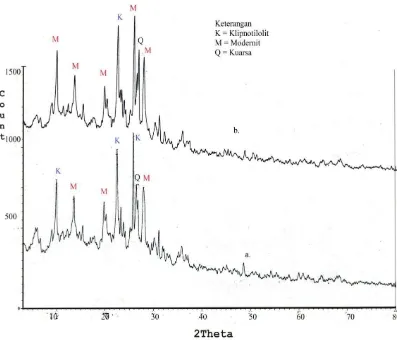
dapat dilihat pada Gambar 4.1 dan Tabel 4.1
Gambar 4.1 dan Tabel 4.1 memperlihatkan adsorben yang digunakan
merupakan zeolit ditunjukkan dengan dua jenis, yaitu klinoptilolit yang lebih
banyak pada zeolit alam sedangkan zeolit alam teraktivas asam lebih banyak
mordenit. jenis klinoptilolit yang merupakan zeolit alam memiliki struktur berupa
| Na1.84K1.76Mg0.2Ca1.24(H2O)21.36 | [ Si29,84Al6.16O72 ] dan mempunyai bentuk
kristal yang monoklinik dengan cincin 8 dan cincin 10 sehingga jenis klinoptilolit
Mordenit yang mendominasi zeolit setelah diaktivasi asam memiliki
struktur berupa | Na8(H2O)24 | [ Si40Al8O96 ] dan mempunyai bentuk kristal
ortorombik dengan cincin 8 dan cincin 12 yang mana jenis mordenit merupakan
jenis faujasit ( M.M.J. Treacy and J.B. Higgins, 2001), menurut Bobonich, F.M.
et, al dalam Suparno (2010) struktur kristal mordenit sangat kompleks terdiri dari
dua tipe saluran pori (pore channels ) dan sistem rongga (void systems) yang
berbeda.
Saluran A terbentuk dari gabungan 12-MR (Membered Rings) yang setiap
cincinnya mengandung 12 atom oksigen. Saluran B terdiri dari 8-MR yang setiap
cincinnya mengandung 8 atom oksigen. Saluran A berbentuk eliptikal dengan
diameter 0,65 – 0,70 nm sementara saluran B memiliki diameter 0,26 – 0,57 nm
Saluran A dan B terhubung secara tegak lurus dengan bentuk kristal ortorombik.
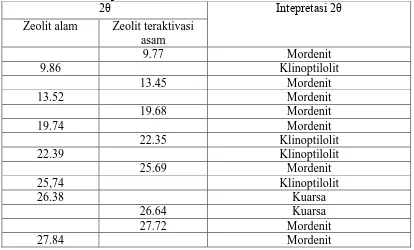
Tabel 4.1 interpretasi 2θ zeolit alam dan zeolit alam teraktivasi asam
Gambar 4.1 Spektra XRD zeolit alam (a) dan zeolit alam teraktivasi asam (b)
Penelitian Suseno (2010) menunjukkan puncak-puncak tertinggi yang
muncul pada difraktogram pada daerah 2θ = 22,17o
; 9,69o; dan 28,20o
menandakan jenis mineral zeolit yaitu klinoptilolit, untuk zeolit alam maupun
yang sudah diaktivasi asam ditemukan adanya puncak tinggi pada daerah 2θ =
25,58o; 27,65o; dan 13,39o yang merupakan ciri khas dari kelompok mordenit
yang berarti bahwa setelah dilakukan aktivasi kristalinitas zeolit alam tidak
Kesuma (2013) menambahkan bahwa mineral penyusun zeolit alam
kebanyakan adalah mordenit dan kuarsa. Hal ini dapat dilihat dari puncak
tertinggi zeolit yang berada pada 2θ = 22,3o
(d = 3,98Å), 2θ = 9,79o (d = 9,02Å),
2θ = 25,65o(d = 3,47Å), dan 2θ = 27,66o
(d = 3,22Å). Sedangkan mineral kuarsa
ditunjukkan pada 2θ = 26,26o (d = 3,39Å). Akan tetapi puncak-puncak spesifik
yang menunjukkan zeolit jenis klinoptilolit pada 2θ = 9,88o (d = 8,96Å) 2θ =
11,19o (d = 7,91Å) ; 2θ = 22,36o (d = 3,98 Å) dan 2θ = 22,50o (d = 3.95 Å)
(Fatimah dan Wijaya K, 2005).
Zeolit alam yang akan digunakan untuk adosrpsi dilakukan aktivasi
dengan cara diasamkan yang bertujuan untuk terjadi dealuminasi. Dealuminasi
menjadi langkah penting berhubungan dengan fungsi zeolit sebagai katalis.
Tujuan dealuminasi adalah untuk mengoptimalkan kandungan Si/Al dalam zeolit,
sehingga zeolit menjadi lebih stabil pada temperatur tinggi (Lestari, 2010).
Pengasaman ini akan menyebabkan terjadi pertukaran kation dengan H+.
Ion H+ yang berasal dari asam mempengaruhi elektron bebas pada atom O untuk
membentuk ikatan koordinasi. Dengan demikian pada Al-O akan kekurangan
elektron sehingga akan bersifat lebih polar dan tidak sekuat sebelumnya, sehingga
Al akan putus dari ikatannya.
Dalam penelitian Syafii dkk (2010), proses aktivasi, ion H+ yang
dihasilkan dari reaksi penguraian HCl dalam medium air akan mengurai ikatan
atom Al yang berada pada struktur zeolit. Ion H+ ini akan diserang oleh atom
oksigen yang terikat pada Si dan Al. Berdasarkan harga energi dissosiasi ikatan
(190 kkal/mol), maka ikatan Al-O jauh lebih mudah terurai dibandingkan Si-O.
Sehingga ion H+ akan cenderung menyebabkan terjadinya pemutusan ikatan Al-O
dan akan terbentuk gugus silanol. Sedangkan ion Cl- hasil penguraian ion HCl
juga akan mempengaruhi kekuatan ikatan Al-O dan Si-O. Ion Cl- memiliki
elektronegativitas yang tinggi (3,16) dan berukuran kecil (r = 0,97Ǻ), sehingga
menyebabkan ion ini mudah berikatan dengan kation bervalensi besar seperti Si4+
dan Al3+. Tetapi ion Cl- akan cenderung berikatan dengan atom Al dikarenakan
harga elektronegativitas atom Al lebih kecil (1,61) dibanding elektronegativitas
atom Si (1,90).
Penurunan kadar Al juga terjadi pada penelitian dari Las (2011) yang
dapat dilihat dari rasio Si/Al zeolit. Rasio Si/Al pada zeolit tanpa aktivasi adalah
5,89 sedangkan zeolit yang sudah diaktivasi adalah 6,52. Semakin kecil kadar Al
dalam zeolit maka semakin besar rasio Si/Al. Penurunan kadar Al pada zeolit
yang sudah diaktivasi dikarenakan penambahan H2SO4 yang menyebabkan zeolit
mengalami dealuminasi (lepasnya Al dari struktur zeolit). Zeolit yang diaktivasi
dengan H2SO4 akan membentuk H-zeolit.
Oleh karena zeolit alam dan zeolit alam teraktivasi asam yang telah
dikarakterisasi oleh difraksi sinar-x menunjukkan kemiripan dengan beberapa
penelitian sebelumnya maka karakterisasi dilanjutkan menggunakan Fourier
Transformattion Infra Red (FTIR) sehingga didapatkan perubahan gugus fungsi
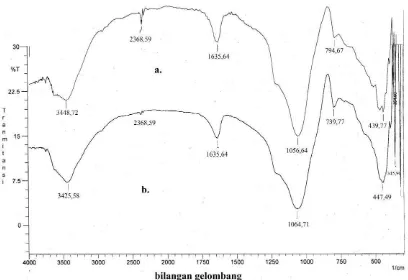
2. Karakterisasi Zeolit menggunakan Fourier Transformation Infra Red
(FTIR)
Fourier Transformation Infra Red (FTIR) yang merupakan salah satu
bentuk karakterisasi yang berguna untuk mengetahui gugus fungsi zeolit seperti
gugus SiO dan Al2O3, karena zeolit merupakan zat padat yang terdiri dari silika
alumina (SiO.Al2O3) serta Fourier Transformation Infra Red (FTIR) memperkuat
karakterisasi yang dimiliki oleh difraksi sinar-x (XRD), hasil dari Fourier
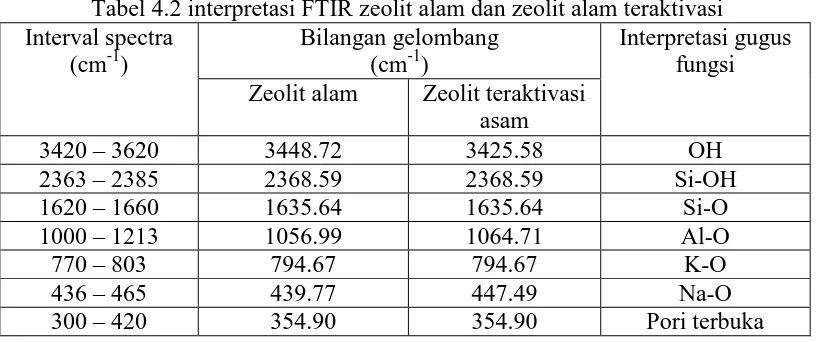
Transformation Infra Red (FTIR) dapat dilihat gambar dan Tabel di bawah ini
Tabel 4.2 interpretasi FTIR zeolit alam dan zeolit alam teraktivasi
adanya vibrasi Si-O, dan daerah 1045 cm-1 adanya vibrasi Al-O. Sedangkan pada
zeolit teraktivasi asam puncak-puncak terlihat jelas, yaitu pada 1046 cm-1 (gugus
Al-O) yang lebih melebar dibandingkan zeolit alam, bahu sekitar 1200 cm-1
(uluran asimetris), puncak 3626 cm-1 (gugus -OH) yang lebih sempit
dibandingkan zeolit alam, dan puncak pada 792 cm-1 semakin tajam dibandingkan
dengan puncak dari zeolit alam.
Gambar 4.2 dan Tabel 4.2 menunjukkan perubahan pada adsorben yang
merupakan zeolit sebelum teraktivasi asam dengan zeolit teraktivasi asam.
Gambar 4.2 memperlihatkan penurunan intensitas bilangan gelombang pada OH
dari 3448.72 cm-1 ke 3425.58 cm-1 yang mana hal ini menunjukkan pengaruh
asam sulfat yang mengurangi OH, selain pada bilangan gelombang OH terdapat
perubahan pada bilangan gelombang 1056.99 cm-1 menjadi 1064.71 cm-1
yang lebih besar ketika diaktivasi dengan asam sulfat. Hal ini menunjukkan
bahwa pada interpretasi Al-O telah terjadi dealuminasi yaitu pengurangan atau
penghilangan Al2O3 yang bersifat asimetris ( Yateman, 2009).
Hasil penelitian Sriatun (2005) menunjukkan bahwa terdapat pergeseran
frekuensi atau bilangan gelombang pada daerah rentangan asimetris O-Si-O dan
O-Al-O. Pergeseran tersebut terjadi dari 1045,3 cm-1 ke 1076,2 cm-1. Untuk
daerah vibrasi tekuk Si-O dan Al-O zeolit alam terletak di daerah 441,7 cm-1 dan
mengalami pergeseran karena diaktivasi dengan asam menjadi 443,6 cm-1. Hampir
semua pita pada zeolit hasil dealuminasi yang telah disebutkan di atas mengalami
pengurangan intensitas bila dibandingkan dengan pita zeolit sebelum
proses dealuminasi. Jadi dengan berkurangnya spesies alumina dari kerangka
zeolit menyebabkan pergeseran frekuensi dan pengurangan intensitas pita spektra
inframerah.Kenaikan intensitas puncak serapan Al-O pada zeolit aktivasi
mengindikasikan bahwa zeolit dengan H2SO4 memberikan efek pertukaran
kation-kation lain dengan H+ berhasil dilakukan.
3. Karakterisasi Zeolit menggunakan Surface Area Analyzer (SAA) Karakterisasi Surface Area Analyzer yang digunakan berupa porositas
yang dapat mengetahui luas permukaan, total pori, rerata pori, dan distribusi pori
yang dihasilkan dari zeolit alam dan zeolit alam teraktivasi asam yang dihasilkan
dari adsorpsi dan desorpsi terhadap gas nitrogen namun sebelum itu dilakukan
pembersihan dari pengotor pada pori-pori adsorben atau dibuat keadaaan nol
Tabel 4.3 yang menunjukkan hasil dari uji porositas sehingga diketahui luas
permukaan, total pori, rerata pori, dan distribusi pori yang di ambil dari multipoint
BET plot dan multipoint BJH dari zeolit tersebut ( Is Fatimah, 2012 ).
Gambar 4.3 menunjukkan pola adsorpsi tipe III yang dapat dilihat dari
ukuran pori zeolit yang menunjukkan zeolit alam termasuk dalam jenis mesopori
yang memiliki ukuran 20-500 Å dan zeolit teraktivasi asam memiliki jenis ukuran
mikropori < 20 Å dengan sifatnya monolayer (Utami, 2012). Dari hasil ukuran
pori tersebut terlihat bahwa ukuran pori semakin kecil karena distribusi pori
meningkat ketika dilakukan proses aktivasi dengan asam sulfat.
a b
Gambar 4.3 a dan b menunjukkan garis hyteris loop untuk zeolit alam dan zeolit
teraktivasi asam
Tabel 4.3 interpretasi SAA terhadap zeolit alam dan zeolit alam teraktivasi asam
Zeolit Total pori
(cc/gram)
Luas permukaan (m2/gram)
Rerata pori (Ǻ)
Alam 1.065x10-1 76.448 2.78725x101
Teraktivasi asam 1.522x10-1 180.459 1.68665x101
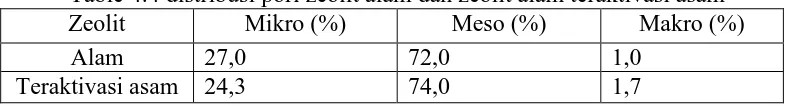
Table 4.4 distribusi pori zeolit alam dan zeolit alam teraktivasi asam
Zeolit Mikro (%) Meso (%) Makro (%)
Alam 27,0 72,0 1,0
Teraktivasi asam 24,3 74,0 1,7
Dari Tabel 4.3 zeolit alam memiliki luas permukaan dan total pori yang lebih
kecil dibandingkan luas permukaan dan total pori dari zeolit teraktivasi asam. Dari
rerata pori zeolit alam lebih besar dibandingkan zeolit sesudah diaktivasi hal ini
dikarenakan dari distribusi pori Tabel 4.4 yang menunjukkan jumlah mikropori
yang berkurang dan meningkatnya jumlah meso dan makropori dari zeolit. Hasl
ini menunjukkan bahwa aktivasi asam membuat luas permukaan dan total pori
menjadi lebih luas karena adanya pelarutan senyawa-senyawa pengotor yang
menutupi pori namun rerata pori mengalami penurunan disebabkan oleh
permukaan zeolit yang memiliki pori-pori yang kecil menjadi tertutup akibat dari
luas permukaan yang bertambah (Rosdiana, 2006).
Suyati (2005) menyatakan bahwa penambahan nikel sebesar 4,35% pada
zeolit aktif meningkatkan luas permukaan pori sekitar 42,32%, volume pori total
juga meningkat sebesar 41,29% namun jejari pori menurun sebesar 4,29%. Ini
berarti zeolit mengalami restrukturisasi khususnya pada saat proses kalsinasi
ataupun aktivasi. Sehingga zeolit alam mengalami peningkatan pada total pori dan
luas permukaan zeolit namun rerata pori dan distribusi pori mengalami
B. Isoterm Adsorpsi
1. Adsorpsi logam Pb
Logam Pb dengan zeolit non aktivasi dengan variasi konsentrasi awal
yang akan mendapatkan hasil adsorpsi dengan dilihat pada Tabel dan grafik
dibawah ini,
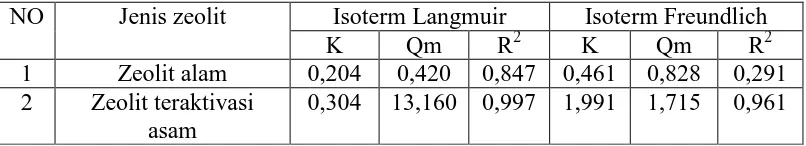
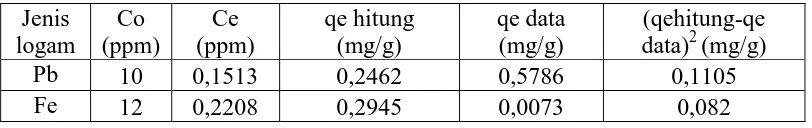
Tabel 4.5 Isoterm adsorpsi logam Pb dari zeolit alam dan zeolit alam teraktivasi asam
NO Jenis zeolit Isoterm Langmuir Isoterm Freundlich
K Qm R2 K Qm R2
alam memiliki nilai R2 lebih kecil dibandingkan zeolit alam teraktivasi asam pada
isoterm Langmuir dan isoterm Freundlich dikarenakan aktivasi asam dapat
mempertambah luas permukaan dan meningkatkan gugus aktif zeolit yang
mengakibatkan peningkatan kemampuan adsorpsi terhadap logam Pb yang sesuai
dengan hasil dari karakterisasi ( Rina, 2012 ).
Isoterm adsorpsi terhadap logam Pb dari zeolit alam dan zeolit alam
teraktivasi asam yaitu isoterm Langmuir diperlihatkan dari harga R2 yang lebih
mendekati satu dibandingkan dengan isoterm Freundlich, sehingga asumsi yang
digunakan asumsi isoterm Langmuir yang berupa monolayer, sifat permukaan
homogen, dan memiliki sisi aktif membentuk ikatan secara kimia sehingga
menghasilkan adsorpsi berupa kemisorpsi ( Do Duong, 1998 ).
Hasil asumsi isoterm adsorpsi menunjukkan kapasitas adsorpsi maksimal
dikarenakan zeolit alam teraktivasi memiliki gugus aktif yang lebih banyak
dibandingkan zeolit alam yang ditunjukkan dari perubahan kristalinitas zeolit dan
terjadi dealuminasi yang dialami zeolit alam teraktivasi asam ( Wahyuni, 2010 ).
2. Adsorpsi logam Fe
Setelah logam Pb yang diadsorpsi maka dilanjutkan logam Fe yang
diadsorp menggunakan zeolit alam dan zeolit alam teraktivasi asam dengan
variasi konsentrasi awal sehingga didapatkan beberapa hasil seperti kapasitas
adsorpsi maskimal, konstanta dan harga R2 yang dapat dilihat pada Tabel dibawah
ini.
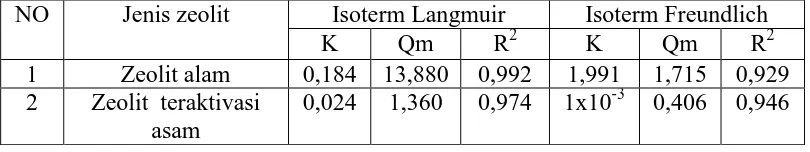
Tabel 4.6 Isoterm adsorpsi logam Fe dari zeolit alam dan zeolit alam teraktivasi asam
NO Jenis zeolit Isoterm Langmuir Isoterm Freundlich
K Qm R2 K Qm R2
1 Zeolit alam 0,184 13,880 0,992 1,991 1,715 0,929
2 Zeolit teraktivasi asam
0,024 1,360 0,974 1x10-3 0,406 0,946
Tabel 4.6 menunjukkan isoterm adsorpsi logam Fe dari zeolit alam berupa
isoterm Langmuir dikarenakan memiliki nilai R2 lebih besar dan mendekati satu
dibandingkan isoterm Freundlich, untuk zeolit alam teraktivasi asam isoterm
adsorpsi berupa isoterm Langmuir dikarenakan memiliki harga R2 lebih besar dan
mendekati satu dibandingkan isoterm Freundlich dikarenakan aktivasi asam dapat
mempertambah luas permukaan dan meningkatkan gugus aktif zeolit yang
mengakibatkan peningkatan kemampuan adsorpsi terhadap logam Pb yang sesuai
Karena isoterm adsorpsi yang terjadi merupakan isoterm langmuir maka
asumsi yang digunakan berupa isoterm Langmuir berupa monolayer, sifat
permukaan homogen, dan memiliki sisi aktif membentuk ikatan secara kimia
sehingga menghasilkan adsorpsi yang lebih spesifik ( Do Duong, 1998 ), terjadi
perbedaan kapasitas adsorpsi maksimal logam Fe yang diadsorp zeolit alam lebih
besar dibandingkan zeolit alam teraktivasi asam hal ini dikarenakan zeolit alam
teraktivasi asam masing terdapat logam Fe dan gugus aktif yang terdapat pada
zeolit alam teraktivasi asam sehingga mengurangi kemampuan kapasitas adsorpsi
maksimum.
3. Adsorpsi Multikomponen
Isoterm adsorpsi dilanjutkan untuk dua komponen yaitu logam Pb dan
logam Fe dengan perbedaan konsentrasi awal yang diadsorp menggunakan zeolit
alam dan zeolit alam teraktivasi asam, karena isoterm pada satu komponen
menggunakan isoterm Langmuir maka pada isoterm dua komponen menggunakan
model kompetisi isoterm Langmuir ( Kundari, 2010 ). Isoterm adsorpsi dari logam
Pb dan Fe menggunakan zeolit alam dan zeolit alam teraktivasi asam dapat dilihat
pada Tabel di bawah ini.
Tabel 4.7 Adsorpsi multikomponen konsentrasi awal logam Pb dan Fe dengan zeolit alam
Tabel 4.7 yang merupakan isoterm adsorpsi multikomponen dari zeolit
menghasilkan suatu persamaan dengan salah satu logam sebagai logam
pembanding, persamaan model kompetitif isoterm Langmuir memerlukan tingkat
daya pemisah antar logam sebagai faktor pengaruh kation atau anion, persamaan
model kompetitif isoterm Langmuir dengan logam Pb sebagai pembanding yang
diadsorp menggunakan zeolit alam ialah
dengan faktor pemisah sebesar 8,865 yang menunjukkan adsorpsi logam Pb dan
logam Fe menggunakan zeolit alam sangat besar sehingga kapasitas adsorpsi
dalam keadaan setimbang zeolit alam terhadap dua logam sangat besar.
Tabel 4.8 adsorpsi multikomponen konsentrasi awal logam Pb dan Fe dengan zeolit alam teraktivasi asam
Dengan logam Pb sebagai pembanding yang diadsorp menggunakan zeolit
alam teraktivasi asam ialah
Dengan faktor pemisah sebesar 0,116 yang menunjukkan adsorpsi logam Pb dan
logam Fe menggunakan zeolit alam teraktivasi asam sangat kecil sehingga
kapasitas adsorpsi zeolit alam teraktivasi asam terhadap dua logam sangat kecil.
Karena faktor pemisah logam Pb dan Fe yang diadsorp menggunakan
zeolit alam lebih baik delapan puluh kali dibandingkan faktor pemisah logam Pb
dengan penelitian amun ( 2004 ) yang menggunakan zeolit-MBT dan zeolit-Na
memiliki faktor pemisah untuk campuran Cr dan Cd lebih baik hingga 5-8 kali.
Kundari ( 2010 ) menyatakan bahwa persamaan tersebut digunakan untuk
mengetahui kapasitas adsorpsi satu logam dari campuran logam yang terdapat
pada larutan sampel limbah yang di adsorps oleh zeolit alam ataupun zeolit alam
teraktivasi asam dan memiliki faktor pemisah antara zeolit alam dan zeolit alam
teraktivasi asam tertentu yang menunjukkan kemampuan adsorpsi adsorben
terhadap adosrbat yang lebih dari satu komponen pada limbah cair.
C. Kinetika Adsorpsi
1. Kinetika adsorpsi logam Pb
Setelah isoterm adsorpsi satu komponen dan multikomponen maka
dilanjutkan kinetika adsorpsi untuk logam Pb dan Fe menggunakan zeolit alam
dan zeolit alam teraktivasi sebagai adsorben. Model kinetika adsorpsi yang
digunakan adalah pseudo orde satu dan pseudo orde dua untuk logam Pb yang
dapat dilihat hasilnya dari Tabel di bawah ini,
Tabel 4.9 Kinetika adsorpsi logam Pb
NO Jenis zeolit Pseudo Orde Satu Pseudo Orde Dua
kapasitas adsorpsi dan konstanta laju yang digunakan yaitu pseudo orde dua.
Selain melihat Harga R2 perlu melihat harga konstanta kinetika dan kapasitas
adsorpsi antara zeolit alam dan zeolit alam teraktivasi asam dengan logam Pb
yang mengalami penurunan pada zeolit alam teraktivasi asam, hal ini
dimungkinkan karena interaksi zeolit alam teraktivasi asam dengan logam Pb
telah setimbang pada waktu yang lama.
Adsorpsi zeolit alam dan zeolit alam teraktivasi asam terhadap logam Pb
menggunakan model kinetika adosrpsi ialah pseudo orde dua sehingga
menunjukkan model adsoprsi ialah kemisoprsi. Hal ini sesuai dengan penelitian
wahyuni (2010) menyatakan isoterm langmuir yang dihasilkan pada
kesetimbangan kimia menunjukkan bahwa kinetika yang akan terjadi ialah pseudo
orde dua.
2. Kinetika adsorpsi logam Fe
Kemudian kinetika adsorpsi dilanjutkan terhadap logam Fe dengan pseudo
orde satu dan pseudo orde dua sebagai kinetika adsorpsi yang digunakan sehingga
hasil kinetika adsorpsi dapat dilihat dari Tabel di bawah ini,
Tabel 4.10 kinetika adsorpsi logam Fe
NO Jenis zeolit Pseudo Orde Satu Pseudo Orde Dua
k Qe R2 K Qe R2
yang lebih mendekati satu dibandingkan pseudo orde satu sehingga harga
kapasitas adsorpsi dan konstanta laju digunakan yaitu pseudo orde dua.
Selain harga R2 perlu melihat harga konstanta kinetika dan kapasitas
adsorpsi antara zeolit alam dan zeolit alam teraktivasi asam dengan logam Fe
yang mengalami penurunan pada zeolit alam teraktivasi asam, hal ini
dimungkinkan karena interaksi zeolit alam teraktivasi asam dengan logam Fe
telah setimbang pada waktu yang lama.
Adsorpsi zeolit alam dan zeolit alam teraktivasi asam terhadap logam Fe
mempunyai model kinetika adosrpsi ialah pseudo orde dua yang sama dengan
logam Pb sehingga memiliki model adsoprsi ialah kemisoprsi.
Hasil dari karakterisasi, isoterm adsoprsi dan kinetika adsorpsi
disimpulkan dari karakerisasi yang menunjukkan zeolit alam teraktivasi asam
mengalami peningkatan kristalinitas, peningkatan rasio Si/Al, dan peningkatan
luas permukaan yang dilanjutkan dari masing – masing hasil uji karakterisasi.
Setelah karakterisasi zeolit dilanjutkan isoterm adsoprsi yang
menunjukkan isoterm untuk satu komponen dan dua komponen menggunakan
isoterm Langmuir dan kapasitas adsorpsi untuk dua komponen ialah
Untuk zeolit alam dan zeolit alam teraktivasi asam ialah
Kemudian kinetika adsorpsi untuk logam Pb dan Fe yang diadsorp zeolit alam dan
zeolit alam teraktivasi asam menghasilkan persamaan pseudo orde dua yang
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Karakter zeolit alam mengalami peningkatan kristalinitas, peningkatan
rasio Si/Al, dan peningkatan luas permukaan setelah zeolit alam
teraktivasi asam.
2. Isoterm adsorpsi untuk logam Pb dan Fe ialah isoterm Langmuir.
3. Kapasitas adsorpsi untuk multikomponen dengan zeolit alam ialah
dan zeolit alam teraktivasi asam ialah
B. Saran
1. Aktivan yang digunakan basa kuat seperti NaOH atau KOH
2. Karakterisasi yang digunakan fluoresense sinar-x (XRF)
Daftar Pustaka
Achmad, Rukaesih. 2004. Kimia lingkungan. Andi, Yogyakarta.
Amri Amun, Supranto, M fahrurozi. 2004. Kesetimbangan Adsorpsi Optional Campuran Biner Cd(II) dan Cr(III) dengan Zeolit Alam Terimpregnasi 2-merkaptobenzotiazol. Jurnal natur Indonesia.
A.M. El-Kamash et al., (2005), Modeling batchkinetics and thermodynamics of zinc and cadmium ions removal from waste solutions using synthetic zeolite A, Journal of Hazardous Materials B127 p:211–220[25] McKay, Y.S. Ho, (1999), Pseudo-second order model forsorption processes Process
Biochem,vol.34,hal.451-460
Arryanto, Yateman. 2009. Material Canggih : Rekayasa material Berbasis Sumber Daya Alam Silika-Alumina. Jurusan Kimia FMIPA UGM, Yogyakarta.
Atkins. 1990. Kimia Fisik jilid 1 Edisi keempat. Diterjemahkan oleh Irma I.Kartohadiprojo. Erlangga, Jakarta.
Breck, D.W. 1974. Zeolite Molecular Sieves: Structure, Chemistry, and Use. John Wiley & Sons. New York.
Darmono. 2001. Lingkungan Hidup Dan Pencemaran, Jakarta: Universitas Indonesia.
Do, D, 1998. Adsorption Analysis: Equilibrium and Kinetics. Series Chemical Engineering Vol2. Queensland.
E. M. Ulfah, F. A. Yasnur, Istadi. 2006. Optimasi Pembuatan Katalis Zeolit X dari Tawas, NaOH dan Water Glass Dengan Response Surface Methodology, Bulletin of Chemical Reaction Engineering & Catalysis, 1, 26-32.
Fatimah, Is. 2013. Kinetika Kimia. Graha Ilmu, Yogyakarta.
Fatimah, Is dan Karna Wijaya. 2005. Sintesis Tio
2/Zeolit Sebagai Fotokatalis Pada Pengolahan Limbah Cair Industri Tapioka Secara Adsorpsi-Fotodegradasi.
Teknoin. Vol 10. No 4. Hal 262
Flanigen, E. M., H. Khatami., H. A. Szymanski. 1971. Infrared Structural Studies of Zeolite Framework, Molecular Sieve Zeolite-I. American Society
Frank A. Settle, 1997. Handbook of Instrumental Techniques for Analytical Chemistry: X-Ray Diffraction by Joseph Formica, p.339-364. Prentice Hall PTR, Upper Sandle River, New Jersey.
Ho, Y.S., Mc Kay, G., Wase, DAJ, dan Foster,CF. 2000. Study of the Sorption of Divalent Metal Ions onto Peat. Adsorp. Sci.Technol 18, 639-650
Islam EU, Yang XE, He ZL, Mahmood Q. 2007. Assessing potential dietary of heavy metals in selected vegetables and food crops. J Zhejiang Univ Sci B 8(1):1-13.
Ismunandar, 2006. Padatan Oksida Logam Struktur,Sintesis, dan Sifat – sifatnya.
ITB, Bandung.
Jing Fan, Chunlai Wu, Yafang Wei,Chuanyun Peng, Pingan Peng. 2007.
Preparation of xylanol orange fungtionalized silica gel as a selective solid phase extractor and its application for preconcentration-sepration of mercury from waters. J Hazard Mater 145 : 323– 330.
Kesuma, R.F dkk. 2013. Karakterisasi Pori Adsorben Berbahan Baku Kaolin Capkala dan Zeolit Dealuminasi. Pontianak: Prodi Kimia, Fakultas MIPA Universitas Tanjungpura Pontianak
Khopkar SM. 1990. Konsep Dasar Kimia Analitik. Terjemahan A. Saptoraharjo. UI Press, Jakarta.
Kundari N. A. dan Wiyuniati, S. 2008. Tinjauan Kesetimbangan Adsorpsi Tembaga dalam Limbah Pencuci PCB dengan Zeolit, Seminar nasional IV SDM Teknologi nuklir Yogyakarta, 25-26 Agustus 2008
Kundari N. A, Susanto Apri, dan Prihatiningsih Maria Christina. 2010. Adsorpsi Fe Dan Mn Dalam Limbah Cair Dengan Zeolit Alam, Seminar nasional VI SDM Teknologi nuklir Yogyakarta, 18 November 2010.
Lagergren. S. 1989, Zur Theorie der Sogenannten Adsorption Geloster Stoffe. Kungliga Svenska Vetenskapsakademiens. Handlingar 24, 1-39
Lestari, Dewi Yuanita. 2010. Kajian Modifikasi dan Karakterisasi Zeolit Alam dari Berbagai Negara. Profesionalisme Peneliti dan Penyidik Dalam Riset dan Pembelajaran yang Berkualitas dan Berkarakter. Yogyakarta