POTENSI Aspergillus niger DAN Penicillium spp. SEBAGAI
ENDOSIMBION PELARUT FOSFAT PADA AKAR SEREALIA
RAHMAH WATY
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2012
ABSTRAK
RAHMAH WATY. Potensi Aspergillus niger dan Penicillium spp. sebagai Endosimbion Pelarut Fosfat pada Akar Serealia. Di bawah bimbingan GAYUH RAHAYU dan RAHAYU WIDYASTUTI.
Aspergillus niger dan Penicillium sp. diketahui memiliki kemampuan melarutkan fosfor (P). P
pada tanah masam berada dalam keadaan terikat sehingga produktivitasnya rendah. Indonesia memiliki lahan masam yang luas dan lahan tersebut digunakan untuk produksi tanaman pangan serealia. Oleh sebab itu, potensi A. niger (IPBCC 10.643) dan Penicillium spp. (IPBCC 09.620 dan IPBCC 09.621) sebagai endosimbion pelarut P pada akar serealia (jagung, sorgum, dan padi) perlu diteliti. Endosimbiosis cendawan pelarut P diteliti pada kecambah bebas endofit yang ditanam selama delapan minggu pada media zeolit dalam kondisi masam dengan AlPO4 sebagai sumber P. Endosimbiosis ditetapkan
berdasarkan persentase kolonisasi cendawan pada akar. Pengaruh endosimbiosis pada pertumbuhan tanaman diamati melalui tinggi dan bobot kering tanaman selama empat minggu, serta melalui efisiensi serapan hara pada umur tanaman delapan minggu. Hasil penelitian menunjukkan bahwa A. niger dan
Penicillium spp. dapat mengolonisasi akar hingga 70%, sehingga cendawan ini tergolong endosimbion.
Asosiasi A. niger menunjukkan pengaruh negatif pada semua tanaman uji. Dua galur Penicillium spp. hanya meningkatkan tinggi dan bobot kering tanaman sorgum serta meningkatkan serapan P pada tanaman jagung dan sorgum. Pada tanaman jagung yang diberi inokulan Penicillium sp. IPBCC 09.620, efisiensi serapan N, P, dan K berturut-turut sebesar 1.22, 1.45, dan 1.36, sedangkan pada tanaman jagung yang diinokulasi Penicillium sp. IPBCC 09.621 berturut-turut sebesar 1.55, 1.52, dan 1.04. Pada tanaman sorgum yang diinokulasi Penicillium sp. IPBCC 09.620 menunjukkan efisiensi serapan N, P, dan K berturut-turut sebesar 1.04, 2.00, dan 1.79. Efisiensi serapan N, P, dan K ini relatif lebih besar daripada efisiensi serapan N, P, dan K dari tanaman sorgum yang diinokulasi Penicillium sp. IPBCC 09.621 yaitu berturut-turut sebesar 1.19, 1.30, dan 1.46.
Kata kunci: A. niger, Penicillium spp., endosimbion, pelarut P, akar serealia. ABSTRACT
RAHMAH WATY. Potential of Aspergillus niger and Penicillium spp. as Phosphate Solubilizing Endosymbiont in Cereals Roots. Under supervision of GAYUH RAHAYU and RAHAYU WIDYASTUTI.
Aspergillus niger and Penicillium sp. are known to have the ability to solubilize phosphorus (P). P
in acid soils exists in unavailable forms that decrease productivity. Indonesia has a large acid soil that used for cereal crops production. Therefore, the potential of A. niger (IPBCC 10.643) and Penicillium spp. (IPBCC 09.620 and 09.621 IPBCC) as P solubilizing endosymbiont in the roots of cereals (maize, sorghum, and rice) was studied. Endosymbiosis of P solubilizing fungi was observed in germlings that were free from endophytic fungi and planted on zeolite in acidic condition with AlPO4as a source of P,
for eight weeks period. Endosymbiosis was determined based on fungal percentage of colonization in the roots. The effects of endosymbiosis on plant growth was measured as height and dry weight of plants for four weeks, and also by efficiency of nutrient uptake in plants at eight weeks old. The results of this study indicated that A. niger and Penicillium spp. colonized the roots up to 70%, so the fungi were considered as endosymbionts. Association of A. niger and roots showed a negative effect on all test plants. Two strains of Penicillium spp. only increased the height and dry weight of sorghum and increased P uptake in maize and sorghum. The N, P, and K efficiency uptake of maize that inoculated with Peniclillium sp. IPBCC 09.620 about 1.22, 1.45, and 1.36 of the control respectively, while those inoculated with
Penicillium sp. IPBCC 09.621 were 1.55, 1.52, and 1.04, respectively. Sorghum that were inoculated with Penicillium sp. IPBCC 09.620 showed the efficiency uptake of N, P, and K about 1.04, 2.00, and 1.79,
respectively. This efficiency uptake of N, P, and K as relatively greater than the efficiency uptake of N, P, and K of sorghum plants (1.19, 1.30, and 1.46, respectively) that were inoculated Penicillium sp. IPBCC 09.621.
POTENSI Aspergillus niger DAN Penicillium spp. SEBAGAI
ENDOSIMBION PELARUT FOSFAT PADA AKAR SEREALIA
RAHMAH WATY
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2012
Judul Skripsi
: Potensi Aspergillus niger
dan Penicillium
spp. sebagai
Endosimbion Pelarut Fosfat pada Akar Serealia
Nama
: Rahmah Waty
NIM
: G34070046
Disetujui:
Pembimbing I
Pembimbing II
Dr. Ir. Gayuh Rahayu
Dr. Rahayu Widyastuti, M.Sc.
NIP. 19580105 198303 2 002
NIP. 19610607 199002 2001
Diketahui,
Ketua Departemen Biologi
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198903 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 13 September 1989 dari bapak Sa’amin dan ibu Rukiah. Penulis merupakan anak kedua dari dua bersaudara.
Tahun 2001 penulis lulus dari SD Negeri Meruya Utara 10, Jakarta. Tahun 2004 penulis lulus dari SLTP Negeri 75, Jakarta. Penulis lulus dari SMA Negeri 65 Jakarta pada tahun 2007, kemudian melanjutkan pendidikan di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB).
Penulis mempunyai pengalaman sebagai asisten praktikum pada mata kuliah Biologi Dasar, Biologi Cendawan, Botani Umum, dan Sistematika Tumbuhan Berpembuluh, melaksanakan Praktik Lapangan di PT PERTAMINA (Persero) RU VI Balongan-Indramayu, serta anggota Himpunan Mahasiswa Biologi periode 2009-2010.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Penelitian dengan judul “Potensi Aspergillus niger dan Penicillium spp. sebagai Endosimbion Pelarut Fosfat pada Akar Serealia” ini dilakukan mulai Mei 2011 sampai dengan Oktober 2011 di Laboratorium Mikologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor dan di Balai Penelitian Tanah, Bogor.
Terima kasih penulis ucapkan kepada Dr. Ir. Gayuh Rahayu selaku pembimbing I dan pemberi dana penelitian, Dr. Rahayu Widyastuti, M.Sc selaku pembimbing II atas bimbingan dan pengarahan yang telah diberikan. Ucapan terimakasih juga disampaikan kepada Prof. Dr. Anja Meriyandini, M. S. sebagai dosen penguji yang telah memberikan koreksi dan saran-saran dalam perbaikan skripsi ini.
Terima kasih kepada Bapak, Ibu, dan kakak atas segala dukungan baik semangat, materil, serta doa selama penulis menempuh pendidikan hingga karya ilmiah ini terselesaikan. Ungkapan terima kasih juga di tujukan kepada Ibu Emi, Bapak Kus, untuk bantuannya, kakak, ibu, dan bapak yang dapat menjadi teman di laboratorium Mikologi, Bapak Supriyanto, Bapak Joni, Komal, Lestari, Sepri, dan teman-teman Biologi 44, terima kasih atas keceriaan dan kerjasamanya.
Semoga karya ilmiah ini dapat bermanfaat untuk perkembangan ilmu pengetahuan.
Bogor, Maret 2012
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 2
BAHAN DAN METODE... 2
Waktu dan Tempat Penelitian ... 2
Bahan dan Alat... 2
Metode ... 2
Perkecambahan Benih ... 2
Produksi Biomassa Inokulan ... 2
Inokulasi Akar Tanaman... 2
Analisis Kolonisasi dengan Biru Tripan ... 2
Respon Tumbuh dan Analisis Serapan Hara... 3
Analisis Data... 3
HASIL DAN PEMBAHASAN ... 3
Kolonisasi A. niger dan Penicillium spp. pada Akar Tanaman ... 3
Pengaruh Pemberian Inokulan Terhadap Pertumbuhan Tanaman... 5
Pengaruh Pemberian Inokulan Terhadap Penampakan Fisik Tanaman... 7
Pengaruh Pemberian Inokulan Terhadap Serapan Hara Tanaman ... 8
SIMPULAN DAN SARAN ... 10
Simpulan ... 10
Saran ... 11
DAFTAR PUSTAKA... 11
DAFTAR TABEL
Halaman
1 Persentase kolonisasi A. niger dan Penicillium spp. 4 minggu setelah inokulasi ... 4
2 Pengaruh pemberian inokulan terhadap serapan N, P, dan K tanaman ... 9
3 Pengaruh pemberian inokulan terhadap persentase serapan N, P, dan K ... 10
4 Efisiensi serapan N, P, dan K ... 10
DAFTAR GAMBAR Halaman 1Kolonisasi hifa pada akar ... 4
2 Struktur selain hifa di dalam akar tanaman ... 5
3 Pengaruh pemberian inokulan terhadap tinggi tanaman jagung ... 5
4 Pengaruh pemberian inokulan terhadap tinggi tanaman sorgum... 6
5 Pengaruh pemberian inokulan terhadap tinggi tanaman padi ... 6
6 Pengaruh pemberian inokulan terhadap tinggi dan bobot kering tanaman jagung ... 6
7 Pengaruh pemberian inokulan terhadap tinggi dan bobot kering tanaman sorgum ... 6
8 Pengaruh pemberian inokulan terhadap tinggi dan bobot kering tanaman padi ... 7
9 Pengaruh pemberian Al dan inokulan terhadap fisik tanaman ... 7
DAFTAR LAMPIRAN Halaman 1 Larutan Hoagland modifikasi ... 14
1
PENDAHULUAN Latar Belakang
Fosfor (P) merupakan salah satu unsur hara yang penting bagi tanaman dan dibutuhkan dalam jumlah besar. Jumlah P di alam melimpah, akan tetapi terdapat dalam keadaan terikat (Gupta et al. 2007). Umumnya unsur P ada dalam bentuk Ca3(PO4)2pada tanah basa dan
Fe-P atau Al-Fe-P pada tanah masam (Suliasih & Rahmat 2006). Bentuk-bentuk P terikat ini menyebabkan ketersediaan P untuk tanaman menjadi kurang dan sering menjadi faktor pembatas bagi serapan unsur hara lainnya.
Salah satu cara mengatasi kekurangan P untuk tanaman ialah dengan pemberian pupuk kimia. Namun penggunaan pupuk kimia secara tunggal merupakan solusi yang kurang efektif untuk memenuhi kebutuhan P. Hanya sekitar 10-25% dari penambahan pupuk fosfat yang dapat dimanfaatkan oleh tanaman, walaupun penambahan pupuk dilakukan dalam jumlah besar (Gupta et al. 2007). Hal ini menyebabkan deposit P menjadi tinggi di dalam tanah. Artinya jumlah P di tanah banyak akan tetapi tidak dapat dimanfaatkan oleh tanaman. Selain itu, penggunaan pupuk kimia yang tidak sesuai dosis dan berlebihan dapat menyebabkan masalah lingkungan. Penggunaan pupuk kimia yang dilakukan secara terus menerus akan mengganggu kesehatan tanah dan membawa dampak negatif bagi produktivitas tanah. Oleh karena itu, pengembangan pupuk hayati menjadi penting dilakukan bagi kegiatan pertanian yang berkesinambungan (Paul & Savithri 2003).
Pupuk hayati adalah inokulan berbahan aktif organisme hidup yang berfungsi menambat hara tertentu atau memfasilitasi tersedianya hara di dalam tanah bagi tanaman. Penyediaan hara dapat berlangsung melalui hubungan simbiosis atau nonsimbiosis (Simanungkalit et al. 2006). Pupuk hayati yang mengandung mikrob pelarut P dalam praktik pertanian dianjurkan digunakan karena pupuk ini dianggap ramah lingkungan. Mikrob yang berada di rizosfer yang berasal dari pupuk hayati secara aktif berperan dalam
transformasi P di tanah dan
mentrasportasikannya ke tanaman, sehingga pupuk ini dapat mengatasi kekurangan P tersedia di tanah (Das et al. 2008). Pupuk ini dapat memperbaiki kesuburan dan kondisi tanah, meningkatkan pertumbuhan tanaman dan hasil panen, melindungi tanaman dari patogen asal tanah, dan tidak menyebabkan pencemaran lingkungan dengan teknologi yang relatif rendah biaya (Khan et al. 2006). Menurut Undang-Undang No. 23 Tahun 1997, pencemaran
lingkungan adalah masuknya atau
dimasukkannya makhluk hidup, zat, energi, dan/atau komponen lain ke dalam lingkungan hidup oleh kegiatan manusia sehingga kualitasnya turun sampai ke tingkat tertentu yang menyebabkan lingkungan hidup tidak dapat berfungsi sesuai peruntukannya.
Pupuk hayati memfasilitasi tersedianya hara melalui peningkatan akses tanaman terhadap hara. Penyediaan hara ini dapat berlangsung melalui hubungan simbiosis atau non simbiosis. Secara simbiosis dapat terjadi pada tanaman tertentu, sedangkan nonsimbiosis berlangsung melalui penyerapan hara hasil pelarutan mikrob (Simanungkalit et al. 2006). Asosiasi tanaman dengan mikrob dapat membantu pelarutan unsur P, sehingga dapat dimanfaatkan oleh tanaman. Cendawan pelarut P adalah mikrob yang dapat menjadi kontributor penting dalam mobilisasi dan meningkatkan ketersediaan P bagi tanaman (El-Azouni 2008). Diantara cendawan penghuni rizosfer, Aspergillus sp. dan Penicillium sp. merupakan cendawan yang umum ditemukan dan telah diketahui memiliki kemampuan melarutkan P, sehingga kedua jenis cendawan ini berpotensi untuk dikembangkan sebagai pupuk hayati yang dapat meningkatkan produktifitas pertanian.
Pelarutan P oleh cendawan dilakukan melalui produksi asam organik. Salah satu spesies
Penicillium, yaitu P. bilaii berperan dalam
aktivitas pelarutan P terikat melalui produksi asam sitrat dan asam oksalat (Cunningham & Kuiack 1992). Selain melarutkan P, A. niger dan
Penicillium sp. merupakan jenis cendawan yang
ditemukan sebagai endosimbion pada Ficus
benghalensis. Kolonisasi cendawan ini ditemukan di berbagai organ dengan frekuensi yang berbeda (Suryanarayanan & Vijaykrishna 2001). Mikrob endosimbion adalah mikrob yang hidup di dalam jaringan tanaman dan mampu membentuk koloni di dalam jaringan (Radji 2005). Mikrob yang dapat meningkatkan ketersediaan hara bagi tanaman akan lebih efektif jika berada di dalam jaringan tanaman, sebab unsur hara yang tersedia dapat langsung ditransportasikan ke tanaman.
Beberapa biakan koleksi IPBCC asal serasah hutan di Kalimantan menunjukkan kemampuan melarutkan P secara in vitro. Handayani (2011) berhasil membuktikan bahwa A. niger dan
Penicillium sp. koleksi IPBCC yang berasal dari
serasah hutan dipterocarp ini memiliki kemampuan melarutkan Ca3(PO4)2 secara in
vitro. Selanjutnya Handayani (2011) juga
menyatakan bahwa kolonisasi Penicillium sp. pada perakaran Zea mays dan Shorea selanica dapat meningkatkan serapan P dari sumber P berupa Ca3(PO4)2. Serapan P ini berkorelasi
2 positif dengan serapan N dan K, sehingga
meningkatkan pertumbuhan tanaman kedua tanaman tersebut.
Indonesia memiliki lahan yang sangat luas dengan kondisi asam, dan lahan-lahan ini dikembangkan untuk produksi beberapa tanaman serealia seperti jagung, sorgum, dan padi. Ketiga tanaman tersebut termasuk tanaman pangan terbesar yang sedang dikembangkan sebagai sumber karbohidrat. Beberapa isolat A. niger dan
Penicillium sp. yang telah diketahui memiliki
kemampuan melarutkan Ca3(PO4)2 merupakan
hasil isolasi dari serasah hutan dipterocarp di Kalimantan yang memiliki tanah dengan kondisi masam. Oleh karena itu, kemampuan A. niger dan Penicillium sp. dalam melarutkan P pada kondisi masam perlu diteliti.
Tujuan
Penelitian ini bertujuan mengetahui potensi
A. niger dan Penicillium spp. sebagai cendawan
endosimbion akar pada beberapa tanaman serealia (jagung, sorgum, dan padi) serta pengaruhnya sebagai cendawan pelarut P terhadap pertumbuhan tanaman tersebut pada kondisi masam.
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Mei 2011 sampai dengan Oktober 2011 di laboratorium Mikologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dan di Balai Penelitian Tanah Bogor.
Bahan dan Alat
Bahan tanaman yang digunakan berupa benih jagung, sorgum, dan padi. Cendawan yang digunakan adalah A. niger IPBCC 10.643,
Penicillium sp. IPBCC 09.620, dan Penicillium
sp. IPBCC 09.621. Bahan lain yang digunakan adalah bahan sterilisasi permukaan (alkohol 60%, NaOCl 1%, akuades steril), bahan pewarna dan pengawet akar (alkohol 70%, KOH 10%, HCl 1 N, biru tripan 0.05%, gliserol 50%), larutan Hoagland modifikasi (Lampiran 1), serta media tanam berupa zeolit. Alat yang digunakan adalah gelas plastik, polybag, tisu steril, erlenmeyer 250 mL, mesin penggoyang, kertas saring, kertas stensil, tabung reaksi, gelas objek, dan kaca penutup, mikroskop, serta peralatan laboratorium lain yang umum digunakan.
Metode
Penelitian dilakukan dengan
mengombinasikan jenis tanaman yaitu jagung, sorgum, dan padi dengan inokulan tunggal
cendawan, sehingga dalam penelitian ada tiga perlakuan untuk setiap tanaman yang disertai kontrol berupa tanaman tanpa inokulan.
Perkecambahan Benih. Benih disterilisasi
permukaan sebelum dikecambahkan. Benih dicuci dengan air mengalir, dicuci dengan air sabun dan direndam dalam air sabun selama 5 menit. Kemudian benih dibilas dan direndam dalam alkohol 60% selama 10 menit, selanjutnya dibilas dengan air steril, direndam dalam larutan NaOCl 1% selama 20 menit, dibilas kembali dengan akuades steril, dan dikeringkan dengan tisu steril. Benih yang telah kering dikecambahkan pada kertas stensil steril lembab. Sebagian kecambah dilihat status kolonisasi cendawan endosimbionnya. Bibit sehat, bebas kontaminan digunakan dalam penelitian ini.
Produksi Biomassa Inokulan. Produksi
biomassa cendawan dilakukan pada dua puluh erlenmeyer dengan menumbuhkan masing-masing tiga potong kultur kerja (diameter 5 mm) umur 6 hari dari media PDA (Potato Dextrose Agar) ke dalam 100 mL media PDB (Potato
Dextrose Broth) di erlenmeyer 250 mL. Kultur
diinkubasi di atas mesin penggoyang pada suhu ruang selama 6 hari dengan kecepatan 100 rpm. Biomassa cendawan dipanen dengan menggunakan kertas saring steril, kemudian dibilas dengan akuades steril.
Inokulasi Akar Tanaman. Tanaman
berumur dua minggu diinokulasikan dengan kira-kira 1 g biomassa berupa gumpalan hifa cendawan. Zeolit steril dan biomassa cendawan diaduk hingga merata dengan bantuan akuades, agar lebih mudah. Akar tanaman ditanam di dalam zeolit yang telah dicampur dengan cendawan pada wadah gelas plastik, dan ditutup dengan zeolit steril kembali, kemudian wadah gelas plastik dilapisi polybag hitam. Sumber unsur hara yang digunakan adalah larutan Hoagland modifikasi dengan AlPO4 sebagai
sumber P. Larutan Hoagland yang diberikan untuk setiap tanaman selama penelitian yaitu sebanyak 260 mL dengan kandungan N, P, dan K berturut-turut sebanyak 54.639 mg, 8.052 mg, dan 50.83 mg (Lampiran 1).
Analisis Kolonisasi dengan Biru Tripan.
Pewarnaan akar dilakukan menggunakan metode Kormanick dan Mc Graw (1982). Akar tanaman diambil dari media tanam, kemudian dicuci dengan air mengalir. Akar dipotong 1 cm, kemudian direndam dalam alkohol 70% selama 2 menit, kemudian dibilas dengan akuades steril 3-5 kali. Selanjutnya akar di rendam dalam KOH
3 10% pada suhu 90oC selama 5-15 menit atau
hingga akar menjadi transparan. KOH dibuang dan dibilas dengan akuades steril 3-5 kali hingga benar-benar bersih, kemudian akar direndam dengan HCl 1 N selama kurang lebih 12 jam atau 1 malam. Akar diwarnai dengan biru tripan 0.05% selama 20 menit. Akar yang telah diwarnai disimpan dalam gliserol 50%, dan diamati menggunakan mikroskop cahaya.
Potongan akar sepanjang 1 cm diletakan berjajar pada gelas objek. Sebanyak 30 potong akar diamati untuk tiap tanaman. Akar yang dianggap terkolonisasi ialah akar yang menunjukkan gejala kolonisasi lebih setengah dari panjang potongan akar. Gejala kolonisasi ditandai dengan terdapatnya benang-benang hifa berwarna biru setelah diwarnai dengan biru tripan.
% kolonisasi =jumlah total akar diamati x 100%akar terkolonisasi Respon Tumbuh dan Analisis Serapan Hara. Respon tumbuh diamati setiap minggu
selama 4 minggu. Sebanyak tiga tanaman yang telah diinokulasikan dan tanaman kontrol dipanen. Respon tumbuh yang diamati yaitu tinggi tajuk dan bobot kering tajuk. Analisis serapan N, P, dan K pada tanaman berumur delapan minggu dilakukan secara komposit oleh Balai Penelitian Tanah Bogor, dengan prosedur terlampir (Lampiran 2).
Analisis Data. Penelitian dilakukan dengan
rancangan acak lengakap (RAL) dengan jenis inokulan sebagai perlakuan yang disertai tanaman kontrol dan dilakukan dengan 3 ulangan. Analisis data dilakukan menggunakan program SAS 9.1 dan uji lanjut menggunakan uji jarak berganda Duncan pada selang kepercayaan 95%.
HASIL DAN PEMBAHASAN
Kolonisasi A. niger dan Penicillium spp. pada Akar Tanaman
Akar tanaman jagung, sorgum, dan padi yang telah satu minggu berkecambah diperiksa status endofitnya sebelum A. niger dan Penicillium spp. diujikan ke tanaman. Setelah akar tanaman terbukti bebas endofit, maka A. niger dan
Penicillium spp. dapat diinokulasi pada akar
tanaman dengan mencampurkan biomassa
cendawan ini ke dalam media tanamnya. Hasil pengamatan menunjukan bahwa A. niger dan
Penicillium spp. dapat mengolonisasi akar
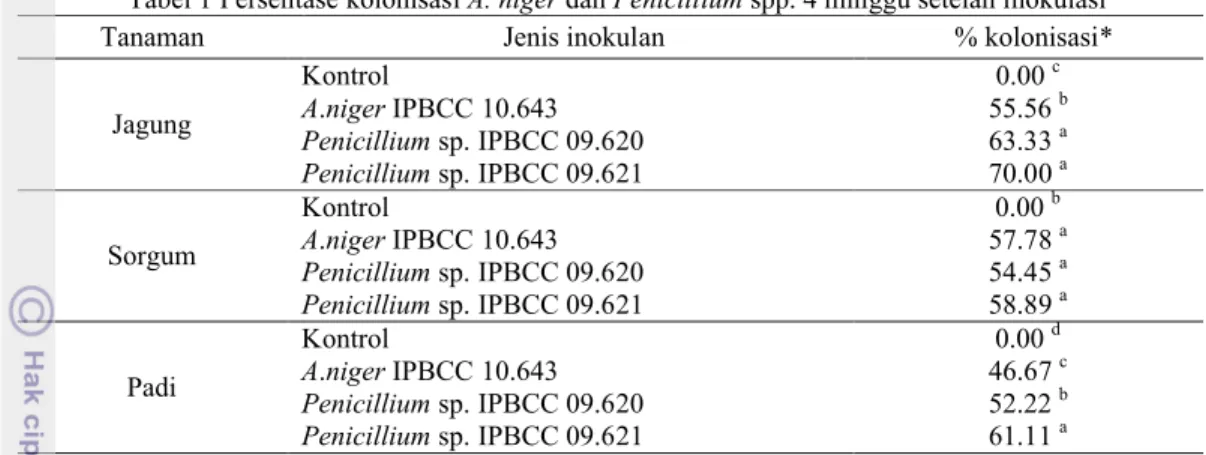
tanaman, baik akar jagung, sorgum, maupun padi, dengan persentase yang berbeda-beda (Tabel 1).
Secara umum, Penicillium sp. IPBCC 09.621 memiliki persentase kolonisasi paling tinggi. Pada tanaman jagung, kolonisasi Penicillium sp. IPBCC 09.621 mencapai 70%. Persentase ini tidak berbeda nyata dengan kolonisasi oleh
Penicillium sp. IPBCC 09.620 sebesar 63.33%
tetapi berbeda nyata dengan kolonisasi A. niger sebesar 55.56% (Tabel 1). Kolonisasi
Penicillium sp. IPBCC 09.621 (58.89%) pada
tanaman sorgum juga paling tinggi, namun tidak berbeda nyata dengan kedua inokulan lainnya (Tabel 1). Pada tanaman padi, Penicillium sp. IPBCC 09.621 juga menunjukkan persentase kolonisasi tertinggi 61.11% dan berbeda nyata dari persentase kolonisasi Penicillium sp. IPBCC 09.620 (52.22%) dan A. niger (46.67%) (Tabel 1). Tanaman kontrol untuk semua perlakuan tidak menunjukkan adanya kolonisasi inokulan (Tabel 1). Persentase kolonisasi yang berbeda-beda ini kemungkinan disebabkan oleh kesesuaian cendawan pada tanaman berbeda-beda. Ketika suatu tanaman merupakan inang yang cocok bagi suatu cendawan, maka cendawan tersebut akan dapat lebih banyak mengolonisasi jaringan tanaman tersebut. Tingkat kolonisasi A. niger yang secara umum lebih rendah mungkin disebabkan cendawan ini kurang sesuai untuk tanaman uji. Selain itu, tanaman juga dapat membentuk suatu pertahanan ketika kondisi lingkungan merugikan, seperti keberadaan mikrob yang dianggap sebagai patogen (Walker et al. 2003). Pertahanan dari tanaman ini yang mungkin membatasi kolonisasi mikrob pada jaringan tanaman.
Beberapa cendawan bersimbiosis secara fakultatif, dapat ditemukan hidup bebas sebagai saprob dan di dalam tanaman, atau hidup secara obligat pada jaringan tanaman (Carlile et al. 2001). Kolonisasi menunjukkan bahwa ketiga cendawan tersebut merupakan cendawan yang dapat berasosiasi dengan akar tanaman uji sebagai mikrob endosimbion. Mikrob endosimbion adalah mikrob yang hidup di dalam jaringan tanaman dan mampu membentuk koloni di dalam jaringan tanaman (Radji 2005).
4
Tabel 1 Persentase kolonisasi A. niger dan Penicillium spp. 4 minggu setelah inokulasi
Tanaman Jenis inokulan % kolonisasi*
Jagung Kontrol 0.00 c A.niger IPBCC 10.643 55.56 b Penicillium sp. IPBCC 09.620 63.33 a Penicillium sp. IPBCC 09.621 70.00 a Sorgum Kontrol 0.00 b A.niger IPBCC 10.643 57.78 a Penicillium sp. IPBCC 09.620 54.45 a Penicillium sp. IPBCC 09.621 58.89 a Padi Kontrol 0.00 d A.niger IPBCC 10.643 46.67 c Penicillium sp. IPBCC 09.620 52.22 b Penicillium sp. IPBCC 09.621 61.11 a
*Angka dalam kolom yang sama pada masing-masing kelompok dan diikuti huruf yang sama tidak berbeda nyata berdasarkan uji jarak berganda Duncan, α = 0.05.
Kolonisasi ditandai dengan terdapatnya benang-benang hifa berwarna biru setelah pewarnaan dengan biru tripan (Gambar 1a dan 1b). Kolonisasi paling banyak terjadi pada akar rambut dan ujung akar (Gambar 1c). Hal ini sesuai dengan Handayani (2011) yang menyatakan bahwa kontak awal Penicillium sp. dengan akar tanaman terjadi pada daerah akar rambut dan permukaan akar. Pada tanaman kontrol tidak terdapat koloni cendawan (Gambar 1d dan 1e).
Gambar 1 Kolonisasi hifa pada akar a) akar jagung dengan Penicillium sp., b) akar padi dengan A. niger, c) ujung akar padi yang seluruhnya terkolonisasi, d) akar jagung kontrol, e) akar padi kontrol.
Menurut Handayani (2011), kolonisasi
Penicillium sp. pada akar jagung dimulai
dengan masuknya hifa ke dalam akar melalui rongga intersel epidermis dengan menggunakan struktur mirip apresorium yang menyebabkan sel akar berlubang, sehingga dapat terjadi penetrasi hifa. Kolonisasi mikrob pelarut P yang banyak terjadi pada akar rambut dan ujung akar dapat disebabkan oleh melimpahnya kandungan nutrisi di sekitar akar rambut dan ujung akar. Walker et al. (2003) menyatakan bahwa akar dapat menghasilkan eksudat berupa polisakrida, protein, asam amino, asam organik, gula sederhana dan metabolit sekunder. Eksudat ini dapat dijadikan sebagai sumber nutrisi bagi mikrob yang berada di tanah rizofer (Niswati et
al. 2008).
Selain benang-benang hifa yang menyebar pada sel-sel akar, cendawan juga membentuk bulatan noktah (Gambar 2a) dan struktur mirip klamidospora (Gambar 2b). Struktur bulat seperti noktah tersebut akan membentuk jalinan hifa renik yang memenuhi akar, sehingga akar berwarna biru gelap setelah diwarnai biru tripan (Handayani 2011). Klamidospora adalah sel hifa berdinding tebal yang terbentuk dari suatu kompartemen hifa yang menerima nutrien ekstra. Klamidospora terbentuk karena lingkungan yang kurang menguntungkan, dan ketika lingkungan mendukung klamidospora dapat berkecambah (Gandjar et al. 2006). Empat minggu setelah inokulasi, cendawan membentuk hifa yang keluar dari sel-sel akar (Gambar 2c dan 2d). Hifa yang muncul ke permukaan akar ini diduga dapat mempermudah transportasi P yang terlarut pada media tanam ke dalam tanaman. Selain hifa yang berwarna biru, pada minggu ke empat ditemukan juga
Dark Septate Endophyte (DSE) pada perakaran
tanaman uji (Gambar 2e dan 2f). Adanya DSE pada minggu ke 4 (sampel bibit yang diamati
20 µm 20 µm
20 µm
a b c
pada minggu pertama tidak menunjukkan adanya infestasi DSE) menunjukkan bahwa sumber inokulum DSE dapat terbawa udara atau DSE berkembang sangat lambat dan memerlukan waktu efektif yang
keberadaannya dapat terdeteksi.
merupakan cendawan dengan hifa berwarna gelap, bersekat, dan berkonidia (dari kelompok Deuteromiset atau Askomiset) yang
mengolonisasi akar tanaman. DSE merupakan cendawan dengan habitat yang luas serta dapat hidup bersama dengan cendawan tanah, cendawan saprofit akar, cendawan patogen, dan mikoriza. Umumnya DSE tidak bersporulasi atau menghasilkan hanya sedikit konidia. Sekitar 59 spesies dari kelompok Graminae telah diketahui membawa DSE pada akarnya Fungsi DSE di tanah maupun di dalam akar tanaman inang belum diketahui dengan jelas mungkin membantu tanaman mendapatkan nutrisi, atau tidak berpengaruh pada tanaman (Jumpponen & Trappe 1998).
Gambar 2 Struktur selain hifa di dalam tanaman a) noktah b) struktur mirip klamidospora, c) dan d) hifa eksternal pada permukaan akar, d) dan e) kolonisasi DSE pada akar sorgum. a c e 20 µm 20 µm tidak menunjukkan menunjukkan bahwa inokulum DSE dapat terbawa udara atau DSE berkembang sangat lambat dan waktu efektif yang lama agar keberadaannya dapat terdeteksi. DSE merupakan cendawan dengan hifa berwarna gelap, bersekat, dan berkonidia (dari kelompok omiset) yang mampu mengolonisasi akar tanaman. DSE merupakan cendawan dengan habitat yang luas serta dapat hidup bersama dengan cendawan tanah, cendawan saprofit akar, cendawan patogen, dan mikoriza. Umumnya DSE tidak bersporulasi
sedikit konidia. Sekitar 59 spesies dari kelompok Graminae telah diketahui membawa DSE pada akarnya. Fungsi DSE di tanah maupun di dalam akar tanaman inang belum diketahui dengan jelas, mendapatkan ada tanaman
di dalam akar a) noktah b) struktur mirip klamidospora, c) dan d) hifa eksternal pada permukaan akar, d) dan e) kolonisasi DSE pada akar
Pengaruh Pemberian Inokulan Pertumbuhan Tanaman
Sumber P yang digunakan dalam
ini yaitu AlPO4. Al merupakan unsur yang
sering berikatan dengan P pada tanah masam sehingga ketersediaan P bagi tanaman menjadi kurang. Al juga bersifat meracuni
merupakan faktor penting yang me produktifitas tanaman pada tanah masam. memiliki pengaruh negatif bagi tanaman, yaitu dapat mengganggu proses pembelahan sel pada akar, menurunkan respirasi akar,
pengambilan serta penggunaan air dan nutrisi terutama Ca dan P (Rout et al. 2000).
al. (2001) juga melaporkan bahwa
dapat mengganggu aktivitas banyak enzim yang dihasilkan tanaman. Selain dapat menghambat pertumbuhan tanaman, Al juga bersifat toksik bagi mikroorganisme. Siham (2007) melaporkan bahwa ion Al3+ dapat menurunkan
pertumbuhan cendawan.
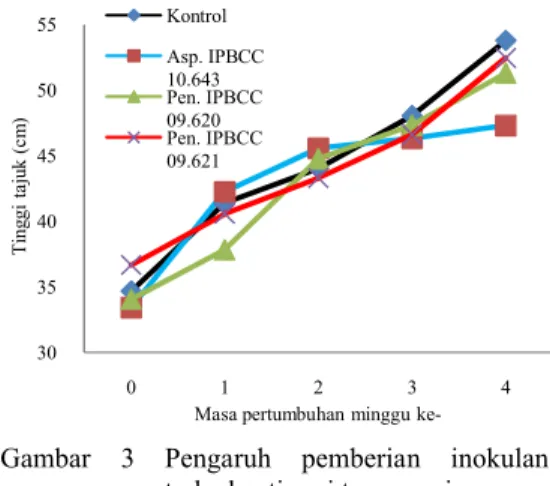
Sesuai dengan jenis tanamannya, a cendawan dan tanaman dapat mempengaruhi pertumbuhan tinggi tanaman yang diamati selama 4 minggu. Asosiasi A. niger
Penicillium spp. dengan akar jagung
berpengaruh pada tinggi tajuk tanama
secara signifikan dibandingkan kontrol (Gambar 3).
Gambar 3 Pengaruh pemberian
terhadap tinggi tanaman jagung. Berbeda dari tanaman jagung, pemberian inokulan pada perakaran tanaman sorgum menyebabkan tanaman tumbuh lebih tinggi kontrol (Gambar 4). Tanaman sorgum yang diinokulasikan Penicillium sp. IPBCC 09.620 memiliki pertumbuhan yang lebih baik dari tanaman sorgum lainnya. Sedangkan tanaman sorgum yang diinokulasikan Penicillium IPBCC 09.621 memiliki pertumbuhan yang hampir serupa dengan tanaman kontrol, dan tanaman dengan inokulan A. niger
pertumbuhan paling rendah (Gambar 4).
30 35 40 45 50 55 0 1 2 T in gg i ta ju k (c m )
Masa pertumbuhan minggu ke Kontrol Asp. IPBCC 10.643 Pen. IPBCC 09.620 Pen. IPBCC 09.621 b d f 20 µm 5
mberian Inokulan Terhadap
dalam penelitian merupakan unsur yang sering berikatan dengan P pada tanah masam, sehingga ketersediaan P bagi tanaman menjadi
bersifat meracuni, sehingga merupakan faktor penting yang membatasi
fitas tanaman pada tanah masam. Al egatif bagi tanaman, yaitu dapat mengganggu proses pembelahan sel pada
, dan proses pengambilan serta penggunaan air dan nutrisi 2000). R’bia et melaporkan bahwa ion Al3+
dapat mengganggu aktivitas banyak enzim yang Selain dapat menghambat pertumbuhan tanaman, Al juga bersifat toksik Siham (2007) dapat menurunkan namannya, asosiasi mempengaruhi pertumbuhan tinggi tanaman yang diamati
A. niger dan
dengan akar jagung tidak tanaman jagung kontrol (Gambar
pemberian inokulan terhadap tinggi tanaman jagung. Berbeda dari tanaman jagung, pemberian
anaman sorgum tumbuh lebih tinggi dari kontrol (Gambar 4). Tanaman sorgum yang sp. IPBCC 09.620 memiliki pertumbuhan yang lebih baik dari tanaman sorgum lainnya. Sedangkan tanaman
Penicillium sp.
IPBCC 09.621 memiliki pertumbuhan yang gan tanaman kontrol, dan
A. niger memiliki
(Gambar 4).
3 4
ke-15 17 19 21 23 25 27 29 31 0 1 2 T in gg i ta ju k (c m )
Masa pertumbuhan minggu ke Kontrol Asp. IPBCC 10.643 Pen. IPBCC 09.620 Pen. IPBCC 09.621
Gambar 4 Pengaruh pemberian inokulan terhadap tinggi tanaman sorgum. Inokulasi cendawan pelarut fosfat pada perakaran tanaman padi juga memberikan pengaruh yang baik (Gambar 5).
inokulan ternyata meningkatkan ketahanan tanaman padi. Tanaman dengan pemberian inokulan dapat bertahan hidup hingga minggu ke-4 sedangkan tanaman kontrol tidak Tanaman padi paling tinggi adalah tanaman dengan inokulan A. niger. Tanaman padi pemberian inokulan Penicillium sp. baik IPBCC 09.620 maupun IPBCC 09.621 memiliki pertumbuhan yang serupa selama empat minggu (Gambar 5). Tanaman padi kontrol yang tidak diberikan inokulan tidak dapat bertahan hidup hingga minggu ke-4 dan mati pada minggu ke 3. Pertumbuhan tanaman padi kontrol juga hampir stastis (Gambar 5).
Gambar 5 Pengaruh pemberian inokulan terhadap tinggi tanaman padi. Pengaruh pemberian cendawan pelarut P paling terlihat pada tanaman padi. Inokulan dapat meningkatkan ketahanan hidup padi pada lingkungan dengan kandungan Al, walaupun pertumbuhannya tidak optimum.
tanaman padi kontrol dapat disebabkan oleh keberadaan Al. Padi termasuk tanaman yang tidak toleran terhadap Al. Kehadiran Al dapat menyebabkan kemampuan akar tanaman padi menyerap hara lebih rendah dan akan mengalami defisiensi hara (Rusdiansyah 2001).
20 30 40 50 60 70 0 1 2 T in gg i ta ju k (c m )
Masa pertumbuhan minggu ke Kontrol Asp. IPBCC 10.643 Pen. IPBCC 09.620 Pen. IPBCC 09.621 3 4
Masa pertumbuhan minggu
ke-Gambar 4 Pengaruh pemberian inokulan terhadap tinggi tanaman sorgum. Inokulasi cendawan pelarut fosfat pada
ga memberikan baik (Gambar 5). Pemberian inokulan ternyata meningkatkan ketahanan anaman dengan pemberian inokulan dapat bertahan hidup hingga minggu 4 sedangkan tanaman kontrol tidak. paling tinggi adalah tanaman . Tanaman padi dengan sp. baik IPBCC 09.620 maupun IPBCC 09.621 memiliki pertumbuhan yang serupa selama empat minggu anaman padi kontrol yang tidak nokulan tidak dapat bertahan hidup 4 dan mati pada minggu ke-3. Pertumbuhan tanaman padi kontrol juga
Gambar 5 Pengaruh pemberian inokulan terhadap tinggi tanaman padi. Pengaruh pemberian cendawan pelarut P paling terlihat pada tanaman padi. Inokulan dapat meningkatkan ketahanan hidup padi pada lingkungan dengan kandungan Al, walaupun pertumbuhannya tidak optimum. Kematian dapat disebabkan oleh Padi termasuk tanaman yang Kehadiran Al dapat menyebabkan kemampuan akar tanaman padi menyerap hara lebih rendah dan akan mengalami defisiensi hara (Rusdiansyah 2001).
Pertumbuhan tanaman tidak saja dilihat dari tinggi tajuknya tetapi juga dari bobot keringnya. Tanaman tinggi yang tidak diimbangi dengan bobot kering yang baik belum tentu merupakan tanaman yang memiliki pertumbuhan yang baik karena pertambahan tinggi tajuk juga dapat disebabkan oleh etiolasi. Bergantung p
tanamannya, perbedaan inokulan mempengaruhi tinggi tajuk dan bobot kering tanaman pada minggu ke-4 (Gambar 6, 7 dan 8). Pada tanaman jagung, pemberian inokulan tidak berpengaruh nyata terhadap tinggi
kering tajuk, kecuali pemberian A.
menurunkan bobot kering tanaman (Gambar 6). Pada tanaman sorgum, pemberian inokulan
Penicillium spp. meningkatkan bobot kering
tanaman dan sebaliknya pemberian
menekan pertumbuhan tanaman sorgum (Gambar 7). Penicillium sp. IPBCC 09.620 meningkatkan tinggi tajuk dan bobot kering tanaman sorgum secara signifikan dibandingkan dengan kontrol. Pada tanaman padi, pemberian inokulan bukan hanya meningkatkan tinggi tajuk dan bobot kering tanaman, tetapi juga meningkatkan ketahanan hidup tanaman (Gambar 8). Tanaman padi dengan pemberian inokulan A. niger memiliki tinggi tajuk yang paling tinggi akan tetapi tidak diimbangi dengan bobot kering yang baik, sehingga
disebabkan oleh terjadinya etiolasi.
Gambar 6 Pengaruh pemberian
terhadap tinggi dan bobot kering tanaman jagung.
Gambar 7 Pengaruh pemberian inokulan terhadap tinggi dan bobot kering tanaman sorgum.
3 4
Masa pertumbuhan minggu
ke-6 Pertumbuhan tanaman tidak saja dilihat dari
i bobot keringnya. yang tidak diimbangi dengan belum tentu merupakan tanaman yang memiliki pertumbuhan yang baik, karena pertambahan tinggi tajuk juga dapat Bergantung pada jenis perbedaan inokulan mempengaruhi tinggi tajuk dan bobot kering tanaman pada 4 (Gambar 6, 7 dan 8). Pada tanaman jagung, pemberian inokulan tidak ruh nyata terhadap tinggi dan bobot
A. niger yang
menurunkan bobot kering tanaman (Gambar 6). , pemberian inokulan spp. meningkatkan bobot kering tanaman dan sebaliknya pemberian A. niger menekan pertumbuhan tanaman sorgum
sp. IPBCC 09.620 meningkatkan tinggi tajuk dan bobot kering tanaman sorgum secara signifikan dibandingkan dengan kontrol. Pada tanaman padi, pemberian inokulan bukan hanya meningkatkan tinggi tajuk dan bobot kering tanaman, tetapi juga gkatkan ketahanan hidup tanaman padi
dengan pemberian memiliki tinggi tajuk yang paling tinggi akan tetapi tidak diimbangi dengan sehingga mungkin disebabkan oleh terjadinya etiolasi.
Gambar 6 Pengaruh pemberian inokulan terhadap tinggi dan bobot kering
Pengaruh pemberian inokulan terhadap tinggi dan bobot kering
Gambar 8 Pengaruh pemberian inokulan terhadap tinggi dan bobot kering tanaman padi.
Pemberian inokulan pada tanaman secara umum tidak memberikan pengaruh yang signifikan terhadap pertumbuhan tanaman dibandingkan dengan kontrol
efektifnya pemberian inokulan terhadap pertumbuhan tanaman mungkin disebabkan baik tanaman maupun cendawan pelarut P mengalami keracunan Al. Al3+
bentuk Al yang paling meracuni bagi tanaman. Bagian apeks akar merupakan bagian akar yang paling tinggi mengalami akumulasi Al (Delhaize & Ryan 1995). Masuknya Al ke dalam akar dapat menghambat penyerapan Ca yang dibutuhkan untuk pembentukan dinding sel (Vardar & Unal 2007). Akumulasi Al pada tanaman akan menghambat proses pemanjangan akar. Terhambatnya proses peman
ini dapat menyebabkan unsur hara yang dapat diserap oleh akar menjadi kurang
berpengaruh terhadap pertumbuhan tinggi dan bobot kering tajuk. Sistem pertahanan tanaman terhadap keberadaan Al dapat melalui produksi asam-asam organik sebagai pengelat dikeluarkan melalui eksudat akar untuk menghindari Al masuk ke dalam sel, sebagian Al dapat masuk ke dalam sel. masuk ke dalam sel akan disimpan di dalam vakuola (Vadar & Unal 2007).
organik yang dihasilkan tanama
mungkin kurang efektif untuk mengatasi keberadaan Al. Jenis asam organik yang dihasilkan tanaman berbeda-beda untuk setiap jenis tanaman (Walker et al. 2003).
Al pada lingkungan mikrob juga dapat menghambat pertumbuhan dan aktivitas enz yang dihasilkan. Ion Al3+ dapat menurunkan
pertumbuhan cendawan (Siham 2007)
Pemberian inokulan pada tanaman sorgum dan padi memperlihatkan hasil tinggi dan bobot kering tajuk yang berbeda nyata dari tanaman kontrol, bahkan dapat meningkatkan ketahanan hidup tanaman padi. Hal ini dapat disebabkan oleh aktivitas inokulan melarutkan
kebutuhan tanaman dan zat pengatur tumbuh Pengaruh pemberian inokulan terhadap tinggi dan bobot kering emberian inokulan pada tanaman jagung tidak memberikan pengaruh yang signifikan terhadap pertumbuhan tanaman
bandingkan dengan kontrol. Kurang inokulan terhadap tanaman mungkin disebabkan baik tanaman maupun cendawan pelarut P merupakan l yang paling meracuni bagi tanaman. Bagian apeks akar merupakan bagian akar yang akumulasi Al Masuknya Al ke dalam akar dapat menghambat penyerapan Ca2+
yang dibutuhkan untuk pembentukan dinding Akumulasi Al pada tanaman akan menghambat proses pemanjangan Terhambatnya proses pemanjangan akar dapat menyebabkan unsur hara yang dapat diserap oleh akar menjadi kurang, sehingga berpengaruh terhadap pertumbuhan tinggi dan Sistem pertahanan tanaman terhadap keberadaan Al dapat melalui produksi agai pengelat yang dikeluarkan melalui eksudat akar untuk menghindari Al masuk ke dalam sel, namun sebagian Al dapat masuk ke dalam sel. Al yang kan disimpan di dalam 2007). Asam-asam organik yang dihasilkan tanaman jagung mungkin kurang efektif untuk mengatasi Jenis asam organik yang beda untuk setiap 2003). Keberadaan Al pada lingkungan mikrob juga dapat menghambat pertumbuhan dan aktivitas enzim dapat menurunkan (Siham 2007).
Pemberian inokulan pada tanaman sorgum dan padi memperlihatkan hasil tinggi dan bobot kering tajuk yang berbeda nyata dari tanaman kontrol, bahkan dapat meningkatkan ketahanan Hal ini dapat disebabkan oleh aktivitas inokulan melarutkan P untuk kebutuhan tanaman dan zat pengatur tumbuh
yang mungkin dihasilkan oleh inokulan. diketahui bahwa Aspergillus niger
menghasilkan auksin dan giberelin (
2008) dan Penicillium spp. menghasilkan hormon pertumbuhan giberelin (Hasan 20 Bertambahnya P tersedia bagi tanaman dan zat pengatur tumbuh yang dihasilkan inokulan dapat meningkatkan pengambilan unsur hara tanaman, sehingga pertumbuhannya lebih baik dibandingkan tanaman kontrol.
Pengaruh Pemberian Inokulan Penampakan Fisik Tanaman
Pemberian AlPO4 sebagai sumber P dan
inokulan cendawan ternyata berpengaruh terhadap penampakan fisik tanaman. Daun padi baik dengan atau tanpa pemberian inokulan menunjukkan gejala bercak kuning pada daunnya (Gambar 9a). Hal ini menunjukkan bahwa tanaman padi mengalami keracunan Al. Keracunan Al pada tanam
menyebabkan penurunan aktivitas fotosintesis melalui penurunan pembukaan stomata, sehingga terjadi klorosis dan nekrosis pada daun (Vardar & Unal 2007). Pada pan
jagung dan sorgum, terdapat bercak cokelat (Gambar 9b dan 9c). Akar tanaman yang diberi inokulan memiliki ujung akar yang agak membengkak dan berwarna kecokelatan (Gambar 9d).
Gambar 9 Pengaruh pemberian Al dan inokulan terhadap fisik tanaman, a) daun padi dengan bercak kuning, b) bercak cokelat pada batang jagung dengan pemberian Penicillium sp
cokelat pada batang sorgum dengan pemberian Penicillium sp
akar jagung dengan pemberian
Penicillium sp. agak membengkak
dan berwarna cokelat. a
c
7 yang mungkin dihasilkan oleh inokulan. Telah
Aspergillus niger
asilkan auksin dan giberelin (Bilkay et al. menghasilkan Hasan 2002). Bertambahnya P tersedia bagi tanaman dan zat pengatur tumbuh yang dihasilkan inokulan dapat meningkatkan pengambilan unsur hara tanaman, sehingga pertumbuhannya lebih baik
mberian Inokulan Terhadap
sebagai sumber P dan inokulan cendawan ternyata berpengaruh terhadap penampakan fisik tanaman. Daun padi baik dengan atau tanpa pemberian inokulan bercak kuning pada Hal ini menunjukkan bahwa tanaman padi mengalami keracunan Al. Keracunan Al pada tanaman dapat itas fotosintesis melalui penurunan pembukaan stomata, dan nekrosis pada daun Pada pangkal batang jagung dan sorgum, terdapat bercak cokelat c). Akar tanaman yang diberi inokulan memiliki ujung akar yang agak membengkak dan berwarna kecokelatan
Gambar 9 Pengaruh pemberian Al dan inokulan terhadap fisik tanaman, a) daun padi dengan bercak kuning, b) bercak cokelat pada batang jagung dengan sp. c) bercak cokelat pada batang sorgum dengan sp., d) ujung r jagung dengan pemberian sp. agak membengkak
b
d d
8 Bercak nekrosis yang ada pada tanaman padi
merupakan tanda bahwa tanaman padi baik tanaman kontrol maupun tanaman dengan inokulan mengalami keracunan Al. Cendawan pelarut P menghasilkan asam-asam organik untuk membantu melepaskan P dari Al agar P dapat dimanfaatkan oleh tanaman. Asam organik yang dihasilkan oleh cendawan untuk mengelat Al merupakan jenis asam lemah. Kompleks asam organik dengan Al mungkin putus, sehingga Al kembali terlepas dan dapat meracuni tanaman atau dapat mengelat kembali P yang telah dibebaskan oleh asam organik dari AlPO4. Asam organik dapat melarutkan mineral
melalui reaksi hidrolisis, asidolisis, dan kompleksolisis. Sifat asam organik dalam pelarutan mineral ditentukan oleh gugus karboksil dan gugus hidroksil fenolatnya. Jumlah gugus karboksil menentukan jumlah proton yang dapat dilepas. Terlepasnya proton dari asam organik dipengaruhi oleh pH yang dapat dilihat dari nilai pKa-nya. Apabila pH lingkungan lebih tinggi dari pKa-nya maka proton akan terlepas (Ismangil & Hanudin 2005).
Tanaman jagung sorgum, dan padi yang diinokulasikan A. niger mengalami kematian setelah minggu ke-4. Menurut Peterson et al. (2008), interaksi akar dengan mikrob asal tanah dapat bersifat merugikan, netral, atau menguntungkan bagi pertumbuhan tanaman. Oleh sebab itu, A. niger merupakan cendawan yang bersifat endosimbion yang dalam keadaan tertentu dapat mematikan inang. Handayani (2011) juga melaporkan bahwa Aspergillus sp. merupakan cendawan patogen bagi tanaman Z.
mays dan S. selanica. Inokulasi A. niger pada
jagung menyebabkan kerusakan akar dan daun. Gejala yang ditimbulkan yaitu layu daun dan busuk akar. Cendawan hidup di jaringan tanaman dapat bersifat biotrofik dan nekrotrofik atau keduanya. Cendawan biotrofik hidup pada jaringan tanaman dan mendapatkan nutrisi tanpa menyebabkan kematian. Sedangkan cendawan nekrotrofik mematikan sel dan menyerap nutrisi dari jaringan mati (Carlile et al. 2001).
Pengaruh Pemberian Inokulan Terhadap Serapan Hara Tanaman
Analisis serapan N, P, dan K dilakukan pada tanaman umur delapan minggu oleh Balai Penelitian Tanah Bogor secara komposit. Analisis tanaman hanya dilakukan terhadap tanaman jagung dan sorgum dengan pemberian inokulan Penicillium spp. dan tanaman kontrol. Tanaman jagung, sorgum, dan padi yang diinokulasikan A. niger mengalami kematian setelah minggu ke-4, sehingga tidak dilakukan analisis. Semua tanaman padi tidak dianalisis. Tanaman padi dengan inokulan Penicillium sp. IPBCC 09.620 mati setelah minggu ke-4, sedangkan tanaman padi kontrol mati sebelum minggu ke-4. Tanaman padi dengan inokulan
Penicillium sp. IPBCC 09.621 dapat hidup
hingga minggu ke-8 setelah tanam, namun bobot kering tanaman tidak mencukupi untuk dilakukan analisis serapan hara di Balai Penelitian Tanah Bogor.
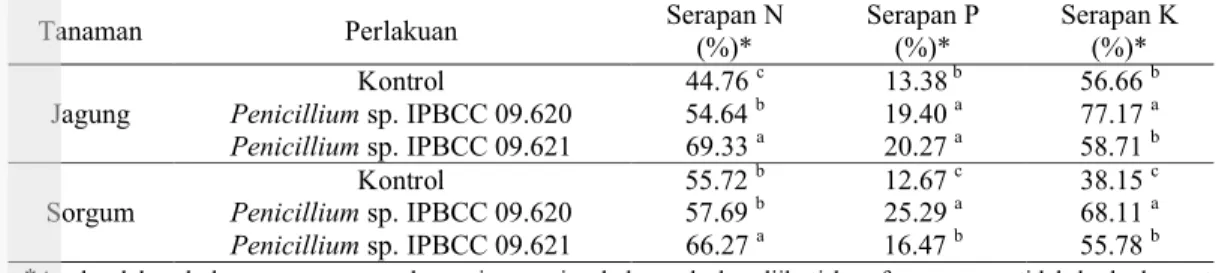
Hasil analisis serapan hara menunjukkan bahwa perbedaan inokulan mempengaruhi serapan unsur N, P, dan K tanaman (Tabel 2). Secara umum, pemberian Penicillium spp. berpengaruh nyata dalam penyerapan unsur hara dibandingkan dengan tanaman kontrol (Tabel 2). Pemberian Penicillium spp. pada tanaman jagung dan sorgum meningkatkan serapan P. Serapan P pada tanaman sorgum dengan pemberian Penicillium sp. IPBCC 09.620 lebih tinggi dibandingkan dengan Penicillium sp. IPBCC 09.621, sedangkan untuk tanaman jagung tidak ada perbedaan pada kedua inokulan (Tabel 2). Meningkatnya penyerapan P pada tanaman relatif akan meningkatkan penyerapan N dan K (Tabel 2). Peningkatan serapan hara tanaman berkaitan dengan peningkatan pertumbuhan tanaman yang telah dijelaskan sebelumnya. Serapan hara yang baik pada tanaman dengan inokulan Penicillium spp. membuat pertumbuhan tinggi dan bobot keringnya secara umum lebih baik dibandingkan dengan tanaman kontrol.
9
*Angka dalam kolom yang sama pada masing-masing kelompok dan diikuti huruf yang sama tidak berbeda nyata berdasarkan uji jarak berganda Duncan, α = 0.05. BK = bobot kering, tan = tanaman, jar = jaringan.
Tujuan penambahan cendawan pelarut fosfat adalah untuk membantu penyerapan unsur hara terutama unsur P yang sering menjadi unsur pembatas bagi serapan hara karena kondisinya yang terikat. Tanaman tidak dapat menyerap P dalam bentuk terikat dan harus diubah menjadi bentuk yang tersedia bagi tanaman. Mikrob pelarut P melepaskan P dari pengikatnya dengan produksi asam-asam organik. Cendawan seperti
A. niger dan Penicillium sp. telah diketahui
menghasilkan asam-asam organik. Keduanya telah diketahui mampu menghasilkan asam organik berupa asam oksalat, asam sitrat asam glukonat, dan asam suksinat (Khan et al. 2006).
Penicillium bilaii melarutkan P terikat dengan
memproduksi asam sitrat dan asam oksalat (Cunningham & Kuiack 1992). Asam-asam organik seperti asam sitrat, asam suksinat, dan asam oksalat dapat menggantikan kedudukan anion P, dan mengelat kation-kation seperti Ca, Al, dan Fe membentuk senyawa kompleks. Keberadaan Al dapat membuat mobilisasi P di jaringan akar terhambat (Gaume et al. 2001).
Persentase serapan hara merupakan persentase unsur hara yang diserap tanaman dari unsur hara yang telah diberikan. Tanaman dengan pemberian inokulan Penicillium spp. memiliki persentase serapan P yang lebih baik dibandingkan dengan tanaman kontrol serta penyerapan N dan K tanaman juga relatif lebih tinggi dibandingkan dengan tanaman kontrol (Tabel 3). Persentase serapan N, P, dan K berbeda-beda untuk tiap tanaman dan inokulan. Pada tanaman jagung, persentase serapan N dengan inokulan Penicillium sp. IPBCC 09.621 (69.33%) berbeda nyata dari tanaman jagung
dengan Penicillium sp IPBCC 09.620 (54.64%), dan keduanya berbeda nyata dari tanaman kontrol (44.76%). Persentase serapan P pada tanaman dengan inokulan Penicillium sp. IPBCC 09.620 (19.40%) tidak berbeda nyata dari tanaman dengan inokulan Penicillium sp. IPBCC 09.621 (20.27%), namun keduanya berbeda nyata dengan serapan P pada tanaman kontrol (13.38%). Persentase serapan K pada tanaman dengan inokulan Penicillium sp. IPBCC 09.620 (77.17%) berbeda nyata baik pada tanaman dengan inokulan Penicillium sp. IPBCC 09.621 (58.71%) maupun dengan tanaman kontrol (56.66%), sedangkan tanaman dengan inokulan Penicillium sp. IPBCC 09.621 dan tanaman kontrol tidak berbeda nyata. Pada tanaman sorgum, persentase serapan N dengan inokulan Penicillium sp. IPBCC 09.621 (66.27%) berbeda nyata dari tanaman dengan inokulan Penicillium sp IPBCC 09.620 (57.69%) dan tanaman kontrol (55.72%), sedangkan tanaman dengan inokulan
Penicillium sp. IPBCC 09.620 dan tanaman
kontrol tidak berbeda nyata. Persentase serapan P pada tanaman sorgum dengan inokulan
Penicillium sp. IPBCC 09.620 (25.29%)
berbeda nyata pada tanaman dengan inokulan
Penicillium sp. IPBCC 09.621 (16.47%), dan
keduanya berbeda nyata dengan serapan tanaman kontrol (12.67%). Persentase serapan K pada dengan inokulan Penicillium sp. IPBCC 09.620 (68.11%) berbeda nyata pada tanaman dengan inokulan Penicillium sp. IPBCC 09.621 (55.78%), dan keduanya berbeda nyata dengan serapan tanaman kontrol (38.15%).
Tanaman Perlakuan BK (g) % N Jar Serapan N* (mg/tan) % P Jar Serapan P* (mg/tan) % K Jar Serapan K* (mg/tan) Jagung Kontrol 0.72 3.41 24.45 c 0.15 1.08 b 4.01 28.80 b Penicillium sp. IPBCC 09.620 0.87 3.44 29.85 b 0.18 1.56 a 4.52 39.23 a Penicillium sp. IPBCC 09.621 1.17 3.25 37.88 a 0.14 1.63 a 2.56 29.83 b Sorgum Kontrol 0.85 3.58 30.45 b 0.12 1.02 c 2.28 19.39 c Penicillium sp. IPBCC 09.620 0.89 3.56 31.52 b 0.23 2.04 a 3.91 34.62 a Penicillium sp. IPBCC 09.621 1.02 3.55 36.21 a 0.13 1.33 b 2.78 28.35 b
10 Tabel 3 Pengaruh pemberian inokulan terhadap persentase serapan N, P, dan K
*Angka dalam kolom yang sama pada masing-masing kelompok dan diikuti huruf yang sama tidak berbeda nyata berdasarkan uji jarak berganda Duncan, α = 0.05.
Tabel 4 Efisiensi serapan N, P dan K
Persentase serapan P paling tinggi pada tanaman sorgum yaitu tanaman dengan pemberian inokulan Penicillium sp. IPBCC 09.620, yaitu sebesar 25.29% (Tabel 3). Kedua galur Penicillium spp. memiliki perbedaan perilaku pada kemampuan membantu penyerapan N dan K tanaman. Penicillium sp. IPBCC 09.620 cenderung meningkatkan serapan K, sedangkan Penicillium sp. IPBCC 09.621 meningkatkan serapan N (Tabel 3). Hal ini menunjukkan bahwa terdapat keragaman antar galur Penicillium sp. dalam membantu penyerapan unsur hara pada tanaman.
Efisiensi serapan unsur hara merupakan perbandingan persentase serapan tanaman dengan pemberian inokulan terhadap persentase serapan tanaman kontrol. Efisiensi serapan menggambarkan seberapa efektif inokulan membantu penyerapan nutrisi bagi tanaman. Hasil penelitian menunjukkan bahwa kedua inokulan dapat meningkatkan serapan P tanaman dari sumber P terikat AlPO4.
Penicillium sp. IPBCC 09.620 meningkatkan
serapan P 2.00 kali lebih besar dibandingkan dengan tanaman kontrol pada sorgum dan 1.45 kali pada tanaman jagung (Tabel 4). Pemberian
Penicillium sp IPBCC 09.621 meningkatkan
serapan P sebesar 1.52 kali untuk jagung dan 1.30 kali untuk sorgum dibandingkan dengan tanaman kontrol (Tabel 4). Selain itu, penambahan Penicillium sp. IPBCC 09.620 pada tanaman jagung meningkatkan penyerapan N sebanyak 1.22 kali dan meningkatkan serapan K sebanyak 1.36 kali dibandingkan dengan kontrol, sedangkan pada sorgum meningkatkan penyerapan N 1.04 kali dan meningkatkan serapan K 1.79 kali lebih efisien dibandingkan
dengan kontrol. Penambahan Penicillium sp. IPBCC 09.621 pada tanaman jagung, meningkatkan serapan N sebesar 1.55 kali dan serapan K 1.04 kali dari tanaman kontrol, serta pada tanaman sorgum meningkatkan serapan N sebesar 1.19 kali dan serapan K sebesar 1.46 kali dari tanaman kontrol.
Rendahnya serapan hara pada tanaman kontrol mungkin disebabkan tanaman teracuni Al. Permukaan akar adalah bagian yang mengalami kontak langsung dengan keberadaan Al. Interaksi Al dengan dinding sel dapat merubah struktur dinding sel dan membran sel, sehingga akan mengganggu pertukaran kation yang dibutuhkan oleh tanaman. Penyerapan Ca2+ akan menjadi terhambat dengan
keberadaan Al. Ca2+ merupakan kation yang
dibutuhkan untuk pembentukan dinding sel. Terganggunya proses pembentukan dinding sel dan membran sel akan mempengaruhi proses pembelahan sel. Terganggunya proses perkembangan sel-sel akar akan menyebabkan terhambatnya pertumbuhan akar dan penyerapan unsur hara (Vardar & Unal 2007). Keberadaan Al dalam konsentrasi tinggi juga dapat membentuk lapisan yang menutupi epidermis di bagian ujung akar, sehingga akan menghambat penyerapan unsur hara (Firmansyah 2010).
SIMPULAN DAN SARAN Simpulan
A. niger dan Penicillium spp. dapat hidup
sebagai endosimbion akar jagung, sorgum, dan padi. Pemberian inokulan mempengaruhi pertumbuhan tanaman. Asosiasi A. niger dengan
Tanaman Perlakuan Serapan N (%)* Serapan P (%)* Serapan K (%)*
Jagung Kontrol 44.76 c 13.38b 56.66 b Penicillium sp. IPBCC 09.620 54.64 b 19.40 a 77.17 a Penicillium sp. IPBCC 09.621 69.33 a 20.27 a 58.71 b Sorgum Kontrol 55.72 b 12.67 c 38.15 c Penicillium sp. IPBCC 09.620 57.69 b 25.29 a 68.11 a Penicillium sp. IPBCC 09.621 66.27 a 16.47 b 55.78 b
Tanaman Perlakuan Serapan NEfisiensi Serapan PEfisiensi Serapan KEfisiensi Jagung Penicillium sp. IPBCC 09.620Penicillium sp. IPBCC 09.621 1.221.55 1.451.52 1.361.04 Sorgum Penicillium sp. IPBCC 09.620Penicillium sp. IPBCC 09.621 1.041.19 2.001.30 1.791.46
11 akar tanaman tersebut memberi dampak negatif
bagi tanaman inangnya, sebaliknya Penicillium spp. adalah endosimbion pelarut P yang berdampak positif seperti meningkatkan serapan P. Penicillium sp. IPBCC 09.620 membantu penyerapan P paling baik, yaitu 25.29% dari jumlah P yang diberikan, dan meningkatkan efisiensi serapan P dua kali lebih baik dibandingkan dengan kontrol. Rendahnya nilai serapan hara tanaman kontrol jagung dan sorgum, serta kematian tanaman padi mungkin disebabkan oleh keberadaan Al.
Saran
Penicillium sp. IPBCC 09.620 dapat digunakan sebagai agen pupuk hayati, sehingga perlu diteliti lebih lanjut untuk diketahui kemampuannya dalam meningkatkan pertumbuhan tanaman di lapangan.
DAFTAR PUSTAKA
Bilkay IS, Karakoç S, Aksöz N. 2008. Indole-3-acetic acid and gibberellic acid
production in Aspergillus niger. Turk J
Biol 34: 313-318.
Carlile MJ, Watkinson SC, Gooday GW. 2001.
The Fungi. London: Academic Press.
Cunningham JE, Kuiack C. 1992. Production of citric and oxalic acids and solubilization of calcium phosphate by Penicillium
bilaii. Appl Environ Microbiol 58:
1451-1458.
Delhaize E, Ryan PR. 1995. Aluminium toxocity and tolerance in plant. Plant
Physiol 107: 315- 321.
Das K, Dang R, Shivananda TN. 2008. Influence of bio-fertilizers on the availability of nutrients (N, P and K) in soil in relation to growth and yield of
Stevia rebaudiana grown in South India. Int J Appl Res Nat Product 1: 20-24.
El-Azouni IM. 2008. Effect of phosphate solubilizing fungi on growth and nutrient uptake of soybean (Glycine max L.) plants. J Appl Sci Res 4: 592-598. Firmansyah MA. 2010. Respon tanaman
terhadap aluminium the responseof crop to aluminium. Agripura 6: 807-818. Gandjar I, Sjamsuridzal W, Oetari A. 2006.
Mikologi Dasar dan Terapan. Jakarta:
Yayasan Obor Indonesia.
Gaume A, Mächler F, Frossard E. 2001. Aluminium resistance in two cultivar of
Zeamays L.: root exudation of organic
acid and influence of phosphorus nutrition. Plant and Soil 234: 73-81. Gupta RP, Kalia A, Kapoor S. 2007.
Bioinoculants A Step Towards
Sustainable Agriculture. New Delhi:
New India Publishing Agency.
Handayani D. 2011. Potensi Aspergillus dan
Penicillium asal serasah dipterocarp
sebagai endosimbion akar pelarut fosfat [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Hasan HAH. 2002. Gibberellin and auxin production by plant root-fungi and their biosynthesis under salinity-calcium interaction. Rostliná Výroba 48: 101-106. Ismangil, Hanudin E. 2005. Degradasi mineral
batuan oleh asam-asam organik. J Ilm
Tanah dan Lingkungan 5: 1-17.
Jumpponen A, Trappe JM. 1998. Dark septate endophytes: a review of facultative biotropic root colonizing fungi. New
Phytol 140: 295-310.
Khan MS, Zaisi A, Wani PA. 2006. Role of phosphate-solubilizing microorganisms in sustainable agriculture - A review.
Agron Sustain 27: 29-43.
Kormanick PP, Mc Graw AC. 1982.
Quantification of Vesicular-Arbuscular Mycorrhiza in Plant Roots. St Paulus:
The American Phytophatology Society. Niswati A, Yusnaini S, Arif MAS. 2008.
Populasi mikroba pelarut fosfat dan P-tersedia pada rizosfer beberapa umur dan jarak dari pusat perakaran jagung (Zea
mays L.). J Tanah Trop 13:123-130.
Paul IK, Savithri KE. 2003. Effect of biofertilizers vs perfected chemical fertilization for sesame grown in summer rice fallow. J Trop Agric 41: 47-49. Presiden Republik Indonesia. 1997. Keputusan
Presiden Republik Indonesia Nomor 23 Tahun 1997 tentang Pengelolaan Lingkungan Hidup. Jakarta: Presiden RI.
Peterson RL, Wagg C, Pautler M. 2008. Association between microfungal endophytes and roots: do structural features indicates function. Botany 86: 445-456.
12 R’bia O, Horchani F, Smida I, Mejri M,
Aschi-Smiti S. 2001. Aluminium phytotoxicity and plant acclimation to acidic soils. Int J
Agric Res 6: 194-208.
Radji M. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah ilmu kefarmasian 2(3).
Rout GR, Samantaray S, Das P. 2000. Aluminium toxicity in plants: a review.
Agronomie 21: 3-21.
Rusdiansyah, Rohaeni N, Trikoesoemaningtyas. 2001. Evaluasi beberapa kultivar padi Gogo asal Kalimantan untuk ketahanan terhadap aluminium menggunakan metode kultur hara. Bul Agron 29: 73-77. Siham AA. 2007. Soil analysis of contaminated
soil from Riyadh City, Saudi Arabia and influence of aluminium and cobalt ion on the growth of fungi isolated. J Biol Sci 7: 549-553.
Simanungkalit RDM, Suriadikarta DA, Saraswati R, Setyorini D, Hartatik W, editor. 2006. Pupuk Organik dan Pupuk
Hayati Organic Fertilizer and
Biofertilizer. Bogor: Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian.
Suliasih, Rahmat. 2006. Aktivitas fosfatase dan pelarutan kalsium fosfat oleh beberapa bakteri pelarut fosfat. Biodiversitas 8: 23-26.
Suryanarayanan TS, Vijaykrishna D. 2001. Fungal endophytes of aerial roots of
Ficus benghalensis. Fungal Diversity
8:155-161.
Vardar F, Unal M. 2007. Aluminium toxicity and resistance in higher plants. Adv in
Mol Biol 1: 1-12.
Walker ST, Bais HP, Grotewold E, Vicanco JM. 2003. Root exudation and rhizosphere biology. Plant Physiol 132: 33-51.
13
14
Lampiran 1 Larutan Hoagland modifikasi Larutan stok terdiri atas:
a. Hara makro
Ca(NO3)2 164.11 g/L
KNO3 101.1 g/L
AlP 58 g/L
MgSO4.7H2O 246.5 g/L
b. Hara mikro (dicampur dalam 1 liter aquades) H3BO3 2.86 g MnCl.4H2O 1.81 g ZnCl2 0.11 g CuCl2H2O 0.05 g Na2MoO4 0.025 g c. Fe EDTA 2Na.EDTA 10.4 g/L FeSO4.7H2O 7.8 g/L KOH 56.1 g/L
Larutan kerja dibuat dengan mencampur ketiga jenis larutan stok dengan dosis sebagai berikut: 5 mL Ca(NO3)2 5 mL KNO3 1 mL AlPO4 2 mL MgSO4.7H2O 1 mL hara mikro 1 mL FeEDTA
Akuades hingga volume 1 L
Larutan Hoagland terpakai per tanaman 260 mL, maka komposisi larutan stok adalah: 1.30 mL Ca(NO3)2
1.30 mL KNO3 0.52 mL MgSO4 0.26 mL AlP
Massa N total = massa NCa(NO3)2+ massa NKNO3
= (mol N x mol Ca(NO3)2x BM N) + (mol N x mol KNO3x BM N)
= (2 x 1.3x10-3x 14.01) + (1 x 1.3 x10-3x 14.01)
= 0.036426 + 0.018213 = 0.054639 g
= 54.639 mg Massa P total = massa PAlPO4
= (mol P x mol AlPO4x BM P)
= (1 x 2.6x10-4x 30.97)
= 0.0080522 g = 8.0522 mg Massa K = massa KKNO3
= (mol K x mol KNO3x BM K)
= (1 x 1.3 x10-3x 39.10)
= 0.05083 g = 50.83 mg
15 Lampiran 2 Prosedur analisis N, P, dan K pada tanaman
a. Analisis kandungan N pada tanaman dilakukan dengan metode N Kjeldahl
Sebanyak 0.250 g contoh tanaman dimasukan ke tabung digestion, ditambahkan 1 g campuran selen (siap pakai) dan 2.5 mL H2SO4.
Campuran diratakan dan didiamkan selama satu malam. Blanko dibuat dengan cara yang sama tanpa contoh tanaman. Campuran kemudian dipanaskan hingga suhu 350oC.
Proses selesai jika telah keluar asap putih dan didapat ekstrak jernih.
Tabung diangkat dan didinginkan. Ekstrak kemudian diencerkan dengan air bebas ion hingga tepat 50 mL, dikocok hingga homogen dan didiamkan semalam agar partikel mengendap.
Ekstrak contoh dipipet 1 mL ke dalam tabung reaksi ditambahkan dengan 9 mL air bebas ion, kemudian dikocok.
Ekstrak encer sebanyak 2 mL dipipet ke tabung baru, ditambahkan tartrat dan Na-fenat masing-masing 4 mL, lalu dikocok dan dibiarkan selama 10 menit.
Campuran dimbahkan 4 mL NaOCl 5%, dikocok dan diukur dengan spetrofotometer pada panjang gelombang 636 nm 10 menit setelah pemberian pereaksi ini.
b. Analisis kandungan P dan K pada tanaman dilakukan dengan metode pengabuan basah
Contoh tanaman sebanyak 0.5 g dimasukan ke dalam tabung digestion, ditambahkan 5 mL asam nitrat dan asam perklorat, didiamkan 1 malam.
Campuran kemudian dipanaskan hingga suhu 100oC selama 1 jam 30 menit, kemudian suhu
ditingkatkan menjadi 130oC selama 1 jam, kemudian 150oC selama 2 jam 30 menit, setelah asap
kuning habis suhu ditingkatkan kembali hingga 170oC selama 1 jam, kemudian 200oC selama 1
jam.
Proses selesai setelah adanya asap putih yang keluar, dan sisa ekstrak sekitar 0.5 mL.
Ekstrak didinginkan dan diencerkan dengan air bebas ion menjadi 50 mL, dikocok hingga homogen dan dibiarkan semalam.
o Pengukuran kadar P
Sebanyak 1 mL ekstrak dimasukan ke dalam tabung reaksi, ditambahkan 9 mL air bebas ion dan dikocok. Masing-masing 1 mL ekstrak encer dan deret standar P dimasukan ke tabung reaksi dan ditambahkan pewarna P kemudian dikocok hingga homogen dan dibiarkan 30 menit. P diukur dengan spektrofotometer pada panjang gelombang 889 nm.
o Pengukuran kadar K
Sebanyak 1 mL ekstrak dimasukan ke dalam tabung reaksi dan ditambahkan 9 mL larutan La 0.25% dan dikocok hingga homogen dan diukur dengan spektrofotometer serapan atom (SSA) dengan deret standar sebagai pembanding.