1
BAB I PENDAHULUAN
A. Latar Belakang
Dari tahun ke tahun, penyakit yang ada semakin kompleks dan obat-obat baru mulai banyak ditemukan. Pencarian dan penemuan obat baru, baik dari bahan alam maupun sintetik terus dilakukan untuk memperoleh obat dengan aktivitas terapi paling optimum dan efek samping paling minimum. Salah satu upaya yang dilakukan adalah mengetahui potensi aktivitas farmakologi, mekanisme aksi dan spesifitas tempat kerja suatu senyawa obat sehingga ke depannya dapat dimanfaatkan dengan lebih optimal.
Di antara banyak senyawa alam di Indonesia yang telah diketahui memiliki aktivitas farmakologis adalah kurkumin. Kurkumin dengan nama IUPHAC
1,7-bis(4’-hidroksi-3’-metoksifenil)-1,6-heptadien-3,5-dion adalah komponen utama
rimpang tanaman Curcuma sp. Curcuma sp. mengandung senyawa yang dikenal sebagai kurkuminoid, terdiri dari kurkumin, demetoksikurkumin dan
bisdemetoksikurkumin. Kurkumin telah banyak diteliti dan dipublikasikan memiliki aktivitas farmakologis antara lain antioksidan (Sardjiman, 2000), antiinfeksi (Sajithlal et al., 1998), antiinflamasi (Sardjiman, 1997), antibakteri (Sardjiman, 2000) dan antikanker (Bharti et al., 2003). Senyawa kurkumin selalu berada dengan dua substituen lain yang berbeda yaitu demetoksikurkumin dan
bisdemetoksikurkumin, sehingga untuk mendapatkan kurkumin dalam jumlah banyak sangat sulit dilakukan. Seiring dengan berkembangnya dunia penelitian,
telah disintesis senyawa analog kurkumin untuk dapat dikembangkan lebih lanjut. Senyawa analog kurkumin yang telah disintesis di Fakultas Farmasi UGM antara lain: Pentagamavunon-0 (PGV-0), PGV-1, PGV-2, Heksagamavunon-0 (HGV-0), HGV-1, Gamavuton-0 (GVT-0), mono-GVT-0, K2GVT-0 dan diasetil-GVT-0. Pentagamavunon-1 (PGV-1) dengan nama kimia 2,5-bis
(4’-hidroksi-3’,5’-dimetil-benziliden)-siklopentanon dan rumus molekul 23 24 O3 merupakan analog kurkumin dengan substituen inti aromatis berupa gugus 4-hidroksi dan 3,5-dimetil. Senyawa ini adalah modifikasi struktur kurkumin pada rantai tengahnya, gugus asetil-aseton diganti dengan siklopentanon. PGV-1 telah diuji aktivitas farmakologinya secara in vivo dan in vitro di Fakultas Farmasi UGM sebagai antioksidan, antibakteri, antiinflamasi melalui penghambatan siklooksigenase dan antikanker (Sardjiman, 2003; Meiyanto, 2006). Namun, potensi PGV-1 dan lead compound-nya (kurkumin) sebagai obat untuk brain disorder belum pernah digali karena dua senyawa ini memiliki kelarutan yang kurang baik di dalam cairan biologis dan tidak efektif dalam menembus blood brain barrier (BBB).
Untuk meningkatkan kelarutan dan bioavailibilitas kurkumin dan PGV-1 yang diharapkan mampu meningkatkan aktivitas farmakologi, maka dikembangkan teknologi formulasinya melalui pembuatan formulasi nanopartikel kurkumin dan nanopartikel PGV-1; metode self nano emulsfying drug delivery system
(SNEDDS) dengan kitosan sebagai pembawa. Uji in vitro dengan sel kanker menunjukkan bahwa sediaan nanokitosan kurkumin dan nanokitosan PGV-1 mampu menembus dinding sel kanker dan sel normal dengan lebih efektif sebagai antiinflamasi. Penelitian pendahuluan menunjukkan bahwa pemberian nanoemulsi
kurkumin secara per oral memberikan konsentrasi tinggi di dalam plasma darah dibandingkan kurkumin tanpa formulasi nanopartikel (Mancuso et al., 2011). Nanokitosan kurkumin memiliki aktivitas antiinflamasi lebih tinggi dibandingkan dengan senyawa aslinya (senyawa tanpa formulasi nanopartikel) (Yin et al., 2011). Selain itu juga diketahui bahwa nanokitosan kurkumin dan nanokitosan PGV-1 mampu menembus BBB dilihat dari struktur molekulnya yang bersifat non-polar dan lipofil. Penelitian yang dilakukan ini dapat memberikan data praklinik dari senyawa uji yang digunakan, mengingat untuk menjadi obat brain disorder diperlukan tinjauan dari data uji praklinik dan uji klinik senyawa bersangkutan. Potensi nanokitosan kurkumin dan nanokitosan PGV-1 sebagai kandidat brain disorders treatment agent baru dapat dilihat dari aktivitas antioksidan dan kemampuannya menembus BBB. Nanokitosan kurkumin dan nanokitosan PGV-1 akan menambah daftar senyawa obat untuk penyakit pada SSP yang selama ini masih sangat terbatas dalam hal jumlah maupun jenisnya.
Hasil penelitian ini diharapkan memberikan kontribusi terhadap penemuan dan pengembangan obat baru berbasis struktur kurkumin yaitu sebagai brain disorder treatment agent baru berupa kontribusi ketersediaan data uji praklinik senyawa kurkumin dan PGV-1 sebagai brain disorder treatment agent model uji: penurunan fungsi kognitif dan gangguan interaksi sosial pada mencit.
B. Rumusan Masalah
Berdasarkan uraian latar belakang masalah di atas, maka pada penelitian ini dirumuskan permasalahan sebagai berikut:
1. Apakah pemberian nanokitosan kurkumin dan nanokitosan PGV-1 mempunyai pengaruh terhadap fungsi kognitif dan gangguan interaksi sosial pada mencit jantan dewasa yang diinduksi etanol?
2. Bagaimana pengaruh pemberian nanokitosan kurkumin dan nanokitosan PGV-1 dalam variasi dosis tertentu pada fenotipe penurunan fungsi kognitif dan gangguan interaksi sosial dari brain disorders?
C. Tujuan Penelitian
1. Untuk mengetahui pengaruh pemberian nanokitosan kurkumin dan nanokitosan PGV-1 terhadap fungsi kognitif dan gangguan interaksi sosial pada mencit jantan dewasa yang diinduksi etanol.
2. Untuk mengetahui dosis pemberian nanokitosan kurkumin dan nanokitosan PGV-1 yang memberikan pengaruh terhadap fenotipe brain disorders yang berupa penurunan fungsi kognitif dan gangguan interaksi sosial pada mencit jantan dewasa yang diinduksi etanol.
D. Tinjauan Pustaka
1. Kurkumin
Kurkumin dengan nama IUPHAC 1,7-bis
(4’-hidroksi-3’-metoksifenil)-1,6-heptadien-3,5-dion adalah komponen utama rimpang tanaman Curcuma sp.
Curcuma sp. adalah anggota Zingiberaceae yang berasal dari Asia Tenggara (Sardjiman, 1997; Chattopadhyay et al., 2004). Curcuma sp. mengandung
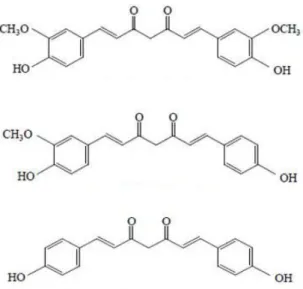
senyawa yang dikenal sebagai kurkuminoid, terdiri dari kurkumin, demetoksikurkumin dan bisdemetoksikurkumin dengan struktur molekul seperti terlihat pada gambar 1 (Sardjiman, 2000; Jurenka, 2009).
Gambar 1. Struktur kurkumin (1), demetoksikurkumin (2) dan bisdemetoksikurkumin (3) (Sardjiman, 2000)
Penelitian tentang kurkumin sebagai bahan aktif untuk berbagai penyakit telah banyak dilakukan selama dua dekade belakangan ini. Di antara penelitian-penelitian tersebut antara lain melaporkan tentang efek kurkumin sebagai antioksidan (Sardjiman, 2000), antiinfeksi (Sajithlal et al., 1998), antiinflamasi (Sardjiman, 1997), antibakteri (Sardjiman, 2000), antikolesterol (Bourne et al., 1999), antikanker (Bharti et al., 2003) dan anti HIV (Mazumder etal., 1997). Kurkumin yang diisolasi dari Curcuma sp. sangat potensial sebagai antioksidan dikarenakan oleh gugus fenolik dan 1,3-diketon. Antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi oksidasi radikal bebas dalam oksidasi lipid (Buck, 1991). Senyawa antioksidan alami polifenolik ini bersifat multifungsional dan dapat berfungsi sebagai penangkal radikal bebas seperti superoksida dan radikal hidroksil, pengkelat logam seperti besi,
menghambat aktivitas enzim oksidatif seperti sitokrom P450 dan peredam terbentuknya oksigen radikal (Majeed et al., 1995). Aktivitas antioksidan gugus fenolik ditunjukkan dengan adanya penghambatan lipid peroksidasi dan penangkal radikal bebas seperti 1,1’-diphenyl picryl hydrazyl (DPP ) dan 2,2’-azinobis (3-ethyl-benthiazoline-6-sulphonic acid (ABTS+) (Sardjiman, 1997; Venkatesan et al., 2003).
Sifat kurkumin dalam menghambat peroksidasi lipid yang terinduksi oleh berbagai agen selular atau zat asing sangat berperan dalam mekanisme aktivitas kurkumin sebagai antiinflamasi, antitumor dan aktivitas farmakologi lainnya (Nurrochmad, 2004). Aktivitas antiinflamasi kurkumin dikaitkan dengan ekspresi berlebih dari enzim siklooksigenase tipe 2 (COX-2) terutama pada sel kanker kolon, kanker paru-paru dan kanker payudara (Aggarwal et al., 2005). Aktivitas antiinflamasi dari kurkumin selain melalui penghambatan enzim COX dapat juga melalui enzim lipoksigenase (LOX) (Nurrochmad, 2004). Dengan adanya penghambatan terhadap enzim COX, maka produksi berlebih prostanoid dapat dicegah dan akan mengurangi efek inflamasi atau mengurangi proliferasi sel kanker dan mempercepat proses apoptosis (Nurrochmad, 2004). Penghambatan enzim LOX akan mengurangi produk LOX seperti asam hidroksieikosatetraenat yang terbukti memacu penyebaran sel kanker dan berpotensi merangsang terjadinya metastasis (Nurrochmad, 2004).
Kurkumin mampu menghambat proliferasi pada beberapa jenis sel tumor termasuk di antaranya sel B dan sel T Leukemia, kanker kolon dan epidemoid carcinoma cells (Bharti et al., 2003). Kurkumin dapat menghambat proliferasi sel
kanker payudara (jenis BT20, SKBR3, MCF-7, T47D dan ZR75-I) secara in vitro. Efek antiproliferasi ini sangat tergantung pada reseptor estrogen (ER) (Aggarwal
et al., 2005). Penghambatan aktivasi pada reseptor estrogen ini akan mengakibatkan penghambatan aktivitas beberapa faktor transkripsi melalui induksi RNA polimerase yang dapat menghambat proliferasi sel kanker. Mekanisme antiproliferasi kurkumin pada sel mieloma dikaitkan dengan kemampuan kurkumin menghambat nuclear factor-kappa В (NF-κВ) (Bharti et al.,2003). NF-κВ merupakan faktor transkripsi gen-gen seperti Bcl-2 dan Bcl-XL yang bersifat antiapoptosis dan cyclin D1 yang bersifat antiproliferatif. Efek kurkumin pada penghambatan NF-κВ dapat memacu terjadinya apoptosis dan menekan terjadinya proliferasi. Kurkumin dapat memacu aktivasi enzim caspase-7 dan caspase-9 yang dapat menstimulasi proses apoptosis pada sel mieloma (Bharti et al., 2003).
Kurkumin menunjukkan aktivitas terhadap berbagai penyakit neurologis, termasuk Alzheimer Disease (AD) (Lim et al., 2001), sklerosis (Natarajan & Bright, 2002), penyakit Parkinson (Zbarsky et al., 2005), epilepsi (Sumanont et al., 2004), cedera otak (Ghoneim et al., 2002), terkait usia degenerasi otak (Calabrese et al., 2003), schizopherenia (Bishnoi et al., 2008), nyeri neuropatik (Sharma et al., 2006) dan depresi (Xu et al., 2005).
AD adalah penyakit neurodegeneratif yang melibatkan peradangan, kerusakan oksidatif dan akumulasi beta-amyloid (Abeta). Plak Abeta adalah fragmen protein tidak larut yang merupakan hasil pemotongan yang tidak sempurna dari suatu protein yang disebut amyloid precursor protein (APP) (Huang et al., 1992).
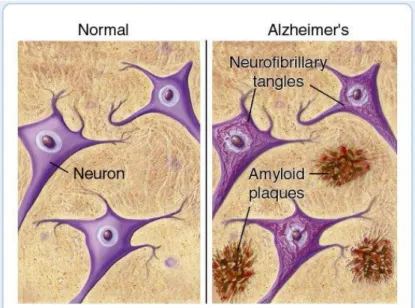
Perbedaan otak normal dan otak pada penderita AD terlihat seperti gambar 2. Penyakit ini merusak memori dan kemampuan berpikir dari waktu ke waktu. Pada awalnya, memori jangka pendek mulai menurun ketika sel-sel di hipokampus mulai mengalami kerusakan dan kematian.
Gambar 2. Otak normal dan otak penderita AD (Lim et al., 2001)
Penelitian Lim et al., (2001), menunjukkan bahwa kurkumin pada dosis rendah menurunkan plak Abeta secara signifikan (43%-50%). Kurkumin menurunkan plak Abeta, protein teroksidasi dan mencegah penurunan fungsi kognitif (Yang et al., 2005). Kemampuan kurkumin dalam kelasi logam-logam seperti Cu dan Fe dapat mencegah terjadinya agregasi amyloid. Sejauh ini penelitian tentang efek kurkumin di otak adalah mengurangi disfungsi kognitif, kerusakan saraf sinaptik, deposisi plak amyloid dan kerusakan oksidatif (Baum & Ng, 2004).
2. Pentagamavunon-1
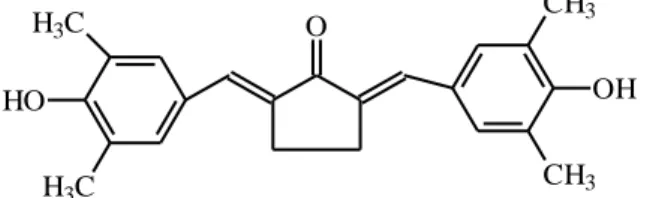
Pengembangan studi hubungan struktur dan aktivitas kurkumin yang dilakukan oleh Tim Molnas Fakultas Farmasi UGM memperoleh senyawa analog kurkumin antara lain pentagamavunon-1 (PGV-1) atau 2,5-bis(4’- hidroksi-3’,5’-dimetil-benzilidin)-siklopentanon (No. Paten: US 6777477 B2). Senyawa ini pertama kali disintesis oleh Sardjiman (1997). PGV-1 dengan struktur molekul seperti terlihat pada gambar 3, merupakan analog kurkumin dengan substituen inti aromatis berupa gugus 4-hidroksi dan 3,5-dimetil. PGV-1 menunjukkan aktivitas antiproliferatif terhadap sel kanker payudara T47D lebih kuat dibanding kurkumin (Da’i, 2007; Meiyanto, 2006). Penelitian lain menunjukkan bahwa modifikasi kurkumin pada inti aromatis dengan gugus 4-hidroksi dan 3,5-dimetil memiliki aktivitas penangkap radikal 50 sebesar 94,26%) (Youssef et al., 2004). Banyak penelitian-penelitian menunjukkan bahwa PGV-1 memiliki aktivitas yang mirip bahkan beberapa lebih baik dibanding kurkumin dan analog kurkumin lainnya.
Gambar 3. Struktur molekul PGV-1 (Sardjiman, 1997)
Pada hasil penelitian yang dilaporkan Orbayinah et al., (2003), menunjukkan perbedaan kemampuan analog kurkumin yaitu PGV-0, PGV-1 dan Heksagamavunon-1 (HGV-1) dalam menghambat aktivitas enzim COX. Senyawa PGV-0 mempunyai daya hambat enzim COX lebih kecil dibandingkan PGV-1 dan HGV-1 yang mempunyai gugus metil pada cincin aromatiknya. Hal ini mungkin disebabkan karena gugus metil mempunyai halangan sterik terhadap
OH HO CH3 CH3 H3C H3C O
gugus hidroksi fenolik yang lebih kecil daripada gugus metoksi sehingga PGV-1 dan HGV-1 lebih mudah berikatan dengan sisi aktif enzim COX.
PGV-1 mempunyai sifat asam lemah, lebih kaku dan lebih mudah larut dalam lipid daripada kurkumin yang membuatnya lebih mudah untuk menembus membran sel dan lebih stabil ketika berinteraksi dengan reseptor. Berdasarkan penelitian lebih lanjut mengenai isomer geometrik dengan menggunakan analisis
X-ray crystallographic menunjukkan bahwa PGV-0 dan PGV-1 mempunyai isomer geometrik E-E. Oleh karena itu berdasarkan hasil penelitian ini diketahui bahwa substituen dimetil pada cincin aromatis, PGV-1 memainkan suatu peran penting pada aktivitas sitotoksik (Dai, 2007).
PGV-0 dan PGV-1 menunjukkan aktivitas antiproliferasi melalui modulasi perkembangan siklus sel (Meiyanto et al., 2006; Dai et al., 2007). PGV-1 lebih bagus daripada kurkumin dan PGV-0 dalam menginduksi apoptosis pada sel T47D. PGV-1 menunjukkan suatu profil yang berbeda dengan kurkumin dan PGV-0 dalam aktivitas antiproliferasi. PGV-1 (2,5 M) dapat untuk memodulasi perkembangan siklus sel melalui penghentian G2/M daripada penghentian G-1, diikuti dengan hyperploidy sel dan kerusakan mitosis pada sel T47D (Dai et al., 2007).
PGV-1 juga berinteraksi dengan suatu polimer tubulin yang menimbulkan penghambatan depolimerisasi mikrotubula seperti yang ditunjukkan dengan kondensasi tubulin. Fenomena ini menyerupai aktivitas taxol sebagai agen anti mikrotubul (Dai et al., 2007). Hasil temuan ini menunjukkan bahwa PGV-1 berperan sebagai suatu inhibitor mikrotubular, dapat dikelompokkan sebagai suatu
agen anti mikrotubular dan berpotensi untuk dikembangkan sebagai agen anti kanker (Widaryanti et al., 2008). Sejauh ini, belum banyak dilakukan penelitian tentang aktivitas terapetik dari PGV-1. Penelitian tentang efektivitas nanopartikel PGV-1 dalam lingkup neuro science belum pernah dilakukan.
3. Uji Perilaku
a. Social interaction test
Social interaction test digunakan untuk mengetahui gangguan neuropsikiatrik yang dikarakteristikkan pada gangguan perilaku sosial dan proses pengenalan sosial, meliputi depresi, autism spectrum disorders (ASD), bipolar disorders, obsessive-compulsive disorders dan schizhoprenia (Kaidanovich-Beilin et al., 2011). Social interaction test adalah hasil dari kelompok riset di Universitas North Carolina, dalam konsultasi dengan dokter, terapis dan tenaga profesional lainnya di bidang autisme yang mencoba merancang serangkaian tes perilaku mencit untuk model aspek-aspek tertentu dari autis (Moy et al., 2004).
Gangguan dalam interaksi sosial dan komunikasi adalah indikator diagnostik utama dalam ASD (American Psychiatric Association, 1994). Autisme dalam hal ini dikaitkan dengan gangguan interaksi sosial yang ditandai dengan kelainan perilaku pada tiga aspek: hubungan sosial, komunikasi dan aktivitas motorik (American Psychiatric Association, 1994).
Gambar 4. Alat uji social interaction test
Penelitian Moy et al (2004) memberikan gambaran uji perilaku pada mencit menggunakan alat social interaction test yang terdiri dari 3 kompartemen seperti terlihat pada gambar 4. Terdapat 2 sesi tes pada uji perilaku ini. Pada tahap pertama disebut social novelty, menggambarkan proses awal pengenalan sosial. Mencit diberikan pilihan antara berinteraksi dengan kurungan berisi mencit
stranger yang ada di satu sisi kompartemen atau tetap sendirian di kompartemen tengah atau di kompartemen seberang berinteraksi dengan kurungan kosong. Mencit dalam posisi di kompartemen tengah, tidak dianggap dalam penilaian uji perilaku. Kompartemen tengah yang ada dalam uji ini berfungsi sebagai ruang mencit uji untuk berpikir dalam menentukan pilihan untuk berinteraksi. Mencit
stranger ditempatkan di kurungan yang memungkinkan kontak visual, auditori dan penciuman, tetapi menghalangi interaksi agresif atau seksual. Interaksi yang dinilai disini adalah mencit uji mendekat sampai menyentuh kurungan. Berada dalam kompartemen yang terdapat kurungan, namun tidak menyentuh kurungan tidak dianggap sebagai interaksi. Parameter yang diamati pada sesi pertama meliputi durasi dan frekuensi berinteraksi dengan kurungan berisi stranger 1serta
durasi dan frekuensi berinteraksi dengan kurungan kosong (Kaidanovich-Beilin et al., 2011). Penelitian pendahuluan menunjukkan bahwa sebagian besar, tetapi tidak semua, mencit memilih untuk menghabiskan lebih banyak waktu berinteraksi dengan mencit stranger 1.
Tahap kedua dari uji ini disebut social affiliation, yaitu menggambarkan uji preferensi untuk kebaruan interaksi sosial. Dalam hal ini, mencit diberi pilihan antara mencit asing dari tahap pertama (stranger 1) dan mencit asing yang benar-benar baru (stranger 2). Pada sesi ini parameter-parameter yang diamati adalah durasi dan frekuensi berinteraksi dengan kurungan berisi stranger 2 serta durasi dan frekuensi berinteraksi dengan kurungan berisi stranger 1 (Kaidanovich-Beilin
et al., 2011). Penelitian terdahulu menyatakan bahwa sebagian besar, tetapi tidak semua, mencit normal lebih banyak menghabiskan waktu dengan kurungan berisi mencit stranger 2 daripada kurungan berisi mencit stranger 1 (Kaidanovich-Beilin et al., 2011).
b. Radial 8-arm maze test (Tarantino & Bucan, 2000)
Radial 8-arm maze test digunakan untuk mengetahui adanya brain disorder
yang berupa deficit in learning and memory atau penurunan fungsi kognitif (Tarantino & Bucan, 2000). Pada uji ini akan dinilai memori belajar dan mengingat ruang dengan melihat waktu yang dihabiskan dalam mencari makanan di ujung akhir dari ke delapan lengan. Alat uji radial 8-arm maze test seperti terlihat pada gambar 5.
Hewan uji ditempatkan pada tengah alat, selama 6 menit dibiarkan untuk mengeksplorasi ruang mencari makanan. Tedapat makanan (pelet) tersembunyi
pada akhir ujung lengan yang diletakkan menurut pola uji (Seo et al., 2013). Terdapat 4 pola yaitu:
1) N-R-N-R-N-R-N-R
No reward (N) adalah tangan yang tidak berisi makanan, sedangkan Reward
(R) adalah tangan yang terdapat makanan. Pola ini berupa peletakan makanan yang berseling satu pada tiap tangan. Tangan yang tidak berisi makanan ditutup pada pintunya.
2) RR-NN-RR-NN
Pola ini berupa peletakan makanan (sebagai reward) yang berseling dua pada tiap tangan di mana tangan yang tidak berisi makanan ditutup pada pintunya.
3) NN-RRRR-NN
Pola peletakan makanan yang mana 4 tangan berisi makanan diapit oleh 2 tangan tanpa makanan dengan pintu yang ditutup.
4) RR-NNNN-RR
Pola peletakan makanan yang mana 4 tangan tanpa makanan dengan pintu yang ditutup diapit oleh 2 tangan yang masing-masing berisi makanan.
Pola yang digunakan dalam uji perilaku ini berperan dalam menguji aktivitas belajar dan mengingat. Dilakukan lebih dari 1 macam penyusunan pelet sehingga akan memaksimalkan kerja mencit uji dalam belajar dan mengingat (Tarantino-Bucan, 2000). Fungsi belajar disini berkaitan dengan motivasi mencit dalam mencari makanan, didukung dengan kemampuan olfaktori mencit uji mencium pelet yang tersembunyi.
Gambar 5. Radial 8 arm-maze
Untuk analisis perilaku, memasuki lengan yang mengandung pelet dianggap sebagai pilihan yang tepat, memasuki lengan tanpa pelet dianggap sebagai kesalahan referensi memori dan masuk kembali dari lengan yang dipilih sebelumnya dianggap kesalahan kerja memori (Sutula et al., 1995).
Uji perilaku dengan alat ini dapat menggambarkan adanya penurunan fungsi kognitif pada hewan coba. Menurut Shaffer (1989), perkembangan kognitif adalah perubahan yang terlihat pada kemampuan dan keterampilan mental pada selang waktu tertentu, secara khusus perubahan yang timbul pada kegiatan mental seperti perhatian, persepsi, belajar, berpikir dan mengingat. Fungsi kognitif ini berkaitan dengan proses belajar dan ingatan. Proses belajar dapat diartikan sebagai modifikasi yang permanen dari perilaku yang terjadi sebagai akibat dari latihan, pengalaman dan observasi. Ingatan dapat diartikan sebagai kemampuan untuk menerima informasi dan mengubah perilaku sesuai dengan kondisi lingkungan. Mengingat merupakan kemampuan untuk menyimpan dan menggunakan kembali pengetahuan yang telah dipelajari sebelumnya secara sadar (Jared, 2010).
Banyak daerah dan struktur di otak sebagaimana korteks serebri juga berperan dalam belajar dan mengingat. Ingatan didistribusikan secara berlebihan di daerah korteks. Hal-hal yang berasal dari ingatan jangka pendek dapat diubah untuk disimpan menjadi ingatan jangka panjang oleh hipokampus. Hipokampus (terletak di antara lobus temporal otak) dan bagian media lobus temporal (bagian yang terletak paling dekat dengan garis tengah badan) juga berperan dalam proses penggabungan ingatan (Sutula et al., 1995).
Pada mencit, ada daerah yang berperan dalam proses penyimpanan informasi yaitu hipokampus. Pada tikus dan mencit, hipokampus berperan dalam mempelajari spatial map. Hipokampus memiliki tiga fungsi utama yang terkait dengan fungsi inhibisi, memori, dan spasial. Fungsi inhibisi diperoleh dari hasil observasi yang menyebutkan bahwa hewan dengan kerusakan hipokampus akan lebih hiperaktif. Hasil observasi lain menyebutkan bahwa hewan dengan kerusakan hipokampus akan mengalami kesulitan untuk menghambat respon yang sebelumnya telah dipelajari (McNaughton & Gray, 2000). Sedikit kerusakan pada hipokampus akan membawa dampak yang besar pada perilaku hewan uji (Carlson, 2004).
4. Otak dan Sawar Darah Otak
Otak adalah organ yang mengkonsumsi 20% oksigen dari tubuh meskipun porsinya hanya 2% dari berat badan tubuh. Dalam penuaan normal, otak mengakumulasi ion-ion seperti besi (Fe), tembaga (Cu) dan zink (Zn). Akibatnya, otak membutuhkan antioksidan yang mengontrol dan mencegah pembentukan
reactive oxygen species (ROS) (Smith et al., 2007). Di dalam otak terdapat jutaan neuron atau saraf-saraf. Neuron dalam SSP berkomunikasi menggunakan kombinasi sinyal kimia dan listrik. Neuron berfungsi menghantarkan impuls atau sinyal dari reseptor ke pusat saraf dan meneruskannya ke efektor. Neuron tersusun atas badan sel saraf, dendrit, dan akson. Akson berfungsi menghantarkan impuls dari badan sel saraf menuju neuron lain. Agar impuls dapat disampaikan ke sistem saraf pusat dan efektor, sel-sel saraf akan saling berhubungan melalui sinapsis. Sinapsis adalah titik temu antara terminal akson salah satu neuron dengan neuron lain. Regulasi yang tepat dari sinapsis dan akson ini penting untuk penghantaran sinyal saraf yang efektif (Abbott, 1992).
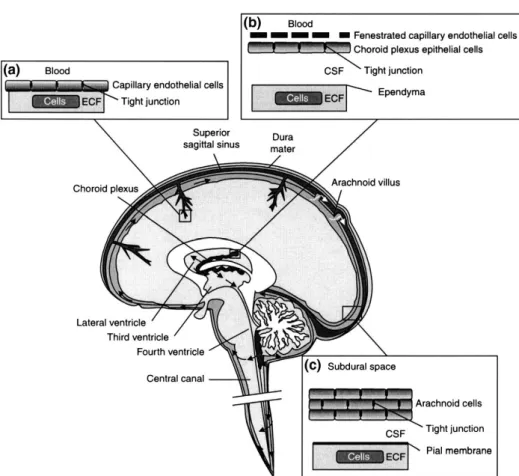
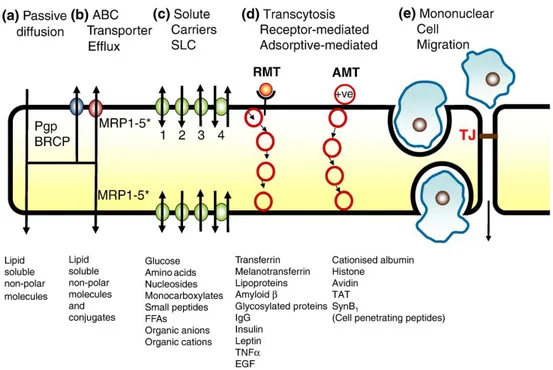
Sawar darah otak atau yang lebih dikenal dengan Blood Brain Barrier (BBB) adalah struktur membran yang secara primer berfungsi untuk melindungi otak dari bahan-bahan kimia dalam sirkulasi darah dan mencegah masuknya makromolekul masuk ke otak, di mana fungsi metabolik masih dapat dilakukan. Gambaran skematis dari BBB seperti terlihat pada gambar 6. Sawar darah otak ini terdiri dari sel-sel endotelial, yang tersusun sangat rapat di kapiler otak. Kepadatan yang tinggi ini membatasi lewatnya substansi-substansi melalui aliran darah (Wolburg
Gambar 6. Tight Junction Blood Brain Barrier (Wolburg et al., 2009)
Dinding-dinding kapiler dibuat dari sel-sel endotel yang memiliki celah-celah kecil. Bahan kimia yang larut dapat melewati celah ini, dari darah ke jaringan atau dari jaringan ke darah. Di otak, sel-sel endotel ini tersusun rapat dan disebut dengan tight junction. Adanya tight junction membuat gerakan molekul-molekul yang menuju dan dari otak terhambat. Masuknya molekul-molekul obat ke dalam otak dapat melalui mekanisme difusi pasif, ABC Transporter Efflux, Solute Linked-Carriers (SLC), Transitosis dan migrasi sel mononuklear. Difusi pasif dapat terjadi apabila molekul obat bersifat non-polar dan larut dalam lipid. Pada
ABC Transporter Efflux, melibatkan transporter seperti MRP1 atau MRP2 dalam menembus tight junction. SLC terjadi apabila molekul obat berikatan dengan carrier misalnya glukosa, peptida kecil atau asam amino. Carrier tersebut akan
mempermudah masuknya obat ke dalam otak. Transitosis adalah mekanisme transport obat melewati BBB dengan di perantarai reseptor yang sesuai. Sedangkan migrasi sel mononuklear adalah mekanisme transport obat melewati BBB tanpa perantara, menyerupai difusi pasif namun melibatkan migrasi sel mononuklear yang mengandung molekul obat (Wolburg et al., 2009).
Gambar 7. Mekanisme transpor obat melewati BBB (Wolburg et al., 2009)
5. Nanokitosan
Nanopartikel didefinisikan sebagai partikel dengan diameter lebih kecil dari 100 nm. Material atau struktur yang mempunyai ukuran nano akan mempunyai sifat-sifat yang berbeda dari material aslinya. Nanopartikel memiliki luas permukaan yang besar sehingga penyerapan bahan aktif meningkat (Huang et al., 1992). Karakteristik spesifik dari nanopartikel bergantung pada ukuran, distribusi, morfologi, dan fasenya. Seiring berkembangnya teknologi, nanopartikel semakin banyak digunakan dalam sistem pembawa obat untuk melewati hambatan organ
seperti sawar darah otak (Hosokawa, 2007). Kurkumin dan pentagamavunon (PGV) merupakan salah satu contoh kandidat obat yang menerapkan teknologi nanopartikel sebagai upaya untuk memperbaiki bioavailibilitasnya (Jayanti, 2011).
Keuntungan menggunakan nanopartikel sebagai penghantar obat di antaranya ukuran partikel dan karakteristik permukaannya mudah dimanipulasi sesuai target sasaran; mengurangi dosis pemberian; mempertahankan pelepasan obat; meningkatkan efikasi terapi; mengurangi efek samping; penargetan ke jaringan atau organ tertentu dan sistem ini dapat dipakai untuk berbagai rute pemberian termasuk oral maupun parenteral (Mohanraj & Chen, 2006).
Kriteria polimer yang ideal sebagai pembawa dalam formulasi nanopartikel adalah mudah untuk disintesis dan dikarakteristik, biokompatible, biodegradable, memiliki respon imun yang minimum, sifat toksisitasnya yang rendah, larut air, dan tidak mahal untuk pembuatan skala besar, dapat diaplikasikan untuk berbagai obat, protein, dan polinukleotida (Tiyaboonchai, 2003).
Self Nano Emulsfying Drug Delivery System SNEDDS adalah sistem yang terdiri dari campuran minyak, surfaktan dan ko-surfaktan yang dapat membentuk nanoemulsi secara spontan ketika bertemu fase air melalui agitasi yang ringan dalam lambung dengan ukuran tetesan emulsi berkisar nanometer (Mahmoud et al., 2009). Selain meningkatkan kelarutan dan disolusi, sistem SNEDDS dapat meningkatkan ketersediaan hayati obat di dalam plasma darah (Gupta et al., 2011). Metode SNEDDS lebih dipilih daripada metode nanoemulsi yang mengandung air karena lebih stabil dan lebih praktis sehingga memungkinkan
untuk dijadikan bentuk sediaan hard atau soft gelatin capsule. Metode SNEDDS juga dapat meningkatkan kelarutan obat yang sukar larut dalam air dengan melewati tahapan disolusi obat (Gupta et al., 2011).
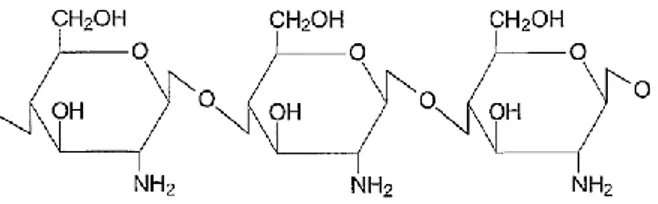
Gambar 8. Struktur kitosan (Hosokawa, 2007)
Kitosan merupakan suatu polimer alami yang diperoleh dari deasetilasi alkali pada kitin. Struktur molekul kitosan seperti terlihat pada gambar 8. Kitin dapat ditemukan dalam eksoskeleton hewan-hewan pada famili Crustaceae (kepiting, udang dan lobster), serangga dan beberapa jamur. Kitosan digunakan secara luas dalam bidang pengobatan dan bioteknologi. Kitosan menjadi bahan penting dalam dunia farmasi karena memiliki kemampuan biodegradasi, biokompabilitas serta daya toksisitasnya yang rendah. Selain itu, kitosan juga bersifat mukoadesif dan polielektrolitik (Hirano, 1986). Kitosan memberikan penghantaran yang baik dalam administrasi biomakromolekul seperti peptida, protein, oligonukleotida dan plasmid di permukaan biologis.
Kitosan merupakan polimer yang populer digunakan dalam sistem nanopartikel. Kitosan dilaporkan memiliki kemampuan untuk membuka kait antar sel (tight junction) pada membran usus secara sementara (Bhardwaj dan Kumar, 2006; Martien et al., 2008) melalui mekanisme translokasi protein Claudin-4 (Cldn4), Zonnula occludens-1 (ZO-1) dan Occludin dari membran sel ke sitosol (Smith et al., 2007; Yeh et al., 2011), sehingga sangat potensial untuk
dikembangkan sebagai bahan utama pembuatan nanopartikel yang ditujukan untuk aplikasi per oral.
Ditinjau dari struktur kimianya, kitosan merupakan suatu polimer multifungsi sehingga menyebabkan kitosan mempunyai reaktifitas kimia yang tinggi (Tokura, 1995). Muatan pada gugus amonium yang positif memiliki kelebihan dapat mengadakan interaksi ionik dengan asam sialat pada membran intestinal saluran cerna (Vllasaliu et al., 2010). Kitosan merupakan senyawa yang tidak larut dalam air dan larutan basa kuat, sedikit larut dalam HCl dan HN . Menurut Widodo (2005) perbedaan antara kitin dan kitosan didasarkan pada kandungan nitrogennya.
6. Etanol sebagai Agen Stres Oksidatif Perusak Otak
Etanol disebut juga etil alkohol dengan rumus kimia OH merupakan larutan tidak berwarna, volatil dan dapat bercampur dengan air dengan titik didihnya 78,4° C. Etanol cepat diserap dan didistribusikan dalam jaringan tubuh yang banyak mengandung air seperti darah dan otak. Senyawa ini diketahui mampu menimbulkan efek neurotoksik akibat peningkatan stres oksidatif (Heaton
et al., 2000). Stres oksidatif yang terjadi timbul karena adanya radikal bebas yang terbentuk dari etanol (Winarsi, 2007). Stres oksidatif juga diakibatkan karena terjadinya penurunan level glutation hippocampus. Penurunan level glutation
hippocampus dalam jangka panjang dapat menyebabkan gangguan aktivitas motorik, endokrinologi, kemampuan kognitif dan meningkatkan resiko terjadinya penyakit neurodegeneratif (Miller dan O’ allaghan, 2005).
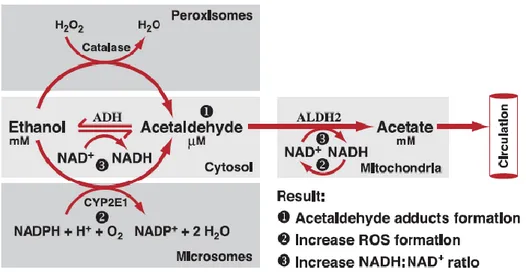
Etanol dimetabolisme oleh tubuh terutama oleh hati dengan bantuan enzim alkohol dehidrogenase (ADH) dan koenzim nikotinamid-adenin-dinukleotida (NAD) menjadi asetaldehid. Proses oksidasi etanol juga terjadi di otak (Zakhari et al., 2006). Asetaldehid oleh enzim aldehid dehidrogenase (ALDH) diubah menjadi asam asetat (Deitrich et al., 2006). Di dalam sel otak terdapat enzim sitokrom P450-2E1 yang membantu produksi asetaldehid yang menyebabkan terbentuknya radikal bebas berupa oksigen reaktif dan toksik sehingga dapat menyebabkan kerusakan jaringan SSP dan inflamasi pada otak (Zakhari et al, 2006). Radikal bebas dapat menyebabkan peroksidasi lipid, oksidasi protein, perubahan spesies oksigen reaktif (ROS) dan akhirnya menyebabkan kematian neuron otak (Vandarajan et al., 2000). Gambaran singkat metabolisme etanol dalam tubuh seperti terlihat pada gambar 9.
Gambar 9. Proses oksidasi etanol dalam tubuh (Zakhari, 2006)
Etanol terbukti dapat merusak SSP ditandai dengan berkurangnya jumlah neuron pada hipokampus. Neuron-neuron yang berkurang adalah hipokampus bagian CA1. Hipokampus bagian CA1 menyokong terjadinya long-term
potentiation (LTP) (Adiningsih, 2013; Lynch, 2004). Kerusakan akibat etanol pada otak menyebabkan penurunan fungsi kognitif dan memori karena adanya stres oksidatif yang menginduksi radikal bebas dan adanya lesi pada hipokampus (Butterfield et al., 1999). Efek etanol pada otak bergantung pada dosis pemberiannya. Penelitian pendahuluan menunjukkan pemberian etanol 10% v/v pada mencit secara kronis dapat mengaktivasi astroglia dan mikroglia pada korteks serebral dan memacu aktivitas sinyal TLR4 sehingga menyebabkan neuroinflamasi (Blanco et al., 2005). Pemberian etanol secara kronis selama 30 hari dapat menyebabkan kerusakan hipokampus CA1 pada tikus (Fowler et al., 2014) dan pemberian selama akut selama 7 hari menyebabkan kerusakan hipokampus CA1 pada mencit (Adiningsih, 2013).
7. Natrium Butirat
Natrium butirat atau sodium butyrate (SB) dikenal sebagai senyawa inhibitor histon deasetilasi (IHD). Struktur molekul dari natrium butirat dapat dilihat pada gambar 10. Natrium butirat memiliki aktivitas antidepresan pada otak tikus (Schroeder et al., 2007). Selain itu, natrium butirat telah terbukti menginduksi neurogenesis di otak tikus setelah iskemia serebral (Kim et al., 2009). Natrium butirat dilaporkan dapat menembus BBB dan meningkatkan asetilasi histon pada penelitian in vivo (Simonini et al., 2006). Pemulihan fungsi memori berkorelasi dengan peningkatan asetilasi histon hipokampus dan peningkatan ekspresi gen yang terlibat dalam fungsi kognitif (Cohen et al., 2013). Pemberian natrium
butirat 1,2 g/kgBB selama 21 hari dilaporkan mampu meningkatkan contextual learning and memory (Govindarajan et al., 2011).
Gambar 10. Struktur molekul natrium butirat (James, 2003)
Asetilasi histon merupakan salah satu dari 3 mekanisme epigenetik. Terjadinya proses epigenerik (epigenesis) merupakan konsekuensi adanya interaksi antara gen dengan lingkungannya dan dapat terjadi akibat tidak terekspresinya informasi genomik (silenced genes) (Holliday, 2005). Keseimbangan asetilasi dan deasetilasi protein histon menentukan suatu gen aktif atau nonaktif. Ketika histon dalam keadaan deasetilasi (dikatalis histon deasetilasi yang melepas gugus asetil dari histon), kromatin berada dalam keadaan menutup dan hal ini menghambat faktor transkripsi DNA dan menonaktifkan gen.
IHD menghambat aktivitas histon deasetilasi dan menjaga histon tetap dalam keadaan terasetilasi sehingga mengaktifkan gen karena kromatin membuka dan memungkinkan faktor transkripsi berinteraksi dengan DNA (Juliandi et al., 2010). Faktor transkripsi Sox5, Fezf2 dan Satb2 diketahui mengatur migrasi dan posisi neuron. Variasi genetik dari tiga faktor transkripsi tersebut ditemukan pada pasien dengan gangguan perkembangan dan bicara, kelemahan intelektual, schizofrenia dan autism spectrum disorder (ASD) (Cooper et al., 2011; Lamb et al., 2012). Abnormalitas yang berhubungan dengan kondisi diatas termasuk diantaranya kesulitan komunikasi dan gangguan interaksi sosial (McFarlane et
al., 2008). Perubahan 3 faktor transkripsi ini berkontribusi pada munculnya gangguan kognitif dan gangguan perkembangan saraf motorik (Muhchyi et al., 2013).
E. Landasan Teori
Kerusakan otak dewasa akibat etanol menyebabkan penurunan fungsi kognitif seperti gangguan belajar dan memori. Hal ini disebabkan adanya stres oksidatif yang menginduksi terbentuknya radikal bebas yang menyebabkan kerusakan dan kematian sel. Radikal bebas dapat menyebabkan peroksidasi lipid, oksidasi protein, perubahan Reactive Oxygen Species (ROS) dan akhirnya menyebabkan kematian neuron otak. Tingkat tinggi dari konsumsi oksigen, kandungan lemak tak jenuh ganda yang tinggi dan relatif kurangnya enzim antioksidan menyebabkan otak lebih rentan terhadap kerusakan oksidatif dibanding organ atau jaringan lain. Pemberian etanol secara akut selama 7 hari diketahui menyebabkan kerusakan hippocampus CA1 pada mencit.
Natrium butirat dikenal sebagai senyawa inhibitor histon deasetilasi. Natrium butirat memiliki aktivitas antidepresan pada otak tikus. Selain itu, natrium butirat telah terbukti menginduksi neurogenesis di otak tikus setelah iskemia serebral dan dilaporkan dapat menembus BBB pada penelitian in vivo. Pemulihan fungsi memori berkorelasi dengan peningkatan asetilasi histon hipokampus dan peningkatan ekspresi gen yang terlibat dalam fungsi kognitif. Pemberian natrium butirat 1,2 g/kgBB selama 21 hari dilaporkan mampu meningkatkan contextual learning and memory.
Banyak penelitian menyebutkan bahwa kurkumin dapat mengurangi kerusakan oksidatif dan penurunan memori yang terkait dengan proses penuaan. Sharma (2006) mengemukakan keberadaan kurkumin sebagai neuroproteksi melalui mekanisme antioksidan akan mencegah kematian sel sehingga gangguan– gangguan yang diakibatkan kerusakan maupun kematian sel ini dapat dicegah, termasuk kematian sel di hippocampus terkait dengan fungsi memori. Untuk mendapatkan kurkumin dalam jumlah banyak sangat sulit dilakukan. Seiring dengan berkembangnya dunia penelitian, telah disintesis senyawa analog kurkumin untuk dapat dikembangkan lebih lanjut. Salah satu senyawa analog kurkumin yang telah dikembangkan adalah PGV-1.
PGV-1 atau 2,5-bis(4’-hidroksi-3’,5’-dimetil-benzilidin)-siklopentanon pertama kali disintesis oleh Sardjiman (1997). PGV-1 merupakan senyawa analog dari kurkumin dengan substituen inti aromatis berupa gugus 4-hidroksi dan 3,5-dimetil. PGV-1 dilaporkan memiliki aktivitas sebagai antikanker, antioksidan dan antiinflamasi. Kurkumin dan PGV-1 bersifat non-polar dan lipofil ditinjau dari struktur molekulnya, sehingga dapat menembus BBB. Banyak penelitian-penelitian menunjukkan bahwa PGV-1 memiliki aktivitas yang mirip bahkan beberapa lebih baik dibanding kurkumin dan analog kurkumin lainnya. Namun, potensi PGV-1 dan lead compoundnya (kurkumin) sebagai obat untuk brain disorder belum pernah digali dikarenakan dua senyawa ini memiliki kelarutan yang kurang baik di dalam cairan biologis dan tidak dapat menembus BBB.
Untuk meningkatkan kelarutan dan bioavailibilitas kurkumin dan PGV-1 yang diharapkan mampu meningkatkan aktivitas farmakologi, maka
dikembangkan teknologi formulasinya melalui pembuatan formulasi nanopartikel kurkumin dan PGV-1; metode self nano emulsfying drug delivery system
(SNEDDS) dengan kitosan sebagai pembawa. Uji in vitro dengan sel kanker menunjukkan bahwa sediaan nanokitosan kurkumin dan PGV-1 mampu menembus dinding sel kanker dan sel normal dengan lebih efektif sebagai antiinflamasi. Penelitian pendahuluan menunjukkan bahwa pemberian nanoemulsi kurkumin secara per oral memberikan konsentrasi tinggi di dalam plasma darah dibandingkan kurkumin tanpa formulasi nanopartikel.
Hasil penelitian ini diharapkan memberikan kontribusi terhadap penemuan dan pengembangan obat baru berbasis struktur kurkumin yaitu sebagai brain disorder treatment agent baru berupa kontribusi ketersediaan data uji praklinik senyawa kurkumin dan PGV-1 sebagai brain disorder treatment agent model uji: penurunan fungsi kognitif dan gangguan interaksi sosial.
F. Hipotesis
1. Nanokitosan kurkumin dan nanokitosan PGV-1 meningkatkan fungsi kognitif dalam hal proses belajar dan ingatan serta menurunkan gangguan interaksi sosialpada hewan uji.
2. Perubahan perilaku pada fenotipe brain disorders yang berupa penurunan fungsi kognitif dan gangguan interaksi sosial pada mencit jantan dewasa yang diinduksi etanol 10% v/v selama 7 hari dipengaruhi oleh dosis pemberian nanokitosan kurkumin dan nanokitosan PGV-1 selama 21 hari.