ilmu teknik kimia lainnya serta mengetahui aspek ekonomi dalam pembiayaan pabrik.
1.4. Manfaat Pra Rancangan Pabrik
Manfaat pra rancangan pabrik pembuatan asam okaslat adalah memberikan informasi mengenai pabrik asam oksalat sebagai tolak ukur sehingga dapat dijadikan referensi untuk pendirian suatu pabrik asam oksalat. Pra rancangan pabrik ini juga memberikan manfaat bagi perguruan tinggi sebagai suatu karya ilmiah yang dapat dipergunakan sebagai bahan acuan, masukan dalam perkembangan studi di kalangan akademis.
BAB II
TINJAUAN PUSTAKA
2.1. Asam OksalatAsam oksalat disintesis untuk pertama kali pada tahun 1776 oleh Scheele melalui oksidasi gula dengan asam nitrat. Kemudian oleh Wohler disintesis dengan hidrolisis sianogen pada tahun 1824. Asam oksalat digunakan dalam berbagai bidang industri, seperti manufaktur tekstil dan pengolahan permukaan logam, penyamakan kulit dan produksi kobalt. Sejumlah besar asam oksalat juga dikonsumsi dalam produksi agrokimia, farmasi dan turunan kimia lainnya (Kirk Othmer, 2007).
Pada tahun 1829, Gay Lussac menemukan bahwa asam oksalat dapat diproduksi dengan cara meleburkan serbuk gergaji dalam larutan alkali. Asam oksalat merupakan turunan dari asam karboksilat yang mengandung 2 gugus karboksil yang terletak pada ujun-ujung rantai karbon yang lurus yang mempunyai rumus molekul C2H2O4 tidak berbau, higroskopis, berwarna putih sampai tidak berwarna dan mempunyai berat molekul 90 gr/mol (Kirk Othmer, 2007).
2.1.1 Sifat-sifat Asam Oksalat Dihidrat
Berwarna putih, berbentuk kristal dan tidak berbau Melting point : 101,5 oC
Densitas : 1,653 gr/cm3
∆Hf (18 O
C) : -1422 kJ/mol Berat molekul : 126 gr/mol
pH : 1 (10 g/l H2O, 20oC)
Tidak berbau Hidroskopis
2.1.2 Kegunaan Asam Oksalat
Asam oksalat merupakan salah satu bahan baku yang dibutuhkan pada industri sebagai berikut :
Sebagai bahan pelapis yang melindungi logam dari kerak. Sebagai bahan peledak
Sebagai bahan pembuatan zat warna Sebagai bahan analisa laboratorium Sebagai bahan dalam industri lilin Sebagai bahan kimia dalam fotografi.
2.2 Tanaman Alang-alang
Alang-alang atau Imperata Cylindrica adalah tanaman liar dan merupakan tanaman pengganggu pertanian yang merisaukan karena sifatnya yang mudah dan cepat berkembang biak, di berbagai tempat terlebih di tempat yang tanahnya subur dapat mencapai ketinggian 1,0 – 2,0 meter.
Gambar 2.1. Alang alang
Klasifikasi tanaman alang-alang adalah sebagai berikut :
Kerajaan : Plantae
Divisi : Liliopsida
Kelas : Poales
Famili : Poaceae
Genus : Imperata
Species : Imperata Cylindrica
Di beberapa daerah di Indonesia alang-alang dikenal dengan nama ilalang. Alang-alang merupakan tumbuhan menahun dan tumbuh liar di lahan terbuka atau sedikit terlindung, seperti ladang atau perkebunan. Alang-alang banyak terdapat di pulau Jawa dengan ketinggian tempat tumbuh dari 0-2700 mdpl (Djauhariya dan Hernani, 2009). Alang-alang dapat mempengaruhi tanaman kultivasi lain karena kebutuhan natrium yang relatif tinggi. Alang-alang dapat menurunkan pH tanah. Besarnya penurunan pH dan hambatan terhadap proses nitritifikasi menunjukkan korelasi positif dengan pertumbuhan alang-alang (Santoso, 1990).
2.3 Sifat-sifat Bahan Utama 2.3.1 Sifat Bahan Utama
A. Alang-alang
Komposisi Alang-alang :
Abu : 5,42 %
Silika : 3,6 %
Pentosan : 28,58 %
Alfa Selulosa : 44,28%
B. Ca(OH)2 (Kalsium Hidrosida)
Dalam proses bereaksi dengan selulosa membentuk calcium oksalat. Sifat Fisika :
Putih berbentuk kristal
Berat molekul : 74,1 gr/mol
Spesifik Gravity : 2.130 pada 70 oF(21,1 oC)
Density : 2.126 gr/cm3
Sifat Kimia : Higroskopis
Kelarutan : Air dingin (10 oC) 17,6/ gr/l
C. Asam Sulfat (H2SO4)
Bereaksi dengan kalsium oksalat membentuk asam oksalat (C2H2O4.2H2O) Sifat Fisika
Berupa cairan kental tidak berwarna/jernih
Berat Molekul : 98,08 g/mol
Spesifik Gravity : 1,839 pada 14,5 oC Melting Point : 10,49 oC
Titik didih : 270 0C Sifat Kimia
Korosif
Termasuk asam kuat
Dapat bereaksi dengan berbagai macam campuran organik untuk produksi yang berguna
Dapat melarutkan logam Merupakan pengoksidasi kuat Bersifat higroskopis
D. CaSO4.H2O
Merupakan limbah hasil reaksi pembentukan asam oksalat pada reaktor asam oksalat.
Sifat Fisika
Berat Molekul : 171,1798 g/mol
Spesifik Gravity : 2,32
Kelarutan : 0,92 pada 100 g H2O (15 oC) Sifat Kimia
Keras, berupa serbuk putih pada waktu kering, berbentuk paste putih ketika tercampur air.
E. CaC2O4 (Kalsium oksalat )
Merupakan hasil reaksi intermediet dari keseluruhan proses untuk mengikat (C2O4)2- dari reaksi pembentukan kalsium oksalat pada reaktor kalsium oksalat, setelah C5H10O5 direaksikan dengan Ca(OH)2
Sifat Fisika
Berat Molekul : 176,18
Spesifik Gravity : 1,55 pada 20 oC
Kelarutan : 5 pada 5 oC
: 45,5 pada 80 oC
Boiling Point : 1200 30
Sifat Kimia
Larut Dalam air
2.4 Pembuatan Asam Oksalat
Asam Oksalat dapat disintesis dengan beberapa metode yaitu :
1. Oksidasi Karbohidrat
Cara ini ditemukan oleh “Scheele” pada tahun 1776. Asam oksalat diproduksi dengan mengoksidasi karbohidrat seperti glukosa, sukrosa, starch, dextrin dan selulosa dengan menggunakan asam nitrat. Biasanya
untuk proses ini bahan yang digunakan adalah bahan yang banyak mengandung karbohidat, misalnya tepung. Dimana tepung yang digunakan biasanya adalah tepung jagung, tepung gandum, tepung ubi jalar atau tepung yang lainnya dan bisa juga menggunakan gula atau mollases. Ketika digunakan bahan baku seperti selulosa maka harus dihidrolisa terlebih dahulu dengan asam sulfat, sehingga menjadi monosakarida. Glukosa ini kemudian dioksidasi dengan asam nitrat pada temperatur 63-85oC dengan katalis vanadium pentoksida (Kirk Othmer, 2007).
Reaksi :
5C6H12O6 + 30HNO3 15C2H2O4 + 3NO + 9N2O + 9NO2 + 30H2O
Glukosa Asam Nitrat As.Oksalat N.oksida Nitro oksida Nitrit Air
Produksi asam oksalat dengan oksidasi karbohidrat masih dapat dikembangkan karena banyaknya bahan baku seperti limbah pertanian (Kirk-Othmer, 2007).
Dalam pembuatan asam oksalat dengan proses ini bahan dasarnya mengandung 60 % larutan glukosa. Temperatur pada proses ini perlu dikontrol dan dijaga. Untuk menghindari terjadinya oksidasi asam oksalat menjadi karbondioksida, maka ditanggulangi dengan penambahan asam sulfat. Kemurnian produk akhir adalah 99 % dengan konversi asam oksalat pada proses ini adalah 63 – 65 %. Prosesnya dapat dilakukan secara batch maupun kontinyu (Kirk Othmer, 2007).
Proses Hidrolisa Proses Oksidasi Glukosa Proses Absorber Proses Penkristalan Asam Oksalat Proses Pemisahan
Mother Liquor dari asam oksalat Proses
Evaporasi
Proses Pelarutan kembali kristal Asam
Oksalat
Proses Pemisahan Mother liquor yang terikut dari kristal asam
oksalat Proses Penkristalan kembali asam oksalat Proses Pengeringa asam Oksalat Air H2SO4 starch Glukosa NO2 H2O CO2 CO CO2 CO Fe2(SO4)3 Asam Nitrat Asam Oksalat mother liquor Recycle mother liquor
Kristal asam oksalat
Mother
Liquor Asam Oksalat
mother liquor
Produk asam oksalat 99 %
Gambar 2.3. Proses Oksidasi Glukosa dengan Asam Nitrat
2. Proses Etilen Glikol
Dalam proses ini etilen glikol dioksidasi dalam campuran 30-40 % asam sulfat dan asam nitrat 20-25 % dengan 0,001-0,1 % vanadium pentoksida pada suhu 50-70oC untuk menghasilkan asam oksalat lebih dari 93 % (Kirk Othmer, 2007).
Proses ini telah dikembangkan di Jepang oleh Mitsubishi Gas Chemical yang memproduksi 12.000 Ton/tahun asam oksalat. Etilen Glikol teroksidasi dengan konsentrasi 60 % asam nitrat pada 0,3 MPa (43,5 psi), 80oC dengan oksigen. Inisiator seperti NaNO2 dapat membantu menghasilkan oksida nitrogen dan promotor seperti senyawa vanadium atau asam sulfat yang digunakan untuk mempercepat reaksi oksidasi. Yield asam oksalat yang dihasilkan adalah 90 % (Kirk Othmer, 2007).
Reaksi berlangsung sesuai persamaan reaksi berikut
(CH2OH)2 + 4NO2 (COOH)2 + 4NO +
2H2O
Etilen Glikol Nitrit As.Oksalat N.Oksida Air
4NO + 2O2 4NO
N.oksida Oksigen N.oksida
Keseluruhan: (CH2OH)2 + 2O2 (COOH)2 + 2H2O
E.Glikol Oksigen As.Oksalat Air
Proses Evaporasi
Proses Pemisahan mother liquor dari Asam
Oksalat
Proses Penkristalan
Asam Oksalat Proses Oksidasi Etilen
Glikol
Proses Absorber
Proses Pelarutan kembali kristal Asam
Oksalat Proses Pemisahan Mother liquor yang terikut dari kristal Asam
Oksalat Proses Penkristalan kembali asam oksalat Proses pengeringan Asam oksalat Asam nitrat H2O Fe2(SO4)2 NO2 Asam Oksalat mother liquor Ethylene Glikol
Recycle mother liquor
Kristal Asam Oksalat
Mother Liquor Kristal As. Oksalat Produk Asam Oksalat 99 %
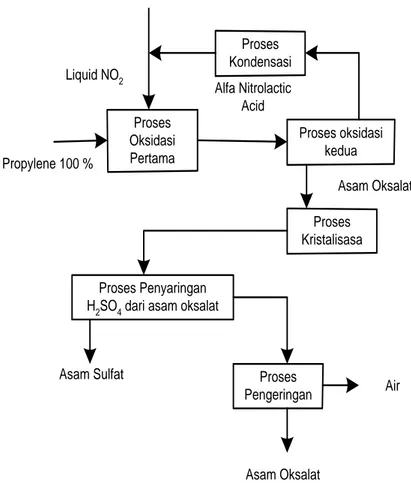
3. Proses Propilen
Pembuatan asam oksalat dengan oksidasi propylene, menggunakan gas bersih dari stok umpan pada operasi cracking minyak bumi. Pada proses propilen, propilen dioksidasi oleh asam nitrat melalui 2 tahap: Tahap pertama propilen direaksikan dengan NO2 cair untuk menghasilkan produk antara berupa asam α-nitrotolactid yang selanjutnya dioksidasi pada temperatur tinggi untuk menghasilkan asam oksalat (Kirk Othmer, 2007).
Rhone-Poulenc (Prancis) mengembangkan sebuah versi modifikasi dari proses pembuatan asam oksalat atau asam laktat, atau keduanya dari propilen. Pada tahun 1978, 65.000 ton/tahun asam oksalat diproduksi di seluruh dunia dengan proses ini, Pada 1990-an proses ini dioperasikan hanya oleh Rhone-Poulenc (Kirk Othmer, 2007).
Reaksi oksidasi Rhone-Poulenc seperti persamaan reaksi berikut:
CH3CH=CH2 + 3HNO3 CH3CHCOOH + 2NO + 2H2O
CH3CHCOOH + 5/2 O2 (COOH)2 + CO2 + HNO3 + H2O
Pada langkah pertama, propylene dicampurkan pada 10-40oC dengan asam nitrat, konsentrasi dijaga pada 50-75 w% dan perbandingan rasio molar untuk propilena 0,01-0,5 hingga terkonversi menjadi asam α-nitratolactic dan asam laktat. Pada tahap kedua asam α-α-nitratolactic teroksidasi oleh oksigen dengan adanya katalis pada 45-100oC untuk menghasilkan asam oksalat dihidrat. Secara keseluruhan dengan konsentrasi
ONO2
Propilen As.Nitrat α-nitrolactid N.oksida
Air
ONO2
propylene lebih besar dari 90% untuk menghasilkan konversi propylene 77,5% (Kirk Othmer, 2007). Proses Kondensasi Proses oksidasi kedua Proses Oksidasi Pertama Proses Kristalisasa Proses Penyaringan H2SO4 dari asam oksalat
Proses Pengeringan Asam Sulfat Asam Oksalat Air Asam Oksalat Alfa Nitrolactic Acid Propylene 100 % Liquid NO2
Gambar 2.5. Proses Oksidasi Propilen Glikol
4. Proses Dialkil Oksalat
Asam oksalat dihasilkan dengan hidrolisis diester asam oksalat dengan gas CO dengan produk samping alkohol. Pada tahun 1978 UBE Industries (Jepang) mengkomersialisasikan proses dua-langkah ini (Kirk Othmer, 2007).
Sintesis pertama yang dilaporkan dengan menggunakan contoh PdCl2 -CuCl2 dalam system redoks dengan persamaan reaksi berikut :
2CO + 2 ROH + PdCl2 (COOR)2 + 2HCl + Pd0
Karbon D Alkohol Pd.Klorida Dialkil Oksalat As.Klorida Paladium
Pd0 + 2CuCl2 PdCl2 + Cu2Cl2
Cu2Cl2 + 2HCl + ½ O2 2 Cu2Cl2 + H2O
Cu(II) klorida As.Klorida Oksigen Cu(II) klorida Air
Overall 2CO + 2ROH + ½ O2 (COOR)2 +H2O
Karbon D Alkohol Oksigen Dialkil Oksalat Air
(COOR)2 + H2O (COOH)2 + 2ROH
Dialkil Oksalat Air As.Oksalat Alkohol
5. Proses Peleburan Alkali
Pembuatan asam oksalat dengan proses peleburan alkali menggunakan bahan baku yang mengandung selulosa tinggi seperti serbuk gergaji, sekam, tongkol jagung, dan lain-lain. Bahan ini dilebur dengan calcium hidroksida pada suhu 240 – 285ºC.
Produk ini kemudian direaksikan dengan asam sulfat untuk membentuk asam oksalat.
Reaksi-reaksi yang terjadi adalah sebagai berikut: (C6H10O5)n + 3n Ca(OH)2 + 6,5n O2
Selulosa Ca.Hidroksida Oksigen
CaC2O4 + nCa(CH3COO)2 + n(HCOOCa)+9H2O+4CO2
Ca.Oksalat Ca.Asetat Ca. Formiat Air K dioksida
CaC2O4 + H2SO4 (COOH)2 + CaSO4
Ca.Oksalat Asam Sulfat As.Oksalat Ca.Sulfat
Konversi yang diperoleh dari proses ini kurang dari 45 % dengan kemurnian produk sebesar 60 % (Isti Azra, dkk., 2011).
Bahan Baku Proses Pemasakan dengan NaOH Proses Pendinginan Proses Penyaringan Proses Pengkristalan CaCl2 H2SO4
Gambar 2.6. Proses Peleburan Alkali
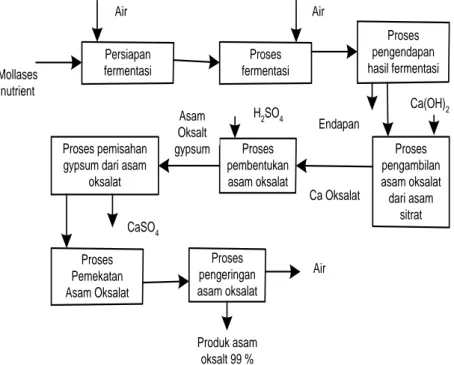
6. Fermentasi Glukosa
Asam oksalat dapat dihasilkan dengan menggunakan proses fermentasi gula dengan menggunakan jamur (seperti Aspergillum atau Penicillium) sebagai pengurainya. Produk yang diperoleh kemudian disaring, diasamkan dan dihilangkan warnanya. Setelah itu, produk dinaikkan konsentrasinya dengan evaporator dan hasilnya dikristalkan. Kemudian dilakukan pengeringan untuk memisahkan produk dengan airnya. Hasil dari asam oksalat tergantung dari nutrient (nitrogen) yang ditambahkan.
Persiapan fermentasi Proses fermentasi Proses pengendapan hasil fermentasi Proses pengambilan asam oksalat dari asam sitrat Proses pembentukan asam oksalat Proses pengeringan asam oksalat Proses pemisahan
gypsum dari asam oksalat Proses Pemekatan Asam Oksalat Mollases nutrient Air Air Ca(OH)2 Endapan Ca Oksalat H2SO4 Air Produk asam oksalt 99 % CaSO4 Asam Oksalt gypsum
Gambar 2.7. Proses Fermentasi Glukosa
7. Metode Baru
Banyak upaya telah dilakukan untuk mensintesis asam oksalat dengan reduksi elektrokimia karbon dioksida baik dengan elektrolit cair maupun tidak cair, misalnya, asam oksalat dibuat dari CO2 sebagai garam Zn yang dalam sel terbagi atas Zn anoda dan katoda stainless steel di asetonitril yang
mengandung (C4H9)4NClO4 dengan efesiensi lebih besar dari 90 % (Kirk Othmer, 2007).
Tabel 2.1 Perbedaan Keuntungan dan Kerugian pada Berbagai Proses Sintesa Asam Oksalat
Metode Keuntungan Kerugian
1. Oksidasi Karbohidrat
Dihasilkan asam oksalat dalam jumlah besar (yield 63-65 %).
Bahan bakunya mahal seperti tepung tapioka, tepung jagung dan lain-lain.
Diperlukan katalis tertentu yaitu V2O5/Fe3+.
2. Etilen Glikol Dihasilkan asam oksalat dalam jumlah besar (yield > 90 %).
Menggunakan bahan
baku yang mahal, yaitu etilen glikol.
3. Proses Propilen Dihasilkan asam oksalat dalam jumlah besar (yield 75 %).
Menggunakan proses yang cukup sulit.
4. Proses Dialkil Oksalat Menggunakan proses yang kompleks. 5. Proses Peleburan Alkali
Bahan yang digunakan tersedia dalam jumlah yang cukup banyak, seperti sabut kelapa, serbuk gergaji, sekam padi, dll.
Asam oksalat yang dihasilkan tidak terlalu besar (yield < 45 %).
Proses yang digunakan cukup sederhana yaitu hanya dengan
penambahan Ca(OH)2 dan H2SO4.
6. Fermentasi Glukosa
Bahan utama yang berasal dari karbohidrat mudah didapat.
Prosesnya yang cukup panjang yaitu gula difermentasikan terlebih dahulu dengan menggunakan jamur aspergillus atau penicillium.
7. Metode Baru Efisiensi proses yang sangat tinggi (>90%).
Prosesnya memerlukan biaya yang cukup mahal dan diperlukan penelitian lebih lanjut.
2.5Deskripsi Proses
Berdasarkan metode proses pembuatan asam oksalat, dipilih salah satu yaitu proses peleburan alkali. Dengan alasan bahan yang digunakan tersedia dalam jumlah yang cukup banyak, seperti sabut kelapa, serbuk gergaji, sekam padi, disamping itu proses yang digunakan cukup sederhana yaitu hanya dengan penambahan Ca(OH)2, dan H2SO4 .
Dalam pembuatan asam oksalat dihidrat dengan proses peleburan alkali ini, terdiri dari beberapa tahap yaitu :
1. Proses Pembentukan Natrium Oksalat (Peleburan Alkali)
Alang-alang yang mengandung selulosa tinggi dan larutan Ca(OH)2 dengan konsentrasi 50% dengan perbandingan 1:1,5 dialirkan ke dalam reaktor dimana operasi berlangsung pada suhu 98oC. Didalam reaktor terjadi reaksi antara alang-alang dan larutan Ca(OH)2 Reaksi yang terjadi adalah sebagai berikut :
(C6H10O5)n + 3n Ca(OH)2 + 6,5n O2
Selulosa Ca.Hidroksida Oksigen
CaC2O4 + nCa(CH3COO)2 + n(HCOOCa)+9H2O+4CO2
Ca.Oksalat Ca.Asetat Ca. Formiat Air K dioksida
2. Proses Pemisahan I
Sebelum masuk pada proses pemisahan, bahan yang keluar dari reaktor terlebih didinginkan. Pada proses pemisahan ini bertujuan untuk memisahkan filtrat yang mengandung kalsium oksalat.
3. Proses Pengasaman
Setelah hasilnya masuk pada tahap pengasaman dengan menggunakan asam sulfat. Reaksi yang terjadi adalah sebagai berikut :
CaC2O4 + H2SO4 C2H2O4 + CaSO4 Ca.Oksalat Asam Sulfat As.Oksalat Ca.Sulfat
4. Proses Pemisahan II
Asam oksalat dan kalsium sulfat dipisahkan hingga memperoleh asam oksalat sebagai filtat.
5. Proses Evaporasi I
Pada proses evaporasi ini filtrat yang berupa asam oksalat dipekatkan kemudian dialirkan menuju tahap kristalizer.
6. Proses Kristalizer
Asam oksalat dari evaporator dialirkan menuju kristalizer untuk didinginkan sampai 30oC hingga terbentuknya kristal dihidrat. Kemudian asam oksalat dialirkan menuju proses pemisahan.
7. Proses Pemisahan III
Pada tahap ini bertujuan memisahkan kristal dari mother liquornya (yang berupa asam oksalat yang tidak mengkristal, H2O dan impurities