BAB I PENDAHULUAN
1.1 Latar Belakang
Halogenasi diambil dari kata halogen yaitu anggota golongan unsur yang sangat aktif, terdiri dari fluorin, bromin, iodin, klorin, atau astatin, yang mempunyai sifat kimia sama. Sedangkan halogenasi tersebut merupakan prosesnya yaitu pemasukan halogen ke dalam senyawa organik, baik secara penambahan (adisi) maupun secara penggantian (substitusi).
Halogenasi merupakan reaksi yang terjadi antara ikatan karbon-karbon rangkap (C=C) pada senyawa-senyawa alkena seperti etena dengan unsur-unsur halogen seperti klorin, bromin dan iodin.
Proses halogenasi banyak digunakan dalam industry, yaitu : pembuatan industrial solvent trichloro ethylene, intermediate penting seperti chloro benzene, vinyl chloride, sebagar refrigerant hidrochloro carbon, dan masih banyak lagi kegunaannya.
1.2 Rumusan Masalah
Dalam penulisan makalah ini penulis merumuskan beberapa masalah sebagai berikut. 1.1.1 Apa yang dimaksud dengan Halogenasi?
1.1.2 Apa saja zat-zat yang dapat dihalogenasi? 1.1.3 Apa saja tipe-tipe reaksi halogeasi?
1.1.4 Bagainana kinetika mekasme reaksi halogenasi?
1.1.5 Apa saja faktor yang mempengaruhi proses halogenasi? 1.1.6 Bagaimana penerapan proses halogenasi di industri?
1.3 Tujuan Penulisan
Dalam penulisan makalah ini,penulis mempunyai beberapa tujuan yaitu sebagai berikut.
1.3.1 Mengetahui pengertian pengertian halogenasi
1.3.2 Mengetahui zat-zat yang dapat digunakan dalam proses halogenasi 1.3.3 Mengetahui tipe-tipe reaksi halogenasi
1.3.4 Mengetahui kinetika mekanisme reaksi halogenasi
1.3.5 Mengetahui faktor yang mempengaruhi proses halogenasi 1.3.6 Mengetahu aplikasi proses halogenasi di industri
1.4 Metode Penulisan
Dalam penulisan makalah ini, penulis menggunakan metode pustaka. Metode pustaka adalah metode penulisan karya ilmiah dengan mengumpulkan bahan-bahan,materi-materi,data-data dan informasi-informasi yang diperoleh dari buku-buku, jurnal, dan web yang tersedia.
BAB II
PEMBAHASAN HALOGENASI
2.1 PENGERTIAN
Halogenasi yaitu proses memasukkan 1 gugus halogen atau lebih. Cara penggantian gugus halogen ada beberapa cara, yaitu:
1. Mengganti H Reaksi: RH + X2 RX + HX C5H12 + Cl2 C5H11Cl + HCl 2. Addisi Reaksi: RCH = CHR’ + X2 RCHX – CHXR’ CH3 – CH = CH2 + Br2 CH3 – CHBr – CH2Br 3. Mengganti suatu gugus (substitusi)
Reaksi: RCH2OH + HX RCH2X + H2O
Halogenasi terdapat dalam proses:
1. Pembuatan insektisida, misal DDT.
2. Pembuatan hasil akhir dengan hasil antaranya adalah halogen, misal C6H6Cl dan C5H11Cl
3. Pembuatan obat-obatan (banyak digunakan bromide dan iodida) dan zat warna. 4. Sebagai bahan pendingin (Freon 12) dan bahan bakar roket (sebab F stabil dan
pada suhu tinggi cepat terbakar dengan panas yang tinggi).
2.2 ZAT-ZAT PEREAKSI
2.2.1 Zat-zat pereaksi untuk halogenasi: 1. Cl2, Br2, I2 dan F2
I2 reaksinya lambat karena reaksinya adalah reaksi setimbang. F2 reaksinya hebat sekali karena itu sangat berbahaya.
2. HX
Digunakan untuk mengganti gugus –O 3. NaOX
Biasa dipakai untuk memperlambat reaksi. Bahan ini harganya mahal maka hanya 3
digunakan untuk keperluan tertentu saja. 4. Ca(OX)2, harganya
lebih murah
2.2.1 Zat-zat yang dapat di halogenasi
1. Alkana secara substitusi, biasanya sebagai hasil antara untuk memperoleh hasil akhir.
Reaksi: RH + Cl2 RCl + HCl
CH4 + Cl2 CH3Cl + CH2Cl2 + HCl 2. Olefin, secara addisi dan substitusi
Reaksi: RCH = CH2 + X2 RCHX – CH2X RCH = CH2 + HX RCH2 – CH2X 3. Alkohol
Reaksi: ROH + HX RX + H2O
RCH2OH + X2 RCHXOH + HX
6. Senyawa aromatik, secara addisi atau substitusi Reaksi:
7. Senyawa aromatik yang mempunyai rantai cabang 4
Halogenasi bisa terhadap inti dan bisa terhadap cabang. a. Substitusi pada inti, secara katalitik
Reaksi:
X Kat. AlCl3
H3C + X2 H3C + HX
T<
b. Substitusi pada cabang, secara termal dan foto reaksi Reaksi:
CH3 + X2 T> CH2X + HX
Adisi sukar terjadi sebab inti lebih sukar diserang halogen.
8. Naphtalin, secara addisi akan diperoleh octachlor naphtalen Reaksi: Cl Cl Cl Cl + Cl2 Cl Cl ClCl + 8HCl 9. Karbon disulfida Reaksi: CS2 + 3Cl2 CCl4 + S2Cl2 5
10. Antroquinon Reaksi: O NH2 Katalisator + Cl2 nitrobzen O NH2 O NH2 Cl Cl O NH2
2.3 KINETIKA DAN MEKANISME REAKSI
2.3.1.Reaksi-reaksi antara Alkena dengan Unsur-unsur Halogen
1. Etena dengan fluorin
Etena bereaksi ledakan (eksplosif) dengan fluorin menghasilkan karbon dan gas hidrogen fluoride. Reaksi ini bukan merupakan reaksi yang bermanfaat, dan jarang dibahas pada pembahasan tingkat dasar.
2. Etena dengan klorin atau bromin atau iodin
Reaksi yang terjadi antara etena dengan klorin atau bromin atau iodin adalah reaksi adisi.
Sebagai contoh, bromin ditambahkan membentuk 1,2-dibromoetana.
Reaksi dengan bromin terjadi pada suhu kamar.
Klorin bereaksi lebih cepat dibanding bromin, tapi sifat kimia reaksi cukup mirip.
Iodin bereaksi jauh lebih lambat, tapi sifat kimia reaksi juga mirip. Reaksi dengan bromin jauh lebih mungkin ditemui dibanding reaksi
dengan klorin dan iodin.
Penggunaan air bromin sebagai sebuah reaksi uji untuk alkena
Jika menggoncang sebuah alkena dengan air bromin atau menggelembungkan sebuah alkena wujud gas (seperti etena) melalui bromin cair murni atau melalui sebuah larutan bromin dalam sebuah pelarut organik seperti tetraklorometana, maka bromin yang berwarna coklat kemerah-merahan akan berubah warna (tidak berwarna).
Sifat kimia reaksi uji
Reaksi uji ini menjadi rumit dengan adanya fakta bahwa produk utama yang dihasilkan bukan 1,2-dibromoetana. Air juga terlibat dalam reaksi, dan kebanyakan hasil reaksi adalah 2-bromoetanol.
2.3.2 Reaksi-reaksi antara Alkana dengan Unsur-unsur Halogen
1. Alkana dengan fluorin
Reaksi ini menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap, dan cenderung dihasilkan karbon dan hidrogen fluoride. Sebagai contoh:
2. Alkana dengan iodin
Iodin tidak bereaksi dengan alkana – sekurang-kurangnya pada kondisi laboratorium yang normal.
3. Alkana dengan klorin atau bromin
Tidak ada reaksi yang terjadi dalam kondisi gelap (tanpa cahaya).
Jika terdapat cahaya, reaksi yang terjadi sedikit mirip dengan fluorin, yakni menghasilkan sebuah campuran karbon dan hidrogen halida. Keagresifan reaksi berkurang tajam semakin ke bawah golongan mulai dari fluorin sampai klorin sampai bromin.
Reaksi-reaksi yang menarik terjadi dengan adanya sinar ultraviolet (begitu juga sinar matahari). Reaksi-reaksi ini disebut reaksi fitokimia, dan terjadi pada suhu kamar.
Reaksi substitusi terjadi dengan mekanisme dimana atom-atom hidrogen
dalam metana digantikan oleh atom-atom klorin. Hasil reaksi adalah campuran klorometana, diklorometana, triklorometana dan tetraklorometana.
Campuran antara gas tidak berwarna dengan sebuah gas berwarna hijau ini akan menghasilkan hidrogen klorida dalam bentuk uap asap dan kabut cairan-cairan organik. Semua produk organik berbentuk cair dalam suhu kamar terkecuali klorometana yang merupakan sebuah gas.
Jika klorin diganti dengan bromin, kita bisa mencampur metana dengan uap bromin, atau menggelembungkan metana melalui cairan bromin – paparkan kedua prosedur ini terhadap sinar UV. Campuran gas yang terbentuk akan berwarna merah-coklat dan bukan hijau.
Reaksi-reaksi ini tidak bisa digunakan untuk membuat senyawa-senyawa organik yang dihasilkan dalam laboratorium karena campuran hasil reaksinya sangat sulit dipisahkan.
Reaksi alkana-alkana yang lebih besar dengan klorin
Sebagai contoh, dengan propana, akan diperoleh salah satu dari dua isomer berikut:
Jika salah satu dari dua isomer yang terbentuk ini hanya secara kebetulan tanpa ada faktor lain, maka bisa diperoleh jumlah isomer yang tiga kali lebih banyak dengan klorin pada atom karbon ujung. Ada 6 hidrogen yang bisa terganti pada atom-atom karbon ujung dan hanya 2 pada atom karbon tengah.
Sebenarnya, jumlah setiap dari dua isomer ini yang diperoleh hampir sama.
Jika digunakan bromin, kebanyakan hasil reaksi adalah isomer dimana bromin terikat pada atom karbon tengah, bukan pada atom karbon ujung.
2.3.3 Reaksi-reaksi antara Sikloalkana dengan Unsur-unsur Halogen Dibawah sinar UV, siklopropana akan mengalami reaksi substitusi dengan klorin atau bromin. Akan tetapi, sikloalkana juga memiliki kemampuan untuk bereaksi dalam kondisi tanpa cahaya.
Dengan adanya sinar UV, siklopropana bisa mengalami reaksi adisi dimana cincinnya terputus. Sebagai contoh, dengan bromin, siklopropana menghasilkan 1,3-dibromopropana.
Reaksi ini masih bisa terjadi dengan adanya sinar biasa – tetapi reaksi substitusi juga terjadi pada kondisi ini.
Struktur cincin terputus karena siklopropana mengalami regangan cincin. Sudut-sudut ikatan dalam cincin menjadi 60° dan tidak normal lagi yaitu sekitar 109.5° ketika karbon membentuk empat ikatan tunggal.
Timpang tindih antara orbital-orbial atom dalam pembetukan ikatan C-C tidak lagi seperti pada keadaan normal, dan terjadi tolak-menolak yang cukup besar antara pasangan-pasangan elektron ikatan. Sistem akan menjadi lebih stabil jika cincin terputus.
2.4. Kecepatan Reaksi Halogenasi
sebagai berikut:
k =
RH + X2 RX +HX dan r = k [RH][X2]
dengan: k = konstanta kecepatan reaksi E = tenaga aktivasi
A = tetapan = konstanta tumbukan
Makin kecil harga E maka reaksi akan makin cepat. Harga E ini merupakan fungsi yang kompleks dari tenaga pemecahan ikatan dan tenaga pembentukan dalam reaksi. Sehingga untuk kebanyakan reaksi harga E diperoleh secara eksperimental.
Pada umumnya reaksi halogenasi adalah reaksi berantai. Ada tiga bentuk mekanisme reaksi yaitu:
1. CH4 + X2 CH3X + HX q1 kalori
Reaksi ini berjalan cepat karena reaksinya berantai dan berjalan secara termis dan yang bereaksi adalah radikal bebas.
2. a. ½ X2 X q2 kalori b. CH3 : H + X H3C + HX c. H3C + X2 CH3X + X
Radikal bebas X akan menarik elektron lagi dari CH4, terjadi radikal bebas CH3, yang bereaksi lagi dengan X2, terbentuk radikal bebas X dan seterusnya, terjadi reaksi berantai.
3. a. ½ X2 X q3 kalori b. CH3 : H + X CH3X + H c. H + X 2 HX + X
Dari ketiga reaksi 1, 2 dan 3, reaksi yang paling cepat akan mengalahkan yang lainnya.
Dari persamaan k = A. e-E/RT; untuk E positif maka reaksi yang paling cepat adalah yang memerlukan tenaga aktivasi paling kecil.
Melihat dari panas reaksinya, misalkan nilai q2<q3<q1, maka bila kita memberikan panas q1 kalori, tetapi baru sampai q2 kalori sudah terjadi reaksi yaitu reaksi 2 dan sudah selesai reaksinya.
Untuk menentukan harga E:
1. Dari persamaan konstanta kecepatan reaksi: ln k E
R T1 ln A
Buat grafik ln k dengan 1/T akan diperoleh garis lurus dengan koefisien tangen arah sebesar –E/R, sehingga harga E dapat dihitung.
Tetapi pada beberapa reaksi harga k sukar menentukannya.
α Slope -E/R = tg α ln k
1/T
2. Menggunakan mekanika kuantum, sukar dilakukan dalam praktek. 3. Dengan bantuan tenaga ikatan.
Dianggap bahwa radikal bebas aktif sekali sehingga tidak memerlukan tenaga ikat, harga E = 0
Juga kalau reaksinya eksotermis E = 0, sedang kalau reaksinya endotermis, harga E = H. Untuk tenaga ikat diperlukan data.
Tenaga Ikatan pada 25 o C (Kkal.)
Jenis Ikatan F Cl Br I
X – X 63,5 57,8 46,1 36,3
H – X 147,6 102,9 87,4 71,6
C - X 103,8 66,6 53,0 38,7
C = C 95,0 I – Cl 51,0 C C 124,5 Br – Cl 52,7 C – H 87,7 Cl – F 86,4 H – H 103,0
Misal reaksi antara CH4 dengan Cl2 dalam fase gas, homogen, katalisator Fe. Ada beberapa kemungkinan mekanisme reaksi:
a. CH4 + Cl2 CH3Cl + HCl
Untuk menghitung tenaga aktivasi atau panas reaksi dari percobaan laboratorium.
b. 1) ½ Cl : Cl Cl
Cl reaktif sekali, Cl ini akan menyerang apa saja.
Pecahnya ikatan Cl : Cl tenaga dibutuhkan = ½ (57,8) = 28,9 Kkal
2) CH4 + Cl CH3 + HCl
Pecahnya ikatan C – H, tenaga dibutuhkan = 87,7 Kkal Timbulnya ikatan H – Cl, tenaga keluar = -102,9 Kkal Ada selisih tenaga keluar = -15,2 Kkal
3) CH3 + Cl 2 CH3X + Cl
Pecahnya ikatan Cl – Cl, tenaga yang dibutuhkan = 57,8 Kkal Timbulnya ikatan C – Cl, tenaga yang dikeluarkan = -66,6 Kkal Ada selisih tenaga keluar = -8,8 Kkal
c. 1) ½ Cl : Cl Cl
Pecahnya ikatan Cl : Cl, tenaga yang dibutuhkan = 28,9 Kkal
2) CH4 + Cl CH3Cl + H
Pecahnya ikatan C – H, tenaga dibutuhkan = 87,7 Kkal Timbulnya ikatan C – Cl, tenaga keluar = -66,6 Kkal Ada selisih tenaga yang dibutuhkan = 21,1 Kkal
3) H + Cl : Cl HCl + Cl
Pecahnya ikatan C – Cl, tenaga dibutuhkan = 57,8 Kkal Timbulnya ikatan H – Cl, tenaga dikeluarkan = -102,9 Kkal Ada selisih tenaga yang dikeluarkan = -45,1 Kkal
Mekanisme bagian c membutuhkan tenaga aktivasi 28,9 + 21,1 = 50 Kkal, sedangkan mekanisme bagian b hanya membutuhkan tenaga 28,9 Kkal. Oleh karena itu mekanisme yang dipilih untuk reaksi tersebut adalah mekanisme bagian b (yang mempunyai tenaga aktivasi terkecil).
Panas reaksi pada mekanisme bagian b adalah: = 87,7 – 102,9 + 57,8 – 66,6 = -24 Kkal
Adanya peroksida akan mempermudah reaksi karena tak memerlukan tenaga yang besar untuk membentuk radikal bebas. Peroksida berfungsi sebagai katalisator yang membantu pembentukan radikal bebas.
ROOR RO + OR, reaktif sekali.
Untuk Iodium karena reaksinya lambat, kemungkinan reaksinya mengikuti mekanisme bagian a. Mekanisme bagian b tenaga aktivasinya lebih kecil daripada yang bagian c.
Untuk F : E2 = E3 Cl : E2 < E3 Br : E2 < E3 I : E2 < E3,
tetapi untuk I kemungkinan reaksinya mengikuti mekanisme bagian a.
Halogenasi ini reaksinya cepat karena berjalan dengan radikal bebas sehingga akan timbul panas besar. Kalau tidak disiapkan dengan baik maka timbunan panasnya akan banyak sekali dan bisa timbul bahaya peledakan. Jadi pada reaksi halogenasi harus ditambah katalisator negatif yang akan memperlambat jalannya reaksi. Atau ditambah bahan lain, misalnya O2, yang akan memperlambat reaksi karena dapat bereaksi dengan radikal bebas membentuk oksida atau alkohol, sehingga radikal bebasnya habis dan untuk berjalannya reaksi lagi harus dari permulaan lagi. Bisa juga dengan penambahan Na dan K (yang mungkin akan mempercepat atau
memperlambat) tergantung kepada zat yang akan bereaksi. Misal: X2 X + X
Na Na+ + e X + e X
-X- di sini tidak bereaksi dengan alkana, maka kecepatan reaksi diperkecil. Atau dengan penambahan benzil oksida.
- C – O – O – C - 2 - C – O
O O O
Maka reaksi dipercepat.
Bukti-bukti bahwa halogenasi adalah reaksi berantai:
1. Dengan penambahan O2 reaksi menjadi lambat. 2. Dengan penambahan Na dan K.
3. Dengan penambahan benzil oksida.
Reaksi substitusi terhadap ikatan rangkap
Kemungkinan mekanisme reaksi sebagai berikut: a. CH2 = CH2 + X : X CH2 = CHX +
HX Termasuk reaksi bimolekuler.
Dilihat apakah bisa bereaksi secara radikal bebas untuk X = Cl.
b. ½ Cl2 Cl Dibutuhkan 28,9 Kkal CH2 = CH2 + Cl CH2 = CH + HCl Dikeluarkan -15,2 Kka l Pecahnya ikatan C – H 87,7 Kka l Terbentuknya H – Cl -102,9 Kka l CH2 = CH + Cl 2 CH2 = CHCl + Cl Dikeluarkan -8,8 Kkal Pecahnya ikatan Cl – Cl 57,8 Kka l
Terbentuknya C – Cl -66,6 Kkal c. ½ Cl2 Cl Dibutuhkan 28,9 Kka l CH2 = CH2 + Cl CH2 = CHCl + H Dibutuhkan 21,1 Kka l Pecahnya ikatan C – H 87,7 Kkal Terbentuknya ikatan C – Cl -66,6
Kka l
H + Cl 2 HCl + Cl
Dikeluarkan -45,1 Kkal
Pecahnya ikatan Cl – Cl 57,8 Kkal Terbentuknya ikatan H – Cl -102, 9 Kkal
Mekanisme bagian b membutuhkan tenaga aktivasi lebih kecil = 28,9 Kkal. Mekanisme bagian c membutuhkan tenaga aktivasi 28,9 + 21,1 = 50 Kkal. Mekanisme yang terjadi adalah mekanisme bagian b
Reaksi addisi terhadap ikatan rangkap
Kemungkinan mekanisme reaksi sebagai berikut: a. CH2 = CH2 + Cl2 CH2Cl – CH2Cl
Termasuk reaksi bimolekuler. Timbul panas dari reaksinya tetapi memerlukan panas/tenaga aktivasi. Kemungkinan reaksi ini adalah reaksi berantai.
b. ½ Cl2 Cl Dibutuhkan 28,9
Kka l Cl + CH 2 = CH2 CH2Cl – CH2
Dikeluarkan tenaga -27 Kkal Pecahnya ikatan rangkap C = C 95,8
Kka l Timbulnya ikatan C – C -56,2 Kkal Timbulnya ikatan C – Cl -66,6 Kka l CH2Cl – CH2 + Cl : Cl CH2Cl – CH2Cl + Cl
Dikeluarkan tenaga -8,8 Kkal Pecahnya ikatan Cl – Cl 57,8 Kka l Timbulnya ikatan C – Cl -66,6 Kka l
Tenaga aktivasi dibutuhkan = 28,9 Kkal. Panas reaksi = 27 – 8,8 = -35,8 Kkal.
Ternyata reaksi adisi ikatan rangkap lebih mudah daripada reaksi substitusi, karena panas reaksi untuk reaksi adisi lebih besar. Kerman menghitung tenaga aktivasi untuk substitusi halogenasi etilin menggunakan mekanika kuantum (dengan satuan Kkal).
Reaksi Cl Br I
Bimolekuler 43,4 46,0 51,2
Rantai 45,0 47,0 54,0
Reaksi adisi pada Br2 dan I2 lebih mudah daripada Cl2. Reaksi adisi memerlukan tenaga aktivasi yang lebih kecil daripada reaksi substitusi. Jadi reaksi adisi lebih mudah daripada reaksi substitusi.
Pada reaksi adisi:
Untuk Brom dan Iodium, reaksi rantai lebih mungkin terjadi daripada reaksi bimolekuler. Sedang untuk khlor, mungkin terjadi reaksi rantai, mungkin reaksi bimolekuler, mungkin juga reaksi tidak berjalan.
Jadi pada suhu rendah terjadi reaksi adisi sedang pada suhu tinggi terjadi reaksi substitusi, tetapi juga tergantung pada bahannya.
Jadi halogenasi pada suhu rendah:
- Untuk alkana reaksinya substitusi. - Untuk olefin reaksinya adisi. Jika halogenasi pada suhu tinggi:
- Untuk alkana reaksinya substitusi. - Untuk olefin reaksinya substitusi.
Hasil percobaan menunjukkan bahwa pada halogenasi lebih mungkin reaksinya reaksi rantai sebab terjadi radikal bebas.
Dehidrohalogenasi, terjadi reaksi secara radikal bebas. CH2X – CH2X CH2 = CHX + HX Reaksinya endotermis, jadi perlu panas.
Terjadinya juga secara radikal bebas dan berantai sebagai berikut: ½ X2 X , X 2 hanya ditambahkan sedikit sebagai katalisator. CH2X – CH2X + X
HX + CH2X - CHX
CH2X - CHX
CH2 = CHX + X
Inilah mekanisme reaksi rantai dehidrohalogenasi dengan katalisator (penambahan halogen sedikit).
Mekanisme halogenasi benzena
Bisa secara radikal bebas dan bisa secara ion.
Secara Radikal Bebas: ½ X2 X
C H + X C H X Kalau didekatnya ada X:X lagi maka akan C H C H X X H C X C X H bergabung lagi. + X
Radikal bebas X akan menyerang benzena asli, sampai habis dan bila benzena sudah habis dan radikal bebas X masih ada, baru akan menyerang kepada benzena yang sudah terhalogenasi.
H C X + X + X : X C X H C H H C C C H X H + X H C C X H C H X
Jika masih ada lagi halogen yang dapat menjadi benzen yang sudah terhalogenasi, dan akhirnya akan terjadi benzena hexahalogenasi. Untuk memecah halogen menjadi radikal bebas, bisa dipakai katalisator (misal peroksida), juga panas (suhu yang tinggi), tetapi karena benzena pada suhu tinggi rusak, maka tidak dapat dipakai suhu tinggi. Dapat dipakai sinar tertentu dengan panjang gelombang tertentu, sehingga dinamakan foto halogenasi.
Secara Ionik:
Mekanismenya mirip dengan nitrasi tetapi disini diinginkan ion halogen. Disini diperlukan senyawa yang mempunyai unsur dimana bisa menampung lebih dari 8 elektron pada kulit terluarnya. Unsur-unsur tersebut adalah logam-logam pada kolom III pada sistem periodik.
-X+ ini sangat reaktif dan sangat memerlukan elektron, jadi akan mencari tempat-tempat yang banyak elektronnya supaya menjadi stabil.
Jika halogennya masih banyak H+ + X2 HX + X+
H+ disini akan menyerang lagi gugus-gugus lain, menuju pada tempat-tempat yang rapat elektronnya terbesar.
Mudah masuk ke orto dan para tetapi dengan adanya + +X mesomeri maka lebih mudah masuk ke posisi para.
Untuk benzena yang sudah tersubstitusi, misalnya:
CH3 CH3
X : X + AlX3
X + H+ + atau
H+ + AlX4
-Gugus CH3 - mempermudah masuknya gugus yang baru dan masuk pada letak orto dan para.
Untuk:
O - C - OC2H5
Halogenasi toluen, secara radikal bebas. ½ X2 X
Dijalankan pada suhu yang tinggi (adisi lebih sulit terjadi), maka cabangnya yang diserang.
- CH3 + X - H2C + HX
Jika suhunya rendah masuknya pada posisi substituen mula-mula. - H2C + X : X Untuk: - CH2CH2CH3 Untuk alkohol: CH3CH2OH + X : X
maka kemungkinan masuknya halogen pada inti dan di mana rapat elektronnya besar yang dipengaruhi oleh
- CH2X + X
+ X : X
T>
- CH2CH2CH2X + HX
CH2XCH2OH + HX
Radikal bebas sukar didapat. Kalau reaksinya dilakukan pada suhu tinggi bisa terjadi radikal bebas, tetapi alkoholnya rusak. Dengan foto/sinar mungkin bisa, tetapi jarang dilakukan.
Jika halogenasi alkohol diteruskan dan kemudian dihidrolisa akan didapatkan: O
XCH2 – C – H . H2O (kloral hidrat)
Jika terhadap alkohol ini digunakan asam halogenida maka akan terjadi: CH3CH2OH + HX CH3CH2X + H2
Tetapi ini tidak dilakukan sebab alkohol harganya mahal dan asam juga mahal, lebih baik digunakan alkana sampai menjadi alkil halida.
Dalam reaksi rantai, salah satu sumber tenaga aktivasi khlorin sudah digunakan, kecepatan reaksi gas khlor dengan uap hidrokarbon parafin sama dengan fungsi komposisi molar campuran. Dalam batas tertentu reaksi ini akan menjadi begitu cepat sehingga campuran akan terjadi karena hamburan kebocoran panas dan masih dalam dekat batas-batas kecepatan nyala api akan naik ke daerah kecepatan peledakan.
Karena radikal bebas reaksinya cepat dan eksotermis sehingga reaksinya harus diawasi. Beberapa cara pencegahan antara lain:
1. Panas yang timbul harus diserap sebaik-baiknya, misal dengan penambahan zat yang langsung bersentuhan, sehingga terjadi penyerapan panas langsung. 2. Membatasi kesempurnaan reaksi RH.
3. Memilih zat pereaksi yang tidak terlalu aktif. 4. Waktu reaksi dibatasi.
Keterangan:
1. Panas diambil langsung dari reaktornya denan penambahan zat penyerap. A
B
Reaktor C
a. Salah satu pereaksi berlebihan. Karena hidrokarbon relatif lebih murah maka hidrokarbonnya yang berlebihan.
Biasanya HC : X2 = 15 : 1
Kelebihan panas dapat diserap oleh kelebihan hidrokarbonnya. Kalau pada reaksi:
1 gmol X2 + 1 gmol RH 1 gmol RX + 1 gmol HX + Q
Disini Q hanya diserap oleh 1 gmol RX + 1 gmol HX sehingga kelebihan panas masih cukup besar.
Kalau reaksinya:
1 gmol X2 + 15 gmol RH 1 gmol RX + 1 gmol HX + 14 gmol RH + Q Disini Q diserap oleh 1 gmol RX, 1 gmol HX dan oleh 14 gmol RH sisa, sehingga kelebihan panas jadi kecil.
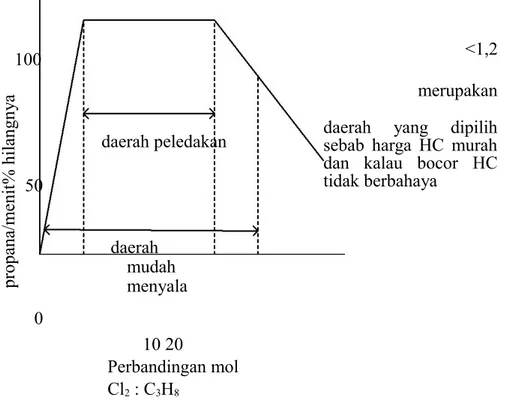
% h ila ng ny a pr op an a/ m en it 100 50 0 daerah peledakan daerah mudah menyala 10 20 Perbandingan mol Cl2 : C3H8 <1,2 merupakan daerah yang dipilih sebab harga HC murah dan kalau bocor HC tidak berbahaya
Grafik Efek Perbandingan Mol Pada Kecepatan Reaksi Khlor dan Propana
Kalau dipakai harga Cl2
-19,2 harga halogen mahal dan kalau terjadi C3 H 8
kebocoran berbahaya dan kelebihan X2 mengganggu dan juga ada kemungkinan didapatkan hasil lain, yaitu Polihalogenida.
Cl2/C3 H8
b. Dengan penambahan gas inert misalnya NO2, CO2, H2O, tetapi karena gas inert ini mahal harganya, maka proses ini jarang/tidak dilakukan.
2. Berhubungan dengan keterangan 1.
3. Biasanya pada fluorinasi.
a. RH dibuat besar, ditambah inert, tetapi masih reaktif. Biasanya F2 dan inert ditambah, maka keaktifan dikurangi.
b. Menggunakan senyawa gabungan, misalnya FeF3, CoF3. Tetapi harga senyawa ini mahal.
c. RH + Pelarut + F2
Harus dipilih pelarut yang benar-benar stabil sebab F2 ini sangat reaktif, sehingga kalau salah memilih maka kemungkinan zat pelarutnya akan juga diserang.
Untuk gugus alkil primer, sekunder dan tertier; gugus alkil primer yang lebih mudah diserang. Untuk suhu yang tinggi substitusi lebih mudah.
4. Waktu reaksi kecil dan waktu tinggal reaksi dalam reaktor kecil, hasil reaksi cepat didinginkan, sehingga reaksi tidak sempurna.
Dalam foto halogenasi diperlukan cahaya dengan panjang gelombang tertentu, biasa dipakai lampu Cl sebagai sumber sinar. Dalam reaksi ini akan timbul HX maka bahan reaktor harus tahan korosi.
Reaktor:
1. Bahannya harus tahan korosi. 2. Harus tahan suhu tinggi.
Untuk 1 dan 2 bisa dipilih dari bahan keramik.
3. Panas yang ada harus lebih mudah dikeluarkan artinya daya hantar panas harus baik.
Untuk syarat no.3 keramik tidak baik sama sekali, selain itu keramik tidak tahan tekanan, maka keramik tidak dapat digunakan. Agar perpindahan panas yang lebih baik, maka diberi kasa layer dari bahan yang tahan korosi tetapi harganya mahal.
Reaktor Alir : berbentuk pipa, kolom dan tangki berikut pipa-pipanya Reaktor Batch : tangki
Katalisator yang digunakan biasanya garam logam dari halogen dengan valensi 2 dan 3, misal AlX3 dan FeX3.
2.5 TERMODINAMIKA
RH + X2 RX + HX
Ditinjau dari panas reaksi yang menyertai maka untuk substitusi, reaksi yang bersifat eksotermik adalah flourinasi, chlorinasi, brominasi sedangkan iodinasi adalah endotermik, sebab ikatan antara F – F sangat kuat dan terbentuknya senyawa baru juga diikuti panas yang tinggi.
2Fo + oHR HF + RF Ikatan kuat
Sedangkan Iodium jari-jari atomnya besar, jadi ikatan antara I – I lemah.
Menyempurnakan reaksi:
1. Untuk F2, Cl2 dan Br2 reaksi sudah sempurna jadi tidak perlu disempurnakan, bahkan perlu dibatasi.
2. Untuk I2, reaksi setimbang oleh karenanya perlu diusahakan ke kanan, yaitu dengan mengikat HI yang terbentuk atau mengoksidasinya.
I : I + RH RI + HI HI + NaOH NaI + H
2O
Dioksidasi
HI + HNO3 I 2 + NO + H2O
Cara oksidasi lebih efisien karena I2 yang timbul dapat dipakai lagi.
Untuk reaksi adisi semua eksotermis. Kesetimbangan terletak di kanan pada semua suhu, yaitu untuk Cl2 sampai 1000oC untuk I2 sampai suhu 50oC, Br2 sampai suhu 700oC.
2.6 CONTOH HALOGENASI DALAM INDUSTRI
2.6.1 Reaksi C5H12 + Cl2 Dalam Fase Gas
C5H12 + Cl2 dalam fase gas dimasukkan dalam suatu reaktor bentuk pipa yang dibelok-belokan. C5H12 yang dipakai bisa normal atau iso.
C5H12 : Cl2 = 15 : 1
Kecepatan aliran gas-gas itu dalam reaktor bisa mencapai 90 km/jam. Tidak diperlukan katalisator sebab reaksinya secara radikal bebas. Suhu reaksi 250 oC – 300 oC. C5H12 semula berupa zat cair, mengandung air sedikit. Dari bahan-bahan ini dapat dibuat monokhlor pentana dan amil alkohol. Kemungkinan juga terjadi 5% C5H10Cl2, walau sudah dipakai perbandingan 15 : 1. Ada juga yang tidak bereaksi tetap sebagai C5H12. Air yang ada tidak boleh masuk. Kita harus mempunyai alat penguap dan alat pemisah hasil (dengan mengetahui sifat-sifat dari bahan dan hasilnya). Panas reaksi yang timbul besar dan reaksi berjalan cepat, maka pengawasan suhu harus ketat. Dinding reaktor terbuat dari bahan yang mudah dilewati panas.
C5H12 dijenuhkan dengan HCl. Bila dalam C5H12 terkandung air dan dapat dipisahkan.
Kelebihan C5H12 berguna untuk menghilangkan panas agar tidak terjadi peledakkan dan agar tidak terbentuk polihalogenasi.
Hidrokarbon dipompa pada tekanan 75 psig melalui pemanas dan diuapkan pada 85oC. Uap ini dilewatkan ventury throat dipertemukan dengan uap Cl2 yang masuk pada 50oC dan tekanan 60 psi. Pada daerah ini kecepatan uap pentana 60 mph lebih dengan perbandingan HC dan Cl2 kira-kira 15 : 1.
Pada kondisi ini campuran Cl2 dan dan HC akan terbaik pada suhu rendah dan dengan tidak adanya bahan pengaktif, tidak akan terjadi pembakaran dan kecepatan campuran pada reaksi rendah yang menyebabkan aliran reaksi tidak akan mengalir kembali dari reaktor ke alat pencampur. Rectifier akan me-reflux pentana dan khlor pentana dari dephlegmator.
Menurut Hass, khlorinasi pentana menghasilkan semua kemungkinan isomer dan jika reaksi dijalankan sekitar suhu 300 oC, didapat perbandingan hasil sebagai
berikut:
Dari n-pentana Dari iso-pentana
: 24% primer dan 76% sekunder.
: 50% primer, 28% sekunder dan 22% tertier.
2.6.2 Pembuatan DDT (1,1,1 – trikhloro – 2,2 – bis p – khlorophenil etan)
DDT sudah lama dikenal sebagai insektisida organik yang sudah dikembangkan puluhan tahun terakhir ini karena biaya produksinya rendah. DDT dihasilkan jika khloral atau khloral hidrat direaksikan dengan monokhlorbenzen menggunakan katalisator asam sulfat.
C6H4Cl CCl3CHO +2C6H5Cl H2SO4
CCl3CH +
H2O
C6H4Cl
Secara teoritis, kemungkinan terjadi isomer-isomer cukup banyak dan hasilnya bisa diperoleh dengan pemekatan. Para, isomer para atau p,p’ – DDT, melebur pada 108,5 oC – 109 oC dan terkandung dalam hasil kira-kira 70-75%. Sedang p,p’-DDT yang melebur pada 74-74,5 oC terdapat kira-kira 19-21%. Berdasar sifat-sifat insektisida standard, p,p’-DDT yang lebih aktif.
Khloral dan monokhlorbenzen dipadatkan dengan adanya asam sulfat berasap pada kira-kira 20 oC. Air yang terjadi dari reaksi diambil oleh asam, yang dipisahkan dari reaksi, lalu dikeluarkan. Kelebihan monokhlorbenzen digunakan untuk melarutkan DDT begitu terbentuk. Lapisan solven dicuci air dan dikeringkan untuk memungut monokhlorbenzen dan untuk mendapatkan DDT yang lunak, lalu didinginkan dan diturunkan.
Salah satu masalah dalam pendinginan dan penghalusan DDT adalah berdasarkan pada fase transisi kristal, kira-kira pada 65 oC dan mempunyai kecenderungan menjadi sangat dingin sampai menjadi bubur yang agak stabil. Cara terbaik bubur DDT dikristalkan pada 65-75 oC diikuti penurunan suhu sampai suhu kamar.
2.6.3Pembuatan Monokhlorbenzen (MCB)
Khlorinasi benzen umumnya dilakukan dalam tangki-tangki yang sempit dan tinggi, dilengkapi jaket pendingin atau pendingin permukaan. Alat-alat ini juga dilengkapi dengan kondensor refluk dan sirkulasi luar yang melalui pendingin. Cl2 dimasukkan melalui pipa distributorn (dari besi) di dekat dasar reaktornya. Benzen tak berair masuk ke khlorinator ditambah sejumlah kecil FeCl3 anhidrid (0,1-0,5%).
Cl2 masuk dengan digelembungkan, kecepatan umpan dikontrol untuk mempertahankan suhu. Dengan sirkulasi luar, khlorinasi benzen dipertahankan pada 55-60 oC. Jika sampel menunjukkan densitas yang dibutuhkan, aliran Cl2 dihentikan. Jika semua benzen dikhlorinasi, operasi dihentikan jika densitas mencapai 1,28 pada suhu 15 oC. Waktu yang dibutuhkan kira-kira 6 jam. Ada industri yang mengontrol suhunya pada 25-40 oC dan densitas hasil pada 1,06-1,1 untuk membatasi jumlah benzenpolikhlor.
HCl yang keluar lewat vent dalam dephlegmator atau sistem pemadatan dicuci dengan khloro atau o-dikhlorobenzen untuk mengambil berbagai kabut-kabut senyawa organik.
Benzen yang sudah dikhlorinasi dimasukkan ke dalam netralisator berbentuk tangki baja vertikal yang berjaket dilengkapi dengan refluk dan vent. Larutan kaustik soda ditambahkan sampai memberikan reaksi alkalis. Pada netralisator dilengkapi pengaduk propeller atau turbin dari bahan tahan karat. Aliran dipertahankan tetap hangat oleh jaket uap air selama pengolahan netralisasi.
Jika tes kedua memperlihatkan reaksi alkalis yang lemah, benzen yang dikhlorinasi dipindahkan ke dalam tangki pengendap dan dibiarkan selama beberapa jam. Endapan yang keluar dari dasar, kaya dengan dikhlorobenzen. Bagian yang atas dipompa ke tangki penyimpan yang dipanasi untuk mencegah terjadinya kristalisasi.
Sistem pemurnian berbentuk kolom horizontal yang dilengkapi dengan dephlegmator dan kondensor. Fraksi pertama terdiri dari benzen dan air. Fraksi kedua (yang mempunyai spesifik graviti 1,09-1,108) adalah khlorobenzen yang
belum murni yang kemudian dimasukkan ke dalam alat distilasi. Khlorobenzen murni didapatkan dengan spesifik graviti 1,108. Adanya p-dikhlorobenzen dalam embunan ditunjukkan oleh kenaikan densitas distilat. Titik ini diawasi secara ketat untuk mencegah kontaminasi hasil utama. Isomer para yang mempunyai titik didih agak rendah, dapat dipungut dengan murni menggunakan fraksinasi. Residu senyawa orto terkontaminasi isomer para dan derivat polikhloro, terutama 1,2,4-trikhlorobenzen.
Kalau khlorinasi benzen dijalankan dengan mengalirkan benzen dan khlor dalam reaktor yang disinari lampu pada suhu kamar maka akan diperoleh hexakhlorobenzen.
BAB III
3.1 Kesimpulan
- Halogenasi yaitu proses memasukkan 1 gugus halogen atau lebih. Cara penggantian gugus halogen ada beberapa cara, yaitu:
1. Mengganti H 2. Addisi
3. Mengganti suatu gugus (substitusi) - Zat-zat pereaksi untuk halogenasi: 1. Cl2, Br2, I2 dan F2
- Zat-zat yang dapat di halogenasi 1. Alkana secara substitusi
2. Olefin, secara addisi dan substitusi 3. Alkohol
4. Aldehid , keton dan asam 5. Halogenida
6. Senyawa aromatik, secara addisi atau substitusi 7. Senyawa aromatik yang mempunyai rantai cabang 8. Karbon disulfida
9. Antroquinon
- Tipe-tipe reaksi Halogenasi
1. Reaksi-reaksi antara Alkena dengan Unsur-unsur Halogen 2. Reaksi-reaksi antara Alkana dengan Unsur-unsur Halogen 3. Reaksi-reaksi antara Sikloalkana dengan Unsur-unsur Halogen - Faktor-faktor yang mempengaruhi Halogenasi
Adapun faktor-faktor yang dapat mempengaruhi diantaranya adalah konsentrasi, katalis, suhu ,luas permukaan, tekanan dan energi aktivasi. Semakin besar konsentrasi dari sampel yang digunakan maka laju reaksi semakin besar.
- Penerapan proses Halogenasi terjadi di industry : Reaksi C5H12 + Cl2 Dalam Fase Gas, Pembuatan DDT (1,1,1 – trikhloro – 2,2 – bis p – khlorophenil etan), Pembuatan