BAB II
TINJAUAN PUSTAKA
2.1 Protein
Manusia membutuhkan energi dan nutrisi untuk pertumbuhan,
pemeliharaan fungsi biokimia tubuh, dan perkembangannya. Nutrisi dikategorikan
menjadi dua yaitu makronutrisi yang terdiri dari karbohidrat, lemak dan protein,
dan mikronutrisi berupa vitamin dan mineral (Tull, 1996). Makronutrisi terutama
protein berperan penting karena kaitannya yang erat dengan proses-proses
kehidupan. Semua hayat hidup sel berhubungan dengan zat gizi protein. Nama
protein berasal dari kata Yunani ‘protebos’ yang artinya “yang pertama” atau
“yang terpenting” (Sediaoetama, 2008).
Protein adalah makromolekul penting yang mana tersusun dari asam-asam
amino yang terhubung oleh ikatan peptida membentuk struktur kompleks tiga
dimensi (Stayanarayana dan Chakrapati, 2007). Molekul protein mengandung
unsur-unsur C, H, O, dan N. Selain itu, protein juga dapat mengandung unsur
belerang, fosfor, serta logam seperti seng dan besi (Tull, 1996). Telah banyak
studi tentang berapa banyak jumlah protein yang diperlukan oleh tubuh per
harinya untuk dapat memenuhi kebutuhan tubuh akan asam amino selama
beberapa tahun. Studi-studi tersebut menunjukkan bahwa kebutuhan protein untuk
orang dewasa normal adalah 0,8 g/kg berat badan. Kebutuhan ini sama untuk
wanita maupun pria (Forsythe, 1995).
analisis bahan makanan untuk menentukan kadar protein dengan menganggap
bahwa jumlah N yang terkandung sebanding dengan kadar protein di dalam
makanan (Sediaoetama, 2008).
2.1.1 Struktur protein
Protein tersusun atas unit-unit individual asam-asam amino. Setiap asam
amino memiliki gugus amin (NH
2) pada salah satu dari atom karbon pusat dan
sisi lainnya merupakan gugus asam (COOH). Di dalam makanan ada 20 jenis
asam amino yang berbeda, masing-masing memiliki struktur dasar yang sama,
yang membedakan hanyalah gugus R pada salah satu sisinya. Gugus R yang
berbeda dapat bervariasi dari atom tunggal hidrogen hingga molekul kompleks
yang membuat setiap asam amino unik (Forsythe, 1995). Struktur dasar asam
amino dapat dilihat pada Gambar 1.
H
NH
2-C- COOH
R
Gambar 1. Struktur dasar asam amino (Forysthe, 1995)
dipertautkan dengan ikatan peptida tersebut merupakan struktur primer protein
(Sediaoetama, 2008). Struktur primer protein dapat dilihat pada Gambar 2.
Gambar 2. Struktur Primer Protein (Usmeningsih, 2008)
Rantai polipeptida berinteraksi lokal melalui ikatan hidrogen atau ikatan
sulfhidril membentuk suatu konformasi yang berbentuk seperti spiral yang disebut
α
-helix
ataupun seperti lembaran yang disebut
β
-sheet.
Ada 13 atom yang terikat
dalam ikatan hidrogen pada
α
-helix
dimana ikatan hidrogen ini berorientasi sejajar
dengan sumbu heliks.
β
-sheet
terhubung secara lateral oleh lima atau lebih ikatan
hidrogen membentuk lembaran yang mana gugus asam dan basanya berorientasi
tegak lurus terhadap arah rantai. Konformasi ini dikenal sebagai struktur sekunder
protein
(Brown dan Rogers, 1981). Gambar struktur sekunder protein dapat dilihat
pada Gambar 3.
Gambar 3. Struktur Sekunder Protein (Usmeningsih, 2008)
Asam Amino
Struktur Primer Protein
adalah susunan rantai asam-asam
amino.
Lembaran yang berlipat
Alfa heliks
Struktur Sekunder Protein
Struktur tersier protein mengarah pada interaksi rantai polipeptida dan
struktur sekunder. Struktur ini terbentuk oleh karena gaya-gaya pada gugusan
reaktif yang lebih lemah pada protein yaitu gugusan yang mengandung muatan
listrik dan gaya tarik
Van der Waals
membentuk konformasi tiga dimensi
(Sediaoetama, 2008). Struktur tersier protein dapat dilihat pada Gambar 4.
Gambar 4. Struktur Tersier Protein (Usmeningsih, 2008)
Struktur kuartener protein terbentuk bila protein mengandung dua atau
lebih rantai polipeptida yang mempunyai konfigurasi tiga dimensi. Dimana
rantai-rantai polipeptida ini saling berinteraksi membentuk struktur yang lebih
kompleks (Brown dan Rogers, 1981). Struktur kuartener protein dapat dilihat pada
Gambar 5.
Gambar 5. Struktur Kuartener Protein (Usmeningsih, 2008)
Alfa heliks Lembaran yang berlipat
Struktur Kuartener Protein
adalah protein yang mengandung
lebih dari satu rantai polipeptida
Struktur Tersier Protein
Kombinasi dari struktur-struktur inilah yang memberikan struktur alamiah
yang khas pada molekul protein. Struktur alamiah kompleks ini diperlukan oleh
protein untuk dapat menjalankan fungsinya. Bila struktur stereometri alamiah ini
berubah atau rusak, maka protein tersebut akan kehilangan kesanggupannya untuk
memenuhi fungsi fisiologisnya (Sediaoetama, 2008).
2.1.2 Klasifikasi Protein
Klasifikasi protein dapat dibagi dua yaitu berdasarkan komponen
penyusun dan fungsi fisiologisnya. Protein berdasarkan komponen penyusunnya
terbagi tiga yaitu protein sederhana (
simple protein
) yang bila dihidrolisis
menghasilkan asam amino (albumin), protein kompleks (
Complex/Conjugation
Protein
) yang bila dihidrolisis menghasilkan berbagai jenis asam amino dan juga
komponen lain yang bukan protein seperti unsur logam, gugus fosfat, lipid,
karbohidrat dan asam nukleat (kromoprotein, lipoproterin, glikoprotein,
fosfoprotein, dan nukleoprotein) dan protein derivat yang merupakan produk
antara sebagai hasil hidrolisis parsial protein (albumosa, pepton dan peptida)
(Sediaoetama, 2008).
contohnya: legumin dan gliadin. Protein tidak sempurna adalah protein yang
mengandung asam amino essensial tidak lengkap, protein ini tidak dapat
menyokong pertumbuhan maupun untuk pemeliharaan jaringan, contohnya zein
(Suhardjo dan Kusharto, 2010).
2.1.3 Sumber Protein
Sumber protein dapat berasal dari hewani dan nabati. Sumber protein
hewani berupa daging ataupun organ-organ dalam seperti hati, pankreas, jantung,
paru-paru, jerohan (babat/
gaster
dan usus halus dan usus besar/
iso
), telur, susu,
ikan, kerang, jenis udang dan produk olahannya (Sediaoetama, 2008).
Sumber protein nabati berasal dari sumber padi-padian, biji-bijian,
kacang-kacangan, gandum dan produk olahannya. Contoh protein nabati yang bersumber
dari padi-padian: nasi, pasta, dan roti; untuk golongan kacang-kacangan: kacang
polong, kacang tanah, kacang kedelai, kacang merah, kacang almond, kacang
mente, dan sebagainya; dari biji-bijian: biji wijen, biji bunga matahari, dan biji
labu (Marshall, 2002).
Kandungan kolesterol dan lemak jahatnya rendah serta kaya akan lesitin
yang mampu mengurangi kadar kolesterol darah, disamping itu juga mengandung
baik serat yang larut maupun tidak larut. Kandungan seratnya yang tinggi dapat
mempercepat pengeluaran ammonia dari tubuh (Almatsier, 2006).
Kacang-kacangan dibagi dalam beberapa suku yaitu Vicieae contohnya
kacang golongan
peas
dan
lentils
, suku Hedysareae contohnya golongan
nuts
dan
suku Phaseolaeae contohnya golongan
beans
dan
peanuts
(Sathe dan Deshpande,
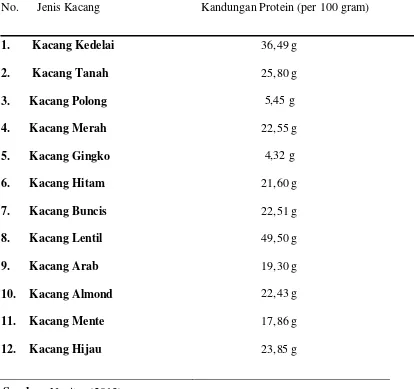
2003). Kandungan protein dari beberapa jenis kacang-kacangan dapat dilihat pada
Tabel 1.
Tabel 1. Kandungan protein dari beberapa jenis kacang-kacangan
Kacang-kacangan golongan
peas
,
beans
dan kacang tanah memiliki
cadangan protein yang tinggi dalam bijinya karena adanya bantuan dari bakteri
yang hidup pada akar tumbuhan tersebut, dimana bakteri-bakteri ini mengkonversi
unsur nitrogen dari udara untuk digunakan tumbuhan tersebut. Sementara
kacang-kacangan golongan
nuts
menyediakan protein berkualitas tinggi, akan
tetapi, kacang golongan ini juga tinggi kandungan lemak dan kalorinya sehingga
jarang dijadikan sumber nutrisi dalam makanan tetapi lebih sering dijadikan
selingan makanan (Eschleman, 1984).
2.1.4 Fungsi Protein
Protein
dalam makanan berperan dalam pertumbuhan, pemeliharaan dan
perbaikan jaringan, sintesis enzim, sintesis hormon, sistem imun tubuh atau
mekanisme pertahanan tubuh dan juga sebagai cadangan energi (Tull, 1996).
Fungsi protein yang paling ditekankan adalah sebagai zat pembangun atau
pembentuk yang berperan dalam pertumbuhan dan pemeliharaan jaringan,
menggantikan sel-sel yang mati dan rusak terpakai. Sebagai zat pengatur, protein
mengatur proses-proses metabolisme dalam bentuk enzim dan hormon. Boleh
dikatakan bahwa semua proses metabolik (reaksi biokimia) di dalam tubuh diatur
dan dilangsungkan atas pengaturan enzim (Sediaoetama, 2008).
harmonis antara proses metabolisme yang satu dengan yang lain. Contohnya
hormon pertumbuhan (GH) dan somatotropin (STH) yang berfungsi untuk
pertumbuhan dan perkembangan jaringan dapat dirusak oleh enzim tripsin dan
pepsin (Sumardjo, 2006).
Protein yang berperan dalam sistem imun tubuh adalah immunoglobulin
yang secara otomatis dibentuk oleh tubuh bila ada antigen yang masuk ke tubuh.
Sebagai zat pengangkut protein membawa ion dan molekul tertentu dari suatu
organ ke organ lainnya melalui aliran darah. Contohnya hemoglobin untuk
mengangkut oksigen dari paru-paru ke jaringan (Sumardjo, 2006).
Mengingat fungsi protein yang sangat penting, sudah selayaknya bila
protein ini diberikan perhatian dan tempat penting dalam penyediaan pangan, baik
bagi anak-anak maupun orang tua (Sediaoetama, 2008).
2.2 Pencernaan dan Metabolisme Protein
polipeptida membentuk dipeptida yang kemudian oleh dipeptidase diubah menjadi
asam amino (Sumardjo, 2006).
Selanjutnya asam amino diabsorpsi, asam amino akan terdeposito di dalam
hati atau otot di dalam kantong asam amino untuk dapat digunakan pada sintesis
protein dalam tubuh. Setelah selesai makan, tubuh dalam kondisi anabolik. Ini
berarti bahwa tubuh telah siap untuk sintesis protein. Materi genetik dalam tubuh
yaitu
Deoxyribo Nucleic Acid
(DNA) menyediakan “
blueprint
” untuk sintesis
protein. DNA menyediakan informasi asam amino mana yang diperlukan dan
urutan protein apa yang harus disintesis. Selama seluruh asam amino tersedia di
dalam kantungnya, sintesis protein akan terus berlangsung. Sangatlah penting
bahwa semua asam amino tersedia dalam jumlah yang cukup ketika protein
disintesis. Struktur dan fungsi dari setiap rantai protein tergantung pada urutan
daripada asam-asam aminonya (Forsythe, 1995).
2.3 Penyakit yang berhubungan dengan Protein
Penyakit yang berkaitan dengan protein yaitu: 1) berdasarkan defisiensi
protein (penyakit utama) dan 2) penyakit penyerta.
1.
Berdasarkan defisiensi protein
Manifestasi dari marasmus adalah pertumbuhan yang terhambat. Berat
badan penderita dibawah 60% berat badan standar sehingga penderita terlihat
sangat kurus seperti hanya terbungkus oleh kulit, di jaringan subkutan tidak
ditemukan adanya jaringan otot dan lemak. Keadaan ini disebut p
aniculus
adiposus
. Karena tidak adanya jaringan otot dan lemak di subkutan, kulit
penderita menjadi kusut dan berlipat kurus (
oldman face/monkey face)
. Pada
penderita kwashiorkor tubuhnya kurus tetapi berat badan penderita diatas 60%
berat badan standar. Penderita tampak apatis, kadar albumin dalam darah juga
turun drastis, terjadi udema akibat akumulasi cairan pada jaringan limfa dan
abdomen. Warna rambut penderita belang (
flag sign phenomena),
kulitnya juga
kasar, kering dan tampak garis-garis permukaan yang nyata (
mosaic skin)
(Crowley, 2011).
2.
Penyakit penyerta
Menurut Sediaoetama (2008), penderita defisiensi protein biasanya akan
mengalami infeksi yang merupakan penyakit penyerta. Hal ini terjadi karena
menurunnya daya imun tubuh secara umum sehingga lebih rentan terhadap
serangan berbagai penyakit infeksi. Karena infeksi penderita akan mengalami
demam, diare, dehidrasi, dan kadang kejang. Penyakit infeksi yang sering
dijumpai adalah:
a.
Infeksi saluran nafas, terutama saluran nafas bagian atas.
Terapi untuk penderita defisiensi protein yang pertama harus ditanggulangi
adalah gejala infeksi akut seperti kejang, diare, dan dehidrasi. Kemudian
menangani infeksi spesifik sambil menangani kondisi kekurangan kalori protein
(KKP). Penanganan penyakit dilakukan dengan memberi makanan cair terlebih
dahulu dengan kalori dan zat gizi yang cukup. Konsentrasi zat diberi secara
parsial dan bertingkat. Bila penderita telah dapat bertahan dengan makanan cair
konsentrasi tinggi maka dilanjutkan dengan pemberian makanan semi padat
kemudian makanan padat (Sediaoetama, 2008).
2.4
Pengaruh Pengolahan Terhadap Protein
amino yang mengandung sulfur akibat teroksidasi radikal bebas (Palupi, dkk.,
2007).
Penelitian oleh Sumiati (2008) pada ikan mujair (
Tilapia moasambica
)
membuktikan bahwa proses pengolahan yang berbeda akan mempengaruhi nilai
gizi terutama kandungan proteinnya. Kandungan protein ikan mujair menurun dari
62,97 g/100 g menjadi 59,84 g/100 g pada perebusan, 59,05 g/100 g pada
pengukusan, 57,78 g/100 g pada pemanggangan dan penurunan paling drastis
terjadi pada penggorengan yaitu menjadi 33,32 g/100 g.
2.5 Analisis Protein
Analisis protein dapat dilakukan dengan dua cara yaitu 1) secara langsung
menggunakan zat kimia yang spesifik terhadap protein, contohnya seperti dengan
pereaksi Biuret, Lowry, Bradford atau dengan metode pengikatan warna dimana
konsentrasi ditentukan berdasarkan kompleks warna yang terbentuk; 2) secara
tidak langsung dengan menghitung jumlah nitrogen yang terkandung di dalam
bahan, contohnya metode Kjeldahl dan metode Dumas dimana kadar protein
sebanding dengan total N yang terkandung di dalamnya (Rhee, 2005).
2.5.1 Metode Kjeldahl
Sejak abad ke-19, metode Kjeldahl telah dikenal dan diterima secara
universal sebagai metode untuk analisis protein dalam berbagai variasi produk
makanan dan produk jadi (Rhee, 2005). Penetapan kadar protein dengan metode
Kjeldahl merupakan metode empiris (tidak langsung) yaitu melalui penetapan
kadar N dalam bahan yang disebut protein kasar (Estiasih, dkk., 2012).
bereaksi dengan asam pekat membentuk garam amonium. Kemudian ditambahkan
basa untuk menetralisasi suasana reaksi dan kemudian didestilasi dengan asam
dan dititrasi untuk mengatahui jumlah N yang dikonversi (Estiasih, dkk., 2012).
Tahapan kerja pada metode Kjeldahl dibagi tiga yaitu:
a.
Tahap Dekstruksi
Pada tahap ini, sampel dipanaskan dengan asam sulfat pekat sehingga
terjadi destruksi menjadi unsur karbon (C), hidrogen (H), oksigen (O) dan
nitrogen (N) kemudian teroksidasi menjadi karbon monoksida (CO), karbon
dioksida (CO
2) dan air. Unsur N akan bereaksi dengan asam sulfat membentuk
garam amonium sulfat. Untuk mempercepat proses destruksi maka ditambahkan
katalisator berupa campuran Na
2SO
4dan HgO atau K
2SO
4dan CuSO
4. Gunning
menyarankan penggunaan katalisator K2SO4 dan CuSO4 karena sifat kalium sulfat
yang dapat menaikkan titik didih sehingga destruksi berlangsung lebih cepat dan
sempurna. Terkadang dapat pula ditambahkan selenium untuk mempercepat
proses oksidasi akan tetapi, selenium sifatnya lebih reaktif sehingga oksidasi
berlangsung sangat cepat yang memungkinkan hilangnya unsur nitrogen (Rohman
dan Sumantri, 2007). Menurut Chang (1998), reaksi pada tahap destruksi adalah:
H H H
-OOC-C- NH
-C- COO- NH- C- COO- (NH
4)
2SO
4R R R
b.
Tahap Destilasi
Garam amonium sulfat yang terbentuk dipecah menjadi ammonia (NH3)
dengan penambahan basa NaOH dan dipanaskan. Ammonia yang dilepas
ditampung dalam larutan asam. Agar kontak antara asam dan ammonia
H2SO4
berlangsung sempurna maka ujung tabung destilasi harus tercelup sedalam
mungkin dalam larutan asam. Pada tahap destilasi dapat juga ditambahkan logam
Zn agar tidak terjadi
superheating
(percikan cairan atau timbulnya gelembung gas
yang besar) (Rohman dan Sumantri, 2007). Menurut Chang (1998), reaksi pada
tahap destilasi adalah:
(NH
4)
2SO
4+ H
2O + 2 NaOH 2 NH
4OH + Na
2SO
4NH
4OH
+ H
2SO
4NH
4HSO
4+ H
2O
c.
Tahap Titrasi
Bila larutan asam yang digunakan untuk penampung destilat adalah asam
klorida dan asam sulfat maka sisa asam yang tidak bereaksi dengan amonia akan
bereaksi dengan larutan pentiter yaitu NaOH. Tetapi bila digunakan larutan
penampung destilat berupa asam borat maka banyaknya asam borat yang bereaksi
dengan ammonia dapat diketahui dengan mentritrasi ion amonium dengan
menggunakan pentiter HCl (Rohman dan Sumantri, 2007). Menurut Chang
(1998), reaksi pada tahap titrasi adalah sebagai berikut:
H2SO4 + 2NaOH Na2 SO4 + 2 H2O
Menurut Rohman dan Sumantri (2007), kadar protein dalam sampel dapat
dihitung dengan rumus:
Kadar =
(𝑉𝑉 𝑏𝑏𝑏𝑏𝑏𝑏𝑏𝑏𝑏𝑏𝑏𝑏 −𝑉𝑉 𝑠𝑠𝑏𝑏𝑠𝑠𝑠𝑠𝑠𝑠𝑏𝑏) 𝑥𝑥𝑁𝑁𝑁𝑁𝑏𝑏𝑁𝑁𝑁𝑁𝑥𝑥𝑏𝑏,𝑏𝑏14 𝑥𝑥𝐹𝐹𝐹𝐹𝐵𝐵𝐵𝐵
𝑥𝑥
100%
dimana :
Faktor konversi untuk berbagai macam bahan dapat dilihat pada Tabel 2.
Tabel 2. Faktor konversi untuk berbagai macam bahan
N
o
Bahan
Faktor Konversi (FK)
1
Bir, sirup, biji-bijian, ragi, makanan
ternak, buah-buahan, teh, anggur
6,25
2
Beras
5,95
3
Roti, gandum, makaroni, bakmi
5,70
4
Kacang tanah
5,46
5
Kedelai
5,75
6
Kenari
5,18
7
Susu
6,38
Sumber: Rohman dan Sumantri (2007)
Keuntungan menggunakan metode Kjeldahl ini adalah dapat diaplikasikan
untuk semua jenis bahan pangan, tidak memerlukan biaya yang mahal untuk
pengerjaannya, dapat dimodifikasi sesuai kuantitas protein yang dianalisis.
Adapun kerugiannya adalah yang ditentukan adalah jumlah total nitrogen yang
terdapat didalamnya bukan hanya nitrogen dari protein, waktu yang diperlukan
relatif lebih lama (minimal 4 jam untuk menyelesaikannya), presisi yang lemah,
pereaksi yang digunakan ada yang bersifat beracun, korosif dan berbahaya bagi
kesehatan, dan adanya variasi faktor konversi untuk masing-masing sampel
(Chang, 1998).
2.5.2
Metode Spektrofotometri
1.
Metode pengukuran langsung pada panjang gelombang 205 nm dan 280 nm
Absorbansi pada panjang gelombang 205 nm dan 280 nm digunakan untuk
menghitung konsentrasi protein dengan terlebih dahulu distandarisasi dengan
protein standar. Metode ini dapat dengan mudah diaplikasikan dan sederhana,
cocok untuk larutan protein yang telah dimurnikan atau dimurnikan parsial.
Penetapannya berdasarkan absorbansi sinar ultraviolet oleh asam amino triptopan,
tirosin dan ikatan disulfida sistein yang menyerap kuat pada panjang gelombang
tersebut, terutama panjang gelombang 280 nm (Simonian, 2005).
Keuntungan metode ini adalah waktu yang diperlukan untuk analisis cepat,
memiliki sensitifitas yang baik, tidak ada gangguan dari ion ammonium dan
garam-garam buffer, larutan sampel masih dapat digunakan untuk analisis lain
selain analisis protein. Kerugian metode ini adalah asam nukleat juga memiliki
absorbansi yang kuat pada panjang gelombang 280 nm, susunan asam amino
aromatis dapat bervariasi untuk setiap sampel protein, larutan protein harus
benar-benar jernih dan tidak berwarna ataupun keruh (Chang, 1998).
2.
Metode pembentukan warna dengan pereaksi tertentu
a.
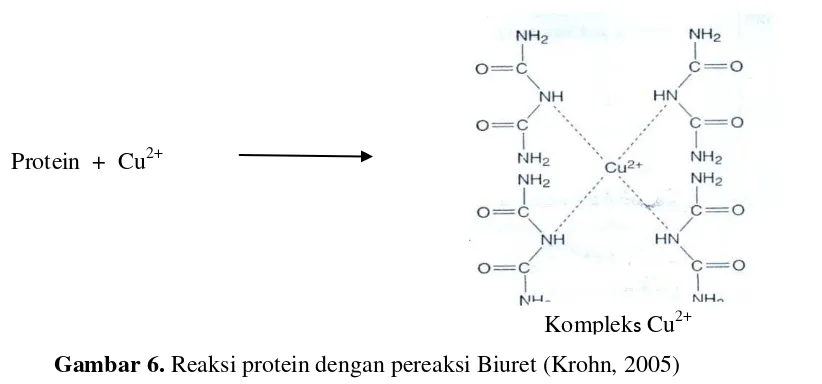
Pereaksi Biuret
Semua protein terususun dari asam-asam amino yang terhubung oleh
ikatan-ikatan peptida. Ion Cu
2+dari CuSO
4dalam suasana basa NaOH akan
membentuk kompleks dengan ikatan peptida protein (-CO-NH-), kompleks ini
memberikan akan warna sehingga konsentrasi protein dapat ditentukan dengan
spektrofotometer sinar tampak (Estiasih, dkk., 2012).
Untuk analisis protein secara umum, standar Bovine Serum Albumin (BSA)
merupakan pilihan yang baik untuk analisis protein karena memiliki kemurnian
yang tinggi, dan harganya tidak terlalu mahal. Selain itu, Bovine Gamma Globulin
(BGG) juga merupakan pilihan yang baik bila akan digunakan untuk analisis
kadar protein immunoglobulin dalam tubuh, karena BGG memberikan warna dan
kurva yang sangat mirip dengan Immunoglobulin G (Ig G). Asam amino tunggal
dan dipeptida tidak akan memberikan reaksi dengan Biuret, akan tetapi tripeptida
dan polipeptida akan membentuk kompleks
chelat.
Satu ion Cu
2+akan
bereaksi
dengan empat sampai enam ikatan peptida. (Krohn, 2005). Reaksi protein dengan
pereaksi Biuret dapat dilihat pada Gambar 6.
Reaksi Biuret ini menunjukkan hasil yang positif melalui pembentukan
warna ungu, merah violet, atau biru violet. Intensitas warna yang terbentuk
sebanding dengan banyaknya ikatan peptida yang bereaksi. Pereaksi Biuret
merupakan dasar dari metode pembentukan warna yang paling sederhana untuk
penetapan konsentrasi total protein secara kuantitatif (Sumardjo, 2006; Krohn,
2005).
Protein + Cu
2+Keuntungan dari metode ini adalah prosedur yang sederhana, tidak
memerlukan biaya yang mahal, waktu yang digunakan relatif singkat, deviasai
warna sangat sedikit bila dibandingkan dengan Lowry, Bradford dan metode
turbidimetri sehingga absorpsi warnanya relatif stabil, sangat sedikit senyawa
yang berinteraksi dengan pereaksi Biuret, dan tidak mendeteksi nitrogen dari
sumber non-protein. Kerugiannya adalah kurang sensitif dibandingkan dengan
Lowry dan Bradford, absorbansinya dapat dipengaruhi oleh asam empedu,
konsentrasi garam ammonium yang sangat tinggi, adanya variasi warna untuk
beberapa protein tertentu, bila bahan mengandung lemak dan karbohidrat yang
sangat tinggi dapat menyebabkan larutan menjadi buram sehingga tidak dapat
ditembus cahaya UV, dan karena metode ini bukan merupakan metode absolut
sehingga absorpsi warnanya perlu terlebih dahulu distandarisasi terhadap protein
murni seperti Bovine Serum Albumin (BSA) (Chang, 1998).
b.
Pereaksi Lowry
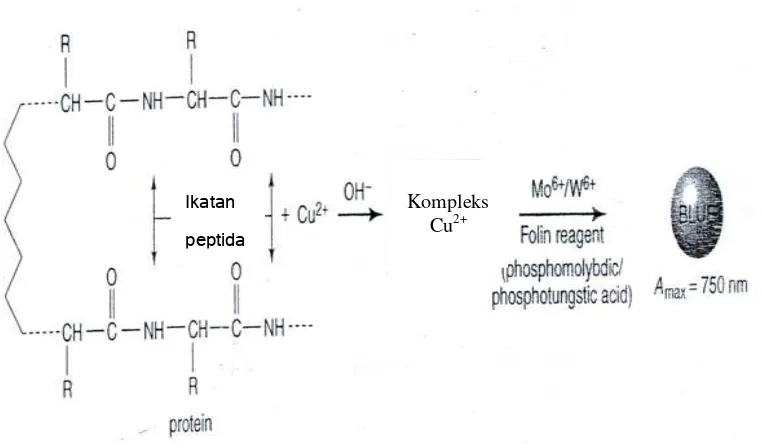
Gambar 7. Reaksi protein dengan pereaksi Lowry (Krohn, 2005)
Keuntungan analisis dengan pereaksi ini adalah memiliki sensitifitas yang
lebih baik dibanding Biuret, lebih spesifik dibanding metode lain, dan waktu
untuk analisis lebih singkat bila dibandingkan dengan metode Kjeldahl (sekitar
1-1,5 jam). Kerugian analisis dengan pereaksi Lowry adalah variasi warnanya
yang lebih banyak dibanding dengan pereaksi Biuret, warna yang terbentuk tidak
secara tepat menggambarkan konsentrasi protein, reaksinya sangat dipengaruhi
oleh senyawa-senyawa pengganggu seperti glukosa, lemak, garam buffer fosfat,
senyawa-senyawa yang mengandung amin, gula pereduksi, garam ammonium
dalam konsentrasi tinggi dan senyawa sulfhidril (Chang, 1998).
c.
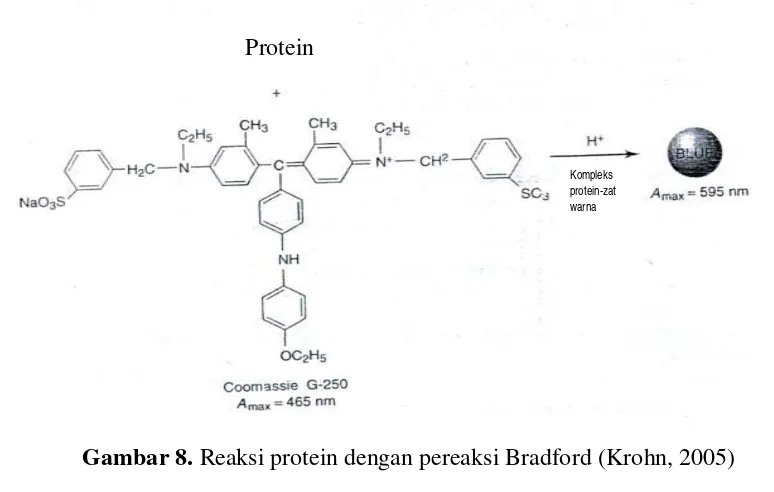
Pereaksi Bradford
Pada tahun 1976, Marion Bradford memperkenalkan penggunaan pereaksi
Coomassive Blue untuk penetapan secara kuantitatif konsentrasi total protein.
Coomasive Blue ini akan berinteraksi dengan gugus samping asam amino yang
memiliki ikatan rangkap sehinngga terjadi perubahan warna pereaksi dari merah
Ikatan
peptida