BAB II
TINJAUAN PUSTAKA
2.1. Gagal Ginjal Terminal
2.1.1. Definisi Gagal Ginjal Terminal
Gagal ginjal terminal adalah suatu keadaan klinis yang ditandai dengan penurunan fungsi ginjal yang irreversibel, sampai pada suatu derajat yang memerlukan terapi pengganti fungsi ginjal yang tetap berupa dialisis atau transplantasi ginjal, disertai keadaan uremia yaitu suatu sindrom klinik dan laboratorik yang terjadi akibat menurunnya fungsi ginjal pada Penyakit Ginjal Kronik (PGK)(NFK.K/DOQI, 2002; PERNEFRI, 2011). Kriteria PGK dapat dijelaskan seperti pada Tabel 2.1 berikut :
Tabel 2.1 Kriteria Penyakit Ginjal Kronik
1. Kerusakan ginjal (renal damage) yang terjadi lebih dari 3 bulan, berupa kelainan struktural atau fungsional, dengan atau tanpa penurunan Laju Filtrasi Glomerulus (LFG) dengan manifestasi sebagai berikut :
Kelainan patologis
Tanda kelainan ginjal, termasuk kelainan dalam komposisi darah atau urin atau kelainan dalam uji pencitraan (imaging test).
2. Laju Filtrasi Glomerulus <60 mL/menit/1,73 m2 selama 3 bulan dengan atau tanpa kerusakan ginjal.
2.1.2. Klasifikasi Penyakit Ginjal Kronik
Klasifikasi PGK atas dasar derajat (stage) penyakit dibuat berdasarkan nilai Laju Filtrasi Glomerulus (LFG) (Skorecki 2005; NFK.K/DOQI 2002 ; PERNEFRI 2011).
Klasifikasi PGK atas dasar derajat penyakit atau nilai LFG dapat dijelaskan seperti pada Tabel 2.2 berikut ini:
Tabel 2.2 Klasifikasi PGK berdasarkan Derajat Penyakit
Derajat Penjelasan LFG (mL/menit/1,73 m2)
1 Kerusakan ginjal dengan LFG normal atau meningkat ≥ 90 2 Kerusakan ginjal dengan LFG menurun ringan 60-89 3 Kerusakan ginjal dengan LFG menurun sedang 30-59 4 Kerusakan ginjal dengan LFG menurun berat 15-29 5 Gagal ginjal terminal <15 atau dialisis (Dikutip dari : National Kidney Foundation (NKF) Kidney Disease Outcome Quality Initiative (NFK.K/DOQI), 2002)
2.1.3. Epidemiologi Gagal Ginjal Terminal
Angka kejadian PGK di dunia pada tahun 2006 secara global mencapai lebih dari 500 juta orang dan yang harus menjalani hidup dengan
Prevalensi penderita GGT di Amerika Serikat adalah 0,1% (NFK.K/DOQI 2006).Prevalensi penderita gagal ginjal di Amerika Serikat tahun 2007 sebanyak 300 ribu orang dengan penderita yang harus menjalani HD sebanyak 220 ribu orang (Widiana, 2007). Jumlah penderita gagal ginjal di Indonesia tahun 2010 sekitar 150 ribu orang dan yang menjalani HD sekitar 10 ribu orang (Yulianti, 2010). Data rekam medik di Unit Hemodialisa RS.Hasan Sadikin, Bandung, pada tahun 2011 tercatat 1.296 orang penderita GGT dan sekitar 144 orang penderita GGT sedang menjalani HD rutin, sedangkan pada tahun 2012 terdapat peningkatan jumlah penderita GGT menjadi 2.004 orang, dan sekitar 167 orang di antaranya sedang menjalani HD rutin.(Rachmiwatie 2013a)
pemasangan atau pelepasan jarum akses vaskuler (Caro 2006). Prevalensi perdarahan saluran cerna (occult blood) pada penderita GGT berkisar antara 6-20%. (PERNEFRI 2011).
2.1.4. Patogenesis Penyakit Ginjal Kronik
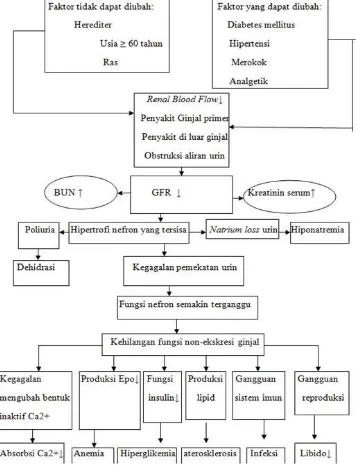
Patogenesis PGK pada awalnya tergantung pada penyakit yang mendasarinya, tetapi dalam perkembangan selanjutnya, proses yang terjadi akan sama. Patogenesis PGK melibatkan dua mekanisme besar kerusakan. Mekanisme pertama adalah mekanisme spesifik penyakit yang mendasari (seperti misalnya kompleks imun dan mediator inflamasi tertentu pada penyakit glomerulonefritis atau paparan toksin tertentu pada tubulus dan interstitium renal), sedangkan mekanisme kedua adalah mekanisme progresif yang melibatkan hiperfiltrasi dan hipertrofi dari nefron sehat yang masih tersisa (surviving nephrons) sebagai upaya kompensasi yang diperantarai oleh molekul vasoaktif seperti sitokin dan growth factors, yang merupakan konsekuensi dari pengurangan massa renal.Hal ini mengakibatkan terjadinya hiperfiltrasi yang diikuti oleh peningkatan tekanan kapiler dan aliran darah glomerulus (Watnick 2008; Skorecki 2010).
elektrolit, hormon dan abnormalitas metabolisme yang timbul akibat penurunan fungsi ginjal dapat terjadi jika bersihan kreatinin telah menurun kurang dari 10 mL/menit (Alper 2012).
Patogenesis PGK dapat dijelaskan seperti pada Gambar 2.1 berikut ini :
2.1.5. Anemia pada Gagal Ginjal Terminal
Anemia pada GGT dikenal dengan nama anemia renal, terutama disebabkan oleh penurunan kapasitas produksi hormon eritropoietin. Disebut Anemia renal jika kadar hemoglobin (Hb) < 14 g/dl (laki-laki) atau <12 g/dl (perempuan). Anemia renal umumnya sudah bermanifestasi pada LFG <50 mL/menit (PGK derajat 3) dan kadar kreatinin serum >2 mg/dL. (NFK.K/DOQI 2006; PERNEFRI 2011; Alper 2012 ). Faktor lain yang berkontribusi pada anemia renal adalah: (PERNEFRI 2011)
a. Defisiensi besi,
(asupan yang berkurang, flebotomi berulang untuk pemeriksaan laboratorium, retensi darah pada dialiser atau tubing, perdarahan saluran cerna)
b. Umur eritrosit yang memendek, c. Hiperparatiroid berat,
d. Inflamasi dan infeksi, e. Toksisitas alumunium, f. Defisiensi asam folat, g. Hipotiroid,
h. Hemoglobinopati
seorang penderita GGT menjalani HD 2 kali per minggu, maka penderita tersebut akan mengalami kehilangan darah ± 48 mL setiap kali menjalani HD. Semakin lama seorang penderita GGT menjalani HD akan memiliki risiko kehilangan darah yang semakin besar (Hoffbrand 2006; Wilson 2006). Jumlah residu darah yang tertinggal pada ginjal buatan dan tube dialysis sekitar 5−10 mL meskipun telah dilakukan pembersihan alat (Zhang 2007). Keadaan defisiensi zat besi pada penderita GGT menyebabkan ganguan eritropoiesis di dalam sumsum tulang, yang berdampak pada menurunnya sintesis hemoglobin di dalam sel-sel prekursor eritroid sehingga kadar Ret-He menjadi rendah (Bell 2009). Pemendekan masa hidup eritrosit pada penderita GGT ± 50% dari masa hidup eritrosit normal disebabkan oleh perubahan lingkungan kimia dalam darah sehingga eritrosit lebih mudah lisis. Jika individu normal memiliki
masa hidup eritrosit 90−120 hari, maka masa hidup eritrosit penderita
GGT sekitar 45−60 hari ( PERNEFRI 2011; Alper 2012).
spectrin-actin cytoskeletal network dan lapisan fosfolipid membran eritrosit menyebabkan perubahan stabilitas dan integritas membran sel eritrosit, rigiditas eritrosit meningkat sehingga eritrosit lebih mudah lisis Kalsifikasi sumsum tulang yang diinduksi keadaan hiperparatiroid akan berkurang setelah dilakukan tindakan paratiroidektomi (Alper 2012; PERNEFRI 2011).
Sasaran kadar hemoglobin dalam penatalaksanaan anemia penderita GGT menurut berbagai studi klinik adalah 10−12 g/dL serta diupayakan tidak melebihi 13 g/dL dengan pertimbangan bahwa kadar hemoglobin >13 g/dL tidak menghasilkan perbaikan kualitas hidup yang bermakna secara klinis, bahkan sebaliknya, dapat meningkatkan risiko terjadinya hipertensi dan trombosis vaskuler serta gangguan kardiovaskuler (Skorecki 2005; PERNEFRI 2011).
Keadaan uremia pada penderita GGT dapat menyebabkan inaktivasi eritropoietin atau menekan respon sumsum tulang terhadap eritropoietin sehingga mengganggu produksi eritrosit. Keadaan uremia dapat ditandai pula oleh penumpukan bahan atau zat sisa metabolit, antara lain hormon paratiroid (Paratyroid Hormone/PTH) akibat retensi fosfat (hiperfosfatemia) (Alper 2012 ; PERNEFRI 2011).
menghambat absorbsi zat besi di intestinal dan menghambat pelepasan zat besi dari enterosit dan sistem retikuloendotelial sehingga mengganggu pemenuhan kebutuhan zat besi untuk eritropoiesis dalam sumsum tulang (Macdougall 2012).
Salah satu parameter untuk mengetahui tingkat inflamasi adalah pemeriksaan laju endap darah (LED) selain melalui pemeriksaan C-reactive protein (CRP) dan kadar sitokin inflamasi IL-6dalam serum. Pemeriksaan LED merupakan pengukuran non spesifik untuk mengetahui dan memonitor respon terhadap adanya kondisi/proses inflamasi yang terjadi, baik akut maupun kronik (seperti pada infeksi, keganasan, collagen-vascular diseases dan uremia). Peningkatan protein fase akut pada keadaan inflamasi/infeksi menyebabkan perubahan muatan eritrosit menjadi netral, sehingga lebih mudah terbentuk roulleaux eritrosit, menyebabkan eritrosit lebih mudah dan lebih cepat mengendap, sehingga nilai LED meningkat (Pagana 2010).
memiliki risiko tinggi mengalami aritmia jantung karena penurunan fungsi ekskresi kalium pada ginjal sehingga terjadi hiperkalemia (Alper 2012)
2.1.6. Diagnosis Anemia Defisiensi Besi Pada Pasien GGT
Pada anemia penyakit kronik dengan anemia defisiensi besi, kadar besi serum dan saturasi transferin menurun, dan hipoferemia menyebabkan berkurangnya penyediaan besi yang dibutuhkan untuk sintesis hemoglobin tetapi cadangan besi sumsum tulang masih cukup. Sebagai perbandingan antara anemia penyakit kronik, anemia defisiensi besi dan kondisi terdapatnya kedua jenis anemia dapat dilihat pada tabel dibawah ini.(Weiss 2005)
Diagnosis Anemia Defisiensi Besi (ADB) absolut dan fungsional pada PGK non dialisis (ND), PGK dengan dialisis peritoneal (DP) dan PGK dengan HD sesuai kriteria PERNEFRI 2011 dijelaskan pada Tabel 2.4
Tabel 2.4 Kriteria Anemia Defisiensi Zat Besi pada Penyakit Ginjal (Dikutip dari : Perhimpunan Nefrologi Indonesia, 2011)
Keterangan: ND= non dialisis; DP= dialisis peritoneal; HD= hemodialisa 2.1.7 Eritropoesis
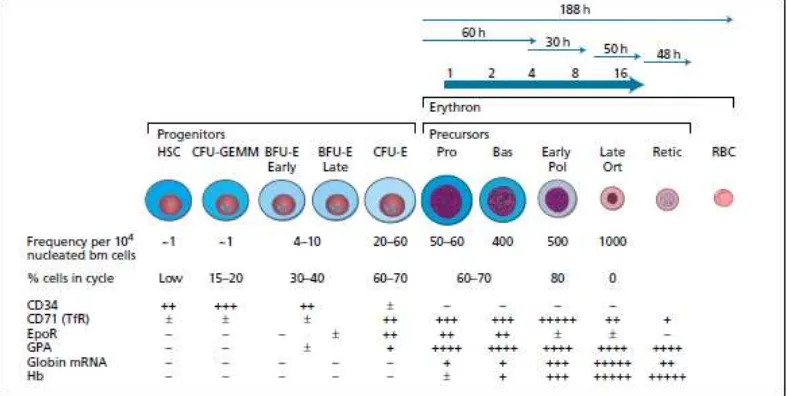
Retikulosit akan terus mensintesis hemoglobin dalam 24-48 jam setelah dilepaskan dari sumsum tulang. Retikulosit memiliki ukuran sekitar 20% lebih besar dibandingkan dengan ukuran eritrosit. Satu pronormoblas
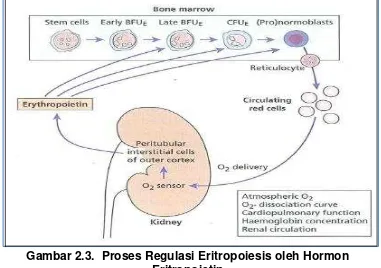
akan menghasilkan 14−16 eritrosit matang (Bell 2009; Smith 2012). Proses regulasi eritropoiesis yang diatur oleh hormon eritropoietin (Epo) dapat dijelaskan seperti pada Gambar 2.2
2.1.8. Eritropoietin
Eritropoiesis diregulasi oleh hormon eritropoietin (Epo) yang dihasilkan oleh epithelial like cell atau fibroblas interstisial di sekitar kapiler peritubuler dan sel epitel tubuler korteks ginjal dan sel perisinusoidal hepar (Hoffbrand 2006).
Eritropoietin dikenal pula dengan nama hematopoietin, adalah hormon glikoprotein yang bertugas mengontrol produksi eritrosit (eritropoiesis),
Gambar 2.3. Proses Regulasi Eritropoiesis oleh Hormon Eritropoietin
( Dikutip dari : Hoffbrand 2006)
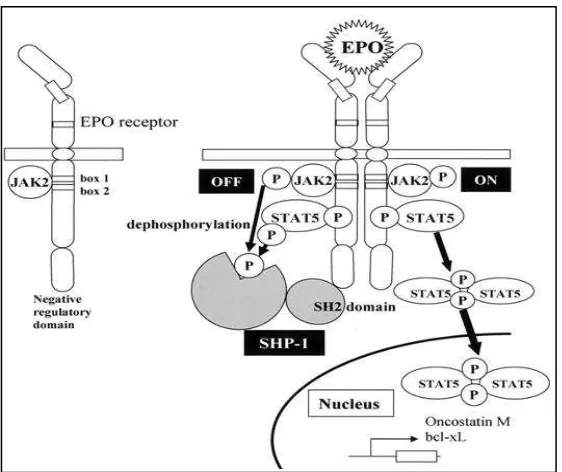
Jalur sinyal yang terjadi sebagai respon terhadap Epo untuk mengaktivasi eritropoesis dapat dijelaskan seperti pada Gambar 2.4.
reseptor EPO melalui domain Src-homologi 2 (SH2) dan menyebabkan defosforilasi JAK2 dan STAT5; dengan demikian, berfungsi sebagai pengatur negatif transduksi sinyal EPO. (Akagi 2004)
Gambar 2.4. Jalur Sinyal Respon Prekursor Eritroid terhadap Eritropoetin (Dikutip dari : Akagi, 2004)
Keterangan :Epo= Eritropoietin; JAK2= Janus kinase pathway 2; STAT 5=Signal transducers activator transcription 5; SH2 = Src-homology;
Bcl2-xL= pro survivalB cell lymphoma
2.2. Metabolisme Besi
2.2.1. Komposisi Besi dalam Tubuh
biologis mereka. Dampak negatifnya adalah logam ini mampu mengkatalisis reaksi yang mengarah ke produksi radikal bebas, terutama ketika berada dalam jumlah yang berlebihan. Sangatlah penting untuk memasok zat besi yang cukup untuk memenuhi persyaratan metabolisme sel, tetapi juga penting untuk mencegah kelebihan zat besi karena hal ini dapat menempatkan sel di bawah tekanan stress oksidatif (Anderson 2010)
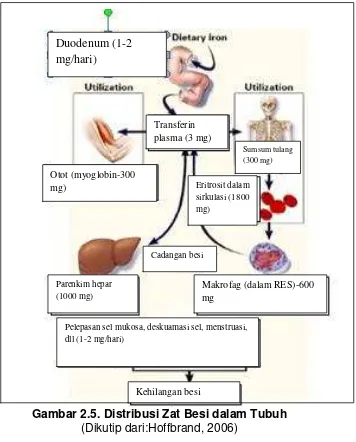
Manusia dewasa rata-rata memiliki 3.500 mg total zat besi tubuh, dua pertiga bagian dalam bentuk hemoglobin dan sepertiga bagian dalam bentuk zat besi jaringan. Hampir 90% total zat besi jaringan adalah cadangan zat besi dalam bentuk feritin atau hemosiderin. Cadangan zat besi tubuh dapat meningkat akibat transfusi whole blood (WB) atau packed red cell (PRC) karena adanya penambahan jumlah eritrosit dari luar tubuh. Apabila eritrosit tersebut sampai waktunya untuk dihancurkan oleh makrofag akan menyebabkan meningkatnya kadar heme dan zat besi tubuh dan akan disimpan dalam bentuk feritin atau hemosiderin (Bell 2009). Sepuluh persen zat besi jaringan merupakan elemen zat besi pada myoglobin dan enzim sitokrom dan sekitar 1% zat besi terdapat dalam plasma (Hoffbrand 2006). Pengaturan distribusi zat besi dalam tubuh ditunjukkan pada Gambar. 2.5.
Manusia dewasa sehat dengan volume darah 4.500−5.000 mL akan
dalam bentuk myoglobin otot, deskuamasi sel mukosa dan proses berkeringat. (Hoffbrand 2006).
Gambar 2.5. Distribusi Zat Besi dalam Tubuh (Dikutip dari:Hoffbrand, 2006)
Setiap 2 mL darah mengandung ±1 mg zat besi, sehingga sekitar 18.5−21
mg zat besi dibutuhkan setiap hari untuk menggantikan zat besi yang hilang. Hanya ±1 mg/hari zat besi yang hilang akan digantikan melalui
Duodenum (1-2 mg/hari)
Transferin plasma (3 mg)
Sumsum tulang (300 mg) Otot (myoglobin-300
mg) Eritrosit dalam
sirkulasi (1800 mg)
Parenkim hepar (1000 mg)
Makrofag (dalam RES)-600 mg
Cadangan besi
Pelepasan sel mukosa, deskuamasi sel, menstruasi, dll (1-2 mg/hari)
konsumsi makanan (diabsorbsi sekitar 5−10% di duodenum dan jejunum) (Hoffbrand 2006).
2.2.2. Absorpsi Besi
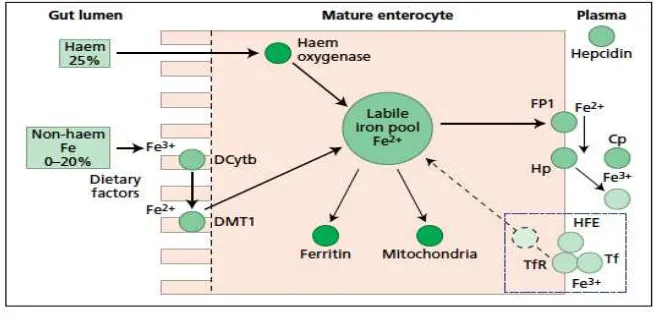
Besi lebih mudah diserap dalam bentuk Ferro (Fe2+) tetapi kebanyakan besi yang ada dalam makanan berada dalam bentuk Ferri (Fe3+) (Ullrich 2005). Hanya sedikit sekali besi yang diserap dalam lambung, tetapi di dalam lambung besi dalam bentuk Ferri (Fe+3) akan diubah menjadi Ferro (Fe+2) oleh ferric reductase dengan bantuan kofaktor duodenal cytochrom b-like (DCYTB) (NKF.K/DOQI 2006)
Perubahan ini sangat penting, karena duodenal metal transporter-1 (DMT1) memungkinkan hanya divalen logam (terutama besi, tetapi juga Cu, Pb, dan Mn) yang dapat melalui membran apikal enterosit duodenal. Namun, DMT1 bukan molekul satu-satunya yang memfasilitasi transportasi besi melalui membran enterosit. Heme carrier protein merupakan molekul penting yang mengangkut besi heme dari permukaan apikal ke enterosit. Besi heme akan terikat oleh reseptor heme di membran brush border dan di dalam sel akan dilepaskan oleh heme oxygenase se-belum memasuki penampungan besi labil dan kemudian akan mengikuti jalur yang sama dengan besi non-heme (Bell 2009)
basolateral transporter dalam bentuk Fe2+ yang disebut ferroportin (Henrika 2012). Ferroportin juga dapat ditemukan pada permukaan membran makrofag. Jika total besi dalam tubuh tinggi, sintesis hati terhadap hepsidin akan meningkat. Pengikatan hepsidin ke segmen eksterior ferroportin akan menyebabkan internalisasi, ubiquitinasi dan degradasi dari ferroportin. Akibatnya, besi yang ditransfer ke sirkulasi akan menurun. Ferroportin, seperti DMT1 bersifat permeabel hanya untuk besi dalam bentuk Ferro (Fe+2). Di sisi lain, besi harus berada dalam bentuk Ferri (Fe+3) agar dapat terikat dengan transferin. Oleh karena itu, oksidasi besi dari bentuk Ferro (Fe+2 ) menjadi Ferri (Fe+3) oleh ferrooxidase atau hephaestin sangat diperlukan (Ozbek 2010; Hernika 2012). Seruloplasmin adalah homolog hephaestin menetap di membran makrofag dekat dengan ferroportin, melakukan kerja yang sama dengan hephaestin. Singkatnya, besi ferro (Fe+2 ) yang berasal dari enterosit dioksidasi oleh hephaestin, dan besi ferro (Fe+2 ) yang berasal dari makrofag akan dioksidasi oleh seruloplasmin dengan cara yang sama (Ozbek 2010) sebagaimana Gambar 2.6.
2.2.3. Transport Besi
Gambar 2.6. Mekanisme absorpsi besi (Worwood 2005)
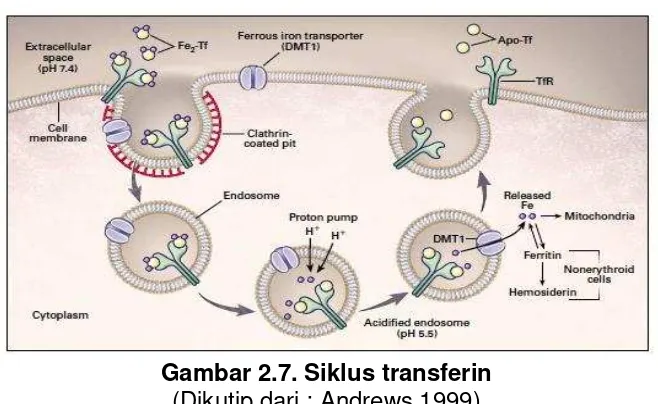
Transferin akan berikatan dengan salah satu transferrin reseptor (TfR) pada membran sel, transferrin reseptor- 1 (TfR-1) atau transferrin reseptor– 2 (TfR-2). Setiap reseptor transferin mengikat 2 molekul transferin.TRF-1 ada dalam semua jaringan kecuali eritrosit yang matang. TRF-2 paling banyak berada di hati. Meskipun struktur protein dari TfR-1 dan TfR-2 hampir sama tetapi fungsi dan regulasinya berbeda. Ekspresi dari TfR1 diatur sangat ketat oleh kadar zat besi seluler melalui human hemochromathosis protein (HFE). Namun, kadar zat besi seluler tidak berpengaruh pada TfR2. TfR2 diatur oleh saturasi transferin dan berfungsi meregulasi ekspresi hepsidin. (Bell 2009; NKF.K/DOQI 2006)
dalam prekursor sel eritroid, seperti pada Gambar. 2.7. Konversi ini diperlukan karena DMT1 hanya mengangkut divalent logam dari endosome ke sitoplasma seperti pada enterosit (Ozbex 2010). Besi di dalam sel eritroid hampir seluruhnya akan menuju mitokondria dimana akan bergabung dengan protoporphyrin membentuk heme, sedangkan pada sel lain besi akan disimpan dalam bentuk feritin dan hemosiderin.(Andrews 1999).
Gambar 2.7. Siklus transferin (Dikutip dari : Andrews 1999)
2.2.4. Pembentukan Hemoglobin
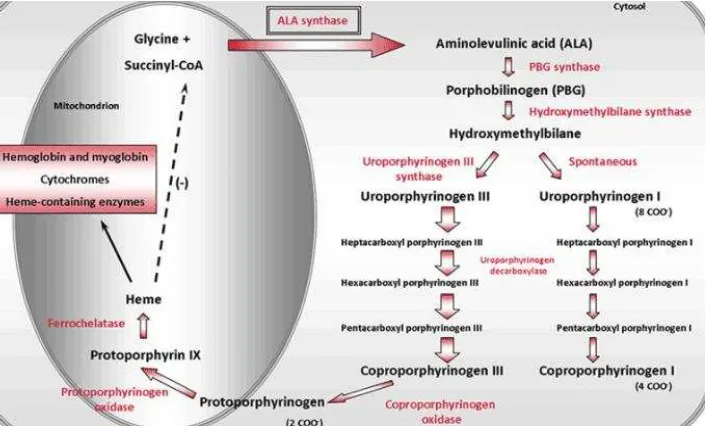
Molekul hemoglobin adalah protein globular terkonjugasi terdiri dari empat molekul heme dan dua pasang rantai polipeptida serta merupakan komponen sitoplasma utama eritrosit. Hemoglobin bebas berasal dari eritrosit yang mengalami hemolisis, memiliki waktu paruh yang pendek, cepat dipecah dan dibersihkan melalui ekskresi oleh ginjal. Fungsi utama hemoglobin sebagai penghantar oksigen dari paru-paru ke berbagai jaringan tubuh. Hemoglobin juga mengatur dilatasi vaskuler melalui penghantaran nitric oxide (NO) dan penghantaran karbondioksida dari jaringan ke paru-paru untuk selanjutnya dikeluarkan melalui ekspirasi (Hilman 2005).
Molekul heme merupakan cincin yang terdiri dari atom karbon, hidrogen dan nitrogen yang disebut protoporphyrin IX dengan sebuah atom besi (divalent ferrous/Fe2+) melekat di tengah cincin (ferroprotoporphyrin). Setiap molekul heme dapat mengikat satu molekul oksigen, sehingga satu molekul hemoglobin dapat mengikat empat molekul oksigen (Hilman 2005; Hoffbrand 2006). Sekitar 1,34 mL oksigen dapat diikat oleh setiap gram hemoglobin (Bell 2009; Smith 2012).
Satu molekul hemoglobin terdiri dari 2 pasang rantai globin yang
identik. Setiap rantai globin terdiri dari 141−146 asam amino. Molekul zat
Molekul heme selanjutnya meninggalkan mitokondria dan bergabung dengan rantai globin di dalam sitoplasma (Bell 2009; Smith 2012).Proses sintesis hemoglobin dapat dijelaskan pada Gambar 2.8.
Setiap molekul heme selanjutnya berikatan dengan satu rantai globin
α dan satu rantai globin non α membentuk heterodimer. Dua molekul
heterodimer tersebut selanjutnya bergabung membentuk satu molekul tetramer (Andrews 2004; Smith 2012).
Gambar 2.8. Proses Sintesis Hemoglobin (Dikutip dari : Bell 2009)
2.2.5. Retikulosit
berada di sumsum tulang sekitar 2−3 hari sebelum dilepaskan ke sirkulasi
perifer dan akan beredar selama 1−2 hari dalam sirkulasi perifer sebelum
menjadi eritrosit yang matur (Bell, 2009)
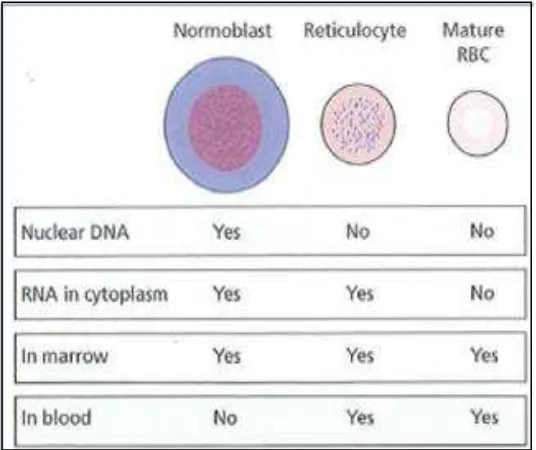
Membran retikulosit mengekspresikan reseptor transferin yaitu reseptor yang berikatan dengan zat besi yang akan digunakan oleh sel untuk sintesis hemoglobin. Reseptor transferin dilambangkan dengan cluster of differentiation 71 (CD71). Antigen CD71 ini dapat digunakan sebagai penanda untuk retikulosit. Perbedaan antara normoblas, retikulosit dan eritrosit matur dapat dijelaskan seperti tampak pada Gambar. 2.9.
Retikulosit dapat terlihat jelas pada sediaan apus darah tepi dengan menggunakan pewarnaan New methylene blue seperti tampak pada Gambar.2.10.
Gambar.2.10. Gambaran retikulosit pada sediaan apus darah tepi (Dikutip dari : Rozenberg 2011)
2.3. Pemeriksaan Status Besi 2.3.1. Serum Iron (SI)
meningkatnya kebutuhan zat besi untuk sintesis berbagai enzim untuk metabolisme tubuh, walaupun dinyatakan bahwa pembatasan waktu sampling untuk pemeriksaan kadar besi serum pada jam tertentu tidak meningkatkan reliabilitas hasil pemeriksaan (Dale 2002). Konsentrasi SI berkurang dengan adanya proses inflamasi baik akut maupun kronis, infeksi, dan keganasan (Buttarello 2004; WHO 2004; Brugnara 2006).
Pemeriksaan SI merupakan pengukuran zat besi yang terikat pada transferin, menggunakan alat spektrofotometer otomatis. Prinsip pemeriksaan SI adalah dalam keadaan asam, zat besi dibebaskan dari transferin. Askorbat akan mereduksi ion Ferri (Fe3+) menjadi ion ferro (Fe2+) dan bereaksi dengan ferrozine membentuk kompleks warna. Intensitas warna yang terbentuk sebanding dengan kadar zat besi dalam serum dan diukur menggunakan metode fotometri (Pagana, 2010).Prinsip pemeriksaan kadar SI adalah sebagai berikut:
Kompleks Transferin-Fe3+(pH < 2,0) apotransferin + Fe3+ Fe3+ (askorbat-reduktor) Fe2+
Ferrozine + Fe2+ kompleks berwarna
Bahan pemeriksaan (serum) yang lipemik akan dijernihkan oleh deterjen. Nilai rujukan kadar zat besi serum pada laki-laki dewasa adalah
70−150 µg/dL (12−27 µmol/L)danpada wanita dewasa adalah 80−150
µg/dL (14−27 µmol/L) (Pagana 2010)
a. Faktor yang dapat meningkatkan kadar zat besi serum : pemberian Kloramfenikol, Cisplatin (antineoplastik golongan alkylating agent) hormon estrogen, preparat besi, etanol, metotreksat dan vitamin B12 pada 48 jam sebelum pemeriksaan serta sampel yang hemolisis.
b. Faktor yang dapat menurunkan kadar zat besi serum : pemberian Adrenocorticotropic hormone (ACTH), Testosteron, Colchicines, Methicillin, dan keadaan stres fisik dan kurang tidur.
Hormon estrogen dapat meningkatkan kadar SI melalui mekanisme hambatan mRNA hepsidin dalam hepatosit sehingga sintesis hepsidin oleh hepatosit berkurang, sedangkan Kloramfenikol, Metotreksat, Cisplatin dan etanol menyebabkan gangguan pada mitokondria hepatosit sehingga sintesis hepsidin terhambat. Hepsidin merupakan protein regulator utama homeostasis zat besi dalam tubuh, sehingga penurunan kadar hepsidin menyebabkan meningkatnya absorbsi dan pelepasan zat besi dari enterosit, makrofag maupun hepatosit yang merupakan tempat cadangan zat besi utama tubuh. Hal ini menyebabkan kadar zat besi serum meningkat (Yang 2012)
2.3.2. Feritin Serum
Pada orang sehat dan penderita defisiensi besi tahap awal, konsentrasi feritin di dalam serum akan seimbang dengan yang tersimpan.
Pada orang dewasa setiap 1 μg/L serum feritin mengindikasikan kurang lebih 8 mg dari besi yang tersimpan. Meskipun demikian, hubungan langsung antara besi yang dikonsumsi dengan feritin tidak begitu baik. Hal ini disebabkan oleh karena feritin juga merupakan protein reaktan fase akut yang kadarnya akan meningkat apabila terjadi proses infeksi, inflamasi, keganasan dan penyakit hati. Cut-off feritin untuk defisiensi besi
menurut WHO adalah <15 μg/L, tetapi apabila didapati infeksi cut off
defisiensi besi adalah < 30 μg/L (Mast 2008)
Prinsip pemeriksaan feritin serum yaitu mengukur pendaran cahaya pada zat kimia yang dicetuskan oleh tenaga listrik menggunakan metode Sandwich electro chemiluminescence immuno assay (Sandwich ECLIA)(Pagana 2010).
Nilai rujukan kadar feritin serum pada populasi normal: )(Pagana, 2010).
Laki-laki: 12−300 ng/mL (12-300 mcg/L-SI Unit). Wanita: 10−150 ng/mL (10−150 mcg/L-SI Unit). Bayi baru lahir : 25−200 ng/mL.
Bayi usia < 1 bulan : 200−600 ng/mL.
Bayi usia 2-5 bulan : 50−200 ng/mL.
Kadar feritin serum cenderung stabil pada laki-laki dewasa dan wanita post menopausal. Faktor interferensi yang dapat meningkatkan kadar feritin serum antara lain transfusi darah dan makanan yang mengandung zat besi dengan kadar tinggi (misalnya red meat).(Pagana, 2010)
Keterbatasan pemeriksaan feritin serum adalah karena feritin serum merupakan protein fase akut yang kadarnya dipengaruhi oleh keadaan infeksi-inflamasi, sehingga kadar feritin serum yang meningkat belum tentu menggambarkan kecukupan cadangan zat besi tubuh, misalnya pada keadaan infeksi/inflamasi akut dan tumor ganas metastatik. Kadar
feritin serum akan meningkat pada 1−2 hari setelah awitan penyakit,
mencapai puncaknya pada hari ke 3-5, sehingga apabila keadaan defisiensi zat besi menyertai penderita ini, defisiensi zat besi tersebut sulit ditemukan karena kadar feritin serum yang meningkat (Hilman, 2005; Skorecki, 2005; Alper, 2012).
atau riwayat transfusi yang baru saja dilakukan, anemia megaloblastik, anemia hemolitik, gangguan hepatoseluler, hepatitis kronik (Hilman, 2005; Pagana, 2010)
2.3.3. Total Iron Binding Capacity (TIBC)
Besi akan ditransportasikan di dalam plasma dan cairan ekstraseluler oleh transferin. Metaloprotein ini memiliki afinitas yang sangat tinggi terhadap besi. Hampir seluruh besi dalam plasma akan diikat oleh transferin. Oleh karena itu, sangat tepat untuk mengukur konsentrasi plasma transferin secara indirek dengan mengukur jumlah total iron binding capacity (TIBC) yang merupakan jumlah total ikatan besi dengan tranferin (Mast, 2008). TIBC akan meningkat apabila terjadi pengurangan simpanan besi dan akan berkurang apabila terjadi infeksi, inflamasi ataupun keganasan (Vaisman, 2000).
Total iron binding capacity menunjukkan total kadar zat besi serum jika semua transferin terikat dengan zat besi. Transferin adalah protein yang terbentuk di dalam hati yang berfungsi sebagai transpor besi ke sumsum tulang untuk sintesis hemoglobin atau digunakan oleh sel tubuh (Pagana, 2010)
hingga semua transferin berikatan (jenuh) dengan zat besi. Sisa zat besi feri yang tidak terikat transferin akan direduksi menjadi besi bentuk fero oleh reagen reduktan dan berikatan dengan zat kromogen ferrozine membentuk kompleks warna magenta yang kadarnya diukur dengan metode fotometrik. Pemeriksaan TIBC menggunakan bahan pemeriksaan serum (Pagana, 2010)
Kadar TIBC dihitung berdasarkan penjumlahan Unsaturated iron binding capacity (UIBC) dengan besi serum. Nilai rujukan UIBC 160−280 µg/dL.
TIBC = UIBC + Fe serum.
Nilai rujukan TIBC pada anak dan dewasa :240−450 µg/dL (41−77
µmol/L). (Pagana, 2010)Faktor interferensi pada pemeriksaan TIBC :
a. Faktor yang dapat meningkatkan hasil TIBC: antibiotika Kloramfenikol, kontrasepsi oral, suplemen besi (suplemen zat besi dapat menyebabkan peningkatan zat besi serum dan penurunan TIBC serum) (Pagana, 2010)
b. Faktor yang dapat menurunkan hasil TIBC : ACTH (Pagana, 2010)
2.3.4. Saturasi Transferin (ST)
Konsentrasi besi dalam serum dan saturasi transferin akan turun seiring dengan pasokan besi yang menurun. Level saturasi dibawah 16% mengindikasikan ketidakcukupan besi untuk mempertahankan sintesa hemoglobin dalam kadar yang normal (Caro, 2006). Persen saturasi transferin dengan besi ditentukan dengan membagi serum besi dengan TIBC dikali 100 (NKF.K/DOQI, 2006)
% � = �
� � � � � �× 100%
Nilai rujukan saturasi transferin populasi normal untuk laki-laki 20−50% dan untuk wanita adalah 15−50% (Pagana, 2010)
Penderita PGK dengan defisiensi zat besi absolut maupun fungsional, nilai saturasi transferin dapat lebih rendah dari nilai rujukan yang sesuai jenis kelamin (Hilman, 2005; Adamson, 2010).
2.3.5. Retikulosit Hemoglobin (RET-HE)
normal, retikulosit akan berada dalam sirkulasi hanya 1 sampai 2 hari tapi mencerminkan status besi yang ada 3 sampai 4 hari sebelum penggabungan besi ke hemoglobin berada pada saat maksimum (Besarab 2001, Brugnara 2006; Wish 2006). Dengan demikian, ketersediaan besi fungsional untuk dimasukkan ke dalam sel darah merah pada sumsum tulang selama proses pembentukan sel darah merah beberapa hari sebelumnya tercermin dari jumlah hemoglobin dalam retikulosit (Mast 2008; Butarello 2010).
Dengan demikian, jumlah hemoglobin dalam retikulosit adalah refleksi yang cukup baik dari seberapa banyak zat besi yang tersedia. Daripada memeriksa kadar hemoglobin di keseluruhan eritrosit yang mungkin berada di mana saja antara 1 sampai 120 hari, hemoglobin retikulosit akan memberikan gambaran berapa banyak besi tersedia untuk produksi sel darah merah dalam jangka waktu yang relevan secara klinis. Oleh karena itu, secara teoritis hemoglobinretikulosit merupakan penanda yang cukup baik (Buttarello 2010).
dari terapi suplemen zat besi intravena serta mencegah kelebihan pemberian suplemen zat besi. Parameter ini telah terbukti berguna dalam mendiagnosis defisiensi zat besi. Informasi mengenai kadar hemoglobin pada retikulosit memungkinkan penegakan diagnosis pada tahap awal terjadinya defisiensi zat besi pada saat parameter biokimia tradisional lainnya belum memberikan informasi (Sysmex 2010).
Pemeriksaan Ret-He merupakan penilaian langsung jumlah zat besi yang akan membentuk hemoglobin dalam sumsum tulang sehingga memperkirakan ketersediaan fungsional zat besi terkini untuk hemoglobin dalam eritrosit. Parameter ini merupakan indikator yang sensitif untuk iron defficient erythropoiesis karena masa hidup retikulosit yang singkat, indikator untuk functional iron deficiency serta indikator respon terhadap terapi recombinant Human Erythropoietin (r-HuEPO) (Sysmex 2007 ; Sysmex 2010).
Ymerupakan hasil pengukuran forward scatter dari retikulosit berlabel zat fluoresensi, selanjutnya diekspresikan sebagai Ret-He. Rentang normal Ret-Y 1630−1860 arbitrary units (AU). Hasil transformasi matematika menjadi kadar Ret-He menghasilkan rentang normal Ret-He : 28,2−35,7 pg/sel (Sysmex 2007).Prinsip pemeriksaan Ret-He dijelaskan pada Gambar 2.11.
Gambar 2.11. Prinsip Pemeriksaan Ret-He (Fluorescence Flowcytometry) (Dikutip dari: Sysmex, 2007)
2.4. HEPSIDIN
2.4.1. Struktur dan sintesa Hepsidin
hep-) dan karakter antimikrobial in vitro (- cidinhep-). Studi sebelumnya oleh Krause et.al.(2000), juga mengisolasi peptidayang samadari ultrafiltrat plasma dan menamakannya LEAP-1 (liver expressed antimicrobial peptide).
Secara struktur, hepsidin manusia merupakan peptida kecil yang kaya sistein (8 sistein) yang di dapat dari gugus c-terminal suatu asam amino prepropeptida, yang diisolasi dari urine dan ultrafiltrat darah, yang sebagian besar mengandung 25 asam amino (hep-25) dan sebagian lagi ditemukan dengan rantai asam amino yang lebih pendek (hep-20 dan hep-22). Molekul hepsidin berbentuk seperti jepitan rambut (hairpin) dimana kedua lengannya silang oleh gugusan disulfida seperti pada Gambar.2.12. (Ganz, 2003).
Hepsidin manusia diproduksi oleh hepatosit (Pigeon 2001). Gen hepsidin manusia berlokasi pada lengan panjang dari kromosom 19q13, yang mengkode 84 asam amino prepropeptida, terdiri dari 24 asam amino N-terminal dan 60 asam amino prohormon ( Bayele 2009).
Gambar 2.12.Urutan asam amino dan struktur utama hepcidin manusia (Sumber: Ganz, 2003)
Hepsidin diproduksi lebih banyak pada hati, sedangkan pada ginjal, jantung, otot, tulang dan otak hanya sedikit diproduksi. Kulaksiz et.al menjelaskan bahwa kadar hepsidin pada periportal hepatosit paling tinggi (Kulaksiz 2004).
Nicolas et.al (2001) menemukan bahwa pada hewan percobaan tikus yang dihilangkan fungsi gen USF2-nya akan mengalami kondisi seperti hematokromatosis, dimana terjadi hiperabsorpsi besi pada usus dan peningkatan pelepasan besi dari makrofag sehingga terjadi peningkatan kandungan besi pada hati dan pankreas serta defisiensi besi pada lien. Pada hati terjadi kekurangan mRNA hepsidin. Hal ini membuktikan bahwa hepsidin dapat secara langsung sebagai sensor pada homeostasis besi. Diduga kuat bahwa hepsidin menghambat pelepasan besi dari makofag dan sistem retikuloendotelial sehingga terjadi retensi besi, serta mengurangi penyerapan besi di usus, sehingga terjadi disregulasi homeostasis besi yang akhimya terjadi kondisi kekurangan besi yang mengganggu proses eritropoesis (Ganz 2003).
2.4.3. Hepsidin dan infeksi/inflamasi
terhadap hepatosit manusia diketahui bahwa produksi hepsidin dirangsang oleh lipopolisakarida dan sitokin dari monosit yang telah terpapar lipopolisakarida sebelumnya. Diantara sitokin proinflamasi tersebut, interleukin-6 (lL-6) merupakan sitokin terkuat merangsang mRNA hepsidin. lnfeksi dan makromolekul seperti lipopolisakarida, kemungkinan bekerja pada makrofag termasuk sel-sel Kupfer hati untuk merangsang produksi IL-6 dan pada gilirannya akan meningkatkan ekspresi mRNA hepsidin dihati (Nemeth 2004).
2.4.4. Hepsidin dan Anemia atau hipoksia
menyebabkan mobilisasi cepat besi dari penyimpanannya untuk memenuhi kebutuhan sumsum tulang (Swinkels 2008).
2.4.5. Hepsidin dan Penyakit Ginjal Kronik
Hepsidin diekskresikan melalui urin dan dimetabolisme oleh ginjal. Gangguan pada kedua proses tersebut terjadi pada keadaan LFG yang menurun. sehingga menyebabkan penumpukan hepsidin di ginjal. Pada pasien PGK terjadi peningkatan kadar hepsidin yang dipengaruhi oleh kelebihan cadangan besi, keadaan inflamasi, dan penurunan LFG. Sedangkan kadar hepsidin menurun pada kondisi anemia, hipoksia, peningkatan eritropoesis, dan defisiensi besi, serta pemberian ESA (Darshan 2010).
Kemna et.al menjelaskan hubungan antara hepsidin dan feritin serum pada penyakit ginjal kronik yaitu kadar dari kedua parameter tersebut terjadi peningkatan tetapi pada kondisi defisiensi besi keduanya akan menurun. Diantara keunggulan dan hepsidin serum adalah dapat mencerminkan ketersediaan besi dan kebutuhan eritropoiesis, dan lebih mencerminkan homeostasis besi dibandingkan dengan masing-masing parameter seperti saturasi transferin, reseptor transferin dan CRP (Kemna 2007).
dengan hepsidin, tetapi berbanding terbalik dengan LFG. Sedangkan pada PGK stadium 5, saturasi transferin dan feritin dapat menentukan kadar hepsidin. Peningkatan kadar hepsidin berperan pada gangguan pengaturan besi dan proses eritropoesis. Hepsidin dapat dijadikan sebagai parameter biokimia pada anemia defisiensi besi dan salah satu penyebab terjadinya respon eritropoetin tidak adekuat. (Zaritsky 2009). Peters et.al melaporkan 83 pasien PGK non dialisis, dan 48 pasien HD, tidak terdapat korelasi kadar hepsidin dengan LFG (p =0,30 dan r =0,12). Kadar hepsidin pada pasien HD lebih tinggi dibandingkan dengan kadar hepsidin pasien PGK non dialisis. LFG bukan merupakan faktor utama yang menentukan kadar hepsidin pada pasien PGK.(Pieter 2010).
2.4.6. Pengukuran Hepsidin
membedakan hepsidin-25, hepsidin-22 dan hepsidin-20, tetapi masih mengandalkan peralatan mahal yang tidak tersedia luas dan bersifat semi-kuantitatif. Belakangan telah dikembangkan pemeriksaan imunologis (immunoassay) dan pemeriksaan berdasarkan kompetisi terhadap ikatan 125I-hepsidin-25 ke peptida yang identik dengan tempat ikatan hepsidin feroportin yang dapat mengukur hepsidin-25 secara kuantitatif. (Malyzko 2007; Kemna 2007; Swinkels 2008; Babitt 2010).
2.5. Kerangka Konsep
Gambar. 2.13. Kerangka konsep
Penderita GGT dengan HD reguler
Infeksi/ Inflamasi Frekuensi
phlebotomi
↑
Penurunan kadar Eritropoeitin
Ret.He Hepsidin
Kehilangan
darah ↑ Diet ↓